Eteen pluss vesi, mis juhtub. Etüleeni kasutamine. Etüleeni omadused. Etüleen ja põlemine
Etüleen(teine nimi - eteen) on keemiline ühend, mida kirjeldatakse valemiga C 2 H 4 . Etüleeni looduses praktiliselt ei esine. See on värvitu, nõrga lõhnaga tuleohtlik gaas. Osaliselt vees lahustuv(25,6 ml 100 ml vees temperatuuril 0 °C), etanool (359 ml samades tingimustes). See lahustub hästi dietüüleetris ja süsivesinikes.
Etüleen on lihtsaim alkeen(olefiin). Sisaldab kaksiksidet ja on seetõttu klassifitseeritud küllastumata ühendiks. See mängib tööstuses äärmiselt olulist rolli ja on ka fütohormoon.
Tooraine polüetüleeni ja muu jaoks
Etüleen on enim toodetud orgaaniline ühend maailmas; etüleeni kogutoodang 2005. aastal oli 107 miljonit tonni ja kasvab jätkuvalt 4–6% aastas. Etüleeni tööstusliku tootmise allikaks on erinevate süsivesinike toorainete, näiteks etaani, propaani, butaani pürolüüs, mis sisalduvad naftatootmisel tekkivates seonduvates gaasides; vedelatest süsivesinikest - õli otsese destilleerimise madala oktaanarvuga fraktsioonid. Etüleeni saagis on umbes 30%. Samal ajal moodustub propüleen ja mitmed vedelad tooted (sh aromaatsed süsivesinikud).
Etüleeni kloorimisel saadakse 1,2-dikloroetaan, hüdraatimisel tekib etüülalkohol, interaktsioonil HCl-ga tekib etüülkloriid. Kui etüleen oksüdeeritakse õhuhapnikuga katalüsaatori juuresolekul, moodustub etüleenoksiid. Vedelfaasilise katalüütilise hapnikuga oksüdeerimise käigus saadakse atseetaldehüüd ja samadel tingimustel äädikhappe juuresolekul vinüülatsetaat. Etüleen on alküüliv aine, näiteks on see Friedel-Craftsi reaktsioonitingimustes võimeline alküülima benseeni ja teisi aromaatseid ühendeid. Etüleen on võimeline polümeriseerima katalüsaatorite juuresolekul kas iseseisvalt või toimides komonomeerina, moodustades laia valikut erinevate omadustega polümeere.
Rakendus
Etüleen on üks tööstusliku keemia põhisaadusi ja on paljude sünteesiahelate aluseks. Etüleeni peamine kasutusala on monomeerina polüetüleeni tootmisel(kõige suuremahulisem polümeer ülemaailmses tootmises). Sõltuvalt polümerisatsioonitingimustest saadakse madala tihedusega polüetüleenid ja kõrge tihedusega polüetüleenid.
Selleks kasutatakse ka polüetüleeni mitmete kopolümeeride tootmine, sealhulgas propüleen, stüreen, vinüülatsetaat ja teised. Etüleen on etüleenoksiidi tootmise tooraine; alküüliva ainena - etüülbenseeni, dietüülbenseeni, trietüülbenseeni tootmisel.
Etüleeni kasutatakse lähteainena atseetaldehüüdi ja sünteetilise etüülalkoholi tootmine. Seda kasutatakse ka etüülatsetaadi, stüreeni, vinüülatsetaadi, vinüülkloriidi sünteesiks; 1,2-dikloroetaani, etüülkloriidi tootmisel.
Etüleeni kasutatakse puuviljade valmimise kiirendamine- näiteks tomatid, melonid, apelsinid, mandariinid, sidrunid, banaanid; taimede defoliatsioon, koristuseelse viljalanguse vähendamine, viljade emataimedele kinnitumise tugevuse vähendamiseks, mis hõlbustab mehhaniseeritud koristamist.
Suurtes kontsentratsioonides mõjutab etüleen inimesi ja loomi narkootiline toime.
Süsivesinikud
10. klass
Jätkamine. Vt algust nr 9/2009.
3. loeng.
Etüleeni seeria küllastumata süsivesinikud, üldkoostise valem. Etüleeni elektrooniline ja ruumiline struktuur, keemilised omadused
Etüleeni seeria küllastumata süsivesinikud ehk alkeenid on süsivesinikud üldvalemiga C n H 2 n, mille molekulid sisaldavad ühte kaksiksidet. Kaksiksidemega ühendatud C-aatomid on olekus sp 2-hübridisatsioon, kaksikside on - ja - sidemete kombinatsioon. Oma olemuselt erineb -ühendus järsult -ühendusest; - side on vähem tugev elektronpilvede kattumise tõttu väljaspool molekuli tasapinda.
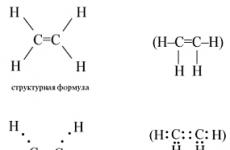
Lihtsaim alkeen on etüleen. Etüleeni struktuursed ja elektroonilised valemid on:

Etüleeni molekulis toimub hübridisatsioon s- ja kaks lk-C aatomite orbitaalid ( sp 2 -hübridiseerimine). Seega on igal C-aatomil kolm hübriidorbitaali ja üks mittehübriidne orbitaal lk-orbitaalid. Kaks C-aatomite hübriidorbitaali kattuvad üksteisega ja moodustavad aatomite vahel C-sideme. Ülejäänud neli C-aatomite hübriidorbitaali kattuvad samal tasapinnal neljaga s-H-aatomite -orbitaalid ja moodustavad ka neli -sidet. Kaks mittehübriidset lk C-aatomite -orbitaalid kattuvad omavahel tasapinnal, mis asub -sidemete tasandiga risti, s.t. tekib üks side. Reaktiivide mõjul katkeb side kergesti.
Etüleeni molekul on sümmeetriline; kõigi aatomite tuumad asuvad samal tasapinnal ja sidemete nurgad on 120° lähedal; C-aatomite tsentrite vaheline kaugus on 0,134 nm.
Kui aatomid on ühendatud kaksiksidemega, siis on nende pöörlemine võimatu ilma sidemeid avamata elektronpilvedeta.
Etüleen on alkeenide homoloogse seeria esimene liige.


Kuid buteen-2 molekul võib olla kahe ruumilise vormi kujul - cis- ja trans-:

Cis- ja trans-isomeerid, millel on ruumis erinev aatomite paigutus, erinevad paljude füüsikaliste ja keemiliste omaduste poolest.
Seega on alkeenide puhul võimalik kahte tüüpi struktuurne isomeeria: süsinikahela isomeeria ja kaksiksideme positsiooni isomeeria. See on ka võimalik geomeetriline isomeeria.
Etüleen (eteen) on väga nõrga magusa lõhnaga värvitu gaas, õhust veidi kergem, vees vähe lahustuv.
Kõrval keemiline Etüleeni omadused erinevad järsult etaanist, mis on tingitud selle molekuli elektroonilisest struktuurist. Etüleen, mille molekulis on kaksikside, mis koosneb - ja - sidemetest, on sideme lõhustumise tõttu võimeline siduma kahte monovalentset aatomit või radikaali.
Reageerimisvõime ühinemine iseloomulik kõigile alkeenidele.
1. Vesiniku lisamine(hüdrogeenimisreaktsioon):
2. Halogeenide lisamine(halogeenimisreaktsioon):
Kui alkeenile lisada broomi (broomivee kujul), kaob broomi pruun värvus kiiresti. See reaktsioon on kaksiksideme jaoks kvalitatiivne.
3. (hüdrohalogeenimisreaktsioon):

Kui lähtealkeen on ebasümmeetriline, kulgeb reaktsioon Markovnikovi reegli järgi.
Vesinikhalogeniidide lisamine küllastumata ühenditele toimub vastavalt iooniline mehhanism.
4. Veeühendus(hüdratatsioonireaktsioon):
Seda reaktsiooni kasutatakse etüülalkoholi tootmiseks tööstuses.
Alkaanidele on iseloomulikud reaktsioonid oksüdatsioon :
1. Etüleen oksüdeerub kergesti isegi tavatemperatuuril, näiteks kaaliumpermanganaadi toimel. Kui etüleen lastakse läbi kaaliumpermanganaadi KMnO4 vesilahuse, siis kaob viimasele iseloomulik violetne värvus ja etüleen oksüdeeritakse (hüdroksüülimisreaktsioon) kaaliumpermanganaadiga (kvalitatiivne reaktsioon kaksiksidemele):

2. Etüleen põleb helendava leegiga, moodustades süsinikmonooksiidi (IV) ja vee:
C2H4 + 3O2 -> 2CO2 + 2H2O.
3. Etüleeni osalisel oksüdeerimisel atmosfäärihapniku toimel on suur tööstuslik tähtsus:

Etüleeni, nagu kõiki küllastumata süsivesinikke, iseloomustavad reaktsioonid polümerisatsioon . Need tekivad kõrgendatud temperatuuril, rõhul ja katalüsaatorite juuresolekul:

Polümerisatsioon on identsete molekulide järjestikune ühendamine suuremateks molekulideks.
Seega iseloomustavad etüleeni ja selle homolooge liitumis-, oksüdatsiooni- ja polümerisatsioonireaktsioonid.
4. loeng.
Atsetüleen on süsivesinike esindaja, mille molekulis on kolmikside.
Atsetüleeni keemilised omadused, tootmine ja kasutamine orgaanilises sünteesis
Alküünid on süsivesinikud üldvalemiga C n H 2 n–2, mille molekulid sisaldavad ühte kolmiksidet.
Atsetüleen– atsetüleeni süsivesinike ehk alküünide homoloogse seeria esimene liige. Atsetüleeni molekulaarne valem on C2H2.
Atsetüleeni H-C struktuurivalem = C–H.
Elektrooniline valem:
H : KOOS : : : KOOS : N.
Kolmiksidemega seotud atsetüleeni süsinikuaatomid on olekus sp- hübridiseerimine. Atsetüleeni molekulide moodustumisel hübridiseerub igas C-aatom s- Ja lk-orbitaalid. Selle tulemusena omandab iga C-aatom kaks hübriidorbitaali ja kaks lk-orbitaalid jäävad mittehübriidseks. Kaks hübriidorbitaali kattuvad üksteisega ja C-aatomite vahel moodustub -side. Ülejäänud kaks hübriidorbitaali kattuvad s-H-aatomite orbitaalid ning -sidemed tekivad ka nende ja C-aatomite vahel. Neli mittehübriidset lk-orbitaalid asetatakse vastastikku risti ja risti -sidemete suundadega. Nendes lennukites lk-orbitaalid kattuvad omavahel ja moodustuvad kaks -sidet, mis on suhteliselt nõrgad ja keemilistes reaktsioonides kergesti purunevad.
Seega on atsetüleeni molekulis kolm -sidet (üks C-C side ja kaks C-H sidet) ja kaks -sidet kahe C-aatomi vahel. Alküünide kolmikside ei ole kolmikside, vaid kombineeritud side, mis koosneb kolmest sidemest: ühest ja kahest sidemest.
Atsetüleeni molekulil on lineaarne struktuur. Kolmanda sideme ilmumine paneb C-aatomid üksteisele veelgi lähemale liikuma: nende tsentrite vaheline kaugus on 0,120 nm.
Füüsikalised omadused. Atsetüleen on värvitu gaas, õhust kergem, vees vähe lahustuv ja puhtal kujul peaaegu lõhnatu.
Keemilised omadused. Atsetüleeni keemilised omadused on suures osas sarnased etüleeniga. Seda iseloomustavad lisamis-, oksüdatsiooni- ja polümerisatsioonireaktsioonid.
Reaktsioonid ühinemine. Alküünid lisavad mitte ühe, vaid kaks reageerivat molekuli. Kolmikside muundub esmalt kaksiksidemeks ja seejärel üksiksidemeks (-side).
1. Vesiniku lisamine(hüdrogeenimisreaktsioon) toimub kuumutamisel katalüsaatori juuresolekul. Reaktsioon toimub kahes etapis, kõigepealt moodustub etüleen ja seejärel etaan:
2. Halogeenide lisamine(halogeenimisreaktsioon) toimub väga lihtsalt (ka kahes etapis):

Broomivesi muutub värvituks. Broomvee värvimuutus on kvalitatiivne reaktsioon atsetüleenile, aga ka kõikidele küllastumata süsivesinikele.
3. Vesinikhalogeniidide lisamine(hüdrohalogeenimisreaktsioon). Vesinikkloriidi lisamisreaktsioon on oluline:

Polümeer, polüvinüülkloriid, saadakse vinüülkloriidist.
4. Veeühendus(hüdratatsioonireaktsioon) toimub elavhõbeda(II) soolade - HgSO 4, Hg(NO 3) 2 - juuresolekul atseetaldehüüdi moodustumisega:

See reaktsioon on oma nime saanud vene teadlase Mihhail Grigorjevitš Kucherovi (1881) järgi.
Reaktsioonid oksüdatsioon . Atsetüleen on oksüdeerivate ainete suhtes väga tundlik.
1. Kaaliumpermanganaadi lahuse läbimisel atsetüleen oksüdeerub kergesti ja KMnO 4 lahus muutub värvituks:
Kaaliumpermanganaadi värvimuutust saab kasutada kvalitatiivse reaktsioonina kolmiksidemele.
Oksüdatsioon hõlmab tavaliselt kolmiksideme lõhustumist ja karboksüülhapete moodustumist:
R–C = C–R " + 3[O] + H 2 O -> R–COOH + R " –COOH.
Atsetüleen tekitab täielikul põlemisel süsinikmonooksiidi (IV) ja vett:
2C 2H2 + 5O2 -> 4CO2 + 2H2O.
Õhus põleb atsetüleen väga suitsuse leegiga.
Reaktsioonid polümerisatsioon . Teatud tingimustel võib atsetüleen polümeriseerida benseeniks ja vinüülatsetüleeniks.
1. Kui atsetüleen juhitakse üle aktiivsöe temperatuuril 450–500 °C, atsetüleen trimeriseerub, moodustades benseeni (N.D. Zelinsky, 1927):

2. CuCl ja NH 4 Cl vesilahuse mõjul atsetüleen dimeriseerub, moodustades vinüülatsetüleeni:
Vinüülatsetüleen on väga reaktsioonivõimeline; Vesinikkloriidi lisamisel moodustub kloropreen, mida kasutatakse kunstkummi tootmiseks:

Atsetüleeni valmistamine. Laboris ja tööstuses toodetakse atsetüleeni kaltsiumkarbiidi reageerimisel veega (karbiidi meetod):

Kaltsiumkarbiidi toodetakse elektriahjudes koksi kuumutamisel kustutamata lubjaga:
![]()
CaC 2 tootmiseks kulub palju elektrit, seega ei suuda karbiidmeetod atsetüleeni vajadusi rahuldada.
Tööstuses saadakse atsetüleeni metaani kõrgtemperatuurse krakkimise tulemusena:
![]()
Atsetüleeni kasutamine orgaanilises sünteesis. Atsetüleeni kasutatakse laialdaselt orgaanilises sünteesis. See on üks lähtematerjale sünteetiliste kummide, polüvinüülkloriidi ja muude polümeeride tootmisel. Äädikhape ja lahustid (1,1,2,2-tetrakloroetaan ja 1,1,2-trikloroetaan) saadakse atsetüleenist. Atsetüleeni põletamisel hapnikus ulatub leegi temperatuur 3150 °C-ni, mistõttu kasutatakse seda metallide keevitamisel ja lõikamisel.
Näited atsetüleeni tööstuslikuks kasutamiseks:


5. loeng.
Dieeni süsivesinikud, nende struktuur, omadused, valmistamine ja praktiline tähendus
Dieeni süsivesinikud ehk alkadieenid on süsivesinikud, mis sisaldavad süsinikuahelas kahte kaksiksidet. Nende koostist saab väljendada üldvalemiga C n H 2 n–2. Need on atsetüleeni süsivesinike suhtes isomeersed.
Alkadieene, mille molekulides on kaksiksidemed eraldatud üksiksidemega (konjugeeritud kaksiksidemed), kasutatakse laialdaselt – need on

mis on kummide tootmise lähtematerjalid.
Kahe kaksiksideme moodustamiseks ühes molekulis on vaja vähemalt kolme C-aatomit Alkadieenide lihtsaim esindaja on propadieen CH 2 =C=CH 2.
Dieeni süsivesinikud võivad süsinikuahelas kaksiksideme positsiooni poolest erineda:

Võimalik on ka süsinikuahela isomeeria.
Butadieen-1,3 on kõige lihtsam konjugeeritud alkadieen. Butadieen-1,3-s on kõik neli süsinikuaatomit olekus sp 2-hübridisatsioon. Need asuvad samas tasapinnas ja moodustavad molekuli skeleti. Mittehübriidne lk-iga C-aatomi orbitaalid on skeleti tasandiga risti ja üksteisega paralleelsed, mis loob tingimused nende vastastikuseks kattumiseks. Kattuvus ei toimu mitte ainult C1-C2- ja C3-C4-aatomite vahel, vaid osaliselt ka C2-C3-aatomite vahel. Kui neli kattuvad lk-orbitaalid, tekib üksik -elektronpilv, s.o. kahe kaksiksideme konjugatsioon (, -konjugatsioon).
Füüsikalised omadused. Butadieen-1,3 on tavatingimustes gaas, mis veeldub, kui t= 4,5 °C; 2-metüülbutadieen-1,3 on lenduv vedelik, mis keeb temperatuuril t= 34,1 °C.
Keemilised omadused. Konjugeeritud kaksiksidemetega dieeni süsivesinikud on väga reaktsioonivõimelised.
Nad reageerivad kergesti ühinemine , reageerides vesiniku, halogeenide, vesinikhalogeniididega jne.
Tavaliselt toimub lisamine dieeni molekulide otstes. Seega broomiga suheldes katkevad kaksiksidemed, äärmistele C-aatomitele lisanduvad broomiaatomid ja vabad valentsid moodustavad kaksiksideme, s.t. Lisamise tulemusena liigub kaksikside:

Kui broomi on liiga palju, võib ülejäänud kaksiksideme kohale lisada teise molekuli.
Alkadieenides võivad liitumisreaktsioonid toimuda kahes suunas:
1) ühe kaksiksideme purunemise kohas (1,2-lisand):

2) molekuli otstele lisamisega ja kahe kaksiksideme katkestamisega (1,4-liitmine):

Reaktsiooni eelistatud kulg ühel või teisel viisil sõltub konkreetsetest tingimustest.
Kaksiksidemete olemasolu tõttu on dieeni süsivesinikud üsna kergesti polümeriseerida . 2-metüülbutadieen-1,3 (isopreen) polümerisatsiooniprodukt on polüisopreen - loodusliku kautšuki analoog:

Kviitung. Katalüütilise meetodi 1,3-butadieeni tootmiseks etanoolist avastas 1932. aastal Sergei Vasilievich Lebedev. Lebedevi meetodi kohaselt saadakse butadieen-1,3 etanooli samaaegse dehüdrogeenimise ja dehüdratsiooni tulemusena ZnO ja Al 2 O 3 baasil katalüsaatorite juuresolekul:

Kuid paljulubavam meetod butadieeni tootmiseks on naftagaasides sisalduva butaani dehüdrogeenimine. Kell t= 600 °C, toimub butaani astmeline dehüdrogeenimine katalüsaatori juuresolekul:

Isopentaani katalüütiline dehüdrogeenimine annab isopreeni:

Praktiline tähtsus. Dieeni süsivesinikke kasutatakse peamiselt kummide sünteesiks:

Butadieen-1,3 polümerisatsioonireaktsioon:
Kordustrükk koos jätkuga
Küllastumata süsivesinike silmapaistev esindaja on eteen (etüleen). Füüsikalised omadused: värvitu tuleohtlik gaas, hapniku ja õhuga segamisel plahvatusohtlik. Etüleeni saadakse märkimisväärses koguses õlist väärtuslike orgaaniliste ainete (mono- ja kaheaatomilised alkoholid, polümeerid, äädikhape ja muud ühendid) järgnevaks sünteesiks.
etüleen, sp 2 hübridisatsioon
Eteeniga struktuurilt ja omadustelt sarnaseid süsivesinikke nimetatakse alkeenideks. Ajalooliselt on selle rühma jaoks loodud veel üks termin - olefiinid. Üldvalem C n H 2n peegeldab kogu aineklassi koostist. Selle esimene esindaja on etüleen, mille molekulis ei moodusta süsinikuaatomid vesinikuga mitte kolme, vaid ainult kaks x-sidet. Alkeenid on küllastumata või küllastumata ühendid, nende valem on C2H4. Süsiniku aatomist segunevad kokku vaid 2 p- ja 1 s-elektroni pilve, kokku tekib kolm õ-sidet; Seda seisundit nimetatakse sp2 hübridisatsiooniks. Säilitatakse süsiniku neljas valents ja molekuli ilmub π-side. Struktuurne iseärasus kajastub struktuurivalemis. Kuid diagrammidel erinevat tüüpi ühenduste tähistamise sümbolid on tavaliselt samad - kriipsud või punktid. Etüleeni struktuur määrab selle aktiivse koostoime erinevate klasside ainetega. Vee ja muude osakeste lisandumine toimub nõrga π-sideme purunemise tõttu. Vabanenud valentsid küllastuvad hapniku, vesiniku ja halogeenide elektronidega.
Etüleen: aine füüsikalised omadused
Eteen on normaaltingimustes (normaalne atmosfäärirõhk ja temperatuur 18°C) värvitu gaas. Sellel on magus (eeterlik) lõhn ja selle sissehingamisel on inimestele narkootiline toime. See kivistub -169,5°C juures ja sulab samadel temperatuuritingimustel. Eteen keeb temperatuuril -103,8 °C. Süttib temperatuurini 540°C kuumutamisel. Gaas põleb hästi, leek on helendav, nõrga tahmaga. Etüleen lahustub eetris ja atsetoonis, palju vähem vees ja alkoholis. Aine ümardatud molaarmass on 28 g/mol. Eteeni homoloogse seeria kolmas ja neljas esindaja on samuti gaasilised ained. Viienda ja järgnevate alkeenide füüsikalised omadused on erinevad;
Etüleeni valmistamine ja omadused
Saksa keemik Johann Becher kasutas seda kogemata katsetes kontsentreeritud väävelhappega. Nii saadi eteeni esmakordselt laboritingimustes (1680). 19. sajandi keskel e.m.a. Butlerov andis ühendile nimetuse etüleen. Füüsikalisi omadusi kirjeldas ka kuulus vene keemik. Butlerov pakkus välja aine struktuuri peegeldava struktuurivalemi. Meetodid selle saamiseks laboris:

- Atsetüleeni katalüütiline hüdrogeenimine.
- Kloroetaani dehüdrohalogeenimine reaktsioonil tugeva aluse (leelise) kontsentreeritud alkoholilahusega kuumutamisel.
- Vee eemaldamine etüülmolekulidest Reaktsioon toimub väävelhappe juuresolekul. Selle võrrand: H2C-CH2-OH → H2C=CH2 + H2O
Tööstuslik tootmine:
- nafta rafineerimine - süsivesinike krakkimine ja pürolüüs;
- etaani dehüdrogeenimine katalüsaatori juuresolekul. H3C-CH3 → H2C=CH2 + H2
Etüleeni struktuur selgitab selle tüüpilisi keemilisi reaktsioone - osakeste lisamist C-aatomitega, mis on mitmes sidemes:
- Halogeenimine ja hüdrohalogeenimine. Nende reaktsioonide produktid on halogeeni derivaadid.
- Hüdrogeenimine (etaaniga küllastumine.
- Oksüdeerimine kahehüdroksüülseks alkoholiks etüleenglükooliks. Selle valem on OH-H2C-CH2-OH.
- Polümerisatsioon vastavalt skeemile: n(H2C=CH2) → n(-H2C-CH2-).


Etüleeni kasutusalad
Suures koguses fraktsioneerimisel võimaldavad aine füüsikalised omadused, struktuur ja keemiline olemus seda kasutada etüülalkoholi, halogeenderivaatide, alkoholide, oksiidi, äädikhappe ja muude ühendite tootmisel. Eteen on polüetüleeni monomeer ja ka polüstüreeni lähteühend.
Eteenist ja kloorist toodetav dikloroetaan on hea lahusti, mida kasutatakse polüvinüülkloriidi (PVC) tootmisel. Kile, torud, nõud on valmistatud madala ja kõrge tihedusega polüetüleenist CD-de ümbrised ja muud osad on valmistatud polüstüreenist. PVC on linoleumi ja veekindlate vihmamantlite alus. Põllumajanduses töödeldakse puuvilju enne koristamist eteeniga, et kiirendada valmimist.
Füüsikalised omadused
Ethan all n. y on värvitu lõhnatu gaas. Molaarmass - 30,07. Sulamistemperatuur -182,81 °C, keemistemperatuur -88,63 °C. . Tihedus ρ gaas. =0,001342 g/cm³ või 1,342 kg/m³ (nr), ρ vedelik. = 0,561 g/cm3 (T = -100 °C). Dissotsiatsioonikonstant 42 (vees, standard) [ allikas?] . Aururõhk 0 °C juures - 2,379 MPa.
Keemilised omadused
Keemiline valem C 2 H 6 (ratsionaalne CH 3 CH 3). Kõige tüüpilisemad reaktsioonid on vesiniku asendamine halogeenidega, mis toimuvad vabade radikaalide mehhanismi kaudu. Etaani termiline dehüdrogeenimine temperatuuril 550-650 °C toob kaasa keteeni, temperatuuril üle 800 °C - atsetüleeni (tekib ka bensolüsaat). Otsene kloorimine 300-450 °C juures - etüülkloriid, nitreerimine gaasifaasis annab nitroetaani ja trometaani segu (3:1).
Kviitung
Tööstuses
Tööstuses saadakse seda naftast ja maagaasidest, kus see moodustab kuni 10% mahust. Venemaal on naftagaasides etaani sisaldus väga madal. USA-s ja Kanadas (kus selle nafta ja maagaaside sisaldus on kõrge) on see eteeni tootmise peamine tooraine.
Laboratoorsetes tingimustes
Saadakse jodometaanist Wurtzi reaktsiooniga, naatriumatsetaadist elektrolüüsi teel Kolbe reaktsiooniga, naatriumpropionaadi liitmisel leelisega, etüülbromiidist Grignardi reaktsiooniga, eteeni (Pd kohal) või atsetüleeni (Raney juuresolekul) hüdrogeenimisel Nikkel).
Rakendus
Etaani peamine tööstuslik kasutusala on etüleeni tootmine.
butaan(C 4 H 10) - klassi orgaaniline ühend alkaanid. Keemias kasutatakse seda nimetust peamiselt n-butaani tähistamiseks. N-butaani segu ja selle isomeer isobutaan CH(CH3)3. Nimi pärineb tüvest "but-" (ingliskeelne nimi võihape - võihape) ja järelliide “-an” (kuulub alkaanidele). Suurtes kontsentratsioonides on butaani sissehingamine mürgine; Sisaldub maagaas, tekib siis, kui pragunemine naftasaadused, seostatud jagamisel naftagaas, "rasv" maagaas. Süsivesinikgaaside esindajana on see tule- ja plahvatusohtlik, vähetoksiline, spetsiifilise iseloomuliku lõhnaga ja narkootiliste omadustega. Kehale avalduva mõju astme poolest kuulub gaas vastavalt standardile GOST 12.1.007-76 4. ohuklassi (madala ohuga) ainetesse. Kahjulik mõju närvisüsteemile .
Isomerism
Butaanil on kaks isomeer:
Füüsikalised omadused
Butaan on värvitu, spetsiifilise lõhnaga süttiv gaas, mis vedeldub kergesti (alla 0 °C ja normaalrõhul või kõrgendatud rõhul ja normaaltemperatuuril – väga lenduv vedelik). Külmumistemperatuur -138°C (tavarõhul). Lahustuvus vees - 6,1 mg 100 ml vees (n-butaani puhul 20 °C, lahustub palju paremini orgaanilistes lahustites ). Võib moodustada aseotroopne segu veega temperatuuril umbes 100 °C ja rõhul 10 atm.
Leidmine ja vastuvõtmine
Sisaldub gaasikondensaadis ja naftagaasis (kuni 12%). See on katalüütilise ja hüdrokatalüütilise produkt pragunemineõlifraktsioonid. Laboris on võimalik saada Wurtzi reaktsioonid.
2 C2H5Br + 2Na → CH3-CH2-CH2-CH3 + 2NaBr
Butaani fraktsiooni väävlitustamine (demerkaptaniseerimine).
Otsedestillatsiooniga butaanifraktsioon tuleb puhastada väävliühenditest, mida esindavad peamiselt metüül- ja etüülmerkaptaanid. Merkaptaanidest butaanifraktsiooni puhastamise meetod seisneb merkaptaanide leeliselises ekstraheerimises süsivesinike fraktsioonist ja sellele järgnevas leelise regenereerimises homogeensete või heterogeensete katalüsaatorite juuresolekul atmosfäärihapnikuga koos disulfiidõli vabanemisega.
Rakendused ja reaktsioonid
Vabade radikaalide kloorimisel moodustub 1-kloro- ja 2-klorobutaani segu. Nende suhe on hästi seletatav CH-sidemete tugevuse erinevusega positsioonides 1 ja 2 (425 ja 411 kJ/mol). Täielikul põlemisel õhus moodustub süsinikdioksiid ja vesi. Butaani kasutatakse segus koos propaan tulemasinates, veeldatud olekus gaasiballoonides, kus sellel on lõhn, kuna see sisaldab spetsiaalselt lisatud lõhnaained. Sel juhul kasutatakse erineva koostisega "talviseid" ja "suviseid" segusid. Põlemissoojus 1 kg - 45,7 MJ (12,72 kWh).
2C 4 H 10 + 13 O 2 → 8 CO 2 + 10 H 2 O
Hapnikupuuduse korral tekib see tahma või vingugaas või mõlemad koos.
2C 4 H 10 + 5 O 2 → 8 C + 10 H 2 O
2C 4 H 10 + 9 O 2 → 8 CO + 10 H 2 O
Ettevõtte järgi DuPont saamiseks on välja töötatud meetod maleiinanhüdriid n-butaanist katalüütilise oksüdatsiooni teel.
2 CH 3 CH 2 CH 2 CH 3 + 7 O 2 → 2 C 2 H 2 (CO) 2 O + 8 H 2 O
n-butaan – tooraine tootmiseks buteen, 1,3-butadieen, kõrge oktaanarvuga bensiini komponent. Kõrge puhtusastmega butaani ja eriti isobutaani saab kasutada külmutusagensina külmutusseadmetes. Selliste süsteemide jõudlus on veidi madalam kui freoonsüsteemidel. Butaan on keskkonnasõbralik, erinevalt freoonkülmaainetest.
Toiduainetööstuses on butaan registreeritud kui toidulisandid E943a ja isobutaan - E943b, Kuidas raketikütus, näiteks sisse deodorandid.
Etüleen(Kõrval IUPAC: eteen) - orgaaniline keemiline ühend, mida kirjeldatakse valemiga C2H4. Kas kõige lihtsam alkeen (olefiin). Etüleeni looduses praktiliselt ei esine. See on värvitu, nõrga lõhnaga tuleohtlik gaas. Osaliselt lahustuv vees (25,6 ml 100 ml vees temperatuuril 0 °C), etanoolis (359 ml samadel tingimustel). See lahustub hästi dietüüleetris ja süsivesinikes. Sisaldab kaksiksidet ja on seetõttu klassifitseeritud küllastumata või küllastumata süsivesinikud. Mängib tööstuses äärmiselt olulist rolli ja on ka fütohormoon. Etüleen on maailmas enim toodetud orgaaniline ühend ; aastal kogu maailma etüleenitoodang 2008 ulatus 113 miljoni tonnini ja jätkab kasvu 2-3% aastas .
Rakendus
Etüleen on juhtiv toode põhiline orgaaniline süntees ja seda kasutatakse järgmiste ühendite tootmiseks (loetletud tähestikulises järjekorras):
Vinüülatsetaat;
Dikloroetaan / vinüülkloriid(3. koht, 12% kogumahust);
Etüleenoksiid(2. koht, 14-15% kogumahust);
Polüetüleen(1. koht, kuni 60% kogumahust);
Stüreen;
Äädikhape;
Etüülbenseen;
Etüleenglükool;
Etanool.
Hapnikuga segatud etüleeni on kasutatud meditsiinis anesteesia 20. sajandi 80. aastate keskpaigani NSV Liidus ja Lähis-Idas. Etüleen on fütohormoon peaaegu kõigis taimedes , muuhulgas vastutab okaspuude langemise eest.
Põhilised keemilised omadused
Etüleen on keemiliselt aktiivne aine. Kuna molekulis on süsinikuaatomite vahel kaksikside, puruneb üks neist, mis on vähem tugev, kergesti ja sideme katkemise kohas toimub molekulide kinnitumine, oksüdatsioon ja polümerisatsioon.
Halogeenimine:
CH2 =CH2 + Cl2 → CH2Cl-CH2CI
Broomivesi muutub värvituks. See on kvalitatiivne reaktsioon küllastumata ühenditele.
Hüdrogeenimine:
CH 2 = CH 2 + H - H → CH 3 - CH 3 (Ni mõjul)
Hüdrohalogeenimine:
CH2 =CH2 + HBr → CH3 - CH2Br
Niisutus:
CH 2 =CH 2 + HOH → CH 3 CH 2 OH (katalüsaatori mõjul)
Selle reaktsiooni avastas A.M. Butlerov ja seda kasutatakse etüülalkoholi tööstuslikuks tootmiseks.
Oksüdatsioon:
Etüleen oksüdeerub kergesti. Kui etüleen lastakse läbi kaaliumpermanganaadi lahuse, muutub see värvituks. Seda reaktsiooni kasutatakse küllastunud ja küllastumata ühendite eristamiseks.
Etüleenoksiid on habras aine, mis puruneb ja vesi liitub, mille tulemusena moodustub etüleenglükool:
C2H4 + 3O2 → 2CO2 + 2H2O
Polümerisatsioon:
nCH2 =CH2 → (-CH2-CH2-) n
Isopreen CH2 =C(CH3)-CH=CH2, 2-metüülbutadieen-1,3 - küllastumata süsivesinik dieeni seeria (C n H 2n−2 ) . Normaaltingimustes värvitu vedelik. Ta on monomeer Sest looduslik kautšuk ja struktuuriüksus paljudele teiste looduslike ühendite molekulidele – isoprenoididele või terpenoidid. . Lahustub sisse alkohol. Isopreen polümeriseerub, saades isopreeni kummid. Reageerib ka isopreen polümerisatsioon vinüülühenditega.
Leidmine ja vastuvõtmine
Looduslik kautšuk on isopreeni polümeer – kõige sagedamini cis-1,4-polüisopreen, mille molekulmass on 100 000 kuni 1 000 000. Sisaldab lisanditena mitu protsenti muid materjale, nt oravad, rasvhape, vaigud ja anorgaanilised ained. Mõningaid loodusliku kautšuki allikaid nimetatakse gutapertš ja koosneb trans-1,4-polüisopreenist, struktuurne isomeer, millel on sarnased, kuid mitte identsed omadused. Isopreeni toodavad ja eraldavad atmosfääri mitut tüüpi puud (peamine on tamm) Taimkatte aastane isopreenitoodang on umbes 600 miljonit tonni, millest poole toodavad troopilised lehtpuud, ülejäänud põõsad. Pärast atmosfääri sattumist muundatakse isopreen vabade radikaalide (nagu hüdroksüül- (OH) radikaalid) ja vähemal määral osooni poolt. erinevatesse ainetesse nagu aldehüüdid, hüdroksüperoksiidid, orgaanilised nitraadid ja epoksiidid, mis segunevad veepiiskadega, moodustades aerosoole või hägune. Puud kasutavad seda mehhanismi mitte ainult selleks, et vältida lehtede ülekuumenemist päikese poolt, vaid ka kaitseks vabade radikaalide eest, eriti osoon. Isopreen saadi esmakordselt loodusliku kautšuki kuumtöötlemisel. Enamik tööstuslikult saadaval termotootena pragunemine tööstusbensiin või õlid ja ka tootmise kõrvalsaadusena etüleen. Aastas toodetakse umbes 20 000 tonni. Umbes 95% isopreeni toodangust kasutatakse cis-1,4-polüisopreeni, loodusliku kautšuki sünteetilise versiooni valmistamiseks.
Butadieen-1,3(divinüül) CH2 =CH-CH=CH2 - küllastumata süsivesinik, lihtsaim esindaja dieeni süsivesinikud.
Füüsikalised omadused
Butadieen - värvitu gaas iseloomuliku lõhnaga, keemistemperatuur−4,5 °C, sulamistemperatuur−108,9 °C, leekpunkt–40 °C, maksimaalne lubatud kontsentratsioonõhus (maksimaalne lubatud kontsentratsioon) 0,1 g/m³, tihedus 0,650 g/cm³ temperatuuril –6 °C.
Vees vähelahustuv, alkoholis hästi lahustuv, õhuga petrooleum koguses 1,6-10,8%.
Keemilised omadused
Butadieenil on kalduvus polümerisatsioon, oksüdeerub kergesti õhku haridusega peroksiid polümerisatsiooni kiirendavad ühendid.
Kviitung
Reaktsiooni käigus toodetakse butadieeni Lebedeva edasikandumine etüülalkohol läbi katalüsaator:
2CH 3 CH 2OH → C 4 H 6 + 2 H 2 O + H 2
Või normaalse dehüdrogeenimine butüleen:
CH2 =CH-CH2-CH3 → CH2 =CH-CH=CH2 + H2
Rakendus
Butadieeni polümerisatsioonil saadakse sünteetiline kumm. Kopolümerisatsioon koos akrüülnitriil Ja stüreen saada ABS plastik.
Benseen (C 6 H 6 , Ph H) - orgaaniline keemiline ühend, värvitu vedel meeldiva magusaga lõhn. kõige lihtsam aromaatne süsivesinik. Benseen sisaldub bensiin, kasutatakse laialdaselt tööstusele, on tootmise tooraine ravimid, mitmesugused plastid, sünteetiline kumm, värvained. Kuigi benseen on kaasas toornafta, tööstuslikus mastaabis sünteesitakse see selle teistest komponentidest. Mürgine, kantserogeenne.
Füüsikalised omadused
Värvitu vedelik, millel on omapärane terav lõhn. Sulamistemperatuur = 5,5 °C, keemistemperatuur = 80,1 °C, tihedus = 0,879 g/cm3, molaarmass = 78,11 g/mol. Nagu kõik süsivesinikud, põleb benseen ja tekitab palju tahma. Moodustab õhuga plahvatusohtlikke segusid, seguneb hästi eetrid, bensiin ja muud orgaanilised lahustid, moodustab veega aseotroopse segu, mille keemistemperatuur on 69,25 °C (91% benseen). Vees lahustuvus 1,79 g/l (25 °C juures).
Keemilised omadused
Benseeni iseloomustavad asendusreaktsioonid – benseen reageerib alkeenid, kloor alkaanid, halogeenid, lämmastik Ja väävelhapped. Benseenitsükli lõhustamisreaktsioonid toimuvad karmides tingimustes (temperatuur, rõhk).
Koostoime klooriga katalüsaatori juuresolekul:
6 H 6 + Cl 2 -(FeCl 3) → 6 H 5 Cl + HCl-st moodustub klorobenseen
Katalüsaatorid soodustavad aktiivsete elektrofiilsete liikide teket halogeeniaatomite vahelise polarisatsiooni kaudu.
Cl-Cl + FeCl 3 → Cl ઠ - ઠ +
C 6 H 6 + Cl ઠ - -Cl ઠ + + FeCl 3 → [C 6 H 5 Cl + FeCl 4 ] → C 6 H 5 Cl + FeCl 3 + HCl
Katalüsaatori puudumisel toimub kuumutamisel või valgustamisel radikaalse asendusreaktsioon.
6 H 6 + 3Cl 2 - (valgustus) → C 6 H 6 Cl 6 abil moodustub heksaklorotsükloheksaani isomeeride segu video
Reaktsioon broomiga (puhas):
Koostoime alkaanide halogeeni derivaatidega ( Friedel-Craftsi reaktsioon):
Moodustub C 6 H 6 + C 2 H 5 Cl -(AlCl 3) → C 6 H 5 C 2 H 5 + HCl etüülbenseen
C6H6 + HNO3-(H2SO4) → C6H5NO2 + H2O
Struktuur

Benseen on koostiselt küllastumata. süsivesinikud(homoloogne seeria C n H 2n-6), kuid erinevalt seeria süsivesinikest etüleen C 2 H 4 avaldab küllastumata süsivesinikele omaseid omadusi (neid iseloomustavad liitumisreaktsioonid) ainult karmides tingimustes, kuid benseen on asendusreaktsioonidele vastuvõtlikum. Benseeni selline "käitumine" on seletatav selle erilise struktuuriga: kõigi sidemete ja molekulide paiknemine samal tasapinnal ning konjugeeritud 6π-elektronpilve olemasolu struktuuris. Kaasaegne arusaam benseeni sidemete elektroonilisest olemusest põhineb hüpoteesil Linus Pauling, kes tegi ettepaneku kujutada benseeni molekuli sisse kirjutatud ringiga kuusnurgana, rõhutades sellega fikseeritud kaksiksideme puudumist ja ühe elektronpilve olemasolu, mis katab tsükli kõiki kuut süsinikuaatomit.
Tootmine
Tänapäeval on benseeni tootmiseks kolm põhimõtteliselt erinevat meetodit.
Kokseerimine kivisüsi. See protsess oli ajalooliselt esimene ja oli peamise benseeni allikana kuni Teise maailmasõjani. Praegu on selle meetodiga toodetud benseeni osakaal alla 1%. Olgu lisatud, et kivisöetõrvast saadav benseen sisaldab olulisel määral tiofeeni, mistõttu on selline benseen mitmete tehnoloogiliste protsesside jaoks sobimatu tooraine.
Katalüütiline reformimine(aroomi andvad) õli bensiinifraktsioonid. See protsess on peamine benseeni allikas Ameerika Ühendriikides. Lääne-Euroopas, Venemaal ja Jaapanis saadakse seda meetodit kasutades 40-60% aine koguhulgast. Selles protsessis kasutatakse lisaks benseenile tolueen Ja ksüleenid. Kuna tolueeni toodetakse kogustes, mis ületavad selle nõudlust, töödeldakse seda osaliselt ka:
benseen - hüdrodealküülimismeetodil;
benseeni ja ksüleenide segu - disproportsioonimeetodil;
Pürolüüs bensiin ja raskemad naftafraktsioonid. Selle meetodiga toodetakse kuni 50% benseenist. Koos benseeniga moodustuvad tolueen ja ksüleenid. Mõnel juhul saadetakse kogu see fraktsioon dealküleerimisetappi, kus nii tolueen kui ka ksüleenid muudetakse benseeniks.
Rakendus
Benseen on keemiatööstuses üks kümnest kõige olulisemast ainest. [ allikat pole täpsustatud 232 päeva ] Suurem osa toodetud benseenist kasutatakse teiste toodete sünteesiks:
umbes 50% benseenist muundatakse etüülbenseen (alküülimine benseen etüleen);
umbes 25% benseenist muundatakse kumeen (alküülimine benseen propüleen);
umbes 10-15% benseeni hüdrogeenida V tsükloheksaan;
umbes 10% benseenist kulub tootmiseks nitrobenseen;
2-3% benseeni muundatakse lineaarsed alküülbenseenid;
sünteesiks kasutatakse ligikaudu 1% benseeni klorobenseen.
Mõnede teiste ühendite sünteesiks kasutatakse benseeni oluliselt väiksemates kogustes. Aeg-ajalt ja äärmuslikel juhtudel kasutatakse benseeni selle kõrge toksilisuse tõttu kui lahusti. Lisaks on benseen osa bensiin. Selle kõrge toksilisuse tõttu on selle sisaldus uute standarditega piiratud 1% -ni.
Tolueen(alates hispaania keel Tolu, Tolu balsam) - metüülbenseen, iseloomuliku lõhnaga värvitu vedelik, kuulub areenide hulka.
P. Peltier sai tolueeni esmakordselt 1835. aastal männivaigu destilleerimisel. 1838. aastal eraldas A. Deville selle Kolumbiast Tolu linnast toodud palsamist, mille järgi see oma nime sai.
üldised omadused
Värvitu, liikuv, terava lõhnaga lenduv vedelik, millel on nõrk narkootiline toime. Seguneb piiramatult süsivesinikega, paljudega alkoholid Ja eetrid, ei segune veega. Murdumisnäitaja valgus 1,4969 temperatuuril 20 °C. See on tuleohtlik ja põleb suitsuse leegiga.
Keemilised omadused
Tolueeni iseloomustavad elektrofiilsed asendusreaktsioonid aromaatses ringis ja asendus metüülrühmas vastavalt radikaalmehhanismile.
Elektrofiilne asendus aromaatses ringis esineb see metüülrühma suhtes valdavalt orto- ja para-asendis.
Lisaks asendusreaktsioonidele läbib tolueen liitumisreaktsioonid (hüdrogeenimine) ja osonolüüsi. Mõned oksüdeerivad ained (kaaliumpermanganaadi leeliseline lahus, lahjendatud lämmastikhape) oksüdeerivad metüülrühma karboksüülrühmaks. Isesüttimistemperatuur 535 °C. Leegi leviku kontsentratsioonipiir, mahuprotsent. Leegi leviku temperatuuripiirang, °C. Leekpunkt 4 °C.
Koostoime kaaliumpermanganaadiga happelises keskkonnas:
5C 6 H 5 CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O bensoehappe moodustumine
Vastuvõtt ja puhastamine
Toode katalüütiline reformimine bensiin fraktsioonid õli. Eraldatud selektiivse ekstraheerimise ja järgnevaga parandamine.Katalüütilise dehüdrogeenimisega saavutatakse ka head saagid heptaan läbi metüültsükloheksaan. Tolueen puhastatakse samal viisil benseen, ainult siis, kui seda kasutatakse keskendunud väävelhape Me ei tohi seda tolueeni unustada sulfoneeritud kergem kui benseen, mis tähendab, et on vaja hoida madalamat temperatuuri reaktsioonisegu(alla 30 °C). Tolueen moodustab ka veega aseotroopi .
Tolueeni saab benseenist saada Friedeli-Craftsi reaktsioonid:
Rakendus
Tooraine tootmiseks benseen, bensoehape, nitrotolueenid(kaasa arvatud trinitrotolueen), tolueeni diisotsüanaadid(dinitrotolueeni ja tolueendiamiini kaudu) bensüülkloriid ja muud orgaanilised ained.
On lahusti paljudele polümeerid, on osa erinevatest kaubanduslikest lahustitest lakid Ja värvid. Sisaldub lahustites: R-40, R-4, 645, 646 , 647 , 648. Kasutatakse lahustina keemilises sünteesis.
Naftaleen- C 10 H 8 tahke kristalne aine, millel on iseloomulikud omadused lõhn. See ei lahustu vees, kuid lahustub hästi benseen, õhus, alkohol, kloroform.
Keemilised omadused
Naftaleen on keemiliste omaduste poolest sarnane benseen: lihtsalt nitraadid, sulfoneeritud, suhtleb halogeenid. See erineb benseenist selle poolest, et reageerib veelgi kergemini.
Füüsikalised omadused
Tihedus 1,14 g/cm³, sulamistemperatuur 80,26 °C, keemistemperatuur 218 °C, lahustuvus vees ligikaudu 30 mg/l, leekpunkt 79 - 87 °C, isesüttimistemperatuur 525 °C, molaarmass 128,17052 g/mol.
Kviitung
Naftaleeni saadakse kivisöetõrv. Naftaleeni saab eraldada ka raskest pürolüüsivaigust (kustutusõli), mida kasutatakse pürolüüsiprotsessis etüleenitehastes.
Termiidid toodavad ka naftaleeni. Coptotermes formosanus nende pesade eest kaitsmiseks sipelgad, seened ja nematoodid .
Rakendus
Keemiatööstuse oluline tooraine: kasutatakse sünteesiks ftaalanhüdriid, tetraliin, dekaliin, mitmesugused naftaleeni derivaadid.
Tootmiseks kasutatakse naftaleeni derivaate värvained Ja lõhkeained, V ravim, Kuidas insektitsiid.