एथीन प्लस पानी क्या होता है. एथिलीन का प्रयोग. एथिलीन के गुण. एथिलीन और दहन
ईथीलीन(अन्य नाम - ईथेन) एक रासायनिक यौगिक है जिसे सूत्र C 2 H 4 द्वारा वर्णित किया गया है। एथिलीन व्यावहारिक रूप से प्रकृति में नहीं पाया जाता है। यह एक रंगहीन, हल्की गंध वाली ज्वलनशील गैस है। आंशिक रूप से पानी में घुलनशील(0 डिग्री सेल्सियस पर 100 मिलीलीटर पानी में 25.6 मिलीलीटर), इथेनॉल (समान परिस्थितियों में 359 मिलीलीटर)। यह डायथाइल ईथर और हाइड्रोकार्बन में अत्यधिक घुलनशील है।
एथिलीन है सबसे सरल एल्कीन(ओलेफ़िन)। इसमें दोहरा बंधन होता है और इसलिए इसे असंतृप्त यौगिक के रूप में वर्गीकृत किया जाता है। यह उद्योग में अत्यंत महत्वपूर्ण भूमिका निभाता है और एक फाइटोहोर्मोन भी है।
पॉलीथीन और अन्य के लिए कच्चा माल
एथिलीन दुनिया में सबसे अधिक उत्पादित कार्बनिक यौगिक है; 2005 में कुल वैश्विक एथिलीन उत्पादन 107 मिलियन टन था और प्रति वर्ष 4-6% की दर से बढ़ रहा है। एथिलीन के औद्योगिक उत्पादन का स्रोत विभिन्न हाइड्रोकार्बन कच्चे माल का पायरोलिसिस है, उदाहरण के लिए, तेल उत्पादन से संबंधित गैसों में निहित ईथेन, प्रोपेन, ब्यूटेन; तरल हाइड्रोकार्बन से - तेल के प्रत्यक्ष आसवन के कम-ऑक्टेन अंश। एथिलीन की उपज लगभग 30% है। इसी समय, प्रोपलीन और कई तरल उत्पाद (सुगंधित हाइड्रोकार्बन सहित) बनते हैं।
जब एथिलीन को क्लोरीनीकृत किया जाता है, तो 1,2-डाइक्लोरोइथेन प्राप्त होता है, जलयोजन से एथिल अल्कोहल बनता है, एचसीएल के साथ संपर्क से एथिल क्लोराइड बनता है। जब एथिलीन को उत्प्रेरक की उपस्थिति में वायुमंडलीय ऑक्सीजन के साथ ऑक्सीकृत किया जाता है, तो एथिलीन ऑक्साइड बनता है। ऑक्सीजन के साथ तरल-चरण उत्प्रेरक ऑक्सीकरण के दौरान, एसीटैल्डिहाइड प्राप्त होता है, और एसिटिक एसिड की उपस्थिति में समान परिस्थितियों में, विनाइल एसीटेट प्राप्त होता है। एथिलीन एक एल्काइलेटिंग एजेंट है, उदाहरण के लिए, फ्रीडेल-क्राफ्ट्स प्रतिक्रिया स्थितियों के तहत यह बेंजीन और अन्य सुगंधित यौगिकों को एल्काइलेट करने में सक्षम है। एथिलीन उत्प्रेरक की उपस्थिति में या तो स्वतंत्र रूप से या एक कोमोनोमर के रूप में कार्य करके पॉलिमराइज़ करने में सक्षम है, जिससे विभिन्न गुणों वाले पॉलिमर की एक विस्तृत श्रृंखला बनती है।
आवेदन
एथिलीन औद्योगिक रसायन विज्ञान के बुनियादी उत्पादों में से एक है और कई संश्लेषण श्रृंखलाओं के आधार पर है। एथिलीन का मुख्य उपयोग है पॉलीथीन के उत्पादन में एक मोनोमर के रूप में(वैश्विक उत्पादन में सबसे बड़े पैमाने पर पॉलिमर)। पोलीमराइजेशन स्थितियों के आधार पर, कम घनत्व वाली पॉलीथीन और उच्च घनत्व वाली पॉलीथीन प्राप्त की जाती हैं।
पॉलीथीन का भी उपयोग किया जाता है कई कॉपोलिमर का उत्पादन, जिसमें प्रोपलीन, स्टाइरीन, विनाइल एसीटेट और अन्य शामिल हैं। एथिलीन एथिलीन ऑक्साइड के उत्पादन के लिए कच्चा माल है; एक एल्काइलेटिंग एजेंट के रूप में - एथिलबेन्जीन, डायथाइलबेन्जीन, ट्राइएथिलबेन्जीन के उत्पादन में।
एथिलीन का उपयोग प्रारंभिक सामग्री के रूप में किया जाता है एसीटैल्डिहाइड और सिंथेटिक एथिल अल्कोहल का उत्पादन. इसका उपयोग एथिल एसीटेट, स्टाइरीन, विनाइल एसीटेट, विनाइल क्लोराइड के संश्लेषण के लिए भी किया जाता है; 1,2-डाइक्लोरोइथेन, एथिल क्लोराइड के उत्पादन में।
एथिलीन का उपयोग किसके लिए किया जाता है? फलों के पकने में तेजी लाना- उदाहरण के लिए, टमाटर, खरबूजे, संतरे, कीनू, नींबू, केले; पौधों का पतझड़, कटाई से पहले फलों का गिरना कम करना, मातृ पौधों से फलों के जुड़ाव की शक्ति को कम करना, जिससे यंत्रीकृत कटाई की सुविधा मिलती है।
उच्च सांद्रता में, एथिलीन मनुष्यों और जानवरों को प्रभावित करता है मादक प्रभाव.
हाइड्रोकार्बन
ग्रेड 10
निरंतरता. क्रमांक 9/2009 में आरंभ देखें।
व्याख्यान 3.
एथिलीन श्रृंखला के असंतृप्त हाइड्रोकार्बन, सामान्य संरचना सूत्र। इलेक्ट्रॉनिक और स्थानिक संरचना, एथिलीन के रासायनिक गुण
एथिलीन श्रृंखला के असंतृप्त हाइड्रोकार्बन, या एल्कीन, सामान्य सूत्र सी वाले हाइड्रोकार्बन हैं एनएच 2 एन, जिनके अणुओं में एक दोहरा बंधन होता है। दोहरे बंधन से जुड़े C परमाणु अवस्था में हैं एसपी 2-संकरण, दोहरा बंधन - और - बंधन का एक संयोजन है। अपनी प्रकृति से, -कनेक्शन -कनेक्शन से बिल्कुल अलग है; - अणु के तल के बाहर इलेक्ट्रॉन बादलों के ओवरलैप होने के कारण बंधन कम मजबूत होता है।
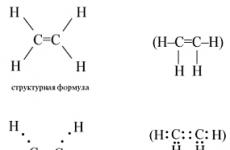
सबसे सरल एल्कीन है ईथीलीन. एथिलीन के संरचनात्मक और इलेक्ट्रॉनिक सूत्र हैं:

एथिलीन अणु में संकरण होता है एस- और दो पी-सी परमाणुओं की कक्षाएँ ( एसपी 2-संकरण)। इस प्रकार, प्रत्येक C परमाणु में तीन संकर कक्षाएँ और एक गैर-संकर कक्षाएँ होती हैं पी-ऑर्बिटल्स. C परमाणुओं के दो संकर कक्षक एक-दूसरे को ओवरलैप करते हैं और परमाणुओं के बीच एक C बंधन बनाते हैं। C परमाणुओं के शेष चार संकर कक्षक चार के साथ एक ही तल में ओवरलैप होते हैं एस-एच परमाणुओं के कक्षक और चार-आबंध भी बनाते हैं। दो गैर-संकर पी C परमाणुओं के -ऑर्बिटल्स एक ऐसे विमान में परस्पर ओवरलैप होते हैं जो -बॉन्ड के विमान के लंबवत स्थित होता है, यानी। एक बंधन बनता है. अभिकर्मकों के प्रभाव में, बंधन आसानी से टूट जाता है।
एथिलीन अणु सममित है; सभी परमाणुओं के नाभिक एक ही तल में स्थित होते हैं और बंधन कोण 120° के करीब होते हैं; C परमाणुओं के केंद्रों के बीच की दूरी 0.134 एनएम है।
यदि परमाणु एक दोहरे बंधन से जुड़े हुए हैं, तो इलेक्ट्रॉन बादलों के बंधन को खोले बिना उनका घूमना असंभव है।
एथिलीन एल्केन्स की समजातीय श्रृंखला का पहला सदस्य है।


लेकिन ब्यूटेन-2 अणु दो स्थानिक रूपों में हो सकता है - सीआईएस- और ट्रांस-:

सीस- और ट्रांस-आइसोमर्स, अंतरिक्ष में परमाणुओं की अलग-अलग व्यवस्था वाले, कई भौतिक और रासायनिक गुणों में भिन्न होते हैं।
इस प्रकार, ऐल्कीनों के दो प्रकार संभव हैं संरचनात्मक समरूपता: कार्बन श्रृंखला समावयवता और दोहरे बंधन स्थिति समावयवता। यह भी संभव है ज्यामितीय समरूपता.
एथिलीन (एथिलीन) एक रंगहीन गैस है जिसमें बहुत हल्की मीठी गंध होती है, हवा से थोड़ी हल्की, पानी में थोड़ी घुलनशील होती है।
द्वारा रासायनिकएथिलीन के गुण ईथेन से बिल्कुल भिन्न होते हैं, जो इसके अणु की इलेक्ट्रॉनिक संरचना के कारण होता है। अणु में एक दोहरा बंधन होने से, जिसमें - और - बंधन शामिल होते हैं, एथिलीन - बंधन के दरार के कारण दो मोनोवैलेंट परमाणुओं या रेडिकल्स को जोड़ने में सक्षम होता है।
प्रतिक्रिया करने की क्षमता परिग्रहण सभी ऐल्कीनों की विशेषता.
1. हाइड्रोजन जोड़(हाइड्रोजनीकरण प्रतिक्रिया):
2. हैलोजन का जोड़(हैलोजनीकरण प्रतिक्रिया):
जब ब्रोमीन (ब्रोमीन पानी के रूप में) को एल्कीन में मिलाया जाता है, तो ब्रोमीन का भूरा रंग जल्दी से गायब हो जाता है। यह प्रतिक्रिया दोहरे बंधन के लिए गुणात्मक है।
3. (हाइड्रोहैलोजनीकरण प्रतिक्रिया):

यदि प्रारंभिक एल्कीन असममित है, तो प्रतिक्रिया मार्कोवनिकोव के नियम के अनुसार आगे बढ़ती है।
असंतृप्त यौगिकों में हाइड्रोजन हैलाइडों का योग इसके अनुसार होता है ईओण कातंत्र।
4. जल कनेक्शन(जलयोजन प्रतिक्रिया):
इस प्रतिक्रिया का उपयोग उद्योग में एथिल अल्कोहल का उत्पादन करने के लिए किया जाता है।
अल्केन्स की विशेषता प्रतिक्रियाओं से होती है ऑक्सीकरण :
1. एथिलीन सामान्य तापमान पर भी आसानी से ऑक्सीकृत हो जाता है, उदाहरण के लिए, पोटेशियम परमैंगनेट की क्रिया के तहत। यदि एथिलीन को पोटेशियम परमैंगनेट KMnO4 के जलीय घोल से गुजारा जाता है, तो बाद वाले का विशिष्ट बैंगनी रंग गायब हो जाता है, और एथिलीन को पोटेशियम परमैंगनेट (एक दोहरे बंधन के लिए गुणात्मक प्रतिक्रिया) के साथ ऑक्सीकरण (हाइड्रॉक्सिलेशन प्रतिक्रिया) किया जाता है:

2. एथिलीन चमकदार लौ के साथ जलकर कार्बन मोनोऑक्साइड (IV) और पानी बनाता है:
सी 2 एच 4 + 3ओ 2 -> 2सीओ 2 + 2एच 2 ओ।
3. वायुमंडलीय ऑक्सीजन द्वारा एथिलीन का आंशिक ऑक्सीकरण अत्यधिक औद्योगिक महत्व का है:

एथिलीन, सभी असंतृप्त हाइड्रोकार्बन की तरह, प्रतिक्रियाओं की विशेषता है बहुलकीकरण . वे ऊंचे तापमान, दबाव और उत्प्रेरक की उपस्थिति में होते हैं:

पॉलिमराइजेशन समान अणुओं को बड़े अणुओं में क्रमबद्ध रूप से संयोजित करना है।
इस प्रकार, एथिलीन और इसके समरूपों को जोड़, ऑक्सीकरण और पोलीमराइज़ेशन प्रतिक्रियाओं की विशेषता है।
व्याख्यान 4.
एसिटिलीन अणु में ट्रिपल बॉन्ड वाले हाइड्रोकार्बन का प्रतिनिधि है।
कार्बनिक संश्लेषण में एसिटिलीन के रासायनिक गुण, उत्पादन और उपयोग
एल्काइन सामान्य सूत्र C वाले हाइड्रोकार्बन हैं एनएच 2 एन-2, जिसके अणुओं में एक त्रिबंध होता है।
एसिटिलीन- एसिटिलीन हाइड्रोकार्बन, या एल्केनीज़ की सजातीय श्रृंखला का पहला सदस्य। एसिटिलीन का आणविक सूत्र C 2 H 2 है।
एसिटिलीन एच-सी का संरचनात्मक सूत्र = सी-एच.
इलेक्ट्रॉनिक सूत्र:
एच : साथ : : : साथ : एन।
ट्रिपल बॉन्ड से जुड़े एसिटिलीन कार्बन परमाणु राज्य में हैं एसपी-संकरण. जब एसिटिलीन अणु बनते हैं, तो प्रत्येक पर एक C परमाणु संकरणित होता है एस- और पी-ऑर्बिटल्स. परिणामस्वरूप, प्रत्येक C परमाणु दो संकर कक्षाएँ प्राप्त करता है, और दो पी-ऑर्बिटल्स गैर-संकर रहते हैं। दो हाइब्रिड ऑर्बिटल्स एक दूसरे को ओवरलैप करते हैं, और सी परमाणुओं के बीच एक -बॉन्ड बनता है। शेष दो संकर कक्षाएँ ओवरलैप होती हैं एस-H परमाणुओं के कक्षक, और -बंध भी उनके और C परमाणुओं के बीच बनते हैं। चार गैर संकर पी-ऑर्बिटल्स को -बॉन्ड की दिशाओं के लिए परस्पर लंबवत और लंबवत रखा जाता है। इन विमानों में पी-ऑर्बिटल्स परस्पर ओवरलैप होते हैं, और दो-बंध बनते हैं, जो अपेक्षाकृत कमजोर होते हैं और रासायनिक प्रतिक्रियाओं में आसानी से टूट जाते हैं।
इस प्रकार, एसिटिलीन अणु में तीन-बंध (एक सी-सी बंधन और दो सी-एच बांड) और दो सी परमाणुओं के बीच दो-बंध होते हैं। एल्काइन्स में ट्रिपल बॉन्ड ट्रिपल बॉन्ड नहीं है, बल्कि एक संयुक्त बॉन्ड है, जिसमें तीन बॉन्ड होते हैं: एक - और दो - बॉन्ड।
एसिटिलीन अणु की एक रैखिक संरचना होती है। तीसरे बंधन की उपस्थिति सी परमाणुओं को एक साथ और करीब ले जाने का कारण बनती है: उनके केंद्रों के बीच की दूरी 0.120 एनएम है।
भौतिक गुण।एसिटिलीन एक रंगहीन गैस है, हवा से हल्की, पानी में थोड़ा घुलनशील और अपने शुद्ध रूप में लगभग गंधहीन होती है।
रासायनिक गुण।एसिटिलीन के रासायनिक गुण काफी हद तक एथिलीन के समान होते हैं। यह जोड़, ऑक्सीकरण और पोलीमराइज़ेशन प्रतिक्रियाओं की विशेषता है।
प्रतिक्रियाओं परिग्रहण. एल्काइन्स एक नहीं, बल्कि दो अभिकारक अणु जोड़ते हैं। ट्रिपल बॉन्ड पहले डबल बॉन्ड में और फिर सिंगल बॉन्ड (-बॉन्ड) में बदल जाता है।
1. हाइड्रोजन जोड़(हाइड्रोजनीकरण प्रतिक्रिया) उत्प्रेरक की उपस्थिति में गर्म करने पर होती है। प्रतिक्रिया दो चरणों में होती है, पहले एथिलीन बनता है, और फिर ईथेन:
2. हैलोजन का जोड़(हैलोजनीकरण प्रतिक्रिया) बहुत आसानी से होती है (दो चरणों में भी):

ब्रोमीन जल का रंग फीका पड़ जाता है। ब्रोमीन जल का रंग बदलना एसिटिलीन के साथ-साथ सभी असंतृप्त हाइड्रोकार्बन के प्रति एक गुणात्मक प्रतिक्रिया है।
3. हाइड्रोजन हैलाइडों का योग(हाइड्रोहैलोजनीकरण प्रतिक्रिया)। हाइड्रोजन क्लोराइड की अतिरिक्त प्रतिक्रिया महत्वपूर्ण है:

विनाइल क्लोराइड से एक बहुलक, पॉलीविनाइल क्लोराइड प्राप्त होता है।
4. जल कनेक्शन(जलयोजन प्रतिक्रिया) पारा (II) लवण की उपस्थिति में होती है - HgSO 4, Hg(NO 3) 2 - एसीटैल्डिहाइड के निर्माण के साथ:

इस प्रतिक्रिया का नाम रूसी वैज्ञानिक मिखाइल ग्रिगोरिएविच कुचेरोव (1881) के नाम पर रखा गया है।
प्रतिक्रियाओं ऑक्सीकरण . एसिटिलीन ऑक्सीकरण एजेंटों के प्रति बहुत संवेदनशील है।
1. जब पोटेशियम परमैंगनेट के घोल से गुजारा जाता है, तो एसिटिलीन आसानी से ऑक्सीकृत हो जाता है, और KMnO 4 घोल फीका पड़ जाता है:
पोटेशियम परमैंगनेट के मलिनकिरण का उपयोग ट्रिपल बॉन्ड की गुणात्मक प्रतिक्रिया के रूप में किया जा सकता है।
ऑक्सीकरण में आमतौर पर ट्रिपल बॉन्ड का टूटना और कार्बोक्जिलिक एसिड का निर्माण शामिल होता है:
आर-सी = C–R " + 3[O] + H 2 O -> R–COOH + R " -COOH.
पूर्ण दहन पर एसिटिलीन कार्बन मोनोऑक्साइड (IV) और पानी पैदा करता है:
2सी 2 एच 2 + 5ओ 2 -> 4सीओ 2 + 2एच 2 ओ।
हवा में, एसिटिलीन अत्यधिक धुएँ वाली लौ के साथ जलता है।
प्रतिक्रियाओं बहुलकीकरण . कुछ शर्तों के तहत, एसिटिलीन बेंजीन और विनाइल एसिटिलीन में बहुलकीकृत हो सकता है।
1. जब एसिटिलीन को 450-500 डिग्री सेल्सियस पर सक्रिय कार्बन के ऊपर से गुजारा जाता है, तो एसिटिलीन बेंजीन बनाने के लिए ट्रिमराइज हो जाता है (एन.डी. ज़ेलिंस्की, 1927):

2. CuCl और NH 4 Cl के जलीय घोल के प्रभाव में, एसिटिलीन मंद हो जाता है, जिससे विनाइल एसिटिलीन बनता है:
विनाइलएसिटिलीन अत्यधिक प्रतिक्रियाशील है; हाइड्रोजन क्लोराइड मिलाने पर यह क्लोरोप्रीन बनाता है, जिसका उपयोग कृत्रिम रबर बनाने में किया जाता है:

एसिटिलीन की तैयारी.प्रयोगशाला और उद्योग में, कैल्शियम कार्बाइड को पानी (कार्बाइड विधि) के साथ प्रतिक्रिया करके एसिटिलीन का उत्पादन किया जाता है:

इलेक्ट्रिक भट्टियों में कोक को बुझे हुए चूने के साथ गर्म करके कैल्शियम कार्बाइड का उत्पादन किया जाता है:
![]()
सीएसी 2 का उत्पादन करने में बहुत अधिक बिजली लगती है, इसलिए कार्बाइड विधि एसिटिलीन की जरूरतों को पूरा नहीं कर सकती है।
उद्योग में, मीथेन के उच्च तापमान के टूटने के परिणामस्वरूप एसिटिलीन प्राप्त होता है:
![]()
कार्बनिक संश्लेषण में एसिटिलीन का अनुप्रयोग।कार्बनिक संश्लेषण में एसिटिलीन का व्यापक रूप से उपयोग किया जाता है। यह सिंथेटिक रबर, पॉलीविनाइल क्लोराइड और अन्य पॉलिमर के उत्पादन में शुरुआती सामग्रियों में से एक है। एसिटिलीन से एसिटिक एसिड और सॉल्वैंट्स (1,1,2,2-टेट्राक्लोरोइथेन और 1,1,2-ट्राइक्लोरोइथेन) प्राप्त होते हैं। जब एसिटिलीन को ऑक्सीजन में जलाया जाता है, तो लौ का तापमान 3150 डिग्री सेल्सियस तक पहुंच जाता है, यही कारण है कि इसका उपयोग वेल्डिंग और धातुओं को काटने में किया जाता है।
एसिटिलीन के औद्योगिक उपयोग के उदाहरण:


व्याख्यान 5.
डायन हाइड्रोकार्बन, उनकी संरचना, गुण, तैयारी और व्यावहारिक महत्व
डायन हाइड्रोकार्बन, या एल्केडीन, हाइड्रोकार्बन हैं जिनमें कार्बन श्रृंखला में दो दोहरे बंधन होते हैं। उनकी संरचना को सामान्य सूत्र C द्वारा व्यक्त किया जा सकता है एनएच 2 एन-2. वे एसिटिलीन हाइड्रोकार्बन के आइसोमेरिक हैं।
अल्केडिएन्स, जिनके अणुओं में दोहरे बंधन एक एकल बंधन (संयुग्मित दोहरे बंधन) द्वारा अलग किए जाते हैं, व्यापक रूप से उपयोग किए जाते हैं - ये हैं

जो रबर के उत्पादन के लिए प्रारंभिक सामग्री हैं।
एक अणु में दो दोहरे बंधन बनाने के लिए कम से कम तीन C परमाणुओं की आवश्यकता होती है। एल्केडीन का सबसे सरल प्रतिनिधि प्रोपेडीन CH2 =C=CH2 है।
डायन हाइड्रोकार्बन कार्बन श्रृंखला में दोहरे बंधन की स्थिति में भिन्न हो सकते हैं:

कार्बन श्रृंखला का समावयवता भी संभव है।
ब्यूटाडीन-1,3 सबसे सरल संयुग्मित एल्केडीन है। ब्यूटाडीन-1,3 में, सभी चार C परमाणु अवस्था में हैं एसपी 2-संकरण. वे एक ही तल में स्थित होते हैं और अणु का कंकाल बनाते हैं। गैर-हाइब्रिड पी-प्रत्येक सी परमाणु की कक्षाएँ कंकाल तल के लंबवत और एक दूसरे के समानांतर होती हैं, जो उनके पारस्परिक ओवरलैप के लिए स्थितियाँ बनाती हैं। ओवरलैप न केवल सी 1 - सी 2 और सी 3 - सी 4 परमाणुओं के बीच होता है, बल्कि आंशिक रूप से सी 2 - सी 3 परमाणुओं के बीच भी होता है। जब चार ओवरलैप होते हैं पी-ऑर्बिटल्स, एक एकल-इलेक्ट्रॉन बादल बनता है, अर्थात। दो दोहरे बंधनों का संयुग्मन (, -संयुग्मन)।
भौतिक गुण।सामान्य परिस्थितियों में ब्यूटाडीन-1,3 एक गैस है जो द्रवीकृत हो जाती है टी= 4.5 डिग्री सेल्सियस; 2-मिथाइलब्यूटाडीन-1,3 एक वाष्पशील तरल है जो उबलता है टी= 34.1 डिग्री सेल्सियस.
रासायनिक गुण।संयुग्मित दोहरे बंधन वाले डायन हाइड्रोकार्बन अत्यधिक प्रतिक्रियाशील होते हैं।
वे आसानी से प्रतिक्रिया करते हैं परिग्रहण , हाइड्रोजन, हैलोजन, हाइड्रोजन हैलाइड आदि के साथ प्रतिक्रिया करता है।
आमतौर पर जोड़ डायन अणुओं के सिरों पर होता है। इस प्रकार, ब्रोमीन के साथ बातचीत करते समय, दोहरे बंधन टूट जाते हैं, ब्रोमीन परमाणु सबसे बाहरी सी परमाणुओं में जुड़ जाते हैं, और मुक्त संयोजकताएं एक दोहरा बंधन बनाती हैं, यानी। जोड़ के परिणामस्वरूप, दोहरा बंधन चलता है:

यदि ब्रोमीन की अधिकता है, तो शेष दोहरे बंधन के स्थान पर एक और अणु जोड़ा जा सकता है।
एल्केडिएन्स में, अतिरिक्त प्रतिक्रियाएं दो दिशाओं में आगे बढ़ सकती हैं:
1) एक दोहरे बंधन के टूटने के स्थान पर (1,2-अतिरिक्त):

2) अणु के सिरों को जोड़ने और दो दोहरे बंधनों को तोड़ने के साथ (1,4-जोड़):

एक मार्ग या किसी अन्य के साथ प्रतिक्रिया का अधिमान्य पाठ्यक्रम विशिष्ट स्थितियों पर निर्भर करता है।
दोहरे बंधनों की उपस्थिति के कारण डायन हाइड्रोकार्बन काफी आसानी से बन जाते हैं भाजन . 2-मिथाइलब्यूटाडीन-1,3 (आइसोप्रीन) के पोलीमराइजेशन का उत्पाद पॉलीआइसोप्रीन है - प्राकृतिक रबर का एक एनालॉग:

रसीद।इथेनॉल से 1,3 ब्यूटाडीन के उत्पादन के लिए उत्प्रेरक विधि की खोज 1932 में सर्गेई वासिलिविच लेबेडेव द्वारा की गई थी। लेबेडेव की विधि के अनुसार, ZnO और Al 2 O 3 पर आधारित उत्प्रेरक की उपस्थिति में इथेनॉल के एक साथ निर्जलीकरण और निर्जलीकरण के परिणामस्वरूप ब्यूटाडीन-1,3 प्राप्त होता है:

लेकिन ब्यूटाडीन के उत्पादन के लिए एक अधिक आशाजनक तरीका पेट्रोलियम गैसों में निहित ब्यूटेन का निर्जलीकरण है। पर टी= 600 डिग्री सेल्सियस, उत्प्रेरक की उपस्थिति में ब्यूटेन का चरणबद्ध निर्जलीकरण होता है:

आइसोपेंटेन का उत्प्रेरक डिहाइड्रोजनीकरण आइसोप्रीन का उत्पादन करता है:

व्यवहारिक महत्व।डायन हाइड्रोकार्बन का उपयोग मुख्य रूप से रबर के संश्लेषण के लिए किया जाता है:

ब्यूटाडीन-1,3 की पॉलिमराइजेशन प्रतिक्रिया:
निरंतरता के साथ पुनर्मुद्रित
असंतृप्त हाइड्रोकार्बन का एक प्रमुख प्रतिनिधि एथीन (एथिलीन) है। भौतिक गुण: रंगहीन ज्वलनशील गैस, ऑक्सीजन और हवा के साथ मिश्रित होने पर विस्फोटक। मूल्यवान कार्बनिक पदार्थों (मोनोहाइड्रिक और डायटोमिक अल्कोहल, पॉलिमर, एसिटिक एसिड और अन्य यौगिकों) के बाद के संश्लेषण के लिए तेल से महत्वपूर्ण मात्रा में एथिलीन प्राप्त किया जाता है।
एथिलीन, एसपी 2 संकरण
संरचना और गुणों में एथीन के समान हाइड्रोकार्बन को एल्कीन कहा जाता है। ऐतिहासिक रूप से, इस समूह के लिए एक और शब्द स्थापित किया गया है - ओलेफ़िन। सामान्य सूत्र C n H 2n पदार्थों के संपूर्ण वर्ग की संरचना को दर्शाता है। इसका पहला प्रतिनिधि एथिलीन है, जिसके अणु में कार्बन परमाणु तीन नहीं, बल्कि हाइड्रोजन के साथ केवल दो एक्स-बंध बनाते हैं। ऐल्कीन असंतृप्त या असंतृप्त यौगिक हैं, इनका सूत्र C 2 H 4 है। कार्बन परमाणु के केवल 2 पी- और 1 एस-इलेक्ट्रॉन बादल आकार और ऊर्जा में मिश्रित होते हैं, कुल मिलाकर तीन õ-बंध बनते हैं; इस स्थिति को sp2 संकरण कहा जाता है। कार्बन की चौथी संयोजकता बरकरार रहती है, और अणु में एक π बंधन दिखाई देता है। संरचनात्मक विशेषता संरचनात्मक सूत्र में परिलक्षित होती है। लेकिन आरेखों पर विभिन्न प्रकार के कनेक्शनों को इंगित करने के लिए प्रतीक आमतौर पर एक ही होते हैं - डैश या बिंदु। एथिलीन की संरचना विभिन्न वर्गों के पदार्थों के साथ इसकी सक्रिय बातचीत को निर्धारित करती है। पानी और अन्य कणों का जुड़ाव कमजोर π बंधन के टूटने के कारण होता है। जारी वैलेंस ऑक्सीजन, हाइड्रोजन और हैलोजन के इलेक्ट्रॉनों द्वारा संतृप्त होते हैं।
एथिलीन: पदार्थ के भौतिक गुण
सामान्य परिस्थितियों (सामान्य वायुमंडलीय दबाव और तापमान 18°C) में एथीन एक रंगहीन गैस है। इसमें एक मीठी (ईथर) गंध होती है, और इसके साँस लेने से मनुष्यों पर मादक प्रभाव पड़ता है। यह -169.5°C पर कठोर हो जाता है और उसी तापमान की स्थिति में पिघल जाता है। एथीन -103.8°C पर उबलता है। 540°C तक गर्म करने पर प्रज्वलित हो जाता है। गैस अच्छी तरह से जलती है, लौ चमकदार है, कमजोर कालिख के साथ। एथिलीन ईथर और एसीटोन में घुल जाता है, पानी और अल्कोहल में तो बहुत कम। पदार्थ का गोलाकार दाढ़ द्रव्यमान 28 ग्राम/मोल है। एथीन की सजातीय श्रृंखला के तीसरे और चौथे प्रतिनिधि भी गैसीय पदार्थ हैं। पांचवें और उसके बाद के ऐल्कीनों के भौतिक गुण अलग-अलग हैं; वे तरल और ठोस हैं;
एथिलीन की तैयारी और गुण
जर्मन रसायनशास्त्री जोहान बेचर ने सांद्र सल्फ्यूरिक एसिड के प्रयोगों में गलती से इसका उपयोग कर लिया। इस प्रकार एथीन को पहली बार प्रयोगशाला स्थितियों (1680) में प्राप्त किया गया था। 19वीं सदी के मध्य में ए.एम. बटलरोव ने यौगिक को एथिलीन नाम दिया। भौतिक गुणों का वर्णन प्रसिद्ध रूसी रसायनज्ञ द्वारा भी किया गया था। बटलरोव ने पदार्थ की संरचना को दर्शाते हुए एक संरचनात्मक सूत्र प्रस्तावित किया। प्रयोगशाला में इसे प्राप्त करने की विधियाँ:

- एसिटिलीन का उत्प्रेरक हाइड्रोजनीकरण।
- गर्म करने पर एक मजबूत आधार (क्षार) के केंद्रित अल्कोहल समाधान के साथ प्रतिक्रिया में क्लोरोइथेन का डीहाइड्रोहैलोजनीकरण।
- एथिल अणुओं से पानी का निष्कासन सल्फ्यूरिक एसिड की उपस्थिति में होता है। इसका समीकरण: H2C-CH2-OH → H2C=CH2 + H2O
औद्योगिक उत्पादन:
- तेल शोधन - हाइड्रोकार्बन का टूटना और पायरोलिसिस;
- उत्प्रेरक की उपस्थिति में ईथेन का निर्जलीकरण। एच 3 सी-सीएच 3 → एच 2 सी=सीएच 2 + एच 2
एथिलीन की संरचना इसकी विशिष्ट रासायनिक प्रतिक्रियाओं की व्याख्या करती है - सी परमाणुओं द्वारा कणों का योग जो एक बहु बंधन में हैं:
- हैलोजनीकरण और हाइड्रोहैलोजनीकरण। इन प्रतिक्रियाओं के उत्पाद हैलोजन व्युत्पन्न हैं।
- हाइड्रोजनीकरण (ईथेन की संतृप्ति)
- डाइहाइड्रिक अल्कोहल एथिलीन ग्लाइकोल का ऑक्सीकरण। इसका सूत्र OH-H2C-CH2-OH है।
- योजना के अनुसार पॉलिमराइजेशन: n(H2C=CH2) → n(-H2C-CH2-)।


एथिलीन के अनुप्रयोग के क्षेत्र
जब बड़ी मात्रा में विभाजित किया जाता है, तो पदार्थ के भौतिक गुण, संरचना और रासायनिक प्रकृति इसे एथिल अल्कोहल, हैलोजन डेरिवेटिव, अल्कोहल, ऑक्साइड, एसिटिक एसिड और अन्य यौगिकों के उत्पादन में उपयोग करने की अनुमति देती है। एथीन पॉलीइथाइलीन का एक मोनोमर है और पॉलीस्टाइनिन का मूल यौगिक भी है।
डाइक्लोरोइथेन, जो एथीन और क्लोरीन से उत्पन्न होता है, पॉलीविनाइल क्लोराइड (पीवीसी) के उत्पादन में उपयोग किया जाने वाला एक अच्छा विलायक है। फिल्म, पाइप, बर्तन निम्न और उच्च घनत्व वाली पॉलीथीन से बनाए जाते हैं; सीडी और अन्य भागों के लिए केस पॉलीस्टाइनिन से बनाए जाते हैं। पीवीसी लिनोलियम और वाटरप्रूफ रेनकोट का आधार है। कृषि में, फलों को जल्दी पकाने के लिए कटाई से पहले एथीन से उपचारित किया जाता है।
भौतिक गुण
एन के तहत एथन. Y एक रंगहीन, गंधहीन गैस है। दाढ़ द्रव्यमान - 30.07. गलनांक -182.81 डिग्री सेल्सियस, क्वथनांक -88.63 डिग्री सेल्सियस। . घनत्व ρ गैस. =0.001342 ग्राम/सेमी³ या 1.342 किग्रा/मीटर³ (संख्या), ρ तरल। =0.561 ग्राम/सेमी³ (टी=-100 डिग्री सेल्सियस)। वियोजन स्थिरांक 42 (पानी में, मानक) [ स्रोत?] . 0 डिग्री सेल्सियस पर वाष्प दबाव - 2.379 एमपीए।
रासायनिक गुण
रासायनिक सूत्र सी 2 एच 6 (तर्कसंगत सीएच 3 सीएच 3)। सबसे विशिष्ट प्रतिक्रियाएं हैलोजन के साथ हाइड्रोजन का प्रतिस्थापन हैं, जो एक मुक्त कट्टरपंथी तंत्र के माध्यम से होती हैं। 550-650 डिग्री सेल्सियस पर ईथेन के थर्मल डिहाइड्रोजनेशन से केटीन बनता है, 800 डिग्री सेल्सियस से ऊपर के तापमान पर - कैसिटिलीन (बेंज़ोलीसेट भी बनता है)। 300-450 डिग्री सेल्सियस पर प्रत्यक्ष क्लोरीनीकरण - एथिल क्लोराइड, गैस चरण में नाइट्रेशन से नाइट्रोएथेन और ट्रोमेथेन का मिश्रण (3:1) मिलता है।
रसीद
उद्योग में
उद्योग में इसे पेट्रोलियम और प्राकृतिक गैसों से प्राप्त किया जाता है, जहां इसकी मात्रा मात्रा के हिसाब से 10% तक होती है। रूस में तेल गैसों में ईथेन की मात्रा बहुत कम है। संयुक्त राज्य अमेरिका और कनाडा में (जहां तेल और प्राकृतिक गैसों में इसकी सामग्री अधिक है) यह एथीन के उत्पादन के लिए मुख्य कच्चे माल के रूप में कार्य करता है।
प्रयोगशाला स्थितियों में
वुर्ट्ज़ प्रतिक्रिया द्वारा आयोडोमेथेन से, कोल्बे प्रतिक्रिया द्वारा इलेक्ट्रोलिसिस द्वारा सोडियम एसीटेट से, क्षार के साथ सोडियम प्रोपियोनेट के संलयन द्वारा, ग्रिग्नार्ड प्रतिक्रिया द्वारा एथिल ब्रोमाइड से, एथीन (पीडी से अधिक) या एसिटिलीन (रेनी की उपस्थिति में) के हाइड्रोजनीकरण द्वारा प्राप्त किया जाता है। निकेल)।
आवेदन
उद्योग में ईथेन का मुख्य उपयोग एथिलीन का उत्पादन है।
बुटान(सी 4 एच 10) - वर्ग का कार्बनिक यौगिक हाइड्रोकार्बन. रसायन विज्ञान में, नाम का उपयोग मुख्य रूप से एन-ब्यूटेन को संदर्भित करने के लिए किया जाता है। एन-ब्यूटेन और उसका मिश्रण आइसोमर आइसोब्यूटेनसीएच(सीएच 3) 3 . यह नाम मूल "लेकिन-" (अंग्रेजी नाम) से आया है ब्यूट्रिक एसिड - ब्यूट्रिक एसिड) और प्रत्यय "-एएन" (अल्केन्स से संबंधित)। उच्च सांद्रता में यह जहरीला होता है; ब्यूटेन के साँस लेने से फुफ्फुसीय-श्वसन तंत्र की शिथिलता हो जाती है। में निहित प्राकृतिक गैस, तब बनता है जब खुर पेट्रोलियम उत्पाद, संबद्ध को विभाजित करते समय तेल गैस, "मोटा" प्राकृतिक गैस. हाइड्रोकार्बन गैसों के प्रतिनिधि के रूप में, यह अग्निमय और विस्फोटक है, कम विषैला है, इसमें विशिष्ट विशिष्ट गंध है और इसमें मादक गुण हैं। शरीर पर प्रभाव की डिग्री के संदर्भ में, गैस GOST 12.1.007-76 के अनुसार चौथे खतरा वर्ग (कम-खतरा) के पदार्थों से संबंधित है। तंत्रिका तंत्र पर हानिकारक प्रभाव .
संवयविता
ब्यूटेन के पास दो हैं आइसोमर:
भौतिक गुण
ब्यूटेन एक रंगहीन ज्वलनशील गैस है, जिसमें एक विशिष्ट गंध होती है, जो आसानी से द्रवीकृत हो जाती है (0 डिग्री सेल्सियस से नीचे और सामान्य दबाव या ऊंचे दबाव और सामान्य तापमान पर - एक अत्यधिक अस्थिर तरल)। हिमांक बिंदु -138°C (सामान्य दबाव पर)। घुलनशीलतापानी में - 100 मिलीलीटर पानी में 6.1 मिलीग्राम (एन-ब्यूटेन के लिए, 20 डिग्री सेल्सियस पर, कार्बनिक सॉल्वैंट्स में बहुत बेहतर घुलनशील) ). बन सकता है azeotropicलगभग 100 डिग्री सेल्सियस के तापमान और 10 एटीएम के दबाव पर पानी के साथ मिश्रण।
ढूँढना और प्राप्त करना
गैस घनीभूत और पेट्रोलियम गैस (12% तक) में निहित है। यह कैटेलिटिक और हाइड्रोकैटलिटिक का एक उत्पाद है खुरतेल अंश. प्रयोगशाला में प्राप्त किया जा सकता है वर्ट्ज़ प्रतिक्रियाएँ.
2 C 2 H 5 Br + 2Na → CH 3 -CH 2 -CH 2 -CH 3 + 2NaBr
ब्यूटेन अंश का डीसल्फराइजेशन (डीमर्कैप्टेनाइजेशन)।
सीधे चलने वाले ब्यूटेन अंश को सल्फर यौगिकों से शुद्ध किया जाना चाहिए, जो मुख्य रूप से मिथाइल और एथिल मर्कैप्टन द्वारा दर्शाए जाते हैं। मर्कैप्टन से ब्यूटेन अंश को शुद्ध करने की विधि में हाइड्रोकार्बन अंश से मर्कैप्टन का क्षारीय निष्कर्षण और उसके बाद डाइसल्फ़ाइड तेल की रिहाई के साथ वायुमंडलीय ऑक्सीजन के साथ सजातीय या विषम उत्प्रेरक की उपस्थिति में क्षार का पुनर्जनन शामिल है।
अनुप्रयोग और प्रतिक्रियाएँ
मुक्त मूलक क्लोरीनीकरण के दौरान यह 1-क्लोरो- और 2-क्लोरोब्यूटेन का मिश्रण बनाता है। उनके अनुपात को स्थिति 1 और 2 (425 और 411 केजे/मोल) में सी-एच बांड की ताकत में अंतर से अच्छी तरह से समझाया गया है। वायु में पूर्णतः दहन होने पर यह बनता है कार्बन डाईऑक्साइडऔर पानी। ब्यूटेन का उपयोग किसके मिश्रण में किया जाता है? प्रोपेनलाइटर में, तरलीकृत अवस्था में गैस सिलेंडर में, जहां इसकी गंध होती है, क्योंकि इसमें विशेष रूप से जोड़ा जाता है गंधक. इस मामले में, विभिन्न रचनाओं वाले "सर्दी" और "ग्रीष्मकालीन" मिश्रण का उपयोग किया जाता है। दहन की ऊष्मा 1 किग्रा - 45.7 एमजे (12.72 किलोवाट).
2सी 4 एच 10 + 13 ओ 2 → 8 सीओ 2 + 10 एच 2 ओ
जब ऑक्सीजन की कमी होती है तो यह बनता है कालिखया कार्बन मोनोआक्साइडया दोनों एक साथ.
2सी 4 एच 10 + 5 ओ 2 → 8 सी + 10 एच 2 ओ
2सी 4 एच 10 + 9 ओ 2 → 8 सीओ + 10 एच 2 ओ
कंपनी द्वारा Dupontप्राप्त करने हेतु एक विधि विकसित की गई है Maleic एनहाइड्राइडउत्प्रेरक ऑक्सीकरण द्वारा एन-ब्यूटेन से।
2 सीएच 3 सीएच 2 सीएच 2 सीएच 3 + 7 ओ 2 → 2 सी 2 एच 2 (सीओ) 2 ओ + 8 एच 2 ओ
एन-ब्यूटेन - उत्पादन के लिए कच्चा माल ब्यूटेन, 1,3-ब्यूटाडीन, उच्च ऑक्टेन गैसोलीन का एक घटक। उच्च शुद्धता वाले ब्यूटेन और विशेष रूप से आइसोब्यूटेन का उपयोग प्रशीतन इकाइयों में रेफ्रिजरेंट के रूप में किया जा सकता है। ऐसी प्रणालियों का प्रदर्शन फ़्रीऑन प्रणालियों की तुलना में थोड़ा कम होता है। फ़्रीऑन रेफ्रिजरेंट के विपरीत, ब्यूटेन पर्यावरण के अनुकूल है।
खाद्य उद्योग में, ब्यूटेन के रूप में पंजीकृत है खाद्य योज्य E943a, और आइसोब्यूटेन - E943बी, कैसे फेंकने योग्य, उदाहरण के लिए, में डिओडोरेंट्स.
ईथीलीन(द्वारा आईयूपीएसी: ईथेन) - जैविक रासायनिक यौगिक, सूत्र C 2 H 4 द्वारा वर्णित है। सबसे सरल है एल्केन (ओलेफ़िन). एथिलीन व्यावहारिक रूप से प्रकृति में नहीं पाया जाता है। यह एक रंगहीन, हल्की गंध वाली ज्वलनशील गैस है। पानी में आंशिक रूप से घुलनशील (0°C पर 100 मिली पानी में 25.6 मिली), इथेनॉल (समान परिस्थितियों में 359 मिली)। यह डायथाइल ईथर और हाइड्रोकार्बन में अत्यधिक घुलनशील है। इसमें दोहरा बंधन होता है और इसलिए इसे असंतृप्त या असंतृप्त के रूप में वर्गीकृत किया जाता है हाइड्रोकार्बन. उद्योग जगत में अत्यंत महत्वपूर्ण भूमिका निभाता है और है भी फाइटोहोर्मोन. एथिलीन विश्व में सबसे अधिक उत्पादित कार्बनिक यौगिक है ; कुल विश्व एथिलीन उत्पादन 2008मात्रा 113 मिलियन टन हो गई और प्रति वर्ष 2-3% की दर से बढ़ रही है .
आवेदन
एथिलीन प्रमुख उत्पाद है बुनियादी कार्बनिक संश्लेषणऔर इसका उपयोग निम्नलिखित यौगिकों का उत्पादन करने के लिए किया जाता है (वर्णमाला क्रम में सूचीबद्ध):
विनयल असेटेट;
डाइक्लोरोइथेन / विनाइल क्लोराइड(तीसरा स्थान, कुल मात्रा का 12%);
इथिलीन ऑक्साइड(दूसरा स्थान, कुल मात्रा का 14-15%);
polyethylene(प्रथम स्थान, कुल मात्रा का 60% तक);
स्टाइरीन;
एसीटिक अम्ल;
एथिलबेन्जीन;
इथाइलीन ग्लाइकॉल;
इथेनॉल.
ऑक्सीजन के साथ मिश्रित एथिलीन का उपयोग दवा में किया जाता है बेहोशीयूएसएसआर और मध्य पूर्व में बीसवीं सदी के मध्य 80 के दशक तक। एथिलीन है फाइटोहोर्मोनलगभग सभी पौधों में , अन्य बातों के अलावा कोनिफर्स में सुइयों के गिरने के लिए जिम्मेदार है।
बुनियादी रासायनिक गुण
एथिलीन एक रासायनिक रूप से सक्रिय पदार्थ है। चूँकि अणु में कार्बन परमाणुओं के बीच एक दोहरा बंधन होता है, उनमें से एक, जो कम मजबूत होता है, आसानी से टूट जाता है, और बंधन टूटने के स्थान पर अणुओं का जुड़ाव, ऑक्सीकरण और पोलीमराइजेशन होता है।
हैलोजनीकरण:
सीएच 2 =सीएच 2 + सीएल 2 → सीएच 2 सीएल-सीएच 2 सीएल
ब्रोमीन जल का मलिनकिरण होता है। यह असंतृप्त यौगिकों के प्रति एक गुणात्मक प्रतिक्रिया है।
हाइड्रोजनीकरण:
सीएच 2 =सीएच 2 + एच - एच → सीएच 3 - सीएच 3 (नी के प्रभाव में)
हाइड्रोहैलोजनीकरण:
सीएच 2 =सीएच 2 + एचबीआर → सीएच 3 - सीएच 2 ब्र
जलयोजन:
सीएच 2 =सीएच 2 + एचओएच → सीएच 3 सीएच 2 ओएच (उत्प्रेरक के प्रभाव में)
इस प्रतिक्रिया की खोज ए.एम. ने की थी। बटलरोव, और इसका उपयोग एथिल अल्कोहल के औद्योगिक उत्पादन के लिए किया जाता है।
ऑक्सीकरण:
एथिलीन आसानी से ऑक्सीकृत हो जाता है। यदि एथिलीन को पोटेशियम परमैंगनेट के घोल में प्रवाहित किया जाए तो इसका रंग फीका पड़ जाएगा। इस प्रतिक्रिया का उपयोग संतृप्त और असंतृप्त यौगिकों के बीच अंतर करने के लिए किया जाता है।
एथिलीन ऑक्साइड एक नाजुक पदार्थ है; ऑक्सीजन पुल टूट जाता है और पानी जुड़ जाता है, जिसके परिणामस्वरूप निर्माण होता है इथाइलीन ग्लाइकॉल:
सी 2 एच 4 + 3ओ 2 → 2सीओ 2 + 2एच 2 ओ
पॉलिमराइजेशन:
एनसीएच 2 =सीएच 2 → (-सीएच 2 -सीएच 2 -) एन
आइसोप्रेनसीएच 2 =सी(सीएच3)-सीएच=सीएच2, 2-मिथाइलब्यूटाडीन-1,3 - असंतृप्त हाइड्रोकार्बन डायन श्रृंखला (सी एन एच 2n -2 ) . सामान्य परिस्थितियों में, रंगहीन तरल। वह है मोनोमरके लिए प्राकृतिक रबरऔर अन्य प्राकृतिक यौगिकों के कई अणुओं के लिए एक संरचनात्मक इकाई - आइसोप्रेनोइड्स, या टेरपेनोइड्स. . में घुलनशील शराब. आइसोप्रीन पोलीमराइज़ होकर आइसोप्रीन देता है घिसने. आइसोप्रीन भी प्रतिक्रिया करता है बहुलकीकरणविनाइल यौगिकों के साथ।
ढूँढना और प्राप्त करना
प्राकृतिक रबर आइसोप्रीन का एक बहुलक है - आमतौर पर 100,000 से 1,000,000 के आणविक भार के साथ सीआईएस-1,4-पॉलीसोप्रीन। इसमें अशुद्धियों के रूप में कई प्रतिशत अन्य सामग्रियां शामिल होती हैं, जैसे गिलहरी, वसा अम्ल, रेजिन और अकार्बनिक पदार्थ. प्राकृतिक रबर के कुछ स्रोत कहलाते हैं गटापारचाऔर इसमें ट्रांस-1,4-पॉलीसोप्रीन, संरचनात्मक शामिल है आइसोमर, जिसमें समान लेकिन समान गुण नहीं हैं। आइसोप्रीन का उत्पादन और वायुमंडल में कई प्रकार के पेड़ों द्वारा किया जाता है (मुख्य है ओक) वनस्पति द्वारा आइसोप्रीन का वार्षिक उत्पादन लगभग 600 मिलियन टन है, जिसमें से आधा उष्णकटिबंधीय चौड़ी पत्ती वाले पेड़ों द्वारा उत्पादित किया जाता है, बाकी झाड़ियों द्वारा उत्पादित किया जाता है। एक बार वायुमंडल में छोड़े जाने के बाद, आइसोप्रीन मुक्त कणों (जैसे हाइड्रॉक्सिल (ओएच) रेडिकल्स) और, कुछ हद तक, ओजोन द्वारा परिवर्तित हो जाता है। जैसे विभिन्न पदार्थों में एल्डीहाइड, हाइड्रोक्सीपेरॉक्साइड्स, कार्बनिक नाइट्रेट और एपॉक्साइड्स, जो पानी की बूंदों के साथ मिलकर एरोसोल या बनाते हैं धुंध. पेड़ इस तंत्र का उपयोग न केवल सूर्य द्वारा पत्तियों को अधिक गरम होने से बचाने के लिए करते हैं, बल्कि विशेष रूप से मुक्त कणों से बचाने के लिए भी करते हैं। ओजोन. आइसोप्रीन सबसे पहले प्राकृतिक रबर के ताप उपचार द्वारा प्राप्त किया गया था। अधिकांश औद्योगिक रूप से थर्मल उत्पाद के रूप में उपलब्ध है खुर मिट्टी का तेलया तेल, और उत्पादन में उप-उत्पाद के रूप में भी ईथीलीन. प्रति वर्ष लगभग 20,000 टन का उत्पादन होता है। आइसोप्रीन उत्पादन का लगभग 95% उपयोग सीआईएस-1,4-पॉलीसोप्रीन बनाने के लिए किया जाता है, जो प्राकृतिक रबर का सिंथेटिक संस्करण है।
ब्यूटाडीन-1.3(डिविनाइल) सीएच 2 =सीएच-सीएच=सीएच2 - असंतृप्त हाइड्रोकार्बन, सबसे सरल प्रतिनिधि डायन हाइड्रोकार्बन.
भौतिक गुण
ब्यूटाडीन - रंगहीन गैसएक विशिष्ट गंध के साथ, उबलने का तापमान-4.5 डिग्री सेल्सियस, पिघलने का तापमान-108.9 डिग्री सेल्सियस, फ़्लैश प्वाइंट-40 डिग्री सेल्सियस, अधिकतम अनुमेय एकाग्रताहवा में (अधिकतम अनुमेय सांद्रता) 0.1 ग्राम/वर्ग मीटर, घनत्व-6 डिग्री सेल्सियस पर 0.650 ग्राम/सेमी³।
पानी में थोड़ा घुलनशील, अल्कोहल में अत्यधिक घुलनशील, हवा के साथ मिट्टी का तेल 1.6-10.8% की मात्रा में।
रासायनिक गुण
ब्यूटाडाइन का खतरा है बहुलकीकरण, आसानी से ऑक्सीकरण हो जाता है वायुशिक्षा के साथ पेरोक्साइडयौगिक जो पोलीमराइजेशन को तेज करते हैं।
रसीद
प्रतिक्रिया से ब्यूटाडीन का निर्माण होता है लेबेडेवासंचरण एथिल अल्कोहोलके माध्यम से उत्प्रेरक:
2CH 3 CH 2 OH → C 4 H 6 + 2H 2 O + H 2
या सामान्य का डिहाइड्रोजनीकरण ब्यूटिलीन:
सीएच 2 =सीएच-सीएच 2 -सीएच 3 → सीएच 2 =सीएच-सीएच=सीएच 2 + एच 2
आवेदन
ब्यूटाडीन के पोलीमराइजेशन से सिंथेटिक उत्पादन होता है रबड़. सहबहुलकीकरण के साथ acrylonitrileऔर स्टाइरीनपाना एबीएस प्लास्टिक.
बेंजीन (सी 6 एच 6 , पीएचडी एच) - कार्बनिक रासायनिक यौगिक, बेरंग तरलएक सुखद मिठास के साथ गंध. सरल सुगंधित हाइड्रोकार्बन. बेंजीन शामिल है पेट्रोल, में व्यापक रूप से उपयोग किया जाता है उद्योग, उत्पादन के लिए कच्चा माल है दवाएं, विभिन्न प्लास्टिक, सिंथेटिक रबड़, रंग। हालांकि बेंजीन शामिल है कच्चा तेल, औद्योगिक पैमाने पर इसे इसके अन्य घटकों से संश्लेषित किया जाता है। विषाक्त, कासीनजन.
भौतिक गुण
एक अजीब तीखी गंध वाला रंगहीन तरल। गलनांक = 5.5 डिग्री सेल्सियस, क्वथनांक = 80.1 डिग्री सेल्सियस, घनत्व = 0.879 ग्राम/सेमी³, दाढ़ द्रव्यमान = 78.11 ग्राम/मोल। सभी हाइड्रोकार्बन की तरह, बेंजीन जलता है और बहुत अधिक कालिख पैदा करता है। हवा के साथ विस्फोटक मिश्रण बनाता है, अच्छी तरह मिश्रित होता है ईथर, पेट्रोलऔर अन्य कार्बनिक सॉल्वैंट्स, 69.25 डिग्री सेल्सियस (91% बेंजीन) के क्वथनांक के साथ पानी के साथ एक एज़ोट्रोपिक मिश्रण बनाते हैं। पानी में घुलनशीलता 1.79 ग्राम/लीटर (25 डिग्री सेल्सियस पर)।
रासायनिक गुण
बेंजीन को प्रतिस्थापन प्रतिक्रियाओं की विशेषता है - बेंजीन के साथ प्रतिक्रिया करता है ऐल्कीन, क्लोरीन हाइड्रोकार्बन, हैलोजन, नाइट्रोजनऔर सल्फ्यूरिक एसिड. बेंजीन रिंग के विखंडन की प्रतिक्रियाएं कठोर परिस्थितियों (तापमान, दबाव) में होती हैं।
उत्प्रेरक की उपस्थिति में क्लोरीन के साथ अन्योन्यक्रिया:
6 एच 6 + सीएल 2 -(एफईसीएल 3) → 6 एच 5 सीएल + एचसीएल से क्लोरोबेंजीन बनता है
उत्प्रेरक हैलोजन परमाणुओं के बीच ध्रुवीकरण द्वारा एक सक्रिय इलेक्ट्रोफिलिक प्रजाति के निर्माण को बढ़ावा देते हैं।
सीएल-सीएल + FeCl 3 → सीएल ઠ - ઠ +
सी 6 एच 6 + सीएल ઠ - -सीएल ઠ + + FeCl 3 → [सी 6 एच 5 सीएल + FeCl 4 ] → सी 6 एच 5 सीएल + FeCl 3 + एचसीएल
उत्प्रेरक की अनुपस्थिति में, गर्म या रोशन होने पर एक कट्टरपंथी प्रतिस्थापन प्रतिक्रिया होती है।
6 एच 6 + 3सीएल 2 - (प्रकाश) → सी 6 एच 6 सीएल 6 के साथ हेक्साक्लोरोसाइक्लोहेक्सेन आइसोमर्स का मिश्रण बनता है वीडियो
ब्रोमीन के साथ प्रतिक्रिया (शुद्ध):
अल्केन्स के हैलोजन डेरिवेटिव के साथ इंटरेक्शन ( फ्रीडेल-शिल्प प्रतिक्रिया):
C 6 H 6 + C 2 H 5 Cl -(AlCl 3) → C 6 H 5 C 2 H 5 + HCl एथिलबेन्जीन बनता है
सी 6 एच 6 + एचएनओ 3 -(एच 2 एसओ 4) → सी 6 एच 5 नंबर 2 + एच 2 ओ
संरचना

बेंजीन की संरचना असंतृप्त है। हाइड्रोकार्बन(समजात श्रृंखला C n H 2n-6), लेकिन श्रृंखला के हाइड्रोकार्बन के विपरीत ईथीलीनसी 2 एच 4 असंतृप्त हाइड्रोकार्बन में निहित गुणों को प्रदर्शित करता है (वे अतिरिक्त प्रतिक्रियाओं की विशेषता रखते हैं) केवल कठोर परिस्थितियों में, लेकिन बेंजीन प्रतिस्थापन प्रतिक्रियाओं के लिए अधिक प्रवण होता है। बेंजीन के इस "व्यवहार" को इसकी विशेष संरचना द्वारा समझाया गया है: एक ही तल पर सभी बंधनों और अणुओं का स्थान और संरचना में संयुग्मित 6π-इलेक्ट्रॉन बादल की उपस्थिति। बेंजीन में बांड की इलेक्ट्रॉनिक प्रकृति की आधुनिक समझ परिकल्पना पर आधारित है लिनस पॉलिंग, जिन्होंने बेंजीन अणु को एक खुदे हुए वृत्त के साथ एक षट्भुज के रूप में चित्रित करने का प्रस्ताव दिया, जिससे निश्चित दोहरे बंधनों की अनुपस्थिति और चक्र के सभी छह कार्बन परमाणुओं को कवर करने वाले एक एकल इलेक्ट्रॉन बादल की उपस्थिति पर जोर दिया गया।
उत्पादन
आज, बेंजीन के उत्पादन के लिए तीन मौलिक रूप से भिन्न तरीके हैं।
कोकिंगकोयला। यह प्रक्रिया ऐतिहासिक रूप से पहली थी और द्वितीय विश्व युद्ध तक बेंजीन के मुख्य स्रोत के रूप में काम करती थी। वर्तमान में, इस विधि द्वारा उत्पादित बेंजीन का हिस्सा 1% से भी कम है। यह जोड़ा जाना चाहिए कि कोयला टार से प्राप्त बेंजीन में महत्वपूर्ण मात्रा में थियोफीन होता है, जो ऐसे बेंजीन को कई तकनीकी प्रक्रियाओं के लिए अनुपयुक्त कच्चा माल बनाता है।
उत्प्रेरक सुधार(सुगंधित) गैसोलीन तेल के अंश। यह प्रक्रिया संयुक्त राज्य अमेरिका में बेंजीन का मुख्य स्रोत है। पश्चिमी यूरोप, रूस और जापान में पदार्थ की कुल मात्रा का 40-60% इसी विधि से प्राप्त किया जाता है। इस प्रक्रिया में बेंजीन के अलावा, टोल्यूनिऔर जाइलीन. इस तथ्य के कारण कि टोल्यूनि का उत्पादन इसकी मांग से अधिक मात्रा में किया जाता है, इसे आंशिक रूप से संसाधित भी किया जाता है:
बेंजीन - हाइड्रोडिएल्काइलेशन विधि द्वारा;
बेंजीन और जाइलीन का मिश्रण - अनुपातहीन विधि द्वारा;
पायरोलिसिसगैसोलीन और भारी पेट्रोलियम अंश। इस विधि से 50% तक बेंजीन का उत्पादन होता है। बेंजीन के साथ टोल्यूनि और ज़ाइलीन बनते हैं। कुछ मामलों में, इस पूरे अंश को डीलकिलेशन चरण में भेजा जाता है, जहां टोल्यूनि और जाइलीन दोनों बेंजीन में परिवर्तित हो जाते हैं।
आवेदन
बेंजीन रासायनिक उद्योग में दस सबसे महत्वपूर्ण पदार्थों में से एक है। [ स्रोत 232 दिन निर्दिष्ट नहीं है ] उत्पादित अधिकांश बेंजीन का उपयोग अन्य उत्पादों के संश्लेषण के लिए किया जाता है:
लगभग 50% बेंजीन परिवर्तित हो जाता है एथिलबेन्जीन (alkylationबेंजीन ईथीलीन);
लगभग 25% बेंजीन परिवर्तित हो जाता है क्यूमीन (alkylationबेंजीन प्रोपलीन);
लगभग 10-15% बेंजीन हाइड्रोजनीकृतवी cyclohexane;
बेंजीन का लगभग 10% उत्पादन पर खर्च किया जाता है nitrobenzene;
2-3% बेंजीन में परिवर्तित हो जाता है रैखिक एल्काइलबेन्जीन;
संश्लेषण के लिए लगभग 1% बेंजीन का उपयोग किया जाता है क्लोरोबेंजीन.
कुछ अन्य यौगिकों के संश्लेषण के लिए बेंजीन का उपयोग काफी कम मात्रा में किया जाता है। कभी-कभी और चरम मामलों में, इसकी उच्च विषाक्तता के कारण, बेंजीन का उपयोग किया जाता है विलायक. इसके अलावा, बेंजीन का हिस्सा है पेट्रोल. इसकी उच्च विषाक्तता के कारण, इसकी सामग्री नए मानकों द्वारा 1% तक सीमित है।
टोल्यूनि(से स्पैनिश तोलु, टोलु बालसम) - मिथाइलबेन्जीन, एक विशिष्ट गंध वाला रंगहीन तरल, एरेन्स से संबंधित है।
टोल्यूनि को पहली बार 1835 में पाइन राल के आसवन के दौरान पी. पेल्टियर द्वारा प्राप्त किया गया था। 1838 में, ए. डेविल ने इसे कोलंबिया के टोलू शहर से लाए गए बालसम से अलग किया, जिसके बाद इसे इसका नाम मिला।
सामान्य विशेषताएँ
तीखी गंध वाला रंगहीन, गतिशील, वाष्पशील तरल, कमजोर मादक प्रभाव प्रदर्शित करता है। हाइड्रोकार्बन के साथ असीमित सीमा के भीतर मिश्रणीय, अनेक अल्कोहलऔर ईथर, पानी के साथ नहीं घुलता है। अपवर्तक सूचकांकप्रकाश 1.4969 20 डिग्री सेल्सियस पर। यह ज्वलनशील है और धुएँ के साथ जलता है।
रासायनिक गुण
टोल्यूनि को सुगंधित वलय में इलेक्ट्रोफिलिक प्रतिस्थापन प्रतिक्रियाओं और रेडिकल तंत्र के अनुसार मिथाइल समूह में प्रतिस्थापन की विशेषता है।
इलेक्ट्रोफिलिक प्रतिस्थापनसुगंधित वलय में यह मुख्य रूप से मिथाइल समूह के सापेक्ष ऑर्थो- और पैरा-स्थितियों में होता है।
प्रतिस्थापन प्रतिक्रियाओं के अलावा, टोल्यूनि अतिरिक्त प्रतिक्रियाओं (हाइड्रोजनीकरण) और ओजोनोलिसिस से गुजरता है। कुछ ऑक्सीकरण एजेंट (पोटेशियम परमैंगनेट का क्षारीय घोल, पतला नाइट्रिक एसिड) मिथाइल समूह को कार्बोक्सिल समूह में ऑक्सीकरण करते हैं। स्व-प्रज्वलन तापमान 535 डिग्री सेल्सियस। लौ प्रसार की एकाग्रता सीमा, %वॉल्यूम। लौ प्रसार की तापमान सीमा, डिग्री सेल्सियस। फ़्लैश बिंदु 4°C.
अम्लीय वातावरण में पोटेशियम परमैंगनेट के साथ परस्पर क्रिया:
5C 6 H 5 CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O बेंजोइक एसिड का निर्माण
प्राप्ति एवं शुद्धि
उत्पाद उत्प्रेरक सुधार पेट्रोलगुटों तेल. चयनात्मक निष्कर्षण और उसके बाद पृथक किया गया परिहार.इसके अलावा कैटेलिटिक डिहाइड्रोजनेशन से भी अच्छी पैदावार प्राप्त होती है हेपटैनके माध्यम से मिथाइलसाइक्लोहेक्सेन. टोल्यूनि को इसी प्रकार शुद्ध किया जाता है बेंजीन, केवल यदि उपयोग किया जाता है केंद्रित सल्फ्यूरिक एसिडहमें उस टोल्यूनि को नहीं भूलना चाहिए सल्फोनेटेडबेंजीन से हल्का, जिसका अर्थ है कि कम तापमान बनाए रखना आवश्यक है प्रतिक्रिया मिश्रण(30 से कम डिग्री सेल्सियस). टोल्यूनि पानी के साथ एज़ोट्रोप भी बनाता है .
टोल्यूनि को बेंजीन से प्राप्त किया जा सकता है फ़्रीडेल-शिल्प प्रतिक्रियाएँ:
आवेदन
उत्पादन के लिए कच्चा माल बेंजीन, बेंज़ोइक एसिड, nitrotoluenes(शामिल trinitrotoluene), टोल्यूनि डायसोसायनेट्स(डाइनिट्रोटोलुइन और टोल्यूनि डायमाइन के माध्यम से) बेंजाइल क्लोराइडऔर अन्य कार्बनिक पदार्थ।
है विलायककई के लिए पॉलिमर, विभिन्न वाणिज्यिक सॉल्वैंट्स का हिस्सा है वार्निशऔर पेंट. सॉल्वैंट्स में शामिल: आर-40, आर-4, 645, 646 , 647 , 648. रासायनिक संश्लेषण में विलायक के रूप में उपयोग किया जाता है।
नेफ़थलीन- C 10 H 8 विशेषता वाला ठोस क्रिस्टलीय पदार्थ गंध. यह पानी में नहीं घुलता, लेकिन पानी में अच्छा रहता है बेंजीन, हवा में, शराब, क्लोरोफार्म.
रासायनिक गुण
नेफ़थलीन रासायनिक गुणों में समान है बेंजीन: आसानी से नाइट्रेट, सल्फोनेटेड, के साथ इंटरैक्ट करता है हैलोजन. यह बेंजीन से इस मायने में भिन्न है कि यह और भी आसानी से प्रतिक्रिया करता है।
भौतिक गुण
घनत्व 1.14 ग्राम/सेमी³, गलनांक 80.26 डिग्री सेल्सियस, क्वथनांक 218 डिग्री सेल्सियस, पानी में घुलनशीलता लगभग 30 मिलीग्राम/लीटर, फ़्लैश बिंदु 79 - 87 डिग्री सेल्सियस, ऑटो-इग्निशन तापमान 525 डिग्री सेल्सियस, दाढ़ द्रव्यमान 128.17052 ग्राम/मोल।
रसीद
नेफ़थलीन किससे प्राप्त होता है? कोल तार. नेफ़थलीन को भारी पायरोलिसिस रेजिन (बुझाने वाला तेल) से भी अलग किया जा सकता है, जिसका उपयोग एथिलीन पौधों में पायरोलिसिस प्रक्रिया में किया जाता है।
दीमक नेफ़थलीन भी उत्पन्न करते हैं। कॉप्टोटर्मेस फॉर्मोसैनस अपने घोंसलों को बचाने के लिए चींटियों, कवक और नेमाटोड .
आवेदन
रासायनिक उद्योग का महत्वपूर्ण कच्चा माल: संश्लेषण के लिए उपयोग किया जाता है फ्थेलिक एनहाइड्राइड, टेट्रालीन, डिकलिन, विभिन्न नेफ़थलीन डेरिवेटिव।
नेफ़थलीन डेरिवेटिव का उपयोग उत्पादन के लिए किया जाता है रंगोंऔर विस्फोटक, वी दवा, कैसे कीटनाशक.