Gamtinių dujų degimo formulė. Gamtinių dujų. degimo procesas
A. S. Isserlinas
Degimo procesas yra pagrįstas cheminės reakcijos kuro ir oksidatoriaus derinys. Kad vyktų degimo procesas, turi būti sukurtos dujos specialios sąlygos. Pirmiausia į degiąsias dujas reikia įpilti pakankamą oksidatoriaus (dažniausiai oro) kiekį ir jas sumaišyti. Antra, dujų ir oro mišinys turi turėti koncentracijos ribos turi būti numatytas degumo ir užsiliepsnojimo šaltinis. Trečia, būtina sudaryti sąlygas vystytis degimo procesui, t.y., tam tikrą temperatūros lygį.
Maišymas (vienodas dujų maišymas su oru) yra vienas iš pagrindinių viso degimo proceso etapų. Visi tolesni etapai, per kuriuos kuras praeina cheminės energijos pavertimo šilumine energija metu, labai priklauso nuo mišinio susidarymo proceso. Kadangi degimo zonoje visada nustatomas aukštas temperatūros lygis, laikas, sugaištas cheminėms degimo reakcijoms, visada yra žymiai trumpesnis nei laikas, reikalingas mišinio susidarymo procesui.
Degimas dujinis kuras, kaip ir bet kuri kita, oro sraute, remiantis šiuolaikinėmis pažiūromis, tai įmanoma remiantis kinetikos ir difuzijos principais.
Bendras dujų degimo laikas, kuris lemia degimo greitį,
TP TS ~ 1" ~ X1
kur tc yra maišymo laikas, reikalingas dujoms sumaišyti su oksidatoriumi; tx – cheminių reakcijų laikas.
Jei ts<Стх, то практически тп«т*. В этом случае процесс протекает в кинетической области. Если же, наоборот, Тс^-Тх, то Тп»тс и, следовательно, процесс протекает в диффузионной области.
Kai degimo procesas vyksta kinetinėje srityje, degimo greitis priklauso nuo konkretaus degiojo mišinio savybių, reakcijos tūrio temperatūros ir reagentų koncentracijos degimo zonoje, t. y. reguliuoja chemijos dėsniai. kinetika. Tuo pačiu metu proceso greitis kinetinėje srityje nepriklauso nuo hidrodinaminių veiksnių, ty nuo srauto greičio, reakcijos kameros geometrinių matmenų ir kt.
Priešingai, difuzijos srityje proceso greitį lemia hidrodinaminiai veiksniai ir nepriklauso nuo kinetinių. Šiame regione degiojo mišinio savybės ir temperatūros faktorius nustoja vaidinti lemiamą vaidmenį. Santykinai paprastos hidrodinaminės priemonės gali turėti įtakos maišymo intensyvumui, todėl pasikeis difuzinės liepsnos charakteristikos.
Kinetiniu principu degiklyje iš anksto sukuriamas homogeninis dujų ir oro mišinys, kuris tiekiamas į degimo kamerą. Todėl tokio mišinio degimas vyksta esant pastoviai visų pagrindinių charakteristikų vertei (šilumos įtempiai, oro perteklius ir kt.). Grynai kinetinis degimas įvyksta tik esant sąlygai A^1.0. Kada<1 кинетическое горение протекает лишь на первой стадии, т. е. до тех пор, пока не израсходован весь кислород смеси. Остаток горючих компонентов, разбавленных продуктами сгорания, может быть сожжен только при условии подвода дополнительного окислителя (воздуха).
Degimo difuzijos principas reiškia, kad reikia sudaryti tokias sąlygas, kad procesas prasidėtų, kai mišinys išdegtų iš karto pačiam jo atsiradimo metu, t. y. kai kuras ir oksidatorius susiliečia atitinkamais kiekybiniais santykiais. Difuzinio degimo procesas kontroliuojamas keičiant mišinio susidarymo intensyvumą, keičiant degiklio konstrukciją ir veikimo parametrus. Dėl to, priklausomai nuo technologinių reikalavimų, galima pasiekti maišymo zonos sutrumpinimą arba jos pailgėjimą.
Praktikoje dažnai naudojamas dujų deginimas, derinant abu minėtus principus. Šiuo atveju dalis oro iš anksto sumaišoma su dujomis degiklyje, o likusi dalis, reikalinga visiškam degimui, tiekiama tiesiai į degimo zoną. Keičiant šį santykį galima įtakoti dujinio degiklio ilgį. Daugumoje degiklių dujos tiekiamos tam tikru kampu oro srautui.
Daug darbo skirta mišinio susidarymo procesui tirti. Tai leidžia mums suformuluoti keletą bendrų modelių.
Tiesioginio srauto dujų degikliams kuo geresnis maišymas, tuo didesnį degiklio skerspjūvį dengia dujų srovės, t.y., tuo didesnis dujų srautų diapazonas. Degikliuose su stipriai besisukančiomis srovėmis nereikėtų siekti didelio dujų purkštukų diapazono.
Padidėjus oro srauto posūkiui, dujos ir oras perskirsto degiklio skerspjūvį, padidėja dujų maišymosi su oru intensyvumas ir padidėja centrinė atvirkštinių srovių zona degiklyje.
Oro srauto posūkio įtakos mišinio susidarymo procesui pobūdis skiriasi priklausomai nuo kitų lemiančių parametrų. Taigi, kai dujos tiekiamos į periferines degiklio zonas (nepriklausomai nuo jo tipo), padidėjus srauto posūkiui pastebimai pagerėja mišinio susidarymas. Priešingai, kai dujos tiekiamos į centrinę degiklio zoną, posūkio padidėjimas, kaip taisyklė, nepagerina proceso, „sprendimas.
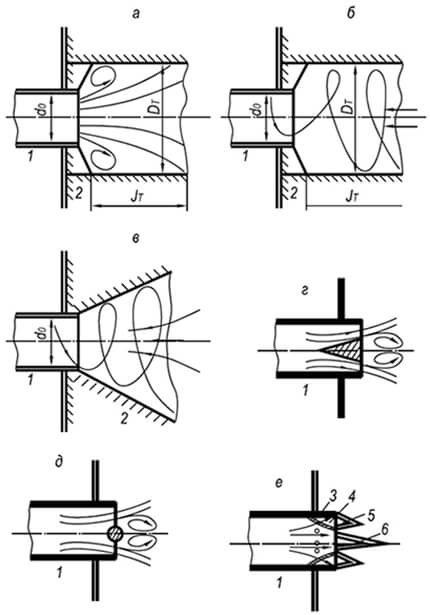
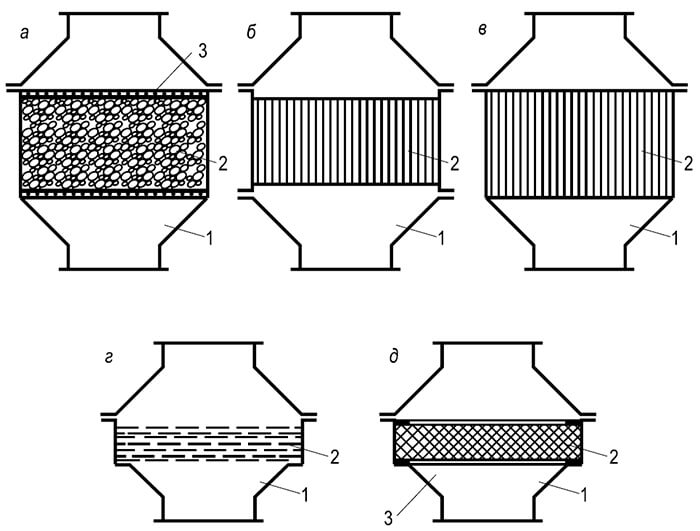
Reiškinių, kuriuos vadiname degimu, visuma gali vykti tik tam tikra seka, iš vienos stadijos į kitą. G. F. Knorre pateikia tokias pastovaus dujų ir skystojo kuro degimo su fiksuotu židiniu proceso schemas, kurias jis vadina in-line (1 pav.). Paprasčiausia srauto schema atsiranda degant dujiniam kurui, susidedančiam iš paprastų molekulių (pavyzdžiui, vandenilio), kurioms nereikia išankstinio kompleksinio pirogeninio skaidymo (1 pav., BET). Kai deginamas dujinis arba skystasis angliavandenilių kuras, A 6
Degimo srauto procesas yra sudėtingas: yra dar vienas tarpinis etapas - pirogeninis skilimas. Skystam kurui prieš šį etapą vyksta išgarinimo etapas (1.6 pav.). Srauto schemai įgyvendinti reikalingas pakankamas temperatūros lygis degimo kameroje, į kurią nuolatiniais srautais tiekiamas kuras ir oksidatorius. Degimo produktai pasibaigus reakcijoms taip pat nuolat šalinami iš degimo šaltinio.
Yra žinoma, kad dujų ir oro mišiniai užsidega tik tada, kai dujų kiekis ore yra tam tikrose (kiekvienoms dujoms) ribose. Esant mažam dujų kiekiui, degimo metu išsiskiriančios šilumos kiekio nepakanka, kad gretimi mišinio sluoksniai pasiektų užsidegimo temperatūrą. Tas pats pastebimas, kai dujų kiekis dujų ir oro mišinyje yra per didelis. Dėl deguonies trūkumo degimo ore sumažėja temperatūros lygis, dėl to gretimi mišinio sluoksniai neįkaista iki
Uždegimo temperatūros. Šie du atvejai atitinka apatinę ir viršutinę degumo ribas (1 lentelė). Todėl, be dujų maišymo su oru tam tikromis proporcijomis, reikia sukurti pradines sąlygas mišiniui užsidegti.
|
Lentelė / Įvairių ore esančių dujų degumo ribos ir užsiliepsnojimo temperatūros
|
Degiųjų dujų oksidacija galima esant žemai temperatūrai, tačiau tada ji vyksta labai lėtai dėl nereikšmingo reakcijų greičio. Kylant temperatūrai, oksidacijos reakcijos greitis didėja, kol įvyksta savaiminis užsidegimas (vietoj lėtos oksidacijos prasideda savaiminio užsidegimo procesas). Tai reiškia, kad iki užsidegimo temperatūros įkaitintas degusis mišinys turi tokią energiją, kuri ne tik kompensuoja šilumos nuostolius į aplinką, bet ir užtikrina šildymą bei į degimo zoną patenkančio dujų-oro mišinio paruošimą užsidegimui.
Dujų užsidegimo temperatūra priklauso nuo daugelio veiksnių, įskaitant degiųjų dujų kiekį dujų ir oro mišinyje, slėgį, mišinio kaitinimo būdą ir kt., todėl nėra tiksli reikšmė. Lentelėje. 1 parodyta kai kurių ore esančių degiųjų dujų užsidegimo temperatūra.
Praktikoje yra du degiųjų mišinių uždegimo būdai: savaiminis užsidegimas ir užsidegimas.
At Savaiminis užsidegimas visas degiųjų dujų ir oro mišinio tūris palaipsniui pakeliamas iki užsidegimo temperatūros, po kurios mišinys užsidega be išorinės šiluminės įtakos.
Technologijoje plačiai naudojamas antrasis metodas, vadinamas uždegimas. Taikant šį metodą, nebūtina kaitinti viso dujų ir oro mišinio iki užsidegimo temperatūros, užtenka šaltą mišinį viename tūrio taške uždegti kokiu nors aukštos temperatūros šaltiniu (kibirkštimi, karštu korpusu, liepsna, ir tt). Dėl to užsidegimas visam mišinio tūriui perduodamas spontaniškai plintant liepsnai, kuri vyksta ne akimirksniu, o tam tikru erdviniu greičiu. Šis greitis vadinamas Liepsnos plitimo greitis dujų ir oro mišinyje ir yra svarbiausia charakteristika, lemianti tekėjimo ir degimo stabilizavimo sąlygas. Degiklių stabilumas, kaip parodyta toliau, yra susijęs su liepsnos plitimo greičiu.
Taigi dujinio kuro degimo procesas susideda iš dujų maišymo su oru, gauto mišinio kaitinimo iki užsidegimo temperatūros, jo uždegimo ir degimo reakcijų, lydimų šilumos išsiskyrimo, atsiradimo. Be to, dujų maišymas su oru ir mišinio kaitinimas užtrunka daugiausia degimo proceso laiko, nes degimo reakcijos vyksta beveik akimirksniu.
Priklausomai nuo technologinio proceso (garo ir karšto vandens gavimas katilo bloke, produktų kaitinimas krosnies įrenginyje ir kt.), atsiranda būtinybė paveikti degimo procesą keičiant galutines jo charakteristikas. Tai pasiekiama įvairiomis konstruktyviomis technikomis, kurios aprašytos sk. III.
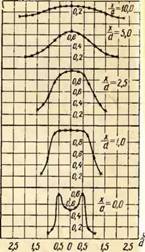
Orientacinėmis sąlygomis reikia palyginti degiklio tūrio temperatūros laukus degant dujoms su skirtingais oro pertekliaus koeficientais. Tokio palyginimo pavyzdys pateiktas fig. 2 degikliui, kurio išleidimo antgalio skersmuo 35 mm
|
|
Kur Ir- esama liepsnos temperatūros vertė, °C; tmax – maksimali temperatūra liepsnoje (išmatuota), °С; X- atstumas nuo matavimo taško iki degiklio pradžios, m; At- atstumas nuo matavimo taško iki degiklio ašies, m; Y- degiklio antgalio skersmuo, m.
Ant pav. 2 parodyta trijų oro pertekliaus koeficientų temperatūros pasiskirstymo grafikai. Be to, koordinatė X / m\u003d O atitinka degiklio antgalio išleidimo sekciją ir koordinatę y/m=0 - liepsnos ašis.
Kaip matyti iš paveikslo, temperatūros pasiskirstymas laisvoje liepsnoje yra netolygus. Esant nedideliam pirminio oro pertekliui, pavyzdžiui, a = 0,5, vidinės šerdies buvimas liepsnoje labai iškreipia temperatūros lauką ir jis išsilygina tik x / c / = 10 atstumu, o esant a = 0,75, išlyginimas įvyksta jau ties X / m=2,5, o esant a=1,0 dar anksčiau - at X/d = 1,0.
Aukščiausia atviros liepsnos temperatūra stebima pradinėse dalyse, esančiose atstumu nuo liepsnos ašies Taip / m \u003d 0,5, o tada degiklio centre. Be to, padidėjus oro pertekliaus koeficientui, maksimali temperatūra pasislenka į degiklio angą. Taigi aukščiausia temperatūra a = 0,75 buvo išmatuota atstumu X / m\u003d 2,5, o \u003d 1,0 - per atstumą X/d = 1,0.
 Vertinant temperatūrų ir CO2 koncentracijų pasiskirstymą stulpelyje kartu, maksimumai sutampa
Vertinant temperatūrų ir CO2 koncentracijų pasiskirstymą stulpelyje kartu, maksimumai sutampa
Temperatūra ir CO2 kiekis. Vadinasi, maksimalus temperatūros lygis degiklyje taip pat atitinka maksimalią degimo perdegimo laipsnio vertę.
Dalies šilumos, išsiskiriančios dėl dujų degimo, praradimas yra neišvengiamas. Tačiau juos galima sumažinti iki minimumo tinkamai valdant degimo procesą. Pasvarstykime, kurie. komponentai sudeda šiuos nuostolius.
Deginant dujinį kurą, atsiranda šie šilumos nuostoliai: su išmetamosiomis dujomis, nuo cheminio nepilno degimo ir į aplinką. Remiantis individualių šilumos nuostolių nustatymu atvirkštine pusiausvyra, galima apskaičiuoti įrenginio efektyvumą, ° / o:
Kur<72 - потери тепла с уходящими газами, %; - потери тепла
Nuo cheminio degimo neužbaigtumo, %; Q5- šilumos nuostoliai į aplinką, %.
Šilumos nuostoliai su išmetamosiomis dujomis- iš bloko išeinančių degimo produktų fizinė šiluma yra pagrindinė. Visiškai jų panaikinti neįmanoma, tačiau stengtis juos sumažinti būtina. Šilumos nuostoliai su išmetamosiomis dujomis priklauso nuo dujų temperatūros ir jų kiekio. Kuo žemesnė išmetamųjų dujų temperatūra, tuo mažiau šilumos bus prarasta, todėl reikėtų stengtis sumažinti išmetamųjų dujų temperatūrą protingomis ribomis. Išmetamųjų dujų temperatūros poveikis šilumos nuostoliams matomas iš lentelės. 2.
2 lentelė
|
Šilumos nuostoliai su išmetamosiomis dujomis deginant gamtines dujas, %
|
Šilumos nuostoliai su išmetamosiomis dujomis paprastai išreiškiami procentais nuo visos turimos šilumos, t.y. kuro degimo šilumos. Pavyzdžiui, jei deginant gamtines dujas šilumos nuostoliai yra 700 kcal/m3, tai
700-100 ___ „ 24°/
Iš įrenginio išeinančių dujų kiekis priklauso nuo degiklio ir siurbtukų oro pertekliaus santykio.
Oras per nesandarius įrenginyje. Kuo didesnis oro pertekliaus koeficientas degiklio išėjimo angoje ir oro įsiurbimas į įrenginį, tuo didesni šilumos nuostoliai su išmetamosiomis dujomis. Iš lentelės. 2 matyti, kad bendro oro pertekliaus koeficiento pokytis degimo produktuose nuo aa = 1,2-5-1,6 padidina šilumos nuostolius su išmetamosiomis dujomis nuo 10,5 iki 13,2% (esant pastoviai 240 ° C išmetamųjų dujų temperatūrai) .
Taigi, norint sumažinti šilumos nuostolius su išmetamosiomis dujomis, reikia degimo procesą vykdyti su mažiausiu leistinu oro pertekliaus koeficientu, užtikrinti didžiausią įrenginio tankį, pasiekti išmetamųjų dujų temperatūros sumažėjimą.
Šilumos nuostoliai dėl cheminio nepilno dujų degimo atsiranda, kai trūksta oro, blogai maišosi dujų degiklyje, staigiai sumažėja temperatūros lygis degimo zonoje. Dėl to dujų degimas vyksta nevisiškai, o degūs komponentai (pvz., vandenilis, anglies monoksidas ir kt.) pasišalina kartu su degimo produktais. Dėl to nepakankamai išnaudojama kuro cheminė energija ir sumažėja įrenginio efektyvumas. Net nedidelis degių komponentų kiekis degimo produktuose sukelia didelius šilumos nuostolius dėl cheminio nepilno degimo. Tarkime, kad degimo produktuose buvo 0,7% vandenilio ir 0,5% anglies monoksido. Gamtinės dujos buvo deginamos bloke su oro pertekliaus koeficientu pasroviui nuo įrenginio a» = 1,5. Šilumos nuostoliai dėl cheminio degimo neužbaigtumo siekė ~450 kcal/m3 arba
A___ 450-100 poo/
Taigi iš nagrinėjamo pavyzdžio matyti, kad degių komponentų degimo produktuose neturėtų būti arba jų turėtų būti minimaliai.
Šilumos nuostoliai į aplinką atsiranda dėl to, kad įrenginio sienose temperatūra yra aukštesnė nei aplinkiniame ore. Šių nuostolių dydis daugiausia priklauso nuo temperatūros skirtumo tarp įrenginio išorinių sienelių ir aplinkinio oro, sienos paviršiaus dydžio, mūro medžiagos šilumos laidumo ir jos storio. Nuostoliai aplinkai skaičiuojami teoriškai arba paimami iš šiluminio skaičiavimo normų, priklausomai nuo įrenginio konstrukcijos ir eksploatacinių savybių.
Susumavus visus šilumos nuostolius, kurie atsiranda degant dujoms įrenginyje, ir atėmus juos iš 100, gauname įrenginio efektyvumą. Pavyzdžiui, naudojant aukščiau pateiktus skaičius, darant prielaidą<75 равным 3,60%, тогда к. п. д. агрегата
T]= 100-(8,24+5,28+3,60)=82,88 %*
8.1. DEGIMO REAKCIJOS
Degimas yra greita cheminė reakcija, kai degiosios sudedamosios dalys sujungiamos su deguonimi, kartu su intensyviu šilumos išsiskyrimu ir staigiu degimo produktų temperatūros padidėjimu. Degimo reakcijos apibūdinamos vadinamaisiais. stechiometrinės lygtys, kurios kokybiškai ir kiekybiškai apibūdina medžiagas, patenkančias į reakciją ir atsirandančias po jos (Degiojo mišinio stechiometrinė sudėtis (iš graikų kalbos stoicheion – bazė, elementas ir graikiško metreo – I matas) – mišinio sudėtis, kurioje oksidatoriaus yra tiksliai tiek, kiek reikia visiškam degalų oksidavimui. ). Bendroji bet kurio angliavandenilio degimo reakcijos lygtis
C m H n + (m + n/4) O 2 = mCO 2 + (n/2) H 2 O + Q (8.1)
čia m, n yra anglies ir vandenilio atomų skaičius molekulėje; Q yra reakcijos terminis efektas arba degimo šiluma.
Kai kurių dujų degimo reakcijos pateiktos lentelėje. 8.1. Šios lygtys yra pusiausvyra, ir iš jų neįmanoma spręsti nei apie reakcijų greitį, nei apie cheminių virsmų mechanizmą.
8.1 lentelė. Degimo reakcijos ir sausų dujų kaloringumas (esant 0°С ir 101,3 kPa)
| Dujos | Degimo reakcija | Degimo šiluma | |||||
|---|---|---|---|---|---|---|---|
| Molinis, kJ/kmol | Masė, kJ/kg | Tūrinis, kJ/m3 | |||||
| aukštesnė | prastesnis | aukštesnė | prastesnis | aukštesnė | prastesnis | ||
| Vandenilis | H 2 + 0,5O 2 \u003d H 2 0 | 286,06 | 242,90 | 141 900 | 120 080 | 12 750 | 10 790 |
| smalkės | CO + 0,5O 2 \u003d CO 2 | 283,17 | 283,17 | 10 090 | 10 090 | 12 640 | 12 640 |
| Metanas | CH 4 + 2O 2 \u003d CO 2 + 2H 2 O | 880,90 | 800,90 | 55 546 | 49 933 | 39 820 | 35 880 |
| Etanas | C 2 H 6 + 0,5 O 2 \u003d 2CO 2 + 3H 2 O | 1560,90 | 1425,70 | 52 019 | 47 415 | 70 310 | 64 360 |
| Propanas | C 3 H 8 + 5H 2 O \u003d 3CO 2 + 4H 2 O | 2221,40 | 2041,40 | 50 385 | 46 302 | 101 210 | 93 180 |
| n-butanas | 2880,40 | 2655,00 | 51 344 | 47 327 | 133 800 | 123 570 | |
| Izobutanas | C 4 H 10 + 6,5 O 2 \u003d 4CO 2 + 5H 2 O | 2873,50 | 2648,30 | 51 222 | 47 208 | 132 960 | 122 780 |
| n-pentanas | C 5 H 12 + 8O 2 \u003d 5CO 2 + 6H 2 O | 3539,10 | 3274,40 | 49 052 | 45 383 | 169 270 | 156 630 |
| Etilenas | C 2 H 4 + 3O 2 \u003d 2CO 2 + 2H 2 O | 1412,00 | 1333,50 | 50 341 | 47 540 | 63 039 | 59 532 |
| Propilenas | C 3 H 6 + 4,5 O 2 \u003d 3CO 2 + 3H 2 O | 2059,50 | 1937,40 | 48 944 | 46 042 | 91 945 | 88 493 |
| Butilenas | C 4 H 8 + 6O 2 \u003d 4CO 2 + 4H 2 O | 2720,00 | 2549,70 | 48 487 | 45 450 | 121 434 | 113 830 |
Šiluminis efektas (kaloringumas) Q - šilumos kiekis, išsiskiriantis visiškai sudegus 1 kmolei, 1 kg arba 1 m 3 dujų normaliomis fizinėmis sąlygomis. Yra didesnis Q in ir mažesnis Q n kaloringumas: į didesnę šiluminę vertę įeina vandens garų kondensacijos šiluma degimo metu (realiai degant dujoms vandens garai nesikondensuoja, o pašalinami kartu su kitais degimo produktais). . Paprastai techniniai skaičiavimai dažniausiai atliekami pagal mažesnę kaloringumo vertę, neatsižvelgiant į vandens garų kondensacijos šilumą (≈2400 kJ / kg).
Pagal mažesnį šilumingumą skaičiuojamas efektyvumas formaliai didesnis, tačiau vandens garų kondensacijos šiluma gana didelė, o jos panaudojimas daugiau nei pagrįstas. Tai patvirtina ir aktyvus kontaktinių šilumokaičių naudojimas šildymo technologijoje, kurių dizainas yra labai įvairus.
Degiųjų dujų mišinio didesnė (ir mažesnė) dujų šilumingumas nustatomas pagal santykį
Q = r 1 Q 1 + r 2 Q 2 + ... + r n Q n (8.2)
čia r 1 , r 2 , ..., r n - mišinyje esančių komponentų tūrinės (molinės, masės) dalys; Q 1 , Q 2 , …, Q n - komponentų kaloringumas.
Naudojant lentelę. 8.1, sudėtingų dujų aukštesnę ir mažesnę kaloringumo vertę, kJ / m 3, galima nustatyti pagal šias formules:
Q = 127,5 H2 + 126,4 CO + 398 CH 4 + 703 C 2 H 6 + 1012 C 8 H 8 + 1 338 C 4 H 10 + 1 329 C 4 H 10 +
+ 1693 C 5 H 12 + 630 C 2 H 4 + 919 C 3 H 6 + 1214 C 4 H 8 (8.3)
Q n = 107,9 H2 + 126,4 CO + 358,8 CH4 + 643 C 2 H6 + 931,8 C 8 H 8 + 1235 C 4 H 10 + 1227 C 4 H 10 +
+ 1566 C 5 H 12 + 595 C 2 H 4 + 884 C 8 H 6 + 1138 C 4 H 8 (8,4)
kur H2, CO, CH4 ir kt. - atskirų komponentų kiekis dujiniame kure, t. %.
Degimo procesas yra daug sudėtingesnis nei pagal (8.1) formulę, nes kartu su grandinių išsišakojimu jos nutrūksta dėl to, kad susidaro tarpiniai stabilūs junginiai, kurie aukštoje temperatūroje toliau virsta. Esant pakankamai deguonies koncentracijai, susidaro galutiniai produktai: vandens garai H 2 O ir anglies dioksidas CO 2. Trūkstant oksiduojančio agento, taip pat kai reakcijos zona atvėsinama, tarpiniai junginiai gali stabilizuotis ir patekti į aplinką.
Šilumos išsiskyrimo intensyvumas ir temperatūros kilimas lemia aktyvių dalelių padidėjimą reaguojančioje sistemoje. Toks grandininės reakcijos ir temperatūros ryšys, būdingas beveik visiems degimo procesams, lėmė grandininio-terminio sprogimo sąvokos įvedimą – pačios degimo cheminės reakcijos yra grandininio pobūdžio, o jų pagreitis atsiranda dėl šilumos išsiskyrimas ir temperatūros padidėjimas reaguojančioje sistemoje.
Cheminės reakcijos greitis vienalyčiame mišinyje yra proporcingas reaguojančių medžiagų koncentracijų sandaugai:
w = kС 1 С 2 (8,5)
čia C 1 ir C 2 yra reaguojančių komponentų koncentracijos, kmol/m 3; k - reakcijos greičio konstanta, priklausomai nuo reagentų pobūdžio ir temperatūros.
Kai deginamos dujos, reagentų koncentracijas sąlygiškai galima laikyti nepakitusiomis, nes degimo zonoje vyksta nuolatinis vienos vertės kompozicijos šviežių komponentų antplūdis.
Reakcijos greičio konstanta (pagal Arrhenius lygtį):
K \u003d K 0 e -E / RT (8,6)
kur K 0 – biometrinių vienalyčių mišinių priešeksponentinis koeficientas, ≈1,0; E - aktyvacijos energija, kJ/kmol; R yra universali dujų konstanta, J/(kg K); T - absoliuti temperatūra, K (°C); e yra natūraliųjų logaritmų pagrindas.
Preeksponentinis koeficientas K 0 gali būti interpretuojamas kaip konstanta, atspindinti molekulių susidūrimo užbaigtumą, o E - kaip minimali energija, skirta molekulių ryšiams nutraukti ir aktyvioms dalelėms, kurios užtikrina susidūrimų efektyvumą, susidaryti. Įprastiems degiems mišiniams jis yra (80÷150) 10 3 kJ/kmol.
(8.6) lygtis rodo, kad didėjant temperatūrai cheminių reakcijų greitis smarkiai didėja: pavyzdžiui, temperatūrai pakilus nuo 500 iki 1000 K, degimo reakcijos greitis padidėja 2 10 4 ÷5 10 8 kartų (priklausomai nuo aktyvavimo energijos).
Degimo reakcijų greitį įtakoja jų grandininis pobūdis. Iš pradžių reakcijos metu susidarę atomai ir radikalai sudaro junginius su pradinėmis medžiagomis ir tarpusavyje, sudarydami galutinius produktus ir naujas daleles, kurios kartoja tą pačią reakcijų grandinę. Didėjantis tokių dalelių susidarymas lemia cheminių reakcijų „pagreitėjimą“ – iš tikrųjų viso mišinio sprogimą.
Angliavandenilių degimas aukštoje temperatūroje yra sudėtingas ir susijęs su aktyvių dalelių atomų ir radikalų, taip pat tarpinių molekulinių junginių susidarymu. Pavyzdžiui, pateikiamos paprasčiausio angliavandenilio - metano degimo reakcijos:
- H + O 2 -› OH + O
CH4 + OH -› CH3 + H2O
CH4 + O -› CH2 + H2O - CH 3 + O 2 -› HCNO + OH
CH 2 + O 2 -› HCHO + O - HCHO + OH -› HCO + H 2 O
HCNO + O -› CO + H 2 O
HCO + O 2 -› CO + O + OH - CO + O -› CO 2
CO + OH -› CO 2 + H
Vieno ciklo rezultatas:
2CH4 + 4O2 -› 2CO2 + 4H2O
8.2. DEGIMO SKAIČIAVIMAI
Deguonis degimui yra jo sudedamoji dalis. Skaičiuojant daroma prielaida, kad sauso oro tūrinė sudėtis yra tokia:
deguonies - 21,0%, azoto - 79,0%.
Remiantis pateikta informacija, 1 m 3 deguonies yra 100/21 = 4,76 m 3 oro arba 79/21 = 3,76 m 3 azoto 1 m 3 deguonies. Atsižvelgiant į tai, kad 1 kmol dujų normaliomis sąlygomis užima 22,4 litro tūrį, bet kurio angliavandenilio ore degimo reakciją (žr. 8.1 lygtį) galima parašyti apibendrinta forma:
C m H n + (t + n/4) (O 2 + 3,76 N 2) = tCO 2 + (n/2) H 2 O + (t + n/4) 3,76 N 2
Deguonies ir oro reikalavimai degant įvairioms dujoms, apskaičiuoti pagal nurodytas degimo reakcijas, pateikti lentelėje. 8.2.
8.2 lentelė. Teorinis sauso deguonies ir oro poreikis m 3 ir dujų degimo produktų tūris deginant 1 m 3 dujų
| Dujos | Teorinis poreikis | degimo produktai | ||||
|---|---|---|---|---|---|---|
| deguonies | oro | anglies dvideginis | vandens garai | azoto | Iš viso | |
| Vandenilis H2 | 0,5 | 2,38 | – | 1,0 | 1,88 | 2,88 |
| Anglies monoksidas CO | 0,5 | 2,38 | 1,0 | – | 1,88 | 2,88 |
| Metanas CH 4 | 2,0 | 9,52 | 1,0 | 2,0 | 7,52 | 10,52 |
| Etanas C 2 H 6 | 3,5 | 16,66 | 2,0 | 3,0 | 13,16 | 18,16 |
| Propanas C 3 H 8 | 5,0 | 23,80 | 3,0 | 4,0 | 18,80 | 25,80 |
| Butanas C 4 H 10 | 6,5 | 30,94 | 4,0 | 5,0 | 24,44 | 33,44 |
| Pentanas C 5 H 12 | 8,0 | 38,08 | 5,0 | 6,0 | 30,08 | 41,08 |
| Etilenas C 2 H 4 | 3,0 | 14,28 | 2,0 | 2,0 | 11,28 | 15,28 |
| Propilenas C 3 H 6 | 4,5 | 21,42 | 3,0 | 3,0 | 16,92 | 22,92 |
| Butilenas C 4 H 8 | 6,0 | 28,56 | 4,0 | 4,0 | 22,56 | 30,56 |
| Pentilenas C 5 H 10 | 7,5 | 35,70 | 5,0 | 5,0 | 28,20 | 38,20 |
| Acetilenas C 2 H 2 | 2,5 | 11,90 | 2,0 | 1,0 | 9,40 | 12,40 |
Sudėtingoms dujoms sauso oro suvartojimas V c, m 3 / m 3, apskaičiuojamas pagal formulę, kurioje atsižvelgiama į atskirų mišinio komponentų deguonies poreikį:
Vc = 4,76 / 100 (0,5H2 + 0,5CO + 2CH4 + 3,5C2H6 + 5C3H8 + 6,5C 4H10 + 3C2H4 + 4,5C3H6 +6C4H8 -O 2) (8,7)
Teorinis drėgno oro srautas V vl, m 3 / m 3, labiau nustatomas pagal (8.7) formulę pagal jame esančių vandens garų tūrį:
V ow \u003d V s + 0,001244d V s (8,8)
kur d - oro drėgnumas, g / m 3.
Kai dujų cheminė sudėtis nežinoma, bet žinoma žemesnė šilumingumas Q n, kJ / m 3, teorinis oro suvartojimas V t, m 3 / m 3,
Vt ≈ Q n / 3770 (8,9)
Tikrasis oro suvartojimas V dv, m 3 / m 3, visada yra šiek tiek didesnis:
V variklis \u003d V t α (8.10)
kur α yra oro pertekliaus koeficientas, atitinkantis GOST reikalavimus. Visiškam kurui sudeginti α reikšmė turi būti didesnė nei 1. Degimo produktų sudėtis ir tūris, apskaičiuoti pagal kai kurių dujų degimo reakcijas sausame ore, pateikti lentelėje. 8.2.
8.3. DEGIMO TEMPERATŪRA
Šilumos inžinerijoje išskiriamos šios dujų degimo temperatūros: šiluminė, kalorimetrinė, teorinė ir faktinė (skaičiuojamoji). Šildymo galia t w - maksimali visiško dujų degimo produktų temperatūra adiabatinėmis sąlygomis, kai oro pertekliaus koeficientas α = 1,0, o dujų ir oro temperatūra lygi 0 ° C:
t W = Q n /(∑Vc p)(8.11)
kur Q n - mažesnis dujų kaloringumas, kJ / m 3; ∑ Vc p - anglies dioksido, vandens garų ir azoto tūrių, susidarančių deginant 1 m 3 dujų (m 3 / m 3 ), ir jų vidutinių tūrinių šiluminių pajėgumų, esant pastoviam slėgiui, esant temperatūrai nuo 0, suma. ° C iki t w (kJ / (m 3 o ° C).
Dėl dujų šiluminės talpos kintamumo šiluminė galia nustatoma nuoseklių aproksimacijų metodu. Pradiniu parametru imama jo reikšmė gamtinėms dujoms (≈2000°C), o esant α = 1,0, nustatomi degimo produktų komponentų tūriai pagal lentelę. 8.3 randama jų vidutinė šiluminė galia ir tada pagal (8.11) formulę apskaičiuojama dujų šiluminė galia. Jei dėl skaičiavimo paaiškėja, kad ji yra mažesnė arba didesnė už priimtą, tada nustatoma kita temperatūra ir skaičiavimas kartojamas.
8.3 lentelė. Vidutinė tūrinė dujų šiluminė talpa, kJ / (m 3 ° С)
Temperatūra, °C |
CO2 | N 2 | O2 | CO | CH 4 | H2 | H 2 O (vandens garai) | oro | |
|---|---|---|---|---|---|---|---|---|---|
| sausas | šlapias 1 m 3 sausos dujos |
||||||||
| 0 | 1,5981 | 1,2970 | 1,3087 | 1,3062 | 1,5708 | 1,2852 | 1,4990 | 1,2991 | 1,3230 |
| 100 | 1,7186 | 1,2991 | 1,3209 | 1,3062 | 1,6590 | 1,2978 | 1,5103 | 1,3045 | 1,3285 |
| 200 | 1,8018 | 1,3045 | 1,3398 | 1,3146 | 1,7724 | 1,3020 | 1,5267 | 1,3142 | 1,3360 |
| 300 | 1,8770 | 1,3112 | 1,3608 | 1,3230 | 1,8984 | 1,3062 | 1,5473 | 1,3217 | 1,3465 |
| 400 | 1,9858 | 1,3213 | 1,3822 | 1,3356 | 2,0286 | 1,3104 | 1,5704 | 1,3335 | 1,3587 |
| 500 | 2,0030 | 1,3327 | 1,4024 | 1,3482 | 2,1504 | 1,3104 | 1,5943 | 1,3469 | 1,3787 |
| 600 | 2,0559 | 1,3453 | 1,4217 | 1,3650 | 2,2764 | 1,3146 | 1,6195 | 1,3612 | 1,3873 |
| 700 | 2,1034 | 1,3587 | 1,3549 | 1,3776 | 2,3898 | 1,3188 | 1,6464 | 1,3755 | 1,4020 |
| 800 | 2,1462 | 1,3717 | 1,4549 | 1,3944 | 2,5032 | 1,3230 | 1,6737 | 1,3889 | 1,4158 |
| 900 | 2,1857 | 1,3857 | 1,4692 | 1,4070 | 2,6040 | 1,3314 | 1,7010 | 1,4020 | 1,4293 |
| 1000 | 2,2210 | 1,3965 | 1,4822 | 1,4196 | 2,7048 | 1,3356 | 1,7283 | 1,4141 | 1,4419 |
| 1100 | 2,2525 | 1,4087 | 1,4902 | 1,4322 | 2,7930 | 1,3398 | 1,7556 | 1,4263 | 1,4545 |
| 1200 | 2,2819 | 1,4196 | 1,5063 | 1,4448 | 2,8812 | 1,3482 | 1,7825 | 1,4372 | 1,4658 |
| 1300 | 2,3079 | 1,4305 | 1,5154 | 1,4532 | – | 1,3566 | 1,8085 | 1,4482 | 1,4771 |
| 1400 | 2,3323 | 1,4406 | 1,5250 | 1,4658 | – | 1,3650 | 1,8341 | 1,4582 | 1,4876 |
| 1500 | 2,3545 | 1,4503 | 1,5343 | 1,4742 | – | 1,3818 | 1,8585 | 1,4675 | 1,4973 |
| 1600 | 2,3751 | 1,4587 | 1,5427 | – | – | – | 1,8824 | 1,4763 | 1,5065 |
| 1700 | 2,3944 | 1,4671 | 1,5511 | – | – | – | 1,9055 | 1,4843 | 1,5149 |
| 1800 | 2,4125 | 1,4746 | 1,5590 | – | – | – | 1,9278 | 1,4918 | 1,5225 |
| 1900 | 2,4289 | 1,4822 | 1,5666 | – | – | – | 1,9698 | 1,4994 | 1,5305 |
| 2000 | 2,4494 | 1,4889 | 1,5737 | 1,5078 | – | – | 1,9694 | 1,5376 | 1,5376 |
| 2100 | 2,4591 | 1,4952 | 1,5809 | – | – | – | 1,9891 | – | – |
| 2200 | 2,4725 | 1,5011 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2300 | 2,4860 | 1,5070 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2400 | 2,4977 | 1,5166 | 1,6002 | – | – | – | 2,0389 | – | – |
| 2500 | 2,5091 | 1,5175 | 1,6045 | – | – | – | 2,0593 | – | – |
Įprastų paprastų ir sudėtingų dujų šilumos išeiga joms degant sausame ore pateikta lentelėje. 8.4. Kai dujos deginamos atmosferos ore, kuriame yra apie 1 masės %. % drėgmės, šiluminė galia sumažėja 25-30°C.
8.4 lentelė. Dujų šilumos išsiskyrimas sausame ore
| paprastos dujos | Šilumos galia, °С | Sudėtinės dujos vidutinė sudėtis |
Apytikslis šilumos išeiga, °C |
|---|---|---|---|
| Vandenilis | 2235 | gamtinių dujų telkinių |
2040 |
| smalkės | 2370 | natūralūs naftos telkiniai |
2080 |
| Metanas | 2043 | Koksas |
2120 |
| Etanas | 2097 | Aukštos temperatūros skalūnų distiliavimas |
1980 |
| Propanas | 2110 | Garų-deguonies pūtimas esant slėgiui |
2050 |
| Butanas | 2118 | Generatorius iš riebių anglių |
1750 |
| Pentanas | 2119 | Generatoriaus garo-oro pūtimas iš lieso kuro |
1670 |
| Etilenas | 2284 | Suskystintas (50 % C 3 H 4 + 50 % C 4 H 10) |
2115 |
| Acetilenas | 2620 | 2210 |
Kalorimetrinė degimo temperatūra t iki – temperatūra, nustatyta neatsižvelgiant į vandens garų ir anglies dioksido disociaciją, bet atsižvelgiant į faktinę pradinę dujų ir oro temperatūrą. Nuo šiluminės galios t skiriasi tuo, kad dujų ir oro temperatūra bei oro pertekliaus koeficientas α imamas pagal jų faktines reikšmes. Galite nustatyti t k pagal formulę:
t k \u003d (Q n + q fizinis) / (ΣVc p) (8.12)
kur q fizinis – dujų ir oro šilumos kiekis (fizinė šiluma), matuojamas nuo 0 °C, kJ/m3.
Natūralios ir suskystintos angliavandenilių dujos prieš deginimą dažniausiai nekaitinamos, o jų tūris yra mažas, palyginti su degimo oro tūriu. Todėl nustatant kalorimetrinę temperatūrą galima nepaisyti dujų šilumos kiekio. Kai deginamos mažo šilumingumo dujos (generatorius, aukštakrosnė ir kt.), jų šilumos kiekis (ypač pakaitintų iki degimo) turi labai didelę įtaką kalorimetrinei temperatūrai.
Vidutinės sudėties gamtinių dujų kalorimetrinės temperatūros ore, kurio temperatūra 0°C ir drėgnumas 1 %, priklausomybė nuo oro pertekliaus koeficiento α pateikta lentelėje. 8.5, suskystintoms angliavandenilių dujoms, kai jos deginamos sausame ore – lentelėje. 8.7. Lentelės duomenys. 8.5–8.7, galima pakankamai tiksliai nustatyti kalorimetrinę kitų gamtinių dujų, santykinai panašios sudėties, ir beveik bet kokios sudėties angliavandenilių dujų degimo temperatūrą. Jei reikia gauti aukštą temperatūrą deginant dujas su mažu oro pertekliaus koeficientu, taip pat padidinti krosnių efektyvumą, praktikoje jos šildo orą, todėl padidėja kalorimetrinė temperatūra (žr. 8.6 lentelę).
8.5 lentelė. Kalorimetrinė ir teorinė gamtinių dujų degimo temperatūra ore, kai t = 0°C ir 1% drėgmė, priklausomai nuo oro pertekliaus koeficiento α
| Teorinė degimo temperatūra t t, ° С | Oro pertekliaus koeficientas α | Kalorimetrinė degimo temperatūra t k, °С | ||
|---|---|---|---|---|
| 1,0 | 2010 | 1920 | 1,33 | 1620 |
| 1,02 | 1990 | 1900 | 1,36 | 1600 |
| 1,03 | 1970 | 1880 | 1,40 | 1570 |
| 1,05 | 1940 | 1870 | 1,43 | 1540 |
| 1,06 | 1920 | 1860 | 1,46 | 1510 |
| 1,08 | 1900 | 1850 | 1,50 | 1470 |
| 1,10 | 1880 | 1840 | 1,53 | 1440 |
| 1,12 | 1850 | 1820 | 1,57 | 1410 |
| 1,14 | 1820 | 1790 | 1,61 | 1380 |
| 1,16 | 1800 | 1770 | 1,66 | 1350 |
| 1,18 | 1780 | 1760 | 1,71 | 1320 |
| 1,20 | 1760 | 1750 | 1,76 | 1290 |
| 1,22 | 1730 | – | 1,82 | 1260 |
| 1,25 | 1700 | – | 1,87 | 1230 |
| 1,28 | 1670 | – | 1,94 | 1200 |
| 1,30 | 1650 | – | 2,00 | 1170 |
8.6 lentelė. Kalorimetrinė gamtinių dujų degimo temperatūra t k, ° С, priklausomai nuo sauso oro pertekliaus koeficiento ir jo temperatūros (suapvalintos reikšmės)
| Oro pertekliaus koeficientas α | Sauso oro temperatūra, °C | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| 0,5 | 1380 | 1430 | 1500 | 1545 | 1680 | 1680 | 1740 | 1810 | 1860 |
| 0,6 | 1610 | 1650 | 1715 | 1780 | 1840 | 1900 | 1960 | 2015 | 2150 |
| 0,7 | 1730 | 1780 | 1840 | 1915 | 1970 | 2040 | 2100 | 2200 | 2250 |
| 0,8 | 1880 | 1940 | 2010 | 2060 | 2130 | 2200 | 2260 | 2330 | 2390 |
| 0,9 | 1980 | 2030 | 2090 | 2150 | 2220 | 2290 | 2360 | 2420 | 2500 |
| 1,0 | 2050 | 2120 | 2200 | 2250 | 2320 | 2385 | 2450 | 2510 | 2560 |
| 1,2 | 1810 | 1860 | 1930 | 2000 | 2070 | 2140 | 2200 | 2280 | 2350 |
| 1,4 | 1610 | 1660 | 1740 | 1800 | 2870 | 1950 | 2030 | 2100 | 2160 |
| 1,6 | 1450 | 1510 | 1560 | 1640 | 1730 | 1800 | 1860 | 1950 | 2030 |
| 1,8 | 1320 | 1370 | 1460 | 1520 | 1590 | 1670 | 1740 | 1830 | 1920 |
| 2,0 | 1220 | 1270 | 1360 | 1420 | 1490 | 1570 | 1640 | 1720 | 1820 |
8.7 lentelė. Kalorimetrinė degimo temperatūra t iki techninio propano sausame ore, kai t = 0°C, priklausomai nuo oro pertekliaus koeficiento α
| Oro pertekliaus koeficientas α | Kalorimetrinė degimo temperatūra t k, °С | Oro pertekliaus koeficientas α | Kalorimetrinė degimo temperatūra t k, °С |
|---|---|---|---|
| 1,0 | 2110 | 1,45 | 1580 |
| 1,02 | 2080 | 1,48 | 1560 |
| 1,04 | 2050 | 1,50 | 1540 |
| 1,05 | 2030 | 1,55 | 1500 |
| 1,07 | 2010 | 1,60 | 1470 |
| 1,10 | 1970 | 1,65 | 1430 |
| 1,12 | 1950 | 1,70 | 1390 |
| 1,15 | 1910 | 1,75 | 1360 |
| 1,20 | 1840 | 1,80 | 1340 |
| 1,25 | 1780 | 1,85 | 1300 |
| 1,27 | 1750 | 1,90 | 1270 |
| 1,30 | 1730 | 1,95 | 1240 |
| 1,35 | 1670 | 2,00 | 1210 |
| 1,40 | 1630 | 2,10 | 1170 |
Teorinė degimo temperatūra t T - maksimali temperatūra, nustatyta panašiai kaip kalorimetrinė t k, bet pritaikyta endoterminėms (reikalaujančioms šilumos) anglies dioksido ir vandens garų disociacijos reakcijoms, vykstančioms padidėjus tūriui:
CO 2 ‹–› CO + 0,5O 2 - 283 mJ / mol (8,13)
H 2 O ‹–› H 2 + 0,5O 2 - 242 mJ / mol (8,14)
Esant aukštai temperatūrai, disociacija gali sukelti atominių vandenilio, deguonies ir OH hidroksilo grupių susidarymą. Be to, deginant dujas visada susidaro šiek tiek azoto oksido. Visos šios reakcijos yra endoterminės ir dėl to sumažėja degimo temperatūra.
Teorinę degimo temperatūrą galima nustatyti pagal šią formulę:
t T \u003d (Q n + q fizinis - q dis) / (ΣVc p) (8.15)
kur q dis - bendra šilumos kaina CO 2 ir H 2 O disociacijai degimo produktuose, kJ / m 3; ΣVc p – degimo produktų tūrio ir vidutinės šiluminės talpos sandaugos suma, atsižvelgiant į disociaciją 1 m 3 dujų.
8.8 lentelė. Vandens garų H 2 O ir anglies dioksido CO 2 disociacijos laipsnis priklausomai nuo dalinio slėgio
| Temperatūra, °C | Dalinis slėgis, MPa | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,004 | 0,006 | 0,008 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,025 | 0,030 | 0,040 | |
| Vandens garai H2O | ||||||||||||
| 1600 | 0,85 | 0,75 | 0,65 | 0,60 | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,42 |
| 1700 | 1,45 | 1,27 | 1,16 | 1,08 | 1,02 | 0,95 | 0,90 | 0,85 | 0,8 | 0,76 | 0,73 | 0,67 |
| 1800 | 2,40 | 2,10 | 1,90 | 1,80 | 1,70 | 1,60 | 1,53 | 1,46 | 1,40 | 1,30 | 1,25 | 1,15 |
| 1900 | 4,05 | 3,60 | 3,25 | 3,0 | 2,85 | 2,70 | 2,65 | 2,50 | 2,40 | 2,20 | 2,10 | 1,9 |
| 2000 | 5,75 | 5,05 | 4,60 | 4,30 | 4,0 | 3,80 | 3,55 | 3,50 | 3,40 | 3,15 | 2,95 | 2,65 |
| 2100 | 8,55 | 7,50 | 6,80 | 6,35 | 6,0 | 5,70 | 5,45 | 5,25 | 5,10 | 4,80 | 4,55 | 4,10 |
| 2200 | 12,3 | 10,8 | 9,90 | 9,90 | 8,80 | 8,35 | 7,95 | 7,65 | 7,40 | 6,90 | 6,50 | 5,90 |
| 2300 | 16,0 | 15,0 | 13,7 | 12,9 | 12,2 | 11,6 | 11,1 | 10,7 | 10,4 | 9,6 | 9,1 | 8,4 |
| 2400 | 22,5 | 20,0 | 18,4 | 17,2 | 16,3 | 15,6 | 15,0 | 14,4 | 13,9 | 13,0 | 12,2 | 11,2 |
| 2500 | 28,5 | 25,6 | 23,5 | 22,1 | 20,9 | 20,0 | 19,3 | 18,6 | 18,0 | 16,8 | 15,9 | 14,6 |
| 3000 | 70,6 | 66,7 | 63,8 | 61,6 | 59,6 | 58,0 | 56,5 | 55,4 | 54,3 | 51,9 | 50,0 | 47,0 |
| Anglies dioksidas CO2 | ||||||||||||
| 1500 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | – |
| 1600 | 2,0 | 1,8 | 1,6 | 1,5 | 1,45 | 1,4 | 1,35 | 1,3 | 1,25 | 1,2 | 1,1 | |
| 1700 | 3,8 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,4 | 2,3 | 2,2 | 2,0 | 1,9 | |
| 1800 | 6,3 | 5,5 | 5,0 | 4,6 | 4,4 | 4,2 | 4,0 | 3,8 | 3,7 | 3,5 | 3,3 | |
| 1900 | 10,1 | 8,9 | 8,1 | 7,6 | 7,2 | 6,8 | 6,5 | 6,3 | 6,1 | 5,6 | 5,3 | |
| 2000 | 16,5 | 14,6 | 13,4 | 12,5 | 11,8 | 11,2 | 10,8 | 10,4 | 10,0 | 9,4 | 8,8 | |
| 2100 | 23,9 | 21,3 | 19,6 | 18,3 | 17,3 | 16,5 | 15,9 | 15,3 | 14,9 | 13,9 | 13,1 | |
| 2200 | 35,1 | 31,5 | 29,2 | 27,5 | 26,1 | 25,0 | 24,1 | 23,3 | 22,6 | 21,2 | 20,1 | |
| 2300 | 44,7 | 40,7 | 37,9 | 35,9 | 34,3 | 32,9 | 31,8 | 30,9 | 30,0 | 28,2 | 26,9 | |
| 2400 | 56,0 | 51,8 | 48,8 | 46,5 | 44,6 | 43,1 | 41,8 | 40,6 | 39,6 | 37,5 | 35,8 | |
| 2500 | 66,3 | 62,2 | 59,3 | 56,9 | 55,0 | 53,4 | 52,0 | 50,7 | 49,7 | 47,3 | 45,4 | |
| 3000 | 94,9 | 93,9 | 93,1 | 92,3 | 91,7 | 90,6 | 90,1 | 89,6 | 88,5 | 87,6 | 86,8 | |
Kaip matyti iš lentelės. 8.8, esant temperatūrai iki 1600 ° C, į disociacijos laipsnį gali būti neatsižvelgiama, o teorinė degimo temperatūra gali būti lygi kalorimetrinei. Esant aukštesnei temperatūrai, disociacijos laipsnis gali žymiai sumažinti temperatūrą darbo vietoje. Praktikoje tam ypatingo poreikio nėra, teorinę degimo temperatūrą reikia nustatyti tik aukštatemperatūrinėms krosnims, veikiančioms pašildytu oru (pavyzdžiui, atviro židinio krosnyse). Katiliniams tai nėra būtina.
8.9 lentelė. Maksimalus
kylančios temperatūros
laisvoje liepsnoje, °С
Faktinė (apskaičiuota) degimo produktų temperatūra t d- temperatūra, kuri realiomis sąlygomis pasiekiama karščiausiame degiklio taške. Jis yra mažesnis nei teorinis ir priklauso nuo šilumos nuostolių į aplinką, šilumos perdavimo laipsnio iš degimo zonos spinduliuote, degimo proceso trukmės laike ir kt. Faktinės vidutinės temperatūros krosnyse ir katiluose yra nustatomas pagal šilumos balansą arba apytiksliai pagal teorinę ar kalorimetrinę degimo temperatūrą, priklausomai nuo temperatūros krosnyse, įvedant į jas eksperimentiškai nustatytus pataisos koeficientus:
t d = t t η(8,16)
kur η- vadinamasis. pirometrinis koeficientas ribose:
- gerai pagamintoms šiluminėms ir šildymo krosnims su šilumos izoliacija - 0,75–0,85;
- sandarioms krosnims be šilumos izoliacijos - 0,70–0,75;
- ekranuotoms katilinėms krosnims - 0,60–0,75.
Praktikoje būtina žinoti ne tik aukščiau nurodytas adiabatinio degimo temperatūras, bet ir maksimalias liepsnoje pasitaikančias temperatūras. Jų apytikslės vertės paprastai nustatomos eksperimentiniu būdu spektrografiniais metodais. Lentelėje pateiktos maksimalios temperatūros, kurios susidaro laisvoje liepsnoje 5–10 mm atstumu nuo kūginio degimo fronto viršaus. 8.9. Pateiktų duomenų analizė rodo, kad maksimalios temperatūros liepsnoje yra mažesnės nei šiluminė galia (dėl šilumos sąnaudų H 2 O ir CO 2 disociacijai ir šilumos pašalinimui iš liepsnos zonos).
8.4. SAVIMIŠIO UŽSIEGIMO TEMPERATŪRA
Norint pradėti degimo reakcijas, būtinos kuro mišinio su oksidatoriumi užsidegimo sąlygos. Uždegimas gali būti spontaniškas ir priverstinis (užsidegimas).
Savaiminio užsidegimo temperatūra- minimali temperatūra, kuriai esant įkaitintame dujų ir oro mišinyje prasideda savaiminio (t. y. be išorinio šilumos tiekimo) degimo procesas, dėl šilumos išsiskyrimo degant dujų dalelėms.
Savaiminio užsidegimo temperatūra tam tikroms dujoms nėra fiksuota ir priklauso nuo daugelio parametrų: jos kiekio dujų ir oro mišinyje, mišinio homogeniškumo laipsnio, indo, kuriame mišinys kaitinamas, formos ir dydžio, greičio ir jo šildymo būdas, indo sienelių katalizinis poveikis, slėgis, kuriuo veikiamas mišinys. Tiksliai įvertinti šiuos veiksnius yra labai sunku, todėl praktikoje, pavyzdžiui, vertinant sprogumą, naudojami eksperimentiniai duomenys (žr. 8.10 lentelę).
8.10 lentelė. Kai kurių dujų ir garų, sumaišytų su oru, esant atmosferos slėgiui, žemiausia išmatuota savaiminio užsidegimo temperatūra
Degiųjų dujų savaiminio užsidegimo temperatūra deguonyje yra šiek tiek žemesnė nei ore. Balastinių priemaišų (azoto ir anglies dioksido) patekimas į dujų sudėtį padidina savaiminio užsidegimo temperatūrą. Komponentų, kurių savaiminio užsidegimo temperatūra yra žema, buvimas sudėtingose dujose sumažina mišinio savaiminio užsidegimo temperatūrą.
Priverstinis uždegimas (uždegimas) atliekamas mišinį uždegant viename ar keliuose taškuose aukštos temperatūros šaltiniu - atvira liepsna arba elektros kibirkštimi toje vietoje, kur dujos iš degiklių degimo kanalų patenka į krosnies tūrį. . Uždegimas skiriasi nuo savaiminio užsidegimo tuo, kad degusis mišinys liepsna atrodo ne visame tūryje, o tik nedidelėje jo dalyje. Šilumos pašalinimas iš šildomos zonos reikalauja, kad uždegimo šaltinio šilumos išsiskyrimo greitis viršytų šį šilumos pašalinimą. Uždegus, uždegimo šaltinis pašalinamas ir degimas vyksta plintant liepsnos frontui.
8.5. DEGUMO IR SPROGIMO RIBOS
Dujų ir oro mišiniai gali užsidegti (sprogti) tik tada, kai dujų kiekis mišinyje yra tam tikrose (kiekvienoms dujoms) ribose. Šiuo atžvilgiu yra apatinės ir viršutinės degumo koncentracijos ribos. Apatinė riba atitinka minimalų, o viršutinė - didžiausią dujų kiekį mišinyje, kuriam esant jos užsidega (uždegimo metu) ir savaiminiu (be šilumos antplūdžio iš išorės) liepsnos plitimo (savaiminio užsidegimo). Tos pačios ribos atitinka dujų ir oro mišinių sprogumo sąlygas.
Jei dujų kiekis dujų ir oro mišinyje yra mažesnis už apatinę degumo ribą, toks mišinys negali degti ir sprogti, nes šalia uždegimo šaltinio išsiskiriančios šilumos nepakanka mišiniui pašildyti iki užsidegimo temperatūros. Jei dujų kiekis mišinyje yra tarp apatinės ir viršutinės degumo ribos, užsidegęs mišinys užsiliepsnoja ir dega tiek šalia uždegimo šaltinio, tiek jį pašalinus. Šis mišinys yra sprogus. Kuo platesnis degumo ribų diapazonas (dar vadinamas sprogumo ribomis) ir kuo žemesnė apatinė riba, tuo dujos sprogstamesnės. Ir galiausiai, jei dujų kiekis mišinyje viršija viršutinę degumo ribą, tai oro kiekis mišinyje yra nepakankamas, kad dujos visiškai sudegtų.
Degumo ribas lemia šilumos nuostoliai degimo metu. Degąjį mišinį skiedžiant oru, deguonimi ar dujomis, padidėja šilumos nuostoliai, mažėja liepsnos sklidimo greitis, o degimas nutrūksta pašalinus uždegimo šaltinį.
8.11 lentelė. Dujų, sumaišytų su oru, degumo ribos (esant t = 20°C ir p = 101,3 kPa)
| Dujos | Dujų kiekis dujų ir oro mišinyje, t. % | Maksimalus |
Oro koeficientas α degumo ribose | ||||
|---|---|---|---|---|---|---|---|
| Degumo ribose | Su stechiometrine mišinio sudėtimi | Mišinio sudėtis suteikia didžiausią sprogimo slėgį | |||||
| žemesnė | viršutinė | žemesnė | viršutinė | ||||
| Vandenilis | 4,0 | 75,0 | 29,5 | 32,3 | 0,739 | 9,8 | 0,15 |
| smalkės | 12,5 | 74,0 | 29,5 | – | – | 2,9 | 0,15 |
| Metanas | 5,0 | 15,0 | 9,5 | 9,8 | 0,717 | 1,8 | 0,65 |
| Etanas | 3,2 | 12,5 | 5,68 | 6,28 | 0,725 | 1,9 | 0,42 |
| Propanas | 2,3 | 9,5 | 4,04 | 4,60 | 0,858 | 1,7 | 0,40 |
| n-butanas | 1,7 | 8,5 | 3,14 | 3,6 | 0,858 | 1,7 | 0,35 |
| Izobutanas | 1,8 | 8,4 | 3,14 | – | – | ~1,8 | 0,35 |
| n-pentanas | 1,4 | 7,8 | 2,56 | 3,0 | 0,865 | 1,8 | 0,31 |
| Etilenas | 3,0 | 16,0 | 6,5 | 8,0 | 0,886 | 2,2 | 0,17 |
| Propilenas | 2,4 | 10,0 | 4,5 | ~5,1 | ~0,89 | 1,9 | 0,37 |
| Butilenas | 1,7 | 9,0 | 3,4 | ~4,0 | ~0,88 | 1,7 | 0,35 |
| Acetilenas | 2,5 | 80,0 | 7,75 | 14,5 | 1,03 | 3,3 | 0,019 |
8.12 lentelė. Dujų, sumaišytų su deguonimi, degumo ribos (esant t = 20°C ir p = 101,3 kPa)
Įprastų dujų mišiniuose su oru ir deguonimi degumo ribos pateiktos lentelėje. 8.11–8.12 val. Didėjant mišinio temperatūrai, degumo ribos plečiasi, o esant temperatūrai, viršijančiai savaiminio užsiliepsnojimo temperatūrą, dujų ir oro ar deguonies mišiniai dega bet kokiu tūrio santykiu.
Degumo ribos priklauso ne tik nuo degiųjų dujų rūšių, bet ir nuo eksperimentų sąlygų (indo talpos, uždegimo šaltinio šiluminės galios, mišinio temperatūros, liepsnos sklidimo aukštyn, žemyn, horizontaliai ir kt.). Tai paaiškina šiek tiek skirtingas šių ribų vertes įvairiuose literatūros šaltiniuose. Lentelėje. 8.11–8.12 paveiksluose pateikti gana patikimi duomenys, gauti esant kambario temperatūrai ir atmosferos slėgiui liepsnai plintant iš apačios į viršų 50 mm ar didesnio skersmens vamzdyje. Kai liepsna plinta iš viršaus į apačią arba horizontaliai, apatinės ribos šiek tiek padidėja, o viršutinės mažėja. Sudėtingų degiųjų dujų, kuriose nėra balastinių priemaišų, degumo ribos nustatomos pagal adityvumo taisyklę:
L g \u003d (r 1 + r 2 + ... + r n) / (r 1 / l 1 + r 2 / l 2 + ... + r n / l n) (8.17)
čia L g yra apatinė arba viršutinė sudėtingų dujų degumo riba dujų ir oro arba dujų ir deguonies mišinyje, t. %; r 1 , r 2 , …, r n - atskirų komponentų kiekis kompleksinėse dujose, t. %; r 1 + r 2 + ... + r n \u003d 100%; l 1, l 2, ..., l n - atskirų komponentų apatinės arba viršutinės degumo ribos dujų-oro arba dujų-deguonies mišinyje pagal lentelę. 8.11 arba 8.12, t. %.
Jei dujose yra balastinių priemaišų, degumo ribas galima nustatyti pagal formulę:
L b \u003d L g / (8,18)
kur L b - viršutinė ir apatinė mišinio su balastinėmis priemaišomis degumo ribos, t. %; L g - viršutinė ir apatinė degaus mišinio degumo ribos, t. %; B - balastinių priemaišų kiekis, vieneto frakcijos.
Skaičiuojant dažnai reikia žinoti oro pertekliaus koeficientą α esant skirtingoms degumo riboms (žr. 8.11 lentelę), taip pat slėgį, susidarantį dujų ir oro mišinio sprogimo metu. Oro pertekliaus koeficientas, atitinkantis viršutinę arba apatinę degumo ribas, gali būti nustatytas pagal formulę
α = (100/L – 1) (1/V T) (8,19)
Slėgis, atsirandantis dėl dujų ir oro mišinių sprogimo, gali būti pakankamai apytiksliai nustatytas pagal šias formules:
paprastų dujų ir oro stechiometriniam santykiui:
P vz \u003d P n (1 + βt k) (m / n) (8,20)
bet kokiam sudėtingų dujų ir oro santykiui:
R vz \u003d R n (1 + βt k) V vlps / (1 + αV m) (8,21)
kur P vz - slėgis, atsirandantis dėl sprogimo, MPa; p n - pradinis slėgis (prieš sprogimą), MPa; β - dujų tūrinio plėtimosi koeficientas, skaitiniu būdu lygus slėgio koeficientui (1/273); t K - kalorimetrinė degimo temperatūra, °С; m – molių skaičius po sprogimo, nustatomas pagal dujų degimo ore reakciją; n – degimo reakcijoje dalyvaujančių molių skaičius prieš sprogimą; V vlps - šlapio degimo produktų tūris 1 m 3 dujų, m 3; V t - teorinis oro suvartojimas, m 3 /m 3.
8.13 lentelė. Slėgis, atsirandantis sprogus propano ir oro mišiniui, priklausomai nuo išleidimo koeficiento k sb ir apsauginio įtaiso tipo
| Apsauginio įtaiso tipas | Iškrovos koeficientas k sb, m 2 / m 3 | ||
|---|---|---|---|
| 0,063 | 0,033 | 0,019 | |
| Viengubas fiksuotas stiklas su išoriniu tvirtinimu iš 3 mm storio stiklo | 0,005 | 0,009 | 0,019 |
| Dvigubas fiksuotas stiklas su išoriniu tvirtinimu iš 3 mm storio stiklo | 0,007 | 0,015 | 0,029 |
| Pasukamas vieno lango rėmas su dideliu vyriu ir spyruokliniu užraktu 5 MPa/m 2 apkrovai | 0,002 | – | – |
| Pasukamas vieno lango rėmas su viršutiniu vyriu ir spyruokliniu užraktu 5 MPa/m 2 apkrovai | 0,003 | – | – |
| Plokštės, laisvai gulinčios ant grindų, kurių masė, kg / m 2: | |||
| 0,023 | |||
| 0,005 | |||
| 0,018 | |||
Sprogimo slėgiai pateikti lentelėje. 8.13 arba nustatomos pagal formules, gali atsirasti tik tuo atveju, jei dujos visiškai sudegintos talpos viduje ir jos sienelės pritaikytos šiems slėgiams. Kitu atveju juos riboja sienų ar lengviausiai sunaikinamų jų dalių tvirtumas – slėgio impulsai garso greičiu sklinda neužsidegančiu mišinio tūriu ir tvorą pasiekia daug greičiau nei liepsnos frontas.
Ši savybė – liepsnos plitimo greičių ir slėgio impulsų skirtumas (smūgio banga) – plačiai taikoma praktikoje, siekiant apsaugoti dujinius įrenginius ir patalpas nuo sunaikinimo sprogimo metu. Tam į sienų ir lubų angas įrengiami lengvai atsidarantys ar susitraukiantys skersiniai, karkasai, plokštės, vožtuvai ir kt. Slėgis, atsirandantis dėl sprogimo, priklauso nuo apsauginių įtaisų konstrukcijos ypatybių ir iškrovos koeficiento k sb, kuris yra apsauginių įtaisų ploto ir patalpos tūrio santykis.
8.6. DEGINIMAS NUSTATYMOJE APLINKOJE
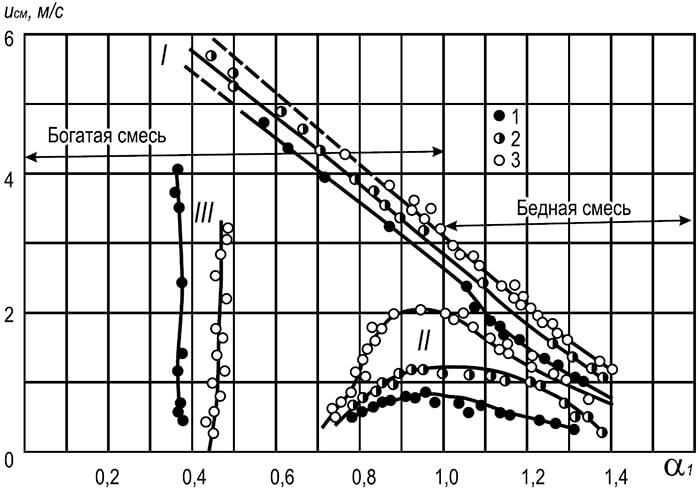
Liepsnos zonos – liepsnos fronto, – zonos, skiriančios nesureagavusį degųjį mišinį nuo degimo produktų, judėjimą lemia tai, kad priešais esantis šaltas degus mišinys dėl šilumos laidumo ir difuzijos įkaista iki užsidegimo temperatūros. karštų degimo produktų į šaltą mišinį. Linijinis greitis, kuriuo liepsnos frontas juda per homogeninį degų mišinį, vadinamas vienodas liepsnos plitimo greitis priklausomai nuo dujų rūšies ir jų kiekio dujų ir oro mišinyje. Mažiausias visų rūšių degių dujų greitis atitinka apatinę ir viršutinę uždegimo ribas, o didžiausias - dujų ir oro santykį.
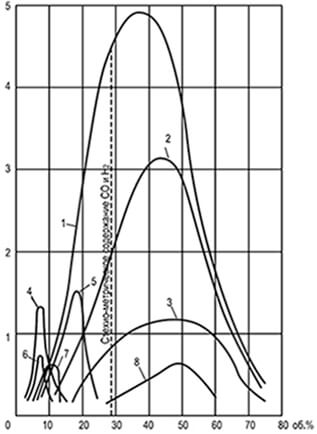
Ryžiai. 8.1. Vienodų greičių kreivės
liepsnos plitimas u n, apibrėžtas
25,4 mm skersmens vamzdyje
1-vandenilis; 2-vandens dujos; 3-anglies monoksidas;
4-etilenas; 5-kokso krosnies dujinės; 6-etanas; 7-metanas;
8 generatorių garo-oro pūtimo dujos
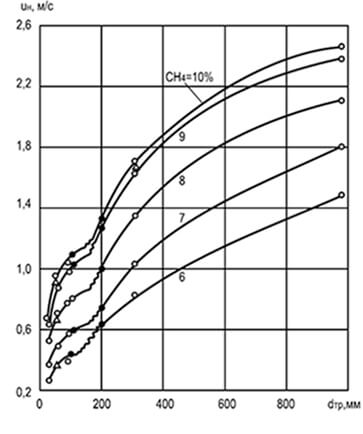
Ryžiai. 8.2. Skersmens d tr ir koncentracijos įtaka
metanas, sumaišytas su oru, kad pasikeistų
vienodas liepsnos sklidimo greitis u n
Eksperimentais nustatyta, kad liepsnos plitimo greitis priklauso nuo cilindrinio vamzdžio, kuriuo ji sklinda, skersmens: kuo didesnis skersmuo, tuo didesnis plitimo greitis. Padidėjęs vamzdžio skersmuo sumažina sienelių įtaką degimo procesui ir judančiam liepsnos frontui bei prisideda prie konvekcijos stiprinimo (8.2 pav.). Grafiko duomenų analizė rodo, kad esant labai mažiems vamzdžių dydžiams, liepsnos plitimas paprastai yra neįmanomas (dėl stipraus santykinio šilumos pašalinimo). Vamzdžių, kanalų ir plyšių dydžiai, kuriuose liepsna neplinta, vadinami kritiniais.
Skirtingoms dujoms jie skiriasi:
- šaltas metano ir oro mišinys - 3 mm;
- vandenilio-oro mišinys - 0,9 mm;
- šildomas metano ir oro mišinys - 1,2 mm.
Gesinimas mažo skerspjūvio kanaluose praktikoje naudojamas kuriant gaisro gesintuvus: liepsnos stabdymo groteles, keraminius porėtus diskus, diskus iš presuoto metalo rutuliukų, smulkiagrūdžių medžiagų pripildytus indus ir kt.); gaisro kanalai projektuojant degiklius, veikiančius su dujų ir oro mišiniais.
Siekiant palyginti dujų degiųjų savybių charakteristikas (neatsižvelgiant į vamzdžių dydį), koncepcija "normalus liepsnos plitimo greitis"- tai greitis, vadinamas šaltu (dar neuždegtu) mišiniu, kuriuo liepsna juda įprastu būdu į jos paviršių. Laikoma, kad liepsnos priekis yra plokščias ir lygus vamzdžio skersmeniui:
u n \u003d w p πr 2 / S (8,22)
čia u n – normalus liepsnos plitimo greitis, m/s; w p - išmatuotas vienodas liepsnos plitimo greitis, m/s; r - vamzdžio spindulys, m; S yra liepsnos fronto paviršiaus plotas, m 2 .
8.14 lentelė. Liepsnos sklidimo greičiai įvairiuose dujų ir oro mišiniuose (esant t=20°C ir p=103,3 kPa), m/s
| Dujos | Mišinys su maksimaliu normaliu liepsnos plitimo greitis |
Stechiometrinis mišinys | ||||
|---|---|---|---|---|---|---|
| Turinys mišinyje, t. % | Maksimalus normalus greitis platinimas |
Turinys mišinyje, t. % | Normalus greitis platinimas liepsna |
|||
| dujų | oro | dujų | oro | |||
| Vandenilis | 42,0 | 58,0 | 2,67 | 29,5 | 70,5 | 1,6 |
| smalkės | 43,0 | 57,0 | 0,42 | 29,5 | 70,5 | 0,30 |
| Metanas | 10,5 | 89,0 | 0,37 | 9,5 | 90,5 | 0,28 |
| Etanas | 6,3 | 93,7 | 0,40 | 5,7 | 94,3 | 0,32 |
| Propanas | 4,3 | 95,7 | 0,38 | 4,04 | 95,96 | 0,31 |
| n-butanas | 3,3 | 96,7 | 0,37 | 3,14 | 96,86 | 0,30 |
| Etilenas | 7,0 | 93,0 | 0,63 | 6,5 | 93,5 | 0,5 |
| Propilenas | 4,8 | 95,2 | 0,44 | 4,5 | 95,5 | 0,37 |
| Butilenas | 3,7 | 96,3 | 0,43 | 3,4 | 96,6 | 0,38 |
| Acetilenas | 10,0 | 90,0 | 1,35 | 7,75 | 92,25 | 1,0 |
Kaip matyti iš lentelėje pateiktų duomenų. 8.14, didžiausias liepsnos plitimo greitis atitinka dujų ir oro mišinius, kuriuose nėra oksidatoriaus (ne stechiometrinis). Esant kuro pertekliui, didėja reaguojančių dalelių susidūrimo efektyvumas ir didėja cheminių reakcijų greitis.
Liepsnos plitimo greitis dujų ir deguonies mišiniuose yra daug didesnis nei dujų ir oro mišinių. Taigi didžiausias normalus liepsnos plitimo greitis metano ir deguonies mišiniui yra 3,3 m/s, o propano ir butano mišinio su deguonimi – 3,5–3,6 m/s.
Didžiausias normalus liepsnos plitimo greitis sudėtingų dujų ir oro mišinyje, m/s, nustatomas pagal formulę:
u n max \u003d (r 1 u 1 + r 2 u 2 + ... + r n u n) / (r 1 + r 2 + ... + r n) (8,23)
čia r 1 , r 2 ,…r n yra atskirų komponentų kiekis sudėtingose dujose, t. %; u 1 , u 2 ,...u n – didžiausi įprastiniai su oru susimaišytų dujų komponentų liepsnos plitimo greičiai, m/s.
Pateikti santykiai tinka dujoms, kurių liepsnos plitimo greitis yra artimas normaliam, pavyzdžiui, natūralioms ir suskystintoms angliavandenilių dujoms. Dujų mišiniams, kurių liepsnos plitimo greitis labai skiriasi (pvz., gamtinių ir dirbtinių dujų mišiniams, mišiniams, kuriuose yra daug vandenilio), jie pateikia tik apytiksles vertes.
Jei mišinyje yra balastinių priemaišų (azoto ir anglies dioksido), apytiksliai liepsnos plitimo greičiui apskaičiuoti reikia naudoti šią formulę:
u b \u003d u n max (1 – 0,01N 2 – 0,012 CO 2) (8,24)
Žymiai padidina liepsnos plitimo greitį kaitinant dujų ir oro mišinį:
u‘ n \u003d u n (T‘ / T) (8,25)
čia u‘ n – liepsnos plitimo greičiai įkaitintame mišinyje esant absoliučiai temperatūrai T‘, K; ir n - tas pats, šaltame mišinyje, kurio temperatūra T, K.
Iš anksto pakaitinus mišinį, jo tankis keičiasi atvirkščiai proporcingai absoliučiai temperatūrai, todėl liepsnos sklidimo greičiai didėja proporcingai šiai temperatūrai. Į šį faktą reikia atsižvelgti atliekant skaičiavimus, ypač tais atvejais, kai degiklių degimo kanalai yra įkaitusiame mūre arba kai juos veikia krosnies spinduliuotė, karštos dujos ir pan.
Tolygus liepsnos sklidimas galimas tokiomis sąlygomis:
- ugnies vamzdis trumpas;
- degimas plinta esant pastoviam, artimam atmosferiniam slėgiui.
Jei vamzdžio ilgis yra reikšmingas, kai kurių mišinių tolygus liepsnos sklidimas gali virsti vibraciniu, o po to - detonaciniu, kurio degimo greitis viršgarsinis (2000 m/s ir didesnis), kai mišinys užsiliepsnoja. dėl smūginės bangos, kuri įkaitina mišinį iki temperatūros, viršijančios užsidegimo temperatūrą. Detonacija vyksta mišiniuose su dideliu liepsnos plitimo greičiu. Detonacijos koncentracijos ribos yra siauresnės nei dujų-oro ir dujų-deguonies mišinių degumo ribos, t. %: propanas - 3,2-37, izobutanas - 2,8-31, vandenilis - 15-90. Detonacinio degimo metu susidarantis slėgis gali dešimtis kartų viršyti pradinį slėgį ir sukelti vamzdžių bei kitų aukštam slėgiui pritaikytų indų sunaikinimą.
8.7. DEGIMO LAMINARUOSE IR TURBULENTUOSE SRAUTUOSE

Ryžiai. 8.3. degimo priekis
dujų ir oro mišinys
laminarinis judesys
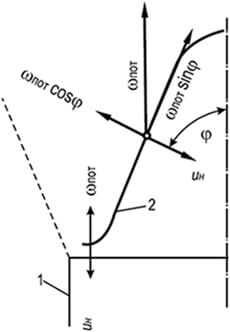
Liepsnos frontą galima sustabdyti sukuriant atvažiuojantį degiojo mišinio judėjimą greičiu, lygiu normaliam liepsnos plitimo greičiui. Puikus pavyzdys yra Bunseno degiklio vidinio kūgio paviršius. Reguliuojant iš degiklio ištekančio dujų ir oro mišinio sudėtį laminariniu judėjimo režimu, galima pasiekti stabilaus ir ryškiai apibrėžto degimo kūgio išvaizdą (8.3 pav.). Kūgio šoninis paviršius (liepsnos priekis), kuris yra nejudantis degiklio kanalo degimo krašto atžvilgiu, juda link ištekančio dujų ir oro mišinio, o liepsna šiuo atveju sklinda išilgai uždegimo paviršiaus įprastu kampu. jo taškai. Kūginio liepsnos fronto paviršiuje išsaugoma greičių lygybė - dujų ir oro mišinio tėkmės greičio projekcijos į normalią wн į kūgio generatorių ir normalus liepsnos plitimo greitis nepaklūsta Michelsono dėsniui:
w n \u003d w prakaito cosφ \u003d u n (8,26)
čia φ – kampas tarp srauto krypties ir kūginio liepsnos fronto paviršiaus statinės; w prakaitas - vidutinis dujų ir oro mišinio, praeinančio per degiklį, srautas per laiko vienetą, m/s.
Normalaus liepsnos plitimo greičio pastovumas galioja tik pagrindinei kūginio liepsnos fronto šoninio paviršiaus daliai. Kūgio viršuje greitis didėja dėl dujų ir oro mišinio kaitinimo glaudžiai išdėstytomis liepsnos priekio kūginio paviršiaus atkarpomis, o kūgio apačioje sumažėja dėl aušinimo galo. degiklio ugnies kanalo dalis.
Praktiniams skaičiavimams į šį skirtumą paprastai neatsižvelgiama ir daroma prielaida, kad mišinio praėjimo per liepsnos frontą greitis yra pastovus visame kūgio paviršiuje ir lygus u n.
Vidutinis normalus liepsnos plitimo greitis yra
u n \u003d V cm / S (8,27)
kur V cm yra dujų ir oro mišinio, praeinančio per degiklį, tūris, S yra kūginio liepsnos priekio paviršiaus plotas.
Praktiškai kūginis liepsnos frontas neturi taisyklingos geometrinės formos, todėl norint tiksliai nustatyti S, liepsna fotografuojama, liepsnos frontas padalinamas į nupjautų kūgių eilę. Šoninių paviršių suma yra visas kūginio liepsnos priekio paviršius. Įprastų liepsnos plitimo greičių reikšmės, nustatytos tiek Bunseno degiklio metodu, tiek kitais metodais, yra tokios pačios ir lygios normaliam greičiams, nurodytiems lentelėje. 8.14.
Kūgio liepsnos priekio aukštis daugiausia priklauso nuo degiklio degimo kanalo dydžio. Liepsnos aukštį galima sumažinti sutraiškant didelius ugnies kanalus į kelis mažus. Tos pačios sudėties dujų ir oro mišiniams mažų kanalų kūginių liepsnos frontų aukštį h galima apytiksliai nustatyti pagal vieno kanalo H liepsnos priekio aukštį:
h = H/ √n(8,28)
kur n yra mažų kanalų skaičius.
Didelės šiluminės galios degikliams (pramoninių katilų, krosnių ir kt. degikliai) degimas, kaip taisyklė, vyksta turbulentiniu srautu – lygus kūgio formos liepsnos priekis susilieja ir praranda aiškią kūgio formą dėl sūkurinio judėjimo ir pulsacijų. Šiuo atveju pastebimi du būdingi degimo tipai, atitinkantys mažo ir didelio masto turbulenciją.
Esant turbulencijos skalėms, neviršijančioms laminarinio degimo zonos storio, kūgio formos liepsnos priekis išlaiko formą ir išlieka lygus, nors degimo zona didėja. Jei turbulencijos skalė viršija normalaus degimo zonos storį, kūginio liepsnos fronto paviršius tampa nelygus. Dėl to padidėja bendras degimo fronto paviršius ir sudeginamas didesnis degiojo mišinio kiekis srauto skerspjūvio vienete.
Esant didelio masto turbulencijai, kuri yra daug didesnė už laminarinio degimo zonos storį, liepsnos fronto paviršiaus sutrikimas lemia atskirų karšto mišinio dalelių atsiskyrimą, kurios susmulkinamos dėl vėlesnių pulsacijų. Liepsnos frontas praranda vientisumą ir virsta atskirų degimo centrų sistema lygių degaus mišinio dalelių pavidalu, kurios išsisklaido ir dega sraute.

Ryžiai. 8.4. Santykinis greičio pokytis
kokso krosnies dujų liepsnos plitimas
sumaišytas su oru priklausomai nuo skaičiaus
Reinoldsas ir mišinio judėjimo būdas
Esant didelio masto turbulencijai, didėja liepsnos fronto paviršius, susidedantis iš visų degančių dalelių paviršių, todėl smarkiai padidėja liepsnos plitimo greitis (8.4 pav.). Tokiu atveju gali vykti ne tik priekinis degimas, sklindantis normaliu greičiu v n , bet ir tūrinis degimas, atsirandantis dėl karštų degimo produktų turbulentinių pulsacijų į šviežią mišinį. Vadinasi, bendrą liepsnos plitimo greitį didelio masto turbulencijos metu lemia vienoks ar kitoks priekinio ir tūrinio degimo elementų derinys.
Nesant pulsacijų, turbulentinis degimo greitis tampa lygus įprastam liepsnos plitimo greičiui. Priešingai, jei pulsavimo greitis yra daug didesnis nei normalus, turbulentinis degimo greitis mažai priklauso nuo fizikinių ir cheminių degiojo mišinio savybių. Eksperimentai parodė nedidelę įvairių vienalyčių dujų-oro mišinių, kurių α>1, degimo greičio priklausomybę pramoninėse krosnyse nuo įprasto liepsnos sklidimo greičio.
8.8. DEGIMO STABILUMAS
Ryžiai. 8.5. Tiesioginio kompensavimo schema
u n \u003d w prakaitas laminarinio judėjimo metu
dujų ir oro mišinys
1 – degiklio sienelė;
2 - liepsnos priekis
Pagrindiniai veiksniai, turintys įtakos degimo stabilumui, yra dujų ir oro mišinio nutekėjimo greitis ir liepsnos plitimas. Deginant dujų ir oro mišiniams laminariniu srautu, stabili kūginio liepsnos priekio dalis yra apatinė jo dalis. Šiuo metu liepsnos frontas dėl į atmosferą tekančio dujų ir oro mišinio išsiplėtimo ir kanalo sienelės sulėtinančio poveikio pasukamas horizontaliai ir pakyla virš kanalo krašto liepsnos fronto storiu (2 pav.). 8.5).
Šioje priekinėje dalyje dujų ir oro srauto greitis visiškai kompensuojamas liepsnos plitimo greičiu u n = w prakaitas . Likusioje liepsnos priekio kūginėje dalyje kompensacija yra dalinė ir atliekama tik kryptimi, kuri yra normali degimo frontui: u n = w prakaitas cosφ . Komponentas w prakaitas sinφ lieka nesubalansuotas ir perkelia uždegimo tašką nuo kūgio pagrindo iki jo viršaus. Kūginio liepsnos priekio stabilumas paaiškinamas tuo, kad prie pagrindo esantis žiedinis diržas yra uždegimo šaltinis, be kurio dujų ir oro mišinio srautas nuneštų likusią priekio dalį.
Jei mišinio srautas viršija liepsnos plitimo greitį, uždegimo diržo plotis mažėja, kol tampa nereikšmingas. Tokiu atveju pažeidžiamas liepsnos priekio stabilumas ir atsiskiria nuo degiklio. Jei liepsnos plitimo greitis žiedinėje prie sienos srityje (ne ant sienos) viršija dujų ir oro mišinio nutekėjimo greitį, liepsna įtraukiama į degiklio maišytuvą (viršija).
Atjungus yra:
- liepsnos gedimas iš degiklio ir jos užgesimas;
- atskyrimas nuo ugnies kanalo krašto, kai liepsna pasiekia naują, gana stabilią padėtį sraute virš degiklio;
- pakilusios liepsnos sugedimas ir jos užgesimas;
- pakelto degiklio išmetimas į degiklio ugnies kanalo kraštą;
- sklindančios liepsnos sukūrimas, kai srovė užsidega tam tikru atstumu nuo degiklio.
Visi šie reiškiniai yra nepriimtini, nes juos supančioje atmosferoje arba krosnyje kaupiasi nesudegusios dujos.
Ryžiai. 8.6. Vieneto atskyrimo greičio priklausomybė
liepsnos atviroje atmosferoje natūralių mišinių
dujos su oru ant gaisro kanalo dydžio ir
pirminio oro kiekis.
Ryžiai. 8.7. Atskyrimo greičio priklausomybė
daugialiepė liepsna atviroje atmosferoje
dydžio gamtinių dujų ir oro mišiniai
gaisro kanalas ir pirminis oro kiekis.
a - degiklio schema; b – liepsnos atskyrimo kreivės
Ant pav. 8.6 parodytos eksperimentinės liepsnos atsiskyrimo nuo įpurškimo vieno degiklio, veikiančių šaltų dujų ir oro mišiniu, ugnies kanalų kraštų kreivės. Ties riba ir virš šių kreivių prasideda liepsnos atsiskyrimas, o žemiau kreivių prasideda stabilus degimas.
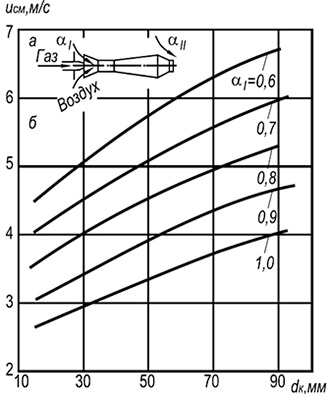
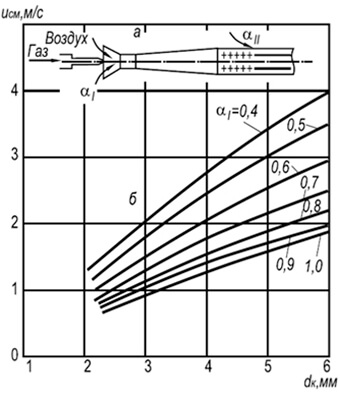
Praktikoje plačiai paplitę kelių deglių įpurškimo degikliai su 2–6 mm skersmens ugnies kanalais (8.7 pav.). Tokiems degikliams liepsnos atskyrimo greitis w ref gali būti nustatomas pagal šią formulę:
w neg = 3,5 10 -3 d k T 2 (1 + V t) / (1 + α 1 V t) (8,29)
čia d k – šaudymo kanalų skersmuo, m; α 1 - pirminio oro pertekliaus koeficientas; T yra absoliuti dujų ir oro mišinio temperatūra, K.
Iš formulės matyti, kad degimo stabilumas didėja didėjant gaisro kanalų skersmenims ir temperatūrai, o mažėja didėjant pirminio oro pertekliaus koeficientui. Degimo stabilumas taip pat padidėja dėl abipusės liepsnos įtakos.
Liepsnos atsiskyrimas nuo ugnies kanalų gali atsirasti ir dėl kitų priežasčių. Jei degiklis ir išmetamosios dujos nėra tinkamai išdėstytos, jos gali patekti į degiklio purkštuką ir sukelti liepsnos atsiskyrimą (sumažinus liepsnos plitimo greitį dujų ir oro mišinyje, praskiestame inertinėmis dujomis). Taip pat atskyrimo priežastis gali būti didelis antrinio oro greitis, pučiantis liepsną iš ugnies kanalų.
8.15 lentelė. Natūralaus homogeniško mišinio norma
dujos su oru, dėl kurių įvyksta proveržis
liepsna, m/s (mišinio temperatūra 20°C)
| Skersmenys šaudymas kanalai |
Pirminio oro santykis | |||||
|---|---|---|---|---|---|---|
| 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | |
| 3,5 | 0,05 | 0,10 | 0,18 | 0,22 | 0,23 | 0,21 |
| 4,0 | 0,08 | 0,12 | 0,22 | 0,25 | 0,26 | 0,20 |
| 5,0 | 0,09 | 0,16 | 0,27 | 0,31 | 0,31 | 2,23 |
| 6,0 | 0,11 | 0,18 | 0,32 | 0,38 | 0,39 | 0,26 |
| 7,0 | 0,13 | 0,22 | 0,38 | 0,44 | 0,45 | 0,30 |
| 8,0 | 0,15 | 0,25 | 0,43 | 0,50 | 0,52 | 0,35 |
| 9,0 | 0,17 | 0,28 | 0,48 | 0,57 | 0,58 | 0,39 |
| 10,0 | 0,20 | 0,30 | 0,54 | 0,64 | 0,65 | 0,43 |
Taip pat nepriimtina, kad degiklio maišytuvo viduje blykčiotų liepsna, dažniausiai kartu su sprogimu. Dėl slydimo liepsna užgęsta ir nesudegęs mišinys išstumiamas į patalpą ar krosnį, arba mišinys sudega degiklio viduje. Liepsnos pliūpsnio polinkis priklauso nuo dujų rūšies, normalaus liepsnos plitimo greičio, pirminio oro kiekio dujų ir oro mišinyje, gaisro kanalų matmenų, mišinio temperatūros ar sienelių. kanalus. Liepsnos prasiskverbimui taip pat turi įtakos medžiagų, iš kurių gaminami ugnies kanalai, šilumos laidumas, jų forma, gylis ir apdirbimas, įdubimų, sulaužytų kraštų ir kt.
Pateikta lentelėje. 8.15 vienarūšių gamtinių dujų mišinių su oru greičių vertės, kai įvyksta proveržis, taip pat gali būti naudojamos kitoms dujoms, su pataisymais:
w" inc \u003d w inc u" n / u n (8.30)
čia w‘pr – liepsnos pliūpsnio greitis kitoms dujoms, m/s; w pr - gamtinių dujų slydimo greitis (pagal 8.15 lentelę), m / s; u‘ n - normalus liepsnos plitimo greitis kitoms dujoms, m/s; u n - liepsnos plitimo greitis metane, m/s.
Didžiausią slydimo greitį galima apskaičiuoti pagal apytikslę formulę:
w pr \u003d 0,73 10 -3 d k T 2 (8,31)
Tą pačią formulę, kurios apytikslis pakanka praktiškai, taip pat galima naudoti kitoms dujoms, įvedant pataisą, atsižvelgiant į įprasto liepsnos plitimo greičio pasikeitimą. Remiantis daugybe eksperimentų, galima padaryti tokią išvadą: stabilaus degiklių veikimo ribas riboja liepsnos atsiskyrimo ir pliūpsnio greitis.
Ryžiai. 8.8. Dujų ir oro mišinio greičio, kuriuo vyksta liepsnos atsiskyrimas ir atsimušimas, priklausomybė nuo pirminio oro pertekliaus koeficiento
I - liepsnos atsiskyrimas; II - liepsnos proveržis; III - geltoni liepsnos kraštai;
1–3 degiklių ugnies kanalų skersmenys, mm: 1 – 25, 2 – 25, 3 – 32
Ant pav. 8.8 pavaizduotos kreivės, apibūdinančios gamtinių dujų ir oro mišinio srautus, kai atsiranda liepsnos atsiskyrimas ir atsimušimas. Kreivių pobūdis rodo staigų liepsnos stabilumo sumažėjimą, nes didėja pirminio oro kiekis mišinyje. Liepsnos stabilumas padidėja sumažėjus pirminio oro kiekiui ir pasiekia maksimumą, kai jis sumažėja iki nulio (difuzinis degimas). Tačiau toks angliavandenilių dujų deginimas daugeliu atvejų yra nepriimtinas, nes dėl jo atsiranda geltonos liepsnos, kurios apibūdina suodžių dalelių atsiradimą jame.
Ryžiai. 8.9. Įprasti antipirenai
a - cilindrinis tunelis su staigiu atkarpos išsiplėtimu;
b - tas pats, su sūkuriu srautu;
c – kūginis tunelis su sūkuriu srautu;
d - kūginio korpuso formos stabilizatorius;
e - tas pats, apvalaus strypo pavidalu;
e - tas pats, stabilios žiedinės liepsnos pavidalu
1 - degiklio antgalis; 2 - tunelis; 3 - šoninė skylė;
4 – žiedinis kanalas; 5 - žiedinė liepsna;
6 - pagrindinio dujų ir oro mišinio srauto liepsna
Praktikoje, norint išplėsti bet kokių degiųjų dujų ir oro mišinių degimo stabilumo diapazoną, manoma, kad srauto greitis yra kelis kartus didesnis nei atskyrimo greitis. Liepsnos atsiskyrimo prevencija pasiekiama naudojant liepsnos stabilizatorius (8.9 pav.).
Įpurškimo ir kitų degiklių, gaminančių ašimetrines dujų ir oro čiurkšles, liepsnai stabilizuoti naudojami ugniai atsparūs cilindriniai tuneliai, kurių skerspjūvis staigiai išsiplečia. Tokio tunelio veikimas pagrįstas dalies karštų degimo produktų periferine cirkuliacija, kuri atsiranda dėl purkštuko sukuriamo retėjimo.
Degiklių, gaminančių besisukantį dujų ir oro mišinį, liepsnai stabilizuoti naudojami tiek cilindriniai, tiek kūginiai tuneliai, kurių atidarymo kampas yra 30–60°. Esant sūkuriuojančiam srautui, tunelio pakraštyje susidaro didesnis slėgis nei jo centrinėje dalyje. Tai veda prie kai kurių karštų degimo produktų paraksialinės recirkuliacijos ir užsidega šalto dujų ir oro mišinio, patenkančio į tunelį iš vidaus.
Kai tunelių įrengti neįmanoma, liepsnai stabilizuoti naudojami prastai aptakios formos kūnai, dedami į dujų ir oro mišinio srautą jo išėjimo iš degiklio ugnies kanalo vietoje. Šiuo atveju mišinio užsidegimas įvyksta stabilizatoriaus periferijoje, už kurios vyksta dalinė karštų dujų recirkuliacija, kuri uždega degųjį mišinį iš vidaus. Tokių prietaisų stabilizavimo efektas yra mažesnis nei tunelių.
Vieno ir kelių degiklio įpurškimo degikliuose degimo stabilizatoriai plačiai naudojami specialaus liepsnos antgalio pavidalu. Šio prietaiso stabilizuojantis poveikis yra pagrįstas tuo, kad neleidžia pagrindiniam srautui praskiesti liepsnos šaknyje pertekliniu oru, kuris susiaurina jo stabilumo ribas, taip pat pagrindinio srauto kaitinimu ir uždegimu žiedine liepsna per visą jo periferiją. . Žiedinės liepsnos stabilumas atskyrimo metu pasiekiamas dėl tokio ugnies žiedo sekcijų ir šoninių angų santykio, kuriame dujų ir oro mišinio greitis žiedinėje ertmėje neviršija įprasto liepsnos plitimo greičio. Kad liepsna nemirksėtų į degiklio maišytuvą, šoninių angų, sudarančių žiedinę liepsną, matmenys yra mažesni už kritinius.
8.9. APSAUGOS PRIEŽIŪRIŲ SCHEMOS
Į dujotiekį patekęs oras ar deguonis gali sudaryti sprogų mišinį, todėl dujotiekius būtina apsaugoti nuo oro ar deguonies patekimo į jį. Visose sprogstamosiose pramonės šakose turi būti sudarytos sąlygos, kurios pašalintų uždegimo impulsų galimybę. Uždegimo šaltiniai, dėl kurių gali sprogti dujų ir oro mišiniai, yra šie:
- atvira liepsna;
- veikiančių elektros įrenginių elektros iškrovos;
- trumpasis jungimas elektros laiduose;
- kibirkštys elektros prietaisuose;
- perdegę saugikliai;
- statinės elektros iškrovos.
Saugumą nuo sprogimo užtikrina įvairūs liepsnos slopintuvai. montuojamas vamzdynuose, rezervuaruose, prapūtimo dujotiekiuose, žvakėse ir kitose sistemose, kuriose yra sprogimo pavojus.
Liepsnos užgesimas kanale, užpildytame degiu mišiniu, įvyksta tik esant minimaliam kanalo skersmeniui, kuris priklauso nuo mišinio cheminės sudėties ir slėgio, ir paaiškinamas šilumos nuostoliais iš reakcijos zonos į kanalo sieneles. Sumažėjus kanalo skersmeniui, jo paviršius didėja reaguojančio mišinio masės vienetui, t.y. šilumos nuostoliai didėja. Kai jie pasiekia kritinę vertę, degimo reakcijos greitis sumažėja tiek, kad tolesnis liepsnos sklidimas tampa neįmanomas.
Liepsnos slopintuvo gebėjimas gesinti liepsną daugiausia priklauso nuo gesinimo kanalų skersmens ir daug mažiau nuo jų ilgio, o liepsnos prasiskverbimo per gesinimo kanalus galimybė daugiausia priklauso nuo degiojo mišinio savybių ir sudėties bei slėgio. Normalus liepsnos plitimo greitis yra pagrindinis dydis, lemiantis gesinimo kanalų dydį ir liepsnos slopintuvo tipo pasirinkimą: kuo jis didesnis, tuo mažesnis kanalas reikalingas liepsnai užgesinti. Taip pat gesinimo kanalų matmenys priklauso nuo pradinio degiojo mišinio slėgio. Norint įvertinti liepsnos slopintuvų gebėjimą sulaikyti liepsną, vadinamasis. „Peclet Re“ kriterijus:
Pe \u003d w cm dc p p / (RT 0 λ 0) (8,32)
Liepsnos užgesimo ribose Pekleto kriterijaus formulė yra tokia:
Re cr = w cm d cr c p p cr /(RT 0 λ 0) (8,33)
čia w cm – įprastas liepsnos plitimo greitis; d – slopinimo kanalo skersmuo; d kp - kritinis gesinimo kanalo skersmuo; c p – savitoji dujų šiluminė talpa esant 0°C ir pastoviam slėgiui; p - dujų slėgis; p cr - kritinis dujų slėgis; R yra universali dujų konstanta; T 0 - absoliuti dujų temperatūra; λ 0 - pradinio mišinio šilumos laidumas.
Taigi, norint apskaičiuoti liepsnos slopintuvų gebėjimą sulaikyti liepsną, reikalingi šie pradiniai duomenys:
- normalūs degių dujų mišinių liepsnos plitimo greičiai;
- tikrasis tam tikro liepsnos slopintuvo didžiausių gesinimo kanalų dydis.
Jei gauta vertė yra didesnė nei Re cr = 65, liepsnos slopintuvas netrukdys šio degaus mišinio liepsnai plisti ir atvirkščiai, jei Re< 65, огнепреградитель задержит распространение пламени. Запас надежности огнепреградителя, который находят из отношения Ре кр к вычисленному значению Ре, должен составлять не менее 2:
P \u003d Re cr / Re \u003d 65 / Re\u003e 2.0 (8.34)
Remiantis tuo, kad Pe cr yra pastovus ties liepsnos užgesimo riba, galima apskaičiuoti apytikslį bet kurio degiojo mišinio kanalų kritinį skersmenį, jei žinomas liepsnos plitimo greitis, taip pat ugnies šilumos talpa ir šilumos laidumas. dujų sistema. Rekomenduojami šie kritiniai gesinimo kanalo skersmenys, mm:
- deginant dujų ir oro mišinį - 2,9 metanui ir 2,2 propanui ir etanui;
- deginant deguonies mišinius vamzdžiuose (esant 0,1 MPa absoliučiam slėgiui laisvo degimo produktų plėtimosi sąlygomis) - 1,66 metanui ir 0,39 propanui ir etanui.
Ryžiai. 8.10. Liepsnos slopintuvų tipai:
a - supakuotas; b - kasetė; c - lamelinis; g - tinklelis; e - kermetas
Struktūriškai liepsnos slopintuvai skirstomi į keturis tipus (8.10 pav.):
- su antgaliu, pagamintu iš granuliuotų medžiagų;
- su tiesioginiais kanalais;
- iš keramikos arba metalo pluošto;
- Tinklelis.
Pagal montavimo būdą - į tris tipus: ant vamzdžių, skirtų dujoms išmesti į atmosferą arba ant degiklio; apie ryšius; prieš dujinius degiklius.
Montuojamo liepsnos slopintuvo korpuse, tarp grotelių, yra antgalis su užpildu (stiklo arba porceliano rutuliukai, žvyras, korundas ir kitos patvarios medžiagos granulės). Kasetinis gaisro gesintuvas – tai korpusas, kuriame iš gofruotų ir plokščių metalinių juostų, sandariai suvyniotų į ritinį, sumontuota gaisro gesinimo kasetė. Plokštinio liepsnos slopintuvo atveju - plokštumos lygiagrečių metalinių plokščių paketas su griežtai apibrėžtu atstumu tarp jų. Prie tinklinio liepsnos slopintuvo korpuse yra tvirtai suspaustų metalinių tinklelių paketas. Keraminis-metalinis liepsnos slopintuvas yra korpusas, kurio viduje yra sumontuota akyta metalo-keraminė plokštė plokščio disko arba vamzdžio pavidalu.
Dažniausiai naudojami tinkliniai liepsnos slopintuvai (jie pradėti montuoti XIX a. pradžioje kalnakasių lempose (Devi lempose), kad būtų išvengta ugnies sprogimo). Šie liepsnos slopintuvai rekomenduojami dujinį kurą deginančių įrenginių apsaugai. Liepsnos slopintuvas susideda iš kelių sluoksnių žalvario tinklelio, kurio tinklelio dydis 0,25 mm, įterptų tarp dviejų perforuotų plokščių. Tinklo paketas sutvirtintas nuimamame laikiklyje.
Liepsnos slopintuvo korpusas pagamintas iš ketaus arba aliuminio lydinio ir susideda iš dviejų identiškų dalių, sujungtų varžtais su nuimamu spaustuku, esančiu tarp jų. Be minėtų sausų liepsnos slopintuvų, dujotiekiams apsaugoti nuo sprogstamosios bangos ir liepsnos patekimo apdorojant metalus dujų liepsnoje plačiai naudojamos skystos apsauginės spynos, taip pat dujomis užpildyti vamzdynai ir aparatai nuo prasiskverbimo į dujotiekį. į juos patenka deguonies ir oro.
Skysti sandarikliai turi:
- užkirsti kelią sprogstamosios bangos sklidimui atvirkštinio smūgio metu ir užsiliepsnojant dujoms;
- apsaugoti dujotiekį nuo deguonies ir oro patekimo į jį;
- užtikrinti minimalų hidraulinį pasipriešinimą dujų srautui. Be to, skystis iš sklendės neturėtų būti nuneštas pastebimais kiekiais lašelių pavidalu.
8.10. DEGIMO PRINCIPAI
Dujų degimo procesai yra pagrįsti principais, paprastai vadinamais kinetiniais ir difuziniais. Taikant kinetinį principą, prieš prasidedant degimui sukuriamas vienalytis mišinys su nedideliu oro pertekliumi. Tokio mišinio degimas vyksta trumpoje skaidrioje liepsnoje, o liepsnoje nesusidaro suodžių dalelės. Dujoms deginti pagal kinetinį principą naudojami specialūs maišytuvai arba įpurškimo degikliai, kurie paruošia homogeninį dujų ir oro mišinį, kurio pirminio oro pertekliaus santykis α 1 = 1,02: 1,05.
Esant mažesniam pirminio oro kiekiui, pagal kinetinį principą vyksta tik pradinis degimo etapas, kol naudojamas deguonis, kuris yra mišinyje su dujomis. Likusios dujos ir nepilno degimo produktai sudegina išorinės deguonies difuzijos (antrinio oro) būdu, t.y. pagal d ir f u z ir o n n o m ties principu. Dėl α 1< 1 у факела есть два видимых фронта горения: внутренний, возникающий за счет первичного воздуха, и наружный, образующийся за счет диффузии кислорода из окружающей среды. Общая высота пламени при таком горении возрастает, а температура - несколько снижается. Устойчивость пламени и его прозрачность зависят от содержания первичного воздуха в смеси: чем оно выше, тем ниже устойчивость пламени, больше его прозрачность, и наоборот.
Dujų degimo su α 1 principas< 1,0 является п р о м е ж у т о ч н ы м (между кинетическим и диффузионным). С учетом этого принципа конструируются все газовые аппараты с инжекционными горелками. В таких горелках содержание первичного воздуха в смеси принимается в зависимости от вида газа таким, чтобы:
- liepsnoje nebuvo suodžių dalelių;
- degimo stabilumas buvo užtikrintas keičiant šiluminę galią bet kokiomis praktikoje būtinomis ribomis.
Pagal difuzijos principą (α 1 = 0) degimo ir maišymosi procesai vystosi lygiagrečiai. Kadangi maišymo procesai vyksta daug lėčiau nei degimo procesai, degimo greitį ir užbaigtumą lemia dujų ir oro maišymo greitis ir išsamumas. Dujų maišymasis su oru šiuo atveju gali vykti difuzijos būdu (lėta molekulinė arba turbulentinė, įskaitant molekulinę kaip paskutinę stadiją). Atitinkamai skiriasi degimo greitis ir difuzinės liepsnos struktūra.
Tokio deginimo ypatybės:
- liepsnos stabilumas, kai šiluminė galia keičiasi nuo nulio iki didžiausios galimos pagal atskyrimo sąlygas;
- temperatūros pastovumas per visą liepsnos aukštį;
- galimybė jį paskirstyti dideliuose savavališkuose paviršiuose;
- degiklių kompaktiškumas ir jų gamybos paprastumas;
- didelis liepsnos aukštis ir pirolitinių procesų neišvengiamumas, dėl kurio susidaro ryški suodžių liepsna.
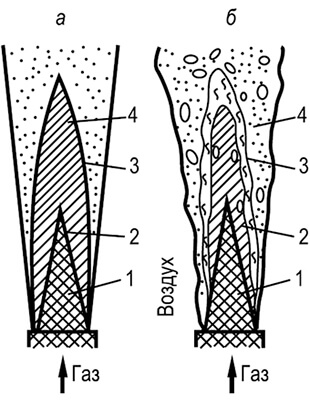
Ryžiai. 8.11. Laisvosios liepsnos struktūra:
a - laminarinė liepsna; b - turbulentinė liepsna
Difuzinis degimas gali būti paverstas kinetiniu arba tarpiniu degimu, jei maišymas vyksta anksčiau nei degimo procesai. Praktiškai tai galima pasiekti naudojant priverstinį oro tiekimą, dėl kurio susidaro beveik homogeniškas dujų ir oro mišinys, kurio α 1 > 1,0, kuris dega skaidria liepsna.
Degimo principams iliustruoti pav. 8.11. pateiktos laisvos liepsnos schemos: laminarinė ir turbulentinė. Laminarinis degiklis atsiranda dėl abipusės molekulinės dujų ir oro difuzijos. Kūgio šerdies 1 viduje yra grynos dujos, ištekančios iš vamzdžio laminariniu srautu. 2 zonoje - dujų ir degimo produktų mišinys, 3 zonoje - degimo produktų ir oro mišinys. 4 riba yra lygus kūginis liepsnos frontas, į kurį iš išorės sklinda oro molekulės, o iš vidaus – dujų molekulės. Degimo produktai iš dalies pasklinda link dujų, intensyviai kaitindami jas priešliepsnio zonoje. Dėl to vyksta angliavandenilių pirolizė ir susidaro suodžių dalelės, kurios suteikia liepsnai ryškų švytėjimą.
Degimą gali sustiprinti maišymo srautų turbulencija. Turbulentinė liepsna neturi aiškaus kūginio degimo fronto, ji yra „neryški“ ir pulsuojant suskaidoma į atskiras daleles.
Liepsnos struktūrą sudaro grynų dujų šerdis 1, santykinai lėto degimo zona 2, difuzinė intensyviausio degimo zona 3 su dideliu degimo produktų kiekiu ir 4 degimo zona, kurioje vyrauja oras. Tarp zonų nėra aiškiai apibrėžtų ribų, jos nuolat kinta priklausomai nuo srauto turbulencijos laipsnio. Turbulentinės liepsnos savybės yra šios:
- degimo proceso eiga beveik visame tūryje;
- degimo intensyvumo didinimas;
- didelis liepsnos skaidrumas;
- mažesnis jo atsparumas atsiskyrimui.
Turbulentinis dujų deginimas plačiai naudojamas įvairių katilų ir krosnių krosnyse. Degimo procesui suintensyvinti naudojama tiek natūrali (dėl padidėjusių greičių), tiek dirbtinė srauto turbulencija, pavyzdžiui, sukant oro srautą ir tiekiant į jį plonas dujų čiurkšles skirtingais kampais.
8.11. NEVISKO DEGIMO PRODUKTŲ SUDARYMO IR KENKSINGŲ MEDŽIAGŲ KONCENTRACIJOS JUOSE SUMAŽINIMO SĄLYGOS
Deginant degiąsias dujas, degimo produktuose gali būti tiek visiško (anglies dioksido ir vandens garų), tiek nepilno degimo komponentų (anglies monoksido, vandenilio, nesočiųjų, sočiųjų, aromatinių angliavandenilių ir suodžių dalelių). Be to, degimo produktuose visada randama azoto oksidų. Nepilno degimo produktų buvimas didelėmis koncentracijomis yra nepriimtinas, nes dėl to oras užteršiamas toksinėmis medžiagomis ir sumažėja įrenginių, naudojančių dujinį kurą, efektyvumas.
Pagrindinės didelio jų kiekio priežastys:
- deginamos dujos, kai nepakanka oro;
- prastas degiųjų dujų ir oro maišymas prieš degimą ir degimo metu;
- per didelis liepsnos aušinimas prieš pasibaigiant degimo reakcijoms.
Metano degimo reakcijas (priklausomai nuo deguonies koncentracijos reaguojančiame mišinyje) galima apibūdinti tokiomis lygtimis:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O + 800,9 MJ / mol
stechiometriniu santykiu arba su oksiduojančios medžiagos pertekliumi;
CH 4 + O 2 \u003d CO + H 2 + H 2 O + Q ir CH 4 + 0,5O 2 \u003d CO + 2H 2 O + Q
kai nėra oksiduojančios medžiagos.

Ryžiai. 8.12. Tarpiniai degimo produktai
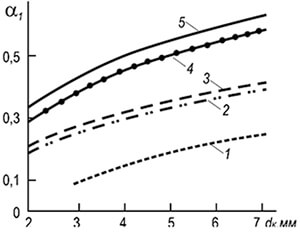
Ryžiai. 8.13. Pirminis oro kiekis,
kuris neleidžia susidaryti
geltoni liežuviai liepsnose
Dujos: 1 - koksas;
2 - gamtinių dujų telkiniai;
3 - naftos telkiniai;
4 - propanas; 5 - butanas
Ant pav. 8.12 parodyta apytikslė vidutinė kai kurių tarpinių junginių - vandenilio, anglies monoksido, etileno, acetileno ir santykinai nedidelio skaičiaus sočiųjų ir paprastų aromatinių junginių - bei anglies dioksido, atsirandančių liepsnoje difuzinio gamtinių dujų degimo metu (97%), sudėtis. Dujos buvo deginamos laminariniame degiklyje, dujos ištekėjo iš 12 mm skersmens vamzdžio. Bendras liepsnos aukštis 130–140 mm.
Didžiausia vandenilio ir acetileno koncentracija pasiekiama maždaug tame pačiame liepsnos aukštyje, jie išnyksta beveik vienu metu liepsnos šviesos zonos viršuje. Iš visų tarpinių junginių, susidarančių liepsnoje (išskyrus suodžių daleles), anglies monoksidas išnyksta paskutinis. Tai leidžia pagal indeksą spręsti apie dujų degimo užbaigtumą. Degimo produktuose visada yra azoto oksidų, kurių didžiausia koncentracija susidaro intensyvaus anglies monoksido ir vandenilio perdegimo zonose.
Angliavandenilių dujų degimas, kai trūksta oksidatoriaus, sukelia suodžių dalelių susidarymą, todėl liepsna tampa geltona. Suodžių deginimo procesas vyksta etapais ir palyginti lėtai. Kartais susidariusių suodžių dalelių perdegimas vėluoja ir gali visiškai sustoti patekus į žemos temperatūros degiklio sritį arba kai šilumos mainų paviršiai nuplaunami liepsnos. Taigi šviečiančios liepsnos buvimas visada rodo pirolitinių procesų atsiradimą ir cheminio degimo neužbaigtumo galimybę, ypač mažo dydžio ekranuotų katilų krosnyse.
Suodžių dalelių susidarymo prevencija pasiekiama iš anksto sumaišius angliavandenilių dujas su pakankamu oksidatoriaus kiekiu. Pirminio oro kiekis mišinyje, prie kurio atsiranda skaidri liepsna, priklauso ne tik nuo angliavandenilių rūšies, bet ir nuo maišymosi su antriniu oru sąlygų (degiklių degimo kanalų skersmens) (8.13 pav. ). Pasienyje ir virš kreivių liepsna yra skaidri, o žemiau vingių turi geltonus liežuvėlius. Kreivės rodo, kad pirminio oro kiekis mišinyje didėja didėjant anglies atomų skaičiui molekulėje ir degiklių degimo kanalų skersmeniui. Pirminio oro pertekliaus α 1 santykis mišinyje, kuriam esant geltonos liepsnos išnyksta, atsižvelgiant į aukščiau nurodytus veiksnius, gali būti nustatytas mažiems degiklio ugnies kanalams:
α 1 \u003d 0,12 (m + n / 4) 0,5 (d k / d 0) 0,25 (8,35)
čia m ir n yra anglies ir vandenilio atomų skaičius molekulėje arba vidutinis jų skaičius sudėtingose dujose; d k - degiklio ugnies kanalų skersmuo, mm; d 0 - degiklio kanalo atskaitos skersmuo (1 mm).
Užtikrinti degimo užbaigtumą praktinėmis sąlygomis yra gana sudėtinga užduotis, priklausanti ne tik nuo dujų degimo principo, bet ir nuo liepsnos išsivystymo krosnies tūryje sąlygų. Buitiniams prietaisams ir kitiems įrenginiams, išleidžiantiems degimo produktus į atmosferą, keliami aukščiausi degimo užbaigtumo reikalavimai. Dujų degimas tokiuose įrenginiuose yra sunkiausias, nes tai susiję su šaltų šilumos mainų paviršių plovimu liepsna. Dujų deginimui buitinėse krosnyse naudojami įpurškimo kelių degiklio degikliai, kurie sudaro homogeninį mišinį su pirminio oro pertekliaus koeficientu α 1< 1. Недостающий для сгорания газа воздух поступает за счет диффузии из окружающей атмосферы.
Ryžiai. 8.14. Anglies monoksido koncentracija
degimo produktuose dujinėje viryklėje
a – degiklis su periferiniu antrinio oro padavimu;
b - su centriniu ir periferiniu antriniu oro tiekimu
1 - gamtinės dujos, degiklis su periferiniu tiekimu
antrinis oras, atstumas iki indų dugno 25 mm;
2–4 - gamtinės dujos, degiklis su periferiniu ir
centrinis antrinis oro padavimas, atstumas
iki indų apačios, mm: 2 - 25, 3 - 18, 4 - 10;
5 - suskystintos dujos, degiklis su centriniu ir periferiniu
antrinis oro padavimas, atstumas iki indo dugno 25 mm;
6 - suskystintos dujos, degiklis su periferiniu tiekimu
Ant pav. 8.14 pateiktos 2 degiklių buitinių dujinių viryklių degiklių ir vidutinės anglies monoksido CO koncentracijos natūralaus metano (95 tūrio proc.) ir propano (93 tūrio proc.) degimo produktuose diagramos, kai degikliai veikia vardine šiluma. išvestis. Skirtumas tarp degiklių yra tas, kad antrinis oras į vieną iš jų tiekiamas tik iš periferijos, o į kitą – tiek iš periferijos, tiek iš centrinio kanalo.
Dujų degimo užbaigtumas priklauso nuo pirminio oro pertekliaus mišinyje koeficiento, atstumo nuo degiklio ugnies kanalų iki indo dugno, degiųjų dujų rūšies ir antrinio oro padavimo būdo. Tuo pačiu metu padidėjus pirminio oro kiekiui mišinyje, taip pat padidėjus atstumui nuo degiklio iki indo dugno, sumažėja anglies monoksido koncentracija degimo produktuose. Minimali anglies monoksido koncentracija atitinka pirminio oro pertekliaus koeficientą α 1 = 0,6 ir daugiau ir atstumą nuo degiklio iki indo dugno 25 mm, o didžiausią - α 1 = 0,3 ir žemiau bei atstumą nuo degiklis iki indo dugno 10 mm. Be to, 15–20% padidėjus degiklių šiluminei galiai dėl padidėjusio dujų slėgio, anglies monoksido koncentracija degimo produktuose padidėja 1,2–1,3 karto, o dėl degimo šilumos. dujų, 1,5–2 kartus.
Ypatingas dėmesys turėtų būti skiriamas aromatinių junginių – benzeno, policiklinio benzpireno, benzantraceno ir kt. – atsiradimui degimo metu, nes kai kurie iš jų yra kancerogeniški. Jų formavimosi procesas yra labai sudėtingas ir vyksta etapais. Pirmajame etape atsiranda acetilenas ir jo dariniai. Liepsnos zonoje šiose medžiagose vyksta grandinės pailgėjimo procesai, kai trigubos anglies ryšiai persitvarko į dvigubus. Dėl ciklizacijos ir dehidratacijos atsiranda įvairių aromatinių junginių, įskaitant policiklinius.
8.16 lentelė. Vidutinė anglies monoksido ir benzo(a)pireno koncentracija degimo produktuose, priklausomai nuo dujų rūšies, degiklio tipo ir pirminio oro pertekliaus koeficiento (degiklio šiluminė apkrova – 1600 kcal/val., atstumas nuo degiklio iki indo dugno - 24–26 mm)
| Degiklio tipas | Vidutinė koncentracija | |
|---|---|---|
| anglies monoksido, mg/l (pagal α = 1,0) |
benzo(a)pirenas, mcg / 100 m3 |
|
| Gamtinių dujų | ||
esant α i = 0,60 ÷ 0,70 |
0,10 | Nerastas |
esant α i = 0,30 ÷ 0,35 |
1,20 | Pėdsakai |
esant α i = 0,60 ÷ 0,70 |
0,50 | Nerastas |
esant α i = 0,30 ÷ 0,35 |
0,12 | Nerastas |
| Suskystintos dujos | ||
| Degiklis su periferiniu antriniu oro tiekimu: | ||
esant α i = 0,60 ÷ 0,70 |
0,30 | 0,03 |
esant α i = 0,30 ÷ 0,35 |
1,20 | 1,10 |
| Degiklis su centriniu ir periferiniu antriniu oro tiekimu: | ||
esant α i = 0,60 ÷ 0,70 |
0,07 | 0,02 |
esant α i = 0,30 ÷ 0,35 |
1,00 | 0,045 |
Lentelės duomenys. 8.16 rodo, kad abiejų tipų degikliuose deginant gamtines dujas, kurių pirminio oro pertekliaus koeficientas α 1 \u003d 0,6 ir didesnis, anglies monoksido koncentracija degimo produktuose atitinka GOST 5542–87 reikalavimus.
8.17 lentelė. Atstumas tarp įpurškimo vienos eilės degiklių degimo kanalų kraštų, priklausomai nuo jų matmenų ir pirminio oro pertekliaus koeficiento
| Gaisrinių kanalų skersmenys, mm | Atstumai tarp kanalų kraštų, mm esant skirtingoms pirminio oro pertekliaus koeficiento vertėms α 1 | ||||
|---|---|---|---|---|---|
| 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | |
| 2,0 | 11 | 8 | 6 | 5 | 4 |
| 3,0 | 15 | 12 | 9 | 7 | 5 |
| 4,0 | 16 | 14 | 11 | 9 | 7 |
| 5,0 | 18 | 15 | 14 | 12 | 10 |
| 6,0 | 20 | 18 | 16 | 14 | 12 |
Tyrimai parodė, kad atstumai tarp ugnies kanalų kraštų, kurie užtikrina greitą liepsnos plitimą, neleidžia jiems susilieti, priklauso nuo jų dydžio ir pirminio oro kiekio mišinyje, mažėja jam didėjant. Optimalūs atstumai tarp kanalų kraštų, užtikrinantys pakankamą dujų degimo užbaigtumą ir greitą liepsnos plitimą, pateikti lentelėje. 8.17. Kai šaudymo kanalai yra išdėstyti dviem eilėmis šaškių lentos tvarka, atstumai tarp kraštų gali būti imami pagal tą pačią lentelę. Šiuo atveju atstumai tarp eilučių turėtų būti 2–3 kartus didesni nei atstumai tarp kanalų.
Ryžiai. 8.15. Anglies monoksido, acetileno koncentracija,
etanas, etilenas ir benzo(a)pirenas degimo produktuose
vidutinio slėgio dujos įpurškimo degiklyje
Daugelio eksperimentinių duomenų apibendrinimas leido gauti vidutines koncentracijos kreives įvairių komponentų degimo produktuose, kokybiškai ir kiekybiškai charakterizuojančias degimo procesą (8.15 pav.). Visiškas homogeninio dujų ir oro mišinio sudegimas pasiekiamas tik tada, kai pirminio oro pertekliaus koeficientas α = 1,05 ir didesnis. Sumažėjus oro kiekiui mišinyje, ypač esant α< 1,0, возрастает концентрация оксида углерода СО, ацетилена С 2 Н 2 , этилена С 2 Н 4 , пропилена С 3 Н 6 и пропана С 3 Н 8 , а также бенз(а)-пирена С 20 Н 9 . Также возрастает концентрация и других компонентов - водорода, бензола и др.
Be nagrinėjamų nepilno degimo produktų, degant dujoms visada susidaro tam tikras kiekis azoto oksidų, kurie susidaro aukštos temperatūros zonose tiek pasibaigus pagrindinėms degimo reakcijoms, tiek degant. Didžiausia NO x koncentracija susidaro paskutiniuose etapuose, atitinkančius dujų išdegimą ir intensyvų tarpinių produktų vandenilio ir anglies monoksido degimą.
Pagrindinis junginys deginant dujų ir oro mišinius yra azoto oksidas. Grandininės reakcijos pradžia siejama su atominiu deguonimi, atsirandančiu aukštos temperatūros zonose dėl molekulinio deguonies disociacijos:
O 2 -› 2O - 490 kJ / mol (8,36)
O + N 2 -› NO + N - 300 kJ / mol (8,37)
N + O 2 –› 2NO + 145 kJ/mol (8,38)
pusiausvyros reakcija
N 2 + O 2 -› 2NO - 177 kJ / mol (8,39)
Atominio deguonies susidarymas vyksta ir dalinės degimo produktų disociacijos metu: mažėjant temperatūrai ir esant deguoniui, dalis susidariusio azoto oksido (1–3 tūr.%) oksiduojasi į azoto dioksidą NO 2 . Reakcija intensyviausiai vyksta po azoto oksido išleidimo į atmosferą. Pagrindiniai įtakojantys veiksniai:
- temperatūra reakcijos zonose;
- oro pertekliaus santykis ir reaguojančių komponentų kontakto laikas.
Liepsnos temperatūra priklauso nuo dujų cheminės sudėties, oro kiekio dujų ir oro mišinyje, jo homogeniškumo laipsnio ir šilumos pašalinimo iš reakcijos zonos. Didžiausia galima azoto oksido koncentracija tam tikroje temperatūroje, t. %, galima apskaičiuoti naudojant formulę
NO p \u003d 4,6e -2150 / (RT) / √ O 2 N 2 (8,40)
kur NO p yra azoto oksido pusiausvyros koncentracija, t. %; R yra universali dujų konstanta; T - absoliuti temperatūra, K; O 2 ir N 2 - koncentracija, t. % atitinkamai deguonies ir azoto.
Didelė azoto oksido koncentracija, atitinkanti pusiausvyrą, susidaro deginant dujas galingų garo generatorių krosnyse ir aukštos temperatūros atvirose, kokso ir panašiose krosnyse. Mažos ir vidutinės galios katiluose, mažose šildymo ir šiluminėse krosnyse, kuriose didelis šilumos pašalinimas ir trumpas komponentų buvimo laikas aukštos temperatūros zonose, azoto oksido išeiga yra mažesnė. Be to, kuo trumpesnis reaguojančių komponentų buvimo laikas aukštos temperatūros zonoje, tuo mažiau azoto oksido yra degimo produktuose.
Dujų degimas spinduliavimo degikliuose ir verdančiojo sluoksnio sluoksnyje taip pat yra efektyvus: tokiais atvejais vyksta homogeninio dujų ir oro mišinio degimas mikrofragmentu, kai oro pertekliaus koeficientas α = 1,05, labai intensyviai šalinant šilumą iš reakcijos zonos. Azoto oksidų koncentracija degant dujoms spinduliavimo degikliuose yra apie 40, o verdančiojo sluoksnio - 80-100 mg/m 3 . Spinduliuojančių degiklių ir ugniai atsparių grūdelių dydžio sumažinimas verdančiojoje sluoksnyje padeda sumažinti azoto oksidų išmetimą.
Sukaupti duomenys leido atlikti daugybę pakeitimų katilų ir šildymo įrangos konstrukcijoje, užtikrinant ne tik aukštą efektyvumą ir mažą nepilno degimo produktų koncentraciją, bet ir sumažinant azoto oksidų išmetimą į atmosferą. Šie pakeitimai apima:
- sumažinti aukštos temperatūros tunelių ilgį ir perkelti degimą iš jų į krosnis;
- degimo stabilizatorių, o ne keraminių tunelių naudojimas blefų kūnų arba žiedinės liepsnos pavidalu;
- plokščios liepsnos su padidintu šilumos perdavimo paviršiumi organizavimas;
- liepsnos išsklaidymas didinant degiklių skaičių arba naudojant blokinius degiklius;
- laipsniškas oro tiekimas į reakcijos zoną;
- tolygus šilumos srautų paskirstymas krosnyje, krosnių sijojimas ir jų padalijimas į skyrius tinkleliais;
- dujų degimo difuzinio principo taikymas (difuzinis degimas leidžiamas tik tais atvejais, kai galima užtikrinti laisvą liepsnos vystymąsi neplaunant šilumos mainų paviršių).
Veiksmingiausias azoto oksidų išmetimo sumažinimas pasiekiamas vienu metu naudojant kelis metodus.
Dujų deginimas yra šių procesų derinys:
Degiųjų dujų maišymas su oru
mišinio pašildymas
terminis degiųjų komponentų skilimas,
Degiųjų komponentų uždegimas ir cheminis derinys su atmosferos deguonimi, lydimas degiklio susidarymo ir intensyvaus šilumos išsiskyrimo.
Metano degimas vyksta pagal reakciją:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Dujoms deginti reikalingos sąlygos:
Užtikrinti reikiamą degiųjų dujų ir oro santykį,
kaitinimas iki užsidegimo temperatūros.
Jei dujų ir oro mišinys yra mažesnis už apatinę degumo ribą, jis nedegs.
Jei dujų ir oro mišinyje yra daugiau dujų nei viršutinė degumo riba, jis visiškai nesudegs.
Visiško dujų degimo produktų sudėtis:
CO 2 – anglies dioksidas
H 2 O – vandens garai
* N 2 - azotas (degimo metu nereaguoja su deguonimi)
Nevisiško dujų degimo produktų sudėtis:
CO – anglies monoksidas
C - suodžiai.
1 m 3 gamtinių dujų sudeginimui reikia 9,5 m 3 oro. Praktiškai oro suvartojimas visada didesnis.
Požiūris faktinis suvartojimas oras teoriškai reikalingas srautas vadinamas oro pertekliaus koeficientu: α = L/L t .,
Kur: L- faktinės išlaidos;
L t – teoriškai reikalingas srautas.
Oro pertekliaus koeficientas visada yra didesnis nei vienas. Gamtinių dujų atveju jis yra 1,05–1,2.
2. Momentinių vandens šildytuvų paskirtis, įtaisas ir pagrindinės charakteristikos.
Dujiniai vandens šildytuvai. Jie skirti vandens pašildymui iki tam tikros temperatūros nutekėjimo metu.Tekančio vandens šildytuvai skirstomi pagal šiluminės galios apkrovą: 33600, 75600, 105000 kJ, pagal automatizavimo laipsnį - į aukščiausias ir pirmas klases. efektyvumą vandens šildytuvai 80%, oksido kiekis ne didesnis kaip 0,05%, degimo produktų temperatūra už traukos pertraukiklio yra ne mažesnė kaip 180 0 C. Principas pagrįstas vandens šildymu išleidimo laikotarpiu.
Pagrindiniai momentinių vandens šildytuvų mazgai yra: dujų degiklis, šilumokaitis, automatikos sistema ir dujų išvadas. Žemo slėgio dujos tiekiamos į įpurškimo degiklį. Degimo produktai praeina per šilumokaitį ir išleidžiami į kaminą. Degimo šiluma perduodama vandeniui, tekančiam per šilumokaitį. Gaisro kamerai aušinti naudojama gyvatė, per kurią cirkuliuoja vanduo, einantis per šildytuvą. Dujiniuose momentiniuose vandens šildytuvuose yra įrengti dujų išmetimo įtaisai ir traukos pertraukikliai, kurie, esant trumpam traukos pažeidimui, neleidžia užgesti dujinio degiklio liepsnai. Yra dūmtakio vamzdis prijungimui prie kamino.
Dujinis momentinis vandens šildytuvas - VPG. Korpuso priekinėje sienelėje yra: dujų čiaupų valdymo rankenėlė, mygtukas, skirtas įjungti solenoidinį vožtuvą ir apžvalgos langas, skirtas stebėti pagrindinio ir pagrindinio degiklio liepsną. Įrenginio viršuje yra dūmų šalinimo įrenginys, apačioje yra vamzdžių atšakos, skirtos įrenginiui prijungti prie dujų ir vandens sistemų. Dujos patenka į solenoidinį vožtuvą, vandens ir dujų degiklio bloko dujų uždarymo vožtuvas paeiliui įjungia pilotinį degiklį ir tiekia dujas į pagrindinį degiklį.
Dujų srauto blokavimas į pagrindinį degiklį, privalomai veikiant uždegiklį, atliekamas elektromagnetiniu vožtuvu, veikiančiu iš termoporos. Dujų tiekimo į pagrindinį degiklį blokavimas, atsižvelgiant į vandens įsiurbimo buvimą, atliekamas vožtuvu, varomu per kotą iš vandens bloko vožtuvo membranos.
Gamtinės dujos šiandien yra plačiausiai naudojamas kuras. Gamtinės dujos vadinamos gamtinėmis dujomis, nes jos išgaunamos iš pačių Žemės gelmių.
Dujų degimo procesas yra cheminė reakcija, kurios metu gamtinės dujos sąveikauja su ore esančiu deguonimi.
Dujiniame kure yra degioji dalis ir nedegioji dalis.
Pagrindinis degiųjų gamtinių dujų komponentas yra metanas – CH4. Jo kiekis gamtinėse dujose siekia 98%. Metanas yra bekvapis, beskonis ir netoksiškas. Jo degumo riba yra nuo 5 iki 15%. Būtent šios savybės leido naudoti gamtines dujas kaip vieną iš pagrindinių kuro rūšių. Metano koncentracija yra daugiau nei 10% pavojinga gyvybei, todėl dėl deguonies trūkumo gali uždusti.
Norint aptikti dujų nuotėkį, dujos yra odoruojamos, kitaip tariant, pridedama stipriai kvepianti medžiaga (etilmerkaptanas). Tokiu atveju dujas galima aptikti jau esant 1 % koncentracijai.
Be metano, gamtinėse dujose gali būti degiųjų dujų, tokių kaip propanas, butanas ir etanas.
Norint užtikrinti kokybišką dujų degimą, į degimo zoną reikia tiekti oro pakankamais kiekiais ir pasiekti gerą dujų susimaišymą su oru. Optimalus laikomas santykis 1: 10. Tai yra, dešimt dalių oro patenka į vieną dujų dalį. Be to, būtina sukurti norimą temperatūros režimą. Kad dujos užsidegtų, jos turi būti pakaitintos iki užsiliepsnojimo temperatūros ir ateityje temperatūra neturi nukristi žemiau užsidegimo temperatūros.
Būtina organizuoti degimo produktų pašalinimą į atmosferą.
Visiškas sudegimas pasiekiamas, jei į atmosferą išmetamuose degimo produktuose nėra degių medžiagų. Šiuo atveju anglis ir vandenilis susijungia ir sudaro anglies dioksidą bei vandens garus.
Vizualiai, visiškai sudegus, liepsna yra šviesiai mėlyna arba melsvai violetinė.
Visiškas dujų deginimas.
metanas + deguonis = anglies dioksidas + vanduo
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Be šių dujų, su degiomis dujomis į atmosferą patenka azotas ir likęs deguonis. N 2 + O 2
Jei dujos nesudega iki galo, į atmosferą išmetamos degios medžiagos – anglies monoksidas, vandenilis, suodžiai.
Nevisiškas dujų degimas atsiranda dėl nepakankamo oro. Tuo pačiu metu liepsnoje vizualiai atsiranda suodžių liežuvėliai.
Nevisiško dujų degimo pavojus yra tas, kad anglies monoksidas gali apsinuodyti katilinės personalu. 0,01–0,02% CO kiekis ore gali sukelti lengvą apsinuodijimą. Didesnė koncentracija gali sukelti sunkų apsinuodijimą ir mirtį.
Susidarę suodžiai nusėda ant katilų sienelių, todėl pablogėja šilumos perdavimas aušinimo skysčiui, o tai mažina katilinės efektyvumą. Suodžiai praleidžia šilumą 200 kartų blogiau nei metanas.
Teoriškai 1m3 dujų sudeginti reikia 9m3 oro. Realiomis sąlygomis reikia daugiau oro.
Tai yra, reikalingas perteklinis oro kiekis. Ši reikšmė, žymima alfa, parodo, kiek kartų daugiau oro suvartojama, nei teoriškai reikia.
Alfa koeficientas priklauso nuo konkretaus degiklio tipo ir paprastai nurodomas degiklio pase arba pagal eksploataciją pateikusios organizacijos rekomendacijas.
Padidėjus oro pertekliaus kiekiui virš rekomenduojamo, šilumos nuostoliai didėja. Žymiai padidėjus oro kiekiui, gali įvykti liepsnos atsiskyrimas, sukeldamas avarinę situaciją. Jei oro kiekis yra mažesnis nei rekomenduojama, degimas bus nepilnas, todėl kyla pavojus apsinuodyti katilinės personalui.
Siekiant tiksliau kontroliuoti kuro degimo kokybę, yra prietaisai - dujų analizatoriai, matuojantys tam tikrų medžiagų kiekį išmetamųjų dujų sudėtyje.
Dujų analizatoriai gali būti tiekiami su katilais. Jei jų nėra, atitinkamus matavimus atlieka eksploataciją paleidžianti organizacija, naudodama nešiojamus dujų analizatorius. Sudaromas režimo žemėlapis, kuriame nustatomi būtini valdymo parametrai. Jų laikydamiesi galite užtikrinti normalų visišką kuro degimą.
Pagrindiniai kuro degimo valdymo parametrai yra šie:
- į degiklius tiekiamo dujų ir oro santykis.
- oro pertekliaus santykis.
- plyšys krosnyje.
- Katilo naudingumo koeficientas.
Tuo pačiu katilo naudingumo koeficientas reiškia naudingos šilumos santykį su bendros sunaudotos šilumos verte.
Oro sudėtis
| Dujų pavadinimas | Cheminis elementas | Turinys ore |
| Azotas | N2 | 78 % |
| Deguonis | O2 | 21 % |
| Argonas | Ar | 1 % |
| Anglies dvideginis | CO2 | 0.03 % |
| Helis | Jis | mažiau nei 0,001 % |
| Vandenilis | H2 | mažiau nei 0,001 % |
| Neoninis | Ne | mažiau nei 0,001 % |
| Metanas | CH4 | mažiau nei 0,001 % |
| Kriptonas | kr | mažiau nei 0,001 % |
| Ksenonas | Xe | mažiau nei 0,001 % |
Dujinio kuro deginimas yra šių fizinių ir cheminių procesų derinys: degiųjų dujų maišymas su oru, mišinio kaitinimas, terminis degiųjų komponentų skilimas, degių elementų užsidegimas ir cheminis sujungimas su atmosferos deguonimi.
Stabilus dujų ir oro mišinio degimas galimas nuolat tiekiant reikiamą kiekį degiųjų dujų ir oro į degimo frontą, juos kruopščiai maišant ir kaitinant iki užsidegimo arba savaiminio užsidegimo temperatūros (5 lentelė).
Dujų ir oro mišinio uždegimas gali būti atliekamas:
- kaitinant visą dujų ir oro mišinio tūrį iki savaiminio užsidegimo temperatūros. Šis metodas naudojamas vidaus degimo varikliuose, kur dujų ir oro mišinys kaitinamas greitu suspaudimu iki tam tikro slėgio;
- pašalinių uždegimo šaltinių (uždegiklių ir kt.) naudojimas. Šiuo atveju iki užsidegimo temperatūros įkaista ne visas dujų ir oro mišinys, o dalis jo. Šis metodas naudojamas deginant dujas dujinių prietaisų degikliuose;
- esantį degiklį nuolat degimo procese.
Norint pradėti dujinio kuro degimo reakciją, reikia išleisti tam tikrą energijos kiekį, reikalingą molekuliniams ryšiams nutraukti ir sukurti naujus.
Dujinio kuro deginimo cheminė formulė, nurodanti visą reakcijos mechanizmą, susijusį su daugybės laisvųjų atomų, radikalų ir kitų aktyvių dalelių atsiradimu ir išnykimu, yra sudėtinga. Todėl supaprastinimui naudojamos lygtys, kurios išreiškia pradinę ir galutinę dujų degimo reakcijų būsenas.
Jei angliavandenilių dujos žymimos C m H n, tada šių dujų degimo deguonyje cheminės reakcijos lygtis bus tokia forma.
C m H n + (m + n/4) O 2 = mCO 2 + (n/2) H 2 O,
čia m yra anglies atomų skaičius angliavandenilio dujose; n yra vandenilio atomų skaičius dujose; (m + n/4) - deguonies kiekis, reikalingas visiškam dujų degimui.
Pagal formulę gaunamos dujų degimo lygtys:
- metanas CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
- etanas C 2 H 6 + 3,5 O 2 \u003d 2CO 2 + ZH 2 O
- butanas C 4 H 10 + 6,5O 2 \u003d 4CO 2 + 5H 2 0
- propanas C 3 H 8 + 5O 3 \u003d ZSO 2 + 4H 2 O.
Praktinėmis dujų degimo sąlygomis deguonis nėra paimamas gryna forma, o yra oro dalis. Kadangi orą sudaro 79 % azoto ir 21 tūrio % deguonies, kiekvienam deguonies tūriui reikia 100:21 = 4,76 tūrio oro arba 79:21 = 3,76 tūrio azoto. Tada metano degimo reakciją ore galima parašyti taip:
CH 4 + 2O 2 + 2 * 3,76 N 2 \u003d CO 2 + 2H 2 O + 7,52 N 2.
Iš lygties matyti, kad 1 m 3 metano sudeginti reikia 1 m 3 deguonies ir 7,52 m 3 azoto arba 2 + 7,52 = 9,52 m 3 oro.
Sudegus 1 m 3 metano, gaunama 1 m 3 anglies dvideginio, 2 m 3 vandens garų ir 7,52 m 3 azoto. Žemiau esančioje lentelėje pateikti šie dažniausiai pasitaikančių degiųjų dujų duomenys.
Dujų ir oro mišinio degimo procesui būtina, kad dujų ir oro kiekis dujų ir oro mišinyje būtų tam tikrose ribose. Šios ribos vadinamos degumo ribomis arba sprogumo ribomis. Yra apatinės ir viršutinės degumo ribos. Mažiausias dujų kiekis dujų ir oro mišinyje, išreikštas tūrio procentais, kuriam esant užsiliepsnoja, vadinamas apatine degumo riba. Didžiausias dujų kiekis dujų ir oro mišinyje, kurį viršijus mišinys neužsidega be papildomos šilumos tiekimo, vadinamas viršutine degumo riba.
Deguonies ir oro kiekis degant tam tikroms dujoms
|
Norint sudeginti reikia 1 m 3 dujų, m 3 |
Degant išsiskiria 1 m 3 dujų, m 3 |
Degimo šiluma He, kJ/m3 |
|||||
|
deguonies |
dioksidas anglies |
||||||
|
smalkės |
|||||||
Jei dujų ir oro mišinyje dujų yra mažiau nei apatinė degumo riba, jis nesudegs. Jei dujų ir oro mišinyje nėra pakankamai oro, degimas nevyksta iki galo.
Inertinės dujose esančios priemaišos turi didelę įtaką sprogumo ribos dydžiui. Padidėjus balasto kiekiui (N 2 ir CO 2) dujose susiaurėja degumo ribos, o kai balasto kiekis pakyla virš tam tikrų ribų, dujų ir oro mišinys neužsidega bet kokiu dujų ir oro santykiu (lentelė žemiau) .
Inertinių dujų tūrių skaičius 1 degiųjų dujų tūriui, kai dujų ir oro mišinys nustoja būti sprogus
Mažiausias oro kiekis, reikalingas visiškam dujų degimui, vadinamas teoriniu oro srautu ir žymimas Lt, tai yra, jei dujinio kuro grynasis kaloringumas yra 33520 kJ/m 3 , tada teoriškai reikalingas oro kiekis deginant 1 m 3 dujos
L T\u003d (33 520/4190) / 1,1 \u003d 8,8 m 3.
Tačiau tikrasis oro srautas visada viršija teorinį. Tai paaiškinama tuo, kad esant teoriniams oro srautams labai sunku pasiekti visišką dujų degimą. Todėl bet kuris dujų deginimo įrenginys veikia su tam tikru oro pertekliumi.
Taigi, praktiškas oro srautas
L n = αL T,
kur L n- praktiškas oro suvartojimas; α - oro pertekliaus koeficientas; L T- teorinis oro suvartojimas.
Oro pertekliaus koeficientas visada yra didesnis nei vienas. Gamtinėms dujoms tai yra α = 1,05 - 1,2. Koeficientas α rodo, kiek kartų tikrasis oro srautas viršija teorinį, paimtas kaip vienetas. Jeigu α = 1, tada vadinamas dujų ir oro mišinys stechiometrinis.
At α = 1,2 dujų deginimas atliekamas esant 20% oro pertekliui. Paprastai dujų degimas turėtų vykti esant mažiausia reikšmei a, nes sumažėjus oro pertekliui, sumažėja šilumos nuostoliai su išmetamosiomis dujomis. Degimo metu dalyvaujantis oras yra pirminis ir antrinis. Pirminis oras, patenkantis į degiklį, vadinamas susimaišymui su jame esančiomis dujomis; antraeilis- į degimo zoną patenkantis oras maišomas ne su dujomis, o atskirai.






