Šiluminė degimo teorija. Degimo teorijos pagrindai. Degimo rūšys, jų charakteristikos
Degimas- greitai tekanti cheminė degiųjų medžiagų sąveika su oksidatoriumi, kartu išsiskirianti dideliu šilumos kiekiu ir ryškiu švytėjimu (liepsna). Degimas įmanomas tik esant trims veiksniams: degiajai medžiagai, oksiduojančiai medžiagai ir šilumos šaltiniui.
karščio šaltinis(uždegimas) gali būti atvira liepsna, kibirkštis, karštis, įkaitęs dėl trinties (diržai diržinėje pavaroje), smūgio, slėgio. Šilumos šaltinis taip pat gali būti elektrinė (laidininkų šildymas, lankas), cheminė ir saulės spinduliavimo energija.
Oksidatoriai yra chloras, fluoras, bromas. Dažniausias oksidatorius yra atmosferos deguonis, degimo procesas priklausys nuo jo kiekio ore. Jei ore yra daugiau nei 14-16% deguonies, tada stebimas stabilus degimas. Kai deguonies kiekis yra mažesnis nei 14%, stebimas rūkstymas, o kai jo kiekis mažesnis nei 8-10%, rūkimas taip pat nutrūksta.
degioji medžiaga. Tai gali būti dujos (amoniakas, acetilenas, vandenilis), skysčiai (benzinas, acetonas, alkoholis), kietosios medžiagos (anglis, mediena). Kad kiltų gaisras kietas arba skystis, juos būtina pašildyti šilumos šaltiniu iki tokios temperatūros, kad nuo jų paviršių intensyviai išsiskirtų degūs garai. Pasiekus tam tikrą koncentraciją šie garai užsidega. Degimo procese esančios dujos nekeičia savo agregacijos būsenos.
Yra šie degimo tipai: 1) blyksnis; 2) uždegimas; 3) savaiminis užsidegimas; 4) savaiminis užsidegimas; 5) irimas; 6) sprogimas.
1. Blykstė vadinamas momentiniu deguonies mišinio ore degimu su garais, dujomis, dulkėmis, nelydimas suslėgtų dujų susidarymo. Pliūpsnio temperatūra yra didžiausia žema temperatūra degi medžiaga, kurioje virš jos paviršiaus susidaro garai ar dujos, kurios gali užsidegti nuo uždegimo šaltinio, tačiau tolesniam stabiliam degimui jų susidarymo greitis yra nepakankamas.
Priklausomai nuo šios temperatūros vertės, degūs skysčiai skirstomi į:
a) degūs (degūs skysčiai - benzinas, acetonas, alkoholis) - t vsp ≤ + 45 ° С;
b) degieji skysčiai (GZH - alyvos, dyzelinis kuras, mazutas) - t vsp> + 45 ° С.
2. Uždegimu vadinamas stabiliu ilgalaikiu medžiagos degimu iš šilumos šaltinio. Minimali degiosios medžiagos temperatūra, kuriai esant ji užsiliepsnoja nuo užsiliepsnojimo šaltinio ir po jos pašalinimo toliau dega, vadinama užsidegimo temperatūra. Jis yra didesnis nei pliūpsnio temperatūra.
Degiųjų medžiagų koncentracijos ore, kurioms esant galimas užsidegimas ar sprogimas, yra tam tikrose ribose: apatinė – NVP ir viršutinė – ERW. Degiųjų mišinių užsidegimas neįmanomas, kai koncentracija yra mažesnė už NVP (nepakankamai degiosios medžiagos molekulių mišinyje) ir viršija ERW (nepakankamai deguonies molekulių mišinyje). Kuo didesnis skirtumas tarp ERW ir NWP, tuo pavojingesnė medžiaga. Šių parametrų reikšmės gali sumažėti, pavyzdžiui, padidėjus dulkių ir oro mišinio (DAM) drėgmei, pavyzdžiui, oro mišinio su cukrumi, miltais, anglies dulkėmis.
Pateiksime NWP ir WPW verčių pavyzdžius įvairioms dujoms ir skysčių garams:
Acetilenas 3,5-82%;
Gamtinių dujų 3,8-19,2%;
Benzino 1-6%;
Anglies monoksidas 12,8-75%.
3.Savaiminis užsidegimas- medžiagų užsidegimo iš išorinio šaltinio (liepsnos, įkaitusio ar raudonai įkaitusio kūno) procesas be tiesioginio sąlyčio su ja esant užsidegimo temperatūrai. Ši temperatūra mažės didėjant slėgiui ir daugumai degiųjų dujų ji yra 400–700 ° C, medienos - 340–400 ° C; anglis - 400-500 ° C. Savaiminio užsiliepsnojimo pavyzdys: medienos, popieriaus, esančio šalia atviros liepsnos (be sąlyčio su ja) arba karštų daiktų (anglies, atvira spiralėšildytuvas).
4. Savaiminis užsidegimas medžiagos atsiranda dėl pačioje medžiagoje (medžiagoje) vykstančių fizinių, cheminių ir biologinių reakcijų, dėl kurių užsidega, nesant uždegimo šaltinio.
Laikant dideliais kiekiais šlapių grūdų, šieno, šiaudų ir esant nepakankamam jų vėdinimui, šių medžiagų viduje vyksta biocheminiai procesai (puvimas), išsiskiriant šilumai. Šių medžiagų temperatūra pakyla, didelė jų masė (riedė, rietuvė) neleidžia susidariusiai šilumai išsisklaidyti į aplinką, kuris sukelia gaisrą. Tokios medžiagos prieš sandėliavimą turi būti gerai išdžiovintos. Savaime užsidega ir kontaktiniai audiniai (kombinezonai, valymo priemonės), kuriuose yra aliejaus dėmių ir sukrauti į krūvą be ventiliacijos. Todėl kombinezonus reikia pakabinti taip, kad būtų užtikrintas laisvas oro patekimas, o iš darbo patalpų laiku pašalinti alyvuotas skudurus.
Priklausomai nuo reakcijos greičio, degimo procesas vyksta formoje rūkstantis(greitis keli cm/s), tiesą sakant degimo(keli m/s) ir sprogimas(keli šimtai ir tūkstančiai m/s).
5. Sprogimas- staigus medžiagos fizinės ir cheminės būklės pasikeitimas veikiant aukštai temperatūrai, slėgiui, cheminiams reagentams. Sprogimo metu smarkiai padidėja susidarančių dujų ir garų tūris, išsiskiria didžiulis energijos kiekis, kuris smūgio bangos pavidalu gali atlikti mechaninis darbas(griauti pastatus, statinius, sužaloti žmones).
Medžiagų degimas gali būti visiškas arba neišsamus. Visiškai degant (deguonies perteklius) susidaro nedegūs produktai (CO 2 ir H 2 O).Nepilnai degant (trūksta O 2) susidaro nepilnos oksidacijos produktai (CO, alkoholiai, rūgštys). Jie yra toksiški ir sprogūs. Todėl organizuojant kuro degimo procesą (katiluose, krosnyse), būtina užtikrinti pakankamą deguonies kiekį krosnyje.
Molekulinė degimo energija
Dauguma degimo procesų yra susiję su degiųjų medžiagų, kurių sudėtyje yra vandenilio ir anglies, derinys su atmosferos deguonimi.
Prieš pradėdami svarstyti fizinius ir matematinius degimo teorijos pagrindus, pabandysime molekuliniu lygmeniu suprasti, iš kur atsiranda degimo energija, nuo kurios išskyrimo priklauso visa kita: dujų šildymas, aktyviųjų medžiagų atsiradimas. joje esantys cheminiai centrai ir kt.
Pažiūrėkime, iš ko susideda pagrindinių anglies ir vandenilio mišinio su atmosferos deguonimi reakcijų šiluma.
Rašome pagal lentelės duomenis. 3.1 kietosios anglies, tokios kaip grafitas, nuoseklių oksidacijos reakcijų energijos balansas:
Taigi visos kietosios anglies oksidacijos reakcijos metu išsiskiria 386 kJ/mol:
Energija, išsiskirianti, kai vandenilis susijungia su deguonimi, taip pat yra artimas:
CO molekulė yra bene stipriausia, jos surišimo energija yra 1016 kJ/mol. (Toliau pagal stiprumą yra N2 molekulė, kurios surišimo energija yra 892 kJ/mol. Abi molekulės turi tris jungiamųjų elektronų poras, chemiškai kalbant, trys valentiniai ryšiai. CO molekulėje pirmiausia vienas elektronas eina iš O į C, po to kurie O + ir C- tampa panašūs į azoto atomus; tai patvirtina dipolio momento buvimas CO molekulėje.) CO2 molekulėje antrojo deguonies atomo ryšys yra silpnesnis: pagal lentelę. 3.1
Deguonies surišimo energija šiuose junginiuose yra panaši į pradinės deguonies molekulės surišimo energiją. Nes
tada vienas deguonies atomas sudaro tik 240 kJ / mol. Maža deguonies molekulės surišimo energija yra jos cheminio aktyvumo ir oksidacijos kaip energijos šaltinio naudojimo priežastis.
Anglies atomo surišimo energija grafito (taip pat deimanto ir amorfinės anglies) kristalinėje gardelėje yra labai didelė. Santykinai maža reakcijos energija C(tv) + 0,5O2 = CO + 98 kJ/mol yra skirtumas tarp dviejų labai didelių reikšmių: iš CO rišimosi energijos (256 kJ/mol) reikia atimti pusę O2 suskaidymo energijos atomų (59 kJ/mol ) ir atimti anglies atomo garavimo šilumą. Tiesą sakant, taip nustatoma garavimo šiluma, lygi 671 kJ / mol. Jis taip pat labai didelis.
Kietosios anglies ir dujinio vandenilio pavertimas angliavandenilių kuru įvyksta šiek tiek pasikeitus energijai. Kita vertus, į organines alavo alkoholių, aldehidų ir ketonų, organinių rūgščių, angliavandenių molekules patekus deguonies, išsiskiria beveik tiek pat energijos, kiek išsiskiria visiško degimo metu (iki CO2 ir H2O), natūraliai, suvartojus vienodą kiekį deguonies. Todėl galime apytiksliai daryti prielaidą, kad visiškai sudegus bet kuriam organiniam kurui išsiskiria 419–500 kJ/mol sunaudoto deguonies. Vienintelės išimtys yra kai kurie endoterminiai, daug energijos turintys junginiai, pavyzdžiui, acetilenas ir cianidas, jų degimo šiluma yra didesnė.
Nepilnas degimas yra energetiškai nepalankus ne tik vienai kuro, bet ir sunaudoto deguonies molekulei. Reakcijoje 2Q(tv) + O2 = 2CO išsiskiria tik 210 kJ/mol, o ne 466 deginant vandenilį ir 526 kJ/mol deginant CO.
Dėl stiprios C atomo jungties kietoje anglyje anglis neišgaruoja. Anglis išeina iš kietos būsenos tik kartu su deguonimi CO arba CO2 pavidalu.
Esant nepilnam degimui ir žemai temperatūrai, reakcija 2CO = CO2 + C(kieta) + 41 kJ/mol yra energetiškai palanki tik skaičiuojant kietajai angliai. Skaičiuojant vienam laisvajam anglies atomui, atitinkama reakcija 2СО = СO2 + С – 129 kJ/mol turi didelį energijos barjerą. Todėl suodžiai ir suodžiai degimo metu susidaro tik skylant organinėms molekulėms, turinčioms anglies skeletą, bet ne iš CO.
Dabar pereikime prie oksidacijos reakcijų, susijusių su azotu.
Azoto molekulė N2 yra labai stipri – jos disociacijos energija yra 226 kJ/mol. Todėl N2 ir O2 virsmo į 2NO reakcija yra endoterminė ir dėl termodinaminių priežasčių gali vykti tik esant aukštai temperatūrai.
Aukštesniųjų oksidų (NO2, N2O3, N2O4, N2O5) susidarymas iš azoto ir deguonies vyksta praktiškai nekeičiant energijos (palyginti su N2 ir O2 surišimo energija). Todėl energetiniu požiūriu deguonis, supakuotas į junginius su azotu (CH3-ONO2 yra nitroeteris, CH3(CeH2)(NO2)3 yra trinitrotoluenas), praktiškai prilygsta dujiniam deguoniui. Deguonis, įmontuotas į organinę molekulę, bet sujungtas su azotu, leidžia sukurti medžiagas, kurios išskiria didelę energiją, kai molekulė persitvarko į N2 ir deguonis paverčiamas CO2 ir H2O molekulėmis. Dėl šios priežasties junginiai, kuriuose deguonis yra prijungtas prie azoto (taip pat ir su chloru, grupėse CIO3, ClO4), naudojami kaip parakas ir sprogmenys.
Tai yra bendros idėjos apie molekulinė energija deginimas.
Mes ir toliau kalbame apie klasikinius chemijos pagrindus, kurie yra būtini bet kokiai pirotechnikos praktikai. BA-BACH primena, kad bet koks praktinė pamoka pirotechnika yra pavojinga įmonė, jei ji nėra pagrįsta griežta teorija. Tiems skaitytojams, kurie svarsto, kas gali tapti jų gyvenimo pašaukimu, rekomenduojame mokytis visaverčio kurso, pavyzdžiui, Sergiev Posado taikomosios chemijos tyrimų institute.
Minėdami junginius nurodėme, kad pagrindinė jų priežastis yra elementų giminingumo vienas su kitu laipsnis. Priešingu atveju, esant kai kurioms medžiagoms, elementai lieka abejingi ir jiems kyla daugiau ar mažiau stiprus noras derintis su kitomis. Taigi, pavyzdžiui, kalkės lengvai sugeria sunkias chloro dujas, t.y. su ja susijungia į chlorkalkes; gyvsidabris jungiasi su išlydyta siera ir sudaro gerai žinomą ryškiai raudoną medžiagą, vadinamą „cinobaru“. Cinabaras (Zinnober) vėl gali būti suskaidytas į sierą ir gyvsidabrį, jei sumaišysite jį su medžiaga, kuriai vienas iš sudedamųjų elementų (pavyzdžiui, siera) turėtų stipresnį potraukį nei bendražygiui (t. y. gyvsidabriui), po to o antrasis elementas, susietas su kažkuo, gali būti išlaisvintas tokiu pat būdu naudojant ketvirtąją substanciją. Toks išleidimas ar išleidimas ne visada būna pilnas, tačiau dažniausiai pakanka dalinio išleidimo, kurį teoriškai galima apskaičiuoti naudojant formules.
Viena iš labai dažnų giminingumo pasekmių, pasikartojančių kiekviename žingsnyje, yra savybė, vadinama „higroskopiškumu“, t.y. gebėjimas sušlapti, sušlapti, kitaip - sugerti drėgmę ir formuoti deguonies-vandenilio junginius. Daugelis medžiagų išsiskiria šia savybe ir, be kita ko, valgomoji druska ir sieros rūgštis, kurios dedamos tarp langų rėmai traukti į save drėgmę; negesintos kalkės, putojančios nuo sąlyčio su vandeniu; želatina, su kuria dehidratuojamas alkoholis ir kt. Pirotechnikos gaminiams higroskopiškumas yra bjauri savybė, su kuria reikia atsižvelgti. Taigi, pavyzdžiui, stroncio chloridą ir nitratą dėl didelio higroskopiškumo ne visada įmanoma naudoti, nors šios medžiagos turi vertingų pirotechninių savybių; ir apskritai visos kompozicijos turi būti kruopščiai apsaugotos nuo drėgmės poveikio. Tačiau svarbiausią vaidmenį pirotechnikos chemijoje atlieka junginių tipas, vadinamas „degimu“ (Verbrennung, degimas).
Sąvoka „degimas“ arba „degimas“ plačiąja prasme reiškia, kad chemija apskritai reiškia kiekvieną cheminį dviejų kūnų derinį, sudarantį trečiąjį; artimiausia prasme tai reiškia kūno derinį su deguonimi.
Norėdami paaiškinti, kaip įprasta, pereikime prie eksperimentų. sumaišyti tam tikras kiekis geležies drožles su tam tikru kiekiu sieros ir šiek tiek pašildykite mišinį; tada šis mišinys iš karto įkaista ir greitai ištirpsta. Tokiu būdu gautas lydinys nebėra siera ar geležis: geležis sudegė siera, t.y. chemiškai su ja susijungė ir dėl to susidarė naujas kūnas – geležies arba sieros (priklausomai nuo vieno ar kito ingrediento vyravimo) piritai.
Ištirpinkite sierą tiglyje, užvirinkite lydinį ir įmeskite į jį varinės vielos gabaliukus: ši viela degs siera, išryškindama nuostabią raudoną spalvą; rezultatas yra specialus junginys - vario sulfidas arba vario blizgesys. Lygiai taip pat galite deginti variu, t.y. sujungti su juo daugybę kūnų: švino, alavo, cinko ir kt.
Sieringa anglis - bespalvis, stipriai dvokiantis skystis, neužšąlantis net esant 48 ° R (anglies disulfido lydymosi temperatūra (CS 2) \u003d -112 ° C) - susidaro derinant sieros garus su karštomis anglimis. Abu pagrindiniai kūnai sudegs, t.y. susijungę pavirs skysčiu.
Toks pat panašumas yra tarp metalų (geležies, vario, cinko, antimono, arseno ir kt.), kurie yra degimo būsenoje su anksčiau minėtomis dujomis, vadinamomis „chloru“: geležimi, variu, cinku ir kt. sudeginti su chloru į geležies chloridą, vario chloridą, cinko chloridą, švino chloridą ir kt., išskirdami stiprią šilumą ir skleisdami specialią šviesą. Išlydyta siera, susilietusi su chloro dujomis, dega mėlyna liepsna ir virsta sieros chloridu; susmulkintas stibis arba smulkus arsenas, dedamas į chloro pripildytą indą, patys užsidega ir susijungia į arseno chloridą arba stibio chloridą.
Abiem atvejais dėl panašumų buvo sujungti įvairūs kūnai, dabar su siera, dabar su chloru, išsiskyrė šiluma ir šviesa.
Lygiai tokiomis pačiomis sąlygomis įvairių kūnų junginiai susidaro su skirtingomis dujomis – deguonimi.
Prijunkite retortą ( stiklinis indas distiliavimui), į kurį dedamas gyvsidabris su stikliniu dangteliu, hermetiškai izoliuotu nuo išorės oro. Įkaitinkite gyvsidabrį beveik iki virimo temperatūros: gyvsidabris nesudegs, o praras ir metalinį blizgesį, ir buvusią sidabrinę spalvą, ir lašelinę-skysčio būseną – pavirs rausvais milteliais, giminingais tame pačiame buvusiam metalui. kaip anglis į medieną. Jei prieš eksperimento pradžią tiksliai pasvėrėte gyvsidabrį ir orą, esantį po dangteliu, o dabar dar kartą pasvėrėte abu, paaiškės, kad ore trūksta svorio, o milteliuose - perteklius. , ir tiek pat.. Jei, pavyzdžiui, oras po gaubtu svėrė lygiai 1000 gramų, tai dabar jis sveria tik 767 gramus; bet milteliai sveria 233 gramais daugiau nei gyvsidabris. Dabar atlikite atvirkštinį eksperimentą: sudėkite miltelius į mažą retortą, sujungtą su stikliniu buteliu, pusiau pripildytu vandens. Retortą pakaitinkite ant stipraus alkoholio ugnies: milteliai pavirs garais, kurie, eidami per vandenį, pasiskirstys į dvi dalis: į metalines nuosėdas, susidedančias iš gryno lašo-skysto gyvsidabrio ir cilindre surinkto deguonies.
Toks pat giminingumas kaip ir karštam gyvsidabriui, deguonis taip pat pasireiškia karštos geležies ar išlydyto vario atžvilgiu: kontaktuodami su oru šie metalai ant paviršiaus godžiai impregnuoja ore esančiu deguonimi ir susidaro vario arba geležies apnašos (šlakas), t.y. . geležies arba vario „oksidas“ (junginys su deguonimi), išskirdamas ryškių spalvų kibirkštis.
Visais šiais atvejais įvyko tas pats reiškinys: susijungimas su deguonimi, arba šių kūnų oksidacija (oksidacija) – ne tik veikiant šilumai, bet ir išsiskiriant šilumai bei šviesai, kad šiluma ir šviesa, t.y. tai, kas paprastai vadinama „degimu“, yra šalutinis poveikis, tiesioginė pasekmė, o tiksliau – galinga apraiška, kurią senovės žmonės laikė ypatingu elementu, kurio principą vadino „flogistonu“.
Tačiau oksidacija gali vykti ne tik be ugnies tarpininkavimo, bet net ir be pastebimo šilumos išsiskyrimo: jei geležis bus veikiama oro, ji rūdys. Šios rūdys yra ne kas kita, kaip oksidacijos produktas, būtent geležies oksidas arba sudegusi geležis.
Degimo procesas liko be pastebimo šilumos išsiskyrimo tik todėl, kad pati oksidacija buvo labai lėta. Medžio oksidacija kiek labiau pastebima: supuvę švyti tamsoje; jei įkiši ranką į pūvančių krūvą, jautiesi šilta; pati krūva mažėja kiekvieną dieną; kitaip tariant, medis lėtai dega (rūks) ore.
Dar labiau pastebimas antplūdis grynas oras rusenant: jei oro srove pučiama ant įkaitusių anglių ar lėtai rūkstančių malkų (pavyzdžiui, su pripūstu kailiu), tuoj pat atsiras liepsna. Procesas yra toks: medienoje yra du degūs kūnai – anglis ir vandenilis; pirmasis susijungia su deguonimi ir degdamas virsta anglies dioksidu arba anglies dioksidu, o antrasis – deguonimi arba vandeniu.
Bet koks degi medžiaga, in kasdienybė vadinamas kuru arba apšvietimo medžiaga, dega pagal tas pačias taisykles. Pavyzdžiui, taukai ir sviestas daugiausia sudaryti iš anglies ir vandenilio; abu jie turi didelį giminingumą deguoniui, o visas degimo procesas, t.y. Oksidacija susideda iš to, kad deguonis suskaido degią medžiagą į sudedamąsias dalis ir susijungia su kiekviena iš jų atskirai.
Lygiai tokia pati oksidacija vyksta ir gyvūno organizme: azotinės (riebalinės) kūno dalys oksiduojasi, arba dega, nuo sąlyčio su deguonimi, kurio laidininkas yra kraujas, o pasekmė – gyvuliška šiluma.
Tačiau kaip oksidacija gali būti labai lėta, ji gali būti labai greita ir energinga. Raudonasis fosforas, pavyzdžiui, gulint lauke, ne tik rūksta ir šviečia, bet ir yra pilamas dideliais kiekiais, lėtai tirpsta ir galiausiai užsidega (savaiminis užsidegimas). Mažiausi chemiškai grynos geležies milteliai užsiliepsnoja vieno sąlyčio su išoriniu oru metu. Galiausiai natrio metalas, vos patekęs į vandenį, iš karto suskaido jį į sudedamąsias dalis, kad sugertų vandenyje esantį deguonį, be to, taip stipriai, kad susidariusi šiluma gali uždegti kitas išsiskiriančias dujas – vandenilį. natrio derinys su deguonimi. Taigi vandenilis užsidega bespalve liepsna ir, rekombinuodamas su atmosferos deguonimi, vėl virsta vandeniu. Todėl natrio yra mineralinis aliejus, nes šis aliejus yra angliavandenilių junginys, kuriame nėra deguonies.
Iš to, kas pasakyta, galima padaryti keletą rimtų išvadų:
- Tai, ką mes kasdieniame gyvenime vadiname degimu, t.y. liepsnos, šviesos ir šilumos atsiradimui reikia dviejų kūnų: degiosios medžiagos ir deguonies.
- Pats degimo procesas, pirma, susideda iš degiųjų medžiagų skilimo, kai išsiskiria tos dalys, kurios susijungia su deguonimi, ir, antra, pačiame šio derinio procese, t.y. oksidacijoje. Degiųjų medžiagų oksidacijos, pakankamai kaitinant, produktas daugiausia yra šių medžiagų pavertimas anglies rūgštimi ir vandeniu.
- Nes gamtoje deguonis niekada nerandamas atskiru pavidalu, tada degioji medžiaga jį išskiria iš atmosferos, vandens ar bet kokio kito sudėtingo kūno, kuriame yra deguonies; atsižvelgiant į tai, kūnai, išskiriantys deguonį, vadinami oksidatoriais, oksiduoti – bazėmis, o medžiagos, sukeliančios arba sustiprinančios deguonies išsiskyrimą, – skaidytojais. Pirotechnikos preparatų ir fejerverkų mišinių sudėtyje paprastai yra kiekvienos iš šių trijų grupių atstovų, tačiau yra ir išimčių: tam tikrais atvejais pakanka bazės ir oksiduojančios medžiagos (pavyzdžiui, aliuminio su kalio permanganatu); kitais, tačiau labai retais atvejais, tik bazė, jei ji pakankamai prisotinta deguonimi (pavyzdžiui, magnis, likopodis ir kt.).
- Nedalyvaujant oksiduojančiam agentui, pagrindas nedega, bet jei į jį įdedama medžiagos, kuri gali susijungti su baze ir ją suskaidyti, mišinys tampa degus. Tokios bazės, kurios pačios yra nedegios, yra: cinko, natrio, švino, bario, kalio, stroncio, chloro ir nitratų druskos ir kt. Degiosios priemaišos, kurios prisideda prie pagrindo irimo, yra: siera, anglis, suodžiai, cukrus, krakmolas, dekstrinas, šelakas, gummilacas, taukai ir kt. Pavyzdys yra salietra (kalio nitratas): pati savaime salietra nedega, bet sumaišius su siera gaunamas degus mišinys, nes. siera skaido salietrą ir paima iš jos deguonį, su kuriuo susijungia į sieros rūgštį. Tas pats pastebimas ir sierą derinant su Bertoleto druska (Kali cliloricum) arba su kalio permanganatu (Kali hypemanganiucum). Jei kompozicija sudaryta iš akmens anglių, suodžių ar celiuliozės kaip pagrindo su sieros ir salietros mišiniu, tada salietra tarnauja kaip oksidatorius, o siera - kaip skaidytojas. Procesas yra toks: anglis skaido salietrą, susijungdama su jos azoto rūgšties deguonimi, o deguonis ir anglis susijungia į dujinę anglies rūgštį ir išsiskiria azotas. Siera skatina irimą, o svarbiausia – neleidžia anglies rūgščiai jungtis su kaliu: iš to paties junginio susidarytų vientisas kūnas – kalis. Be sieros pusė anglies rūgšties virstų kietu junginiu.
- Be deguonies degimas neįsivaizduojamas, natris, laikomas po žibalu, nedega; fosforas, uždegtas po hermetiškai uždarytu varpu, užgęsta, kai išsenka turimas deguonies kiekis (apie 1/5 viso kubinio oro kiekio po varpu); gyvūnai, patalpinti į „Šuns grotą“, užpildytą anglimi, dūsta ir. ir tt
Tačiau nors atmosferos oras yra pagrindinis deguonies rezervuaras kasdieniame gyvenime, chemija nurodo daugybę kitų oksiduojančių medžiagų, per kurias galima degti tiek po vandeniu, tiek erdvėje - arba visiškai beorį, arba aprūpintą dujomis, kuriose nėra. vienas deguonies atomas.. Tokios oksiduojančios medžiagos, galinčios išskirti pakankamai deguonies, kad kompozicija visiškai sudegtų, nedalyvaujant atmosferos orui, yra salietra, bartolito druska ir keletas kitų jau minėtų kūnų. Pavyzdžiui, salietros dėka parakas įgyja galimybę degti ginklo ar patrankos tūtoje nedalyvaujant atmosferos orui; degimas po vandeniu yra įmanomas su sąlyga, kad priemaišoje yra pakankamai stiprus oksidatorius, kad ne tik visiškai sudegintų kompoziciją, bet ir palaikytų temperatūrą reikiamame aukštyje degimo po vandeniu metu.
Remdamiesi tuo, kas išdėstyta, pažymime, kad degiųjų medžiagų (pavyzdžiui, kuro) pavertimas dujomis pakankamai aukšta temperatūra gali vykti esant keturioms sąlygoms: a) šildymas, kai nėra oro, taigi ir deguonies (anglies, kokso, apšvietimo dujų); b) kaitinimas, kai yra chemiškai surištas deguonis (H 2 O, CO 2): vandens dujos; c) su ribotu laisvo deguonies (oro) tiekimu: gamintojo dujos; d) su pakankamu oro patekimu (įprasta pakura) arba su padidintu deguonies tiekimu (trauka). - Kuo intensyviau vyksta oksidacijos procesas ir kuo artimesnis bazės cheminis giminingumas su oksidatoriumi ir skaidikliu, tuo stipresnis ir greitesnis šviesos ir šilumos pasireiškimas. Aukščiau buvo pažymėta dar viena aplinkybė: kitais atvejais vyksta savavališka oksidacija (rūkimas, rūdys, savaiminis užsidegimas), o kitais atvejais reikia pakelti temperatūrą (pašildyti daiktą) iki tam tikros normos, kad susidarytų derinys (oksidacija). karštų metalų, jų derinimo su chloru ir siera, degančios žvakės, malkos, lempos, žibalas, parako uždegimas ir kt.).
Be to: tolesnė proceso eiga gali būti atliekama greitai arba lėtai.
Todėl reikia išskirti dvi skirtingas degios medžiagos jautrumo ugniai (t. y. išoriniam oksidacijos pasireiškimui) savybes: degumą ir degumą. Pirmasis nurodo temperatūrą, kurioje vyksta užsidegimas (oksidacijos pradžia), o antrasis nurodo paties oksidacijos proceso greitį. Pirotechnikui būtina tiksliai žinoti ir vieną, ir kitą, nes cheminis kompozicijų įvertinimas visiškai priklauso nuo to žinojimo tiek dėl jų užsidegimo, tiek nuo šviesos intensyvumo ir trukmės. deginimo.
Kalbėdamas apie cheminius reiškinius, kuriuos sukelia šiluma, Rudolfas Wagneris pažymi štai ką: „Šiluminių reiškinių cheminių junginių ir skilimo mokslas, „termochemija“, dar toli gražu negali paaiškinti įvairių skilimų ir paruošimo būdų. chemijos pramonė, tačiau tai jau dabar rodo didesnę ar mažesnę cheminių reakcijų tikimybę ir pagrįstumą, nes apskritai junginius, susidariusius išsiskiriant šilumai, gauti lengviausia, tuo tarpu reakcija, kuri vyksta sugeriant šilumą, daugeliu atvejų yra daug sunkesnė.
Šilumos vienetas – tai kiekis, kurio reikia vandens vieneto svorio pašildymui nuo 0 iki 1 laipsnio Celsijaus. Pagal dešimtainę sistemą svorio vienetas yra gramas (cm 3); cheminis šilumos vienetas, vadinamas "kalorija", pavaizduotas simboliu "cal", o 1000 kalorijų - simboliu "Cal". Simbolis "K" (kg) išreiškia šilumos kiekį, kurį išskiria 1 g vandens, kai jis atšaldomas nuo virimo iki užšalimo temperatūros. Mechaninis šilumos ekvivalentas yra 425 kg/m.
Poveikis ir degimo produktai
Visiško degimo nėra: tos degiosios kompozicijos dalys, kurios nepavirto dujomis, sudaro nei dūmus, nei nuosėdas. Dūmai – tai ne kas kita, kaip nesudegusios medžiagos, suvirintos iki smulkiausių dulkių ir nuneštos oro srovės. Be kita ko, toks kūnas yra suodžiai (nesudegusio medžio likutis), suodžiai (nesudegusio riebalinio kūno likutis), anglies kamino dūmai (kabantys tūkstančius svarų virš gamyklų miestelių ir dabar išnaudojami ištisos visuomenės) ir kt. Nuosėdose dažniausiai susidaro ne tik nesudegęs, bet ir ugniai atsparus (ugniai atsparus) cheminis junginys.
Todėl kita užduotis pirotechnika susideda iš tokių kompozicijų užbaigimo, kurios degtų kuo mažiau dūmų ir nuosėdų.

Degimas sukelia gaisrą liepsnos arba kibirkščių pavidalu; dujų liepsna pati savaime visiškai nešviečia (kaip, pavyzdžiui, deginant vandenilį, kai natris panardinamas į vandenį); šviesa ir jos spalva atsiranda dėl tankesnių kūnų buvimo ugnyje. Taigi, pavyzdžiui, apšvietimo dujų geltona šviesa atsiranda dėl to, kad šios dujos susideda iš vandenilio ir anglies; vandenilis turi didesnę oksidacinę galią nei anglis ir dega greičiau bei tobuliau, o anglis, susikaupusi perteklių ugnyje, suteikia liepsnai šviesią ir geltoną spalvą. Todėl norint išsiaiškinti, ar nerūksta kokia liepsna, pakanka įsmeigti į vidurį, kur mažiausiai atviras oras, bet kokį svetimkūnį: jis tuoj pasidengs suodžių danga.
Tai, kad būtent kietieji kūnai suteikia šviesą liepsnai, įrodo: iš visų esamų kūnų degdamas vandenilis išskiria didžiausią šilumą, nes. tirpdo ir platiną, ir kalnų krištolą; bet jo liepsna itin blyški, o oksidacijos elementais tarnauja tik dujos – vandenilis ir vandens garai, bet vos tik atsiranda bet kokios tankios medžiagos (pvz., geležies, anglies, marmuro) mišinio, akinanti šviesa (Drummondo šviesa) gaunamas.
Šviesos intensyvumas tiesiogiai priklauso nuo oksidacijos energijos: kuo pastaroji stipresnė, tuo aukštesnė degimo temperatūra, taigi, tuo stipresnis kietųjų priemaišų degimas. Taigi, pavyzdžiui, alkoholio ugnis, uždegimo dujos su įkaitinto oro mišiniu ir galiausiai Unica benzininis degiklis skleidžia labai blyškią liepsną, tačiau per tam tikras priemaišas gali duoti daug šviesos: elektros lemputės duoda geltoną, silpnesnė šviesa, o elektros lempos – baltos, akinančios, nes pirmuoju atveju elektros įtampa nepalyginamai mažiau energingai nei antrajame.
Ypatingą susidomėjimą kelia Auer degikliai, dabar naudojami ne tik dujų, bet ir benzino, alkoholio, acetileno ir kitų apšvietimo šaltinių apšvietimui: šie degikliai, sudaryti iš ugniai atsparių kūnų mišinio, paverčia silpną stipraus šilumos šaltinio šviesą ryški, žalsva arba melsva Balta šviesa.
Šviesos ryškumui padidinti ir liepsnai padidinti pirotechnikos kompozicijose naudojamas stibis, anglis ir kitos medžiagos.
Liepsnos spalva atsiranda ne dėl pačių priemaišų, o tik nuo dujų, susidarančių degant šioms priemaišoms; dujos patenka į ugnį ir suteikia liepsnai įvairių atspalvių baltą, geltoną, raudoną, žalią, mėlyną, violetinę spalvą. Tokios priemaišos yra natrio, vario, švino, bario, stroncio, stibio ir kt. Taigi, pavyzdžiui, siera, sumaišyta su salietra degimo metu, suteikia neapibrėžtą spalvą, o esant stibiui - baltą; jei į bario druskos ir sieros mišinį dedama bario nitrato, tai gauname žalia spalva ir tt
Dažančios priemaišos daugiausia susideda iš metalų junginių, tačiau patys dažai priklauso ne tik nuo metalo, bet ir nuo su juo susijusių nemetalinių medžiagų. Tai aiškiausiai įrodo sekantis eksperimentas su variu. Varis, kaip jau minėta, dega sieros dujose raudona liepsna ir virsta vario sulfidu. Deguonyje sudegus varį su nedideliu sieros mišiniu, susidaro violetinė liepsna. Jei vietoj sieros į varį bus dedamas kietas angliavandenis (šelakas, cukrus ir kt.), liepsna įgaus žalią spalvą.
Sprogimo vamzdžio liepsna pakaitinkite žiupsnelį verdigrio (Grunspan) arba sieros druskos: veikiant alkoholio dujoms, susidaro ryškiai žalia liepsna. Į tą pačią medžiagą įpilkite šiek tiek kalomelio arba amoniako: gausite ryškiai mėlyną liepsną, nes varis susijungia su išsiskyrusiu chloru ir degdamas susidaro vario chloridas (Chlorkupfer). Vario chloridas, veikiamas alkoholio ugnies, dega žalia liepsna, nes alkoholio ugnies vandenilis atima iš vario chlorą ir daro jį negaliojančiu liepsnos spalvos atžvilgiu (CuCl 2 + 2H-2HCl + Cu). Jei vario oksidas (Kupferoxid, CuO) sudeginamas alkoholio ugnyje, tada liepsnos šerdis ir dugnas bus balti, o liežuvio kraštai ir galas – mėlyni. Tai paaiškinama tuo, kad liepsnos vandenilis pirmiausia redukuoja vario oksidą (CuO + 2H = Cu + H 2 O), o po to, veikiant oksidacijai, išoriniame liepsnos apvalkale vėl atsiranda vario dažymas. apvalkalo gebėjimas ir labai aukšta jame esanti temperatūra.
Spalvos „storumui“ sustiprinti naudojamas kalomelis, amoniakas, mastika, šelakas ir kt.
Kompozicijos degimo greitis daugiausia priklauso nuo:
- iš cheminio ryšio tarp pagrindo elementų ir skaidytojų, tk. irimo laipsnis ir, atitinkamai, pagrindo degumas priklauso nuo šio ryšio laipsnio;
- iš sudėtinių proporcijų, nes kiekvienam mišiniui yra kraštutinė riba, kurią pasiekus gaunamas greičiausias ir pilniausias bazės skilimas, tuo tarpu už šios ribos, t.y. prieš jį arba už jo gaunamas prasčiausias rezultatas – tokia riba vadinama „norma“;
- dėl degimo susidariusio temperatūros aukščio;
- dėl kompozicijos tankio ir vienodumo;
- iš cheminis poveikis priemaišų, t.y. priedų elementai;
- nuo atmosferos drėgmės ir kompozicijos higroskopiškumo;
- nuo išorinės temperatūros;
- galiausiai, dėl daugybės mažų ir didelių, pagrindinių ar antrinių priežasčių, kurių kiekviena turi savo įtakos bendras procesas narkotikų deginimas.
Degimo greičio nustatymas yra vienas svarbiausių pirotechnikos meno uždavinių, nes. su tuo susijęs savavališko liepsnos sustiprėjimo ar sulėtėjimo klausimas, todėl atitinkamose vietose ypatingas dėmesys skiriamas normai.
Pirmoji chronologiškai (XIX a. pabaiga) buvo terminė teorija, kurios įkūrėjai yra Malyardas, Le Chatelier ir Nuseltas. Ši teorija pagrįsta van't Hoffo hipoteze apie cheminės reakcijos greičio priklausomybę nuo temperatūros. Šiluminio sprogimo sąlyga yra šilumos padidėjimas dėl reakcijos energijos, o ne šilumos pašalinimas į aplinką. Tokiu atveju sistemoje kaupiasi šiluma, dėl kurios savaime įkaista ir, atitinkamai, savaime pagreitėja reakcija.
Oksidacijos reakcijos atsiradimas degioje sistemoje dažniausiai siejamas su sistemos įkaitinimu nuo vieno ar kito uždegimo šaltinio. Kaitinant kuro sistemą, kuro ir deguonies molekulių energija didėja ir, pasiekus tam tikrą vertę, jos aktyvuojamos, t.y. susidaro aktyvieji centrai (radikalai ir atomai), turintys laisvųjų valentų, dėl kurių degiosios medžiagos molekulės lengvai susijungia su atmosferos deguonimi. A.N. Bachas ir K. Engleris 1898 m. nepriklausomai pasiūlė peroksido oksidacijos teoriją, pagal kurią, kaitinant degiąją sistemą, deguonis aktyvuojamas nutraukus vieną ryšį tarp atomų, o aktyvioji molekulė susijungia su degia medžiaga nesuirdama į atomų ir formuojančių peroksido junginius, tokio tipo: R1 -O-O-R2 arba R-O-O-OH.
Tačiau peroksido teorija negali paaiškinti kai kurių būdingų oksidacijos proceso ypatybių, pavyzdžiui, aštraus poveikio, kartais nereikšmingų pašalinių priemaišų pėdsakų.
Cheminės reakcijos greitis, m/s, gali būti išreikštas, remiantis Arenijaus įstatymu, tokia lygtimi:
![]() , (1.12)
, (1.12)
kur reakcijos greičio konstanta (cheminės reakcijos greitis, kai reagentų koncentracija sumažinama iki vieneto);
Reagentų koncentracijos, mol/m 3 ;
Stechiometriniai koeficientai, nustatyti pagal pradinių reagentų koncentracijų santykį stechiometrinėje reakcijos lygtyje;
Natūralių logaritmų bazė;
Universali dujų konstanta, = 8,3 J/(mol∙K);
temperatūra, K.
Šiluminė savaiminio užsidegimo teorija (taip pat vadinama terminio sprogimo teorija) remiasi šilumos išsiskyrimo greičių palyginimu egzoterminės oksidacijos metu ir šilumos pašalinimo iš reaguojančio mišinio indo, kuriame jis yra, sienelėje. Savaiminio užsidegimo sąlygą lemia šių greičių lygybė. Indo sienelių temperatūra, kuriai esant pasiekiama ši lygybė, vadinama savaiminio užsidegimo temperatūra. Pradedant nuo šios temperatūros (būdinga kiekvienu atveju konkrečioms sąlygoms – indo dydžiui ir formai, dujų termofizinėms savybėms), įvyksta savaiminis įkaitimas, kuris gali sukelti pliūpsnį (savaiminį užsidegimą).
Atsižvelgdami į tai, kas išdėstyta pirmiau, savaiminiam įkaitimui reaguojančioje terpėje galime parašyti:
kur šiluminė talpa esant pastoviam tūriui, J/K;
Dujų tankis, kg/m 3;
Dujų temperatūra, K;
Laikai;
Reakcijos terminis poveikis, W;
Reakcijos greitis, m/s;
Reakcijos indo paviršius, m 2 ;
Reakcijos indo tūris, m 3 ;
Šilumos perdavimo koeficientas, W / (m 2 × K);
Laivo sienelės temperatūra, K.
D.A. Frank-Kamenetsky pasiūlė terminio savaiminio užsidegimo kriterijų, pagrįstą stacionarios temperatūros pasiskirstymo reaktyviniame inde pažeidimu esant pakankamam šilumos išsiskyrimo greičiui:
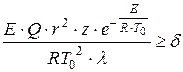 , (1.14)
, (1.14)
kur būdingas laivo dydis, m;
Preeksponentinis daugiklis;
Šilumos laidumo koeficientas dujų mišinys, W/(m×K);
Bedimensinis kriterijus lygus 3,3; 0,88 ir 2 atitinkamai sferiniams, lygiagretiesiems ir cilindriniams indams.
D.A. Frank-Kamenetsky kriterijus turėtų būti suprantamas taip: jei pakeitę visus parametrus, kurie lemia , gauname reikšmę, tada užsidegimo metu nebus užsidegimo. Iš kriterijaus lygties išplaukia, kad reakcijos šiluma ir indo, kuriame vyksta reakcija, spindulys yra svarbūs sprogimo veiksniai. Terminis sprogimas yra ryškesnis, tuo geriau tenkinamos nelygybės:
Jei šios nelygybės yra prastai įvykdytos, terminis sprogimas išsigimsta - kartu su temperatūros padidėjimu greitai perdega pradinė medžiaga, kuri ištepa sprogimo vaizdą.
Degimo atsiradimas dažniausiai siejamas su degiosios sistemos kaitinimu vienu ar kitu uždegimo šaltiniu. Remiantis akademiko N.N. Semjonovo, oksidacijos procesą lydi šilumos išsiskyrimas ir tam tikromis sąlygomis jis gali savaime paspartėti. Šis savaiminio oksidacijos reakcijos pagreitėjimo procesas su perėjimu prie degimo vadinamas savaiminiu užsidegimu.
Šiluminio savaiminio užsidegimo atveju jis atsiranda dėl šilumos išsiskyrimo greičio viršijimo šilumos pašalinimo greičiui.
Apsvarstykite terminio savaiminio užsidegimo procesą, naudodami degiųjų dujų arba degiojo skysčio garų pavyzdį su oru, patalpintu į indą, kurio tūris yra . Padidėjus indo ir degiojo mišinio temperatūrai, padidės reakcijos greitis ir šilumos išsiskyrimas. Šilumos išsiskyrimo greičio priklausomybę nuo temperatūros , J/s lemia:
![]() , (1.15)
, (1.15)
kur yra dujų degimo šiluma, J;
Degiojo mišinio tūris, m 3;
Reakcijos greičio konstanta;
Reagento koncentracija, kg/m 3 ;
Reakcijos tvarka;
Aktyvinimo energija, J/mol;
Universali dujų konstanta J/(mol K);
Mišinio temperatūra, K.
Išsiskyrusi šiluma perduodama degiam mišiniui, ir jis įkaista. Kai tik mišinio temperatūra viršys indo sienelių temperatūrą, per laiko vienetą pro indo sieneles pradės šalintis šiluma proporcingai temperatūrų skirtumui tarp mišinio ir indo sienelių ir yra nustatomi pagal priklausomybę:
![]() , (1.16)
, (1.16)
kur šilumos pašalinimo per indo sieneles greitis J/s;
Šilumos perdavimo koeficientas, J / (K m 2 × s);
Indo sienelių paviršius, m 2;
Mišinio temperatūra, K;
Laivo sienelės temperatūra, K

1.5 pav. Šilumos išsiskyrimo priklausomybė nuo temperatūros esant skirtingam slėgiui
1.5 paveikslo 2, 3 ir 4 kreivės parodo šilumos išsiskyrimo priklausomybę nuo temperatūros esant skirtingiems slėgiams ir tos pačios mišinio sudėties. Esant pastoviai indo ir terpės temperatūrai bei pastoviai mišinio sudėčiai, šilumos kiekis, pašalintas iš degimo zonos, apibūdinamas tiesia linija 1. Keičiantis mišinio sudėčiai, pasikeis ir šilumos nuostolių greitis, vadinasi, tiesės nuolydis. Kuo didesnis slėgis, tuo daugiau šilumos išsiskiria reakcijos metu (4 kreivė). 2 kreivės nustatytomis sąlygomis savaiminis užsidegimas negali įvykti, nes šilumos nuostoliai (1 eilutė) yra didesni nei šilumos išsiskyrimas esant tokiam slėgiui. 3 kreivės sąlyčio taškas su tiesia linija atitinka pusiausvyrą tarp susidariusios ir pašalintos šilumos esant - minimaliai tam tikros degios sistemos savaiminio užsidegimo temperatūrai tam tikromis sąlygomis. Esant nedideliam energijos tiekimui iš išorės, galimas savaiminis užsidegimas. 4 kreivė apibūdina sąlygas, kurioms esant savaiminis užsidegimas yra neišvengiamas, nes išsiskiria daugiau šilumos nei pašalinama.
Analizuodamas aukščiau pateiktą schemą, N.N. Semjonovas nustatė priklausomybę:
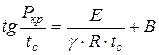 , (1.17)
, (1.17)
kur yra mažiausias uždegimo slėgis, Pa;
Minimali savaiminio užsidegimo temperatūra, K;
Reakcijos tvarka;
Konstanta, kuri priklauso nuo mišinio sudėties ir kitų savybių.
Remiantis šia (1.17) lygtimi, galima teoriškai iš anksto nustatyti, ar konkrečiomis sąlygomis galimas savaiminis degaus mišinio užsidegimas. Ryšys, susijęs su minimaliu slėgiu ir savaiminio užsidegimo temperatūra, buvo patvirtintas daugybe eksperimentų ir pasirodė esąs vertingas tiriant degimo procesus.
Degimo grandinės teorija
1928 m. N. N. Semenovas iškėlė idėją, kad cheminėse sistemose gali egzistuoti dviejų tipų sprogimai - grandininiai ir terminiai.
Grandininėmis reakcijomis vadinamos reakcijos, kurios pereina eilę etapų (per tarpinių reakcijų seriją), kurių metu susidaro tarpiniai junginiai su laisvaisiais valentais, vadinamieji aktyvieji centrai, kurie yra vėlesnių greitai tekančių etapų branduoliai. procesas.
Pirmą kartą grandininės reakcijos samprata atsirado 1913 m., kai vokiečių fizikas chemikas M. Bodensteinas išsiaiškino, kad apšvietus vandenilio ir chloro mišinį, chloro molekulė, sugerdama šviesos energijos kvantą, suyra į atomus:
![]() .
.
Chloro atomai akimirksniu reaguoja su vandeniliu, todėl mišinys sprogsta. Vienos chloro molekulės aktyvavimas turėtų sukelti dviejų molekulių susidarymą:
![]() .
.
Tačiau eksperimentai rodo, kad taip susidaro 100 000 vandenilio chlorido molekulių. Tai galima paaiškinti darant prielaidą, kad chlorui sąveikaujant su vandeniliu susidaro produktas, kuris, patekęs į antrines reakcijas, vėl atgimsta ir gali tęsti reakciją. Ši prielaida atitinka šią reakcijos schemą:
I Pirminė reakcija
IV Atvira grandinė
Pagal šią schemą, vienos chloro (I) molekulės aktyvavimas sukelia dviejų chloro atomų - dviejų aktyvių grandininės reakcijos centrų - atsiradimą. Kiekvienas iš chloro atomų sukelia savo grandininę reakciją, kurios metu aktyvusis centras nuolat redukuojamas (II, III). Taigi, veikiant inicijuojančiai reakcijai (I), vyksta nuoseklios reakcijos, kurios sudaro grandinę (II, III ir kt.). Tokių reakcijų skaičius nuo grandinės pradžios iki jos pabaigos vadinamas grandinės ilgiu. Grandinė gali būti nutraukta susidūrus chloro (IV) arba vandenilio (V) atomams ir iš jų susidarant molekulėms arba aktyviems centrams susidūrus su kietosios medžiagos paviršiumi. Tai tipiška nesišakojanti grandininė reakcija. Jame kiekviena aktyvi vieta sukelia tik vienos naujos aktyvios vietos atsiradimą, todėl reakcija gali tęstis, bet ne paspartėti.
Šakančios grandininės reakcijos metu kiekvienas aktyvus centras sukuria du ar daugiau naujų aktyvių centrų.
Pagal grandininių reakcijų teoriją oksidacijos procesas prasideda nuo degiosios medžiagos aktyvavimo.
Praktika parodė, kad užsidegimas gali įvykti izoterminėmis sąlygomis, t.y. nedidinant reaguojančios terpės temperatūros („šaltas“ mišinio užsidegimas). Šiuo atveju kalbama apie grandininį (izometrinį) sprogimą.
Du pradiniai komponentai: kuras ir oksidatorius, būdami santykinai stabilios molekulinės būsenos, prieš susijungiant į naujas, stabilesnes degimo produktų molekules, patiria visą sudėtingų tarpinių virsmų grandinę, dėl kurių susidaro nestabilūs produktai: atomai, radikalai. , sužadintos molekulės, turinčios gana didelį jonizacijos laipsnį (formaldehidas, angliavandeniliai ir hidroksilo radikalai, atominis deguonis ir vandenilis).
Kondratjevas V.N. Įvairių angliavandenilių liepsnoje buvo galima aptikti dideles atominio deguonies (O), hidroksido radikalo (OH), angliavandenilių radikalų (CH 3), anglies monoksido (CO), formaldehido (CH 2 O) ir kt. Šių medžiagų koncentracijos liepsnoje buvo tūkstančius ir milijonus kartų didesnės už jų pusiausvyros koncentracijas terminio skilimo metu galutinių reakcijos produktų, pavyzdžiui, H 2 O → H + OH, liepsnos temperatūroje.
Šių stebėjimų rezultatai leido daryti išvadą, kad nagrinėjami atomai ir radikalai reaguojančiose dujose atsiranda ne dėl galutinio produktų skilimo, o yra tarpiniai reakcijos produktai.
Taigi uždegimo grandinės mechanizmas yra pagrįstas visa grandine cheminių vienos medžiagos virsmų kita, kurios rezultatas yra chemiškai labai aktyvių nestabilių produktų susidarymas atskirose tarpinėse stadijose, vadinamose aktyviais centrais, kurie lengvai reaguoja tarpusavyje ir su pradinių medžiagų molekulėmis, susidarant naujoms aktyvioms vietoms ir galutiniams produktams, pavyzdžiui, H 2 O ir CO 2 metano-oro mišiniui.
aukštas reaktyvumas radikalai ir atomai paaiškinami maža jų reakcijų aktyvavimo energija, artima atominių reakcijų aktyvavimo energijai:
OH + H 2 \u003d H 2 O + H - 25 kJ / mol
CH 3 + C 3 H 6 - 12,5 kJ / mol
CH 3 + C 6 H 6 - 23,5 kJ / mol
H 2 O → H + OH
Bet kuri iš susidariusių aktyviųjų dalelių (H arba OH), būdama itin nestabili, todėl chemiškai aktyvi, susidūrusi su pradinės medžiagos molekule, skyla, sudarydama naujas aktyvias daleles:
H + O 2 \u003d OH + O
OH + H 2 \u003d H 2 O + H
Reakcijos metu gautos aktyvios H ir OH dalelės vėl pradės reakcijas, o O dalelės sąveikaus su vandeniliu:
O + H2 \u003d OH + H.
Tai yra, dėl reakcijos tarp aktyvių dalelių ir pradinių medžiagų molekulių susidaro ne tik galutiniai produktai, bet ir naujos aktyvios dalelės. Reakcijos metu susidariusios aktyvios dalelės sukelia naujus cheminės transformacijos etapus, kurie vyks iki visiško pradinių medžiagų sunaudojimo.
Tokios pakartotinai pasikartojančios cheminės reakcijos vadinamos grandininėmis, o aktyviosios dalelės, kurios sukelia naujas virsmų grandines, – aktyviais centrais.
Aukščiau aptartas grandininis vandenilio degimo procesas gali būti pavaizduotas diagrama (1.6 pav.).
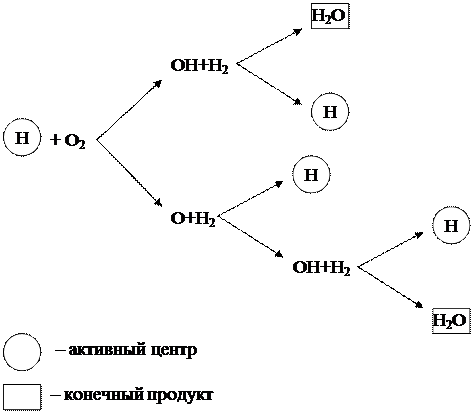
1.6 pav. – Vandenilio degimo grandininė schema
Iš schemos matyti, kad tik vandenilio (H) dalelės, kurios yra aktyvūs centrai, sukelia naujas transformacijų grandines. Tuo pačiu metu kiekvienoje grandinės proceso grandyje, vykstant reakcijai tarp aktyvaus centro H ir deguonies molekulės O 2, be galutinio produkto H 2 O, susidaro 3 nauji aktyvūs centrai H, kilti į naujas transformacijų grandines.
Tokia grandininė reakcija, vykstanti aktyvių centrų padidėjimu, vadinama šakota. Reakcija vystosi kaip lavina ir vyksta labai dideliu greičiu, gerokai viršijančiu įprastų molekulinių reakcijų greitį.
Tipiška nesišakojanti reakcija yra chloro reakcija su vandeniliu. Šios reakcijos aktyvieji centrai yra kintantys chloro ir vandenilio atomai. Kai reaguoja chloro atomas, susidaro vienas vandenilio atomas, lygiai taip pat, kai reaguoja vandenilio atomas, susidaro vienas chloro atomas. Todėl reakcija gali tęstis, bet ne paspartėti.
Visiems gerai žinomas faktas, kad fotocheminė chloro reakcija su vandeniliu vis tiek baigiasi sprogimu (savaiminiu užsidegimu), paaiškinama tuo, kad esant pakankamai dideliam grandininės reakcijos greičiui, šilumos išsiskyrimas viršija šilumos pašalinimą. kurių mišinys yra labai karštas ir susidaro terminio savaiminio užsidegimo sąlygos.
Vykstant šakotajai grandininei reakcijai, kuri būdinga angliavandeniliams, aktyvių centrų koncentracija gali padidėti nepriklausomai nuo pradinių inicijavimo sąlygų, o jei aktyvių centrų susidarymo greitis šakojimosi metu viršija grandinės nutraukimo greitį, tai savaime įsibėgėjanti lavina. Įvyksta panašus procesas, dėl kurio užsiliepsnoja.
Grandininių reakcijų teorija leido paaiškinti daugybę degimo procesų ypatybių (stiprią priemaišų įtaką, savaiminio užsiliepsnojimo slėgio ribas, katalizę ir slėgio slopinimą ir kt.), kurių negalima paaiškinti šilumine teorija. Tikrų gaisrų ir sprogimų atsiradimo ir vystymosi mechanizmui būdingas kombinuotas grandininis-terminis procesas. Prasidėjusi grandininiu būdu, oksidacijos reakcija dėl savo egzotermiškumo ir toliau spartinama terminiu būdu. Todėl galiausiai kritines (ribines) degimo pradžios ir vystymosi sąlygas lems šilumos išsiskyrimas ir šilumos mainų tarp reaguojančios sistemos ir aplinkos sąlygos.
Ant grandinės cheminės reakcijos daug technologiniai procesai in chemijos pramonė. Tokie procesai apima, pavyzdžiui, polimerizacijos procesus, kurie sudaro sintetinių kaučiukų, plastikų, polimerinių pluoštų ir daugelio kitų gaminių gamybos pagrindą. Jie taip pat apima svarbius pramoniniai procesai, kaip sintetinių riebalų rūgščių, pakeičiančių anksčiau naudotus valgomuosius riebalus, gamyba ploviklių ir tepalų gamyboje, krekingas yra aukštos kokybės kuro gavimo procesas iš naftos ir kt.






