Природний газ формули горіння. Природний газ. Процес горіння
А. С.Іссерлін
В основі процесу горіння лежать хімічні реакціїз'єднання палива з окислювачем. Для протікання процесу горіння газу мають бути створені спеціальні умови. По-перше, необхідно до пального газу підвести в достатній кількості окислювач (найчастіше повітря) і перемішати їх. По-друге, газоповітряна суміш повинна мати концентраційні межізаймистості і має бути створено джерело займання. По-третє, необхідно створити умови для розвитку процесу горіння, тобто певний температурний рівень.
Сумішоутворення (рівномірне змішування газу з повітрям) - одна з основних стадій всього процесу горіння. Від процесу сумішоутворення багато в чому залежать і всі подальші стадії, через які проходить паливо при перетворенні хімічної енергії на теплову. Оскільки в зоні горіння завжди встановлюється високий температурний рівень, час, який витрачається на хімічні реакції горіння, завжди значно менше часу, необхідного для процесу сумішоутворення.
Спалювання газового палива, як і будь-якого іншого, у повітряному потоці відповідно до сучасних поглядів можливо на основі кінетичного та дифузійного принципів.
Повний час згоряння газу, що визначає швидкість згоряння,
ТП ТС~1"~Х1
Де тс - час сумішоутворення, необхідне змішування газу з окислювачем; тх – час протікання хімічних реакцій.
Якщо транспортний засіб<Стх, то практически тп«т*. В этом случае процесс протекает в кинетической области. Если же, наоборот, Тс^-Тх, то Тп»тс и, следовательно, процесс протекает в диффузионной области.
При протіканні процесу горіння в кінетичній області швидкість горіння залежить від властивостей цієї горючої суміші, температури в реакційному обсязі та концентрації реагентів у зоні горіння, тобто регулюється законами хімічної кінетики. У той самий час швидкість процесу у кінетичної області залежить від гидродинамических чинників, т. е. від швидкості потоку, геометричних розмірів реакційної камери тощо.
Навпаки, в дифузійній ділянці швидкість процесу визначається гідродинамічними факторами і не залежить від кінетичних. У цій галузі перестають грати визначальну роль якості горючої суміші та температурний фактор. Порівняно простими гідродинамічними засобами можна впливати на інтенсивність змішування, що призведе до зміни характеристик дифузійного факелу.
При кінетичному принципі в пальнику попередньо створюється однорідна газоповітряна суміш, яка і подається в камеру топки. Тому горіння такої суміші протікає при постійному значенні всіх основних характеристик (теплонапруження, надлишок повітря тощо). Чисто кінетичне горіння виникає лише за умови дотримання умови А ^ 1,0.При а<1 кинетическое горение протекает лишь на первой стадии, т. е. до тех пор, пока не израсходован весь кислород смеси. Остаток горючих компонентов, разбавленных продуктами сгорания, может быть сожжен только при условии подвода дополнительного окислителя (воздуха).
Дифузійний принцип спалювання передбачає створення таких умов виникнення процесу, у яких суміш згоряє негайно за її виникненні, т. е. при зіткненні палива і окислювача у відповідних кількісних співвідношеннях. Процес дифузійного горіння регулюється зміною інтенсивності сумішоутворення шляхом варіювання конструктивних та режимних параметрів пальника. В результаті в залежності від технологічних вимог можна досягти укорочення зони змішування або її подовження.
У практиці часто застосовується спалювання газу, що поєднує в собі обидва згадані принципи. В цьому випадку частина повітря попередньо змішується з газом у пальнику, а решта, необхідна для повного згоряння, подається безпосередньо до зони горіння. Змінюючи це співвідношення, можна впливати на довжину газового смолоскипа. У більшості пальників газ подається під тим чи іншим кутом до потоку повітря.
Вивченню процесу сумішоутворення присвячено багато робіт. Це дозволяє сформулювати деякі загальні закономірності.
Для прямоточних газових пальників змішання тим краще, чим більшу частину поперечного перерізу пальника охоплюють газові струмені, тобто чим більша далекобійність газових струменів. У пальниках із сильно закрученими потоками не слід прагнути великої далекобійності газових струменів.
Збільшення крутки потоку повітря призводить до перерозподілу газу та повітря по перерізу пальника, підвищення інтенсивності перемішування газу з повітрям та збільшення центральної зони зворотних струмів у пальнику.
Характер впливу крутки повітряного потоку процес смесеобразования різний залежно від інших визначальних параметрів. Так, при подачі газу до периферійних зон пальника (незалежно від її типу) збільшення крутки потоку призводить до помітного поліпшення сумішоутворення. Навпаки, при подачі газу до центральної зони пальника зростання крутки не призводить, як правило, до поліпшення процесу, «рішення.
Сукупність явищ, яку ми називаємо горінням, може протікати лише певної послідовності, від однієї стадії до інший. Г. Ф. Кнорре дає наступні схеми процесу горіння газового і рідкого палива, що встановився, з фіксованим вогнищем, які він називає потоковими (рис. 1). Найпростіша потокова схема виникає при спалюванні газового палива, що складається з простих молекул (наприклад, водень), які не вимагають попереднього складного пирогенного розкладання (мал. а).Коли ж спалюється газове або рідке вуглеводневе паливо, А 6
Поточний процес горіння ускладнюється: виникає ще одна проміжна стадія – пірогенне розкладання. Для рідкого палива цій стадії передує стадія випаровування (рис. 1,6). Для здійснення потокової схеми необхідний достатній температурний рівень в осередку горіння, якого безперервними потоками підводяться паливо і окислювач. Продукти згоряння після завершення реакцій також відводяться від вогнища горіння.
Відомо, що газоповітряні суміші спалахують тільки в тому випадку, коли вміст газу в повітрі знаходиться в певних (для кожного газу) межах. При незначних вмістах газу кількість тепла, що виділилося під час горіння, недостатньо для доведення сусідніх шарів суміші до температури займання. Те саме спостерігається і при занадто великому вмісті газу газоповітряної суміші. Нестача кисню повітря, що йде на горіння, призводить до зниження температурного рівня, внаслідок чого сусідні шари суміші не нагріваються до
Температури займання. Цим двом випадкам відповідають нижня і верхня межі займистості (табл. 1). Тому крім перемішування газу з повітрям у певних пропорціях повинні бути створені початкові умови для займання суміші.
|
Таблиця / Межі займистості та температури займання різних газів у повітрі
|
Окислення горючих газів можливе за низьких температур, але тоді воно протікає надзвичайно повільно через незначну швидкість реакцій. При підвищенні температури швидкість реакції окислення зростає до самозаймання (замість повільного окислення починається процес мимовільного горіння). Значить, нагріта до температури займання горюча суміш має таку енергію, яка не тільки компенсує втрати тепла в навколишнє середовище, але забезпечує нагрівання та підготовку газоповітряної суміші, що надходить до зони горіння, до займання.
Температура займання газу залежить від ряду факторів, у тому числі від вмісту пального газу в газоповітряній суміші, тиску, способу нагрівання суміші і т. д., і тому не є точною величиною. У табл. 1 наведено значення температур займання деяких горючих газів у повітрі.
У практиці зустрічаються два способи займання горючих сумішей: самозаймання та запалення.
При Самозайманнявесь обсяг горючої газоповітряної суміші поступово доводиться до температури займання, після чого суміш займається вже без зовнішнього теплового впливу.
У техніці широко застосовується другий спосіб, що називається Запалювання.При цьому способі не потрібно нагрівати всю газоповітряну суміш до температури займання, достатньо запалити холодну суміш в одній точці об'єму яким-небудь високотемпературним джерелом (іскра, розжарене тіло, чергове полум'я тощо). В результаті займання передається на весь обсяг суміші мимоволі шляхом поширення полум'я, що відбувається не миттєво, а з певною просторовою швидкістю. Ця швидкість називається Швидкістю поширення полум'яу газоповітряній суміші і є найважливішою характеристикою, що визначає умови протікання та стабілізації горіння. Стійкість роботи пальників, як буде показано нижче, пов'язана зі швидкістю розповсюдження полум'я.
Таким чином, процес горіння газового палива складається з змішування газу з повітрям, нагрівання отриманої суміші до температури займання, запалення її та протікання реакцій горіння, що супроводжуються виділенням тепла. Причому змішання газу з повітрям та нагрівання суміші займають більшу частину часу в процесі горіння, оскільки реакції горіння протікають практично миттєво.
Залежно від технологічного процесу (отримання пари та гарячої води в котельному агрегаті, нагрівання виробів у пічній установці тощо) виникає необхідність впливати на процес горіння, змінюючи його кінцеві характеристики. Це досягається різними конструктивними прийомами, викладеними в гол. ІІІ.
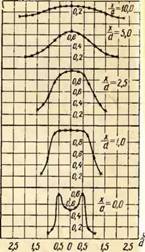
Показове зіставлення полів температур обсягом факела при спалюванні газу з різними коефіцієнтами надлишку повітря. Приклад такого зіставлення дано на рис. 2 для пальника діаметром вихідного насадка 35 мм у вигляді залежності
|
|
Де І- поточне значення температури у смолоскипі, °С; £тах - максимальна температура у факелі (виміряна), °С; Х- Відстань від точки заміру до початку смолоскипа, м; У- Відстань від точки виміру до осі факела, м; Й- Діаметр насадка пальника, м.м.
На рис. 2 наведено графіки розподілу температур для трьох коефіцієнтів надлишку повітря. Причому координаті Х/й=Про відповідає вихідний переріз насадка пальника, а координаті У/й=0 - вісь смолоскипа.
Як видно з малюнка, розподіл температур у вільному смолоскипі нерівномірний. При малих надлишках первинного повітря, наприклад а=0,5, наявність внутрішнього ядра у факелі сильно спотворює температурне поле і воно вирівнюється тільки на відстані х/с/ =10, тоді як при а=0,75 вирівнювання настає вже при Х/й=2,5, а при а=1,0 ще раніше - за Х/й = 1,0.
Найвищі температури у відкритих смолоскипах спостерігаються у початкових перерізах на відстані від осі смолоскипа У/й = 0,5, а потім по центру смолоскипа. Причому зі збільшенням коефіцієнта надлишку повітря максимум температур зміщується до гирла пальника. Так, найвища температура при а=0,75 виміряна з відривом Х/й=2,5, а за а =1,0 - з відривом Х/й = 1,0.
 При спільному розгляді розподілу температур та концентрацій С02 у факелі спостерігається збіг максимумів
При спільному розгляді розподілу температур та концентрацій С02 у факелі спостерігається збіг максимумів
Температур та змістів С02. Отже, максимальному температурному рівню у смолоскипі відповідає і максимальна величина ступеня вигоряння горючих.
Втрати частини тепла, що виділилося внаслідок згоряння газу, є неминучими. Однак вони можуть бути знижені до мінімуму при правильному веденні процесу топки. Розглянемо, з яких. складових складаються ці втрати.
При спалюванні газового палива мають місце такі втрати тепла: з газами, що йдуть, від хімічної неповноти згоряння і в навколишнє середовище. На підставі визначення окремих втрат тепла за зворотним балансом може бути підрахований к. п. д (коефіцієнт корисної дії) агрегату, °/о:
Де<72 - потери тепла с уходящими газами, %; - потери тепла
Від хімічної неповноти згоряння, %; Q5- Втрати тепла в навколишнє середовище, %.
Втрати тепла з газами, що йдуть- фізичне тепло продуктів згоряння, що залишають агрегат, є основними. Цілком усунути їх неможливо, проте необхідно прагнути зменшення. Втрати тепла з газами, що йдуть, залежать від температури газів та їх кількості. Чим нижче температура газів, тим менше тепла буде губитися, тому слід прагнути до зниження в розумних межах температури газів. Вплив температури газів на втрати тепла видно з табл. 2.
Таблиця 2
|
Втрати тепла з газами, що йдуть при спалюванні природного газу, %
|
Втрату тепла з газами, що йдуть, виражають зазвичай у відсотках від усього наявного тепла, тобто від теплоти згоряння палива. Наприклад, якщо втрата тепла становить 700 ккал/м3 при спалюванні газу, то
700-100 ___ „ 24°/
Кількість газів, що залишають, залежить від коефіцієнта - ента надлишку повітря, з яким працює пальник, і присосів
Повітря через нещільність в агрегаті. Чим більший коефіцієнт надлишку повітря на виході з пальника і присоси повітря в агрегат, тим вище втрати тепла з газами. З табл. 2 видно, що зміна загального коефіцієнта надлишку повітря в продуктах згоряння з аа = 1,2-5-1,6 збільшує втрату тепла з газами, що йдуть з 10,5 до 13,2% (при незмінній температурі газів, що йдуть 240° С).
Таким чином, для зниження втрат тепла з газами, що йдуть, необхідно вести процес горіння з найменшим допустимим коефіцієнтом надлишку повітря, забезпечувати найбільшу щільність агрегату і домагатися зниження температури газів.
Втрати тепла від хімічної неповноти згоряння газу виникають при нестачі повітря, поганому змішуванні в пальнику, при різкому зниженні температурного рівня в зоні горіння. Через війну горіння газу протікає неповно і з продуктами згоряння йдуть горючі компоненти (наприклад, водень, окис вуглецю та інших.). Це призводить до недовикористання хімічної енергії палива та зниження економічності роботи агрегату. Навіть невеликий вміст горючих компонентів у продуктах згоряння призводить до суттєвих втрат тепла від хімічної неповноти згоряння. Припустимо, що продукти згоряння містилося 0,7% водню і 0,5% окису вуглецю. В агрегаті спалювався природний газ з коефіцієнтом надлишку повітря за встановленням а = 1,5. Втрати тепла від хімічної неповноти згоряння становили ~450 ккал/м3 або
А___ 450-100 по/
Таким чином, з розглянутого прикладу видно, що горючі компоненти в продуктах згоряння повинні повністю відсутні або становити мінімальну величину.
Втрати тепла в довкілля пов'язані з тим, що стінки агрегату мають більш високу температуру, ніж повітря, що його оточує. Величина цих втрат залежить в основному від різниці температур між зовнішніми стінками агрегату та навколишнім повітрям, величини поверхні стін, теплопровідності матеріалу кладки та її товщини. Втрати в довкілля підраховуються теоретично або приймаються з норм теплового розрахунку залежно від конструкції та продуктивності агрегату.
Якщо підсумуємо всі теплові втрати, які мають місце при спалюванні газу в агрегаті, і віднімемо їх зі 100, то отримаємо к. п. д. агрегату. Наприклад, скористаємося цифрами, наведеними вище, прийнявши<75 равным 3,60%, тогда к. п. д. агрегата
Т] = 100-(8,24 +5,28 +3,60) = 82,88% *
8.1. РЕАКЦІЇ ГОРІННЯ
Горіння - швидкопротікаюча хімічна реакція з'єднання горючих компонентів з киснем, що супроводжується інтенсивним виділенням теплоти та різким підвищенням температури продуктів згоряння. Реакції горіння описуються т.зв. стехіометричними рівняннями, що характеризують якісно і кількісно вступають у реакцію і утворюються в результаті її речовини (Стехіометричний склад горючої суміші (від грец. stoicheion - основа, елемент і грец. metroo - вимірюю) - склад суміші, в якій окислювача рівно стільки, скільки необхідно для повного окислення палива). Загальне рівняння реакції горіння будь-якого вуглеводню
C m H n + (m + n/4) O 2 = mCO 2 + (n/2) Н 2 O + Q(8.1)
де m, n - число атомів вуглецю та водню в молекулі; Q – тепловий ефект реакції, або теплота згоряння.
Реакції горіння деяких газів наведено у табл. 8.1. Ці рівняння є балансовими, і з них не можна судити про швидкість реакцій, ні механізм хімічних перетворень.
Таблиця 8.1. Реакції горіння та теплота згоряння сухих газів (при 0°С та 101,3 кПа)
| Газ | Реакція горіння | Теплота спалювання | |||||
|---|---|---|---|---|---|---|---|
| Молярна, кДж/кмоль | Масова, кДж/кг | Об'ємна, кДж/м 3 | |||||
| найвища | нижча | найвища | нижча | найвища | нижча | ||
| Водень | H 2 + 0,5 O 2 = H 2 0 | 286,06 | 242,90 | 141 900 | 120 080 | 12 750 | 10 790 |
| Оксид вуглецю | CO + 0,5O 2 = CO 2 | 283,17 | 283,17 | 10 090 | 10 090 | 12 640 | 12 640 |
| Метан | CH 4 + 2O 2 = CO 2 + 2H 2 O | 880,90 | 800,90 | 55 546 | 49 933 | 39 820 | 35 880 |
| Етан | C 2 H 6 + 0,5O 2 = 2CO 2 + 3H 2 O | 1560,90 | 1425,70 | 52 019 | 47 415 | 70 310 | 64 360 |
| Пропан | C 3 H 8 + 5H 2 O = 3CO 2 +4H 2 O | 2221,40 | 2041,40 | 50 385 | 46 302 | 101 210 | 93 180 |
| н-бутан | 2880,40 | 2655,00 | 51 344 | 47 327 | 133 800 | 123 570 | |
| Вибутий | C 4 H 10 + 6,5O 2 = 4CO 2 + 5H 2 O | 2873,50 | 2648,30 | 51 222 | 47 208 | 132 960 | 122 780 |
| н-Пентан | C 5 H 12 + 8O 2 = 5CO 2 + 6H 2 O | 3539,10 | 3274,40 | 49 052 | 45 383 | 169 270 | 156 630 |
| Етилен | C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O | 1412,00 | 1333,50 | 50 341 | 47 540 | 63 039 | 59 532 |
| Пропілен | C 3 H 6 + 4,5O 2 = 3CO 2 + 3H 2 O | 2059,50 | 1937,40 | 48 944 | 46 042 | 91 945 | 88 493 |
| Бутілен | C 4 H 8 + 6O 2 = 4CO 2 + 4H 2 O | 2720,00 | 2549,70 | 48 487 | 45 450 | 121 434 | 113 830 |
Тепловий еффект (теплота згоряння) Q - кількість теплоти, що виділяється при повному згорянні 1 кмоля, 1 кг або 1 м 3 газу за нормальних фізичних умов. Розрізняють вищу Q і нижчу Q н теплоту згоряння: вища теплота згоряння включає теплоту конденсації водяної пари в процесі горіння (в реальності при спалюванні газу водяні пари не конденсуються, а видаляються разом з іншими продуктами згоряння). Зазвичай технічні розрахунки зазвичай ведуть за нижчою теплотою згоряння, не враховуючи теплоти конденсації водяної пари (≈2400 кДж/кг).
ККД, розрахований за нижчою теплотою згоряння, формально вище, але теплота конденсації водяної пари досить велика, і її використання більш ніж доцільно. Підтвердженням цього є активне застосування в опалювальній техніці контактних теплообмінників, дуже різноманітних по конструкції.
Для суміші горючих газів найвища (і нижча) теплота згоряння газів визначається за співвідношенням
Q = r 1 Q 1 + r 2 Q 2 + ... + r n Q n (8.2)
де r 1 , r 2 , …, r n - об'ємні (молярні, масові) частки компонентів, що входять до суміші; Q 1 , Q 2 , …, Q n – теплота згоряння компонентів.
Скориставшись табл. 8.1, вищу та нижчу теплоту згоряння, кДж/м 3 складного газу можна визначати за такими формулами:
Q в = 127,5 Н 2 + 126,4 СО + 398 СН 4 + 703 С 2 Н 6 + 1012 С 8 Н 8 + 1338 C 4 H 10 + 1329 C 4 H 10 +
+ 1693 С 5 Н 12 + 630 С 2 Н 4 + 919 С 3 Н 6 +1214 C 4 H 8 (8.3)
Q н = 107,9 H 2 + 126,4 CO + 358,8 CH 4 + 643 C 2 H 6 + 931,8 C 8 H 8 + 1235 C 4 H 10 + 1227 C 4 H 10 +
+ 1566 C 5 H 12 + 595 C 2 H 4 + 884 C 8 H 6 + 1138 C 4 H 8 (8.4)
де H 2 CO, CH 4 і т.д. - утримання окремих складових у газовому паливі, про. %.
Процес горіння протікає набагато складніше, ніж за формулою (8.1), так як поряд з розгалуженням ланцюгів відбувається їх обрив за рахунок утворення проміжних стабільних сполук, які за високої температури зазнають подальших перетворень. При достатній концентрації кисню утворюються кінцеві продукти: водяна пара Н 2 Про двоокис вуглецю СО 2 . При нестачі окислювача, а також при охолодженні зони реакції проміжні сполуки можуть стабілізуватися і потрапляти в навколишнє середовище.
Інтенсивність тепловиділення та зростання температури призводять до збільшення в системі активних частинок, що реагує. Такий взаємозв'язок ланцюгового реагування та температури, властивий практично всім процесам горіння, привів до введення поняття ланцюжково-теплового вибуху - самі хімічні реакції горіння мають ланцюговий характер, а їх прискорення відбувається за рахунок виділення теплоти та зростання температури в системі, що реагує.
Швидкість хімічної реакції в однорідній суміші пропорційна добутку концентрацій реагуючих речовин:
w = kС 1 С 2 (8.5)
де З 1 і 2 - концентрації реагуючих компонентів, кмоль/м 3 ; k - константа швидкості реакції, що залежить від природи реагуючих речовин та температури.
При спалюванні газу концентрації реагують речовин можна умовно вважати незмінними, оскільки у зоні горіння відбувається безперервний приплив нових компонентів однозначного складу.
Константа швидкості реакції (за рівнянням Арреніуса):
К = К 0 е-Е/RT (8.6)
де К 0 - передекспоненційний множник, який приймається для біометричних гомогенних сумішей, ≈1,0; Е – енергія активації, кДж/кмоль; R - універсальна газова стала, Дж/(кг К); Т – абсолютна температура, К (°С); е - основа натуральних логарифмів.
Передекспоненційний множник До 0 можна тлумачити як константу, що відображає повноту зіткнення молекул, а Е - як мінімальну енергію розриву зв'язків молекул та утворення активних частинок, що забезпечують ефективність зіткнень. Для поширених горючих сумішей вона укладається в межах (80÷150) 10 3 кДж/кмоль.
Рівняння (8.6) показує, що швидкість хімічних реакцій різко зростає зі збільшенням температури: наприклад, підвищення температури з 500 до 1000 К тягне підвищення швидкості реакції горіння в 2 10 4 ÷ 5 10 8 разів (залежно від енергії активації).
На швидкість реакцій горіння впливає їх ланцюговий характер. Спочатку генерується реакцією атоми і радикали вступають у сполуки з вихідними речовинами і між собою, утворюючи кінцеві продукти і нові частинки, що повторюють той самий ланцюг реакцій. Зростання генерування таких частинок призводить до «розгону» хімічних реакцій - фактично вибуху всієї суміші.
Високотемпературне горіння вуглеводнів має складний характер і пов'язане з утворенням активних частинок у вигляді атомів та радикалів, а також проміжних молекулярних сполук. Як приклад наводяться реакції горіння найпростішого вуглеводню - метану:
- Н + О 2 -> ВІН + О
СН 4 + ВІН -> СН 3 + Н 2
СН 4 + О -> СН 2 + Н 2 О - СН 3 + Про 2 -> НСНО + ВІН
СН 2 + О 2 -> НСНО + О - НСНО + ВІН -> НСО + Н 2 О
НСНО + О -> ЗІ + Н 2 О
НСО + О 2 -> СО + О + ВІН - СО + О -› СО 2
СО + ВІН -> СО 2 + Н
Підсумок одиничного циклу:
2СН 4 + 4О 2 -> 2СО 2 + 4Н 2 О
8.2. РОЗРАХУНКИ ГОРІННЯ
Кисень для горіння надходить із повітря як його складова частина. Для розрахунків приймається, що об'ємний склад сухого повітря є наступним:
кисень – 21,0%, азот – 79,0%.
Згідно з наведеними відомостями, 1 м 3 кисню міститься в 100/21 = 4,76 м 3 повітря, або на 1 м 3 кисню припадає 79/21 = 3,76 м 3 азоту. Враховуючи, що 1 кмоль газу за нормальних умов займає об'єм 22,4 л, реакцію горіння (див. рівняння 8.1) будь-якого вуглеводню в повітрі можна записати в узагальненому вигляді:
C m H n + (т + n/4) (O 2 + 3,76N 2) = тСO 2 + (n/2) Н 2 O + (т +n/4) 3,76N 2
Потреби в кисні та повітрі при горінні різних газів, підраховані за наведеними реакціями горіння, представлені в табл. 8.2.
Таблиця 8.2. Теоретична потреба в сухому кисні і повітрі, м 3 і обсяг продуктів згоряння газу при спалюванні 1 м 3 газу
| Газ | Теоретична потреба | Продукти згоряння | ||||
|---|---|---|---|---|---|---|
| кисню | повітря | діоксид вуглецю | водяна пара | азот | всього | |
| Водень H 2 | 0,5 | 2,38 | – | 1,0 | 1,88 | 2,88 |
| Оксид вуглецю CO | 0,5 | 2,38 | 1,0 | – | 1,88 | 2,88 |
| Метан CH 4 | 2,0 | 9,52 | 1,0 | 2,0 | 7,52 | 10,52 |
| Етан C 2 H 6 | 3,5 | 16,66 | 2,0 | 3,0 | 13,16 | 18,16 |
| Пропан C 3 H 8 | 5,0 | 23,80 | 3,0 | 4,0 | 18,80 | 25,80 |
| Бутан C 4 H 10 | 6,5 | 30,94 | 4,0 | 5,0 | 24,44 | 33,44 |
| Пентан C 5 H 12 | 8,0 | 38,08 | 5,0 | 6,0 | 30,08 | 41,08 |
| Етилен C 2 H 4 | 3,0 | 14,28 | 2,0 | 2,0 | 11,28 | 15,28 |
| Пропілен C 3 H 6 | 4,5 | 21,42 | 3,0 | 3,0 | 16,92 | 22,92 |
| Бутилен C 4 H 8 | 6,0 | 28,56 | 4,0 | 4,0 | 22,56 | 30,56 |
| Пентилен C 5 H 10 | 7,5 | 35,70 | 5,0 | 5,0 | 28,20 | 38,20 |
| Ацетилен C 2 H 2 | 2,5 | 11,90 | 2,0 | 1,0 | 9,40 | 12,40 |
Для складного газу витрата сухого повітря V c , м 3 /м 3 підраховується за формулою, що враховує потребу в кисні окремих компонентів суміші:
V c =4,76/100 (0,5Н 2 +0,5СО+2СН 4 +3,5С 2 Н 6 +5С 3 H 8 +6,5С 4 Н 10 +3С 2 Н 4 +4,5С 3 Н 6 +6C 4 H 8 -О 2) (8.7)
Теоретична витрата вологого повітря V вл, м 3 /м 3 більше визначається за формулою (8.7) на об'єм водяної пари:
V вл = V с + 0,001244d в V с (8.8)
де d - вологість повітря, г/м 3 .
При невідомому хімічному складі газів, але відомій нижчій теплоті згоряння Q н, кДж/м 3 теоретичний витрата повітря V т , м 3 /м 3 ,
V т ≈ Q н /3770 (8.9)
Реальна витрата повітря V дв, м 3 /м 3 приймається завжди трохи більшим:
V дв = V т α(8.10)
де - коефіцієнт надлишку повітря, відповідний вимогам ГОСТ. Для повного згоряння палива значення α має бути більшим за 1. Склад та обсяг продуктів згоряння, підрахований за реакціями горіння деяких газів у сухому повітрі, наведено в табл. 8.2.
8.3. ТЕМПЕРАТУРА ГОРІННЯ
У теплотехніці розрізняються такі температури горіння газів: жаропродуктивність, калориметричну, теоретичну та дійсну (розрахункову). Жаропродуктивність t ж - максимальна температура продуктів повного згоряння газу в адіабатичних умовах з коефіцієнтом надлишку повітря α = 1,0 та при температурі газу та повітря, що дорівнює 0°C:
t ж = Q н /(∑Vc p)(8.11)
де Q н - нижча теплота згоряння газу, кДж/м 3 ; ∑Vc p - сума добутків об'ємів діоксиду вуглецю, водяної пари та азоту, що утворилися при згорянні 1 м 3 газу (м 3 /м 3), та їх середніх об'ємних теплоємностей при постійному тиску в межах температур від 0°С до t ж (кДж /(М 3 o ° С).
Через непостійність теплоємності газів жаропродуктивність визначається методом послідовних наближень. Як початковий параметр береться її значення для газу (≈2000°С), при α = 1,0 визначаються обсяги компонентів продуктів згоряння, по табл. 8.3 знаходиться їхня середня теплоємність і потім за формулою (8.11) вважається жаропродуктивність газу. Якщо в результаті підрахунку вона виявиться нижче або вище за прийняту, то задається інша температура і розрахунок повторюється.
Таблиця 8.3. Середня об'ємна теплоємність газів, кДж/(м 3 °С)
Температура, °С |
CO 2 | N 2 | O 2 | CO | CH 4 | H 2 | H 2 O (водяні пари) | повітря | |
|---|---|---|---|---|---|---|---|---|---|
| сухий | вологий на 1 м3 сухого газу |
||||||||
| 0 | 1,5981 | 1,2970 | 1,3087 | 1,3062 | 1,5708 | 1,2852 | 1,4990 | 1,2991 | 1,3230 |
| 100 | 1,7186 | 1,2991 | 1,3209 | 1,3062 | 1,6590 | 1,2978 | 1,5103 | 1,3045 | 1,3285 |
| 200 | 1,8018 | 1,3045 | 1,3398 | 1,3146 | 1,7724 | 1,3020 | 1,5267 | 1,3142 | 1,3360 |
| 300 | 1,8770 | 1,3112 | 1,3608 | 1,3230 | 1,8984 | 1,3062 | 1,5473 | 1,3217 | 1,3465 |
| 400 | 1,9858 | 1,3213 | 1,3822 | 1,3356 | 2,0286 | 1,3104 | 1,5704 | 1,3335 | 1,3587 |
| 500 | 2,0030 | 1,3327 | 1,4024 | 1,3482 | 2,1504 | 1,3104 | 1,5943 | 1,3469 | 1,3787 |
| 600 | 2,0559 | 1,3453 | 1,4217 | 1,3650 | 2,2764 | 1,3146 | 1,6195 | 1,3612 | 1,3873 |
| 700 | 2,1034 | 1,3587 | 1,3549 | 1,3776 | 2,3898 | 1,3188 | 1,6464 | 1,3755 | 1,4020 |
| 800 | 2,1462 | 1,3717 | 1,4549 | 1,3944 | 2,5032 | 1,3230 | 1,6737 | 1,3889 | 1,4158 |
| 900 | 2,1857 | 1,3857 | 1,4692 | 1,4070 | 2,6040 | 1,3314 | 1,7010 | 1,4020 | 1,4293 |
| 1000 | 2,2210 | 1,3965 | 1,4822 | 1,4196 | 2,7048 | 1,3356 | 1,7283 | 1,4141 | 1,4419 |
| 1100 | 2,2525 | 1,4087 | 1,4902 | 1,4322 | 2,7930 | 1,3398 | 1,7556 | 1,4263 | 1,4545 |
| 1200 | 2,2819 | 1,4196 | 1,5063 | 1,4448 | 2,8812 | 1,3482 | 1,7825 | 1,4372 | 1,4658 |
| 1300 | 2,3079 | 1,4305 | 1,5154 | 1,4532 | – | 1,3566 | 1,8085 | 1,4482 | 1,4771 |
| 1400 | 2,3323 | 1,4406 | 1,5250 | 1,4658 | – | 1,3650 | 1,8341 | 1,4582 | 1,4876 |
| 1500 | 2,3545 | 1,4503 | 1,5343 | 1,4742 | – | 1,3818 | 1,8585 | 1,4675 | 1,4973 |
| 1600 | 2,3751 | 1,4587 | 1,5427 | – | – | – | 1,8824 | 1,4763 | 1,5065 |
| 1700 | 2,3944 | 1,4671 | 1,5511 | – | – | – | 1,9055 | 1,4843 | 1,5149 |
| 1800 | 2,4125 | 1,4746 | 1,5590 | – | – | – | 1,9278 | 1,4918 | 1,5225 |
| 1900 | 2,4289 | 1,4822 | 1,5666 | – | – | – | 1,9698 | 1,4994 | 1,5305 |
| 2000 | 2,4494 | 1,4889 | 1,5737 | 1,5078 | – | – | 1,9694 | 1,5376 | 1,5376 |
| 2100 | 2,4591 | 1,4952 | 1,5809 | – | – | – | 1,9891 | – | – |
| 2200 | 2,4725 | 1,5011 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2300 | 2,4860 | 1,5070 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2400 | 2,4977 | 1,5166 | 1,6002 | – | – | – | 2,0389 | – | – |
| 2500 | 2,5091 | 1,5175 | 1,6045 | – | – | – | 2,0593 | – | – |
Жаропродуктивність поширених простих і складних газів при їх горінні в сухому повітрі наведено в табл. 8.4. При спалюванні газу атмосферному повітрі, що містить близько 1 вагу. % вологи, жаропродуктивність знижується на 25–30°С.
Таблиця 8.4. Жаропродуктивність газів у сухому повітрі
| Простий газ | Жаропродуктивність, °С | Складний газ усередненого складу |
Наближена жаропродуктивність, °С |
|---|---|---|---|
| Водень | 2235 | Природні газові родовища |
2040 |
| Оксид вуглецю | 2370 | Природні нафтові родовища |
2080 |
| Метан | 2043 | Коксовий |
2120 |
| Етан | 2097 | Високотемпературної перегонки сланців |
1980 |
| Пропан | 2110 | Парококисневого дуття під тиском |
2050 |
| Бутан | 2118 | Генераторний із жирного вугілля |
1750 |
| Пентан | 2119 | Генераторний пароповітряного дуття з тонких палив. |
1670 |
| Етилен | 2284 | Зріджений (50% 3 Н 4 +50% 4 Н 10) |
2115 |
| Ацетилен | 2620 | 2210 |
Калориметрична температура горіння t до - температура, яка визначається без урахування дисоціації водяної пари та діоксиду вуглецю, але з урахуванням фактичної початкової температури газу та повітря. Вона відрізняється від жаропродуктивності t ж тим, що температура газу і повітря, а також коефіцієнт надлишку повітря приймаються за їх дійсними значеннями. Визначити t до можна за такою формулою:
t до = (Q н + q фіз)/(ΣVc p)(8.12)
де q фіз - теплозміст (фізична теплота) газу і повітря, що відраховується від 0 ° С, кДж/м 3 .
Природні та зріджені вуглеводневі гази перед спалюванням зазвичай не нагрівають, та їх обсяг у порівнянні з обсягом повітря, що йде на горіння, невеликий. Тому при визначенні калориметричної температури теплоутримання газів можна не враховувати. При спалюванні газів з низькою теплотою згоряння (генераторні, доменні та інших.) їх теплосодержание (особливо нагрітих до спалювання) дуже істотно впливає на калориметричну температуру.
Залежність калориметричної температури природного газу середнього складу повітря з температурою 0°З вологістю 1% від коефіцієнта надлишку повітря α наведено у табл. 8.5 для скрапленого вуглеводневого газу при його спалюванні в сухому повітрі - в табл. 8.7. Даними табл. 8.5–8.7 можна з достатньою точністю керуватися при встановленні калориметричної температури горіння інших природних газів, порівняно близьких до складу, та вуглеводневих газів практично будь-якого складу. При необхідності одержати високу температуру при спалюванні газів з малими коефіцієнтами надлишку повітря, а також для підвищення ККД печей, на практиці підігрівають повітря, що призводить до зростання калориметричної температури (див. табл. 8.6).
Таблиця 8.5. Калориметрична та теоретична температури горіння природного газу в повітрі з t = 0°С та вологістю 1% залежно від коефіцієнта надлишку повітря α
| Теоретична температура горіння t т °С | Коефіцієнт надлишку повітря α | Калориметрична температура горіння t до °С | ||
|---|---|---|---|---|
| 1,0 | 2010 | 1920 | 1,33 | 1620 |
| 1,02 | 1990 | 1900 | 1,36 | 1600 |
| 1,03 | 1970 | 1880 | 1,40 | 1570 |
| 1,05 | 1940 | 1870 | 1,43 | 1540 |
| 1,06 | 1920 | 1860 | 1,46 | 1510 |
| 1,08 | 1900 | 1850 | 1,50 | 1470 |
| 1,10 | 1880 | 1840 | 1,53 | 1440 |
| 1,12 | 1850 | 1820 | 1,57 | 1410 |
| 1,14 | 1820 | 1790 | 1,61 | 1380 |
| 1,16 | 1800 | 1770 | 1,66 | 1350 |
| 1,18 | 1780 | 1760 | 1,71 | 1320 |
| 1,20 | 1760 | 1750 | 1,76 | 1290 |
| 1,22 | 1730 | – | 1,82 | 1260 |
| 1,25 | 1700 | – | 1,87 | 1230 |
| 1,28 | 1670 | – | 1,94 | 1200 |
| 1,30 | 1650 | – | 2,00 | 1170 |
Таблиця 8.6. Калориметрична температура горіння природного газу t до, °С, залежно від коефіцієнта надлишку сухого повітря та його температури (округлені значення)
| Коефіцієнт надлишку повітря α | Температура сухого повітря, °С | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| 0,5 | 1380 | 1430 | 1500 | 1545 | 1680 | 1680 | 1740 | 1810 | 1860 |
| 0,6 | 1610 | 1650 | 1715 | 1780 | 1840 | 1900 | 1960 | 2015 | 2150 |
| 0,7 | 1730 | 1780 | 1840 | 1915 | 1970 | 2040 | 2100 | 2200 | 2250 |
| 0,8 | 1880 | 1940 | 2010 | 2060 | 2130 | 2200 | 2260 | 2330 | 2390 |
| 0,9 | 1980 | 2030 | 2090 | 2150 | 2220 | 2290 | 2360 | 2420 | 2500 |
| 1,0 | 2050 | 2120 | 2200 | 2250 | 2320 | 2385 | 2450 | 2510 | 2560 |
| 1,2 | 1810 | 1860 | 1930 | 2000 | 2070 | 2140 | 2200 | 2280 | 2350 |
| 1,4 | 1610 | 1660 | 1740 | 1800 | 2870 | 1950 | 2030 | 2100 | 2160 |
| 1,6 | 1450 | 1510 | 1560 | 1640 | 1730 | 1800 | 1860 | 1950 | 2030 |
| 1,8 | 1320 | 1370 | 1460 | 1520 | 1590 | 1670 | 1740 | 1830 | 1920 |
| 2,0 | 1220 | 1270 | 1360 | 1420 | 1490 | 1570 | 1640 | 1720 | 1820 |
Таблиця 8.7. Калориметрична температура горіння t до технічного пропану у сухому повітрі з t = 0°С залежно від коефіцієнта надлишку повітря α
| Коефіцієнт надлишку повітря α | Калориметрична температура горіння t до °С | Коефіцієнт надлишку повітря α | Калориметрична температура горіння t до °С |
|---|---|---|---|
| 1,0 | 2110 | 1,45 | 1580 |
| 1,02 | 2080 | 1,48 | 1560 |
| 1,04 | 2050 | 1,50 | 1540 |
| 1,05 | 2030 | 1,55 | 1500 |
| 1,07 | 2010 | 1,60 | 1470 |
| 1,10 | 1970 | 1,65 | 1430 |
| 1,12 | 1950 | 1,70 | 1390 |
| 1,15 | 1910 | 1,75 | 1360 |
| 1,20 | 1840 | 1,80 | 1340 |
| 1,25 | 1780 | 1,85 | 1300 |
| 1,27 | 1750 | 1,90 | 1270 |
| 1,30 | 1730 | 1,95 | 1240 |
| 1,35 | 1670 | 2,00 | 1210 |
| 1,40 | 1630 | 2,10 | 1170 |
Теоретична температура горіння t T - максимальна температура, яка визначається аналогічно калориметричній t до, але з поправкою на ендотермічні (що вимагають теплоти) реакції дисоціації діоксиду вуглецю і водяної пари, що йдуть зі збільшенням обсягу:
СО 2 ‹–› СО + 0,5О 2 - 283 мДж/моль(8.13)
Н 2 Про ‹–› Н 2 + 0,5О 2 - 242 мДж/моль(8.14)
За високих температур дисоціація може призвести до утворення атомарного водню, кисню та гідроксильних груп ВІН. Крім того, при спалюванні газу завжди утворюється деяка кількість оксиду азоту. Всі ці реакції ендотермічні та призводять до зниження температури горіння.
Теоретична температура горіння може бути визначена за такою формулою:
t T = (Q н + q фіз - q дис) / (Σ Vc p) (8.15)
де q дис - сумарні витрати теплоти на дисоціацію СО 2 і Н 2 Про продукти згоряння, кДж/м 3 ; ΣVc p - сума добутку обсягу та середньої теплоємності продуктів згоряння з урахуванням дисоціації на 1 м 3 газу.
Таблиця 8.8. Ступінь дисоціації водяної пари H 2 O та діоксиду вуглецю CO 2 залежно від парціального тиску
| Температура, °С | Парціальний тиск, МПа | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,004 | 0,006 | 0,008 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,025 | 0,030 | 0,040 | |
| Водяна пара H 2 O | ||||||||||||
| 1600 | 0,85 | 0,75 | 0,65 | 0,60 | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,42 |
| 1700 | 1,45 | 1,27 | 1,16 | 1,08 | 1,02 | 0,95 | 0,90 | 0,85 | 0,8 | 0,76 | 0,73 | 0,67 |
| 1800 | 2,40 | 2,10 | 1,90 | 1,80 | 1,70 | 1,60 | 1,53 | 1,46 | 1,40 | 1,30 | 1,25 | 1,15 |
| 1900 | 4,05 | 3,60 | 3,25 | 3,0 | 2,85 | 2,70 | 2,65 | 2,50 | 2,40 | 2,20 | 2,10 | 1,9 |
| 2000 | 5,75 | 5,05 | 4,60 | 4,30 | 4,0 | 3,80 | 3,55 | 3,50 | 3,40 | 3,15 | 2,95 | 2,65 |
| 2100 | 8,55 | 7,50 | 6,80 | 6,35 | 6,0 | 5,70 | 5,45 | 5,25 | 5,10 | 4,80 | 4,55 | 4,10 |
| 2200 | 12,3 | 10,8 | 9,90 | 9,90 | 8,80 | 8,35 | 7,95 | 7,65 | 7,40 | 6,90 | 6,50 | 5,90 |
| 2300 | 16,0 | 15,0 | 13,7 | 12,9 | 12,2 | 11,6 | 11,1 | 10,7 | 10,4 | 9,6 | 9,1 | 8,4 |
| 2400 | 22,5 | 20,0 | 18,4 | 17,2 | 16,3 | 15,6 | 15,0 | 14,4 | 13,9 | 13,0 | 12,2 | 11,2 |
| 2500 | 28,5 | 25,6 | 23,5 | 22,1 | 20,9 | 20,0 | 19,3 | 18,6 | 18,0 | 16,8 | 15,9 | 14,6 |
| 3000 | 70,6 | 66,7 | 63,8 | 61,6 | 59,6 | 58,0 | 56,5 | 55,4 | 54,3 | 51,9 | 50,0 | 47,0 |
| Діоксид вуглецю CO 2 | ||||||||||||
| 1500 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | – |
| 1600 | 2,0 | 1,8 | 1,6 | 1,5 | 1,45 | 1,4 | 1,35 | 1,3 | 1,25 | 1,2 | 1,1 | |
| 1700 | 3,8 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,4 | 2,3 | 2,2 | 2,0 | 1,9 | |
| 1800 | 6,3 | 5,5 | 5,0 | 4,6 | 4,4 | 4,2 | 4,0 | 3,8 | 3,7 | 3,5 | 3,3 | |
| 1900 | 10,1 | 8,9 | 8,1 | 7,6 | 7,2 | 6,8 | 6,5 | 6,3 | 6,1 | 5,6 | 5,3 | |
| 2000 | 16,5 | 14,6 | 13,4 | 12,5 | 11,8 | 11,2 | 10,8 | 10,4 | 10,0 | 9,4 | 8,8 | |
| 2100 | 23,9 | 21,3 | 19,6 | 18,3 | 17,3 | 16,5 | 15,9 | 15,3 | 14,9 | 13,9 | 13,1 | |
| 2200 | 35,1 | 31,5 | 29,2 | 27,5 | 26,1 | 25,0 | 24,1 | 23,3 | 22,6 | 21,2 | 20,1 | |
| 2300 | 44,7 | 40,7 | 37,9 | 35,9 | 34,3 | 32,9 | 31,8 | 30,9 | 30,0 | 28,2 | 26,9 | |
| 2400 | 56,0 | 51,8 | 48,8 | 46,5 | 44,6 | 43,1 | 41,8 | 40,6 | 39,6 | 37,5 | 35,8 | |
| 2500 | 66,3 | 62,2 | 59,3 | 56,9 | 55,0 | 53,4 | 52,0 | 50,7 | 49,7 | 47,3 | 45,4 | |
| 3000 | 94,9 | 93,9 | 93,1 | 92,3 | 91,7 | 90,6 | 90,1 | 89,6 | 88,5 | 87,6 | 86,8 | |
Як очевидно з табл. 8.8 при температурі до 1600°С ступінь дисоціації може не враховуватися, і теоретичну температуру горіння може прийняти рівною калориметричною. При вищій температурі ступінь дисоціації може істотно знижувати температуру робочому просторі. На практиці особливої потреби в цьому немає, теоретичну температуру горіння необхідно визначати тільки для високотемпературних печей, що працюють на попередньо нагрітому повітрі (наприклад, мартенівських). Для котельних установок цього потреби немає.
Таблиця 8.9. Максимальні
температури, що виникають
у вільному полум'ї, °С
Дійсна (розрахункова) температура продуктів згоряння tд- температура, яка досягається в реальних умовах у найгарячішій точці факела. Вона нижче теоретичної і залежить від втрат теплоти в навколишнє середовище, ступеня віддачі теплоти із зони горіння випромінюванням, розтягнутості процесу горіння в часі та ін. від температури в топках із введенням у них експериментально встановлених поправочних коефіцієнтів:
t д = t т η(8.16)
де η-т.зв. пірометричний коефіцієнт, що укладається в межах:
- для якісно виконаних термічних та нагрівальних печей з теплоізоляцією – 0,75–0,85;
- для герметичних печей без теплоізоляції – 0,70–0,75;
- для екранованих топок котлів – 0,60–0,75.
У практиці треба знати не лише наведені вище адіабатні температури горіння, а й максимальні температури, що виникають у полум'ї. Їхні наближені значення зазвичай встановлюють експериментально методами спектрографії. Максимальні температури, що виникають у вільному полум'ї з відривом 5–10 мм від вершини конусного фронту горіння, наведено у табл. 8.9. Аналіз наведених даних показує, що максимальні температури в полум'ї менші за жаропродуктивність (за рахунок витрат тепла на дисоціацію Н 2 Про і СО 2 і відведення теплоти з полум'яної зони).
8.4. ТЕМПЕРАТУРА САМОВСПЛАМУВАННЯ
Для ініціювання реакцій горіння потрібні умови займання суміші палива з окислювачем. Запалення може бути мимовільним та вимушеним (запалювання).
Температура самозаймання- мінімальна температура, при якій у нагрітій газоповітряній суміші починається мимовільний (тобто без зовнішнього підведення теплоти) процес горіння, за рахунок виділення теплоти частинками газу, що горять.
Температура самозаймання не є фіксованою для даного газу і залежить від багатьох параметрів: його вмісту в газоповітряній суміші, ступеня однорідності суміші, форми та розмірів судини, в якій суміш нагрівається, швидкості та способу її нагріву, каталітичного впливу стінок судини, тиску, під яким знаходиться суміш. Точний облік перелічених чинників дуже складний, тому практично, наприклад, в оцінці вибухонебезпечності, користуються експериментальними даними (див. табл. 8.10).
Таблиця 8.10. Найменші виміряні температури самозаймання деяких газів та пар у суміші з повітрям при атмосферному тиску
Температури самозаймання горючих газів у кисні дещо нижчі, ніж у повітрі. Введення до складу газів баластових домішок (азоту та діоксиду вуглецю) призводить до збільшення температури самозаймання. Присутність у складних газах компонентів із низькою температурою самозаймання призводить до зниження температури самозаймання суміші.
Вимушене займання (запалювання) здійснюється підпалюванням суміші в одній або ряді точок високотемпературним джерелом - відкритим полум'ям або електричною іскрою в точці вильоту газу з вогневих каналів пальників в топковий об'єм. Запалювання відрізняється від самозаймання тим, що горючу суміш доводять до появи полум'я не у всьому обсязі, а лише у невеликій частині його. Тепловідведення з зони, що нагрівається вимагає, щоб інтенсивність тепловиділення джерела запалювання перевищувала цей відвід теплоти. Після займання джерело запалювання видаляється, і горіння відбувається з допомогою поширення фронту полум'я.
8.5. МЕЖІ ЗАПАЛЕННЯ І ВИБУХУ
Газоповітряні суміші можуть спалахувати (вибухати) тільки тоді, коли вміст газу в суміші знаходиться в певних (для кожного газу) межах. У зв'язку з цим розрізняють нижній та верхній концентраційні межі займистості. Нижня межа відповідає мінімальній, а верхня - максимальній кількості газу в суміші, при якому відбуваються їх запалення (при запаленні) і мимовільне (без припливу тепла ззовні) поширення полум'я (самоспаление). Ці межі відповідають і умовам вибуховості газоповітряних сумішей.
Якщо вміст газу в газоповітряній суміші менше нижньої межі займистості, така суміш горіти і вибухати не може, оскільки виділяється поблизу джерела запалювання теплоти для підігріву суміші до температури займання недостатньо. Якщо вміст газу в суміші знаходиться між нижньою та верхньою межами займистості, підпалена суміш спалахує і горить як поблизу джерела запалювання, так і при видаленні його. Така суміш є вибухонебезпечною. Чим ширшим буде діапазон меж займистості (називаються також межами вибуховості) і нижче нижня межа, тим більше вибухонебезпечний газ. І нарешті, якщо вміст газу в суміші перевищує верхню межу займистості, то кількості повітря в суміші недостатньо для повного згоряння газу.
Існування меж займистості викликається тепловими втратами при горінні. При розведенні паливної суміші повітрям, киснем або газом теплові втрати зростають, швидкість розповсюдження полум'я зменшується і горіння припиняється після видалення джерела запалювання.
Таблиця 8.11. Межі займистості газів у суміші з повітрям (при t = 20°C та p = 101,3 кПа)
| Газ | Зміст газу газоповітряної суміші, про. % | максимальне |
Коефіцієнт надлишку повітря при межах займання | ||||
|---|---|---|---|---|---|---|---|
| При межах займистості | При стехіометричному складі суміші | При складі суміші, що дає максимальний тиск вибуху | |||||
| нижньому | верхньому | нижньому | верхньому | ||||
| Водень | 4,0 | 75,0 | 29,5 | 32,3 | 0,739 | 9,8 | 0,15 |
| Оксид вуглецю | 12,5 | 74,0 | 29,5 | – | – | 2,9 | 0,15 |
| Метан | 5,0 | 15,0 | 9,5 | 9,8 | 0,717 | 1,8 | 0,65 |
| Етан | 3,2 | 12,5 | 5,68 | 6,28 | 0,725 | 1,9 | 0,42 |
| Пропан | 2,3 | 9,5 | 4,04 | 4,60 | 0,858 | 1,7 | 0,40 |
| н-Бутан | 1,7 | 8,5 | 3,14 | 3,6 | 0,858 | 1,7 | 0,35 |
| Вибутий | 1,8 | 8,4 | 3,14 | – | – | ~1,8 | 0,35 |
| н-Пентан | 1,4 | 7,8 | 2,56 | 3,0 | 0,865 | 1,8 | 0,31 |
| Етилен | 3,0 | 16,0 | 6,5 | 8,0 | 0,886 | 2,2 | 0,17 |
| Пропілен | 2,4 | 10,0 | 4,5 | ~5,1 | ~0,89 | 1,9 | 0,37 |
| Бутілен | 1,7 | 9,0 | 3,4 | ~4,0 | ~0,88 | 1,7 | 0,35 |
| Ацетилен | 2,5 | 80,0 | 7,75 | 14,5 | 1,03 | 3,3 | 0,019 |
Таблиця 8.12. Межі займистості газів у суміші з киснем (при t = 20°C та p = 101,3 кПа)
Межі займистості для поширених газів у сумішах з повітрям та киснем наведені в табл. 8.11–8.12. Зі збільшенням температури суміші межі займистості розширюються, а при температурі, що перевищує температуру самозаймання, суміші газу з повітрям або киснем горять при будь-якому об'ємному співвідношенні.
Межі займистості залежать не тільки від видів горючих газів, а й від умов проведення експериментів (місткості судини, теплової потужності джерела запалювання, температури суміші, поширення полум'я вгору, вниз, горизонтально та ін.). Цим пояснюються дещо відрізняються один від одного значення цих меж у різних літературних джерелах. У табл. 8.11–8.12 наведено порівняно достовірні дані, отримані при кімнатній температурі та атмосферному тиску при поширенні полум'я знизу вгору у трубці діаметром 50 мм і більше. При поширенні полум'я згори донизу або горизонтально нижні межі дещо зростають, а верхні знижуються. Межі займання складних горючих газів, що не містять баластових домішок, визначаються за правилом адитивності:
L г = (r 1 + r 2 + … + r n) / (r 1 / l 1 + r 2 / l 2 + … + r n / l n) (8.17)
де L г - нижня або верхня межа займистості складного газу газоповітряної або газокисневої суміші, про. %; r 1 , r 2 , …, r n - вміст окремих компонентів у складному газі, про. %; r 1 + r 2 + … + r n = 100%; l 1 , l 2 , …, l n - нижні або верхні межі займистості окремих компонентів газоповітряної або газокисневої суміші за даними табл. 8.11 або 8.12, про. %.
За наявності в газі баластових домішок межі займистості можуть бути визначені за формулою:
L б = L г / (8.18)
де L б - верхній і нижній межі займистості суміші з баластними домішками, про. %; L г - верхній і нижній межі займистості горючої суміші, про. %; Б – кількість баластових домішок, частки одиниці.
При розрахунках часто необхідно знати коефіцієнт надлишку повітря при різних межах займистості (див. табл. 8.11), а також тиск, що виникає при вибуху газоповітряної суміші. Коефіцієнт надлишку повітря, що відповідає верхній або нижній межі займистості, можна визначити за формулою
α = (100/L – 1) (1/V T)(8.19)
Тиск, що виникає під час вибуху газоповітряних сумішей, можна визначити з достатнім наближенням за такими формулами:
для стехіометричного співвідношення простого газу з повітрям:
Р вз = Р н (1 + βt до) (m/n) (8.20)
для будь-якого співвідношення складного газу з повітрям:
Р вз = Р н (1 + βt до) V влпс / (1 + αV m) (8.21)
де Р вз - тиск, що виникає під час вибуху, МПа; р н - Початковий тиск (до вибуху), МПа; β - коефіцієнт об'ємного розширення газів, чисельно рівний коефіцієнту тиску (1/273); t K – калориметрична температура горіння, °С; m - число молей після вибуху, що визначається за реакцією горіння газу в повітрі; п - число молей до вибуху, що у реакції горіння; V влпс - обсяг вологих продуктів згоряння на 1 м3 газу, м3; V т - теоретична витрата повітря, м3/м3.
Таблиця 8.13. Тиск, що виникає при вибуху пропаново-повітряної суміші, в залежності від коефіцієнта скидання k сб і виду захисного пристрою
| Вид захисного пристрою | Коефіцієнт скидання k сб, м2/м3 | ||
|---|---|---|---|
| 0,063 | 0,033 | 0,019 | |
| Одинарне глухе скління із зовнішнім кріпленням скла завтовшки 3 мм | 0,005 | 0,009 | 0,019 |
| Подвійне глухе скління із зовнішнім кріпленням скла товщиною 3 мм. | 0,007 | 0,015 | 0,029 |
| Поворотна одинарна віконна палітурка з великим шарніром і пружинним замком на навантаження 5 МПа/м 2 | 0,002 | – | – |
| Поворотна одинарна віконна палітурка з верхнім шарніром і пружинним замком на навантаження 5 МПа/м 2 | 0,003 | – | – |
| Вільно лежать на перекритті плити масою, кг/м2: | |||
| 0,023 | |||
| 0,005 | |||
| 0,018 | |||
Тиск вибуху, наведені в табл. 8.13 або визначені за формулами можуть виникнути тільки в тому випадку, якщо відбувається повне згоряння газу всередині ємності та її стінки розраховані на ці тиски. В іншому випадку вони обмежені міцністю стінок або їх частин, що найбільш легко руйнуються - імпульси тиску поширюються по незаймистому об'єму суміші зі швидкістю звуку і досягають огорожі набагато швидше, ніж фронт полум'я.
Ця особливість – відмінність швидкостей поширення полум'я та імпульсів тиску (ударної хвилі) – широко використовується на практиці для захисту газових пристроїв та приміщень від руйнування під час вибуху. Для цього в отворах стін і перекриттів встановлюються фрамуги, рами, панелі, клапани, що легко відкриваються або руйнуються і т.д. Виникає при вибуху тиск залежить від особливостей конструкції пристроїв захисту та коефіцієнта скидання k сб, що є відношенням площі захисних пристроїв до обсягу приміщення.
8.6. ГОРІННЯ У НЕРУХОМОМУ СЕРЕДОВИЩІ
Переміщення полум'яної зони - фронту полум'я - області, що відокремлює горючу суміш від продуктів горіння, що не вступила в реакцію, викликано тим, що холодна горюча суміш перед ним нагрівається до температури займання за рахунок теплопровідності і дифузії розпечених продуктів горіння в холодну суміш. Лінійна швидкість, з якої переміщається фронт полум'я по однорідній горючій суміші, називається рівномірною швидкістю поширення полум'я, яка залежить як від виду газу, так і від його вмісту в газоповітряній суміші. Мінімальна швидкість для всіх видів горючих газів відповідає нижній і верхній межі займання, а максимальна - співвідношенню газів і повітря.
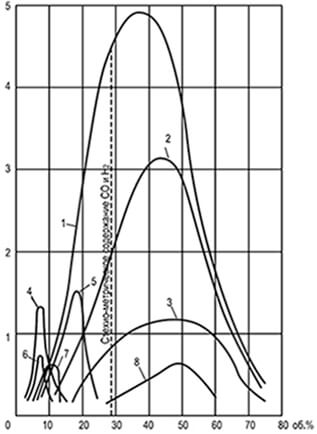
Рис. 8.1. Криві рівномірних швидкостей
поширення полум'я u н, визначені
у трубці діаметром 25,4 мм
1-водень; 2-водяний газ; 3-оксид вуглецю;
4-етилен; 5-коксовий газ; 6-етан; 7-метан;
8-генераторний газ пароповітряного дуття
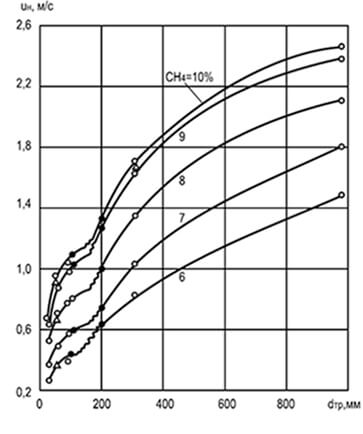
Рис. 8.2. Вплив діаметра d тр та концентрації
метану в суміші з повітрям на зміну
рівномірної швидкості поширення полум'я u н
Експериментами встановлено, що швидкість поширення полум'я залежить від діаметра циліндричної трубки, якою воно поширюється: чим більше діаметр, тим вища швидкість поширення. Збільшення діаметра трубки знижує вплив стінок на процес горіння і фронт полум'я, що переміщається, і сприяє посиленню конвекції (рис. 8.2). Аналіз даних графіка вказує, що при дуже малих розмірах трубок поширення полум'я взагалі неможливе (через сильне відносне тепловідведення). Розміри трубок, каналів та щілин, при яких полум'я не поширюється, називаються критичними.
Вони різні для різних газів:
- холодна суміш метану з повітрям – 3 мм;
- воднево-повітряна суміш – 0,9 мм;
- розігріта суміш метану з повітрям – 1,2 мм.
Згасання в каналах малого перерізу використовуються на практиці для створення вогнеперегороджувачів: сіток, що пламегасять, керамічних пористих дисків, дисків з пресованих металевих кульок, судин, що заповнюються дрібнозернистими матеріалами та ін); вогневих каналів у конструкції пальників, що працюють на газоповітряних сумішах.
Для порівняльної характеристики горючих властивостей газів (незалежно від розмірів трубок) запроваджено поняття «Нормальна швидкість поширення полум'я»- це швидкість, віднесена до холодної (ще незаймистої) суміші, з якої полум'я переміщається по нормалі до її поверхні. Фронт полум'я приймається плоским і рівним діаметру трубки:
u н = w p πr 2 / S (8.22)
де u н – нормальна швидкість поширення полум'я, м/с; w p - виміряна рівномірна швидкість поширення полум'я, м/с; r – радіус трубки, м; S - площа поверхні фронту полум'я, м2.
Таблиця 8.14. Швидкості поширення полум'я в різних газоповітряних сумішах (при t=20°C та p=103,3кПа),м/с
| Газ | Суміш із максимальною нормальною швидкістю поширення полум'я |
Стехіометрична суміш | ||||
|---|---|---|---|---|---|---|
| Зміст у суміші, про. % | Максимальна нормальна швидкість поширення |
Зміст у суміші, про. % | Нормальна швидкість поширення полум'я |
|||
| газу | повітря | газу | повітря | |||
| Водень | 42,0 | 58,0 | 2,67 | 29,5 | 70,5 | 1,6 |
| Оксид вуглецю | 43,0 | 57,0 | 0,42 | 29,5 | 70,5 | 0,30 |
| Метан | 10,5 | 89,0 | 0,37 | 9,5 | 90,5 | 0,28 |
| Етан | 6,3 | 93,7 | 0,40 | 5,7 | 94,3 | 0,32 |
| Пропан | 4,3 | 95,7 | 0,38 | 4,04 | 95,96 | 0,31 |
| н-Бутан | 3,3 | 96,7 | 0,37 | 3,14 | 96,86 | 0,30 |
| Етилен | 7,0 | 93,0 | 0,63 | 6,5 | 93,5 | 0,5 |
| Пропілен | 4,8 | 95,2 | 0,44 | 4,5 | 95,5 | 0,37 |
| Бутілен | 3,7 | 96,3 | 0,43 | 3,4 | 96,6 | 0,38 |
| Ацетилен | 10,0 | 90,0 | 1,35 | 7,75 | 92,25 | 1,0 |
Як очевидно з даних табл. 8.14, максимальна швидкість розповсюдження полум'я відповідає сумішам газу та повітря з недоліком окислювача (не стехіометричним). При надлишку пального підвищується ефективність зіткнення частинок реагуючих і швидкість хімічних реакцій зростає.
Швидкості поширення полум'я для газокисневих сумішей значно вище, ніж для газоповітряних. Так, максимальна нормальна швидкість поширення полум'я метано-кисневої суміші – 3,3 м/с, а для суміші пропану та бутану з киснем – 3,5–3,6 м/с.
Максимальна нормальна швидкість поширення полум'я у суміші складного газу з повітрям, м/с, визначається за формулою:
u н max = (r 1 u 1 + r 2 u 2 + … + r n u n)/(r 1 + r 2 + ... + r n)(8.23)
де r 1 , r 2 , ... r n - вміст окремих компонентів у складному газі, про. %; u 1 , u 2 ,...u n - максимальні нормальні швидкості поширення полум'я компонентів складного газу суміші з повітрям, м/с.
Наведені співвідношення придатні для газів, що мають близькі нормальні швидкості поширення полум'я, наприклад, для природних і зріджених вуглеводневих газів. Для сумішей газів, що мають різко різні швидкості поширення полум'я (наприклад, для сумішей природних і штучних газів, сумішей з високим вмістом водню), вони дають тільки наближені значення.
Якщо ж у суміші присутні баластові домішки (азот і діоксид вуглецю), то для наближеного розрахунку швидкості поширення полум'я слід скористатися формулою:
u б = u н max (1 – 0,01N 2 – 0,012СО 2)(8.24)
Значно підвищує швидкість поширення полум'я підігрів газоповітряної суміші:
і 'н = і н (Т'/Т)(8.25)
де і н - швидкості поширення полум'я в нагрітій суміші з абсолютною температурою Т, К; і н - те ж, в холодній суміші з температурою Т, До.
Попереднє нагрівання суміші змінює її щільність назад пропорційно до абсолютної температури, тому і швидкості поширення полум'я ростуть пропорційно цій температурі. Цей факт треба враховувати при розрахунках, особливо в тих випадках, коли вогневі канали пальників розташовуються в нагрітій кладці або на них впливає випромінювання топки, розпечених газів і т.п.
Рівномірність розповсюдження полум'я можлива при виконанні наступних умов:
- вогнева трубка має невелику довжину;
- горіння поширюється при постійному тиску, близькому до атмосферного.
Якщо довжина трубки значна, то рівномірне поширення полум'я для деяких сумішей може перейти у вібраційне, а потім - і в детонаційне зі надзвуковою швидкістю горіння (2000 м/с і більше), коли займання суміші відбувається за рахунок ударної хвилі, що нагріває суміш до температур, що перевищують температуру самозаймання. Детонація виникає в сумішах, що мають високі швидкості поширення полум'я. Межі концентрації детонації межі займистості газоповітряних і газокисневих сумішей, про. %: пропан – 3,2–37, ізобутан – 2,8–31, водень – 15–90. Тиск, що виникає при детонаційному горінні, може перевищувати початкове в десятки разів і призводити до руйнування труб та інших судин, розрахованих на високий тиск.
8.7. ГОРІННЯ В ЛАМІНАРНОМУ І турбулентному ПОТІКАХ

Рис. 8.3. Фронт горіння
газоповітряної суміші в
ламінарному режимі руху
Фронт полум'я може бути зупинений, якщо створити зустрічний рух горючої суміші зі швидкістю, що дорівнює нормальній швидкості розповсюдження полум'я. Наочний приклад – поверхня внутрішнього конуса бунзенівського пальника. За рахунок регулювання складу газоповітряної суміші, що витікає з пальника при ламінарному режимі руху, можна досягти появи стійкого та різко окресленого конуса горіння (рис. 8.3). Бічна поверхня конуса (фронт полум'я), нерухома щодо вогневої кромки каналу пальника, рухається у напрямку до газоповітряної суміші, що витікає, а полум'я в цьому випадку поширюється по нормалі до поверхні займання в кожній її точці. На поверхні конусного фронту полум'я зберігається рівність швидкостей - проекції швидкості потоку газоповітряної суміші на нормаль wн до конуса, що утворює, і нормальної швидкості поширення полум'я u н підпорядковуються закону Михельсона:
w н = w піт cosφ = u н (8.26)
де - кут між напрямком потоку і нормаллю до поверхні конусного фронту полум'я; w піт - середня швидкість потоку газоповітряної суміші, що проходить через пальник за одиницю часу, м/с.
Постійність нормальної швидкості розповсюдження полум'я справедливе лише для основної частини бічної поверхні конусного фронту полум'я. У вершині конуса швидкість збільшується завдяки прогріву газоповітряної суміші близько розташованими ділянками конусної поверхні фронту полум'я, а біля основи конуса - знижується за рахунок охолодного впливу торцевої частини вогневого каналу пальника.
Для практичних розрахунків зазвичай нехтують цією різницею та приймають швидкість проходження суміші через фронт полум'я постійної по всій поверхні конуса та рівної u н.
Середня нормальна швидкість поширення полум'я дорівнює
u н = V см / S (8.27)
де V см - обсяг газоповітряної суміші, що проходить через пальник, S - площа поверхні конусного фронту полум'я.
Насправді конусний фронт полум'я немає правильної геометричної форми, для точного визначення S полум'я фотографують, фронт полум'я розбивається ряд усічених конусів. Сума бічних поверхонь є загальна поверхня конусного фронту полум'я. Значення нормальних швидкостей поширення полум'я, визначені як методом бунзенівського пальника, так і іншими методами, однакові і дорівнюють нормальним швидкостям, наведеним у табл. 8.14.
Висота конусного фронту полум'я залежить переважно від розміру вогневого каналу пальника. Зменшення висоти полум'я може досягатися дробленням великих вогневих каналів на кілька дрібних. Для однакових за складом газоповітряних сумішей висота конусних фронтів полум'я малих каналів h може бути приблизно визначена за висотою фронту полум'я одиночного каналу Н:
h = Н/√n(8.28)
де n – число малих каналів.
Для пальників з високою тепловою потужністю (пальники промислових котлів, печей тощо) горіння, як правило, відбувається в турбулентному потоці - гладкий конусний фронт полум'я через вихровий рух і пульсації розмивається і втрачає чіткі конусні контури. При цьому спостерігаються два характерні види горіння, що відповідають дрібній великомасштабній турбулентності.
При масштабах турбулентності, що не перевищують товщину зони ламінарного горіння, конусний фронт полум'я зберігає свою форму і залишається гладким, хоча зона горіння збільшується. Якщо масштаб турбулентності перевищує товщину зони нормального горіння, поверхня конусного фронту полум'я стає нерівною. Це веде до збільшення сумарної поверхні фронту горіння та спалювання більшої кількості горючої суміші на одиницю поперечного перерізу потоку.
При великомасштабній турбулентності, що значно перевищує товщину зони ламінарного горіння, хвилювання поверхні фронту полум'я призводить до відриву окремих частинок гарячої суміші, що подрібнюються наступними пульсаціями. Фронт полум'я втрачає свою цілісність і перетворюється на систему окремих вогнищ горіння у вигляді рівних частинок горючої суміші, що розчленовуються і згорають у потоці.

Рис. 8.4. Зміна відносної швидкості
поширення полум'я коксового газу
у суміші з повітрям залежно від числа
Рейнольдса та режиму руху суміші
При великомасштабній турбулентності поверхня фронту полум'я, складаючись з поверхонь всіх частинок, що горять, збільшується, призводячи до різкого зростання швидкості поширення полум'я (рис. 8.4). У цьому випадку може відбуватися не тільки фронтове горіння, що розповсюджується з нормальною швидкістю v n , але і об'ємне, що виникає за рахунок турбулентних пульсацій розпечених продуктів горіння свіжу суміш. Отже, сумарна швидкість поширення полум'я за великомасштабної турбулентності визначається тим чи іншим поєднанням елементів фронтового та об'ємного горіння.
За відсутності пульсацій турбулентна швидкість горіння стає рівною нормальній швидкості розповсюдження полум'я. Навпаки, якщо пульсаційна швидкість значно перевищує нормальну, турбулентна швидкість горіння стає мало залежною від фізико-хімічних властивостей паливної суміші. Експерименти показали малу залежність швидкості згоряння різних гомогенних газоповітряних сумішей з >1 у промислових топках від нормальної швидкості поширення полум'я.
8.8. СТІЙКІСТЬ ГОРІННЯ
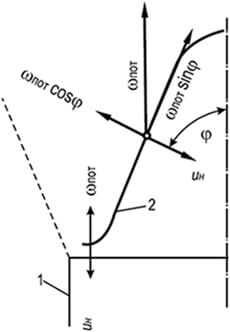
Рис. 8.5. Схема прямої компенсації
u н = w піт при ламінарному русі
газоповітряної суміші
1 – стінка пальника;
2 – фронт полум'я
Основні фактори, що впливають на стійкість горіння, - швидкість закінчення газоповітряної суміші та поширення полум'я. При горінні газоповітряних сумішей у ламінарному потоці стійкою частиною конусного фронту полум'я є його нижня частина. У цьому місці фронт полум'я за рахунок розширення газоповітряної суміші, що витікає в атмосферу, і гальмує дії стінки каналу розгорнутий на горизонталь і піднятий над кромкою каналу на товщину фронту полум'я (рис. 8.5).
На даній ділянці фронту відбувається повна компенсація швидкості газоповітряного потоку швидкістю розповсюдження полум'я u н = w піт. На всій іншій конусній ділянці фронту полум'я компенсація має частковий характер і здійснюється тільки в напрямку, нормальному до фронту горіння: u н = w пот cosφ. Складаючий w піт sinφ залишається неврівноваженим і зносить точку займання від основи конуса до його вершини. Стабільність конусного фронту полум'я пояснюється тим, що кільцевий пояс біля основи служить джерелом запалювання, без якого решта фронту була б знесена потоком газоповітряної суміші.
Якщо швидкість закінчення суміші перевищує швидкість розповсюдження полум'я, ширина паску, що запалює, зменшується, поки не стане мізерно малою. У цьому випадку стійкість фронту полум'я порушується і відбувається відрив від пальника. Якщо ж швидкість поширення полум'я в кільцевій пристінній області (не на стінці) перевищить швидкість закінчення газоповітряної суміші, полум'я втягується всередину змішувача пальника (проскок).
При відриві спостерігаються:
- зрив полум'я з пальника та його згасання;
- відрив від кромки вогневого каналу, коли полум'я досягає нового досить стійкого положення в потоці над пальником;
- зрив піднятого полум'я та його згасання;
- відкидання піднесеного смолоскипа до краю вогневого каналу пальника;
- створення зваженого полум'я при підпалюванні струменя на певній відстані від пальника.
Всі ці явища неприпустимі, оскільки призводять до накопичення в навколишній атмосфері або в топці незгорілого газу.
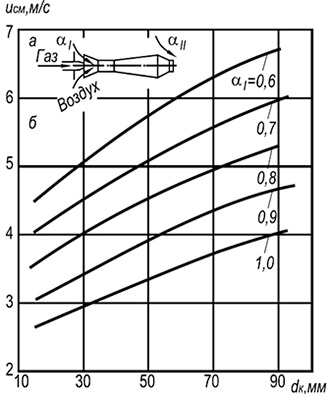
Рис. 8.6. Залежність швидкості відриву одиночного
полум'я у відкритій атмосфері сумішей природного
газу з повітрям від розміру вогневого каналу та
вміст первинного повітря.
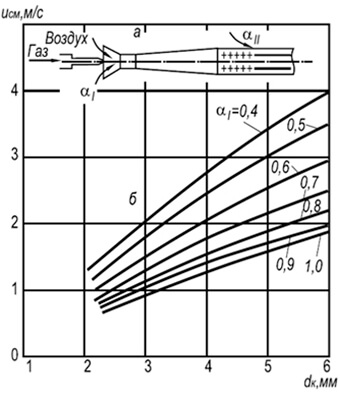
Рис. 8.7. Залежність швидкості відриву
багатофакельного полум'я у відкритій атмосфері
сумішей природного газу з повітрям від розміру
вогневого каналу та вмісту первинного повітря.
а – схема пальника; б – криві відриву полум'я
На рис. 8.6 показані експериментальні криві відриву полум'я від кромок вогневих каналів інжекційних однофакельних пальників, що працюють на суміші холодного газу з повітрям. На межі та вище зазначених кривих починається відрив полум'я, а нижче кривих – стійке горіння.
У практиці поширені багатофакельні інжекційні пальники з вогневими каналами діаметром 2–6 мм (рис. 8.7). Встановлення швидкостей відриву полум'я w отр для таких пальників може здійснюватися за такою формулою:
w отр = 3,5 10 -3 d k T 2 (1 + V т) / (1 + α 1 V т) (8.29)
де d k - Діаметр вогневих каналів, м; α 1 - коефіцієнт надлишку первинного повітря; T - абсолютна температура газоповітряної суміші, До.
За формулою видно, що стабільність горіння зростає зі збільшенням діаметрів вогневих каналів та температури та знижується зі збільшенням коефіцієнта надлишку первинного повітря. Стабільність горіння також підвищується за рахунок взаємного впливу полум'я.
Відрив полум'я від вогневих каналів може й інших причин. При неправильному розташуванні пальника та каналів відведення продуктів згоряння вони можуть потрапити в інжектор пальника та призвести до відриву полум'я (за рахунок зниження швидкості розповсюдження полум'я у газоповітряній суміші, розведеній інертними газами). Також причиною відриву може бути висока швидкість вторинного повітря, що здуває полум'я з вогневих каналів.
Таблиця 8.15. Швидкість гомогенної суміші природної
газу з повітрям, при якій відбувається проскок
полум'я, м/с (температура суміші 20°С)
| Діаметри вогневих каналів |
Коефіцієнт надлишку первинного повітря | |||||
|---|---|---|---|---|---|---|
| 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | |
| 3,5 | 0,05 | 0,10 | 0,18 | 0,22 | 0,23 | 0,21 |
| 4,0 | 0,08 | 0,12 | 0,22 | 0,25 | 0,26 | 0,20 |
| 5,0 | 0,09 | 0,16 | 0,27 | 0,31 | 0,31 | 2,23 |
| 6,0 | 0,11 | 0,18 | 0,32 | 0,38 | 0,39 | 0,26 |
| 7,0 | 0,13 | 0,22 | 0,38 | 0,44 | 0,45 | 0,30 |
| 8,0 | 0,15 | 0,25 | 0,43 | 0,50 | 0,52 | 0,35 |
| 9,0 | 0,17 | 0,28 | 0,48 | 0,57 | 0,58 | 0,39 |
| 10,0 | 0,20 | 0,30 | 0,54 | 0,64 | 0,65 | 0,43 |
Неприпустимий також і проскок полум'я всередину змішувача пальника, що зазвичай супроводжується бавовною. Проскок призводить або до згасання полум'я і викиду суміші, що не згоріла, в приміщення або топку, або до горіння суміші всередині пальника. Тенденція полум'я до проскоку залежить від виду газу, нормальної швидкості поширення полум'я, вмісту первинного повітря в газоповітряній суміші, розмірів вогневих каналів, температур суміші або стінок каналів. Вплив на проскок полум'я надають також коефіцієнт теплопровідності матеріалів, з яких виконані вогневі канали, їх форма, глибина та якість виготовлення, наявність задирок, обломів країв тощо.
Наведені у табл. 8.15 значення швидкостей гомогенних сумішей природних газів з повітрям, при яких відбувається проскок, можна використовувати і для інших газів з урахуванням поправок:
w" пр = w пр u" н /u н (8.30)
де w пр - швидкість проскоку полум'я для іншого газу, м/с; w пр - швидкість проскоку для газу (по табл. 8.15), м/с; u н - нормальна швидкість поширення полум'я для іншого газу, м/с; u н - швидкість поширення полум'я у метані, м/с.
Максимальна швидкість проскоку може бути розрахована за наближеною формулою:
w пр = 0,73 10 -3 d k T 2 (8.31)
Цією ж формулою з достатнім для практики наближенням можна керуватися і для інших газів з введенням поправки на зміну нормальної швидкості поширення полум'я. На підставі численних експериментів можна зробити наступний висновок: межі стійкої роботи пальників обмежені швидкостями відриву та проскакування полум'я.
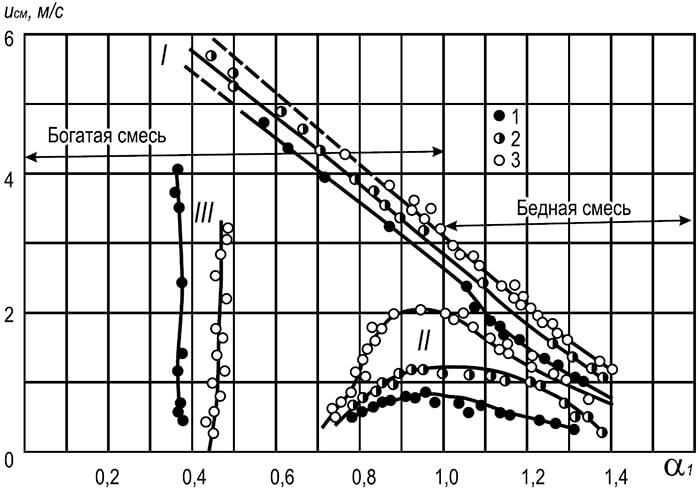
Рис. 8.8. Залежність швидкості газоповітряної суміші, коли відбувається відрив і проскок полум'я, від коефіцієнта надлишку первинного повітря.
I – відрив полум'я; II - проскок полум'я; III – жовті краї полум'я;
1–3 діаметри вогневих каналів пальників, мм: 1 – 25, 2 – 25, 3 – 32
На рис. 8.8 наведено криві, що характеризують швидкості потоку суміші природного газу з повітрям, при яких відбуваються відрив і проскок полум'я. Характер кривих свідчить про різке зниження стійкості полум'я зі збільшенням вмісту у суміші первинного повітря. Підвищення стійкості полум'я відбувається при зниженні вмісту первинного повітря і досягає максимуму при зменшенні до нуля (дифузійне горіння). Однак таке спалювання вуглеводневих газів у багатьох випадках неприпустимо, тому що призводить до появи жовтих язичків полум'я, що характеризують появу в ньому сажистих частинок.
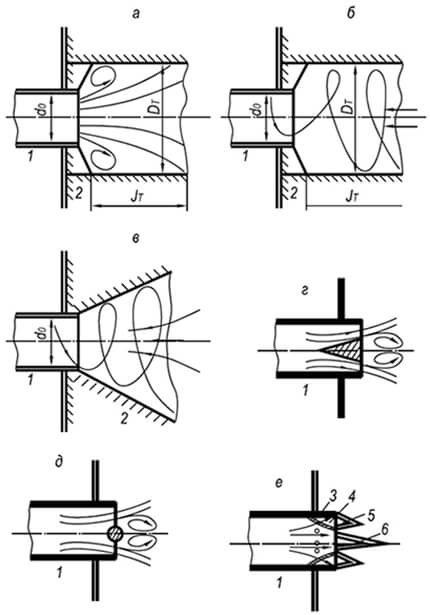
Рис. 8.9. Поширені стабілізатори горіння
а – циліндричний тунель із раптовим розширенням перерізу;
б – те саме, при закрученому потоці;
в – конічний тунель при закрученому потоці;
г – стабілізатор у вигляді конічного тіла;
д – те саме, у вигляді круглого стрижня;
е – те саме, у вигляді стійкого кільцевого полум'я
1 – вогневий насадок пальника; 2 – тунель; 3 – бічне отвір;
4 – кільцевий канал; 5 – кільцеве полум'я;
6 – полум'я основного потоку газоповітряної суміші
У практиці для розширення діапазону стійкості горіння будь-яких горючих газоповітряних сумішей швидкість потоку приймається у кілька разів більшою, ніж швидкість відриву. Запобігання відриву полум'я досягається застосуванням стабілізаторів горіння (рис. 8.9).
Для стабілізації полум'я інжекційних та інших пальників, що видають осесиметричні газоповітряні струмені, застосовуються вогнетривкі циліндричні тунелі з раптовим розширенням їх перетину. Дія такого тунелю засноване на периферійній циркуляції частини розпечених продуктів горіння, що виникає за рахунок розрідження, що створюється струменем.
Для стабілізації полум'я пальників, що видають закручену газоповітряну суміш, застосовуються як циліндричні, і конічні тунелі з кутом розкриття 30–60°. При закрученому потоці на периферії тунелю виникає більший тиск, ніж у центральній частині. Це призводить до приосевой рециркуляції частини розпечених продуктів горіння і підпалювання холодної газоповітряної суміші, що втікає в тунель, зсередини.
Коли установка тунелів неможлива, для стабілізації полум'я застосовують тіла погано обтічної форми, що розміщуються в потоці газоповітряної суміші на виході з вогневого каналу пальника. Запалення суміші при цьому відбувається на периферії стабілізатора, за яким виникає часткова рециркуляція розпечених газів, що підпалюють горючу суміш зсередини. Стабілізуюча дія таких пристроїв нижча, ніж тунелів.
В інжекційних та багатофакельних пальниках широко використовуються стабілізатори горіння у вигляді спеціальної вогневої насадки. Стабілізуюча дія цього пристрою заснована на запобіганні розведенню основного потоку в корені смолоскипа надлишковим повітрям, що звужує межі його стійкості, а також на підігріванні та підпалюванні кільцевим полум'ям основного потоку по всій його периферії. Стійкість кільцевого полум'я при відриві досягається за рахунок такого співвідношення перерізів вогневого кільця і бічних отворів, при якому швидкість газоповітряної суміші кільцевої порожнини не перевищує нормальної швидкості розповсюдження полум'я. Для запобігання проскоку полум'я в змішувач пальника розміри бічних отворів, що формують кільцеве полум'я, приймаються меншими за критичні.
8.9. СХЕМИ ВОГНІ ПЕРЕГРАДНИКІВ
Повітря або кисень, потрапивши в газопровід, може утворити вибухову суміш, тому необхідно обов'язково оберігати трубопроводи від проникнення повітря або кисню. На всіх вибухонебезпечних виробництвах повинні бути створені умови, що виключають можливість виникнення імпульсів, що підпалюють. Джерелами займання, що призводять до газоповітряних сумішей до вибуху, є:
- відкрите полум'я;
- електричні розряди діючого електроустаткування;
- коротке замикання в електричних дротах;
- іскріння в електричних приладах;
- перегорання відкритих запобіжників;
- розряди статичної електрики.
Вибухобезпечність забезпечується різними вогнеперешкодниками. що встановлюються в трубопроводах, на резервуарах, на продувних газопроводах, свічках та інших системах, де існує небезпека вибуху.
Погасання полум'я в каналі, заповненому горючою сумішшю, відбувається лише при мінімальному діаметрі каналу, що залежить від хімічного складу та тиску суміші, і пояснюється втратами теплоти із зони реакції до стінок каналу. При зменшенні діаметра каналу збільшується його поверхню на одиницю маси суміші, що реагує, тобто. зростають тепловтрати. Коли вони досягають критичного значення, швидкість реакції горіння зменшується настільки, що подальше поширення полум'я стає неможливим.
Пламегасна здатність вогнеперегороджувача залежить в основному від діаметра гасять каналів і набагато менше - від їх довжини, а можливість проникнення полум'я через гасять канали залежить в основному від властивостей і складу горючої суміші і тиску. Нормальна швидкість поширення полум'я є основною величиною, що визначає розмір гасять каналів і вибір типу вогнеперегороджувача: чим вона більша, тим меншого розміру канал потрібний для гасіння полум'я. Також розміри каналів, що гасять, залежать від початкового тиску горючої суміші. Для оцінки пламегасящей здатності вогнеперегороджувачів застосовується т.зв. критерій Пекле Ре:
Ре = w cm dc p p/(RT 0 λ 0)(8.32)
У межі гасіння полум'я формула критерій Пекле набуває вигляду:
Рекр = w см d кр c p p кр /(RT 0 λ 0)(8.33)
де w см – нормальна швидкість поширення полум'я; d - діаметр каналу, що гасить; d кp - критичний діаметр каналу, що гасить; з р - питома теплоємність газу при 0°З постійному тиску; р - тиск газу; р кр – критичний тиск газу; R - універсальна постійна газова; Т 0 – абсолютна температура газу; 0 - теплопровідність вихідної суміші.
Таким чином, для розрахунку пламегасящей здатності вогнеперегороджувачів необхідні наступні вихідні дані:
- нормальні швидкості поширення полум'я горючих газових сумішей;
- фактичний розмір максимальних каналів, що гасять даного вогнеперешкодника.
Якщо отримане значення більше Ре кр = 65, вогнеперегороджувач не затримає поширення полум'я даної горючої суміші, і навпаки, якщо Ре< 65, огнепреградитель задержит распространение пламени. Запас надежности огнепреградителя, который находят из отношения Ре кр к вычисленному значению Ре, должен составлять не менее 2:
П = Ре кр / Ре = 65 / Ре > 2,0 (8.34)
Використовуючи факт сталості Ре кр на межі гасіння полум'я, можна обчислити орієнтовний критичний діаметр каналів для будь-якої горючої суміші, якщо відомі швидкість поширення полум'я, а також теплоємність та теплопровідність газової системи. Рекомендуються наступні критичні діаметри каналу, що гасить, мм:
- при спалюванні газоповітряної суміші - 2,9 для метану та 2,2 для пропану та етану;
- при спалюванні кисневих сумішей у трубах (при абсолютному тиску 0,1 МПа в умовах вільного розширення продуктів згоряння) - 1,66 для метану та 0,39 для пропану та етану.
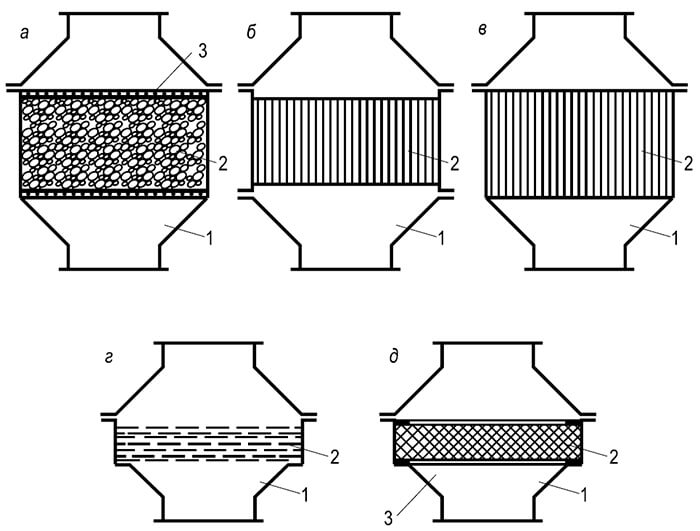
Рис. 8.10. Типи вогнезапобіжників:
а – насадочний; б - касетний; в – пластинчастий; г – сітчастий; д – металокерамічний
Конструктивно вогнеперегородники поділяються на чотири типи (рис. 8.10):
- з насадкою із гранульованих матеріалів;
- із прямими каналами;
- з металокераміки чи металоволокна;
- сітчасті.
За способом встановлення - на три типи: на трубах для викиду газів в атмосферу або факел; на комунікаціях; перед газогорілчаними пристроями.
У корпусі насадочного вогнеперегороджувача між решітками знаходиться насадка з наповнювачем (скляні або фарфорові кульки, гравій, корунд та інші гранули із міцного матеріалу). Касетний вогнеперегороджувач являє собою корпус, в який вмонтована вогнеперегороджувальна касета з гофрованої та плоскої металевих стрічок, щільно звитих у рулон. У корпусі пластинчастого вогнеперегороджувача - пакет з плоскопаралельних металевих пластин зі строго певною відстанню між ними. У сітківки в корпусі розміщений пакет з щільно стиснутих металевих сіток. Металокерамічний огнепреградитель є корпус, всередині якого встановлена пориста металокерамічна пластина у вигляді плоского диска або трубки.
Найчастіше застосовуються сітчасті вогнеперегородники (їх почали встановлювати ще на початку XIX століття у шахтарських лампах (лампах Деві) для запобігання вибухам рудничного газу). Ці вогнетривкі рекомендуються для захисту установок, в яких спалюється газове паливо. Вогнеперегороджувальний елемент складається з декількох шарів сітки латунної з розміром осередків 0,25 мм, затиснутих між двома перфорованими пластинами. Пакет сіток укріплений у знімній обоймі.
Корпус вогнеперегороджувача виготовлений з чавунного або алюмінієвого сплаву і складається з двох однакових частин, з'єднаних болтами з розташованою знімною обоймою. Крім розглянутих сухих вогнеперегороджувачів, широко застосовуються запобіжні рідинні затвори, що оберігають газопроводи від попадання вибухової хвилі і полум'я при газополум'яній обробці металів, а також трубопроводи та апарати, заповнені газом, від проникнення в них кисню і повітря.
Рідинні затвори повинні:
- перешкоджати поширенню вибухової хвилі при зворотних ударах та при займанні газів;
- оберігати газопровід від потрапляння до нього кисню та повітря;
- забезпечувати мінімальний гідравлічний опір проходженню потоку газу. Крім того, рідина із затвора не повинна нестись у вигляді крапель у помітних кількостях.
8.10. ПРИНЦИПИ СПАЛЮВАННЯ
В основі процесів спалювання газу – принципи, умовно звані кінетичним та дифузійним. При кінетичному принципі до початку горіння створюється однорідна суміш з деяким надлишком повітря. Згоряння такої суміші відбувається в короткому прозорому факелі без утворення полум'я частинок сажі. Для спалювання газу за кінетичним принципом застосовуються спеціальні змішувачі або інжекційні пальники, що готують газоповітряну суміш з коефіцієнтом надлишку первинного повітря α 1 = 1,02:1,05.
При меншому вмісті первинного повітря за кінетичним принципом протікає тільки початкова стадія горіння до використання кисню, що знаходиться в суміші з газом. Решту газів і продуктів неповного згоряння спалюють з допомогою зовнішньої дифузії кисню (вторинного повітря), тобто. підф ф у з і о н н о м у принципу. При α 1< 1 у факела есть два видимых фронта горения: внутренний, возникающий за счет первичного воздуха, и наружный, образующийся за счет диффузии кислорода из окружающей среды. Общая высота пламени при таком горении возрастает, а температура - несколько снижается. Устойчивость пламени и его прозрачность зависят от содержания первичного воздуха в смеси: чем оно выше, тем ниже устойчивость пламени, больше его прозрачность, и наоборот.
Принцип спалювання газу з α 1< 1,0 является п р о м е ж у т о ч н ы м (между кинетическим и диффузионным). С учетом этого принципа конструируются все газовые аппараты с инжекционными горелками. В таких горелках содержание первичного воздуха в смеси принимается в зависимости от вида газа таким, чтобы:
- в полум'ї були відсутні сажисті частки;
- забезпечувалася стабільність горіння при змінах теплової потужності в будь-яких необхідних у практиці межах.
При дифузійному принципі (α 1 = 0) процеси горіння та змішування розвиваються паралельно. Так як процеси змішування протікають значно повільніше процесів горіння, швидкість і повнота згоряння визначаються швидкістю і повнотою змішування газу і повітря. Змішування газу з повітрям при цьому може відбуватися шляхом дифузії (або повільної молекулярної, або турбулентної, що включає і молекулярну як кінцеву стадію). Відповідно до цього різняться швидкість горіння і структура дифузійного полум'я.
Особливості такого спалювання:
- стійкість полум'я за зміни теплової потужності від нуля до максимально можливих за умов відриву;
- сталість температур по всій висоті полум'я;
- можливість розподілу його за великими довільними поверхнями;
- компактність пальників та простота їх виготовлення;
- значна висота полум'я та неминучість піролітичних процесів, що призводять до утворення яскравого сажистого полум'я.
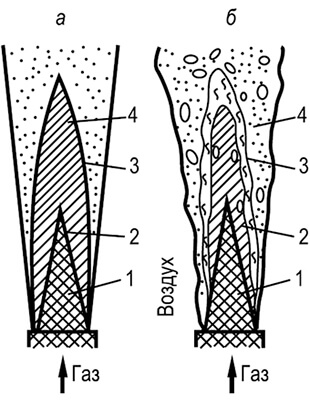
Рис. 8.11. Структура вільних полум'я:
а – ламінарне полум'я; б – турбулентне полум'я
Дифузійне горіння може бути переведено в кінетичне або проміжне, якщо змішування випереджатиме процеси горіння. На практиці цього можна домогтися примусової подачі повітря, що призводить до утворення квазигомогенной газоповітряної суміші з α 1 > 1,0, що згорає у прозорому факелі.
Для ілюстрації принципів спалювання на рис. 8.11. наведено схеми вільних смолоскипів: ламінарного та турбулентного. Ламінарний факел виникає за рахунок взаємної молекулярної дифузії газу та повітря. Всередині конусного ядра 1 - чистий газ, що з трубки при ламінарному режимі течії. У зоні 2 - суміш із газу та продуктів згоряння, у зоні 3 - суміш із продуктів згоряння та повітря. Кордон 4 являє собою гладкий конусний фронт полум'я, якого зовні дифундують молекули повітря, а зсередини - молекули газу. Продукти згоряння частково дифундують назустріч газу, інтенсивно нагріваючи його в передполум'яній зоні. Це призводить до піролізу вуглеводнів та утворення сажистих частинок, що надають полум'ю яскравої світності.
Інтенсифікувати горіння можна за рахунок турбулізації потоків, що змішуються. У турбулентного смолоскипа немає чіткого конусного фронту горіння, він «розмитий» і подрібнений пульсаціями на окремі частинки.
Структура полум'я складається з ядра чистого газу 1 зони порівняно повільного горіння 2 розмитої зони найбільш інтенсивного горіння 3 з високим вмістом продуктів згоряння і зони горіння 4 з переважанням в ній повітря. Чітко виражених меж між зонами немає, вони безперервно зміщуються залежно від рівня турбулізації потоку. Особливостями турбулентного факела є:
- протікання процесу горіння майже з усього обсягу;
- підвищення інтенсивності горіння;
- велика прозорість полум'я;
- менша його стійкість стосовно відриву.
Турбулентне спалювання газу широко використовується в топках різних казанів та печей. Для інтенсифікації процесу горіння застосовують як природну (за рахунок підвищення швидкостей), так і штучну, турбулізацію потоків, наприклад, закруткою повітряного потоку та подачею до нього під різними кутами тонких струменів газу.
8.11. УМОВИ ОСВІТИ ПРОДУКТІВ НЕПОВНОГО ЗГОРЯННЯ І ЗНИЖЕННЯ В НИХ КОНЦЕНТРАЦІЇ ШКІДЛИВИХ РЕЧОВИН
При спалюванні горючих газів у продуктах згоряння можуть утримуватися компоненти як повного (діоксид вуглецю та водяна пара), так і неповного згоряння (оксид вуглецю, водень, ненасичені, насичені, ароматичні вуглеводні та сажисті частки). Крім того, у продуктах згоряння завжди виявляються і оксиди азоту. Наявність продуктів неповного згоряння у значних концентраціях є неприпустимим, оскільки призводить до забруднення атмосфери токсичними речовинами та до зниження ККД установок, що працюють на газовому паливі.
Основні причини їхнього великого змісту:
- спалювання газів із недостатньою кількістю повітря;
- погане змішування горючих газів та повітря до та в процесі горіння;
- надмірне охолодження полум'я до завершення реакцій горіння.
Для метану реакції горіння (залежно від концентрації кисню в суміші, що реагує) можуть бути описані наступними рівняннями:
СН 4 + 2О 2 = СО 2 + 2Н 2 О + 800,9 МДж/моль
при стехіометричному співвідношенні або при надлишку окислювача;
СН 4 + О 2 = СО + Н 2 + Н 2 О + Q і СН 4 + 0,5 О 2 = СО + 2Н 2 О + Q
при нестачі окислювача.

Рис. 8.12. Проміжні продукти згоряння
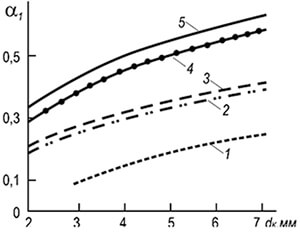
Рис. 8.13. Вміст первинного повітря,
при якому запобігає освіті
жовтих мов у полум'ї
Газ: 1 – коксовий;
2 – природні газові родовища;
3 – нафтових родовищ;
4 – пропан; 5 – бутан
На рис. 8.12 показано наближений усереднений склад деяких проміжних сполук - водню, оксиду вуглецю, етилену, ацетилену та порівняно невелику кількість насичених і найпростіших ароматичних сполук - і діоксиду вуглецю, що виникають в полум'ї при дифузійному горінні природного газу (97%). Спалювання газу проводилося у ламінарному факелі, газ випливав із трубки діаметром 12 мм. Загальна висота полум'я 130-140 мм.
Максимальна концентрація водню і ацетилену досягається приблизно на одній висоті полум'я, вони зникають майже одночасно у вершині зони полум'я, що світиться. З усіх проміжних сполук, що утворюються в полум'ї (виключаючи сажисті частинки) оксид вуглецю зникає останнім. Це дає підстави судити з його індексу про повноту згоряння газу. У продуктах згоряння завжди присутні оксиди азоту, максимальна концентрація яких виникає у зонах інтенсивного вигоряння оксиду вуглецю та водню.
Горіння вуглеводневих газів з нестачею окислювача призводить до утворення частинок сажі, що надають полум'я жовтого забарвлення. Процес вигоряння сажі протікає стадійно та порівняно повільно. Іноді вигоряння частинок сажі, що утворилися, затягується і може припинитися повністю при вході в низькотемпературну область факела або при омиванні полум'ям теплообмінних поверхонь. Таким чином, наявність полум'я, що світиться, завжди свідчить про протікання піролітичних процесів і про можливість хімічної неповноти згоряння, особливо в малогабаритних екранованих топках котлів.
Запобігання утворенню сажистих частинок досягається попереднім змішуванням вуглеводневих газів з достатньою кількістю окислювача. Вміст первинного повітря в суміші, при якому виникає прозоре полум'я, залежить не тільки від виду вуглеводнів, а й від умов змішування з вторинним повітрям (діаметр вогневих каналів пальників) (рис. 8.13). На межі і вище кривих полум'я прозоре, а нижче кривих має жовті язички. Криві показують, що вміст первинного повітря в суміші зростає зі збільшенням числа вуглецевих атомів у молекулі та діаметра вогневих каналів пальників. Коефіцієнт надлишку первинного повітря 1 у суміші, при якому зникають жовті язички полум'я, залежно від зазначених факторів може бути визначений для малих вогневих каналів пальників:
α 1 = 0,12 (m + n/4) 0,5 (d k /d 0) 0,25 (8.35)
де m і n - число вуглецевих та водневих атомів у молекулі або середнє їх число для складного газу; d k – діаметр вогневих каналів пальника, мм; d 0 – еталонний діаметр каналу пальника (1 мм).
Забезпечення повноти згоряння в практичних умовах - завдання досить складне, що залежить не тільки від принципу спалювання газу, а й від умов розвитку полум'я в обсязі топки. Найбільш високі вимоги щодо повноти згоряння пред'являються до побутових апаратів та інших установок, що скидають продукти згоряння в атмосферу. Згоряння газу в таких установках є найважчим, оскільки пов'язане з омиванням полум'ям холодних теплообмінних поверхонь. Для спалювання газу в побутових плитах застосовують інжекційні багатофакельні пальники, що утворюють гомогенну суміш з коефіцієнтом надлишку первинного повітря α 1< 1. Недостающий для сгорания газа воздух поступает за счет диффузии из окружающей атмосферы.
Рис. 8.14. Концентрація оксиду вуглецю
у продуктах згоряння у газовій плиті
а – пальник з периферійною подачею вторинного повітря;
б – з центральною та периферійною подачею вторинного повітря
1 – природний газ, пальник з периферійним підведенням
вторинного повітря, відстань до дна посуду 25 мм;
2–4 – природний газ, пальник з перифейрійним та
центральним підведенням вторинного повітря, відстань
до дна посуду, мм: 2 – 25, 3 – 18, 4 – 10;
5 – скраплений газ, пальник з центральним та периферійним
підведенням вторинного повітря, відстань до дна посуду 25 мм;
6 - скраплений газ, пальник з периферійним підведенням
На рис. 8.14 наведено схеми 2-конфорочних пальників для побутових газових плит та усереднену концентрацію оксиду вуглецю СО у продуктах згоряння природного метану (95 об. %) та пропану (93 об. %) при роботі пальників з номінальною тепловою потужністю. Відмінність пальників полягає в тому, що до однієї з них вторинне повітря підводиться лише з периферії, а до іншої – як із периферії, так і з центрального каналу.
Повнота згоряння газу залежить від коефіцієнта надлишку первинного повітря суміші, відстані від вогневих каналів пальника до дна посуду, виду пального газу, способу підведення вторинного повітря. При цьому збільшення вмісту первинного повітря суміші, а також збільшення відстані від пальника до дна посуду призводять до зниження концентрації оксиду вуглецю в продуктах згоряння. Мінімальна концентрація оксиду вуглецю відповідає коефіцієнту надлишку первинного повітря α 1 = 0,6 і вище та відстані від пальника до дна посуду 25 мм, а максимальна - α 1 = 0,3 і нижче та відстані від пальника до дна посуду 10 мм. Крім того, збільшення теплової потужності пальників на 15–20% за рахунок підвищення тиску газу призводить до зростання концентрації оксиду вуглецю в продуктах згоряння у 1,2–1,3 раза, а за рахунок теплоти згоряння газу – у 1,5–2 рази.
На появу в процесі горіння ароматичних сполук - бензолу, поліциклічних бензпірену, безантрацену та ін - слід звернути особливу увагу, так як деякі з них канцерогенні. Процес освіти дуже складний і протікає стадійно. На першому етапі з'являється ацетилен та його похідні. У полум'яній зоні ці речовини зазнають процесів подовження ланцюга з перебудовою потрійних вуглецевих зв'язків на подвійні. В результаті циклізації та дегідратації призводять до появи різних ароматичних сполук, включаючи поліциклічні.
Таблиця 8.16. Середня концентрація в продуктах згоряння оксиду вуглецю та бенз(а)пірену в залежності від виду газу, типу пальника та коефіцієнта надлишку первинного повітря (теплове навантаження пальника - 1600 ккал/год, відстань від пальника до дна посуду - 24-26 мм)
| Тип пальника | Середня концентрація | |
|---|---|---|
| оксиду вуглецю, мг/л (У перерахунку на α = 1,0) |
бенз(а)пірена, мкг/100 м 3 |
|
| Природний газ | ||
при α i = 0,60 ÷ 0,70 |
0,10 | Не знайден |
при α i = 0,30 ÷ 0,35 |
1,20 | Сліди |
при α i = 0,60 ÷ 0,70 |
0,50 | Не знайден |
при α i = 0,30 ÷ 0,35 |
0,12 | Не знайден |
| Зріджений вуглеводневий газ | ||
| Пальник з периферійним підведенням вторинного повітря: | ||
при α i = 0,60 ÷ 0,70 |
0,30 | 0,03 |
при α i = 0,30 ÷ 0,35 |
1,20 | 1,10 |
| Пальник з центральним та периферійним підведенням вторинного повітря: | ||
при α i = 0,60 ÷ 0,70 |
0,07 | 0,02 |
при α i = 0,30 ÷ 0,35 |
1,00 | 0,045 |
Дані таблиці. 8.16 показують, що при спалюванні природних газів з коефіцієнтом надлишку первинного повітря α 1 = 0,6 і вище на обох типах пальників концентрація оксиду вуглецю в продуктах згоряння відповідає вимогам ГОСТ 5542–87.
Таблиця 8.17. Відстань між кромками вогневих каналів інжекційних однорядних пальників залежно від їх розмірів та коефіцієнта надлишку первинного повітря.
| Діаметри вогневих каналів, мм | Відстань між кромками каналів, мм при різних значеннях коефіцієнта надлишку первинного повітря α 1 | ||||
|---|---|---|---|---|---|
| 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | |
| 2,0 | 11 | 8 | 6 | 5 | 4 |
| 3,0 | 15 | 12 | 9 | 7 | 5 |
| 4,0 | 16 | 14 | 11 | 9 | 7 |
| 5,0 | 18 | 15 | 14 | 12 | 10 |
| 6,0 | 20 | 18 | 16 | 14 | 12 |
Дослідження показали, що відстані між кромками вогневих каналів, що забезпечують швидке поширення полум'я, що запобігають їх злиттю, залежать від їх розміру та вмісту первинного повітря в суміші, зменшуючись з його збільшенням. Оптимальні відстані між кромками каналів, що забезпечують достатню повноту згоряння газу та швидке розповсюдження полум'я, наведено в табл. 8.17. При розташуванні вогневих каналів у два ряди у шаховому порядку відстані між кромками можуть прийматись по цій же таблиці. Відстань між рядами при цьому має бути в 2–3 рази більшою за відстані між каналами.
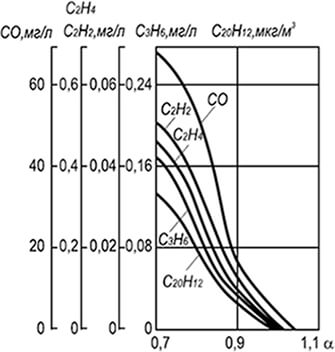
Рис. 8.15. Концентрація оксиду вуглецю, ацетилену,
етану, етилену та бенз(а)пірену в продуктах згоряння
газу середнього тиску в інжекційному пальнику
Узагальнення численних експериментальних даних дозволило отримати усереднені криві концентрації у продуктах згоряння різних компонентів, що якісно та кількісно характеризують процес горіння (рис. 8.15). Повне згоряння гомогенної газоповітряної суміші досягається лише за коефіцієнта надлишку первинного повітря α = 1,05 і від. При зменшенні вмісту повітря у суміші, особливо при α< 1,0, возрастает концентрация оксида углерода СО, ацетилена С 2 Н 2 , этилена С 2 Н 4 , пропилена С 3 Н 6 и пропана С 3 Н 8 , а также бенз(а)-пирена С 20 Н 9 . Также возрастает концентрация и других компонентов - водорода, бензола и др.
Крім розглянутих продуктів незавершеного горіння, при спалюванні газу завжди виникає деяка кількість оксидів азоту, утворення яких відбувається в зонах високих температур після завершення основних реакцій горіння, так і в процесі горіння. Максимальна концентрація NO х виникає на кінцевих стадіях, що відповідають вигорянню газу та інтенсивному горінню проміжних продуктів у вигляді водню та оксиду вуглецю.
Первинне з'єднання при горінні газоповітряних сумішей – оксид азоту. Початок ланцюгової реакції пов'язаний з атомарним киснем, що виникає в зонах високих температур за рахунок дисоціації молекулярного кисню:
Про 2 -> 2О - 490 кДж/моль(8.36)
Про + N 2 -> NO + N - 300 кДж/моль(8.37)
N + Про 2 –> 2NO + 145 кДж/моль(8.38)
Балансова реакція
N 2 + Про 2 –> 2NO - 177 кДж/моль(8.39)
Утворення атомарного кисню відбувається і при частковій дисоціації продуктів згоряння: при зниженні температури та наявності кисню частина оксиду азоту (1–3 об. %), що утворився, окислюється до діоксиду азоту NO 2 . Найінтенсивніше реакція протікає після виходу оксиду азоту в атмосферу. Основні фактори, що впливають:
- температура у реакційних зонах;
- коефіцієнт надлишку повітря та час контакту реагуючих компонентів.
Температура полум'я залежить від хімічного складу газу, вмісту повітря в газоповітряній суміші, ступеня її однорідності та тепловідведення з реакційної зони. Максимально можлива за даної температури концентрація оксиду азоту, про. %, може бути підрахована за формулою
NO p = 4,6е -2150/(RT) /√Про 2 N 2 (8.40)
де NO p - рівноважна концентрація оксиду азоту, про. %; R - універсальна постійна газова; Т – абсолютна температура, К; O 2 та N 2 - концентрація, про. %, відповідно кисню та азоту.
Висока концентрація оксиду азоту, порівнянна з рівноважною, виникає при спалюванні газу в топках потужних парогенераторів і високотемпературних мартенівських, коксових і аналогічних печах. У котлах малої та середньої потужності, у невеликих нагрівальних та термічних печах із значним тепловідведенням та малим часом перебування компонентів у високотемпературних зонах вихід оксиду азоту на порядок менший. Крім того, що коротший час перебування реагуючих компонентів у зоні високих температур, тим менше оксиду азоту в продуктах згоряння.
Ефективно також спалювання газу у випромінюючих пальниках і псевдозрідженому шарі: у цих випадках відбувається мікрофакельне горіння гомогенної газоповітряної суміші з коефіцієнтом надлишку повітря α= 1,05 при дуже інтенсивному відведенні теплоти з реакційної зони. Концентрація оксидів азоту при спалюванні газу у випромінюючих пальниках становить близько 40, а в псевдозрідженому шарі – 80–100 мг/м 3 . Зменшення розмірів вогневих каналів випромінюючих пальників та вогнетривких зерен у псевдозрідженому шарі сприяє зниженню виходу оксидів азоту.
Накопичені дані дозволили внести низку змін у конструкцію котельно-опалювального обладнання, що забезпечують не лише високий ККД та низьку концентрацію продуктів неповного згоряння, а й знижене скидання в атмосферу оксидів азоту. До цих змін відносяться:
- скорочення довжини високотемпературних тунелів та переміщення горіння з них у топки;
- застосування замість керамічних тунелів стабілізаторів горіння у вигляді тіл поганообтічної форми або кільцевого полум'я;
- організація плоского смолоскипа полум'я зі збільшеною поверхнею тепловіддачі;
- розосередження полум'я за рахунок збільшення числа пальників або використання блочних пальників;
- ступінчасте підведення повітря в реакційну зону;
- рівномірний розподіл теплових потоків у топці, екранування топок та їх поділ на відсіки екранами;
- застосування дифузійного принципу спалювання газу (дифузійне горіння допустиме лише в тих випадках, коли може бути забезпечений вільний розвиток полум'я без обмивання теплообмінних поверхонь).
Найбільш ефективне зниження виходу оксидів азоту досягається при одночасному використанні кількох способів.
Горіння газу є поєднанням наступних процесів:
· Змішення пального газу з повітрям,
· Підігрів суміші,
· Термічне розкладання горючих компонентів,
· Займання та хімічна сполука горючих компонентів з киснем повітря, що супроводжується утворенням факела та інтенсивним тепловиділенням.
Горіння метану відбувається за реакцією:
СН 4 + 2О 2 = СО 2 + 2Н 2 О
Умови, необхідні для згоряння газу:
· Забезпечення необхідного співвідношення пального газу та повітря,
· Нагрів до температури займання.
Якщо в газоповітряній суміші газу менше нижньої межі займання, то вона не горітиме.
Якщо в газоповітряній суміші більше газу ніж верхня межа займання, вона згорятиме не повністю.
Склад продуктів повного згоряння газу:
· СО 2 - вуглекислий газ
· Н 2 О - водяні пари
* N 2 – азот (він не реагує з киснем під час горіння)
Склад продуктів неповного згоряння газу:
· ЗІ – чадний газ
· З - сажа.
Для згоряння 1 м 3 газу потрібно 9.5м 3 повітря. Практично витрата повітря завжди більша.
Ставлення дійсної витратиповітря до теоретично необхідної витратиназивається коефіцієнтом надлишку повітря: α = L/L t .,
Де: L - дійсні витрати;
L t - Теоретично необхідна витрата.
Коефіцієнт надлишку повітря завжди більше одиниці. Для газу він становить 1.05 – 1.2.
2. Призначення, будову та основні характеристики проточних водонагрівачів.
Проточні газові водонагрівачіПроточні водонагрівачі діляться за навантаженням теплової потужності: 33600, 75600, 105000 кДж, за ступенем автоматизації - на вищий і перший класи. К.п.д. водонагрівачів 80%, вміст оксиду трохи більше 0,05%, температура продуктів згоряння за тягопереривачем щонайменше 180 0 З. Принцип заснований на нагріванні води під час водорозбору.
Основними вузлами проточних водонагрівачів є: газопальниковий пристрій, теплообмінник, система автоматики та газовідведення. Газ низького тиску подається в інжекційний пальник. Продукти згоряння проходять через теплообмінник та відводяться в димар. Теплота згоряння передається протікає через теплообмінник воді. Для охолодження вогневої камери служить змійовик, через який циркулює вода через калорифер. Газові проточні водонагрівачі обладнані газовідвідними пристроями та тягопоперечниками, які у разі короткочасного порушення тяги запобігають погасанню полум'я газопальникового пристрою. Для приєднання до димаря є димовідвідний патрубок.
Газовий проточний водонагрівач -ВПГ.На передній стінці кожуха розташовані: ручка керування газовим краном, кнопка включення електромагнітного клапана та оглядове вікно для спостереження за полум'ям запального та основного пальника. Вгорі апарата розташований димовідвідний пристрій, внизу - патрубки для приєднання апарату до газової та водяної системи. Газ надходить в електромагнітний клапан, газовий блокувальний кран водогазопального блоку здійснює послідовне включення пальника і подачу газу до основного пальника.
Блокування надходження газу до основного пальника, при обов'язковій роботі запальника, здійснює електромагнітний клапан, що працює від термопари. Блокування подачі газу в основний пальник залежно від наявності водорозбору здійснюється клапаном, що має привід через шток від мембрани водяного блок-крана.
Природний газ - це найпоширеніше паливо на сьогоднішній день. Природний газ так і називається природним, тому що він видобувається з надр Землі.
Процес горіння газу є хімічною реакцією, за якої відбувається взаємодія природного газу з киснем, що міститься у повітрі.
У газоподібному паливі є горюча частина і негорюча.
Основним пальним компонентом газу є метан — CH4. Його вміст у природному газі досягає 98%. Метан не має запаху, не має смаку та є нетоксичним. Межа його займистості знаходиться від 5 до 15%. Саме ці якості дозволили використовувати природний газ як один із основних видів палива. Небезпечно для життя концентрація метану більше 10%, так може настати ядуху, внаслідок нестачі кисню.
Для виявлення витоку газу, газ піддають одоризації, інакше кажучи додають сильно пахнучу речовину (етилмеркаптан). При цьому газ можна виявити вже за концентрації 1 %.
Крім метану в природному газі можуть бути горючі гази - пропан, бутан і етан.
Для забезпечення якісного горіння газу необхідно в достатній кількості підвести повітря в зону горіння і досягти хорошого перемішування газу з повітрям. Оптимальним вважається співвідношення 1:10. Тобто одну частину газу припадає десять частин повітря. Крім цього, необхідно створення потрібного температурного режиму. Щоб газ спалахнув необхідно його нагріти до температури його займання і надалі температура не повинна опускатися нижче за температуру займання.
Необхідно організувати відведення продуктів згоряння в атмосферу.
Повне горіння досягається в тому випадку, якщо в продуктах згоряння, що виходять в атмосферу, відсутні горючі речовини. При цьому вуглець і водень з'єднуються разом і утворюють вуглекислий газ та пари води.
Візуально при повному згорянні полум'я світло-блакитне або блакитно-фіолетове.
Повне згоряння газу.
метан + кисень = вуглекислий газ + вода
СН 4 + 2О 2 = СО 2 + 2Н 2 О
Крім цих газів в атмесферу з горючими газами виходить азот і кисень, що залишився. N 2 + O 2
Якщо згоряння газу відбувається в повному обсязі, то атмосферу викидаються горючі речовини – чадний газ, водень, сажа.
Неповне згоряння газу відбувається через недостатню кількість повітря. При цьому візуально в полум'ї з'являються мови кіптяви.
Небезпека неповного згоряння газу полягає в тому, що чадний газ може спричинити отруєння персоналу котельні. Зміст СО повітря 0,01-0,02% може викликати легке отруєння. Вища концентрація може призвести до тяжкого отруєння та смерті.
Сажа, що утворюється, осідає на стінках котлів, що погіршує, тим самим передачу тепла теплоносія знижує ефективність роботи котельні. Сажа проводить тепло гірше за метан у 200 разів.
Теоретично для спалювання 1м3 газу необхідно 9м3 повітря. У реальних умовах повітря потрібно більше.
Тобто необхідна надмірна кількість повітря. Ця величина альфа, що позначається, показує у скільки разів повітря витрачається більше, ніж необхідно теоретично.
Коефіцієнт альфа залежить від типу конкретного пальника і зазвичай прописується в паспорті пальника або у відповідність до рекомендацій організації пусконалагоджувальної роботи.
Зі збільшенням кількості надлишкового повітря вище за рекомендоване, зростають втрати тепла. При значному збільшенні кількості повітря може статися відрив полум'я, створивши аварійну ситуацію. Якщо кількість повітря менша за рекомендоване, то горіння буде неповним, створюючи тим самим загрозу отруєння персоналу котельні.
Для більш точного контролю якості згоряння палива існують прилади — газоаналізатори, які вимірюють вміст певних речовин у складі газів.
Газоаналізатори можуть надходити в комплекті з казанами. Якщо їх немає, відповідні вимірювання проводить пусконалагоджувальна організація за допомогою переносних газоаналізаторів. Складається режимна карта, в якій прописуються необхідні контрольні параметри. Дотримуючись їх, можна забезпечити нормальне повне згоряння палива.
Основними параметрами регулювання горіння палива є:
- співвідношення газу і повітря, що подаються на пальники.
- коефіцієнт надлишку повітря.
- розрядження у топці.
- Коефіцієнт корисної дії казана.
При цьому під коефіцієнтом корисної дії котла мають на увазі співвідношення корисного тепла до величини всього витраченого тепла.
Склад повітря
| Назва газу | Хімічний елемент | Зміст у повітрі |
| Азот | N2 | 78 % |
| Кисень | O2 | 21 % |
| Аргон | Ar | 1 % |
| Вуглекислий газ | CO2 | 0.03 % |
| Гелій | He | менше 0,001% |
| Водень | H2 | менше 0,001% |
| Неон | Ne | менше 0,001% |
| Метан | CH4 | менше 0,001% |
| Криптон | Kr | менше 0,001% |
| Ксенон | Xe | менше 0,001% |
Горіння газоподібного палива є поєднанням наступних фізичних і хімічних процесів: змішання пального газу з повітрям, підігрів суміші, термічне розкладання горючих компонентів, займання і хімічне з'єднання горючих елементів з киснем повітря.
Стійке горіння газоповітряної суміші можливе при безперервному підведенні до фронту горіння необхідних кількостей пального газу та повітря, їх ретельному перемішуванні та нагріванні до температури займання або самозаймання (табл. 5).
Запалення газоповітряної суміші може бути здійснено:
- нагріванням всього обсягу газоповітряної суміші до температури самозаймання. Такий спосіб застосовують у двигунах внутрішнього згоряння, де газоповітряну суміш нагрівають швидким стисненням до певного тиску;
- застосуванням сторонніх джерел запалювання (запальників тощо). В цьому випадку до температури займання нагрівається не вся газоповітряна суміш, а її частина. Цей спосіб застосовується при спалюванні газів у пальниках газових приладів;
- існуючим смолоскипом безперервно в процесі горіння.
Для початку реакції горіння газоподібного палива слід витратити певну кількість енергії, необхідної для розриву молекулярних зв'язків та створення нових.
Хімічна формула згоряння газового палива із зазначенням всього механізму реакції, пов'язаного із виникненням та зникненням великої кількості вільних атомів, радикалів та інших активних частинок, складна. Тому для спрощення користуються рівняннями, що виражають початковий та кінцевий стан реакцій горіння газу.
Якщо вуглеводневі гази позначити С m Н n , то рівняння хімічної реакції горіння цих газів у кисні набуде вигляду
C m H n + (m + n/4)O 2 = mCO 2 + (n/2)H 2 O ,
де m – кількість атомів вуглецю у вуглеводневому газі; n – кількість атомів водню в газі; (m + n/4) - кількість кисню, необхідне повного згоряння газу.
Відповідно до формули виводяться рівняння горіння газів:
- метану СН 4 + 2O 2 = СO 2 + 2Н 2 O
- етану З 2 Н 6 + 3,5O 2 = 2СO 2 + ДН 2 O
- бутану С 4 Н 10 + 6,5O 2 = 4СO 2 + 5Н 2 0
- пропану C 3 H 8 + 5O 3 = ЗСO 2 + 4Н2O.
У практичних умовах спалювання газу кисень береться над чистому вигляді, а входить до складу повітря. Оскільки повітря складається за обсягом на 79 % з азоту і 21 % з кисню, то кожен обсяг кисню потрібно 100: 21 = 4,76 обсягу повітря чи 79: 21 = = 3,76 обсягу азоту. Тоді реакцію горіння метану у повітрі можна записати так:
СН 4 + 2O 2 + 2*3,76N 2 = CO 2 + 2H 2 O + 7,52N 2 .
З рівняння видно, що спалювання 1 м 3 метану потрібно 1 м 3 кисню і 7,52 м 3 азоту чи 2 + 7,52 = 9,52 м 3 повітря.
В результаті згоряння 1 м 3 метану виходить 1 м 3 діоксиду вуглецю, 2 м 3 водяної пари і 7,52 м 3 азоту. У таблиці нижче наведені ці дані найбільш поширених горючих газів.
Для процесу горіння газоповітряної суміші необхідно, щоб кількість газу і повітря газоповітряної суміші було в певних межах. Ці межі називаються межами займистості або межами вибуховості. Розрізняють нижню і верхню межі займистості. Мінімальний вміст газу в газоповітряній суміші, виражене в об'ємних відсотках, при якому відбувається займання, називається нижньою межею займистості. Максимальний вміст газу в газоповітряній суміші, вище якого суміш не займається без підведення додаткової теплоти, називається верхньою межею займистості.
Кількість кисню та повітря при спалюванні деяких газів
|
Для спалювання 1 м 3 газу потрібно, м 3 |
При спалюванні 1 м 3 газу виділяється, м 3 |
Теплота згоряння Він,кДж/м 3 |
|||||
|
кисню |
діоксиду вуглецю |
||||||
|
Оксид вуглецю |
|||||||
Якщо в газоповітряній суміші міститься газу менше нижньої межі займистості, то вона не горітиме. Якщо газоповітряної суміші недостатньо повітря, то горіння протікає в повному обсязі.
Великий вплив на величини меж вибуховості надають інертні домішки у газах. Збільшення вмісту в газі баласту (N 2 і СО 2) звужує межі займистості, а при підвищенні вмісту баласту вище за певні межі газоповітряна суміш не займається при будь-яких співвідношеннях газу і повітря (таблиця нижче).
Кількість обсягів інертного газу на 1 обсяг пального газу, при якому газоповітряна суміш перестає бути вибухонебезпечною
Найменша кількість повітря, необхідна для повного спалювання газу, називається теоретичною витратою повітря і позначається Lt, тобто, якщо нижча теплота згоряння газового палива 33520 кДж/м 3 теоретично необхідна кількість повітря для спалювання 1 м 3 газу
L T= (33520/4190) / 1,1 = 8,8 м 3 .
Однак дійсна витрата повітря завжди перевищує теоретичну. Пояснюється це тим, що дуже важко досягти повного згоряння газу за теоретичних витрат повітря. Тому будь-яка газова установка для спалювання газу працює з деяким надлишком повітря.
Отже, практична витрата повітря
L n = αL T,
де L n- практична витрата повітря; α - Коефіцієнт надлишку повітря; L T- Теоретична витрата повітря.
Коефіцієнт надлишку повітря завжди більше одиниці. Для природного газу він складає α = 1,05 – 1,2. Коефіцієнт α показує, скільки разів дійсна витрата повітря перевищує теоретичний, який приймається за одиницю. Якщо α = 1, то газоповітряна суміш називається стехіометричної.
При α = 1,2 спалювання газу проводиться з надлишком повітря на 20%. Як правило, спалювання газів повинно проходити з мінімальним значенням а, так як зі зменшенням надлишку повітря знижуються втрати теплоти з газами, що йдуть. Повітря, що бере участь у горінні, буває первинним та вторинним. Первиннимназивається повітря, що надходить у пальник для змішування в ньому з газом; вторинним- Повітря, що надходить в зону горіння не в суміші з газом, а окремо.






