Công thức đốt cháy khí thiên nhiên. Khí tự nhiên. quá trình đốt
A. S. Isserlin
Quá trình cháy dựa trên phản ứng hoá học sự kết hợp của nhiên liệu và chất oxy hóa. Để quá trình đốt cháy diễn ra, phải tạo ra khí điều kiện đặc biệt. Đầu tiên, cần đưa một lượng vừa đủ chất oxy hóa (thường là không khí) vào khí dễ cháy và trộn chúng. Thứ hai, hỗn hợp khí-không khí phải có giới hạn nồng độ tính dễ cháy và nguồn đánh lửa phải được cung cấp. Thứ ba, cần tạo điều kiện cho quá trình đốt cháy phát triển, tức là ở một mức nhiệt độ nhất định.
Trộn (trộn đều khí với không khí) là một trong những giai đoạn chính của toàn bộ quá trình đốt cháy. Tất cả các giai đoạn tiếp theo mà nhiên liệu đi qua trong quá trình chuyển đổi năng lượng hóa học thành năng lượng nhiệt phần lớn phụ thuộc vào quá trình hình thành hỗn hợp. Vì mức nhiệt độ cao luôn được thiết lập trong vùng đốt cháy nên thời gian dành cho các phản ứng hóa học của quá trình đốt cháy luôn ít hơn đáng kể so với thời gian cần thiết cho quá trình hình thành hỗn hợp.
Đốt cháy nhiên liệu khí, giống như bất kỳ luồng nào khác, trong luồng không khí, theo quan điểm hiện đại, có thể dựa trên các nguyên tắc động học và khuếch tán.
Tổng thời gian đốt cháy của khí, xác định tốc độ đốt cháy,
TPTS~1"~X1
Trong đó tc là thời gian trộn cần thiết để trộn khí với chất oxy hóa; tx là thời gian xảy ra các phản ứng hóa học.
Nếu ts<Стх, то практически тп«т*. В этом случае процесс протекает в кинетической области. Если же, наоборот, Тс^-Тх, то Тп»тс и, следовательно, процесс протекает в диффузионной области.
Khi quá trình đốt cháy diễn ra trong vùng động học, tốc độ cháy phụ thuộc vào tính chất của hỗn hợp dễ cháy nhất định, nhiệt độ trong thể tích phản ứng và nồng độ thuốc thử trong vùng cháy, tức là nó được điều chỉnh bởi các định luật hóa học động học. Đồng thời, tốc độ của quá trình trong vùng động học không phụ thuộc vào các yếu tố thủy động lực học, tức là vào tốc độ dòng chảy, kích thước hình học của buồng phản ứng, v.v.
Ngược lại, trong vùng khuếch tán, tốc độ của quá trình được xác định bởi các yếu tố thủy động lực học và không phụ thuộc vào động học. Trong khu vực này, các tính chất của hỗn hợp dễ cháy và yếu tố nhiệt độ không còn đóng vai trò quyết định. Các phương tiện thủy động tương đối đơn giản có thể ảnh hưởng đến cường độ trộn, điều này sẽ dẫn đến thay đổi đặc tính của ngọn lửa khuếch tán.
Với nguyên lý động học, hỗn hợp khí-không khí đồng nhất được tạo ra sơ bộ trong vòi đốt, hỗn hợp này được đưa vào buồng đốt. Do đó, quá trình đốt cháy hỗn hợp như vậy diễn ra ở một giá trị không đổi của tất cả các đặc điểm chính (ứng suất nhiệt, không khí dư thừa, v.v.). Sự cháy động học hoàn toàn chỉ xảy ra nếu điều kiện A^1,0. Khi một<1 кинетическое горение протекает лишь на первой стадии, т. е. до тех пор, пока не израсходован весь кислород смеси. Остаток горючих компонентов, разбавленных продуктами сгорания, может быть сожжен только при условии подвода дополнительного окислителя (воздуха).
Nguyên lý đốt cháy khuếch tán ngụ ý việc tạo ra các điều kiện như vậy để bắt đầu quá trình theo đó hỗn hợp cháy hết ngay khi nó xảy ra, tức là khi nhiên liệu và chất oxy hóa tiếp xúc với nhau theo tỷ lệ định lượng thích hợp. Quá trình đốt cháy khuếch tán được kiểm soát bằng cách thay đổi cường độ hình thành hỗn hợp bằng cách thay đổi các thông số thiết kế và vận hành của vòi đốt. Do đó, tùy thuộc vào yêu cầu công nghệ, có thể đạt được sự rút ngắn của vùng trộn hoặc kéo dài của nó.
Trong thực tế thường sử dụng đốt bằng khí kết hợp cả hai nguyên tắc trên. Trong trường hợp này, một phần không khí được trộn sẵn với khí trong đầu đốt và phần còn lại, cần thiết cho quá trình đốt cháy hoàn toàn, được đưa trực tiếp vào vùng đốt. Bằng cách thay đổi tỷ lệ này, có thể ảnh hưởng đến chiều dài của mỏ hàn khí. Trong hầu hết các đầu đốt, khí được cung cấp ở một góc nào đó so với luồng không khí.
Rất nhiều công việc đã được dành cho việc nghiên cứu quá trình hình thành hỗn hợp. Điều này cho phép chúng tôi xây dựng một số mẫu chung.
Đối với đầu đốt khí dòng chảy trực tiếp, sự pha trộn càng tốt thì mặt cắt ngang của đầu đốt được bao phủ bởi các tia khí càng lớn, tức là phạm vi của các tia khí càng lớn. Trong các đầu đốt có dòng chảy xoáy mạnh, không nên phấn đấu để có nhiều tia khí.
Sự gia tăng độ xoắn của luồng không khí dẫn đến sự phân phối lại khí và không khí trên mặt cắt ngang của đầu đốt, tăng cường độ trộn khí với không khí và tăng vùng trung tâm của dòng ngược trong đầu đốt.
Bản chất ảnh hưởng của độ xoắn của dòng khí đến quá trình hình thành hỗn hợp là khác nhau tùy thuộc vào các thông số xác định khác. Vì vậy, khi khí được cung cấp cho các vùng ngoại vi của đầu đốt (bất kể loại nào), sự gia tăng độ xoắn của dòng chảy dẫn đến sự cải thiện rõ rệt trong quá trình hình thành hỗn hợp. Ngược lại, khi khí được cung cấp cho vùng trung tâm của đầu đốt, theo quy luật, sự gia tăng độ xoắn không dẫn đến sự cải thiện quy trình, “giải pháp.
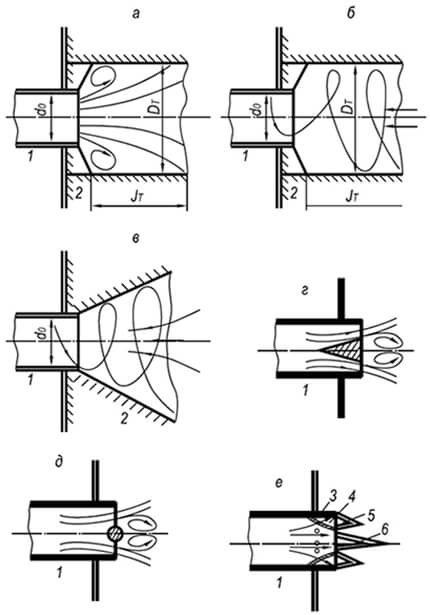
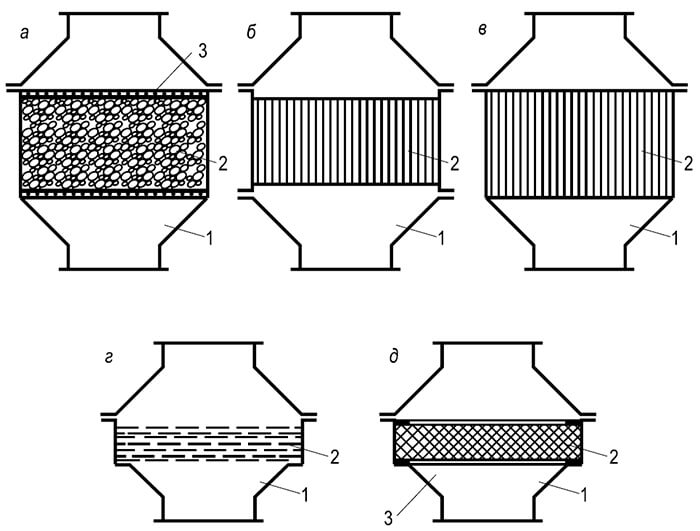
Toàn bộ các hiện tượng mà chúng ta gọi là quá trình đốt cháy chỉ có thể diễn ra theo một trình tự nhất định, từ giai đoạn này sang giai đoạn khác. G. F. Knorre đưa ra các sơ đồ sau đây về quá trình đốt cháy ổn định nhiên liệu khí và lỏng với một lò sưởi cố định, mà ông gọi là nội tuyến (Hình 1). Sơ đồ dòng chảy đơn giản nhất xảy ra trong quá trình đốt cháy nhiên liệu khí bao gồm các phân tử đơn giản (ví dụ: hydro) không yêu cầu phân hủy chất gây sốt phức tạp sơ bộ (Hình 1, VÀ). Khi nhiên liệu khí hoặc hydrocacbon lỏng bị đốt cháy, một 6
Quá trình đốt cháy dòng chảy rất phức tạp: có một giai đoạn trung gian khác - phân hủy pyrogen. Đối với nhiên liệu lỏng, giai đoạn này diễn ra trước giai đoạn bay hơi (Hình 1.6). Để thực hiện sơ đồ dòng chảy, buồng đốt cần có mức nhiệt độ đủ để cung cấp nhiên liệu và chất oxy hóa theo dòng liên tục. Sản phẩm cháy sau khi kết thúc các phản ứng cũng liên tục được thải ra khỏi nguồn cháy.
Được biết, hỗn hợp khí-không khí chỉ bốc cháy khi hàm lượng khí trong không khí nằm trong giới hạn nhất định (đối với từng loại khí). Ở hàm lượng khí thấp, lượng nhiệt giải phóng trong quá trình đốt cháy không đủ để đưa các lớp hỗn hợp liền kề đến nhiệt độ bắt cháy. Điều tương tự cũng xảy ra khi hàm lượng khí trong hỗn hợp khí-không khí quá cao. Việc thiếu oxy trong không khí đốt dẫn đến giảm mức nhiệt độ, do đó các lớp liền kề của hỗn hợp không nóng lên đến mức
Nhiệt độ đánh lửa. Hai trường hợp này tương ứng với giới hạn cháy trên và dưới (Bảng 1). Do đó, ngoài việc trộn khí với không khí theo tỷ lệ nhất định, phải tạo điều kiện ban đầu để hỗn hợp bốc cháy.
|
Cái bàn / Giới hạn cháy và nhiệt độ bốc cháy của các loại khí khác nhau trong không khí
|
Quá trình oxy hóa các khí dễ cháy có thể xảy ra ở nhiệt độ thấp, nhưng sau đó nó diễn ra cực kỳ chậm do tốc độ phản ứng không đáng kể. Với sự gia tăng nhiệt độ, tốc độ của phản ứng oxy hóa tăng lên cho đến khi xảy ra hiện tượng tự bốc cháy (thay vì quá trình oxy hóa chậm, quá trình đốt cháy tự phát bắt đầu). Điều này có nghĩa là hỗn hợp dễ cháy được làm nóng đến nhiệt độ đánh lửa có năng lượng không chỉ bù nhiệt thất thoát ra môi trường mà còn cung cấp nhiệt và chuẩn bị hỗn hợp khí-không khí đi vào vùng cháy để đánh lửa.
Nhiệt độ bốc cháy của khí phụ thuộc vào một số yếu tố, bao gồm hàm lượng khí dễ cháy trong hỗn hợp khí-không khí, áp suất, phương pháp đốt nóng hỗn hợp, v.v., và do đó không phải là một giá trị chính xác. Trong bảng. 1 cho thấy nhiệt độ bốc cháy của một số khí dễ cháy trong không khí.
Trong thực tế, có hai phương pháp đánh lửa hỗn hợp dễ cháy: tự đánh lửa và đánh lửa.
Tại Tự đánh lửa toàn bộ thể tích của hỗn hợp khí-không khí dễ cháy dần dần được đưa đến nhiệt độ bắt cháy, sau đó hỗn hợp tự bốc cháy mà không có ảnh hưởng nhiệt bên ngoài.
Trong công nghệ, phương pháp thứ hai được sử dụng rộng rãi, được gọi là đánh lửa. Với phương pháp này, không cần thiết phải đốt nóng toàn bộ hỗn hợp khí-không khí đến nhiệt độ bắt lửa, chỉ cần đốt cháy hỗn hợp lạnh tại một điểm trong thể tích bằng một nguồn nhiệt độ cao nào đó (tia lửa, vật nóng, ngọn lửa thí điểm, vân vân.). Kết quả là, sự đánh lửa được truyền đến toàn bộ thể tích của hỗn hợp một cách tự nhiên bằng sự lan truyền ngọn lửa, không xảy ra ngay lập tức mà ở một tốc độ không gian nhất định. Tốc độ này được gọi là Tốc độ lan truyền ngọn lửa trong hỗn hợp khí-không khí và là đặc tính quan trọng nhất quyết định điều kiện cho dòng chảy và sự ổn định của quá trình cháy. Độ ổn định của đầu đốt, như sẽ được trình bày dưới đây, có liên quan đến tốc độ lan truyền ngọn lửa.
Do đó, quá trình đốt cháy nhiên liệu khí bao gồm trộn khí với không khí, làm nóng hỗn hợp thu được đến nhiệt độ đánh lửa, đốt cháy nó và xảy ra các phản ứng đốt cháy kèm theo sự giải phóng nhiệt. Hơn nữa, việc trộn khí với không khí và làm nóng hỗn hợp chiếm phần lớn thời gian trong quá trình đốt cháy, vì các phản ứng đốt cháy diễn ra gần như ngay lập tức.
Tùy thuộc vào quy trình công nghệ (thu hơi nước và nước nóng trong bộ phận nồi hơi, làm nóng sản phẩm trong lắp đặt lò, v.v.), cần phải tác động đến quá trình đốt cháy bằng cách thay đổi các đặc tính cuối cùng của nó. Điều này đạt được bằng các kỹ thuật xây dựng khác nhau, được mô tả trong Chương. III.
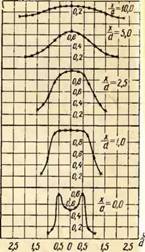
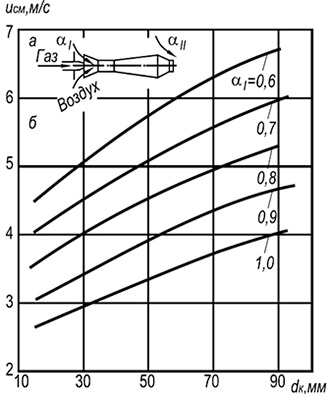
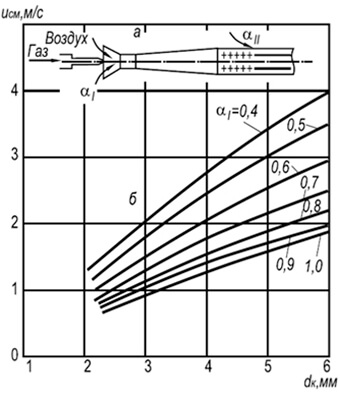
Đó là dấu hiệu để so sánh các trường nhiệt độ trong thể tích của ngọn đuốc trong quá trình đốt cháy khí với các hệ số không khí dư thừa khác nhau. Một ví dụ về so sánh như vậy được đưa ra trong Hình. 2 cho đầu đốt có đường kính đầu ra của vòi là 35 mm như một chức năng
|
|
Ở đâu Và- giá trị hiện tại của nhiệt độ trong ngọn lửa, °C; tmax - nhiệt độ tối đa trong ngọn lửa (đo được), °С; X- khoảng cách từ điểm đo đến đầu mỏ hàn, m; Tại- khoảng cách từ điểm đo đến trục của mỏ hàn, m; Y- đường kính vòi đốt, m.
Trên hình. Hình 2 thể hiện đồ thị phân bố nhiệt độ cho ba hệ số của không khí thừa. Hơn nữa, tọa độ X / y\u003d O tương ứng với phần đầu ra của vòi đốt và tọa độ y/y= 0 - trục ngọn lửa.
Như có thể thấy từ hình, sự phân bố nhiệt độ trong ngọn lửa tự do không đồng đều. Ví dụ, với lượng không khí sơ cấp dư thừa nhỏ, a = 0,5, sự hiện diện của lõi bên trong ngọn lửa làm biến dạng đáng kể trường nhiệt độ và nó chỉ cân bằng ở khoảng cách x / c / = 10, trong khi ở a = 0,75, sự cân bằng đã xảy ra tại X / y=2,5 và tại a=1,0 thậm chí sớm hơn - tại X/d=1,0.
Nhiệt độ cao nhất trong ngọn lửa trần được quan sát thấy trong các phần ban đầu ở khoảng cách từ trục ngọn lửa Y / y \u003d 0,5 và sau đó ở giữa ngọn đuốc. Hơn nữa, với sự gia tăng hệ số không khí dư thừa, nhiệt độ tối đa sẽ chuyển sang miệng của đầu đốt. Như vậy, nhiệt độ cao nhất tại a = 0,75 đo được ở khoảng cách X / y\u003d 2,5 và ở \u003d 1,0 - ở khoảng cách xa X/d=1,0.
 Khi xem xét sự phân bố nhiệt độ và nồng độ CO2 trong chùm khói với nhau, các cực đại trùng nhau
Khi xem xét sự phân bố nhiệt độ và nồng độ CO2 trong chùm khói với nhau, các cực đại trùng nhau
Nhiệt độ và hàm lượng CO2. Do đó, mức nhiệt độ tối đa trong ngọn đuốc cũng tương ứng với giá trị tối đa của mức độ cháy của chất cháy.
Việc mất một phần nhiệt lượng tỏa ra do quá trình đốt cháy khí là điều không thể tránh khỏi. Tuy nhiên, chúng có thể được giảm đến mức tối thiểu với sự quản lý thích hợp của quá trình đốt cháy. Hãy xem xét cái nào. các thành phần cộng lại những tổn thất này.
Trong quá trình đốt cháy nhiên liệu khí, các tổn thất nhiệt sau đây xảy ra: với khí thải, do đốt cháy không hoàn toàn hóa học và ra môi trường. Dựa trên việc xác định tổn thất nhiệt riêng lẻ bằng cân bằng nghịch đảo, hiệu quả của thiết bị có thể được tính, ° / o:
Ở đâu<72 - потери тепла с уходящими газами, %; - потери тепла
Từ quá trình đốt cháy không hoàn toàn về mặt hóa học, %; Q5- tổn thất nhiệt ra môi trường, %.
Tổn thất nhiệt với khói lò- nhiệt vật lý của các sản phẩm đốt cháy rời khỏi thiết bị - là những nhiệt chính. Không thể loại bỏ hoàn toàn chúng, nhưng cần phải cố gắng giảm thiểu chúng. Tổn thất nhiệt với khí thải phụ thuộc vào nhiệt độ của khí và số lượng của chúng. Nhiệt độ của khí thải càng thấp thì nhiệt lượng tỏa ra càng ít, vì vậy bạn nên cố gắng giảm nhiệt độ của khí thải trong giới hạn hợp lý. Ảnh hưởng của nhiệt độ khí thải đến tổn thất nhiệt có thể được nhìn thấy từ Bảng. 2.
ban 2
|
Tổn thất nhiệt với khí thải trong quá trình đốt khí tự nhiên, %
|
Tổn thất nhiệt do khí thải thường được biểu thị bằng tỷ lệ phần trăm của tổng nhiệt lượng khả dụng, tức là nhiệt lượng đốt cháy nhiên liệu. Ví dụ, nếu tổn thất nhiệt là 700 kcal/m3 khi đốt khí tự nhiên, thì
700-100 ___ „ 24°/
Lượng khí thoát ra khỏi thiết bị phụ thuộc vào tỷ lệ không khí thừa của đầu đốt và các giác hút.
Không khí thông qua rò rỉ trong thiết bị. Hệ số không khí thừa ở đầu ra của đầu đốt và lượng không khí hút vào thiết bị càng lớn thì tổn thất nhiệt với khí thải càng cao. Từ Bảng. 2 có thể thấy sự thay đổi hệ số tổng không khí thừa trong sản phẩm cháy từ aa = 1,2-5-1,6 làm tăng tổn thất nhiệt theo khói lò từ 10,5 lên 13,2% (ở nhiệt độ khói lò không đổi 240°C) .
Do đó, để giảm tổn thất nhiệt với khí thải, cần thực hiện quá trình đốt cháy với hệ số không khí dư thấp nhất cho phép, đảm bảo mật độ cao nhất của thiết bị và giảm nhiệt độ của khí thải.
Tổn thất nhiệt do đốt cháy khí không hoàn toàn về mặt hóa học xảy ra khi thiếu không khí, trộn kém trong đầu đốt khí và giảm mạnh mức nhiệt độ trong vùng đốt. Do đó, quá trình đốt cháy khí diễn ra không hoàn toàn và các thành phần dễ cháy (ví dụ: hydro, carbon monoxide, v.v.) sẽ rời đi cùng với các sản phẩm đốt cháy. Điều này dẫn đến việc sử dụng không đúng mức năng lượng hóa học của nhiên liệu và giảm hiệu quả của thiết bị. Ngay cả một hàm lượng nhỏ các thành phần dễ cháy trong các sản phẩm đốt cháy cũng dẫn đến tổn thất nhiệt đáng kể do quá trình đốt cháy không hoàn toàn hóa chất. Chúng ta hãy giả sử rằng các sản phẩm đốt cháy chứa 0,7% hydro và 0,5% carbon monoxide. Khí đốt tự nhiên được đốt cháy trong thiết bị có hệ số không khí thừa phía sau thiết bị a» = 1,5. Tổn thất nhiệt do đốt cháy không hoàn toàn hóa học lên tới ~450 kcal/m3 hoặc
A___ 450-100 poo/
Do đó, từ ví dụ được xem xét, có thể thấy rằng các thành phần dễ cháy trong các sản phẩm đốt cháy phải hoàn toàn không có hoặc ở mức tối thiểu.
Sự thất thoát nhiệt ra môi trường là do các bức tường của thiết bị có nhiệt độ cao hơn không khí xung quanh. Độ lớn của những tổn thất này chủ yếu phụ thuộc vào chênh lệch nhiệt độ giữa các bức tường bên ngoài của thiết bị và không khí xung quanh, kích thước của bề mặt tường, độ dẫn nhiệt của vật liệu xây và độ dày của nó. Tổn thất đối với môi trường được tính toán theo lý thuyết hoặc lấy từ các định mức tính toán nhiệt, tùy thuộc vào thiết kế và hiệu suất của thiết bị.
Nếu chúng ta cộng tất cả các tổn thất nhiệt xảy ra trong quá trình đốt cháy khí trong thiết bị và trừ chúng đi 100, chúng ta sẽ nhận được hiệu suất của thiết bị. Ví dụ: sử dụng các số ở trên, giả sử<75 равным 3,60%, тогда к. п. д. агрегата
T]= 100-(8,24+5,28+3,60)=82,88%*
8.1. PHẢN ỨNG CHÁY
Đốt cháy là một phản ứng hóa học nhanh chóng kết hợp các thành phần dễ cháy với oxy, kèm theo sự giải phóng nhiệt mạnh và tăng mạnh nhiệt độ của các sản phẩm đốt cháy. Phản ứng đốt cháy được mô tả bởi cái gọi là. phương trình cân bằng hóa học đặc trưng định tính và định lượng các chất tham gia phản ứng và tạo ra từ nó (Thành phần cân bằng hóa học của hỗn hợp dễ cháy (từ stoicheion của Hy Lạp - cơ sở, nguyên tố và métreo của Hy Lạp - tôi đo) - thành phần của hỗn hợp, trong đó chất oxy hóa chính xác như mức cần thiết cho quá trình oxy hóa hoàn toàn nhiên liệu ). Phương trình tổng quát của phản ứng đốt cháy một hiđrocacbon bất kỳ
C m H n + (m + n/4) O 2 = mCO 2 + (n/2) H 2 O + Q(8.1)
trong đó m, n là số nguyên tử cacbon và hiđro trong phân tử; Q là hiệu ứng nhiệt của phản ứng, hay nhiệt của quá trình đốt cháy.
Các phản ứng đốt cháy của một số khí được đưa ra trong bảng. 8.1. Các phương trình này là cân bằng và không thể đánh giá tốc độ phản ứng hoặc cơ chế biến đổi hóa học từ chúng.
Bảng 8.1. Phản ứng đốt cháy và nhiệt trị của khí khô (ở 0°С và 101,3 kPa)
| Khí ga | phản ứng đốt cháy | Nhiệt do cháy | |||||
|---|---|---|---|---|---|---|---|
| Mol, kJ/kmol | Khối lượng, kJ/kg | Thể tích, kJ / m 3 | |||||
| cao hơn | thấp kém | cao hơn | thấp kém | cao hơn | thấp kém | ||
| hydro | H 2 + 0,5O 2 \u003d H 2 0 | 286,06 | 242,90 | 141 900 | 120 080 | 12 750 | 10 790 |
| carbon monoxide | CO + 0,5O 2 \u003d CO 2 | 283,17 | 283,17 | 10 090 | 10 090 | 12 640 | 12 640 |
| mêtan | CH 4 + 2O 2 \u003d CO 2 + 2H 2 O | 880,90 | 800,90 | 55 546 | 49 933 | 39 820 | 35 880 |
| etan | C 2 H 6 + 0,5O 2 \u003d 2CO 2 + 3H 2 O | 1560,90 | 1425,70 | 52 019 | 47 415 | 70 310 | 64 360 |
| propan | C 3 H 8 + 5H 2 O \u003d 3CO 2 + 4H 2 O | 2221,40 | 2041,40 | 50 385 | 46 302 | 101 210 | 93 180 |
| n-butan | 2880,40 | 2655,00 | 51 344 | 47 327 | 133 800 | 123 570 | |
| isobutan | C 4 H 10 + 6,5O 2 \u003d 4CO 2 + 5H 2 O | 2873,50 | 2648,30 | 51 222 | 47 208 | 132 960 | 122 780 |
| n-Pentan | C 5 H 12 + 8O 2 \u003d 5CO 2 + 6H 2 O | 3539,10 | 3274,40 | 49 052 | 45 383 | 169 270 | 156 630 |
| êtylen | C 2 H 4 + 3O 2 \u003d 2CO 2 + 2H 2 O | 1412,00 | 1333,50 | 50 341 | 47 540 | 63 039 | 59 532 |
| Propylen | C 3 H 6 + 4,5O 2 \u003d 3CO 2 + 3H 2 O | 2059,50 | 1937,40 | 48 944 | 46 042 | 91 945 | 88 493 |
| butylen | C 4 H 8 + 6O 2 \u003d 4CO 2 + 4H 2 O | 2720,00 | 2549,70 | 48 487 | 45 450 | 121 434 | 113 830 |
Hiệu ứng nhiệt (nhiệt trị) Q - lượng nhiệt tỏa ra trong quá trình đốt cháy hoàn toàn 1 kmole, 1 kg hoặc 1 m 3 khí ở điều kiện vật lý bình thường. Có nhiệt trị Q trong cao hơn và nhiệt trị Qn thấp hơn: nhiệt trị cao hơn bao gồm nhiệt lượng ngưng tụ của hơi nước trong quá trình cháy (thực tế khi đốt cháy khí, hơi nước không ngưng tụ mà được loại bỏ cùng với các sản phẩm cháy khác) . Thông thường, các tính toán kỹ thuật thường được thực hiện theo nhiệt trị thấp hơn, mà không tính đến nhiệt ngưng tụ của hơi nước (≈2400 kJ / kg).
Hiệu suất được tính theo nhiệt trị thấp hơn về mặt hình thức cao hơn, nhưng nhiệt ngưng tụ của hơi nước khá cao và việc sử dụng nó là hợp lý hơn. Điều này được khẳng định bằng việc sử dụng tích cực các bộ trao đổi nhiệt tiếp xúc trong công nghệ sưởi ấm, rất đa dạng về thiết kế.
Đối với hỗn hợp khí dễ cháy, nhiệt trị cao hơn (và thấp hơn) của khí được xác định theo tỷ lệ
Q = r 1 Q 1 + r 2 Q 2 + ... + r n Q n (8.2)
trong đó r 1 , r 2 , ..., r n - phần thể tích (mol, khối lượng) của các cấu tử có trong hỗn hợp; Q 1 , Q 2 , …, Q n - nhiệt trị của các thành phần.
Sử dụng bảng. 8.1, nhiệt trị cao hơn và thấp hơn, kJ / m 3, của khí phức hợp có thể được xác định theo các công thức sau:
Q trong \u003d 127,5 H 2 + 126,4 CO + 398 CH 4 + 703 C 2 H 6 + 1012 C 8 H 8 + 1338 C 4 H 10 + 1329 C 4 H 10 +
+ 1693 C 5 H 12 + 630 C 2 H 4 + 919 C 3 H 6 +1214 C 4 H 8 (8,3)
Q n \u003d 107,9 H 2 + 126,4 CO + 358,8 CH 4 + 643 C 2 H 6 + 931,8 C 8 H 8 + 1235 C 4 H 10 + 1227 C 4 H 10 +
+ 1566 C 5 H 12 + 595 C 2 H 4 + 884 C 8 H 6 + 1138 C 4 H 8 (8,4)
trong đó H 2 , CO, CH 4, v.v. - nội dung của các thành phần riêng lẻ trong nhiên liệu khí, vol. %.
Quá trình đốt cháy phức tạp hơn nhiều so với công thức (8.1), vì cùng với sự phân nhánh của chuỗi, chúng bị phá vỡ do sự hình thành các hợp chất ổn định trung gian, trải qua các biến đổi tiếp theo ở nhiệt độ cao. Với nồng độ oxi vừa đủ, sản phẩm cuối cùng được tạo thành: hơi nước H 2 O và khí cacbonic CO 2. Khi thiếu chất oxy hóa, cũng như khi vùng phản ứng được làm mát, các hợp chất trung gian có thể ổn định và xâm nhập vào môi trường.
Cường độ tỏa nhiệt và sự gia tăng nhiệt độ dẫn đến sự gia tăng các hạt hoạt động trong hệ thống phản ứng. Mối quan hệ như vậy giữa phản ứng dây chuyền và nhiệt độ, đặc trưng của hầu hết các quá trình đốt cháy, đã dẫn đến sự ra đời của khái niệm vụ nổ nhiệt dây chuyền - bản thân các phản ứng hóa học của quá trình đốt cháy có tính chất dây chuyền và sự gia tốc của chúng xảy ra do sự giải phóng nhiệt và tăng nhiệt độ trong hệ thống phản ứng.
Tốc độ của phản ứng hóa học trong hỗn hợp đồng nhất tỷ lệ thuận với tích nồng độ của các chất phản ứng:
w = kС 1 С 2 (8,5)
trong đó C 1 và C 2 là nồng độ của các thành phần phản ứng, kmol/m 3; k - hằng số tốc độ phản ứng, phụ thuộc vào bản chất của các chất phản ứng và nhiệt độ.
Khi đốt cháy khí, nồng độ của các chất phản ứng có thể được coi là không thay đổi một cách có điều kiện, vì trong vùng đốt cháy có một dòng liên tục các thành phần mới có thành phần một giá trị.
Hằng số tốc độ phản ứng (theo phương trình Arrhenius):
K \u003d K 0 e -E / RT (8.6)
trong đó K 0 - hệ số tiền hàm được lấy cho hỗn hợp đồng nhất sinh trắc học, ≈1,0; E - năng lượng hoạt hóa, kJ/kmol; R là hằng số khí phổ quát, J/(kg K); T - nhiệt độ tuyệt đối, K (°C); e là cơ số của logarit tự nhiên.
Hệ số trước hàm mũ K 0 có thể được hiểu là hằng số phản ánh mức độ va chạm hoàn toàn của các phân tử và E - là năng lượng tối thiểu để phá vỡ liên kết của các phân tử và hình thành các hạt hoạt động đảm bảo hiệu quả của va chạm. Đối với các hỗn hợp cháy thông thường nằm trong khoảng (80÷150)10 3 kJ/kmol.
Phương trình (8.6) cho thấy tốc độ phản ứng hóa học tăng mạnh khi nhiệt độ tăng: ví dụ, nhiệt độ tăng từ 500 K lên 1000 K kéo theo tốc độ phản ứng đốt cháy tăng theo hệ số 2 10 4 ÷ 5 10 8 lần (tùy thuộc vào năng lượng kích hoạt).
Tốc độ phản ứng đốt cháy bị ảnh hưởng bởi bản chất chuỗi của chúng. Ban đầu, các nguyên tử và gốc được tạo ra bởi phản ứng tham gia vào các hợp chất với các chất ban đầu và với nhau, tạo thành các sản phẩm cuối cùng và các hạt mới lặp lại cùng một chuỗi phản ứng. Việc tạo ra các hạt như vậy ngày càng tăng dẫn đến "sự tăng tốc" của các phản ứng hóa học - thực tế là sự bùng nổ của toàn bộ hỗn hợp.
Quá trình đốt cháy hydrocacbon ở nhiệt độ cao rất phức tạp và có liên quan đến sự hình thành các hạt hoạt động ở dạng nguyên tử và gốc tự do, cũng như các hợp chất phân tử trung gian. Ví dụ, các phản ứng đốt cháy của hydrocarbon đơn giản nhất - metan được đưa ra:
- H + O 2 -› OH + O
CH 4 + OH -› CH 3 + H 2 O
CH 4 + O -› CH 2 + H 2 O - CH 3 + O 2 -› HClO + OH
CH 2 + O 2 -› HClO + O - HCHO + OH -› HCO + H 2 O
HCNO + O -› CO + H 2 O
HCO + O 2 -› CO + O + OH - CO + O -› CO 2
CO + OH -› CO 2 + H
Kết quả của một chu kỳ duy nhất:
2CH 4 + 4O 2 -› 2CO 2 + 4H 2 O
8.2. TÍNH TOÁN CHÁY
Oxy cho quá trình đốt cháy đến từ không khí như một phần cấu thành của nó. Để tính toán, giả định rằng thành phần thể tích của không khí khô như sau:
oxy - 21,0%, nitơ - 79,0%.
Theo thông tin đã cho, 1 m 3 oxy chứa trong 100/21 = 4,76 m 3 không khí, hoặc 79/21 = 3,76 m 3 nitơ trên 1 m 3 oxy. Xét rằng 1 kmol khí ở điều kiện thường chiếm thể tích 22,4 lít, phản ứng đốt cháy (xem phương trình 8.1) của bất kỳ hiđrocacbon nào trong không khí có thể viết dưới dạng tổng quát:
C m H n + (t + n/4) (O 2 + 3,76N 2) = tCO 2 + (n/2) H 2 O + (t + n/4) 3,76N 2
Các yêu cầu đối với oxy và không khí trong quá trình đốt cháy các loại khí khác nhau, được tính toán từ các phản ứng đốt cháy đã cho, được trình bày trong bảng. 8.2.
Bảng 8.2. Nhu cầu lý thuyết về oxy khô và không khí, m 3, và thể tích khí sản phẩm cháy khi đốt cháy 1 m 3 khí
| Khí ga | nhu cầu lý thuyết | sản phẩm đốt cháy | ||||
|---|---|---|---|---|---|---|
| ôxy | không khí | khí cacbonic | hơi nước | nitơ | Tổng cộng | |
| hiđro H 2 | 0,5 | 2,38 | – | 1,0 | 1,88 | 2,88 |
| Cacbon monoxit CO | 0,5 | 2,38 | 1,0 | – | 1,88 | 2,88 |
| Mêtan CH 4 | 2,0 | 9,52 | 1,0 | 2,0 | 7,52 | 10,52 |
| Etan C 2 H 6 | 3,5 | 16,66 | 2,0 | 3,0 | 13,16 | 18,16 |
| Propan C 3 H 8 | 5,0 | 23,80 | 3,0 | 4,0 | 18,80 | 25,80 |
| Butan C 4 H 10 | 6,5 | 30,94 | 4,0 | 5,0 | 24,44 | 33,44 |
| Pentan C 5 H 12 | 8,0 | 38,08 | 5,0 | 6,0 | 30,08 | 41,08 |
| Etylen C 2 H 4 | 3,0 | 14,28 | 2,0 | 2,0 | 11,28 | 15,28 |
| Propylen C 3 H 6 | 4,5 | 21,42 | 3,0 | 3,0 | 16,92 | 22,92 |
| Butylen C 4 H 8 | 6,0 | 28,56 | 4,0 | 4,0 | 22,56 | 30,56 |
| Pentylen C 5 H 10 | 7,5 | 35,70 | 5,0 | 5,0 | 28,20 | 38,20 |
| Axêtylen C 2 H 2 | 2,5 | 11,90 | 2,0 | 1,0 | 9,40 | 12,40 |
Đối với khí phức, mức tiêu thụ không khí khô V c, m 3 / m 3, được tính theo công thức có tính đến nhu cầu oxy của các thành phần riêng lẻ của hỗn hợp:
V c \u003d 4,76 / 100 (0,5H 2 + 0,5CO + 2CH 4 + 3,5C 2 H 6 + 5C 3 H 8 + 6,5C 4 H 10 + 3C 2 H 4 + 4,5C 3 H 6 +6C 4 H 8 -O 2) (8.7)
Lưu lượng lý thuyết của không khí ẩm V vl, m 3 / m 3, xác định thêm theo công thức (8.7) bởi thể tích hơi nước chứa:
V ow \u003d V s + 0,001244d tính bằng V s (8.8)
nơi d in - độ ẩm không khí, g / m 3 .
Với thành phần hóa học chưa biết của khí, nhưng nhiệt trị thấp hơn đã biết Q n, kJ / m 3, mức tiêu thụ không khí lý thuyết V t, m 3 / m 3,
V t ≈ Q n / 3770 (8,9)
Mức tiêu thụ không khí thực V dv, m 3 / m 3, luôn được lấy hơi lớn:
Động cơ V \u003d V t α (8.10)
Trong đó α là hệ số không khí dư thừa, tương ứng với các yêu cầu của GOST. Để đốt cháy hoàn toàn nhiên liệu, giá trị của α phải lớn hơn 1. Thành phần và khối lượng sản phẩm cháy, được tính từ các phản ứng đốt cháy một số khí trong không khí khô, được cho trong Bảng. 8.2.
8.3. NHIỆT ĐỘ ĐỐT
Trong kỹ thuật nhiệt, nhiệt độ đốt cháy khí sau đây được phân biệt: sản lượng nhiệt, nhiệt lượng, lý thuyết và thực tế (tính toán). Công suất sưởi ấm t w - nhiệt độ tối đa của các sản phẩm đốt cháy hoàn toàn khí trong điều kiện đoạn nhiệt với hệ số không khí thừa α = 1,0 và ở nhiệt độ khí và không khí bằng 0 ° C:
t W = Q n /(∑Vc p)(8.11)
trong đó Q n - nhiệt trị thấp hơn của khí, kJ / m 3; ∑ Vc p - tổng các tích của thể tích carbon dioxide, hơi nước và nitơ được hình thành trong quá trình đốt cháy 1 m 3 khí (m 3 / m 3) và nhiệt dung thể tích trung bình của chúng ở áp suất không đổi trong khoảng nhiệt độ từ 0 ° C đến t w (kJ /(m 3 o ° C).
Do sự biến thiên nhiệt dung của các chất khí nên nhiệt lượng tỏa ra được xác định bằng phương pháp lấy xấp xỉ liên tiếp. Giá trị của nó đối với khí tự nhiên (≈2000°C) được lấy làm tham số ban đầu; tại α = 1,0, thể tích của các thành phần của sản phẩm đốt cháy được xác định, theo Bảng. 8.3 tìm nhiệt dung trung bình của chúng rồi theo công thức (8.11) tính nhiệt lượng tỏa ra của khí. Nếu do kết quả tính toán, nó thấp hơn hoặc cao hơn giá trị được chấp nhận, thì nhiệt độ khác được đặt và phép tính được lặp lại.
Bảng 8.3. Nhiệt dung thể tích trung bình của khí, kJ / (m 3 ° С)
Nhiệt độ, °С |
CO2 | thứ 2 | O2 | khí CO | CH 4 | H2 | H 2 O (hơi nước) | không khí | |
|---|---|---|---|---|---|---|---|---|---|
| khô | ướt trên 1 m 3 Khí khô |
||||||||
| 0 | 1,5981 | 1,2970 | 1,3087 | 1,3062 | 1,5708 | 1,2852 | 1,4990 | 1,2991 | 1,3230 |
| 100 | 1,7186 | 1,2991 | 1,3209 | 1,3062 | 1,6590 | 1,2978 | 1,5103 | 1,3045 | 1,3285 |
| 200 | 1,8018 | 1,3045 | 1,3398 | 1,3146 | 1,7724 | 1,3020 | 1,5267 | 1,3142 | 1,3360 |
| 300 | 1,8770 | 1,3112 | 1,3608 | 1,3230 | 1,8984 | 1,3062 | 1,5473 | 1,3217 | 1,3465 |
| 400 | 1,9858 | 1,3213 | 1,3822 | 1,3356 | 2,0286 | 1,3104 | 1,5704 | 1,3335 | 1,3587 |
| 500 | 2,0030 | 1,3327 | 1,4024 | 1,3482 | 2,1504 | 1,3104 | 1,5943 | 1,3469 | 1,3787 |
| 600 | 2,0559 | 1,3453 | 1,4217 | 1,3650 | 2,2764 | 1,3146 | 1,6195 | 1,3612 | 1,3873 |
| 700 | 2,1034 | 1,3587 | 1,3549 | 1,3776 | 2,3898 | 1,3188 | 1,6464 | 1,3755 | 1,4020 |
| 800 | 2,1462 | 1,3717 | 1,4549 | 1,3944 | 2,5032 | 1,3230 | 1,6737 | 1,3889 | 1,4158 |
| 900 | 2,1857 | 1,3857 | 1,4692 | 1,4070 | 2,6040 | 1,3314 | 1,7010 | 1,4020 | 1,4293 |
| 1000 | 2,2210 | 1,3965 | 1,4822 | 1,4196 | 2,7048 | 1,3356 | 1,7283 | 1,4141 | 1,4419 |
| 1100 | 2,2525 | 1,4087 | 1,4902 | 1,4322 | 2,7930 | 1,3398 | 1,7556 | 1,4263 | 1,4545 |
| 1200 | 2,2819 | 1,4196 | 1,5063 | 1,4448 | 2,8812 | 1,3482 | 1,7825 | 1,4372 | 1,4658 |
| 1300 | 2,3079 | 1,4305 | 1,5154 | 1,4532 | – | 1,3566 | 1,8085 | 1,4482 | 1,4771 |
| 1400 | 2,3323 | 1,4406 | 1,5250 | 1,4658 | – | 1,3650 | 1,8341 | 1,4582 | 1,4876 |
| 1500 | 2,3545 | 1,4503 | 1,5343 | 1,4742 | – | 1,3818 | 1,8585 | 1,4675 | 1,4973 |
| 1600 | 2,3751 | 1,4587 | 1,5427 | – | – | – | 1,8824 | 1,4763 | 1,5065 |
| 1700 | 2,3944 | 1,4671 | 1,5511 | – | – | – | 1,9055 | 1,4843 | 1,5149 |
| 1800 | 2,4125 | 1,4746 | 1,5590 | – | – | – | 1,9278 | 1,4918 | 1,5225 |
| 1900 | 2,4289 | 1,4822 | 1,5666 | – | – | – | 1,9698 | 1,4994 | 1,5305 |
| 2000 | 2,4494 | 1,4889 | 1,5737 | 1,5078 | – | – | 1,9694 | 1,5376 | 1,5376 |
| 2100 | 2,4591 | 1,4952 | 1,5809 | – | – | – | 1,9891 | – | – |
| 2200 | 2,4725 | 1,5011 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2300 | 2,4860 | 1,5070 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2400 | 2,4977 | 1,5166 | 1,6002 | – | – | – | 2,0389 | – | – |
| 2500 | 2,5091 | 1,5175 | 1,6045 | – | – | – | 2,0593 | – | – |
Sản lượng nhiệt của các loại khí đơn giản và phức tạp phổ biến trong quá trình đốt cháy chúng trong không khí khô được đưa ra trong Bảng. 8.4. Khi đốt cháy khí trong không khí có chứa khoảng 1 wt. % độ ẩm, nhiệt lượng tỏa ra giảm 25-30°C.
Bảng 8.4. Công suất tỏa nhiệt của khí trong không khí khô
| khí đơn giản | Nhiệt lượng tỏa ra, °С | khí hợp chất thành phần trung bình |
Đầu ra nhiệt gần đúng, °С |
|---|---|---|---|
| hydro | 2235 | mỏ khí tự nhiên |
2040 |
| carbon monoxide | 2370 | mỏ dầu tự nhiên |
2080 |
| mêtan | 2043 | than cốc |
2120 |
| etan | 2097 | Chưng cất đá phiến ở nhiệt độ cao |
1980 |
| propan | 2110 | Vụ nổ hơi-oxy dưới áp suất |
2050 |
| butan | 2118 | Máy phát điện từ than mỡ |
1750 |
| ngũ cốc | 2119 | Máy phát điện thổi hơi từ nhiên liệu nạc |
1670 |
| êtylen | 2284 | Hóa lỏng (50% C 3 H 4 + 50% C 4 H 10) |
2115 |
| axetylen | 2620 | 2210 |
Nhiệt độ đốt cháy nhiệt lượng t đến - nhiệt độ được xác định mà không tính đến sự phân ly của hơi nước và carbon dioxide, nhưng có tính đến nhiệt độ ban đầu thực tế của khí và không khí. Nó khác với công suất tỏa nhiệt t ở chỗ nhiệt độ của khí và không khí, cũng như hệ số của không khí thừa α, được lấy theo giá trị thực của chúng. Bạn có thể xác định t k theo công thức:
t k \u003d (Q n + q vật lý) / (ΣVc p) (8.12)
trong đó q vật lý - nội dung nhiệt (nhiệt vật lý) của khí và không khí, được đo từ 0 ° C, kJ / m 3.
Khí hydrocacbon tự nhiên và hóa lỏng thường không được đốt nóng trước khi đốt và thể tích của chúng nhỏ so với thể tích không khí đốt. Vì vậy khi xác định nhiệt lượng có thể bỏ qua nhiệt dung của khí. Khi các khí có nhiệt trị thấp (máy phát điện, lò cao, v.v.) bị đốt cháy, hàm lượng nhiệt của chúng (đặc biệt là những khí được đốt nóng trước khi đốt) có ảnh hưởng rất đáng kể đến nhiệt độ đo.
Sự phụ thuộc của nhiệt độ đo nhiệt lượng của khí tự nhiên có thành phần trung bình trong không khí ở nhiệt độ 0°C và độ ẩm 1% vào hệ số của không khí thừa α được cho trong Bảng. 8.5, đối với khí hydrocacbon hóa lỏng khi được đốt cháy trong không khí khô - trong bảng. 8.7. Bảng dữ liệu. 8.5–8.7, người ta có thể được hướng dẫn với độ chính xác đầy đủ trong việc thiết lập nhiệt độ đốt cháy theo phép đo nhiệt lượng của các loại khí tự nhiên khác, tương đối giống nhau về thành phần và khí hydrocacbon với hầu hết mọi thành phần. Nếu cần đạt được nhiệt độ cao khi đốt các khí có hệ số không khí dư thấp, cũng như để tăng hiệu suất của lò, thì trong thực tế, chúng làm nóng không khí, dẫn đến tăng nhiệt độ đo nhiệt lượng (xem Bảng 8.6).
Bảng 8.5. Nhiệt độ cháy lý thuyết và nhiệt lượng của khí tự nhiên trong không khí với t = 0°C và độ ẩm 1% phụ thuộc vào hệ số không khí thừa α
| Nhiệt độ cháy lý thuyết t t, ° С | Hệ số không khí thừa α | Nhiệt độ đốt cháy nhiệt lượng t k, °С | ||
|---|---|---|---|---|
| 1,0 | 2010 | 1920 | 1,33 | 1620 |
| 1,02 | 1990 | 1900 | 1,36 | 1600 |
| 1,03 | 1970 | 1880 | 1,40 | 1570 |
| 1,05 | 1940 | 1870 | 1,43 | 1540 |
| 1,06 | 1920 | 1860 | 1,46 | 1510 |
| 1,08 | 1900 | 1850 | 1,50 | 1470 |
| 1,10 | 1880 | 1840 | 1,53 | 1440 |
| 1,12 | 1850 | 1820 | 1,57 | 1410 |
| 1,14 | 1820 | 1790 | 1,61 | 1380 |
| 1,16 | 1800 | 1770 | 1,66 | 1350 |
| 1,18 | 1780 | 1760 | 1,71 | 1320 |
| 1,20 | 1760 | 1750 | 1,76 | 1290 |
| 1,22 | 1730 | – | 1,82 | 1260 |
| 1,25 | 1700 | – | 1,87 | 1230 |
| 1,28 | 1670 | – | 1,94 | 1200 |
| 1,30 | 1650 | – | 2,00 | 1170 |
Bảng 8.6. Nhiệt độ đốt cháy năng lượng của khí tự nhiên t k, ° С, tùy thuộc vào hệ số dư thừa của không khí khô và nhiệt độ của nó (giá trị làm tròn)
| Hệ số không khí thừa α | Nhiệt độ không khí khô, °C | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| 0,5 | 1380 | 1430 | 1500 | 1545 | 1680 | 1680 | 1740 | 1810 | 1860 |
| 0,6 | 1610 | 1650 | 1715 | 1780 | 1840 | 1900 | 1960 | 2015 | 2150 |
| 0,7 | 1730 | 1780 | 1840 | 1915 | 1970 | 2040 | 2100 | 2200 | 2250 |
| 0,8 | 1880 | 1940 | 2010 | 2060 | 2130 | 2200 | 2260 | 2330 | 2390 |
| 0,9 | 1980 | 2030 | 2090 | 2150 | 2220 | 2290 | 2360 | 2420 | 2500 |
| 1,0 | 2050 | 2120 | 2200 | 2250 | 2320 | 2385 | 2450 | 2510 | 2560 |
| 1,2 | 1810 | 1860 | 1930 | 2000 | 2070 | 2140 | 2200 | 2280 | 2350 |
| 1,4 | 1610 | 1660 | 1740 | 1800 | 2870 | 1950 | 2030 | 2100 | 2160 |
| 1,6 | 1450 | 1510 | 1560 | 1640 | 1730 | 1800 | 1860 | 1950 | 2030 |
| 1,8 | 1320 | 1370 | 1460 | 1520 | 1590 | 1670 | 1740 | 1830 | 1920 |
| 2,0 | 1220 | 1270 | 1360 | 1420 | 1490 | 1570 | 1640 | 1720 | 1820 |
Bảng 8.7. Nhiệt lượng đốt cháy t thành propan kỹ thuật trong không khí khô với t = 0°C phụ thuộc vào hệ số không khí thừa α
| Hệ số không khí thừa α | Nhiệt độ đốt cháy nhiệt lượng t k, °С | Hệ số không khí thừa α | Nhiệt độ đốt cháy nhiệt lượng t k, °С |
|---|---|---|---|
| 1,0 | 2110 | 1,45 | 1580 |
| 1,02 | 2080 | 1,48 | 1560 |
| 1,04 | 2050 | 1,50 | 1540 |
| 1,05 | 2030 | 1,55 | 1500 |
| 1,07 | 2010 | 1,60 | 1470 |
| 1,10 | 1970 | 1,65 | 1430 |
| 1,12 | 1950 | 1,70 | 1390 |
| 1,15 | 1910 | 1,75 | 1360 |
| 1,20 | 1840 | 1,80 | 1340 |
| 1,25 | 1780 | 1,85 | 1300 |
| 1,27 | 1750 | 1,90 | 1270 |
| 1,30 | 1730 | 1,95 | 1240 |
| 1,35 | 1670 | 2,00 | 1210 |
| 1,40 | 1630 | 2,10 | 1170 |
Nhiệt độ đốt lý thuyết t T - nhiệt độ tối đa, được xác định tương tự như phép đo nhiệt lượng t k, nhưng được điều chỉnh cho các phản ứng thu nhiệt (đòi hỏi nhiệt) của sự phân ly carbon dioxide và hơi nước, tiến hành tăng thể tích:
CO 2 ‹–› CO + 0,5O 2 - 283 mJ/mol (8.13)
H 2 O ‹–› H 2 + 0,5O 2 - 242 mJ/mol (8.14)
Ở nhiệt độ cao, sự phân ly có thể dẫn đến sự hình thành các nguyên tử hydro, oxy và nhóm OH hydroxyl. Ngoài ra, khi đốt cháy khí, một số oxit nitơ luôn được hình thành. Tất cả các phản ứng này đều thu nhiệt và dẫn đến giảm nhiệt độ đốt cháy.
Nhiệt độ cháy lý thuyết có thể được xác định theo công thức sau:
t T \u003d (Q n + q vật lý - q dis) / (ΣVc p) (8.15)
trong đó q dis - tổng chi phí nhiệt cho sự phân ly CO 2 và H 2 O trong các sản phẩm đốt cháy, kJ / m 3; ΣVc p là tổng của tích thể tích và nhiệt dung trung bình của các sản phẩm cháy có kể đến độ phân ly trên 1 m 3 khí.
Bảng 8.8. Mức độ phân ly của hơi nước H 2 O và khí cacbonic CO 2 tùy thuộc vào áp suất riêng phần
| Nhiệt độ, °С | Áp suất riêng phần, MPa | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,004 | 0,006 | 0,008 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,025 | 0,030 | 0,040 | |
| hơi nước H 2 O | ||||||||||||
| 1600 | 0,85 | 0,75 | 0,65 | 0,60 | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,42 |
| 1700 | 1,45 | 1,27 | 1,16 | 1,08 | 1,02 | 0,95 | 0,90 | 0,85 | 0,8 | 0,76 | 0,73 | 0,67 |
| 1800 | 2,40 | 2,10 | 1,90 | 1,80 | 1,70 | 1,60 | 1,53 | 1,46 | 1,40 | 1,30 | 1,25 | 1,15 |
| 1900 | 4,05 | 3,60 | 3,25 | 3,0 | 2,85 | 2,70 | 2,65 | 2,50 | 2,40 | 2,20 | 2,10 | 1,9 |
| 2000 | 5,75 | 5,05 | 4,60 | 4,30 | 4,0 | 3,80 | 3,55 | 3,50 | 3,40 | 3,15 | 2,95 | 2,65 |
| 2100 | 8,55 | 7,50 | 6,80 | 6,35 | 6,0 | 5,70 | 5,45 | 5,25 | 5,10 | 4,80 | 4,55 | 4,10 |
| 2200 | 12,3 | 10,8 | 9,90 | 9,90 | 8,80 | 8,35 | 7,95 | 7,65 | 7,40 | 6,90 | 6,50 | 5,90 |
| 2300 | 16,0 | 15,0 | 13,7 | 12,9 | 12,2 | 11,6 | 11,1 | 10,7 | 10,4 | 9,6 | 9,1 | 8,4 |
| 2400 | 22,5 | 20,0 | 18,4 | 17,2 | 16,3 | 15,6 | 15,0 | 14,4 | 13,9 | 13,0 | 12,2 | 11,2 |
| 2500 | 28,5 | 25,6 | 23,5 | 22,1 | 20,9 | 20,0 | 19,3 | 18,6 | 18,0 | 16,8 | 15,9 | 14,6 |
| 3000 | 70,6 | 66,7 | 63,8 | 61,6 | 59,6 | 58,0 | 56,5 | 55,4 | 54,3 | 51,9 | 50,0 | 47,0 |
| khí cacbonic CO2 | ||||||||||||
| 1500 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | – |
| 1600 | 2,0 | 1,8 | 1,6 | 1,5 | 1,45 | 1,4 | 1,35 | 1,3 | 1,25 | 1,2 | 1,1 | |
| 1700 | 3,8 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,4 | 2,3 | 2,2 | 2,0 | 1,9 | |
| 1800 | 6,3 | 5,5 | 5,0 | 4,6 | 4,4 | 4,2 | 4,0 | 3,8 | 3,7 | 3,5 | 3,3 | |
| 1900 | 10,1 | 8,9 | 8,1 | 7,6 | 7,2 | 6,8 | 6,5 | 6,3 | 6,1 | 5,6 | 5,3 | |
| 2000 | 16,5 | 14,6 | 13,4 | 12,5 | 11,8 | 11,2 | 10,8 | 10,4 | 10,0 | 9,4 | 8,8 | |
| 2100 | 23,9 | 21,3 | 19,6 | 18,3 | 17,3 | 16,5 | 15,9 | 15,3 | 14,9 | 13,9 | 13,1 | |
| 2200 | 35,1 | 31,5 | 29,2 | 27,5 | 26,1 | 25,0 | 24,1 | 23,3 | 22,6 | 21,2 | 20,1 | |
| 2300 | 44,7 | 40,7 | 37,9 | 35,9 | 34,3 | 32,9 | 31,8 | 30,9 | 30,0 | 28,2 | 26,9 | |
| 2400 | 56,0 | 51,8 | 48,8 | 46,5 | 44,6 | 43,1 | 41,8 | 40,6 | 39,6 | 37,5 | 35,8 | |
| 2500 | 66,3 | 62,2 | 59,3 | 56,9 | 55,0 | 53,4 | 52,0 | 50,7 | 49,7 | 47,3 | 45,4 | |
| 3000 | 94,9 | 93,9 | 93,1 | 92,3 | 91,7 | 90,6 | 90,1 | 89,6 | 88,5 | 87,6 | 86,8 | |
Như có thể thấy từ Bảng. 8.8, ở nhiệt độ lên tới 1600 ° C, mức độ phân ly có thể không được tính đến và nhiệt độ đốt cháy lý thuyết có thể được lấy bằng nhiệt lượng. Ở nhiệt độ cao hơn, mức độ phân ly có thể làm giảm đáng kể nhiệt độ trong không gian làm việc. Trong thực tế, không có nhu cầu đặc biệt nào về điều này, nhiệt độ đốt cháy lý thuyết chỉ cần được xác định đối với các lò nhiệt độ cao hoạt động bằng không khí đã được làm nóng trước (ví dụ: lò đốt hở). Đối với việc lắp đặt nồi hơi, điều này là không cần thiết.
Bảng 8.9. tối đa
nhiệt độ phát sinh
trong ngọn lửa tự do, ° С
Nhiệt độ thực tế (tính toán) của sản phẩm cháy t d- nhiệt độ đạt được trong điều kiện thực tại điểm nóng nhất của ngọn đuốc. Nó thấp hơn lý thuyết và phụ thuộc vào tổn thất nhiệt ra môi trường, mức độ truyền nhiệt từ vùng cháy do bức xạ, độ dài của quá trình cháy trong thời gian, v.v. Nhiệt độ trung bình thực tế trong các lò và nồi hơi là được xác định bởi sự cân bằng nhiệt hoặc xấp xỉ bởi nhiệt độ đốt lý thuyết hoặc nhiệt lượng, tùy thuộc vào nhiệt độ trong lò với việc đưa các hệ số hiệu chỉnh được thiết lập bằng thực nghiệm vào chúng:
t d = t t η(8.16)
trong đó η- được gọi là. hệ số nhiệt kế trong giới hạn:
- đối với lò nhiệt và lò sưởi được chế tạo tốt với lớp cách nhiệt - 0,75–0,85;
- đối với lò kín không có cách nhiệt - 0,70–0,75;
- đối với lò hơi có che chắn - 0,60–0,75.
Trong thực tế, không chỉ cần biết nhiệt độ đốt cháy đáng tin cậy ở trên mà còn cả nhiệt độ tối đa xảy ra trong ngọn lửa. Giá trị gần đúng của chúng thường được thiết lập bằng thực nghiệm bằng phương pháp quang phổ. Nhiệt độ tối đa xảy ra trong ngọn lửa tự do ở khoảng cách 5–10 mm tính từ đỉnh của mặt trước đốt hình nón được đưa ra trong Bảng. 8,9. Phân tích dữ liệu đã cho cho thấy nhiệt độ tối đa trong ngọn lửa nhỏ hơn nhiệt lượng tỏa ra (do chi phí nhiệt cho quá trình phân ly H 2 O và CO 2 và loại bỏ nhiệt khỏi vùng ngọn lửa).
8.4. NHIỆT ĐỘ TỰ BỐC CHÁY
Để bắt đầu các phản ứng đốt cháy, các điều kiện để đánh lửa hỗn hợp nhiên liệu với chất oxy hóa là cần thiết. Đánh lửa có thể tự phát và cưỡng bức (đánh lửa).
Nhiệt độ tự bốc cháy- nhiệt độ tối thiểu tại đó quá trình đốt cháy tự phát (tức là không có nguồn cung cấp nhiệt bên ngoài) bắt đầu trong hỗn hợp khí-không khí được làm nóng, do sự giải phóng nhiệt bằng cách đốt cháy các hạt khí.
Nhiệt độ tự bốc cháy không cố định đối với một loại khí nhất định và phụ thuộc vào nhiều thông số: hàm lượng của nó trong hỗn hợp khí-không khí, mức độ đồng nhất của hỗn hợp, hình dạng và kích thước của bình chứa hỗn hợp, tốc độ và phương pháp gia nhiệt, tác dụng xúc tác của thành bình, áp suất theo đó hỗn hợp. Việc xem xét chính xác các yếu tố này là rất khó khăn, do đó, trong thực tế, ví dụ, khi đánh giá khả năng nổ, dữ liệu thực nghiệm được sử dụng (xem Bảng 8.10).
Bảng 8.10. Nhiệt độ tự bốc cháy thấp nhất đo được của một số khí và hơi trộn với không khí ở áp suất khí quyển
Nhiệt độ tự bốc cháy của khí dễ cháy trong oxy thấp hơn một chút so với trong không khí. Việc đưa các tạp chất dằn (nitơ và carbon dioxide) vào thành phần khí dẫn đến sự gia tăng nhiệt độ tự bốc cháy. Sự hiện diện của các thành phần có nhiệt độ tự bốc cháy thấp trong khí phức dẫn đến giảm nhiệt độ tự bốc cháy của hỗn hợp.
Đánh lửa cưỡng bức (đánh lửa) được thực hiện bằng cách đốt cháy hỗn hợp tại một hoặc một số điểm bằng nguồn nhiệt độ cao - ngọn lửa hở hoặc tia lửa điện tại điểm khí thoát ra từ các kênh đốt của đầu đốt vào thể tích lò . Đánh lửa khác với tự bốc cháy ở chỗ hỗn hợp dễ cháy được đưa đến sự xuất hiện của ngọn lửa không phải trong toàn bộ thể tích của nó mà chỉ ở một phần nhỏ của nó. Quá trình loại bỏ nhiệt khỏi vùng được làm nóng đòi hỏi tốc độ giải phóng nhiệt của nguồn đánh lửa phải vượt quá mức loại bỏ nhiệt này. Sau khi được đánh lửa, nguồn đánh lửa bị loại bỏ và quá trình đốt cháy xảy ra bằng cách lan truyền ngọn lửa phía trước.
8.5. GIỚI HẠN KHẢ NĂNG CHÁY VÀ NỔ
Hỗn hợp khí-không khí chỉ có thể bốc cháy (nổ) khi hàm lượng khí trong hỗn hợp nằm trong giới hạn nhất định (đối với từng loại khí). Về vấn đề này, có giới hạn nồng độ thấp hơn và cao hơn của tính dễ cháy. Giới hạn dưới tương ứng với mức tối thiểu và giới hạn trên tương ứng với lượng khí tối đa trong hỗn hợp, tại đó chúng bốc cháy (trong quá trình đánh lửa) và sự lan truyền ngọn lửa tự phát (không có dòng nhiệt từ bên ngoài) (tự bốc cháy). Các giới hạn tương tự tương ứng với các điều kiện nổ của hỗn hợp khí-không khí.
Nếu hàm lượng khí trong hỗn hợp khí-không khí nhỏ hơn giới hạn dễ cháy dưới, thì hỗn hợp đó không thể cháy và nổ vì nhiệt tỏa ra gần nguồn đánh lửa không đủ để làm nóng hỗn hợp đến nhiệt độ đánh lửa. Nếu hàm lượng khí của hỗn hợp nằm giữa giới hạn dễ cháy dưới và trên, thì hỗn hợp bắt lửa sẽ bắt lửa và cháy cả gần nguồn đánh lửa và khi nó được lấy ra. Hỗn hợp này dễ nổ. Dải giới hạn cháy (còn gọi là giới hạn nổ) càng rộng và giới hạn dưới càng thấp thì khí càng dễ nổ. Và cuối cùng, nếu hàm lượng khí trong hỗn hợp vượt quá giới hạn cháy trên, thì lượng không khí trong hỗn hợp không đủ để đốt cháy hoàn toàn khí.
Sự tồn tại của giới hạn cháy là do mất nhiệt trong quá trình cháy. Khi hỗn hợp dễ cháy được pha loãng với không khí, oxy hoặc khí đốt, tổn thất nhiệt tăng lên, tốc độ lan truyền ngọn lửa giảm và quá trình cháy dừng lại sau khi loại bỏ nguồn đánh lửa.
Bảng 8.11. Giới hạn cháy của khí pha với không khí (ở t = 20°C và p = 101,3 kPa)
| Khí ga | Hàm lượng khí trong hỗn hợp khí-không khí, vol. % | tối đa |
Hệ số không khí α ở giới hạn cháy | ||||
|---|---|---|---|---|---|---|---|
| Trong giới hạn cháy | Với thành phần cân bằng hóa học của hỗn hợp | Với thành phần của hỗn hợp tạo ra áp suất nổ lớn nhất | |||||
| thấp hơn | hàng đầu | thấp hơn | hàng đầu | ||||
| hydro | 4,0 | 75,0 | 29,5 | 32,3 | 0,739 | 9,8 | 0,15 |
| carbon monoxide | 12,5 | 74,0 | 29,5 | – | – | 2,9 | 0,15 |
| mêtan | 5,0 | 15,0 | 9,5 | 9,8 | 0,717 | 1,8 | 0,65 |
| etan | 3,2 | 12,5 | 5,68 | 6,28 | 0,725 | 1,9 | 0,42 |
| propan | 2,3 | 9,5 | 4,04 | 4,60 | 0,858 | 1,7 | 0,40 |
| n-butan | 1,7 | 8,5 | 3,14 | 3,6 | 0,858 | 1,7 | 0,35 |
| isobutan | 1,8 | 8,4 | 3,14 | – | – | ~1,8 | 0,35 |
| n-Pentan | 1,4 | 7,8 | 2,56 | 3,0 | 0,865 | 1,8 | 0,31 |
| êtylen | 3,0 | 16,0 | 6,5 | 8,0 | 0,886 | 2,2 | 0,17 |
| Propylen | 2,4 | 10,0 | 4,5 | ~5,1 | ~0,89 | 1,9 | 0,37 |
| butylen | 1,7 | 9,0 | 3,4 | ~4,0 | ~0,88 | 1,7 | 0,35 |
| axetylen | 2,5 | 80,0 | 7,75 | 14,5 | 1,03 | 3,3 | 0,019 |
Bảng 8.12. Giới hạn cháy của khí trộn với oxy (ở t = 20°C và p = 101,3 kPa)
Giới hạn cháy đối với các loại khí phổ biến trong hỗn hợp với không khí và oxy được đưa ra trong Bảng. 8.11–8.12. Với sự gia tăng nhiệt độ của hỗn hợp, các giới hạn dễ cháy mở rộng và ở nhiệt độ vượt quá nhiệt độ tự bốc cháy, hỗn hợp khí với không khí hoặc oxy sẽ cháy ở bất kỳ tỷ lệ thể tích nào.
Giới hạn cháy không chỉ phụ thuộc vào loại khí cháy được mà còn phụ thuộc vào điều kiện thí nghiệm (dung tích bình, nhiệt lượng tỏa ra của nguồn đánh lửa, nhiệt độ hỗn hợp, ngọn lửa lan truyền lên, xuống, theo chiều ngang, v.v.). Điều này giải thích các giá trị hơi khác nhau của các giới hạn này trong các nguồn văn học khác nhau. Trong bảng. Hình 8.11–8.12 cho thấy dữ liệu tương đối đáng tin cậy thu được ở nhiệt độ phòng và áp suất khí quyển trong quá trình lan truyền ngọn lửa từ dưới lên trên trong một ống có đường kính từ 50 mm trở lên. Khi ngọn lửa lan từ trên xuống dưới hoặc theo chiều ngang, giới hạn dưới tăng nhẹ và giới hạn trên giảm. Giới hạn cháy của các khí dễ cháy phức tạp không chứa tạp chất dằn được xác định theo quy tắc cộng tính:
L g \u003d (r 1 + r 2 + ... + r n) / (r 1 / l 1 + r 2 / l 2 + ... + r n / l n) (8.17)
trong đó L g là giới hạn cháy dưới hoặc trên của khí phức trong hỗn hợp khí-không khí hoặc khí-oxy, vol. %; r 1 , r 2 , …, r n - hàm lượng các cấu tử riêng lẻ trong khí phức, vol. %; r 1 + r 2 + ... + r n \u003d 100%; l 1, l 2, ..., l n - giới hạn cháy dưới hoặc trên của các thành phần riêng lẻ trong hỗn hợp khí-không khí hoặc khí-oxy theo bảng. 8.11 hoặc 8.12, tập. %.
Khi có tạp chất dằn trong khí, giới hạn cháy có thể được xác định theo công thức:
L b \u003d L g / (8.18)
trong đó L b - giới hạn cháy trên và dưới của hỗn hợp có tạp chất dằn, vol. %; L g - giới hạn cháy trên và dưới của hỗn hợp dễ cháy, vol. %; B - lượng tạp chất dằn, phân số của một đơn vị.
Khi tính toán thường cần biết hệ số không khí dư α cho các giới hạn cháy khác nhau (xem Bảng 8.11), cũng như áp suất xuất hiện trong quá trình nổ của hỗn hợp khí-không khí. Hệ số không khí dư tương ứng với giới hạn cháy trên hoặc dưới có thể được xác định theo công thức
α = (100/L – 1) (1/V T) (8.19)
Áp suất phát sinh từ vụ nổ hỗn hợp khí-không khí có thể được xác định gần đúng bằng các công thức sau:
cho tỷ lệ cân bằng hóa học của một loại khí đơn giản với không khí:
P vz \u003d P n (1 + βt k) (m / n) (8.20)
đối với bất kỳ tỷ lệ nào của khí phức với không khí:
R vz \u003d R n (1 + βt k) V vlps / (1 + αV m) (8.21)
trong đó P vz - áp suất phát sinh từ vụ nổ, MPa; p n - áp suất ban đầu (trước khi nổ), MPa; β - hệ số giãn nở thể tích của khí, bằng số với hệ số áp suất (1/273); t K - nhiệt độ đốt cháy theo phép đo nhiệt lượng, °С; m là số mol khí sau khi nổ xác định bằng phản ứng đốt cháy khí trong không khí; n là số mol trước khi nổ tham gia phản ứng cháy; V vlps - thể tích sản phẩm cháy ướt trên 1 m 3 khí, m 3; V t - tiêu thụ không khí lý thuyết, m 3 /m 3.
Bảng 8.13. Áp suất phát sinh từ vụ nổ hỗn hợp propan-không khí, tùy thuộc vào hệ số xả k sb và loại thiết bị bảo vệ
| Loại thiết bị bảo vệ | Hệ số xả k sb, m 2 / m 3 | ||
|---|---|---|---|
| 0,063 | 0,033 | 0,019 | |
| Kính cố định đơn có gắn kính bên ngoài dày 3 mm | 0,005 | 0,009 | 0,019 |
| Kính hai lớp cố định có gắn kính bên ngoài dày 3 mm | 0,007 | 0,015 | 0,029 |
| Khung cửa sổ đơn xoay với bản lề lớn và khóa lò xo chịu tải 5 MPa / m 2 | 0,002 | – | – |
| Khung cửa sổ đơn xoay có bản lề trên và khóa lò xo cho tải trọng 5 MPa / m 2 | 0,003 | – | – |
| Tấm nằm tự do trên sàn với khối lượng, kg / m 2: | |||
| 0,023 | |||
| 0,005 | |||
| 0,018 | |||
Áp suất nổ được đưa ra trong Bảng. 8.13 hoặc được xác định bởi các công thức chỉ có thể xảy ra nếu khí được đốt cháy hoàn toàn bên trong bình chứa và thành bình chứa được thiết kế cho những áp suất này. Mặt khác, chúng bị giới hạn bởi độ bền của tường hoặc các bộ phận dễ bị phá hủy nhất của chúng - các xung áp suất truyền qua thể tích hỗn hợp chưa được đánh lửa với tốc độ âm thanh và chạm tới hàng rào nhanh hơn nhiều so với mặt trước của ngọn lửa.
Tính năng này - sự khác biệt về tốc độ lan truyền ngọn lửa và xung áp suất (sóng xung kích) - được sử dụng rộng rãi trong thực tế để bảo vệ các thiết bị khí đốt và cơ sở khỏi bị phá hủy trong một vụ nổ. Để làm được điều này, các thanh ngang, khung, tấm, van, v.v. dễ dàng mở hoặc thu gọn được lắp đặt vào các khe hở của tường và trần nhà. Áp suất phát sinh từ vụ nổ phụ thuộc vào đặc điểm thiết kế của các thiết bị bảo vệ và hệ số xả k sb, là tỷ lệ giữa diện tích của các thiết bị bảo vệ với thể tích của căn phòng.
8.6. CHÁY TRONG MÔI TRƯỜNG VẪN
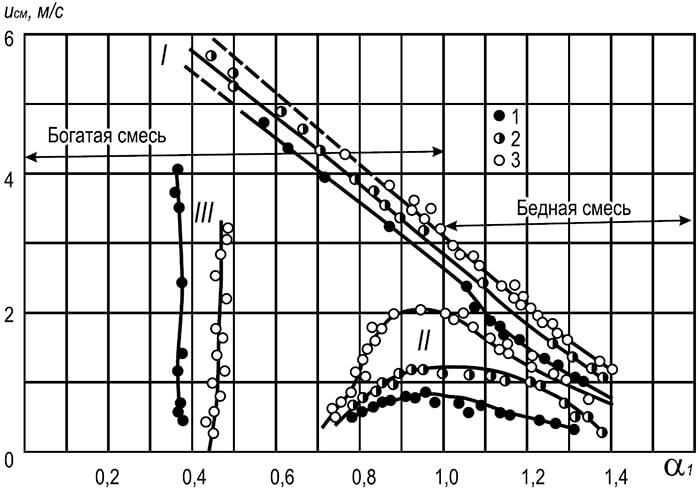
Sự chuyển động của vùng ngọn lửa - mặt trước ngọn lửa, - vùng ngăn cách hỗn hợp dễ cháy chưa phản ứng với các sản phẩm cháy, là do hỗn hợp dễ cháy lạnh phía trước được làm nóng đến nhiệt độ bắt lửa do dẫn nhiệt và khuếch tán. sản phẩm cháy nóng vào hỗn hợp lạnh. Tốc độ tuyến tính mà mặt trước ngọn lửa di chuyển qua hỗn hợp dễ cháy đồng nhất được gọi là tốc độ lan truyền ngọn lửa đồng đều tùy thuộc vào cả loại khí và hàm lượng của nó trong hỗn hợp khí-không khí. Tốc độ tối thiểu đối với tất cả các loại khí dễ cháy tương ứng với giới hạn dưới và trên của quá trình bắt lửa và tối đa - với tỷ lệ khí và không khí.
Cơm. 8.1. Đường cong của tốc độ thống nhất
lan truyền ngọn lửa u n, xác định
trong một ống có đường kính 25,4 mm
1-hiđro; 2-khí nước; 3-cacbon monoxit;
4-etilen; 5-khí lò than cốc; 6-etan; 7-metan;
8-máy phát điện khí nổ hơi
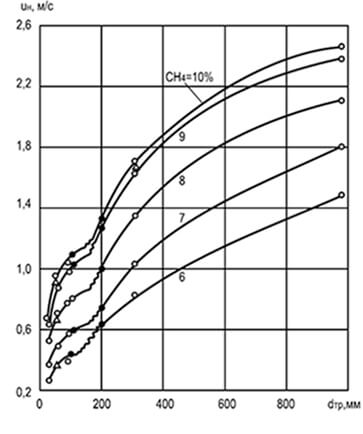
Cơm. 8.2. Ảnh hưởng của đường kính d tr và nồng độ
metan trộn với không khí để thay đổi
tốc độ lan truyền ngọn lửa đồng đều u n
Các thí nghiệm đã xác định rằng tốc độ lan truyền ngọn lửa phụ thuộc vào đường kính của ống hình trụ mà nó lan truyền: đường kính càng lớn thì tốc độ lan truyền càng cao. Việc tăng đường kính của ống làm giảm ảnh hưởng của các bức tường đối với quá trình đốt cháy và phía trước ngọn lửa chuyển động, đồng thời góp phần tăng cường đối lưu (Hình 8.2). Phân tích dữ liệu biểu đồ chỉ ra rằng với kích thước ống rất nhỏ, ngọn lửa lan truyền nói chung là không thể (do loại bỏ nhiệt tương đối mạnh). Kích thước của các ống, kênh và khe mà ngọn lửa không lan rộng được gọi là tới hạn.
Chúng khác nhau đối với các loại khí khác nhau:
- hỗn hợp lạnh của khí mê-tan với không khí - 3 mm;
- hỗn hợp hydro-không khí - 0,9 mm;
- hỗn hợp nóng của metan với không khí - 1,2 mm.
Dập tắt trong các kênh có tiết diện nhỏ được sử dụng trong thực tế để tạo ra các thiết bị chống cháy: lưới bắt lửa, đĩa xốp gốm, đĩa làm bằng quả bóng kim loại ép, bình chứa đầy vật liệu hạt mịn, v.v.); các kênh lửa trong thiết kế đầu đốt hoạt động trên hỗn hợp khí-không khí.
Đối với một đặc tính so sánh về tính chất dễ cháy của khí (bất kể kích thước của ống), khái niệm "tốc độ lan truyền ngọn lửa bình thường"- đây là tốc độ, được gọi là hỗn hợp lạnh (chưa bắt lửa), mà ngọn lửa di chuyển dọc theo bình thường đến bề mặt của nó. Mặt trước ngọn lửa được coi là phẳng và bằng đường kính của ống:
u n \u003d w p πr 2 / S (8.22)
trong đó u n là tốc độ lan truyền ngọn lửa bình thường, m/s; w p - tốc độ lan truyền ngọn lửa đồng đều đo được, m/s; r - bán kính ống, m; S là diện tích bề mặt của mặt trước ngọn lửa, m 2 .
Bảng 8.14. Tốc độ lan truyền ngọn lửa trong các hỗn hợp khí-không khí khác nhau (ở t=20°C và p=103,3 kPa), m/s
| Khí ga | Hỗn hợp với bình thường tối đa tốc độ lan truyền ngọn lửa |
hỗn hợp cân bằng hóa học | ||||
|---|---|---|---|---|---|---|
| Hàm lượng trong hỗn hợp, vol. % | tối đa thông thường tốc độ, vận tốc phổ biến |
Hàm lượng trong hỗn hợp, vol. % | Bình thường tốc độ, vận tốc phổ biến ngọn lửa |
|||
| khí ga | không khí | khí ga | không khí | |||
| hydro | 42,0 | 58,0 | 2,67 | 29,5 | 70,5 | 1,6 |
| carbon monoxide | 43,0 | 57,0 | 0,42 | 29,5 | 70,5 | 0,30 |
| mêtan | 10,5 | 89,0 | 0,37 | 9,5 | 90,5 | 0,28 |
| etan | 6,3 | 93,7 | 0,40 | 5,7 | 94,3 | 0,32 |
| propan | 4,3 | 95,7 | 0,38 | 4,04 | 95,96 | 0,31 |
| n-butan | 3,3 | 96,7 | 0,37 | 3,14 | 96,86 | 0,30 |
| êtylen | 7,0 | 93,0 | 0,63 | 6,5 | 93,5 | 0,5 |
| Propylen | 4,8 | 95,2 | 0,44 | 4,5 | 95,5 | 0,37 |
| butylen | 3,7 | 96,3 | 0,43 | 3,4 | 96,6 | 0,38 |
| axetylen | 10,0 | 90,0 | 1,35 | 7,75 | 92,25 | 1,0 |
Như có thể thấy từ dữ liệu trong Bảng. 8.14, tốc độ lan truyền ngọn lửa tối đa tương ứng với hỗn hợp khí và không khí thiếu chất oxy hóa (không cân bằng hóa học). Với lượng nhiên liệu dư thừa, hiệu suất va chạm của các hạt phản ứng tăng lên và tốc độ phản ứng hóa học tăng lên.
Tốc độ lan truyền ngọn lửa đối với hỗn hợp khí-oxy cao hơn nhiều so với hỗn hợp khí-không khí. Do đó, tốc độ lan truyền ngọn lửa bình thường tối đa đối với hỗn hợp metan-oxy là 3,3 m/s và đối với hỗn hợp propan và butan với oxy là 3,5–3,6 m/s.
Tốc độ lan truyền ngọn lửa bình thường tối đa trong hỗn hợp khí phức với không khí, m/s, được xác định theo công thức:
u n max \u003d (r 1 u 1 + r 2 u 2 + ... + r n u n) / (r 1 + r 2 + ... + r n) (8.23)
trong đó r 1 , r 2 ,…r n là hàm lượng của các thành phần riêng lẻ trong khí phức hợp, thể tích. %; u 1 , u 2 ,...u n là vận tốc lan truyền ngọn lửa pháp tuyến lớn nhất của thành phần khí phức có lẫn không khí, m/s.
Các tỷ lệ đã cho phù hợp với các khí có vận tốc lan truyền ngọn lửa bình thường gần nhau, ví dụ, đối với khí hydrocacbon tự nhiên và khí hóa lỏng. Đối với các hỗn hợp khí có vận tốc lan truyền ngọn lửa khác nhau đáng kể (ví dụ: hỗn hợp khí tự nhiên và khí nhân tạo, hỗn hợp có hàm lượng hydro cao), chúng chỉ cho giá trị gần đúng.
Nếu hỗn hợp chứa các tạp chất dằn (nitơ và carbon dioxide), thì để tính toán gần đúng vận tốc lan truyền ngọn lửa, nên sử dụng công thức sau:
u b \u003d u n max (1 - 0,01N 2 - 0,012CO 2) (8.24)
Tăng đáng kể tốc độ lan truyền ngọn lửa bằng cách làm nóng hỗn hợp khí-không khí:
u‘ n \u003d u n (T‘ / T) (8.25)
trong đó u‘ n là tốc độ lan truyền ngọn lửa trong hỗn hợp nung nóng có nhiệt độ tuyệt đối T‘, K; và n - giống nhau, trong hỗn hợp lạnh có nhiệt độ T, K.
Làm nóng sơ bộ hỗn hợp làm thay đổi mật độ của nó theo tỷ lệ nghịch với nhiệt độ tuyệt đối, và do đó tốc độ lan truyền ngọn lửa tăng tỷ lệ thuận với nhiệt độ này. Thực tế này phải được tính đến trong các tính toán, đặc biệt là trong những trường hợp khi các kênh đốt của đầu đốt được đặt trong khối xây nóng hoặc khi chúng bị ảnh hưởng bởi bức xạ của lò, khí nóng, v.v.
Tính đồng nhất của sự lan truyền ngọn lửa có thể xảy ra trong các điều kiện sau:
- ống lửa ngắn;
- quá trình đốt cháy lan truyền ở áp suất không đổi gần với áp suất khí quyển.
Nếu chiều dài của ống là đáng kể, thì sự lan truyền đồng đều của ngọn lửa đối với một số hỗn hợp có thể chuyển thành rung động, sau đó thành bùng nổ với tốc độ cháy siêu thanh (2000 m/s trở lên), khi hỗn hợp bốc cháy do sóng xung kích làm nóng hỗn hợp đến nhiệt độ cao hơn nhiệt độ đánh lửa. Sự kích nổ xảy ra trong hỗn hợp có vận tốc lan truyền ngọn lửa cao. Giới hạn nồng độ kích nổ hẹp hơn giới hạn cháy của hỗn hợp khí-không khí và khí-oxy, vol. %: propan - 3,2–37, isobutan - 2,8–31, hydro - 15–90. Áp suất phát sinh trong quá trình đốt cháy nổ có thể vượt quá áp suất ban đầu hàng chục lần và dẫn đến phá hủy đường ống và các bình khác được thiết kế cho áp suất cao.
8.7. SỰ ĐỐT TRONG DÒNG CHẢY PHÉP VÀ DÒNG CHẢY

Cơm. 8.3. đốt trước
hỗn hợp khí-không khí trong
chuyển động tầng
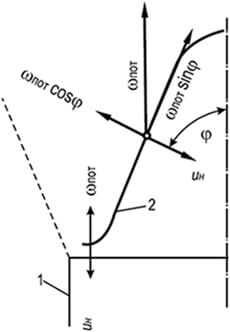
Mặt trước ngọn lửa có thể được dừng lại bằng cách tạo ra chuyển động tới của hỗn hợp dễ cháy với tốc độ bằng với tốc độ lan truyền ngọn lửa bình thường. Một ví dụ điển hình là bề mặt của hình nón bên trong của đầu đốt Bunsen. Bằng cách điều chỉnh thành phần của hỗn hợp khí-không khí chảy ra khỏi đầu đốt ở chế độ chuyển động tầng, có thể đạt được sự xuất hiện của hình nón đốt cháy ổn định và rõ nét (Hình 8.3). Bề mặt bên của hình nón (mặt trước ngọn lửa), đứng yên so với mép đốt của kênh đầu đốt, di chuyển về phía hỗn hợp khí-không khí thoát ra và ngọn lửa trong trường hợp này truyền dọc theo bình thường tới bề mặt đánh lửa ở mỗi điểm của nó. Trên bề mặt của mặt trước ngọn lửa hình nón, sự bằng nhau về vận tốc được bảo toàn - các hình chiếu của vận tốc dòng chảy của hỗn hợp khí-không khí trên đường sinh bình thường của hình nón và vận tốc lan truyền ngọn lửa bình thường tuân theo định luật Michelson:
w n \u003d w mồ hôi cosφ \u003d u n (8.26)
trong đó φ là góc giữa hướng dòng chảy và pháp tuyến với bề mặt của mặt trước ngọn lửa hình nón; w mồ hôi - tốc độ dòng chảy trung bình của hỗn hợp khí-không khí đi qua đầu đốt trên một đơn vị thời gian, m/s.
Sự không đổi của tốc độ lan truyền ngọn lửa bình thường chỉ có giá trị đối với phần chính của bề mặt bên của mặt trước ngọn lửa hình nón. Ở đỉnh hình nón, tốc độ tăng lên do sự đốt nóng hỗn hợp khí-không khí bởi các phần cách đều nhau của bề mặt hình nón của mặt trước ngọn lửa, và ở đáy hình nón, tốc độ giảm xuống do hiệu ứng làm mát của phần cuối một phần của kênh lửa đầu đốt.
Đối với các tính toán thực tế, sự khác biệt này thường được bỏ qua và tốc độ truyền hỗn hợp qua mặt trước ngọn lửa được giả định là không đổi trên toàn bộ bề mặt của hình nón và bằng u n.
Vận tốc lan truyền ngọn lửa bình thường trung bình là
u n \u003d V cm / S (8.27)
trong đó V cm là thể tích của hỗn hợp khí-không khí đi qua đầu đốt, S là diện tích bề mặt của mặt trước ngọn lửa hình nón.
Trong thực tế, mặt trước ngọn lửa hình nón không có dạng hình học thông thường, do đó, để xác định chính xác S, người ta chụp ảnh ngọn lửa, mặt trước ngọn lửa được chia thành một loạt hình nón cụt. Tổng các mặt bên là tổng bề mặt của mặt trước ngọn lửa hình nón. Các giá trị của vận tốc lan truyền ngọn lửa bình thường, được xác định bằng cả phương pháp đầu đốt Bunsen và các phương pháp khác, đều giống nhau và bằng vận tốc bình thường được đưa ra trong Bảng. 8.14.
Chiều cao của mặt trước ngọn lửa hình nón chủ yếu phụ thuộc vào kích thước kênh đốt của đầu đốt. Có thể giảm chiều cao của ngọn lửa bằng cách chia nhỏ các kênh lửa lớn thành nhiều kênh nhỏ. Đối với hỗn hợp khí-không khí có cùng thành phần, chiều cao của mặt trước ngọn lửa hình nón của các kênh nhỏ h có thể được xác định gần đúng từ chiều cao của mặt trước ngọn lửa của một kênh đơn H:
h = H/ √n(8.28)
trong đó n là số lượng kênh nhỏ.
Đối với các đầu đốt có công suất nhiệt cao (đầu đốt của nồi hơi công nghiệp, lò nung, v.v.), quá trình đốt cháy thường xảy ra trong dòng chảy hỗn loạn - mặt trước ngọn lửa hình nón nhẵn bị mờ và mất hình dạng hình nón rõ ràng do chuyển động xoáy và xung. Trong trường hợp này, hai kiểu đốt cháy đặc trưng được quan sát, tương ứng với nhiễu loạn quy mô nhỏ và quy mô lớn.
Ở quy mô nhiễu loạn không vượt quá độ dày của vùng cháy tầng, mặt trước ngọn lửa hình nón vẫn giữ nguyên hình dạng và vẫn nhẵn, mặc dù vùng cháy tăng lên. Nếu quy mô nhiễu loạn vượt quá độ dày của vùng cháy bình thường, bề mặt của mặt trước ngọn lửa hình nón trở nên không bằng phẳng. Điều này dẫn đến sự gia tăng tổng bề mặt của mặt trước đốt cháy và đốt cháy một lượng lớn hỗn hợp dễ cháy trên một đơn vị tiết diện dòng chảy.
Trong trường hợp nhiễu loạn quy mô lớn, lớn hơn nhiều so với độ dày của vùng đốt cháy tầng, sự xáo trộn bề mặt của mặt trước ngọn lửa dẫn đến sự phân tách các hạt riêng lẻ của hỗn hợp nóng, chúng bị nghiền nát bởi các xung tiếp theo. Mặt trước ngọn lửa mất tính toàn vẹn và biến thành một hệ thống các trung tâm đốt cháy riêng biệt dưới dạng các hạt bằng nhau của hỗn hợp dễ cháy phân tách và đốt cháy trong dòng chảy.

Cơm. 8.4. Thay đổi tốc độ tương đối
lan truyền ngọn lửa khí lò than cốc
trộn với không khí tùy thuộc vào số lượng
Reynolds và phương thức chuyển động của hỗn hợp
Với sự nhiễu loạn quy mô lớn, bề mặt của mặt trước ngọn lửa, bao gồm các bề mặt của tất cả các hạt cháy, tăng lên, dẫn đến tốc độ lan truyền ngọn lửa tăng mạnh (Hình 8.4). Trong trường hợp này, không chỉ có thể xảy ra quá trình đốt cháy trực diện lan truyền với vận tốc bình thường v n , mà còn có thể xảy ra quá trình cháy thể tích do chuyển động hỗn loạn của các sản phẩm cháy nóng vào hỗn hợp mới. Do đó, tổng vận tốc lan truyền ngọn lửa trong quá trình nhiễu loạn quy mô lớn được xác định bởi một hoặc một sự kết hợp khác của các yếu tố đốt cháy trực diện và thể tích.
Trong trường hợp không có xung, tốc độ cháy hỗn loạn trở nên bằng với tốc độ lan truyền ngọn lửa bình thường. Ngược lại, nếu vận tốc xung cao hơn nhiều so với vận tốc bình thường, vận tốc cháy hỗn loạn trở nên ít phụ thuộc vào tính chất hóa lý của hỗn hợp dễ cháy. Các thực nghiệm đã chỉ ra sự phụ thuộc nhỏ của tốc độ cháy của các hỗn hợp khí-không khí đồng nhất khác nhau với α>1 trong các lò công nghiệp vào tốc độ lan truyền ngọn lửa thông thường.
8.8. ỔN ĐỊNH CHÁY
Cơm. 8.5. Chương trình bồi thường trực tiếp
u n \u003d w đổ mồ hôi khi di chuyển tầng
hỗn hợp khí-không khí
1 – tường đầu đốt;
2 - ngọn lửa phía trước
Các yếu tố chính ảnh hưởng đến sự ổn định của quá trình cháy là tốc độ thoát ra của hỗn hợp khí-không khí và sự lan rộng của ngọn lửa. Trong quá trình đốt cháy hỗn hợp khí-không khí trong dòng chảy tầng, phần ổn định của mặt trước ngọn lửa hình nón là phần dưới của nó. Tại thời điểm này, mặt trước ngọn lửa, do sự giãn nở của hỗn hợp khí-không khí chảy vào khí quyển và tác dụng làm chậm của thành kênh, được quay theo chiều ngang và nâng lên trên mép kênh bằng độ dày của mặt trước ngọn lửa (Hình. 8.5).
Trong phần này của mặt trước, tốc độ của dòng khí-không khí được bù hoàn toàn bằng tốc độ lan truyền ngọn lửa u n = w mồ hôi . Trên phần còn lại của phần hình nón của mặt trước ngọn lửa, việc bù là một phần và chỉ được thực hiện theo hướng vuông góc với mặt trước cháy: u n = w mồ hôi cosφ . Thành phần w Sweat sinφ không cân bằng và mang điểm đánh lửa từ đáy hình nón lên đỉnh của nó. Sự ổn định của mặt trước ngọn lửa hình nón được giải thích là do vành đai hình khuyên ở đáy đóng vai trò là nguồn đánh lửa, nếu không có phần còn lại của mặt trước sẽ bị dòng hỗn hợp khí-không khí mang đi.
Nếu tốc độ dòng hỗn hợp vượt quá tốc độ lan truyền ngọn lửa, chiều rộng của đai đánh lửa sẽ giảm cho đến khi nó trở nên không đáng kể. Trong trường hợp này, sự ổn định của mặt trước ngọn lửa bị phá vỡ và xảy ra hiện tượng tách khỏi đầu đốt. Nếu tốc độ lan truyền ngọn lửa ở khu vực hình khuyên gần tường (không phải trên tường) vượt quá tốc độ thoát ra của hỗn hợp khí-không khí, ngọn lửa sẽ được hút vào bộ trộn đầu đốt (vượt quá).
Khi tách ra, có:
- sự thất bại của ngọn lửa từ đầu đốt và sự tuyệt chủng của nó;
- tách khỏi mép của kênh lửa, khi ngọn lửa đạt đến một vị trí mới, khá ổn định trong dòng chảy phía trên đầu đốt;
- sự cố của ngọn lửa lớn lên và sự tắt lịm của nó;
- phóng ngọn đuốc đã nâng lên đến mép kênh lửa của đầu đốt;
- tạo ra ngọn lửa lơ lửng khi tia lửa được đốt cháy ở một khoảng cách nào đó từ đầu đốt.
Tất cả những hiện tượng này là không thể chấp nhận được, vì chúng dẫn đến sự tích tụ khí chưa cháy hết trong bầu không khí xung quanh hoặc trong lò.
Cơm. 8.6. Sự phụ thuộc của tốc độ tách đơn chất
ngọn lửa trong một bầu không khí cởi mở hỗn hợp của tự nhiên
khí với không khí trên kích thước của kênh lửa và
nội dung không khí chính.
Cơm. 8.7. Sự phụ thuộc vận tốc ly khai
ngọn lửa đa ngọn lửa trong bầu không khí mở
hỗn hợp khí thiên nhiên với không khí có kích thước
kênh lửa và nội dung không khí chính.
a - sơ đồ đầu đốt; b – đường cong tách ngọn lửa
Trên hình. 8.6 cho thấy các đường cong thực nghiệm về sự tách ngọn lửa từ các cạnh của kênh lửa của vòi đốt một mỏ hàn hoạt động trên hỗn hợp khí lạnh với không khí. Tại ranh giới và phía trên các đường cong này, quá trình tách ngọn lửa bắt đầu và bên dưới các đường cong, quá trình đốt cháy ổn định bắt đầu.
Trong thực tế, phổ biến là các vòi phun phun nhiều mỏ hàn với các kênh lửa có đường kính từ 2–6 mm (Hình 8.7). Việc thiết lập tốc độ tách ngọn lửa w ref cho các đầu đốt như vậy có thể được thực hiện theo công thức sau:
w âm = 3,5 10 -3 d k T 2 (1 + V t) / (1 + α 1 V t) (8.29)
trong đó d k là đường kính của các kênh bắn, m; α 1 - hệ số không khí thừa sơ cấp; T là nhiệt độ tuyệt đối của hỗn hợp khí-không khí, K.
Từ công thức có thể thấy rằng độ ổn định của quá trình đốt cháy tăng lên khi đường kính của các kênh lửa và nhiệt độ tăng lên, và giảm xuống khi hệ số dư không khí sơ cấp tăng lên. Tính ổn định của quá trình cháy cũng được tăng lên do sự ảnh hưởng lẫn nhau của ngọn lửa.
Việc tách ngọn lửa khỏi các kênh lửa cũng có thể xảy ra do các lý do khác. Nếu đầu đốt và khí thải không được định vị chính xác, chúng có thể lọt vào vòi phun của đầu đốt và dẫn đến hiện tượng tách ngọn lửa (do giảm tốc độ lan truyền ngọn lửa trong hỗn hợp khí-không khí pha loãng với khí trơ). Ngoài ra, nguyên nhân của sự phân tách có thể là tốc độ cao của không khí thứ cấp thổi ngọn lửa từ các kênh lửa.
Bảng 8.15. Tỷ lệ của một hỗn hợp đồng nhất của tự nhiên
khí với không khí, tại đó xảy ra đột phá
ngọn lửa, m/s (nhiệt độ hỗn hợp 20°С)
| đường kính sa thải kênh truyền hình |
Tỷ lệ không khí sơ cấp | |||||
|---|---|---|---|---|---|---|
| 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | |
| 3,5 | 0,05 | 0,10 | 0,18 | 0,22 | 0,23 | 0,21 |
| 4,0 | 0,08 | 0,12 | 0,22 | 0,25 | 0,26 | 0,20 |
| 5,0 | 0,09 | 0,16 | 0,27 | 0,31 | 0,31 | 2,23 |
| 6,0 | 0,11 | 0,18 | 0,32 | 0,38 | 0,39 | 0,26 |
| 7,0 | 0,13 | 0,22 | 0,38 | 0,44 | 0,45 | 0,30 |
| 8,0 | 0,15 | 0,25 | 0,43 | 0,50 | 0,52 | 0,35 |
| 9,0 | 0,17 | 0,28 | 0,48 | 0,57 | 0,58 | 0,39 |
| 10,0 | 0,20 | 0,30 | 0,54 | 0,64 | 0,65 | 0,43 |
Cũng không thể chấp nhận được ngọn lửa lóe lên bên trong bộ trộn đầu đốt, thường kèm theo tiếng bốp. Sự trượt dẫn đến dập tắt ngọn lửa và đẩy hỗn hợp chưa cháy vào phòng hoặc lò đốt, hoặc đốt cháy hỗn hợp bên trong đầu đốt. Xu hướng ngọn lửa bùng lên phụ thuộc vào loại khí, tốc độ lan truyền ngọn lửa bình thường, hàm lượng không khí sơ cấp trong hỗn hợp khí-không khí, kích thước của các kênh lửa, nhiệt độ của hỗn hợp hoặc thành của các kênh. Sự đột phá của ngọn lửa cũng bị ảnh hưởng bởi tính dẫn nhiệt của vật liệu mà từ đó các kênh lửa được tạo ra, hình dạng, độ sâu và tay nghề của chúng, sự hiện diện của các gờ, các cạnh bị hỏng, v.v.
Đưa ra trong bảng. 8.15 giá trị vận tốc của hỗn hợp đồng nhất của khí tự nhiên với không khí, tại đó xảy ra sự đột phá, cũng có thể được sử dụng cho các khí khác, có thể hiệu chỉnh:
w" inc \u003d w inc u" n / u n (8.30)
trong đó w‘ pr là tốc độ phóng điện bề mặt của ngọn lửa đối với khí khác, m / s; w pr - tốc độ trượt đối với khí thiên nhiên (theo bảng 8.15), m/s; u‘n - tốc độ lan truyền ngọn lửa bình thường đối với khí khác, m/s; u n - tốc độ lan truyền ngọn lửa tính bằng mêtan, m/s.
Tốc độ trượt tối đa có thể được tính bằng công thức gần đúng:
w pr \u003d 0,73 10 -3 d k T 2 (8,31)
Công thức tương tự, với giá trị gần đúng đủ để thực hành, cũng có thể được sử dụng cho các loại khí khác với việc đưa ra hiệu chỉnh đối với sự thay đổi tốc độ lan truyền ngọn lửa bình thường. Trên cơ sở nhiều thí nghiệm, có thể rút ra kết luận sau: giới hạn hoạt động ổn định của đầu đốt bị giới hạn bởi tốc độ phân tách và hồi tưởng của ngọn lửa.
Cơm. 8.8. Sự phụ thuộc của tốc độ của hỗn hợp khí-không khí, tại đó xảy ra sự phân tách và hồi lửa của ngọn lửa, vào hệ số dư thừa của không khí sơ cấp
I - tách ngọn lửa; II - đột phá ngọn lửa; III - các cạnh màu vàng của ngọn lửa;
1–3 đường kính kênh lửa của đầu đốt, mm: 1 – 25, 2 – 25, 3 – 32
Trên hình. Hình 8.8 thể hiện các đường cong đặc trưng cho tốc độ dòng chảy của hỗn hợp khí tự nhiên với không khí, tại đó xảy ra sự phân tách và bùng cháy trở lại của ngọn lửa. Bản chất của các đường cong cho thấy độ ổn định của ngọn lửa giảm mạnh khi hàm lượng không khí sơ cấp trong hỗn hợp tăng lên. Sự gia tăng độ ổn định của ngọn lửa xảy ra khi hàm lượng không khí sơ cấp giảm và đạt cực đại khi nó giảm về 0 (đốt cháy khuếch tán). Tuy nhiên, việc đốt cháy khí hydrocarbon như vậy trong nhiều trường hợp là không thể chấp nhận được, vì nó dẫn đến sự xuất hiện của ngọn lửa màu vàng, đặc trưng cho sự xuất hiện của các hạt bồ hóng trong đó.
Cơm. 8,9. Chất chống cháy phổ biến
a - hầm hình trụ có tiết diện mở rộng đột ngột;
b - giống nhau, có dòng xoáy;
c – đường hầm hình nón có dòng chảy xoáy;
d - bộ ổn định ở dạng thân hình nón;
e - giống nhau, ở dạng thanh tròn;
e - giống nhau, ở dạng ngọn lửa hình khuyên ổn định
1 - vòi đốt; 2 - đường hầm; 3 - lỗ bên;
4 – kênh hình khuyên; 5 - vòng lửa;
6 - ngọn lửa của dòng chính của hỗn hợp khí-không khí
Trong thực tế, để mở rộng phạm vi ổn định cháy của bất kỳ hỗn hợp khí-không khí dễ cháy nào, tốc độ dòng chảy được giả định là lớn hơn nhiều lần so với tốc độ tách. Ngăn chặn sự phân tách ngọn lửa đạt được bằng cách sử dụng bộ ổn định ngọn lửa (Hình 8.9).
Để ổn định ngọn lửa phun và các đầu đốt khác tạo ra các tia khí-khí đối xứng trục, người ta sử dụng các đường hầm hình trụ chịu lửa có tiết diện mở rộng đột ngột. Hoạt động của một đường hầm như vậy dựa trên sự lưu thông ngoại vi của một phần các sản phẩm đốt cháy nóng, xảy ra do phản lực do tia cực tím tạo ra.
Để ổn định ngọn lửa của vòi đốt tạo ra hỗn hợp khí-không khí xoáy, cả hai đường hầm hình trụ và hình nón có góc mở 30–60° đều được sử dụng. Với dòng chảy xoáy, áp suất phát sinh ở ngoại vi của đường hầm lớn hơn ở phần trung tâm của nó. Điều này dẫn đến sự tuần hoàn đồng trục của một số sản phẩm cháy nóng và đánh lửa hỗn hợp khí-không khí lạnh chảy vào đường hầm từ bên trong.
Khi không thể lắp đặt các đường hầm, các vật thể có hình dạng sắp xếp hợp lý kém được sử dụng để ổn định ngọn lửa, được đặt trong dòng hỗn hợp khí-không khí ở lối ra của nó từ kênh lửa của đầu đốt. Trong trường hợp này, sự đánh lửa của hỗn hợp xảy ra ở ngoại vi của chất ổn định, đằng sau đó có sự tuần hoàn một phần khí nóng đốt cháy hỗn hợp dễ cháy từ bên trong. Hiệu quả ổn định của các thiết bị như vậy thấp hơn so với đường hầm.
Trong các vòi đốt một mỏ hàn và nhiều mỏ hàn, chất ổn định quá trình đốt cháy được sử dụng rộng rãi dưới dạng vòi phun ngọn lửa đặc biệt. Hiệu quả ổn định của thiết bị này dựa trên việc ngăn chặn sự pha loãng của dòng chính ở gốc ngọn lửa với không khí dư thừa, làm thu hẹp giới hạn về độ ổn định của nó, cũng như làm nóng và đốt cháy dòng chính bằng ngọn lửa hình khuyên dọc theo toàn bộ ngoại vi của nó . Sự ổn định của ngọn lửa hình khuyên trong quá trình phân tách đạt được nhờ tỷ lệ giữa các phần của vòng lửa và các lỗ bên, trong đó tốc độ của hỗn hợp khí-không khí trong khoang hình khuyên không vượt quá tốc độ lan truyền ngọn lửa bình thường. Để ngăn ngọn lửa lóe lên trong bộ trộn đầu đốt, kích thước của các lỗ bên tạo thành ngọn lửa hình khuyên được lấy nhỏ hơn kích thước tới hạn.
8,9. SƠ ĐỒ BẢO VỆ LỬA
Không khí hoặc oxy đi vào đường ống dẫn khí có thể tạo thành hỗn hợp nổ, vì vậy bắt buộc phải bảo vệ đường ống khỏi sự xâm nhập của không khí hoặc oxy vào trong đó. Trong tất cả các ngành công nghiệp nổ, các điều kiện phải được tạo ra để loại trừ khả năng bắt lửa. Các nguồn đánh lửa gây nổ hỗn hợp khí-không khí là:
- ngọn lửa mở;
- phóng điện của thiết bị điện đang vận hành;
- ngắn mạch trong dây điện;
- tia lửa điện trong đồ dùng điện;
- nổ cầu chì;
- xả tĩnh điện.
An toàn cháy nổ được cung cấp bởi các thiết bị chống cháy khác nhau. được lắp đặt trong đường ống, trên bể chứa, trên đường dẫn khí thanh lọc, nến và các hệ thống khác có nguy cơ nổ.
Sự dập tắt ngọn lửa trong kênh chứa đầy hỗn hợp dễ cháy chỉ xảy ra ở đường kính kênh tối thiểu, điều này phụ thuộc vào thành phần hóa học và áp suất của hỗn hợp, và được giải thích là do sự mất nhiệt từ vùng phản ứng sang thành kênh. Với việc giảm đường kính kênh, bề mặt của nó tăng trên một đơn vị khối lượng của hỗn hợp phản ứng, tức là tổn thất nhiệt tăng. Khi chúng đạt đến một giá trị tới hạn, tốc độ của phản ứng đốt cháy giảm đi rất nhiều khiến ngọn lửa không thể lan truyền thêm nữa.
Khả năng dập lửa của thiết bị chống cháy chủ yếu phụ thuộc vào đường kính của các kênh dập lửa và ít hơn nhiều vào chiều dài của chúng, và khả năng ngọn lửa xâm nhập qua các kênh dập lửa phụ thuộc chủ yếu vào tính chất và thành phần của hỗn hợp dễ cháy và áp suất. Tốc độ lan truyền ngọn lửa bình thường là đại lượng chính quyết định kích thước của các kênh dập tắt và việc lựa chọn loại thiết bị chống cháy: tốc độ càng lớn thì càng cần có kênh để dập tắt ngọn lửa. Ngoài ra, kích thước của các kênh chữa cháy phụ thuộc vào áp suất ban đầu của hỗn hợp dễ cháy. Để đánh giá khả năng chống cháy của thiết bị chống cháy, cái gọi là. Tiêu chí Peclet Re:
Pe \u003d w cm dc p p / (RT 0 λ 0) (8.32)
Trong giới hạn dập tắt ngọn lửa, công thức tiêu chí Peclet có dạng:
Re cr = w cm d cr c p p cr /(RT 0 λ 0) (8.33)
trong đó w cm là tốc độ lan truyền ngọn lửa bình thường; d là đường kính của kênh giảm chấn; d kp - đường kính tới hạn của kênh dập tắt; c p là nhiệt dung riêng của khí ở 0°C và áp suất không đổi; p - áp suất khí; p cr - áp suất khí tới hạn; R là hằng số khí phổ quát; T 0 - nhiệt độ tuyệt đối của khí; λ 0 - hệ số dẫn nhiệt của hỗn hợp ban đầu.
Do đó, để tính toán khả năng bắt lửa của thiết bị chống cháy, cần có các dữ liệu ban đầu sau:
- vận tốc lan truyền ngọn lửa bình thường của hỗn hợp khí dễ cháy;
- kích thước thực tế của các kênh dập lửa tối đa của một thiết bị chống cháy nhất định.
Nếu giá trị thu được lớn hơn Re cr = 65, thiết bị chống cháy sẽ không làm chậm quá trình lan truyền ngọn lửa của hỗn hợp dễ cháy này và ngược lại, nếu Re< 65, огнепреградитель задержит распространение пламени. Запас надежности огнепреградителя, который находят из отношения Ре кр к вычисленному значению Ре, должен составлять не менее 2:
P \u003d Re cr / Re \u003d 65 / Re\u003e 2.0 (8.34)
Sử dụng thực tế là Pe cr không đổi ở giới hạn dập tắt ngọn lửa, có thể tính toán đường kính tới hạn gần đúng của các kênh đối với bất kỳ hỗn hợp dễ cháy nào, nếu biết tốc độ lan truyền ngọn lửa, cũng như công suất nhiệt và độ dẫn nhiệt của hệ thống khí đốt. Các đường kính tới hạn sau đây của kênh tôi được khuyến nghị, mm:
- khi đốt cháy hỗn hợp khí-không khí - 2,9 đối với metan và 2,2 đối với propan và etan;
- khi đốt cháy hỗn hợp oxy trong đường ống (ở áp suất tuyệt đối 0,1 MPa trong điều kiện sản phẩm cháy nở ra tự do) - 1,66 đối với metan và 0,39 đối với propan và etan.
Cơm. 8.10. Các loại thiết bị chống cháy:
một - đóng gói; b - casset; c - phiến; g - lưới; e - gốm kim loại
Về mặt cấu trúc, thiết bị chống cháy được chia thành bốn loại (Hình 8.10):
- với một vòi làm bằng vật liệu dạng hạt;
- với các kênh trực tiếp;
- từ gốm kim loại hoặc sợi kim loại;
- lưới thép.
Theo phương pháp cài đặt - thành ba loại: trên đường ống để đẩy khí vào khí quyển hoặc trên ngọn đuốc; về thông tin liên lạc; trước bếp gas.
Trong thân của thiết bị chống cháy được gắn, giữa các tấm lưới có một vòi chứa chất độn (bóng thủy tinh hoặc sứ, sỏi, corundum và các hạt khác làm bằng vật liệu bền). Bộ chống cháy băng cassette là một vỏ trong đó băng bắt lửa được gắn từ các băng kim loại phẳng và gấp nếp được quấn chặt thành một cuộn. Trong trường hợp thiết bị chống cháy dạng tấm - một gói các tấm kim loại song song phẳng với khoảng cách được xác định nghiêm ngặt giữa chúng. Tại lưới chống cháy trong thân có một gói lưới kim loại được nén chặt. Thiết bị chống cháy bằng gốm-kim loại là một vỏ bọc bên trong có lắp đặt một tấm gốm-kim loại xốp ở dạng đĩa phẳng hoặc ống.
Thiết bị chống cháy dạng lưới thường được sử dụng nhiều nhất (chúng bắt đầu được lắp đặt vào đầu thế kỷ 19 trong đèn của thợ mỏ (đèn Devi) để ngăn chặn các vụ nổ súng hỏa mai). Những thiết bị chống cháy này được khuyên dùng để bảo vệ các thiết bị đốt nhiên liệu khí. Bộ phận chống cháy bao gồm nhiều lớp lưới đồng thau có kích thước mắt lưới 0,25 mm, được kẹp giữa hai tấm đục lỗ. Gói lưới được gia cố trong giá đỡ có thể tháo rời.
Thân của thiết bị chống cháy được làm bằng gang hoặc hợp kim nhôm và bao gồm hai phần giống hệt nhau được nối với nhau bằng bu lông với một kẹp có thể tháo rời nằm giữa chúng. Ngoài các thiết bị chống cháy khô được coi là, khóa an toàn chất lỏng được sử dụng rộng rãi để bảo vệ đường ống dẫn khí khỏi sự xâm nhập của sóng và ngọn lửa nổ trong quá trình xử lý kim loại bằng ngọn lửa khí, cũng như đường ống và thiết bị chứa đầy khí khỏi sự xâm nhập của oxy và không khí vào chúng.
Con dấu chất lỏng phải:
- để ngăn chặn sự lan truyền của sóng nổ trong các tác động ngược lại và trong quá trình đánh lửa khí;
- bảo vệ đường ống dẫn khí khỏi sự xâm nhập của oxy và không khí vào nó;
- đảm bảo lực cản thủy lực tối thiểu đối với dòng khí. Ngoài ra, chất lỏng từ màn trập không được mang đi dưới dạng giọt với số lượng đáng kể.
8.10. NGUYÊN TẮC CHÁY
Các quá trình đốt cháy khí dựa trên các nguyên tắc thường được gọi là động học và khuếch tán. Với nguyên lý động học, một hỗn hợp đồng nhất với một ít không khí dư thừa được tạo ra trước khi quá trình đốt cháy bắt đầu. Quá trình đốt cháy hỗn hợp như vậy xảy ra trong ngọn lửa trong suốt ngắn mà không tạo thành các hạt bồ hóng trong ngọn lửa. Để đốt cháy khí theo nguyên lý động học, người ta sử dụng máy trộn đặc biệt hoặc đầu đốt phun để chuẩn bị hỗn hợp khí-không khí đồng nhất với tỷ lệ không khí sơ cấp vượt quá α 1 = 1,02: 1,05.
Với hàm lượng không khí sơ cấp thấp hơn, theo nguyên tắc động học, chỉ có giai đoạn đốt cháy ban đầu được tiến hành cho đến khi sử dụng oxy, ở dạng hỗn hợp với khí. Các khí và sản phẩm còn lại của quá trình đốt cháy không hoàn toàn được đốt cháy bằng cách khuếch tán oxy bên ngoài (không khí thứ cấp), tức là. theo d và f u z và o n n o m theo nguyên tắc. Đối với α1< 1 у факела есть два видимых фронта горения: внутренний, возникающий за счет первичного воздуха, и наружный, образующийся за счет диффузии кислорода из окружающей среды. Общая высота пламени при таком горении возрастает, а температура - несколько снижается. Устойчивость пламени и его прозрачность зависят от содержания первичного воздуха в смеси: чем оно выше, тем ниже устойчивость пламени, больше его прозрачность, и наоборот.
Nguyên tắc đốt cháy khí với α 1< 1,0 является п р о м е ж у т о ч н ы м (между кинетическим и диффузионным). С учетом этого принципа конструируются все газовые аппараты с инжекционными горелками. В таких горелках содержание первичного воздуха в смеси принимается в зависимости от вида газа таким, чтобы:
- không có hạt bồ hóng trong ngọn lửa;
- sự ổn định của quá trình đốt cháy được đảm bảo với sự thay đổi của nhiệt điện trong mọi giới hạn cần thiết trong thực tế.
Theo nguyên lý khuếch tán (α 1 = 0), quá trình cháy và hòa trộn phát triển song song. Vì quá trình hòa trộn diễn ra chậm hơn nhiều so với quá trình đốt cháy nên tốc độ và mức độ hoàn thành của quá trình đốt cháy được xác định bởi tốc độ và mức độ hoàn thiện của quá trình trộn khí và không khí. Sự trộn lẫn khí với không khí trong trường hợp này có thể xảy ra do khuếch tán (hoặc phân tử chậm hoặc hỗn loạn, bao gồm cả phân tử là giai đoạn cuối cùng). Theo đó, tốc độ cháy và cấu trúc của ngọn lửa khuếch tán khác nhau.
Các tính năng của việc đốt cháy như vậy:
- sự ổn định của ngọn lửa khi công suất nhiệt thay đổi từ 0 đến mức tối đa có thể theo các điều kiện phân tách;
- nhiệt độ không đổi trên toàn bộ chiều cao của ngọn lửa;
- khả năng phân phối nó trên các bề mặt lớn tùy ý;
- sự nhỏ gọn của đầu đốt và dễ sản xuất;
- chiều cao ngọn lửa đáng kể và không thể tránh khỏi các quá trình nhiệt phân dẫn đến sự hình thành ngọn lửa bồ hóng sáng.
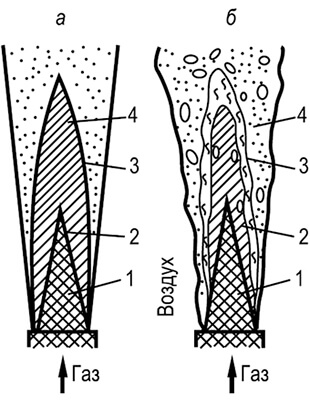
Cơm. 8.11. Cấu tạo ngọn lửa tự do:
a - ngọn lửa tầng; b - ngọn lửa hỗn loạn
Quá trình đốt cháy khuếch tán có thể được chuyển đổi thành quá trình đốt cháy động học hoặc trung gian nếu quá trình trộn diễn ra trước quá trình đốt cháy. Trong thực tế, điều này có thể đạt được bằng cách cung cấp không khí cưỡng bức, dẫn đến sự hình thành hỗn hợp khí-không khí gần như đồng nhất với α 1 > 1,0, cháy trong ngọn lửa trong suốt.
Để minh họa các nguyên tắc đốt cháy trong hình. 8.11. kế hoạch của ngọn lửa miễn phí được đưa ra: laminar và hỗn loạn. Một ngọn đuốc tầng phát sinh do sự khuếch tán phân tử lẫn nhau của khí và không khí. Bên trong lõi nón 1 là khí tinh khiết chảy ra khỏi ống theo dòng chảy tầng. Ở vùng 2 - hỗn hợp khí và sản phẩm cháy, ở vùng 3 - hỗn hợp sản phẩm cháy và không khí. Ranh giới 4 là mặt trước ngọn lửa hình nón nhẵn, nơi các phân tử không khí khuếch tán từ bên ngoài và các phân tử khí từ bên trong. Các sản phẩm đốt cháy khuếch tán một phần về phía khí, làm nóng mạnh nó trong vùng trước ngọn lửa. Điều này dẫn đến quá trình nhiệt phân hydrocacbon và hình thành các hạt bồ hóng, tạo cho ngọn lửa có độ sáng rực rỡ.
Quá trình đốt cháy có thể được tăng cường bởi sự hỗn loạn của các dòng trộn. Ngọn lửa hỗn loạn không có mặt trước đốt cháy hình nón rõ ràng, nó bị “mờ” và bị phá vỡ bởi các xung thành các hạt riêng biệt.
Cấu trúc ngọn lửa bao gồm lõi khí tinh khiết 1, vùng đốt cháy tương đối chậm 2, vùng khuếch tán của quá trình đốt cháy mạnh nhất 3 với hàm lượng sản phẩm cháy cao và vùng đốt cháy 4 với không khí chiếm ưu thế. Không có ranh giới được xác định rõ ràng giữa các khu vực, chúng liên tục thay đổi tùy thuộc vào mức độ nhiễu loạn của dòng chảy. Các đặc điểm của ngọn lửa hỗn loạn là:
- quá trình đốt cháy gần như trong toàn bộ khối lượng;
- tăng cường độ đốt cháy;
- độ trong suốt cao của ngọn lửa;
- khả năng chống phân tách thấp hơn của nó.
Quá trình đốt cháy khí hỗn loạn được sử dụng rộng rãi trong các lò của các nồi hơi và lò nung khác nhau. Ví dụ, để tăng cường quá trình đốt cháy, cả tự nhiên (do tốc độ tăng) và nhiễu loạn dòng chảy nhân tạo đều được sử dụng bằng cách xoáy luồng không khí và đưa các tia khí mỏng vào đó ở các góc khác nhau.
8.11. ĐIỀU KIỆN HÌNH THÀNH SẢN PHẨM CHÁY KHÔNG HOÀN TOÀN VÀ GIẢM Nồng độ các chất có hại trong chúng
Khi đốt cháy các khí dễ cháy, các sản phẩm cháy có thể chứa các thành phần của cả quá trình đốt cháy hoàn toàn (cacbon điôxit và hơi nước) và quá trình đốt cháy không hoàn toàn (cacbon mônôxít, hydro, hydrocacbon không no, bão hòa, thơm và các hạt bồ hóng). Ngoài ra, các oxit nitơ luôn được tìm thấy trong các sản phẩm đốt cháy. Sự hiện diện của các sản phẩm đốt cháy không hoàn toàn ở nồng độ đáng kể là không thể chấp nhận được, vì nó dẫn đến ô nhiễm không khí với các chất độc hại và làm giảm hiệu quả của các thiết bị chạy bằng nhiên liệu khí.
Những lý do chính cho nội dung cao của họ:
- đốt khí không đủ không khí;
- trộn lẫn khí dễ cháy và không khí trước và trong quá trình đốt cháy;
- làm mát ngọn lửa quá mức trước khi hoàn thành các phản ứng đốt cháy.
Đối với metan, các phản ứng đốt cháy (tùy thuộc vào nồng độ oxy trong hỗn hợp phản ứng) có thể được mô tả bằng các phương trình sau:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O + 800,9 MJ / mol
ở tỷ lệ cân bằng hóa học hoặc với lượng chất oxy hóa dư thừa;
CH 4 + O 2 \u003d CO + H 2 + H 2 O + Q và CH 4 + 0,5O 2 \u003d CO + 2H 2 O + Q
trong trường hợp không có chất oxi hóa.

Cơm. 8.12. Sản phẩm trung gian của quá trình đốt cháy
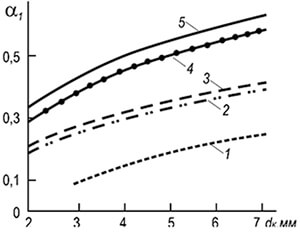
Cơm. 8.13. nội dung không khí chính,
ngăn cản sự hình thành
lưỡi vàng trong ngọn lửa
Khí đốt: 1 - than cốc;
2 - mỏ khí tự nhiên;
3 - mỏ dầu;
4 - propan; 5 - butan
Trên hình. 8.12 cho thấy thành phần trung bình gần đúng của một số hợp chất trung gian - hydro, carbon monoxide, ethylene, axetylen và một số lượng tương đối nhỏ các hợp chất thơm đơn giản và bão hòa - và carbon dioxide xảy ra trong ngọn lửa trong quá trình đốt cháy khí tự nhiên khuếch tán (97%). Khí được đốt trong đèn khò, khí chảy ra từ một ống có đường kính 12 mm. Tổng chiều cao ngọn lửa 130–140 mm.
Nồng độ tối đa của hydro và axetylen đạt được xấp xỉ ở cùng độ cao của ngọn lửa, chúng biến mất gần như đồng thời ở đỉnh vùng phát sáng của ngọn lửa. Trong số tất cả các hợp chất trung gian hình thành trong ngọn lửa (không bao gồm các hạt bồ hóng), carbon monoxide là chất cuối cùng biến mất. Điều này tạo cơ sở để đánh giá tính hoàn chỉnh của quá trình đốt cháy khí bằng chỉ số của nó. Các oxit nitơ luôn có mặt trong các sản phẩm đốt cháy, nồng độ tối đa của chúng xảy ra ở các vùng có nồng độ carbon monoxide và hydro cao.
Quá trình đốt cháy khí hydrocacbon thiếu chất oxy hóa dẫn đến sự hình thành các hạt bồ hóng, tạo cho ngọn lửa có màu vàng. Quá trình đốt cháy bồ hóng diễn ra theo từng giai đoạn và tương đối chậm. Đôi khi quá trình cháy của các hạt bồ hóng hình thành bị trì hoãn và có thể dừng lại hoàn toàn khi đi vào vùng nhiệt độ thấp của ngọn đuốc hoặc khi các bề mặt trao đổi nhiệt được ngọn lửa rửa sạch. Do đó, sự hiện diện của ngọn lửa phát sáng luôn cho thấy sự xuất hiện của các quá trình nhiệt phân và khả năng đốt cháy không hoàn toàn về mặt hóa học, đặc biệt là trong các lò hơi có kích thước nhỏ được che chắn.
Ngăn ngừa sự hình thành các hạt bồ hóng bằng cách trộn trước khí hydrocacbon với một lượng chất oxy hóa vừa đủ. Hàm lượng không khí sơ cấp trong hỗn hợp, tại đó xảy ra ngọn lửa trong suốt, không chỉ phụ thuộc vào loại hydrocacbon mà còn phụ thuộc vào điều kiện hòa trộn với không khí thứ cấp (đường kính kênh đốt của đầu đốt) (Hình 8.13 ). Ở đường viền và phía trên các đường cong, ngọn lửa trong suốt và bên dưới các đường cong có các lưỡi màu vàng. Các đường cong cho thấy hàm lượng không khí sơ cấp trong hỗn hợp tăng lên cùng với sự gia tăng số lượng nguyên tử carbon trong phân tử và đường kính của các kênh đốt cháy của vòi đốt. Tỷ lệ không khí sơ cấp dư thừa α 1 trong hỗn hợp, tại đó ngọn lửa màu vàng biến mất, tùy thuộc vào các yếu tố trên, có thể được xác định đối với các kênh lửa của đầu đốt nhỏ:
α 1 \u003d 0,12 (m + n / 4) 0,5 (d k / d 0) 0,25 (8,35)
trong đó m và n là số nguyên tử cacbon và hydro trong một phân tử hoặc số trung bình của chúng đối với một loại khí phức tạp; d k - đường kính của các kênh lửa của đầu đốt, mm; d 0 - đường kính tham chiếu của rãnh đốt (1 mm).
Đảm bảo quá trình đốt cháy hoàn toàn trong điều kiện thực tế là một nhiệm vụ khá phức tạp, không chỉ phụ thuộc vào nguyên tắc đốt cháy khí mà còn phụ thuộc vào các điều kiện phát triển ngọn lửa trong thể tích lò. Các yêu cầu cao nhất đối với quá trình đốt cháy hoàn toàn được áp dụng đối với các thiết bị gia dụng và các cơ sở lắp đặt khác thải các sản phẩm đốt vào khí quyển. Quá trình đốt cháy khí trong các cơ sở lắp đặt như vậy là khó khăn nhất, vì nó liên quan đến việc rửa các bề mặt trao đổi nhiệt lạnh bằng ngọn lửa. Để đốt khí trong bếp lò gia đình, người ta sử dụng đầu đốt nhiều mỏ hàn, tạo thành hỗn hợp đồng nhất với hệ số dư thừa của không khí sơ cấp α 1< 1. Недостающий для сгорания газа воздух поступает за счет диффузии из окружающей атмосферы.
Cơm. 8.14. Nồng độ carbon monoxide
trong các sản phẩm đốt cháy trong bếp gas
a - vòi đốt có nguồn cung cấp không khí thứ cấp ở ngoại vi;
b - với nguồn cung cấp không khí thứ cấp trung tâm và ngoại vi
1 - khí đốt tự nhiên, đầu đốt có nguồn cung cấp ngoại vi
không khí thứ cấp, khoảng cách đến đáy đĩa 25 mm;
2–4 - khí đốt tự nhiên, đầu đốt có thiết bị ngoại vi và
cung cấp không khí thứ cấp trung tâm, khoảng cách
đến đáy đĩa, mm: 2 - 25, 3 - 18, 4 - 10;
5 - khí hóa lỏng, đầu đốt có trung tâm và ngoại vi
cấp khí thứ cấp, khoảng cách đến đáy đĩa 25 mm;
6 - khí hóa lỏng, đầu đốt có nguồn cung cấp ngoại vi
Trên hình. 8.14 thể hiện sơ đồ của đầu đốt 2 đầu đốt cho bếp gas gia dụng và nồng độ trung bình của carbon monoxide CO trong các sản phẩm đốt cháy của khí metan tự nhiên (95% thể tích) và propan (93% thể tích%) khi đầu đốt đang hoạt động với nhiệt định mức đầu ra. Sự khác biệt giữa các đầu đốt là không khí thứ cấp được cung cấp cho một trong số chúng chỉ từ ngoại vi và cho đầu đốt kia - cả từ ngoại vi và từ kênh trung tâm.
Mức độ hoàn thành của quá trình đốt cháy khí phụ thuộc vào hệ số không khí sơ cấp dư thừa trong hỗn hợp, khoảng cách từ các kênh lửa của đầu đốt đến đáy đĩa, loại khí cháy và phương pháp cung cấp không khí thứ cấp. Đồng thời, sự gia tăng hàm lượng không khí sơ cấp trong hỗn hợp, cũng như sự gia tăng khoảng cách từ đầu đốt đến đáy đĩa, dẫn đến giảm nồng độ carbon monoxide trong các sản phẩm đốt cháy. Nồng độ carbon monoxide tối thiểu tương ứng với hệ số không khí sơ cấp dư thừa α 1 = 0,6 trở lên và khoảng cách từ đầu đốt đến đáy đĩa 25 mm, và tối đa - α 1 = 0,3 trở xuống và khoảng cách từ đầu đốt đến đáy đĩa 10 mm. Ngoài ra, việc tăng công suất nhiệt của đầu đốt lên 15–20% do tăng áp suất khí dẫn đến tăng nồng độ carbon monoxide trong các sản phẩm đốt lên 1,2–1,3 lần và do nhiệt của quá trình đốt cháy khí, gấp 1,5–2 lần.
Sự xuất hiện của các hợp chất thơm trong quá trình đốt cháy - benzen, benzpyrene đa vòng, benzanthracene, v.v. - cần được đặc biệt chú ý, vì một số trong số chúng là chất gây ung thư. Quá trình hình thành của chúng rất phức tạp và diễn ra theo từng giai đoạn. Ở giai đoạn đầu xuất hiện axetilen và các dẫn xuất của nó. Trong vùng ngọn lửa, các chất này trải qua quá trình kéo dài chuỗi với sự sắp xếp lại các liên kết ba cacbon thành liên kết kép. Kết quả của quá trình tuần hoàn và khử nước dẫn đến sự xuất hiện của các hợp chất thơm khác nhau, bao gồm cả các hợp chất đa vòng.
Bảng 8.16. Nồng độ trung bình của carbon monoxide và benzo(a)pyrene trong sản phẩm đốt phụ thuộc vào loại khí đốt, loại vòi đốt và hệ số thừa không khí sơ cấp (tải nhiệt của vòi đốt - 1600 kcal/h, khoảng cách từ vòi đốt đến đáy đĩa - 24–26mm)
| loại đầu đốt | Nồng độ trung bình | |
|---|---|---|
| carbon monoxide, mg/l (về α = 1,0) |
benzo(a)pyren, mcg / 100 m 3 |
|
| Khí tự nhiên | ||
tại α i = 0,60 ÷ 0,70 |
0,10 | Không tìm thấy |
tại α i = 0,30 ÷ 0,35 |
1,20 | dấu chân |
tại α i = 0,60 ÷ 0,70 |
0,50 | Không tìm thấy |
tại α i = 0,30 ÷ 0,35 |
0,12 | Không tìm thấy |
| Khí dầu mỏ hóa lỏng | ||
| Đầu đốt với nguồn cung cấp không khí thứ cấp ngoại vi: | ||
tại α i = 0,60 ÷ 0,70 |
0,30 | 0,03 |
tại α i = 0,30 ÷ 0,35 |
1,20 | 1,10 |
| Đầu đốt với nguồn cung cấp không khí thứ cấp trung tâm và ngoại vi: | ||
tại α i = 0,60 ÷ 0,70 |
0,07 | 0,02 |
tại α i = 0,30 ÷ 0,35 |
1,00 | 0,045 |
Bảng dữ liệu. Hình 8.16 cho thấy khi đốt khí tự nhiên với hệ số vượt quá của không khí sơ cấp α 1 \u003d 0,6 trở lên trên cả hai loại đầu đốt, nồng độ carbon monoxide trong sản phẩm đốt đáp ứng yêu cầu của GOST 5542–87.
Bảng 8.17. Khoảng cách giữa các cạnh của các kênh đốt của vòi phun một hàng, tùy thuộc vào kích thước của chúng và hệ số không khí sơ cấp dư thừa
| Đường kính kênh lửa, mm | Khoảng cách giữa các cạnh của kênh, mm ở các giá trị khác nhau của hệ số không khí sơ cấp dư thừa α 1 | ||||
|---|---|---|---|---|---|
| 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | |
| 2,0 | 11 | 8 | 6 | 5 | 4 |
| 3,0 | 15 | 12 | 9 | 7 | 5 |
| 4,0 | 16 | 14 | 11 | 9 | 7 |
| 5,0 | 18 | 15 | 14 | 12 | 10 |
| 6,0 | 20 | 18 | 16 | 14 | 12 |
Các nghiên cứu đã chỉ ra rằng khoảng cách giữa các cạnh của các kênh lửa, đảm bảo ngọn lửa lan nhanh, ngăn chặn sự hợp nhất của chúng, phụ thuộc vào kích thước của chúng và hàm lượng không khí sơ cấp trong hỗn hợp, giảm dần khi tăng. Khoảng cách tối ưu giữa các cạnh của kênh, đảm bảo đốt cháy khí đầy đủ và lan truyền ngọn lửa nhanh, được đưa ra trong Bảng. 8.17. Khi các kênh bắn được sắp xếp thành hai hàng theo kiểu bàn cờ, khoảng cách giữa các cạnh có thể được lấy theo cùng một bảng. Trong trường hợp này, khoảng cách giữa các hàng phải lớn hơn 2-3 lần so với khoảng cách giữa các kênh.
Cơm. 8.15. Nồng độ carbon monoxide, axetylen,
etan, etylen và benzo(a)pyren trong các sản phẩm đốt cháy
khí áp suất trung bình trong vòi phun
Việc tổng quát hóa nhiều dữ liệu thực nghiệm giúp có thể thu được các đường cong nồng độ trung bình trong các sản phẩm đốt cháy của các thành phần khác nhau, đặc trưng về mặt định tính và định lượng của quá trình đốt cháy (Hình 8.15). Quá trình đốt cháy hoàn toàn hỗn hợp khí-không khí đồng nhất chỉ đạt được khi hệ số dư không khí sơ cấp α = 1,05 trở lên. Với sự giảm hàm lượng không khí trong hỗn hợp, đặc biệt là ở mức α< 1,0, возрастает концентрация оксида углерода СО, ацетилена С 2 Н 2 , этилена С 2 Н 4 , пропилена С 3 Н 6 и пропана С 3 Н 8 , а также бенз(а)-пирена С 20 Н 9 . Также возрастает концентрация и других компонентов - водорода, бензола и др.
Ngoài các sản phẩm được coi là quá trình đốt cháy không hoàn toàn, quá trình đốt cháy khí luôn tạo ra một lượng oxit nitơ nhất định, sự hình thành xảy ra ở vùng nhiệt độ cao cả sau khi hoàn thành các phản ứng đốt cháy chính và trong quá trình đốt cháy. Nồng độ NOx cực đại xảy ra ở giai đoạn cuối, tương ứng với quá trình đốt cháy khí và đốt cháy mạnh các sản phẩm trung gian dưới dạng hydro và carbon monoxide.
Hợp chất chính trong quá trình đốt cháy hỗn hợp khí-không khí là nitơ oxit. Sự khởi đầu của phản ứng dây chuyền có liên quan đến oxy nguyên tử phát sinh ở vùng nhiệt độ cao do sự phân ly của oxy phân tử:
O 2 -› 2O - 490 kJ/mol (8.36)
O + N 2 -› NO + N - 300 kJ/mol (8.37)
N + O 2 –› 2NO + 145 kJ/mol (8.38)
cân bằng phản ứng
N 2 + O 2 -› 2NO - 177 kJ/mol (8.39)
Sự hình thành oxy nguyên tử cũng xảy ra trong quá trình phân ly một phần các sản phẩm đốt cháy: với sự giảm nhiệt độ và sự có mặt của oxy, một phần oxit nitric được tạo thành (1–3 vol.%) bị oxy hóa thành nitơ điôxít NO 2 . Phản ứng diễn ra mạnh mẽ nhất sau khi giải phóng oxit nitric vào khí quyển. Các yếu tố ảnh hưởng chính:
- nhiệt độ trong vùng phản ứng;
- tỉ lệ không khí dư và thời gian tiếp xúc của các cấu tử tham gia phản ứng.
Nhiệt độ ngọn lửa phụ thuộc vào thành phần hóa học của khí, hàm lượng không khí trong hỗn hợp khí-không khí, mức độ đồng nhất của nó và loại bỏ nhiệt khỏi vùng phản ứng. Nồng độ tối đa có thể có của oxit nitric ở một nhiệt độ nhất định, vol. %, có thể được tính bằng công thức
KHÔNG p \u003d 4,6e -2150 / (RT) / √ O 2 N 2 (8,40)
trong đó NO p là nồng độ cân bằng của oxit nitric, vol. %; R là hằng số khí phổ quát; T - nhiệt độ tuyệt đối, K; O 2 và N 2 - nồng độ, vol. % lần lượt là oxi và nitơ.
Nồng độ nitơ oxit cao, tương ứng với nồng độ cân bằng, xảy ra khi khí được đốt trong lò của máy tạo hơi nước mạnh và trong lò sưởi mở, than cốc và các lò tương tự ở nhiệt độ cao. Trong các nồi hơi công suất vừa và nhỏ, trong các lò sưởi và lò nhiệt nhỏ với khả năng loại bỏ nhiệt đáng kể và thời gian lưu trú ngắn của các bộ phận ở vùng nhiệt độ cao, sản lượng oxit nitơ ít hơn. Ngoài ra, thời gian lưu trú của các cấu tử phản ứng trong vùng nhiệt độ cao càng ngắn thì sản phẩm cháy càng ít oxit nitơ.
Quá trình đốt cháy khí trong đầu đốt bức xạ và trong tầng sôi cũng có hiệu quả: trong những trường hợp này, quá trình đốt cháy vi ngọn lửa của hỗn hợp khí-không khí đồng nhất xảy ra với hệ số không khí dư thừa α = 1,05 với sự loại bỏ nhiệt rất mạnh khỏi vùng phản ứng. Nồng độ của nitơ oxit trong quá trình đốt cháy khí ở đầu đốt bức xạ là khoảng 40, và trong tầng sôi - 80–100 mg/m 3 . Việc giảm kích thước kênh lửa của đầu đốt bức xạ và hạt chịu lửa trong tầng sôi giúp giảm sản lượng oxit nitơ.
Dữ liệu tích lũy được cho phép thực hiện một số thay đổi trong thiết kế nồi hơi và thiết bị sưởi ấm, không chỉ mang lại hiệu quả cao và nồng độ thấp của các sản phẩm đốt cháy không hoàn toàn mà còn giảm lượng khí thải nitơ oxit vào khí quyển. Những thay đổi này bao gồm:
- giảm chiều dài của các đường hầm nhiệt độ cao và chuyển quá trình đốt cháy từ chúng sang lò nung;
- việc sử dụng các chất ổn định quá trình đốt cháy thay vì các đường hầm bằng gốm ở dạng thân vô tội vạ hoặc ngọn lửa hình khuyên;
- tổ chức ngọn lửa phẳng với bề mặt truyền nhiệt tăng lên;
- phân tán ngọn lửa bằng cách tăng số lượng đầu đốt hoặc sử dụng đầu đốt khối;
- cung cấp không khí từng bước cho khu vực phản ứng;
- phân phối đồng đều các dòng nhiệt trong lò, sàng lọc lò và phân chia chúng thành các ngăn bằng lưới chắn;
- áp dụng nguyên lý khuếch tán của quá trình đốt cháy khí (đốt cháy khuếch tán chỉ được phép trong trường hợp có thể đảm bảo ngọn lửa phát triển tự do mà không cần rửa các bề mặt trao đổi nhiệt).
Việc giảm sản lượng oxit nitơ hiệu quả nhất đạt được khi sử dụng đồng thời một số phương pháp.
Quá trình đốt cháy khí là sự kết hợp của các quá trình sau:
Trộn khí cháy với không khí
đun nóng hỗn hợp
phân hủy nhiệt của các thành phần dễ cháy,
Đánh lửa và kết hợp hóa học của các thành phần dễ cháy với oxy trong khí quyển, kèm theo sự hình thành ngọn đuốc và tỏa nhiệt mạnh.
Quá trình đốt cháy khí metan xảy ra theo phản ứng:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Điều kiện cần thiết để đốt cháy khí:
Đảm bảo tỷ lệ yêu cầu của khí cháy và không khí,
đốt nóng đến nhiệt độ bốc cháy.
Nếu hỗn hợp khí-không khí nhỏ hơn giới hạn bắt cháy dưới, thì nó sẽ không cháy.
Nếu có nhiều khí trong hỗn hợp khí-không khí hơn giới hạn cháy trên, thì nó sẽ không cháy hoàn toàn.
Thành phần của các sản phẩm đốt cháy hoàn toàn khí:
CO 2 - khí cacbonic
H 2 O - hơi nước
* N 2 - nitơ (nó không phản ứng với oxy trong quá trình đốt cháy)
Thành phần của các sản phẩm đốt cháy không hoàn toàn khí:
CO - khí cacbonic
C - bồ hóng.
Đốt cháy 1 m 3 khí tự nhiên cần 9,5 m 3 không khí. Trong thực tế, mức tiêu thụ không khí luôn cao hơn.
Thái độ tiêu dùng thực tế không khí về mặt lý thuyết lưu lượng yêu cầu gọi là hệ số không khí thừa: α = L/L t .,
Ở đâu: L- thực chi;
L t - lưu lượng yêu cầu theo lý thuyết.
Hệ số không khí thừa luôn lớn hơn một. Đối với khí thiên nhiên là 1,05 - 1,2.
2. Mục đích, thiết bị và đặc điểm chính của máy nước nóng tức thời.
Máy nước nóng khí chảy. Chúng được thiết kế để đun nóng nước đến một nhiệt độ nhất định trong quá trình xả... Máy nước nóng chảy được chia theo tải nhiệt điện: 33600, 75600, 105000 kJ, theo mức độ tự động hóa - thành loại cao nhất và loại nhất. hiệu quả máy nước nóng 80%, hàm lượng oxit không quá 0,05%, nhiệt độ của các sản phẩm đốt cháy phía sau bộ ngắt gió không thấp hơn 180 0 C. Nguyên tắc dựa trên việc đun nóng nước trong thời gian rút nước.
Các bộ phận chính của máy nước nóng tức thời là: đầu đốt gas, bộ trao đổi nhiệt, hệ thống tự động hóa và cửa thoát khí. Khí áp suất thấp được đưa vào vòi đốt. Các sản phẩm đốt cháy đi qua bộ trao đổi nhiệt và được thải vào ống khói. Nhiệt đốt cháy được truyền vào nước chảy qua bộ trao đổi nhiệt. Để làm mát buồng lửa, một cuộn dây được sử dụng, qua đó nước lưu thông, đi qua lò sưởi. Máy nước nóng tức thời bằng gas được trang bị các thiết bị xả khí và bộ ngắt gió, trong trường hợp gió lùa bị vi phạm trong thời gian ngắn, sẽ ngăn ngọn lửa của vòi đốt gas bị dập tắt. Có một ống khói để kết nối với ống khói.
Máy nước nóng tức thời dùng gas - VPG. Trên thành trước của vỏ có: núm điều khiển vòi gas, nút bật van điện từ và cửa sổ quan sát để quan sát ngọn lửa của vòi hoa tiêu và đầu đốt chính. Ở trên cùng của thiết bị có một thiết bị hút khói, ở phía dưới có các ống nhánh để kết nối thiết bị với hệ thống khí và nước. Khí đi vào van điện từ, van ngắt khí của khối đầu đốt nước và khí tuần tự bật đầu đốt thí điểm và cung cấp khí cho đầu đốt chính.
Việc chặn dòng khí vào đầu đốt chính, với hoạt động bắt buộc của bộ phận đánh lửa, được thực hiện bằng van điện từ hoạt động từ cặp nhiệt điện. Việc chặn nguồn cung cấp khí cho đầu đốt chính, tùy thuộc vào sự hiện diện của lượng nước, được thực hiện bằng một van được dẫn động qua thân từ màng của van chặn nước.
Khí tự nhiên là nhiên liệu được sử dụng rộng rãi nhất hiện nay. Khí tự nhiên được gọi là khí tự nhiên vì nó được khai thác từ chính ruột của Trái đất.
Quá trình đốt cháy khí là một phản ứng hóa học trong đó khí tự nhiên tương tác với oxy có trong không khí.
Trong nhiên liệu khí có phần cháy được và phần không cháy.
Thành phần cháy chủ yếu của khí thiên nhiên là metan - CH4. Nội dung của nó trong khí tự nhiên đạt 98%. Mêtan không mùi, không vị và không độc. Giới hạn dễ cháy của nó là từ 5 đến 15%. Chính những phẩm chất này đã giúp sử dụng khí tự nhiên như một trong những loại nhiên liệu chính. Nồng độ khí mêtan trên 10% nguy hiểm đến tính mạng, có thể xảy ra ngạt thở do thiếu ôxy.
Để phát hiện rò rỉ khí, khí được khử mùi, hay nói cách khác, một chất có mùi mạnh (ethyl mercaptan) được thêm vào. Trong trường hợp này, khí có thể được phát hiện ở nồng độ 1%.
Ngoài khí mê-tan, các loại khí dễ cháy như propan, butan và etan có thể có trong khí thiên nhiên.
Để đảm bảo quá trình đốt cháy khí chất lượng cao, cần phải đưa không khí vào vùng đốt với số lượng đủ và đạt được sự hòa trộn tốt của khí với không khí. Tỷ lệ 1: 10 được coi là tối ưu, tức là mười phần không khí rơi vào một phần khí. Ngoài ra, cần phải tạo chế độ nhiệt độ mong muốn. Để khí bắt cháy, nó phải được làm nóng đến nhiệt độ bắt lửa và trong tương lai, nhiệt độ không được giảm xuống dưới nhiệt độ bắt lửa.
Cần phải tổ chức loại bỏ các sản phẩm đốt cháy vào khí quyển.
Quá trình đốt cháy hoàn toàn đạt được nếu không có các chất dễ cháy trong các sản phẩm đốt cháy được thải vào khí quyển. Trong trường hợp này, carbon và hydro kết hợp với nhau và tạo thành carbon dioxide và hơi nước.
Nhìn bề ngoài, khi đốt cháy hoàn toàn, ngọn lửa có màu xanh nhạt hoặc tím xanh.
Đốt cháy hoàn toàn khí.
metan + oxy = carbon dioxide + nước
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Ngoài các khí này, nitơ và oxy còn lại đi vào khí quyển cùng với các khí dễ cháy. N2 + O2
Nếu quá trình đốt cháy khí không hoàn toàn, thì các chất dễ cháy sẽ được thải vào khí quyển - carbon monoxide, hydro, bồ hóng.
Quá trình đốt cháy khí không hoàn toàn xảy ra do không đủ không khí. Đồng thời, những chiếc lưỡi bồ hóng xuất hiện trực quan trong ngọn lửa.
Sự nguy hiểm của việc đốt cháy khí không hoàn toàn là carbon monoxide có thể gây ngộ độc cho nhân viên phòng nồi hơi. Hàm lượng CO trong không khí 0,01-0,02% có thể gây ngộ độc nhẹ. Nồng độ cao hơn có thể dẫn đến ngộ độc nặng và tử vong.
Kết quả là muội than lắng xuống thành nồi hơi, do đó làm xấu đi quá trình truyền nhiệt sang chất làm mát, làm giảm hiệu quả của nhà nồi hơi. Bồ hóng dẫn nhiệt kém hơn khí mê-tan 200 lần.
Về lý thuyết, cần 9m3 không khí để đốt cháy 1m3 khí. Trong điều kiện thực tế, cần nhiều không khí hơn.
Đó là, một lượng không khí dư thừa là cần thiết. Giá trị này, ký hiệu là alpha, cho biết lượng không khí được tiêu thụ nhiều hơn bao nhiêu lần so với mức cần thiết về mặt lý thuyết.
Hệ số alpha phụ thuộc vào loại đầu đốt cụ thể và thường được quy định trong hộ chiếu đầu đốt hoặc theo khuyến nghị của tổ chức vận hành.
Với sự gia tăng lượng không khí dư thừa trên mức khuyến nghị, tổn thất nhiệt tăng lên. Với sự gia tăng đáng kể lượng không khí, có thể xảy ra hiện tượng tách ngọn lửa, gây ra tình trạng khẩn cấp. Nếu lượng không khí ít hơn mức khuyến nghị, thì quá trình đốt cháy sẽ không hoàn toàn, do đó có nguy cơ gây ngộ độc cho nhân viên phòng lò hơi.
Để kiểm soát chính xác hơn chất lượng đốt cháy nhiên liệu, có các thiết bị - máy phân tích khí đo hàm lượng của một số chất trong thành phần của khí thải.
Máy phân tích khí có thể được cung cấp cùng với nồi hơi. Nếu chúng không có sẵn, thì các phép đo liên quan được thực hiện bởi tổ chức vận hành bằng cách sử dụng máy phân tích khí di động. Một bản đồ chế độ được biên soạn trong đó các thông số kiểm soát cần thiết được quy định. Bằng cách tuân thủ chúng, bạn có thể đảm bảo quá trình đốt cháy hoàn toàn nhiên liệu bình thường.
Các thông số chính để kiểm soát quá trình đốt cháy nhiên liệu là:
- tỷ lệ khí đốt và không khí cung cấp cho đầu đốt.
- tỷ lệ không khí thừa.
- vết nứt trong lò.
- Hệ số hiệu suất nồi hơi.
Đồng thời, hiệu suất của nồi hơi có nghĩa là tỷ lệ giữa nhiệt hữu ích với giá trị của tổng nhiệt tiêu hao.
Thành phần của không khí
| Tên khí | Nguyên tố hóa học | Nội dung trong không khí |
| nitơ | N2 | 78 % |
| Ôxy | O2 | 21 % |
| Argon | Ar | 1 % |
| Khí cacbonic | CO2 | 0.03 % |
| heli | Anh ta | ít hơn 0,001% |
| hydro | H2 | ít hơn 0,001% |
| đèn neon | Nê | ít hơn 0,001% |
| mêtan | CH4 | ít hơn 0,001% |
| Krypton | kr | ít hơn 0,001% |
| xenon | Xe | ít hơn 0,001% |
Quá trình đốt cháy nhiên liệu khí là sự kết hợp của các quá trình vật lý và hóa học sau: trộn khí dễ cháy với không khí, làm nóng hỗn hợp, phân hủy nhiệt các thành phần dễ cháy, đánh lửa và kết hợp hóa học của các nguyên tố dễ cháy với oxy trong khí quyển.
Có thể đốt cháy ổn định hỗn hợp khí-không khí với việc cung cấp liên tục một lượng khí và không khí dễ cháy cần thiết cho mặt trận đốt cháy, trộn kỹ và đốt nóng chúng đến nhiệt độ đánh lửa hoặc tự đánh lửa (Bảng 5).
Việc đốt cháy hỗn hợp khí-không khí có thể được thực hiện:
- đốt nóng toàn bộ thể tích của hỗn hợp khí-không khí đến nhiệt độ tự bốc cháy. Phương pháp này được sử dụng trong động cơ đốt trong, trong đó hỗn hợp khí-không khí được làm nóng bằng cách nén nhanh đến một áp suất nhất định;
- việc sử dụng các nguồn đánh lửa nước ngoài (đánh lửa, v.v.). Trong trường hợp này, không phải toàn bộ hỗn hợp khí-không khí được làm nóng đến nhiệt độ đánh lửa mà là một phần của nó. Phương pháp này được sử dụng khi đốt khí trong đầu đốt của các thiết bị dùng gas;
- ngọn đuốc hiện có liên tục trong quá trình đốt cháy.
Để bắt đầu phản ứng đốt cháy nhiên liệu khí, cần tiêu tốn một lượng năng lượng nhất định cần thiết để phá vỡ liên kết phân tử và tạo liên kết mới.
Công thức hóa học của quá trình đốt cháy nhiên liệu khí, chỉ ra toàn bộ cơ chế phản ứng liên quan đến sự xuất hiện và biến mất của một số lượng lớn nguyên tử tự do, gốc tự do và các hạt hoạt động khác, rất phức tạp. Do đó, để đơn giản hóa, người ta sử dụng các phương trình biểu thị trạng thái ban đầu và trạng thái cuối cùng của các phản ứng đốt cháy khí.
Nếu các khí hiđrocacbonat được ký hiệu là C m H n thì phương trình phản ứng hóa học đốt cháy các khí này trong oxi sẽ có dạng
C m H n + (m + n/4)O 2 = mCO 2 + (n/2)H 2 O,
trong đó m là số nguyên tử cacbon trong khí hiđrocacbon; n là số nguyên tử hydro trong khí; (m + n/4) - lượng oxy cần thiết để đốt cháy hoàn toàn khí.
Theo công thức, các phương trình đốt cháy khí được rút ra:
- metan CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
- etan C 2 H 6 + 3,5O 2 \u003d 2CO 2 + ZH 2 O
- butan C 4 H 10 + 6,5O 2 \u003d 4CO 2 + 5H 2 0
- propan C 3 H 8 + 5O 3 \u003d ZSO 2 + 4H 2 O.
Trong điều kiện thực tế của quá trình đốt cháy khí, oxy không được lấy ở dạng nguyên chất mà là một phần của không khí. Vì không khí bao gồm 79% nitơ và 21% oxy theo thể tích, nên cần 100:21 = 4,76 thể tích không khí hoặc 79:21 = 3,76 thể tích nitơ cho mỗi thể tích oxy. Sau đó, phản ứng đốt cháy metan trong không khí có thể được viết như sau:
CH 4 + 2O 2 + 2 * 3,76N 2 \u003d CO 2 + 2H 2 O + 7,52N 2.
Phương trình cho thấy rằng để đốt cháy 1 m 3 khí mê-tan, cần 1 m 3 oxy và 7,52 m 3 nitơ hoặc 2 + 7,52 = 9,52 m 3 không khí.
Kết quả của quá trình đốt cháy 1 m 3 metan, thu được 1 m 3 carbon dioxide, 2 m 3 hơi nước và 7,52 m 3 nitơ. Bảng dưới đây cho thấy những dữ liệu này đối với các loại khí dễ cháy phổ biến nhất.
Đối với quá trình đốt cháy hỗn hợp khí-không khí, lượng khí và không khí trong hỗn hợp khí-không khí cần phải nằm trong giới hạn nhất định. Các giới hạn này được gọi là giới hạn cháy hoặc giới hạn nổ. Có giới hạn dễ cháy dưới và trên. Hàm lượng khí tối thiểu trong hỗn hợp khí-không khí, được biểu thị bằng phần trăm thể tích, tại đó xảy ra quá trình bắt lửa, được gọi là giới hạn dễ cháy dưới. Hàm lượng khí tối đa trong hỗn hợp khí-không khí, trên đó hỗn hợp không bắt lửa mà không cung cấp thêm nhiệt, được gọi là giới hạn dễ cháy trên.
Lượng oxy và không khí trong quá trình đốt cháy một số loại khí
|
Để đốt cháy 1 m 3 khí cần m 3 |
Khi đốt cháy 1 m 3 khí thoát ra là m 3 |
Nhiệt đốt cháy He, kJ / m 3 |
|||||
|
ôxy |
dioxit carbon |
||||||
|
carbon monoxide |
|||||||
Nếu hỗn hợp khí-không khí chứa ít khí hơn giới hạn cháy dưới thì nó sẽ không cháy. Nếu không có đủ không khí trong hỗn hợp khí-không khí, thì quá trình đốt cháy không diễn ra hoàn toàn.
Tạp chất trơ trong khí có ảnh hưởng lớn đến độ lớn của giới hạn nổ. Sự gia tăng hàm lượng dằn (N 2 và CO 2) trong khí thu hẹp các giới hạn dễ cháy và khi hàm lượng dằn tăng vượt quá các giới hạn nhất định, hỗn hợp khí-không khí không bắt lửa ở bất kỳ tỷ lệ khí và không khí nào (bảng bên dưới) .
Số thể tích khí trơ trên 1 thể tích khí cháy mà tại đó hỗn hợp khí-không khí ngừng nổ
Lượng không khí nhỏ nhất cần thiết để đốt cháy hoàn toàn khí được gọi là lưu lượng không khí lý thuyết và được ký hiệu là Lt, nghĩa là nếu nhiệt trị thực của nhiên liệu khí là 33520 kJ / m 3 , thì lượng không khí cần thiết theo lý thuyết để đốt cháy 1 m 3 khí
L T\u003d (33 520/4190) / 1,1 \u003d 8,8 m 3.
Tuy nhiên, lưu lượng khí thực tế luôn vượt quá lưu lượng lý thuyết. Điều này được giải thích là do rất khó đạt được sự đốt cháy hoàn toàn khí ở tốc độ dòng khí lý thuyết. Do đó, bất kỳ nhà máy đốt khí nào cũng hoạt động với một lượng không khí dư thừa.
Vì vậy, luồng không khí thực tế
L n = αL T,
ở đâu l n- tiêu thụ không khí thực tế; α - hệ số không khí thừa; L T- tiêu thụ không khí lý thuyết.
Hệ số không khí thừa luôn lớn hơn một. Đối với khí thiên nhiên là α = 1,05 - 1,2. hệ số α cho biết lưu lượng không khí thực tế vượt quá lưu lượng lý thuyết bao nhiêu lần, được lấy làm đơn vị. Nếu α = 1 thì hỗn hợp khí-không khí được gọi là cân bằng hóa học.
Tại α = 1,2 người ta tiến hành đốt cháy khí có dư không khí bằng 20%. Theo quy định, quá trình đốt cháy khí phải diễn ra với giá trị tối thiểu là a, vì khi giảm lượng không khí dư thừa, tổn thất nhiệt do khí thải giảm. Không khí tham gia vào quá trình cháy là sơ cấp và thứ cấp. Sơ cấpđược gọi là không khí đi vào đầu đốt để trộn với khí trong đó; thứ hai- không khí đi vào vùng cháy không trộn lẫn với khí mà riêng biệt.






