Tenttikemian 30 tehtävän analyysi. Kuinka ratkaista tehtäviä C1 (30) yhtenäisestä kemian valtionkokeesta
Edellisessä artikkelissamme puhuimme kemian yhtenäisen valtiontutkinnon 2018 perustehtävistä. Nyt meidän on analysoitava yksityiskohtaisemmin edistyneitä tehtäviä (2018 kemian yhtenäisen valtiontutkinnon koodittaja - korkeatasoinen monimutkaisuus) monimutkaisuustaso, jota aiemmin kutsuttiin osaksi C.
Monimutkaisempiin tehtäviin kuuluu vain viisi (5) tehtävää - nro 30, 31, 32, 33, 34 ja 35. Pohditaan tehtävien aiheita, niihin valmistautumista ja monimutkaisten tehtävien ratkaisemista. Yhtenäinen kemian valtionkoe 2018.
Esimerkki tehtävästä 30 kemian yhtenäisessä valtiokokeessa 2018
Tarkoituksena on testata opiskelijan tietämystä hapetus-pelkistysreaktioista (ORR). Tehtävä antaa aina yhtälön kemialliselle reaktiolle, jossa aineita puuttuu reaktion kummaltakin puolelta (vasen puoli on lähtöaineet, oikea puoli tuotteet). Tästä tehtävästä voidaan saada enintään kolme (3) pistettä. Ensimmäinen piste annetaan oikea täyttö puutteet reaktiossa ja reaktion oikea tasoitus (kertoimien järjestely). Toinen piste voidaan saada kuvaamalla oikein ORR-tasapainoa ja viimeinen piste antaa oikein määritettäessä, kuka on reaktion hapetin ja kuka pelkistävä aine. Katsotaanpa ratkaisua tehtävään nro 30 Unified State Exam in Chemistry 2018 demoversiosta:
Luo elektronitasapainomenetelmällä yhtälö reaktiolle
Na 2 SO 3 + … + KOH à K 2 MnO 4 + … + H 2 O
Tunnista hapettava aine ja pelkistävä aine.
Ensimmäinen asia, joka sinun on tehtävä, on järjestää yhtälössä ilmoitettujen atomien varaukset, käy ilmi:
Na + 2 S +4 O 3 -2 + … + K + O -2 H + à K + 2 Mn +6 O 4 -2 + … + H + 2 O -2
Usein tämän toimenpiteen jälkeen näemme heti ensimmäisen alkuaineparin, joka muutti hapetusastetta (CO), eli eri puolia Reaktioissa samalla atomilla on eri hapetusaste. Tässä nimenomaisessa tehtävässä emme huomioi tätä. Siksi on tarpeen hyödyntää lisätietoa, nimittäin reaktion vasemmalla puolella, näemme kaliumhydroksidia ( CON), jonka läsnäolo kertoo, että reaktio tapahtuu emäksisessä ympäristössä. Oikealla puolella näemme kaliummanganaattia ja tiedämme, että alkalisessa reaktioväliaineessa kaliummanganaatti saadaan kaliumpermanganaatista, joten reaktion vasemmalla puolella oleva rako on kaliumpermanganaatti ( KMnO 4 ). Osoittautuu, että vasemmalla oli mangaania CO +7:ssä ja oikealla CO +6:ssa, mikä tarkoittaa, että voimme kirjoittaa OVR-saldon ensimmäisen osan:
Mn +7 +1 e — à Mn +6
Nyt voimme arvata, mitä muuta reaktiossa pitäisi tapahtua. Jos mangaani vastaanottaa elektroneja, jonkun on täytynyt antaa ne sille (noudatamme massan säilymisen lakia). Tarkastellaan kaikkia reaktion vasemman puolen alkuaineita: vety, natrium ja kalium ovat jo CO +1:ssä, mikä on niille maksimi, happi ei luovuta elektronejaan mangaanille, mikä tarkoittaa, että rikki pysyy CO +4:ssä . Päättelemme, että rikki luovuttaa elektroneja ja menee rikkitilaan CO +6:n kanssa. Nyt voimme kirjoittaa taseen toisen osan:
S +4 -2 e — à S +6
Yhtälöä tarkasteltaessa näemme, että oikealla puolella ei ole rikkiä tai natriumia missään, mikä tarkoittaa, että niiden on oltava aukossa, ja looginen yhdiste sen täyttämiseksi on natriumsulfaatti ( NaSO 4 ).
Nyt OVR-saldo kirjoitetaan (saamme ensimmäisen pisteen) ja yhtälö saa muodon:
Na2S03 + KMn04 + KOHà K 2 MnO 4 + NaSO 4 + H 2 O
| Mn +7 +1 e — à Mn +6 | 1 | 2 |
| S +4 -2e —à S+6 | 2 | 1 |
Tässä vaiheessa on tärkeää kirjoittaa välittömästi, kuka on hapettava aine ja kuka pelkistävä aine, koska opiskelijat keskittyvät usein yhtälön tasapainottamiseen ja yksinkertaisesti unohtavat suorittaa tämän osan tehtävästä, jolloin menettävät pisteen. Määritelmän mukaan hapettava aine on hiukkanen, joka vastaanottaa elektroneja (tapauksessamme mangaani), ja pelkistävä aine on hiukkanen, joka luovuttaa elektroneja (tapauksessamme rikki), joten saamme:
Hapettaja: Mn +7 (KMnO 4 )
Pelkistävä aine: S +4 (Na 2 NIIN 3 )
Tässä on muistettava, että osoitamme hiukkasten tilan, jossa ne olivat, kun ne alkoivat osoittaa hapettimen tai pelkistimen ominaisuuksia, emme tiloja, joihin ne joutuivat redox-reaktion seurauksena.
Nyt, jotta saat viimeisen pisteen, sinun on tasattava yhtälö oikein (järjestettävä kertoimet). Tasapainoa käyttämällä näemme, että jotta se olisi rikki +4, siirtyäkseen tilaan +6, kahden mangaani +7:n on muututtava mangaaniksi +6, ja mikä on tärkeää, laitamme mangaanin eteen 2:
Na2S03 + 2KMn04 + KOHà 2K 2 MnO 4 + NaSO 4 + H 2 O
Nyt näemme, että meillä on 4 kaliumia oikealla ja vain kolme vasemmalla, mikä tarkoittaa, että meidän on laitettava 2 kaliumhydroksidin eteen:
Na2S03 + 2KMn04 + 2KOHà 2K 2 MnO 4 + NaSO 4 + H 2 O
Tämän seurauksena oikea vastaus tehtävään nro 30 näyttää tältä:
Na2S03 + 2KMn04 + 2KOHà 2K 2 MnO 4 + NaSO 4 + H 2 O
| Mn +7 +1e —à Mn +6 | 1 | 2 |
| S +4 -2e —à S+6 | 2 | 1 |
Hapettaja: Mn +7 (KMnO 4)
Pelkistävä aine: S +4 (Na 2 NIIN 3 )
Kemian yhtenäisen valtiontutkinnon tehtävän 31 ratkaisu
Tämä on epäorgaanisten muutosten ketju. Tämän tehtävän suorittaminen onnistuneesti edellyttää, että sinulla on hyvä käsitys epäorgaanisille yhdisteille ominaisista reaktioista. Tehtävä koostuu neljästä (4) reaktiosta, joista jokaisesta saat yhden (1) pisteen, yhteensä neljä (4) pistettä tehtävästä. On tärkeää muistaa tehtävän suorittamisen säännöt: kaikki yhtälöt on tasoitava, vaikka opiskelija olisi kirjoittanut yhtälön oikein, mutta ei tasoittanut, hän ei saa pistettä; kaikkia reaktioita ei tarvitse ratkaista, voit tehdä yhden ja saada yhden (1) pisteen, kaksi reaktiota ja saada kaksi (2) pistettä jne., eikä yhtälöitä tarvitse suorittaa tiukasti järjestyksessä esim. , opiskelija voi tehdä reaktion 1 ja 3, mikä tarkoittaa, että sinun täytyy tehdä tämä ja saada kaksi (2) pistettä, tärkeintä on ilmoittaa, että nämä ovat reaktiot 1 ja 3. Katsotaanpa tehtävän nro 31 ratkaisua kohteesta Demoversio kemian yhtenäisestä valtionkokeesta 2018:
Rauta liuotettiin kuumaan väkevään rikkihappoon. Saatua suolaa käsiteltiin ylimäärällä natriumhydroksidiliuosta. Muodostunut ruskea sakka suodatettiin ja kalsinoitiin. Saatu aine kuumennettiin raudalla.
Kirjoita yhtälöt neljälle kuvatulle reaktiolle.
Ratkaisun helpottamiseksi voit piirtää luonnokseen seuraavan kaavion:
Tehtävän suorittamiseksi sinun on tietysti tiedettävä kaikki ehdotetut reaktiot. Tilassa on kuitenkin aina piilotettuja vihjeitä (väkevä rikkihappo, ylimäärä natriumhydroksidia, ruskea sakka, kalsinoitu, kuumennettu raudalla). Esimerkiksi opiskelija ei muista mitä tapahtuu raudalle ollessaan vuorovaikutuksessa konsenssin kanssa. rikkihappoa, mutta hän muistaa, että ruskea rautasakka alkalikäsittelyn jälkeen on todennäköisesti rautahydroksidia 3 ( Y = Fe(VAI NIIN) 3 ). Nyt meillä on mahdollisuus, korvaamalla Y kirjoitettuun kaavioon, yrittää tehdä yhtälöt 2 ja 3. Seuraavat vaiheet ovat puhtaasti kemiallisia, joten emme kuvaile niitä niin yksityiskohtaisesti. Opiskelijan tulee muistaa, että rautahydroksidin 3 kuumentaminen johtaa rautaoksidin 3 muodostumiseen ( Z = Fe 2 O 3 ) ja vesi, ja rautaoksidin 3 kuumentaminen puhtaalla raudalla johtaa ne keskitilaan - rautaoksidi 2 ( FeO). Aine X, joka on rikkihapon kanssa reaktion jälkeen saatu suola, josta saadaan rautahydroksidia 3 alkalikäsittelyn jälkeen, on rautasulfaatti 3 ( X = Fe 2 (NIIN 4 ) 3 ). On tärkeää muistaa tasapainottaa yhtälöt. Tämän seurauksena oikea vastaus tehtävään nro 31 on seuraava:
| 1) 2Fe + 6H2S04 (k) a Fe2(SO4)3+ 3SO 2 + 6H 2O |
| 2) Fe2(SO4)3+ 6NaOH (g) à 2 Fe(OH)3+ 3Na2SO4 |
| 3) 2Fe(OH)3à Fe 2 O 3 + 3H 2O |
| 4) Fe 2 O 3 + Fe à 3FeO |
Tehtävä 32 Kemian yhtenäinen valtionkoe
Hyvin samanlainen kuin tehtävä nro 31, vain se sisältää orgaanisten muunnosten ketjun. Suunnitteluvaatimukset ja ratkaisulogiikka ovat samanlaisia kuin tehtävässä 31, erona on vain se, että tehtävässä 32 annetaan viisi (5) yhtälöä, eli yhteensä voi saada viisi (5) pistettä. Koska se on samankaltainen tehtävän nro 31 kanssa, emme käsittele sitä yksityiskohtaisesti.
Ratkaisu tehtävään 33 kemiassa 2018
Laskentatehtävä, jonka suorittamiseksi sinun tulee tietää peruslaskentakaavat, osata käyttää laskinta ja vetää loogisia rinnastuksia. Tehtävä 33 on neljän (4) pisteen arvoinen. Katsotaanpa osaa tehtävän nro 33 ratkaisusta Unified State Exam in Chemistry 2018 demoversiosta:
Määritä seoksen rauta(II)sulfaatin ja alumiinisulfidin massaosuudet (prosentteina), jos käsiteltäessä 25 g tätä seosta vedellä vapautui kaasua, joka reagoi täysin 960 g:n kanssa 5-prosenttista kuparisulfaattiliuosta Kirjoita vastauksessasi tehtävässä ilmoitetut reaktioyhtälöt ja tee kaikki tarvittavat laskelmat (ilmoita tarvittavien fysikaalisten suureiden mittayksiköt).
Ensimmäisen (1) pisteen saamme ongelmassa esiintyvien reaktioiden kirjoittamisesta. Tämän nimenomaisen pisteen saaminen riippuu kemian tiedosta, loput kolme (3) pistettä saadaan vain laskennalla, joten jos opiskelijalla on ongelmia matematiikan kanssa, hänen tulee saada vähintään yksi (1) piste tehtävän nro 33 suorittamisesta. :
| A12S3 + 6H20à 2Al(OH)3 + 3H2S |
| CuSO 4 + H2Sà CuS + H2SO4 |
Koska lisätoimia ovat puhtaasti matemaattisia, emme käsittele niitä tässä. Valikoima analyysistä on katsottavissa YouTube-kanavaltamme (linkki tehtävän nro 33 videoanalyysiin).
Kaavat, joita tarvitaan tämän tehtävän ratkaisemiseen:
Kemiatehtävä 34 2018
Laskentatehtävä, joka eroaa tehtävästä nro 33 seuraavasti:
- Jos tehtävässä nro 33 tiedetään, minkä aineiden välillä vuorovaikutus tapahtuu, niin tehtävässä 34 on löydettävä mikä reagoi;
- Tehtävässä 34 annetaan orgaaniset yhdisteet, kun taas tehtävässä 33 epäorgaaniset prosessit annetaan useimmiten.
Itse asiassa tehtävä nro 34 on käänteinen tehtävälle nro 33, mikä tarkoittaa, että tehtävän logiikka on päinvastainen. Tehtävästä 34 saa neljä (4) pistettä, ja, kuten tehtävässä 33, niistä vain yksi (90 % tapauksista) saadaan kemian tiedosta, loput 3 (harvemmin 2) pistettä saadaan matemaattisia laskelmia varten. Suorittaaksesi onnistuneesti tehtävän nro 34 sinun on:
Tunne kaikkien orgaanisten yhdisteiden pääluokkien yleiset kaavat;
Tunne orgaanisten yhdisteiden perusreaktiot;
Osaat kirjoittaa yhtälön yleismuodossa.
Haluaisin vielä kerran huomauttaa, että se on välttämätöntä menestyksen kannalta yhtenäisen valtionkokeen läpäiseminen kemiassa vuonna 2018 teoreettiset perusteet ovat pysyneet käytännössä ennallaan, mikä tarkoittaa, että kaikki lapsesi koulussa saama tieto auttaa häntä läpäisemään kemian kokeen vuonna 2018. Unified State Examination Hodographin valmistautumiskeskuksessamme lapsesi saa Kaikki valmistautumiseen tarvittavat teoreettiset materiaalit, ja luokkahuoneessa lujittaa hankittua tietoa onnistuneeseen toteutukseen kaikille tenttitehtävät. Hänen kanssaan työskentelevät parhaat opettajat, jotka ovat läpäisseet erittäin suuren kilpailun ja vaikeita pääsykokeita. Tunnit pidetään pienissä ryhmissä, jolloin opettaja voi omistaa aikaa jokaiselle lapselle ja muotoilla yksilöllisen strategiansa koetyön suorittamiseen.
Meillä ei ole ongelmia uudessa muodossa olevien kokeiden puutteessa, opettajamme kirjoittavat ne itse, perustuen kaikkiin Unified State Exam in Chemistry 2018 -koodiin, määrittäjään ja demoversioon.
Soita tänään ja huomenna lapsesi kiittää sinua!
Osa I
Tehtävä nro 30 kemian yhtenäisestä valtionkokeesta on omistettu aiheelle "Hapettumis-pelkistysreaktiot". Aikaisemmin tämäntyyppinen tehtävä sisältyi Unified State Exam -versioon numerolla C1.
Tehtävän 30 merkitys: reaktioyhtälön kertoimet on järjestettävä elektronisen tasapainon menetelmällä. Yleensä ongelmalausekkeessa annetaan vain yhtälön vasen puoli, oikea puoli on suoritettava itsenäisesti.
Täydellinen ratkaisu ongelmaan on 3 pisteen arvoinen. Yksi piste annetaan hapettimen ja pelkistimen määrittämisestä, toinen suoraan elektronisen vaa'an muodostamisesta, viimeinen kertoimien oikeasta järjestelystä reaktioyhtälössä. Huomaa: Unified State Exam 2018:n maksimipistemäärä tehtävän 30 ratkaisemisesta on 2 pistettä.
Mielestäni vaikein asia tässä prosessissa on ensimmäinen askel. Kaikki eivät pysty ennustamaan reaktion lopputulosta oikein. Jos vuorovaikutustuotteet on ilmoitettu oikein, kaikki seuraavat vaiheet ovat teknologiakysymystä.
Ensimmäinen askel: muista hapetustilat
Meidän on aloitettava konseptista alkuaineen hapetustila. Jos et vielä tunne tätä termiä, katso Hapetustila-osio kemian hakuteoksesta. Sinun on opittava määrittämään luottavaisesti kaikkien alkuaineiden hapetustilat epäorgaanisissa yhdisteissä ja jopa yksinkertaisimmissa eloperäinen aine. Ilman tämän aiheen 100-prosenttista ymmärrystä eteenpäin siirtyminen on turhaa.
Vaihe kaksi: hapettimet ja pelkistimet. Redox-reaktiot
Haluaisin muistuttaa, että kaikki luonnossa tapahtuvat kemialliset reaktiot voidaan jakaa kahteen tyyppiin: redox ja ne, jotka tapahtuvat muuttamatta hapetusasteita.
Redox-reaktion aikana (tätä lyhennettä käytämme edelleen redox-reaktioihin) jotkin alkuaineet muuttavat hapetustilaansa.
Alkuaine, jonka hapetusaste on menee alas, nimeltään hapettava aine.
Alkuaine, jonka hapetusaste on nousee, nimeltään pelkistävä aine.
Hapettava aine pelkistyy reaktion aikana.
Pelkistävä aine hapettuu reaktion aikana.
Esimerkki 1. Harkitse rikin reaktiota fluorin kanssa:
S + 3F 2 = SF 6.
Järjestä kaikkien alkuaineiden hapetustilat itse. Näemme, että rikin hapetusaste nousee (0:sta +6:een) ja fluorin hapetusaste laskee (0:sta -1:een). Johtopäätös: S on pelkistävä aine, F2 on hapettava aine. Prosessin aikana rikki hapettuu ja fluori pelkistyy.
Esimerkki 2. Keskustellaan mangaani(IV)oksidin reaktiosta kloorivetyhapon kanssa:
Mn02 + 4HCl = MnCl2 + Cl2 + 2H20.
Reaktion aikana mangaanin hapetusaste laskee (+4:stä +2:een) ja kloorin hapetusaste nousee (-1:stä 0:aan). Johtopäätös: mangaani (MnO 2:n koostumuksessa) on hapetin, kloori (HCl:n koostumuksessa pelkistävä aine). Kloori hapettuu, mangaani pelkistyy.
Huomaa, että viimeisessä esimerkissä kaikki klooriatomit eivät muuttaneet hapetusastetta. Tämä ei vaikuttanut päätelmiimme millään tavalla.
Esimerkki 3. Ammoniumbikromaatin lämpöhajoaminen:
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O.
Näemme, että sekä hapetin että pelkistävä aine ovat osa yhtä "molekyyliä": kromi muuttaa hapetusasteensa +6:sta +3:een (eli se on hapettava aine) ja typpi - -3:sta 0:aan (siis). typpi on pelkistävä aine).
Esimerkki 4. Typpidioksidin vuorovaikutus alkalivesiliuoksen kanssa:
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O.
Järjestettyään hapetustilat (toivottavasti teet tämän ilman vaikeuksia!), löydämme oudon kuvan: vain yhden elementin - typen - hapetustila muuttuu. Jotkut N-atomit lisäävät hapetusastettaan (+4:stä +5:een), kun taas toiset vähentävät niitä (+4:stä +3:een). Itse asiassa tässä ei ole mitään ihmeellistä! Tässä prosessissa N(+4) on sekä hapetin että pelkistävä aine.
Puhutaanpa hieman redox-reaktioiden luokittelusta. Haluan muistuttaa, että kaikki OVR:t on jaettu kolmeen tyyppiin:
- 1) molekyylien väliset ORR:t (hapettava aine ja pelkistävä aine sisältyvät eri molekyyleihin);
- 2) molekyylinsisäiset ORR:t (hapettava aine ja pelkistävä aine ovat yhdessä molekyylissä);
- 3) disproportionaatioreaktiot (hapetin ja pelkistävä aine ovat saman alkuaineen atomeja, joilla on sama alkuhapetusaste yhden molekyylin koostumuksessa).
Uskon, että näiden määritelmien perusteella voit helposti ymmärtää, että esimerkkien 1 ja 2 reaktiot liittyvät molekyylien väliseen ORR:iin, ammoniumdikromaatin hajoaminen on esimerkki molekyylin sisäisestä ORR:sta ja NO 2:n vuorovaikutus alkalin kanssa on esimerkki epäsuhtaisuusreaktio.
Vaihe kolme: alamme hallita elektronista saldomenetelmää
Tarkistaakseni, kuinka hyvin olet hallitsenut edellisen materiaalin, esitän sinulle yksinkertaisen kysymyksen: ”Voitko antaa esimerkin reaktiosta, jossa tapahtuu hapettumista, mutta ei pelkistystä, tai päinvastoin, tapahtuu hapettumista, mutta ei pelkistystä? ”
Oikea vastaus: "Ei, et voi!"
Todellakin, anna alkuaineen X hapetustilan nousta reaktion aikana. Tämä tarkoittaa, että X luovuttaa elektroneja. Mutta kenelle? Loppujen lopuksi elektronit eivät voi yksinkertaisesti haihtua, hävitä jälkiä jättämättä! On olemassa jokin toinen alkuaine Y, jonka atomit hyväksyvät nämä elektronit. Elektroneilla on negatiivinen varaus, joten Y:n hapetusaste laskee.
Johtopäätös: jos on pelkistysaine X, niin varmasti on hapetin Y! Lisäksi yhden elementin luovuttamien elektronien määrä on täsmälleen sama kuin toisen elementin vastaanottamien elektronien lukumäärä.
Se perustuu tähän tosiasiaan elektroninen saldomenetelmä, käytetään tehtävässä C1.
Aloitetaan tämän menetelmän hallitseminen esimerkein.
Esimerkki 4
C + HNO 3 = CO 2 + NO 2 + H 2 O
elektroninen saldomenetelmä.
Ratkaisu. Aloitetaan määrittämällä hapetustilat (tee se itse!). Näemme, että prosessin aikana kaksi alkuainetta muuttaa hapetusasteitaan: C (0:sta +4:ään) ja N (+5:stä +4:ään).
Ilmeisesti hiili on pelkistävä aine (hapettunut) ja typpi (+5) (typpihapossa) on hapetin (pelkistetty). Muuten, jos tunnistit oikein hapettimen ja in-telin, sinulle taataan jo 1 piste ongelmasta N 30!
Nyt hauskuus alkaa. Kirjoitetaan ns hapettumisen ja pelkistyksen puolireaktiot:
Hiiliatomi luovuttaa 4 elektronia, typpiatomi saa 1 elektronin. Annettu elektronien määrä ei ole yhtä suuri kuin vastaanotettujen elektronien määrä. Tämä on huono! Tilanne on korjattava.
"Kerrotaan" ensimmäinen puolireaktio 1:llä ja toinen 4:llä.
| C(0) - 4e | = | C(+4) | (1) |
| N(+5) + 1e | = | N(+4) | (4) |
Nyt kaikki on hyvin: yhdelle hiiliatomille (antaen 4 e) on 4 typpiatomia (joista jokainen vie yhden e). Annettujen elektronien määrä on yhtä suuri kuin vastaanotettujen elektronien määrä!
Se, mitä juuri kirjoitimme, on itse asiassa ns elektroninen tasapaino. Jos kirjoitat tämän saldon oikein kemian todelliseen Unified State -kokeeseen, saat 1 pisteen lisää tehtävästä C1.
Viimeinen vaihe: jäljellä on siirtää saadut kertoimet reaktioyhtälöön. Ennen kaavoja C ja CO 2 emme muuta mitään (koska kerrointa 1 ei laita yhtälöön), ennen kaavoja HNO 3 ja NO 2 laitamme neljän (koska typpiatomien lukumäärä vasemmalla ja oikealla puolella yhtälön tulee olla yhtä suuri kuin 4) :
C + 4HNO 3 = CO 2 + 4NO 2 + H 2 O.
Vielä on tehtävä viimeinen tarkistus: näemme, että typpiatomien lukumäärä on sama vasemmalla ja oikealla, sama koskee C-atomeja, mutta vedyn ja hapen kanssa on edelleen ongelmia. Mutta kaikki on helppo korjata: laitamme kertoimen 2 kaavan H 2 O eteen ja saamme lopullisen vastauksen:
C + 4HNO 3 = CO 2 + 4NO 2 + 2 H 2O.
Siinä kaikki! Ongelma on ratkaistu, kertoimet asetettu ja oikeasta yhtälöstä saa yhden pisteen lisää. Tulos: 3 pistettä täydellisesti ratkaistusta tehtävästä 30. Onnittelut siitä!
Esimerkki 5. Järjestä kertoimet reaktioyhtälöön
NaI + H 2 SO 4 = Na 2 SO 4 + H 2 S + I 2 + H 2 O
elektroninen saldomenetelmä.
Ratkaisu. Järjestä kaikkien alkuaineiden hapetustilat itse. Näemme, että prosessin aikana kaksi alkuainetta muuttavat hapetusasteitaan: S (+6:sta -2:een) ja I (-1:stä 0:aan).
Rikki (+6) (rikkihapossa) on hapetin ja jodi (-1) NaI:ssa pelkistävä aine. Reaktion aikana I(-1) hapettuu, S(+6) pelkistyy.
Kirjoitamme ylös hapettumis- ja pelkistyspuolireaktiot:
kiinnitä huomiota tärkeä pointti: Jodimolekyylissä on kaksi atomia. "Puolet" molekyylistä ei voi osallistua reaktioon, joten vastaavaan yhtälöön emme kirjoita I, vaan täsmälleen I 2.
"Kerrotaan" ensimmäinen puolireaktio 4:llä ja toinen 1:llä.
| 2I(-1) - 2e | = | minä 2 (0) | (4) |
| S(+6) + 8e | = | S(-2) | (1) |
Tasapaino on rakennettu, jokaista 8 annettua elektronia kohden vastaanotetaan 8 elektronia.
Siirrämme kertoimet reaktioyhtälöön. Ennen kaavaa I 2 laitamme 4, ennen kaavaa H 2 S tarkoitamme kerrointa 1 - tämä on mielestäni ilmeistä.
NaI + H 2 SO 4 = Na 2 SO 4 + H 2 S + 4I 2 + H 2 O
Mutta lisäkysymyksiä voi tulla. Ensinnäkin olisi väärin laittaa neljä NaI-kaavan eteen. Todellakin, jo itse hapettumisen puolireaktiossa symbolia I edeltää kerroin 2. Näin ollen yhtälön vasemmalle puolelle ei pitäisi kirjoittaa 4, vaan 8!
8NaI + H 2 SO 4 = Na 2 SO 4 + H 2 S + 4I 2 + H 2 O
Toiseksi, tällaisessa tilanteessa valmistuneet laittavat usein kertoimen 1 rikkihapon kaavan eteen. He perustelevat näin: "Pelkistyspuolireaktiossa löydettiin kerroin 1, tämä kerroin viittaa S:ään, mikä tarkoittaa, että rikkihapon kaavaa edeltää yksikkö."
Tämä perustelu on väärä! Kaikki rikkiatomit eivät muuttaneet hapetusastettaan, osa niistä (Na 2 SO 4 -koostumuksessa) säilytti hapetusasteen +6. Näitä atomeja ei oteta huomioon elektronisessa tasapainossa, eikä kertoimella 1 ole mitään tekemistä niiden kanssa.
Kaikki tämä ei kuitenkaan estä meitä saamasta päätöstä päätökseen. On vain tärkeää ymmärtää, että jatkokeskusteluissa emme enää luota elektroniseen vaakaan, vaan yksinkertaisesti maalaisjärkeen. Muistutan siis, että H 2 S:n, NaI:n ja I 2:n kertoimet ovat "jäädytetty" eikä niitä voi muuttaa. Mutta loput - se on mahdollista ja välttämätöntä.
Yhtälön vasemmalla puolella on 8 natriumatomia (NaI:ssa), oikealla on toistaiseksi vain 2 atomia. Laitamme kertoimen 4 natriumsulfaattikaavan eteen:
8NaI + H2SO4 = 4Na2SO4 + H2S + 4I2 + H2O.
Vasta nyt voit tasoittaa S-atomien lukumäärän. Oikealla niitä on 5, joten sinun on asetettava kerroin 5 rikkihapon kaavan eteen:
8NaI + 5H2SO4 = 4Na2S04 + H2S + 4I2 + H20.
Viimeinen ongelma: vety ja happi. No, luulen, että arvasit itse, että kerroin 4 puuttuu oikealla olevan vesikaavan edestä:
8NaI + 5H2S04 = 4Na2S04 + H2S + 4I2 + 4H20.
Tarkistamme kaikki huolellisesti uudelleen. Kyllä kaikki on oikein! Ongelma on ratkaistu, saimme 3 pistettä.
Joten esimerkeissä 4 ja 5 keskustelimme yksityiskohtaisesti algoritmi ongelman C1 ratkaisemiseksi (30). Ratkaisusi todelliseen koeongelmaan tulee sisältää seuraavat seikat:
- 1) KAIKKIEN alkuaineiden hapetustilat;
- 2) hapettimen ja pelkistimen merkintä;
- 3) sähköinen saldojärjestelmä;
- 4) lopullinen reaktioyhtälö kertoimilla.
Muutama kommentti algoritmista.
1. Kaikkien yhtälön vasemmalla ja oikealla puolella olevien alkuaineiden hapetustilat on ilmoitettava. Kaikki, ei vain hapettava ja pelkistävä aine!
2. Hapettava aine ja pelkistävä aine on ilmoitettava selvästi ja selvästi: elementti X (+...) koostumuksessa... on hapettava aine ja pelkistyy; alkuaine Y(...) koostumuksessa... on pelkistävä aine ja hapettuu. Kaikki eivät pysty tulkitsemaan rikkihapon kaavan alla olevaa tekstiä pienellä käsialalla "ok. kaikki", koska "rikkihapon koostumuksessa oleva rikki (+6) on hapettava aine, pelkistetty".
Älä säästä kirjaimissa! Et laita sanomalehteen mainosta: "Led-huone kaikilla mukavuuksilla."
3. Elektroninen tasapainokaavio on vain kaavio: kaksi puolireaktiota ja vastaavat kertoimet.
4. Kukaan ei tarvitse yksityiskohtaisia selityksiä siitä, kuinka sijoitit kertoimet yhtälöön Unified State Examissa. On vain välttämätöntä, että kaikki numerot ovat oikein, ja itse merkintä tehdään luettavalla käsialalla. Muista tarkistaa itsesi useita kertoja!
Ja vielä kerran kemian yhtenäisen valtionkokeen tehtävän C1 arvioinnista:
- 1) hapettimen (hapetusaineet) ja pelkistimen (pelkistysaineet) määrittäminen - 1 piste;
- 2) sähköinen saldojärjestelmä oikeilla kertoimilla - 1 piste;
- 3) perusreaktioyhtälö kaikilla kertoimilla - 1 piste.
Tulos: 3 pistettä tehtävän nro 30 täydellisestä ratkaisusta.
Huomautus: Muistutan vielä kerran, että Unified State Exam 2018:n enimmäispistemäärä tehtävän nro 30 ratkaisemisesta on 2 pistettä.
Olen varma, että ymmärrät sähköisen saldomenetelmän idean. Ymmärsimme periaatteessa, kuinka esimerkin nro 30 ratkaisu rakennetaan. Periaatteessa kaikki ei ole niin monimutkaista!
Valitettavasti todellisessa kemian yhtenäisessä valtionkokeessa ilmenee seuraava ongelma: itse reaktioyhtälöä ei anneta kokonaisuudessaan. Eli yhtälön vasen puoli on läsnä, mutta oikealla ei ole joko mitään tai yhden aineen kaava on osoitettu. Sinun on täydennettävä yhtälö itse tietosi perusteella ja vasta sitten aloitettava kertoimien järjestäminen.
Tämä voi olla melko vaikeaa. Ei ole olemassa universaaleja reseptejä yhtälöiden kirjoittamiseen. Seuraavassa osassa käsittelemme tätä asiaa yksityiskohtaisemmin ja tarkastelemme monimutkaisempia esimerkkejä.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: kaliumdikromaatti, rikkihappo, ammoniumkarbonaatti, piidioksidi, kaliumnitriitti. On sallittua käyttää aineiden vesiliuoksia.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: ammoniumnitraatti, kaliumdikromaatti, rikkihappo, kaliumsulfidi, magnesiumfluoridi. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Suorita tehtävä loppuun käyttämällä seuraavaa aineluetteloa: kaliumjodidi, rikkihappo, alumiinihydroksidi, mangaani(IV)oksidi, magnesiumnitraatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Suorita tehtävä loppuun käyttämällä seuraavaa aineluetteloa: väkevä suolahappo, fosfori (V) oksidi, mangaani (IV) oksidi, ammoniumfluoridi, kalsiumnitraatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: natriumdikromaatti, rikkihappo, natriumjodidi, natriumsilikaatti, magnesiumnitraatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: väkevä suolahappo, hiilidioksidi, kaliumpermanganaatti, ammoniumfluoridi, rautanitraatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: ammoniumsulfaatti, kaliumhydroksidi, kaliumpermanganaatti, kaliumnitriitti, kupari(II)oksidi. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, väkevä typpihappo, alumiinisulfaatti, fosfori (V) oksidi, kupari (II) nitraatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: magnesiumhydroksidi, rikkivety, hopeanitraatti, natriumdikromaatti, rikkihappo. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, fluorivety, ammoniumkarbonaatti, rauta(II)sulfaatti, kaliumdikromaatti, rikkihappo. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, kaliumkloraatti, natriumhydroksidi, alumiinisulfaatti, kromi(III)oksidi, magnesiumoksidi. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, kaliumsulfiitti, kaliumdikromaatti, rikkihappo, kromi(III)hydroksidi, piidioksidi. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, bromi, bariumnitraatti, ammoniumsulfaatti, väkevä suolahappo, kaliumpermanganaatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, sinkkinitraatti, natriumsulfiitti, bromi, kaliumhydroksidi, kuparioksidi. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, rikki, väkevä typpihappo, hiilidioksidi, hopeafluoridi, kalsiumasetaatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, vetyperoksidi, kaliumhydroksidi, kromi(III)oksidi, magnesiumfosfaatti, ammoniumsulfaatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Tehtävän suorittamiseksi käytä seuraavaa aineluetteloa: rikkivety, natriumkromaatti, natriumbromidi, kaliumfluoridi, rikkihappo, magnesiumnitraatti. On sallittua käyttää aineiden vesiliuoksia.
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Vastaukset:
K 2 Cr 2 O 7 + 3KNO 2 + 4H 2 SO 4 → Cr 2 (SO 4) 3 + 3 KNO 3 + K 2 SO 4 + 4H 2 O
K 2 Cr 2 O 7 + 3K 2 S + 7H 2 SO 4 → Cr 2 (SO 4) 3 + 3S + 4K 2 SO 4 + 7 H 2 O
2Cr 6+ +6e → 2Cr 3+ – hapetin, pelkistetty
Vastaus (lisämäärä): 3K 2 S + 4H 2 SO 4 → 4S + 3K 2 SO 4 + 4H 2 O (yhteissuhde)
2KI + MnO 2 + 2H 2SO 4 → I 2 + MnSO 4 + K 2 SO 4 + 2 H 2 O
Vastaus (lisämäärä): 8KI + 5H 2 SO 4 → 4I 2 + H 2 S + 4K 2 SO 4 + 4H 2 O
MnO 2 + 4HCl → MnCl 2 + Cl 2 + 2H 2 O
Mn 4+ +2e → Mn 2+ – hapetin, pelkistetty
Na 2Cr 2O 7 + 6NaI + 7H 2 SO 4 → Cr 2 (SO 4) 3 + 3I 2 + 4Na 2 SO 4 + 7H 2 O
2Cr 6+ +6e → 2Cr 3+ – hapetin, pelkistetty
2I - –2e → I 2 – pelkistävä aine, hapetettu
2Cl - –2e → Cl 2 – pelkistävä aine, hapetettu
2KMnO4 + KNO2 + 2KOH → 2K2MnO4 + KNO3 + H2O
Mn 7+ +1e → Mn 6+ – hapetin, pelkistetty
N 3+ –2e → N 5+ – pelkistävä aine, hapetettu
H 2 S + 8HNO 3 (väk.) → H 2 SO 4 + 8NO 2 + 4H 2 O
S 2- –8e → S 6+ – pelkistävä aine, hapetettu
N 5+ +1e → N 4+ – hapetin, pelkistetty
Na 2Cr 2O 7 + 3H 2S + 4H 2 SO 4 → Cr 2 (SO 4) 3 + 3S + Na 2 SO 4 + 7H 2 O
2Cr 6+ +6e → 2Cr 3+ – hapetin, pelkistetty
S 2- –2e → S 0 – pelkistävä aine, hapetettu
Vastaus (lisämäärä): H 2 S + H 2 SO 4 → S + SO 2 + 2H 2 O
K 2 Cr 2 O 7 + 6FeSO 4 + 7H 2 SO 4 → Cr 2 (SO 4) 3 + 3Fe 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O
2Cr 6+ +6e → 2Cr 3+ – hapetin, pelkistetty
Fe 2+ –1e → Fe 3+ – pelkistävä aine, hapetettu
KClO 3 + Cr 2 O 3 + 4NaOH → KCl + 2Na 2 CrO 4 + 2H 2 O
Cl 5+ +6e →Cl - - hapetin, pelkistetty
2Cr 3+ –6e → 2Cr 6+ – pelkistävä aine, hapetettu
K 2 Cr 2 O 7 + 3K 2 SO 3 + 4H 2 SO 4 → Cr 2 (SO 4) 3 + 4K 2 SO 4 + 4H 2 O
2Cr 6+ +6e → 2Cr 3+ – hapetin, pelkistetty
S 4+ –2e → S 6+ – pelkistävä aine, hapetettu
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
Mn 7+ +5e → Mn 2+ – hapetin, pelkistetty
2Cl - –2e → Cl 2 – pelkistävä aine, hapetettu
-
Ensimmäinen vastaus:
8KMnO4 + 5PH3 + 12H2SO4 → 4K2SO4 + 8MnSO4 + 5H3PO4 + 12H2O
Mn +7 + 5e — → Mn +2 |⋅8
P -3 — 8e — → P +5 |⋅5Toinen vastaus:
8KMnO 4 + 3PH 3 → 2K 3 PO 4 + K 2 HPO 4 + 8 MnO 2 + 4H 2 O
Mn +7 + 3e — → Mn +4 |⋅8
P -3 — 8e — → P +5 |⋅3Mn +7 (KMnO 4) - hapetin, P -3 (PH 3) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Ensimmäinen vastaus:
2Na 2CrO 4 + 5H 2SO 4 + 3NaNO 2 → Cr 2 (SO 4) 3 + 3NaNO 3 + 2Na 2 SO 4 + 5H 2 O
2Cr +6 + 6e — → 2Cr +3 |⋅1
N +3 — 2e — → N +5 |⋅3
Toinen vastaus:
2Na 2CrO 4 + 3NaNO 2 + 5H 2 O → 2Cr(OH) 3 + 4NaOH + 3NaNO 3
Cr +6 + 3e — → Cr +3 |⋅2
N +3 — 2e — → N +5 | ⋅3
N +3 (NaNO 2) - pelkistävä aine, Cr +6 (Na 2 CrO 4) - hapetin
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Ensimmäinen vastaus:
Na 2Cr 2O 7 + 3H 2S + 4H 2 SO 4 → Na 2 SO 4 + Cr 2 (SO 4) 3 + 3S + 7H 2 O
2Cr +6 + 6e — → 2Cr +3 |⋅1
S -2 - 2e - → S 0 |⋅3Toinen vastaus:
Na 2Cr 2O 7 + 3H 2S + H 2O → 2Cr(OH) 3 + 3S + 2NaOH
2Cr +6 + 6e — → 2Cr +3 |⋅1
S -2 - 2e - → S 0 |⋅3Cr +6 (Na 2 Cr 2 O 7) - hapetin, S -2 (H 2 S) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Ensimmäinen vastaus:
3K 2 SO 3 + K 2 Cr 2 O 7 + 4H 2 SO 4 → Cr 2 ( SO 4 ) 3 + 4K 2 SO 4 + 4 H 2 O
S +4 — 2е — → S +6 |⋅3
2Cr +6 + 6e — → 2Cr +3 |⋅1Toinen vastaus:
3K 2 SO 3 + K 2 Cr 2 O 7 + 4H 2 O → 2Cr(OH) 3 + 3K 2 SO 4 + 2KOH
S +4 — 2е — → S +6 |⋅3
2Cr +6 + 6e — → 2Cr +3 |⋅1S +4 (K 2 SO 3) - pelkistävä aine, Cr +6 (K 2 Cr 2 O 7) - hapetin
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Ensimmäinen vastaus:
2KMnO4 + 6KI + 4H2O → 2MnO2 + 3I2 + 8KOH
Mn +7 + 3e — → Mn +4 |⋅2
2I — — 2e — → I 2 |⋅3Toinen vastaus
2KMnO4 + KI + H2O → 2MnO2 + KIO 3 + 2KOH
Mn +7 + 3e — → Mn +4 |⋅2
I -1 — 6e — → I +5 |⋅1Mn +7 (KMnO 4) - hapetin, I - (KI) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
3NaClO + 4NaOH + Cr 2 O 3 → 2Na 2 CrO 4 + 3NaCl + 2H 2 O
Cl +1 + 2e — → Cl -1 |⋅3
2Cr +3 — 6e — → 2Cr +6 |⋅1Cl +1 (NaClO) - hapetin, Cr +2 (Cr 2 O 3) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2 H 2 O
S 0 — 6e — → S +6
N +5 + 3e — → N +2S 0 - pelkistävä aine, N +5 (HNO 3) - hapetin
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
6FeSO 4 + K 2Cr 2 O 7 + 7H 2 SO 4 → 3Fe 2 (SO 4) 3 + Cr 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O
2Fe +2 – 2e- → 2Fe +3 |⋅3
2Cr +6 + 6e — → 2Cr +3 |⋅1
Fe +2 (FeSO 4) – pelkistävä aine, Cr +6 (K 2 Cr 2 O 7) – hapetin
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
3H 2 O 2 + 4KOH + Cr 2 O 3 → 2K 2 CrO 4 + 5H 2 O
2O -1 +2e — → 2O -2 |⋅1
2Cr +3 – 6e — → 2Cr +6 |⋅1
O -1 (H 2 O 2) - hapetin, Cr +3 (Cr 2 O 3) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Ensimmäinen vastaus:
K 2 Cr 2 O 7 + 4H 2 SO 4 + 3KNO 2 → 3KNO 3 + K 2 SO 4 + Cr 2 (SO 4) 3 + 4H 2 O
2Cr +6 + 6e — → 2Cr +3 |⋅1
N +3 – 2e — → N +5 |⋅3
Toinen vastaus:
K 2 Cr 2 O 7 + 3KNO 2 + 4H 2 O → 3KNO 3 + 2KOH + 2Cr(OH) 3
2Cr +6 + 6e — → 2Cr +3 |⋅1
N +3 – 2e — → N +5 |⋅3
Cr +6 (K 2 Cr 2 O 7) - hapetin, N +3 (KNO 2) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
2Na 2CrO 4 + 6NaBr + 8H 2 SO 4 → 5Na 2 SO 4 + 3Br 2 + Cr 2 (SO 4) 3 + 8H 2 O
2Cr +6 + 6e — → 2Cr +3 |⋅1
2Br — — 2e — → Br 2 0 |⋅3
Cr +6 (Na 2 CrO 4) - hapetin, Br - (NaBr) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Mn +7 + 5e — → Mn +2 |⋅1
2Cl — — 2e — → Cl 2 0 |⋅1
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Ensimmäinen vastaus:
K 2 Cr 2 O 7 + 7 H 2 SO 4 + 3K 2 S → 3S + 4K 2 SO 4 + Cr 2 (SO 4) 3 + 7 H 2 O
2Cr +6 + 6e — → 2Cr +3 |⋅1
S -2 - 2e - → S 0 |⋅3Toinen vastaus:
K 2 Cr 2 O 7 + 3K 2 S + 7H 2 O → 2Cr(OH) 3 + 3S + 8KOH
2Cr +6 + 6e — → 2Cr +3 |⋅1
S -2 - 2e - → S 0 |⋅3Cr +6 (K 2 Cr 2 O 7) - hapetin, S -2 (K 2 S) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
Ensimmäinen vastaus:
2KMnO4 + 2KOH + KNO2 → KNO3 + 2K2MnO4 + H2O
Mn +7 + 1e — → Mn +6 |⋅2
N +3 — 2e — → N +5 |⋅1Toinen vastaus:
2KMnO4 + 3KNO2 + H2O → 3KNO3 + 2MnO2 + 2KOH
Mn +7 + 3e — → Mn +4 |⋅2
N +3 — 2e — → N +5 |⋅3Mn +7 (KMnO 4) - kaliumpermanganaatti, N +3 (KNO 2) - pelkistävä aine
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
4HCl + MnO 2 → MnCl 2 + Cl 2 + 2H 2O
2Cl -1 - 2e - → Cl 2 0 |⋅1
Mn +4 + 2e — → Mn +2 |⋅1
Cl -1 (HCl) - pelkistävä aine, Mn +4 (MnO 2) - hapetin
Valitse ehdotetusta aineluettelosta aineet, joiden välillä hapetus-pelkistysreaktio on mahdollinen, ja kirjoita tämän reaktion yhtälö. Tee elektroninen vaaka, ilmoita hapetin ja pelkistysaine.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Mn +7 + 5e — → Mn +2 |⋅1
2Cl — — 2e — → Cl 2 0 |⋅1
Mn +7 (KMnO 4) - hapetin, Cl - (HCl) - pelkistävä aine
Suorita tehtävät 30, 31 käyttämällä seuraavaa aineluetteloa: sinkkinitraatti, natriumsulfiitti, bromi, kaliumhydroksidi, kupari(II)oksidi. On sallittua käyttää aineiden vesiliuoksia.
Jatkamme keskustelua ongelmatyypin C1 (nro 30) ratkaisusta, johon varmasti törmäävät kaikki kemian yhtenäisen valtiontutkinnon suorittaneet. Artikkelin ensimmäisessä osassa hahmotimme yleisen algoritmin ongelman 30 ratkaisemiseksi, toisessa osassa analysoimme useita melko monimutkaisia esimerkkejä.
Aloitamme kolmannen osan keskustelulla tyypillisistä hapettimista ja pelkistysaineista ja niiden muutoksista eri väliaineissa.
Viides askel: käsittelemme tyypillisiä OVR:itä, joita voi esiintyä tehtävässä nro 30
Haluaisin muistuttaa muutamia hapetustilan käsitteeseen liittyviä seikkoja. Olemme jo todenneet, että vakio hapetustila on ominaista vain suhteellisen pienelle määrälle alkuaineita (fluori, happi, alkali- ja maa-alkalimetallit jne.) Useimmilla alkuaineilla voi olla erilaisia hapettumisasteita. Esimerkiksi kloorille kaikki tilat ovat mahdollisia välillä -1 - +7, vaikka parittomat arvot ovat vakaimpia. Typen hapetustilat ovat välillä -3 - +5 jne.
On kaksi tärkeää sääntöä, jotka on muistettava selvästi.
1. Ei-metallisen alkuaineen korkein hapetusaste on useimmissa tapauksissa sama kuin sen ryhmän numero, jossa elementti sijaitsee, ja alin hapetusaste = ryhmän numero - 8.
Esimerkiksi kloori on ryhmässä VII, joten sen korkein hapetusaste = +7 ja alin -7 - 8 = -1. Seleeni on ryhmässä VI. Korkein hapetusaste = +6, alhaisin - (-2). Pii sijaitsee ryhmässä IV; vastaavat arvot ovat +4 ja -4.
Muista, että tähän sääntöön on poikkeuksia: hapen korkein hapetusaste = +2 (ja tämäkin esiintyy vain happifluoridissa) ja fluorin korkein hapetusaste = 0 (yksinkertaisessa aineessa)!
2. Metallit eivät pysty kehittymään negatiivisia voimia hapettumista. Tämä on varsin merkittävää, kun otetaan huomioon, että yli 70 % kemiallisia alkuaineita viittaavat erityisesti metalleihin.
Ja nyt kysymys: "Voiko Mn(+7) toimia kemialliset reaktiot restauraattorin roolissa?" Älä kiirehdi, yritä vastata itse.
Oikea vastaus: "Ei, se ei voi!" Se on hyvin helppo selittää. Katso tämän elementin sijaintia jaksollisessa taulukossa. Mn on ryhmässä VII, joten sen KORKEA hapetusaste on +7. Jos Mn(+7) toimisi pelkistimenä, sen hapetusaste kasvaisi (muista pelkistimen määritelmä!), mutta tämä on mahdotonta, koska sillä on jo maksimiarvo. Johtopäätös: Mn(+7) voi olla vain hapetin.
Samasta syystä S(+6), N(+5), Cr(+6), V(+5), Pb(+4) jne. voivat osoittaa VAIN HAPETTAVAT ominaisuudet. Katso sijainti näistä elementeistä jaksollisen järjestelmän järjestelmässä ja katso itse.
Ja toinen kysymys: "Voiko Se(-2) toimia hapettavana aineena kemiallisissa reaktioissa?"
Ja taas vastaus on kielteinen. Olet varmaan jo arvannut mitä täällä tapahtuu. Seleeni kuuluu ryhmään VI, sen ALIN hapetusaste on -2. Se(-2) ei voi saada elektroneja, eli se ei voi olla hapetin. Jos Se(-2) osallistuu ORR:ään, niin vain REDUCERin roolissa.
Samasta syystä AINOA pelkistysaine voi olla N(-3), P(-3), S(-2), Te(-2), I(-1), Br(-1) jne.
Lopullinen johtopäätös: alhaisimman hapetusasteen alkuaine voi toimia ORR:ssä vain pelkistimenä ja korkeimman hapetusasteen omaava alkuaine voi toimia vain hapettimena.
"Entä jos elementillä on väliaikainen hapetustila?" - kysyt. No, sitten sekä sen hapettuminen että pelkistyminen ovat mahdollisia. Esimerkiksi rikki hapettuu reaktiossa hapen kanssa ja pelkistyy reaktiossa natriumin kanssa.
On luultavasti loogista olettaa, että jokainen alkuaine korkeimmassa hapetustilassa on voimakas hapetin ja alimmassa - voimakas pelkistävä aine. Useimmissa tapauksissa tämä on totta. Esimerkiksi kaikki yhdisteet Mn(+7), Cr(+6), N(+5) voidaan luokitella vahvoiksi hapettimiksi. Mutta esimerkiksi P(+5) ja C(+4) palautetaan vaikeasti. Ja on lähes mahdotonta pakottaa Ca(+2) tai Na(+1) toimimaan hapettimena, vaikka muodollisesti katsottuna +2 ja +1 ovat myös korkeimmat hapetustilat.
Päinvastoin, monet klooriyhdisteet (+1) ovat voimakkaita hapettimia, vaikka hapetusaste +1 tässä tapauksessa on kaukana korkeimmasta.
F(-1) ja Cl(-1) ovat huonoja pelkistäviä aineita, kun taas niiden analogit (Br(-1) ja I(-1)) ovat hyviä. Alimmassa hapetusasteessa (-2) olevalla hapella ei käytännössä ole pelkistäviä ominaisuuksia, ja Te(-2) on voimakas pelkistävä aine.
Näemme, että kaikki ei ole niin ilmeistä kuin haluaisimme. Joissakin tapauksissa hapetus- ja pelkistyskyky on helposti ennakoitavissa, toisissa tapauksissa on vain muistettava, että aine X on esimerkiksi hyvä hapetin.
Näyttää siltä, että olemme vihdoin saavuttaneet tyypillisten hapettimien ja pelkistysaineiden luettelon. Haluaisin, että et vain "opista ulkoa" nämä kaavat (vaikka se olisi mukavaa!), vaan myös pystyisit selittämään, miksi tämä tai toinen aine sisältyy vastaavaan luetteloon.
Tyypillisiä hapettavia aineita
- Yksinkertaiset aineet - ei-metallit: F 2, O 2, O 3, Cl 2, Br 2.
- Väkevä rikkihappo (H 2 SO 4), typpihappo (HNO 3) missä tahansa pitoisuudessa, hypokloorihappo (HClO), perkloorihappo (HClO 4).
- Kaliumpermanganaatti ja kaliummanganaatti (KMnO 4 ja K 2 MnO 4), kromaatit ja dikromaatit (K 2 CrO 4 ja K 2 Cr 2 O 7), vismutaatit (esim. NaBiO 3).
- Kromin (VI), vismutin (V), lyijyn (IV), mangaanin (IV) oksidit.
- Hypokloriitit (NaClO), kloraatit (NaClO 3) ja perkloraatit (NaClO 4); nitraatit (KNO 3).
- Peroksidit, superoksidit, otsonidit, orgaaniset peroksidit, peroksohapot, kaikki muut -O-O- ryhmän sisältävät aineet (esimerkiksi vetyperoksidi - H 2 O 2, natriumperoksidi - Na 2 O 2, kaliumsuperoksidi - KO 2).
- Jännitesarjan oikealla puolella sijaitsevat metalli-ionit: Au 3+, Ag +.
Tyypillisiä pelkistäviä aineita
- Yksinkertaiset aineet - metallit: alkali ja maa-alkali, Mg, Al, Zn, Sn.
- Yksinkertaiset aineet - ei-metallit: H 2, C.
- Metallihydridit: LiH, CaH 2, litiumalumiinihydridi (LiAlH 4), natriumboorihydridi (NaBH 4).
- Joidenkin epämetallien hydridit: HI, HBr, H 2 S, H 2 Se, H 2 Te, PH 3, silaanit ja boraanit.
- Jodidit, bromidit, sulfidit, selenidit, fosfidit, nitridit, karbidit, nitriitit, hypofosfiitit, sulfiitit.
- Hiilimonoksidi (CO).
Haluaisin korostaa muutamaa kohtaa:
- En asettanut itselleni tavoitteeksi luetella kaikkia hapettavia ja pelkistäviä aineita. Tämä on mahdotonta, eikä se ole välttämätöntä.
- Sama aine voi toimia hapettimena yhdessä prosessissa ja hapettimena toisessa.
- Kukaan ei voi taata, että kohtaat varmasti jonkin näistä aineista C1-kokeen ongelmassa, mutta tämän todennäköisyys on erittäin korkea.
- Tärkeää ei ole kaavojen mekaaninen muistaminen, vaan YMMÄRTÄMINEN. Yritä testata itsesi: kirjoita aineet kahdesta luettelosta keskenään sekoitettuna ja yritä sitten erottaa ne itsenäisesti tyypillisiksi hapettimiksi ja pelkistyksiksi. Käytä samoja näkökohtia, joista keskustelimme tämän artikkelin alussa.
Ja nyt pieni testata. Tarjoan sinulle useita epätäydellisiä yhtälöitä, ja yrität löytää hapettimen ja pelkistimen. Yhtälöiden oikeaa puolta ei tarvitse vielä lisätä.
Esimerkki 12. Määritä hapettava aine ja pelkistävä aine ORR:ssä:
HNO3 + Zn = ...
CrO 3 + C 3 H 6 + H 2 SO 4 = ...
Na 2 SO 3 + Na 2 Cr 2 O 7 + H 2 SO 4 = ...
O 3 + Fe(OH) 2 + H 2 O = ...
CaH 2 + F 2 = ...
KMnO 4 + KNO 2 + KOH = ...
H 2 O 2 + K 2 S + KOH = ...
Luulen, että suoritit tämän tehtävän ilman vaikeuksia. Jos sinulla on ongelmia, lue tämän artikkelin alku uudelleen ja käsittele tyypillisten hapettimien luetteloa.
"Tämä kaikki on ihanaa!" kärsimätön lukija huudahtaa. "Mutta missä ovat luvatut ongelmat C1 epätäydellisillä yhtälöillä? Kyllä, esimerkissä 12 pystyimme määrittämään hapettimen ja hapettimen, mutta se ei ole pääasia. Tärkeintä on pystyä täyttämään reaktioyhtälö, ja voiko luettelo hapettimista auttaa meitä tässä?"
Kyllä, voi, jos ymmärrät MITÄ TAPAHTUU tyypillisille hapettimille erilaiset olosuhteet. Juuri näin teemme nyt.
Kuudes vaihe: joidenkin hapettimien muutokset eri ympäristöissä. Permanganaattien, kromaattien, typpi- ja rikkihappojen "kohtalo".
Meidän ei siis tarvitse vain tunnistaa tyypillisiä hapettimia, vaan myös ymmärtää, mihin nämä aineet muuttuvat redox-reaktion aikana. On selvää, että ilman tätä ymmärrystä emme pysty ratkaisemaan oikein tehtävää 30. Tilannetta mutkistaa se, että vuorovaikutuksen tuotteita ei voida osoittaa AINOASTI. Ei ole mitään järkeä kysyä: "Miksi kaliumpermanganaatti muuttuu pelkistysprosessin aikana?" Kaikki riippuu monista syistä. KMnO 4:n tapauksessa tärkein on alustan happamuus (pH). Periaatteessa talteenottotuotteiden luonne voi riippua seuraavista:
- prosessin aikana käytetty pelkistysaine,
- ympäristön happamuus,
- reaktioon osallistuneiden pitoisuudet,
- prosessin lämpötila.
Emme puhu nyt pitoisuuden ja lämpötilan vaikutuksesta (vaikka uteliaat nuoret kemistit saattavat muistaa, että esimerkiksi kloori ja bromi vuorovaikuttavat eri tavalla alkalin vesiliuoksen kanssa kylmässä ja kuumennettaessa). Keskitytään väliaineen pH-arvoon ja pelkistimen vahvuuteen.
Alla olevat tiedot ovat vain muistettavaa. Syitä ei tarvitse yrittää analysoida, vain MUISTA reaktiotuotteet. Vakuutan teille, että tästä voi olla hyötyä kemian yhtenäistetyssä valtionkokeessa.
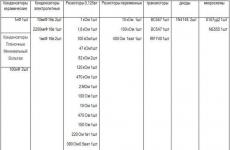
Kaliumpermanganaatin (KMnO 4) pelkistystuotteet erilaisissa väliaineissa
Esimerkki 13. Täydennä redox-reaktioiden yhtälöt:
KMnO 4 + H 2SO 4 + K 2 SO 3 = ...
KMnO 4 + H 2 O + K 2 SO 3 = ...
KMnO 4 + KOH + K 2 SO 3 = ...Ratkaisu. Tyypillisten hapettimien ja pelkistysaineiden luettelon ohjaamana tulemme siihen tulokseen, että hapetin kaikissa näissä reaktioissa on kaliumpermanganaatti ja pelkistävä aine kaliumsulfiitti.
H 2 SO 4, H 2 O ja KOH määrittävät liuoksen luonteen. Ensimmäisessä tapauksessa reaktio tapahtuu happamassa ympäristössä, toisessa - neutraalissa ympäristössä, kolmannessa - emäksisessä ympäristössä.
Johtopäätös: ensimmäisessä tapauksessa permanganaatti pelkistyy Mn(II)-suolaksi, toisessa - mangaanidioksidiksi, kolmannessa - kaliummanganaatiksi. Lisätään reaktioyhtälöt:
KMnO 4 + H 2SO 4 + K 2 SO 3 = MnSO 4 + ...
KMnO 4 + H 2 O + K 2 SO 3 = MnO 2 + ...
KMnO 4 + KOH + K 2 SO 3 = K 2 MnO 4 + ...Mihin kaliumsulfiitti muuttuu? No, luonnollisesti sulfaatiksi. On selvää, että K 2 SO 3:n koostumuksessa olevalla K:lla ei yksinkertaisesti ole enää paikkaa hapettumiseen, hapen hapettuminen on erittäin epätodennäköistä (vaikka periaatteessa mahdollista), mutta S(+4) muuttuu helposti S(+6:ksi) ). Hapetustuote on K 2 SO 4, voit lisätä tämän kaavan yhtälöihin:
KMnO 4 + H 2 SO 4 + K 2 SO 3 = MnSO 4 + K 2 SO 4 + ...
KMnO 4 + H 2 O + K 2 SO 3 = MnO 2 + K 2 SO 4 + ...
KMnO 4 + KOH + K 2 SO 3 = K 2 MnO 4 + K 2 SO 4 + ...Yhtälömme ovat melkein valmiit. Jäljelle jää vain lisätä aineet, jotka eivät ole suoraan mukana OVR:ssä, ja asettaa kertoimet. Muuten, jos aloitat toisesta pisteestä, se voi olla vieläkin helpompaa. Rakennetaan esimerkiksi elektroninen tasapaino viimeiselle reaktiolle
Mn(+7) + 1e = Mn(+6) (2) S(+4) - 2e = S(+6) (1) Laitamme kertoimen 2 kaavojen KMnO 4 ja K 2 MnO 4 eteen; ennen sulfiitin ja kaliumsulfaatin kaavoja tarkoitamme kerrointa. 1:
2KMnO4 + KOH + K 2SO 3 = 2K 2 MnO 4 + K 2 SO 4 + ...
Oikealla näemme 6 kaliumatomia, vasemmalla - toistaiseksi vain 5. Tilanne on korjattava; laita kerroin 2 KOH-kaavan eteen:
2KMnO4 + 2KOH + K 2SO 3 = 2K 2 MnO 4 + K 2 SO 4 + ...
Viimeistely: vasemmalla puolella näemme vetyatomeja, oikealla ei ole yhtään. On selvää, että meidän on kiireellisesti löydettävä jokin aine, joka sisältää vetyä hapetustilassa +1. Otetaan vähän vettä!
2KMnO4 + 2KOH + K 2SO 3 = 2K 2 MnO 4 + K 2 SO 4 + H 2 O
Tarkistetaan yhtälö uudelleen. Kyllä, kaikki on hienoa!
”Mielenkiintoinen elokuva!” valpas nuori kemisti huomauttaa. ”Miksi lisäsit tämän viimeinen askel erityisesti vettä? Entä jos haluan lisätä vetyperoksidia tai vain H2:ta tai kaliumhydridiä tai H2S:ää? Lisäsitkö vettä siksi, että se PITI lisätä, vai halusitko vain?
No, selvitetään se. No, ensinnäkin meillä ei luonnollisesti ole oikeutta lisätä aineita reaktioyhtälöön mielellään. Reaktio menee juuri niin kuin se menee; kuten luonto käski. Meidän mieltymyksemme ja inhoamme eivät voi vaikuttaa prosessin kulkuun. Voimme yrittää muuttaa reaktio-olosuhteita (nostaa lämpötilaa, lisätä katalyyttiä, muuttaa painetta), mutta jos reaktio-olosuhteet asetetaan, sen tulos ei voi enää riippua tahdostamme. Siten veden kaava viimeisen reaktion yhtälössä ei ole toiveeni, vaan tosiasia.
Toiseksi, voit yrittää tasoittaa reaktion tapauksissa, joissa veden sijaan on lueteltuja aineita. Vakuutan sinulle: et voi tehdä tätä missään tapauksessa.
Kolmanneksi vaihtoehdot H 2 O 2:lla, H 2:lla, KH:lla tai H 2 S:lla ovat yksinkertaisesti mahdottomia hyväksyä tässä tapauksessa syystä tai toisesta. Esimerkiksi ensimmäisessä tapauksessa hapen hapetusaste muuttuu, toisessa ja kolmannessa vedyn, ja sovimme, että hapetusaste muuttuu vain Mn:n ja S:n osalta. Neljännessä tapauksessa rikki toimi yleensä hapettavana aineena. ja sovimme, että S - pelkistävä aine. Lisäksi kaliumhydridi ei todennäköisesti "pysy hengissä" vesipitoisessa ympäristössä (ja muistutan teitä, että reaktio tapahtuu vesiliuoksessa), ja H 2 S (vaikka tämä aine olisi muodostunut) joutuu väistämättä liuos KOH:lla. Kuten näet, kemian tuntemus antaa meille mahdollisuuden hylätä nämä aineet.
"Mutta miksi vettä?" - kysyt.
Kyllä, koska esimerkiksi tässä prosessissa (kuten monissa muissakin) vesi toimii liuottimena. Koska esimerkiksi analysoit kaikkia reaktioita, jotka kirjoitit 4 vuoden kemian opiskelun aikana, huomaat, että H 2 O esiintyy lähes puolessa yhtälöistä. Vesi on yleensä melko "suosittu" yhdiste kemiassa.
Ymmärrä, etten väitä, että joka kerta tehtävässä 30 sinun täytyy "lähettää vetyä jonnekin" tai "ottaa happea jostain", sinun täytyy napata vettä. Mutta tämä olisi luultavasti ensimmäinen asia, jota mietitään.
Samanlaista logiikkaa käytetään reaktioyhtälöissä happamissa ja neutraaleissa väliaineissa. Ensimmäisessä tapauksessa sinun on lisättävä veden kaava oikealle puolelle, toisessa - kaliumhydroksidi:
KMnO 4 + H 2 SO 4 + K 2 SO 3 = MnSO 4 + K 2 SO 4 + H 2 O,
KMnO 4 + H 2O + K 2SO 3 = MnO 2 + K 2SO 4 + KOH.Kertoimien järjestelyn ei pitäisi aiheuttaa pienintäkään vaikeuksia kokeneille nuorille kemisteille. Lopullinen vastaus:
2KMnO4 + 3H2SO4 + 5K2SO3 = 2MnSO4 + 6K2SO4 + 3H20,
2KMnO4 + H20 + 3K2S03 = 2MnO2 + 3K2S04 + 2KOH.Seuraavassa osassa puhumme kromaattien ja dikromaattien, typpi- ja rikkihappojen pelkistystuotteista.