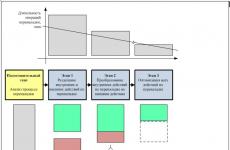
दहन का तापीय सिद्धांत. दहन सिद्धांत के मूल सिद्धांत. दहन के प्रकार, उनकी विशेषताएँ
दहन- ऑक्सीकरण एजेंट के साथ ज्वलनशील पदार्थों की तेजी से होने वाली रासायनिक बातचीत, साथ में बड़ी मात्रा में गर्मी और एक चमकदार चमक (लौ) निकलती है। दहन केवल तीन कारकों की उपस्थिति में संभव है: एक दहनशील पदार्थ, एक ऑक्सीडाइज़र और एक गर्मी स्रोत।
ताप स्रोत(आग) एक खुली लौ, एक चिंगारी, घर्षण (बेल्ट ड्राइव में बेल्ट), प्रभाव, दबाव के परिणामस्वरूप गर्म होने वाली गर्मी हो सकती है। ऊष्मा का स्रोत विद्युत (कंडक्टर, चाप का ताप), रासायनिक और सूर्य से आने वाली दीप्तिमान ऊर्जा भी हो सकता है।
ऑक्सीडाइज़िंग एजेंटक्लोरीन, फ्लोरीन, ब्रोमीन हैं। सबसे आम ऑक्सीकरण एजेंट वायुमंडलीय ऑक्सीजन है; दहन प्रक्रिया हवा में इसकी सामग्री पर निर्भर करेगी। यदि हवा में 14-16% से अधिक ऑक्सीजन है, तो स्थिर दहन देखा जाता है। जब ऑक्सीजन की मात्रा 14% से कम होती है, तो सुलगना देखा जाता है, और जब इसकी मात्रा 8-10% से कम होती है, तो सुलगना बंद हो जाता है।
ज्वलनशील पदार्थ. वे गैसें (अमोनिया, एसिटिलीन, हाइड्रोजन), तरल पदार्थ (गैसोलीन, एसीटोन, अल्कोहल), ठोस (कोयला, लकड़ी) हो सकते हैं। आग लगने के लिए ठोसया तरल पदार्थ, गर्मी स्रोत का उपयोग करके, उन्हें ऐसे तापमान तक गर्म करना आवश्यक है कि उनकी सतहों से ज्वलनशील वाष्प की तीव्र रिहाई हो। जब एक निश्चित सांद्रता तक पहुँच जाता है, तो ये वाष्प प्रज्वलित हो जाते हैं। दहन के दौरान गैसें अपने एकत्रीकरण की स्थिति को नहीं बदलती हैं।
निम्नलिखित प्रकार के दहन प्रतिष्ठित हैं: 1) फ्लैश; 2) इग्निशन; 3) आत्म-प्रज्वलन; 4) स्वतःस्फूर्त दहन; 5) सुलगना; 6)विस्फोट.
1. चमकवाष्प, गैसों, धूल के साथ हवा में ऑक्सीजन के मिश्रण का तात्कालिक दहन कहा जाता है, जो संपीड़ित गैसों के निर्माण के साथ नहीं होता है। फ़्लैश प्वाइंट सबसे ज्यादा है हल्का तापमानदहनशील पदार्थ, जिसकी सतह के ऊपर वाष्प या गैसें बनती हैं जो ज्वलन स्रोत से भड़क सकती हैं, लेकिन बाद के स्थिर दहन के लिए उनके गठन की दर अपर्याप्त होती है।
इस तापमान के मान के आधार पर, ज्वलनशील तरल पदार्थों को विभाजित किया जाता है:
ए) ज्वलनशील (ज्वलनशील तरल पदार्थ - गैसोलीन, एसीटोन, अल्कोहल) - टीएफ ≤ + 45 डिग्री सेल्सियस;
बी) ज्वलनशील तरल पदार्थ (जीजेडएच - तेल, डीजल ईंधन, ईंधन तेल) - चम्मच >+45° सेल्सियस।
2. इग्निशनऊष्मा स्रोत से किसी पदार्थ का स्थिर, दीर्घकालिक दहन कहलाता है। किसी ज्वलनशील पदार्थ का वह न्यूनतम तापमान जिस पर वह किसी ज्वलन स्रोत से प्रज्वलित होता है और उसके हटने के बाद भी जलता रहता है, ज्वलन तापमान कहलाता है। यह फ़्लैश बिंदु से अधिक है.
हवा में ज्वलनशील पदार्थों की सांद्रता, जिस पर प्रज्वलन या विस्फोट संभव है, कुछ सीमाओं के भीतर हैं: निचला - एनवीपी और ऊपरी - ईआरवी। एनवीपी (मिश्रण में दहनशील पदार्थ के पर्याप्त अणु नहीं) और वीपीवी (मिश्रण में पर्याप्त ऑक्सीजन अणु नहीं) से ऊपर की सांद्रता पर ज्वलनशील मिश्रण का प्रज्वलन असंभव है। ईआरडब्ल्यू और एनवीपी के बीच जितना अधिक अंतर होगा, पदार्थ उतना ही अधिक खतरनाक होगा। इन मापदंडों का मान कम हो सकता है, उदाहरण के लिए, धूल-वायु मिश्रण (डीएएम) की बढ़ती आर्द्रता के साथ, उदाहरण के लिए, चीनी, आटा और कोयले की धूल के साथ हवा का मिश्रण।
आइए हम गैसों और तरल वाष्पों की एक श्रृंखला के लिए एनवीपी और वीपीवी के मूल्यों का उदाहरण दें:
एसिटिलीन 3.5-82%;
प्राकृतिक गैस 3,8-19,2%;
गैसोलीन 1-6%;
कार्बन मोनोऑक्साइड 12.8-75%।
3.स्वयंजलन- इग्निशन तापमान पर इसके सीधे संपर्क के बिना किसी बाहरी स्रोत (लौ, गर्म या गर्म शरीर) से पदार्थों के प्रज्वलन की प्रक्रिया। बढ़ते दबाव के साथ यह तापमान कम हो जाएगा और अधिकांश दहनशील गैसों के लिए यह 400-700 डिग्री सेल्सियस की सीमा में है, लकड़ी के लिए - 340-400 डिग्री सेल्सियस; कोयला - 400-500 डिग्री सेल्सियस। स्व-प्रज्वलन का उदाहरण: खुली लौ (इसके संपर्क के बिना) या गर्म वस्तुओं (कोयले) के पास स्थित लकड़ी, कागज को गर्म करना और उसके बाद प्रज्वलित करना। खुला सर्पिलहीटर)।
4. स्वयमेव जल उठनापदार्थ पदार्थ (सामग्री) में होने वाली भौतिक, रासायनिक और जैविक प्रतिक्रियाओं के परिणामस्वरूप होता है, जिससे इग्निशन स्रोत की अनुपस्थिति में दहन होता है।
गीले अनाज, घास, पुआल और अपर्याप्त वेंटिलेशन की बड़ी मात्रा में भंडारण करते समय, गर्मी की रिहाई के साथ इन सामग्रियों के अंदर जैव रासायनिक प्रक्रियाएं (सड़न) होती हैं। इन सामग्रियों का तापमान बढ़ जाता है; उनका बड़ा द्रव्यमान (स्टैक, स्टैक) उत्पन्न गर्मी के अपव्यय को रोकता है पर्यावरण, जो आग का कारण बनता है। ऐसी सामग्रियों को भंडारण से पहले अच्छी तरह सुखा लेना चाहिए। संपर्क कपड़े (कामकाजी कपड़े, सफाई सामग्री) जिनमें तेल के दाग होते हैं और बिना वेंटिलेशन के ढेर लगे होते हैं, वे भी अनायास ही आग पकड़ लेते हैं। इसलिए, काम के कपड़ों को इस तरह से लटकाया जाना चाहिए ताकि हवा की मुफ्त पहुंच सुनिश्चित हो सके, और कार्य क्षेत्रों से तैलीय कपड़ों को तुरंत हटा दिया जाना चाहिए।
प्रतिक्रिया दर के आधार पर, दहन प्रक्रिया रूप में होती है सुलगनेवाला(गति कई सेमी/सेकेंड), वास्तव में दहन(कई मैसर्स) और विस्फोट(कई सौ और हजार मी/से)।
5. विस्फोट- उच्च तापमान, दबाव और रासायनिक अभिकर्मकों के प्रभाव में किसी पदार्थ की भौतिक और रासायनिक अवस्था में अचानक परिवर्तन। एक विस्फोट के दौरान, उत्पन्न गैसों और वाष्पों की मात्रा तेजी से बढ़ जाती है, भारी मात्रा में ऊर्जा निकलती है, जो सदमे की लहर के रूप में कार्य कर सकती है यांत्रिक कार्य(इमारतों, संरचनाओं को नष्ट करें, लोगों को घायल करें)।
सामग्रियों का दहन पूर्ण या अपूर्ण हो सकता है। पूर्ण दहन (अतिरिक्त ऑक्सीजन) के साथ, गैर-दहनशील उत्पाद (सीओ 2 और एच 2 ओ) बनते हैं। अपूर्ण दहन (ओ 2 की कमी) के साथ, अपूर्ण ऑक्सीकरण (सीओ, अल्कोहल, एसिड) के उत्पाद बनते हैं। वे विषैले और विस्फोटक हैं. इसलिए, ईंधन दहन प्रक्रिया (बॉयलर, भट्टियों में) का आयोजन करते समय, भट्ठी में पर्याप्त मात्रा में ऑक्सीजन सुनिश्चित करना आवश्यक है।
दहन की आणविक ऊर्जा
अधिकांश दहन प्रक्रियाओं में हवा में ऑक्सीजन के साथ हाइड्रोजन और कार्बन युक्त ईंधन का संयोजन शामिल होता है।
दहन के सिद्धांत की भौतिक और गणितीय नींव पर विचार करने से पहले, हम आणविक स्तर पर यह समझने की कोशिश करेंगे कि दहन ऊर्जा कहां से आती है, जिसकी रिहाई पर बाकी सब कुछ निर्भर करता है: गैस का ताप, सक्रिय की उपस्थिति इसमें रासायनिक केंद्र, आदि।
आइए देखें कि हवा में ऑक्सीजन के साथ कार्बन और हाइड्रोजन के संयोजन की मुख्य प्रतिक्रियाओं की ऊष्मा किससे बनी होती है।
आइए तालिका में दिए गए आंकड़ों के अनुसार लिखें। 3.1 ठोस कार्बन के अनुक्रमिक ऑक्सीकरण की प्रतिक्रियाओं का ऊर्जा संतुलन, उदाहरण के लिए ग्रेफाइट:
इस प्रकार, ठोस कार्बन की कुल ऑक्सीकरण प्रतिक्रिया में, 386 kJ/mol निकलता है:
जब हाइड्रोजन ऑक्सीजन के साथ संयोजित होता है तो निकलने वाली ऊर्जा भी परिमाण में समान होती है:
CO अणु शायद सबसे मजबूत है, इसकी बंधन ऊर्जा 1016 kJ/mol है। (अगला सबसे मजबूत N2 अणु है जिसकी बंधन ऊर्जा 892 kJ/mol है। दोनों अणुओं में बंधन इलेक्ट्रॉनों के तीन जोड़े हैं, रासायनिक भाषा में - तीन वैलेंस बांड। CO अणु में, पहला इलेक्ट्रॉन O से C तक जाता है , जिसके बाद O+ और C- नाइट्रोजन परमाणुओं के समान हो जाते हैं; इसकी पुष्टि CO अणु में एक द्विध्रुवीय क्षण की उपस्थिति से होती है।) CO2 अणु में, दूसरे ऑक्सीजन परमाणु का बंधन कमजोर होता है: तालिका के अनुसार। 3.1
इन यौगिकों में ऑक्सीजन की बंधन ऊर्जा मूल ऑक्सीजन अणु की बंधन ऊर्जा के बराबर है। क्योंकि
तब प्रति ऑक्सीजन परमाणु केवल 240 kJ/mol है। ऑक्सीजन अणु की कम बंधन ऊर्जा इसकी रासायनिक गतिविधि का कारण है और ऊर्जा स्रोत के रूप में ऑक्सीकरण के उपयोग का कारण है।
ग्रेफाइट (साथ ही हीरे और अनाकार कार्बन) के क्रिस्टल जाली में कार्बन परमाणु की बंधन ऊर्जा बहुत अधिक होती है। प्रतिक्रिया की अपेक्षाकृत छोटी ऊर्जा C(tv) + 0.5O2 = CO + 98 kJ/mol दो बहुत बड़े मूल्यों के बीच का अंतर है: CO (256 kJ/mol) की बंधन ऊर्जा से, किसी को आधी ऊर्जा घटानी होगी O2 को परमाणुओं (59 kJ/mol) में तोड़ना और कार्बन परमाणु के वाष्पीकरण की गर्मी को घटाना। दरअसल, वाष्पीकरण की गर्मी इसी तरह निर्धारित की जाती है, जो 671 kJ/mol के बराबर होती है। यह भी एक बहुत बड़ा मूल्य है.
ठोस कार्बन और हाइड्रोजन गैस का हाइड्रोकार्बन ईंधन में रूपांतरण ऊर्जा में एक छोटे से बदलाव के साथ होता है। दूसरी ओर, जब ऑक्सीजन को अल्कोहल, एल्डिहाइड और कीटोन, कार्बनिक अम्ल और कार्बोहाइड्रेट के कार्बनिक अणुओं में पेश किया जाता है, तो लगभग उतनी ही ऊर्जा निकलती है जितनी पूर्ण दहन (CO2 और H2O) के दौरान निकलती है, स्वाभाविक रूप से, ऑक्सीजन की समान मात्रा की खपत। इसलिए, हम मोटे तौर पर यह मान सकते हैं कि किसी भी कार्बनिक ईंधन के पूर्ण दहन से 419-500 kJ/mol उपभोगित ऑक्सीजन निकलती है। एकमात्र अपवाद कुछ एंडोथर्मिक, ऊर्जा-समृद्ध यौगिक हैं, जैसे एसिटिलीन और सायनोजेन, जिनकी दहन की गर्मी अधिक होती है।
अपूर्ण दहन न केवल ईंधन के प्रति अणु के लिए, बल्कि उपभोग किए गए ऑक्सीजन के प्रति अणु के लिए भी ऊर्जावान रूप से प्रतिकूल है। प्रतिक्रिया 2Q(s) + O2 = 2CO में, हाइड्रोजन जलाने पर 466 और CO जलाने पर 526 के बजाय केवल 210 kJ/mol निकलता है।
ठोस कार्बन में C परमाणु के मजबूत बंधन के कारण कार्बन वाष्पित नहीं हो पाता है। कार्बन केवल CO या CO2 के रूप में ऑक्सीजन के साथ मिलकर ठोस अवस्था छोड़ता है।
अधूरे दहन और कम तापमान के साथ, प्रतिक्रिया 2CO = CO2+ C(s)) + 41 kJ/mol केवल ठोस कार्बन की गणना करते समय ऊर्जावान रूप से अनुकूल होती है। जब प्रति मुक्त कार्बन परमाणु की गणना की जाती है, तो संबंधित प्रतिक्रिया 2CO = CO2 + C - 129 kJ/mol में एक बड़ा ऊर्जा अवरोध होता है। इसलिए, दहन के दौरान कालिख और कालिख केवल कार्बन कंकाल के साथ कार्बनिक अणुओं के अपघटन से बनती है, लेकिन सीओ से नहीं।
आइए अब नाइट्रोजन से जुड़ी ऑक्सीकरण प्रतिक्रियाओं की ओर मुड़ें।
नाइट्रोजन अणु N2 बहुत मजबूत है - इसकी पृथक्करण ऊर्जा 226 kJ/mol है। इसलिए, N2 और O2 को 2NO में परिवर्तित करने की प्रतिक्रिया एंडोथर्मिक है और, थर्मोडायनामिक कारणों से, केवल उच्च तापमान पर ही हो सकती है।
नाइट्रोजन और ऑक्सीजन से उच्च ऑक्साइड (NO2, N2O3, N2O4, N2O5) का निर्माण वस्तुतः ऊर्जा में कोई परिवर्तन नहीं होता है (N2 और O2 की बंधन ऊर्जा की तुलना में)। इसलिए, ऊर्जा के दृष्टिकोण से, नाइट्रोजन (CH3-ONO2 - नाइट्रोईथर, CH3(CeH2)(NO2)3 - ट्रिनिट्रोटोलुइन) के साथ यौगिकों में पैक की गई ऑक्सीजन लगभग गैसीय ऑक्सीजन के बराबर है। ऑक्सीजन एक कार्बनिक अणु में निर्मित होती है, लेकिन नाइट्रोजन से जुड़ी होती है, जिससे ऐसे पदार्थ बनाना संभव हो जाता है जो अधिक ऊर्जा छोड़ते हैं जब अणु एन 2 के गठन के साथ पुनर्व्यवस्थित होता है और ऑक्सीजन का सीओ 2 और एच 2 ओ अणुओं में संक्रमण होता है। इस कारण से, ऐसे यौगिक जिनमें ऑक्सीजन को नाइट्रोजन (साथ ही क्लोरीन, क्लो3, क्लो4 समूहों में) के साथ जोड़ा जाता है, का उपयोग बारूद और विस्फोटक के रूप में किया जाता है।
इसके बारे में ये सामान्य विचार हैं आणविक ऊर्जादहन।
हम रसायन विज्ञान की शास्त्रीय बुनियादी बातों के बारे में बात करना जारी रखते हैं, जो किसी भी अभ्यास करने वाले आतिशबाज़ी बनाने वाले के लिए आवश्यक हैं। BA-BAH किसी को भी याद दिलाता है व्यावहारिक पाठआतिशबाज़ी बनाना एक खतरनाक उपक्रम है जब तक कि यह सख्त सिद्धांत पर आधारित न हो। हम अनुशंसा करते हैं कि वे पाठक जो मानते हैं कि यह उनके जीवन का उद्देश्य बन सकता है, उदाहरण के लिए, सर्गिएव पोसाद में रिसर्च इंस्टीट्यूट ऑफ एप्लाइड केमिस्ट्री में अध्ययन का पूरा कोर्स करें।
कनेक्शनों का उल्लेख करते समय, हमने संकेत दिया कि उनका मुख्य कारण तत्वों के बीच संबंध की डिग्री है। अन्यथा, तत्व कुछ पदार्थों की उपस्थिति में उदासीन रहते हैं और दूसरों के साथ जुड़ने की कमोबेश तीव्र इच्छा के अधीन होते हैं। उदाहरण के लिए, चूना आसानी से भारी क्लोरीन गैस को अवशोषित कर लेता है, यानी। इसके साथ मिलकर क्लोरीन चूना बनाता है; पारा पिघले हुए सल्फर के साथ मिलकर "सिनाबार" नामक प्रसिद्ध चमकीला लाल पदार्थ बनाता है। सिनेबार (ज़िन्नोबर) को एक ऐसे पदार्थ के साथ मिलाकर फिर से सल्फर और पारे में विघटित किया जा सकता है, जिसके घटक तत्वों में से एक (उदाहरण के लिए, सल्फर) में उसके साथी (यानी, पारा) की तुलना में अधिक मजबूत आकर्षण होगा - जिसके बाद और किसी चीज़ से जुड़ा दूसरा तत्व चौथे पदार्थ के माध्यम से उसी क्रम में जारी किया जा सकता है। ऐसी रिलीज़ या रिलीज़ हमेशा पूर्ण नहीं होती है, लेकिन अक्सर आंशिक रिलीज़ पर्याप्त होती है, जिसे सैद्धांतिक रूप से सूत्रों का उपयोग करके गणना की जा सकती है।
आत्मीयता के बहुत सामान्य परिणामों में से एक, जो हर कदम पर दोहराया जाता है, वह गुण है जिसे "हाइग्रोस्कोपिसिटी" कहा जाता है, अर्थात। नम होने, भीगने, या अन्यथा नमी को अवशोषित करने और एसिड-हाइड्रोजन यौगिक बनाने की क्षमता। कई पदार्थों में यह गुण होता है, और, वैसे, टेबल नमक और सल्फ्यूरिक एसिड, जिन्हें बीच में रखा जाता है खिड़की की फ्रेमअपने अंदर नमी खींचना; बुझा हुआ चूना, पानी के संपर्क में आने पर उबलना; जिलेटिन, जिसका उपयोग शराब आदि को निर्जलित करने के लिए किया जाता है। एक आतिशबाज़ी बनाने वाले के लिए, हाइज्रोस्कोपिसिटी एक खराब संपत्ति है जिसे ध्यान में रखा जाना चाहिए। उदाहरण के लिए, अत्यधिक हीड्रोस्कोपिसिटी के कारण स्ट्रोंटियन क्लोराइड और नाइट्रेट का उपयोग करना हमेशा संभव नहीं होता है, हालांकि इन पदार्थों में बहुमूल्य आतिशबाज़ी गुण होते हैं; और सामान्य तौर पर सभी रचनाओं को नमी के प्रभाव से सावधानीपूर्वक संरक्षित किया जाना चाहिए। लेकिन आतिशबाज़ी रसायन विज्ञान में सबसे महत्वपूर्ण भूमिका "दहन" (वर्ब्रेनुंग, दहन) नामक यौगिकों द्वारा निभाई जाती है।
व्यापक अर्थ में "दहन" या "जलने" की अभिव्यक्ति से, रसायन विज्ञान का मतलब आम तौर पर दो निकायों के प्रत्येक रासायनिक संयोजन से एक तिहाई का निर्माण होता है; निकटतम अर्थ में यह ऑक्सीजन के साथ शरीर के संबंध को संदर्भित करता है।
स्पष्टीकरण के लिए, आइए, हमेशा की तरह, प्रयोगों की ओर मुड़ें। मिक्स एक निश्चित मात्रासल्फर की एक निश्चित मात्रा के साथ लोहे का बुरादा और मिश्रण को थोड़ा गर्म करें; तो यह मिश्रण तुरंत गर्म हो जाएगा और जल्दी पिघल जाएगा। इस प्रकार प्राप्त मिश्र धातु अब सल्फर या लोहा नहीं है: लोहा सल्फर के साथ जल जाता है, अर्थात। रासायनिक रूप से इसके साथ संयुक्त, और परिणामस्वरूप एक नया शरीर बना - लोहा या सल्फर (एक या दूसरे घटक की प्रबलता के आधार पर) पाइराइट।
एक क्रूसिबल में सल्फर को पिघलाएं, मिश्र धातु को उबाल लें और इसमें तांबे के तार के टुकड़े डालें: यह तार सल्फर के साथ जल जाएगा, जिससे एक अद्भुत लाल रंग निकलेगा; परिणाम एक विशेष यौगिक है - कॉपर सल्फाइड, या कॉपर चमक। आप इसे तांबे के साथ भी इसी तरह से जला सकते हैं, यानी। इसके साथ कई पिंडों को जोड़ें: सीसा, टिन, जस्ता, आदि।
कार्बन डाइसल्फ़ाइड एक रंगहीन, अत्यधिक बदबूदार तरल है जो 48°R (कार्बन डाइसल्फ़ाइड (CS 2) का गलनांक = -112°C) पर भी नहीं जमता - गर्म कोयले के साथ सल्फर वाष्प के संयोजन से बनता है। दोनों मुख्य पिंड जल जायेंगे अर्थात् एक होकर द्रव में बदल जायेंगे।
वही समानता धातुओं (लोहा, तांबा, जस्ता, एंटीमोनियम, आर्सेनिक, आदि) के बीच मौजूद है जो पहले उल्लेखित "क्लोरीन" नामक गैस के साथ गर्मी की स्थिति में हैं: लोहा, तांबा, जस्ता, आदि। क्लोरीन के साथ फेरिक क्लोराइड, कॉपर क्लोराइड, जिंक क्लोराइड, लेड क्लोराइड आदि में जलाएं, जिससे तेज गर्मी पैदा हो और विशेष प्रकाश उत्सर्जित हो। क्लोरीन गैस के संपर्क में पिघला हुआ सल्फर नीली लौ के साथ जलता है और सल्फर क्लोराइड में बदल जाता है; कुचला हुआ एंटीमनी या बारीक आर्सेनिक, क्लोरीन से भरे बर्तन में रखा जाता है, अपने आप प्रज्वलित हो जाता है और मिलकर आर्सेनिक क्लोराइड या एंटीमनी क्लोराइड बनाता है।
दोनों मामलों में, समानता के कारण, विभिन्न निकायों का संयोजन हुआ, या तो सल्फर के साथ या क्लोरीन के साथ, और गर्मी और प्रकाश की रिहाई दिखाई दी।
बिल्कुल उन्हीं परिस्थितियों में, एक अन्य गैस - ऑक्सीजन - के साथ विभिन्न पिंडों के यौगिक बनते हैं।
प्रत्युत्तर कनेक्ट करें ( कांच का बर्तनआसवन के लिए), जिसमें पारा रखा जाता है, एक कांच की टोपी के अंदर बाहरी हवा से सील कर दिया जाता है। पारे को लगभग क्वथनांक तक गर्म करें: पारा जलेगा नहीं, लेकिन अपनी धात्विक चमक, अपना पूर्व चांदी जैसा रंग और अपनी बूंद-तरल अवस्था खो देगा - यह एक लाल रंग के पाउडर में बदल जाएगा, जो पूर्व धातु से उसी तरह संबंधित होगा जैसे कि कोयला लकड़ी है. यदि प्रयोग शुरू होने से पहले आपने हुड के नीचे मौजूद पारे और हवा दोनों को सटीक रूप से तौला है, और अब दोनों को फिर से तौलते हैं, तो यह पता चलेगा कि हवा में वजन की कमी है, और पाउडर में अधिकता है, और बिल्कुल वैसा ही. यदि, उदाहरण के लिए, हुड के नीचे की हवा का वजन ठीक 1000 ग्राम था, तो अब इसका वजन केवल 767 ग्राम है; लेकिन पाउडर का वजन पारे से 233 ग्राम अधिक है। अब विपरीत प्रयोग करें: पाउडर को पानी से आधी भरी कांच की बोतल से जुड़े एक छोटे रिटॉर्ट में रखें। रिटॉर्ट को उच्च अल्कोहल ताप पर गर्म करें: पाउडर भाप में बदल जाएगा, जो पानी से गुजरते हुए दो भागों में विभाजित हो जाएगा: एक धात्विक अवक्षेप में जिसमें शुद्ध बूंद जैसा तरल पारा और सिलेंडर में एकत्रित ऑक्सीजन शामिल होगा।
ऑक्सीजन गर्म लोहे या पिघले तांबे के संबंध में गर्म पारे के समान ही आत्मीयता प्रदर्शित करती है: हवा के संपर्क के दौरान, ये धातुएं हवा में निहित ऑक्सीजन के साथ सतह पर लालच से संसेचित हो जाती हैं और तांबे या लोहे के स्केल (स्लैग) का निर्माण करती हैं, अर्थात। लोहे या तांबे का "ऑक्साइड" (ऑक्सीजन के साथ मिलकर), चमकीले रंग की चिंगारी पैदा करता है।
इन सभी मामलों में, एक ही घटना हुई: ऑक्सीजन के साथ संयोजन, या इन निकायों का ऑक्सीकरण (ऑक्सीकरण) - न केवल गर्मी के प्रभाव में, बल्कि गर्मी और प्रकाश की रिहाई के साथ भी, ताकि गर्मी और प्रकाश, यानी। जिसे आमतौर पर "दहन" कहा जाता है वह एक दुष्प्रभाव, एक प्रत्यक्ष परिणाम, या बल्कि एक सशक्त अभिव्यक्ति है, जिसे प्राचीन लोग एक विशेष तत्व मानते थे, जिसके सिद्धांत को वे "फ़्लॉजिस्टन" कहते थे।
लेकिन ऑक्सीकरण न केवल आग की मध्यस्थता के बिना हो सकता है, बल्कि गर्मी की ध्यान देने योग्य रिहाई के बिना भी हो सकता है: यदि लोहे को हवा के संपर्क में रखा जाता है, तो यह जंग से ढक जाएगा। यह जंग ऑक्सीकरण के उत्पाद, अर्थात् लौह ऑक्साइड या जला हुआ लोहा से अधिक कुछ नहीं है।
दहन प्रक्रिया ध्यान देने योग्य गर्मी रिलीज के बिना ही रही क्योंकि ऑक्सीकरण स्वयं बहुत धीरे-धीरे हुआ। लकड़ी का ऑक्सीकरण कुछ अधिक स्पष्ट रूप से होता है: सड़ी हुई लकड़ी अंधेरे में चमकती है; यदि आप सड़ी हुई मिट्टी के ढेर में अपना हाथ डालते हैं, तो आपको गर्मी महसूस होती है; ढेर ही दिन-ब-दिन कम होता जा रहा है; दूसरे शब्दों में, लकड़ी हवा में धीरे-धीरे जलती (सुलगती) है।
इससे भी अधिक ध्यान देने योग्य आमद है ताजी हवासुलगने के दौरान: यदि आप गर्म कोयले या धीरे-धीरे सुलगती लकड़ी पर (उदाहरण के लिए, धौंकनी से) हवा की एक धारा फेंकते हैं, तो तुरंत एक लौ दिखाई देगी। प्रक्रिया इस प्रकार है: लकड़ी में दो दहनशील निकाय होते हैं - कार्बन और हाइड्रोजन; पहला ऑक्सीजन के साथ जुड़ता है और जलने पर कार्बन डाइऑक्साइड या कार्बन डाइऑक्साइड में बदल जाता है, और दूसरा ऑक्सीजन या पानी में बदल जाता है।
कोई ज्वलनशील पदार्थ, वी रोजमर्रा की जिंदगीजिसे ईंधन या प्रकाश सामग्री कहा जाता है, समान नियमों के आधार पर जलता है। उदाहरण के लिए, चरबी और तेल में मुख्य रूप से कार्बन और हाइड्रोजन होते हैं; दोनों में ऑक्सीजन और दहन की पूरी प्रक्रिया के लिए महत्वपूर्ण समानता है, यानी। ऑक्सीकरण में यह तथ्य शामिल है कि ऑक्सीजन एक ज्वलनशील पदार्थ को उसके घटक भागों में विघटित करता है और उनमें से प्रत्येक के साथ अलग से जुड़ता है।
बिल्कुल वैसा ही ऑक्सीकरण जानवरों के शरीर में होता है: शरीर के नाइट्रोजनयुक्त (वसायुक्त) हिस्से ऑक्सीजन के संपर्क से ऑक्सीकरण करते हैं, या जलते हैं, जिसका संवाहक रक्त है, और परिणाम जानवरों की गर्मी है।
लेकिन जिस तरह ऑक्सीकरण बहुत धीरे-धीरे हो सकता है, उसी तरह यह बेहद तेज़ और जोरदार भी हो सकता है। उदाहरण के लिए, लाल फास्फोरस पड़ा हुआ है सड़क पर, न केवल सुलगता और चमकता है, बल्कि, डाला जा रहा है बड़ी मात्रा, धीरे-धीरे पिघलता है और अंततः प्रज्वलित हो जाता है (सहज दहन)। रासायनिक रूप से शुद्ध लोहे का बेहतरीन पाउडर बाहरी हवा के संपर्क में आने पर प्रज्वलित हो जाता है। अंत में, धातु सोडियम, जैसे ही पानी में जाता है, पानी में निहित ऑक्सीजन को अवशोषित करने के लिए तुरंत इसे अपने घटक भागों में विघटित कर देता है, और, इसके अलावा, इतनी ऊर्जावान रूप से कि जारी गर्मी एक अन्य गैस, हाइड्रोजन को प्रज्वलित करने में सक्षम होती है। , ऑक्सीजन के साथ सोडियम के संयोजन से मुक्त होता है। तो हाइड्रोजन एक रंगहीन लौ के साथ जलती है और, वायुमंडलीय ऑक्सीजन के साथ मिलकर, फिर से पानी में बदल जाती है। अत: सोडियम नीचे पाया जाता है खनिज तेल, क्योंकि यह तेल एक हाइड्रोकार्बन यौगिक है जिसमें ऑक्सीजन नहीं होता है।
उपरोक्त सभी से, कई सम्मोहक निष्कर्ष निकाले जा सकते हैं:
- रोजमर्रा की जिंदगी में जिसे हम दहन कहते हैं, यानी। लौ, प्रकाश और गर्मी की उपस्थिति के लिए दो निकायों की उपस्थिति की आवश्यकता होती है: दहनशील पदार्थ और ऑक्सीजन।
- दहन प्रक्रिया में, सबसे पहले, उन हिस्सों की रिहाई के साथ दहनशील सामग्री का अपघटन होता है जो ऑक्सीजन के साथ जुड़ते हैं, और दूसरी बात, इस कनेक्शन की प्रक्रिया में ही, यानी। ऑक्सीकरण में. पर्याप्त ताप के साथ ज्वलनशील पदार्थों के ऑक्सीकरण का उत्पाद मुख्य रूप से इन पदार्थों का कार्बोनिक एसिड और पानी में परिवर्तन है।
- क्योंकि प्रकृति में, ऑक्सीजन कभी भी पृथक रूप में नहीं पाई जाती है, लेकिन संयुक्त होने पर, एक दहनशील पदार्थ इसे वायुमंडल से, पानी से या किसी अन्य जटिल शरीर से निकालता है जिसमें ऑक्सीजन होता है; इसे देखते हुए, जो शरीर ऑक्सीजन छोड़ते हैं उन्हें ऑक्सीडाइज़र कहा जाता है, जो शरीर ऑक्सीकृत होते हैं उन्हें आधार कहा जाता है, और जो पदार्थ ऑक्सीजन की रिहाई का कारण बनते हैं या बढ़ाते हैं उन्हें डीकंपोजर कहा जाता है। आतिशबाज़ी की तैयारी और आतिशबाजी मिश्रण की संरचना में आमतौर पर इन तीन समूहों में से प्रत्येक के प्रतिनिधि शामिल होते हैं, लेकिन अपवाद हैं: कुछ मामलों में, एक आधार और एक ऑक्सीकरण एजेंट पर्याप्त होते हैं (उदाहरण के लिए, पोटेशियम परमैंगनेट के साथ एल्यूमीनियम); अन्य में, हालांकि बहुत ही दुर्लभ मामलों में, केवल आधार, यदि यह पर्याप्त रूप से ऑक्सीजन युक्त है (उदाहरण के लिए, मैग्नीशियम, लाइकोपोडियम, आदि)।
- ऑक्सीकरण एजेंट की भागीदारी के बिना, आधार नहीं जलता है, लेकिन यदि आप इसमें कोई ऐसा पदार्थ मिलाते हैं जो आधार के साथ मिलकर इसे विघटित कर सकता है, तो मिश्रण ज्वलनशील हो जाता है। ऐसे आधार, जो स्वयं ज्वलनशील नहीं हैं, हैं: जस्ता, सोडियम, सीसा, बेरियम, पोटेशियम, स्ट्रोंटियम, परक्लोरिक और नाइट्रेट लवण, आदि। दहनशील अशुद्धियाँ जो आधार के अपघटन में योगदान करती हैं वे हैं: सल्फर, कोयला, कालिख, चीनी, स्टार्च, डेक्सट्रिन, शेलैक, गोंद लाख, लार्ड, आदि। एक उदाहरण है साल्टपीटर (पोटेशियम नाइट्रेट): साल्टपीटर स्वयं नहीं जलता है, लेकिन यदि आप इसे सल्फर के साथ मिलाते हैं, तो आपको एक ज्वलनशील मिश्रण मिलता है, क्योंकि सल्फर नाइट्रेट को विघटित करता है और उसकी ऑक्सीजन छीन लेता है, जिसके साथ मिलकर वह सल्फ्यूरस एसिड बनाता है। यही बात तब देखी जाती है जब सल्फर को बर्थोलाइट नमक (काली क्लिलोरिकम) या पोटेशियम परमैंगनेट (काली हाइपमैंगनियम) के साथ मिलाया जाता है। यदि संरचना कोयले, कालिख या सेल्युलोज से सल्फर और साल्टपीटर के मिश्रण के साथ आधार के रूप में बनाई जाती है, तो साल्टपीटर ऑक्सीकरण एजेंट के रूप में कार्य करता है, और सल्फर एक डीकंपोजर के रूप में कार्य करता है। प्रक्रिया इस प्रकार है: कोयला अपने नाइट्रिक एसिड के ऑक्सीजन के साथ मिलकर नाइट्रेट को विघटित करता है, और ऑक्सीजन और कोयला मिलकर गैसीय कार्बोनिक एसिड बनाते हैं, और नाइट्रोजन निकलती है। सल्फर अपघटन को बढ़ावा देता है, और सबसे महत्वपूर्ण बात, पोटेशियम के साथ कार्बोनिक एसिड के संयोजन को रोकता है: वही कनेक्शन एक ठोस - पोटाश का निर्माण करेगा। सल्फर की उपस्थिति के बिना, कार्बोनिक एसिड का आधा हिस्सा एक ठोस यौगिक में बदल जाएगा।
- ऑक्सीजन की उपस्थिति के बिना, दहन अकल्पनीय है, इसलिए मिट्टी के तेल के नीचे संग्रहीत सोडियम नहीं जलता है; फॉस्फोरस, एक भली भांति बंद करके सील किए गए हुड के नीचे जलाया जाता है, जब ऑक्सीजन की उपलब्ध आपूर्ति समाप्त हो जाती है (हुड के नीचे हवा की कुल घन सामग्री का लगभग 1/5); कार्बन से भरे "डॉग ग्रोटो" में रखे गए जानवरों का दम घुट जाता है और... वगैरह।
लेकिन यद्यपि रोजमर्रा की जिंदगी में ऑक्सीजन का मुख्य भंडार वायुमंडलीय वायु है, रसायन विज्ञान कई अन्य ऑक्सीकरण एजेंटों की ओर इशारा करता है, जिनकी मदद से पानी के नीचे और अंतरिक्ष में दहन किया जा सकता है - या तो पूरी तरह से वायुहीन या गैसों से संपन्न जिसमें वहां ऑक्सीजन का परमाणु नहीं है. ऐसे ऑक्सीकरण एजेंट, जो वायुमंडलीय हवा की भागीदारी के बिना संरचना के पूर्ण दहन के लिए पर्याप्त मात्रा में ऑक्सीजन जारी करने में सक्षम हैं, सॉल्टपीटर, बर्थोलाइट नमक और कई अन्य पहले से उल्लिखित निकाय हैं। उदाहरण के लिए, सॉल्टपीटर के लिए धन्यवाद, बारूद वायुमंडलीय हवा की भागीदारी के बिना बंदूक या तोप के थूथन में जलने की क्षमता प्राप्त कर लेता है; पानी के नीचे दहन संभव है बशर्ते कि मिश्रण में एक ऑक्सीकरण एजेंट हो जो न केवल संरचना को पूरी तरह से जला सके, बल्कि पानी के नीचे दहन प्रक्रिया के दौरान आवश्यक ऊंचाई पर तापमान बनाए रख सके।
उपरोक्त के आधार पर, हम ध्यान दें कि दहनशील पदार्थों (उदाहरण के लिए, ईंधन) का गैस में परिवर्तन पर्याप्त रूप से होता है उच्च तापमानचार स्थितियों में हो सकता है: ए) हवा तक पहुंच के बिना हीटिंग, और, परिणामस्वरूप, ऑक्सीजन (कोयला, कोक, प्रकाश गैस); बी) रासायनिक रूप से बाध्य ऑक्सीजन (एच 2 ओ, सीओ 2) की उपस्थिति में हीटिंग: जल गैस; ग) मुक्त ऑक्सीजन (वायु) के सीमित प्रवाह के साथ: जनरेटर गैस; घ) पर्याप्त वायु पहुंच (साधारण फायरबॉक्स) या ऑक्सीजन के बढ़े हुए प्रवाह (ड्राफ्ट) के साथ। - ऑक्सीकरण प्रक्रिया जितनी अधिक तीव्रता से होती है और ऑक्सीकरण एजेंट और डीकंपोजर के साथ आधार की रासायनिक आत्मीयता जितनी करीब होती है, प्रकाश और गर्मी की अभिव्यक्ति उतनी ही मजबूत और तेज होती है। एक और परिस्थिति ऊपर नोट की गई थी: अन्य मामलों में, मनमाना ऑक्सीकरण होता है (सुलगना, जंग लगना, सहज दहन), जबकि अन्य में कनेक्शन (ऑक्सीकरण) पैदा करने के लिए तापमान को एक निश्चित मानक तक बढ़ाना (वस्तु को गर्म करना) आवश्यक है। गर्म धातुओं का, क्लोरीन और सल्फर के साथ उनका संयोजन, मोमबत्ती जलाना, जलाऊ लकड़ी, दीपक, मिट्टी का तेल, बारूद का प्रज्वलन, आदि)।
इसके अलावा: प्रक्रिया का आगे का कोर्स जल्दी या धीरे-धीरे हो सकता है।
इसलिए, आग के प्रति दहनशील सामग्री की संवेदनशीलता के दो अलग-अलग गुणों (यानी, ऑक्सीकरण की बाहरी अभिव्यक्ति) के बीच अंतर करना आवश्यक है: ज्वलनशीलता और दहनशीलता। पहला उस तापमान को इंगित करता है जिस पर दहन होता है (ऑक्सीकरण की शुरुआत), और दूसरा ऑक्सीकरण प्रक्रिया की गति को इंगित करता है। एक आतिशबाज़ी बनाने वाले के लिए, एक और दूसरे दोनों को सटीक रूप से जानना आवश्यक है, क्योंकि रचनाओं का रासायनिक अनुमान पूरी तरह से इसके ज्ञान पर निर्भर करता है, उनके ज्वलन के अर्थ में, और प्रकाश की तीव्रता और अवधि के संबंध में। दहन।
गर्मी के कारण होने वाली रासायनिक घटनाओं के संबंध में, रुडोल्फ वैगनर निम्नलिखित कहते हैं: "रासायनिक संयोजनों और अपघटनों में थर्मल घटनाओं का विज्ञान, "थर्मोकैमिस्ट्री", अभी भी विभिन्न अपघटनों और तैयारी के तरीकों की व्याख्या करने में सक्षम होने से बहुत दूर है। रासायनिक उत्पादन, लेकिन यह पहले से ही रासायनिक प्रतिक्रियाओं की अधिक या कम संभावना और व्यवहार्यता के संबंध में निर्देश देता है, क्योंकि सामान्य तौर पर, गर्मी की रिहाई के साथ बनने वाले यौगिकों को प्राप्त करना सबसे आसान होता है, जबकि गर्मी के अवशोषण के साथ होने वाली प्रतिक्रियाएं ज्यादातर मामलों में अधिक कठिन होती हैं।
ऊष्मा की एक इकाई पानी के एक इकाई वजन को 0 से 1 डिग्री सेल्सियस तक गर्म करने के लिए आवश्यक मात्रा है। दशमलव प्रणाली के अनुसार, वजन की इकाई ग्राम (सेमी 3) है; ऊष्मा की रासायनिक इकाई जिसे "कैलोरी" कहा जाता है, को "कैल" प्रतीक द्वारा दर्शाया जाता है, और 1000 कैलोरी को "कैल" प्रतीक द्वारा दर्शाया जाता है। प्रतीक "K" (किग्रा) 1 ग्राम पानी को उसके क्वथनांक से उसके हिमांक तक ठंडा करने पर निकलने वाली गर्मी की मात्रा को व्यक्त करता है। ऊष्मा का यांत्रिक तुल्यांक 425 किग्रा/मीटर है।
दहन के प्रभाव और उत्पाद
पूर्ण दहन मौजूद नहीं है: दहनशील संरचना के वे हिस्से जो गैसों में परिवर्तित नहीं हुए हैं वे या तो धुआं या तलछट बनाते हैं। धुआं बिना जले हुए पदार्थ से अधिक कुछ नहीं है जो महीन धूल में बदल गया है और हवा के प्रवाह द्वारा दूर ले जाया गया है। ऐसा शरीर, वैसे, कालिख (बिना जली लकड़ी का अवशेष), कालिख (बिना जले वसायुक्त शरीर का अवशेष), कोयले की चिमनी का धुआं (कारखाने के कस्बों पर हजारों पाउंड का लटका हुआ है और अब पूरे समाज द्वारा शोषण किया जाता है), वगैरह। तलछट अक्सर न केवल एक बिना जला हुआ, बल्कि एक गैर-दहनशील (अग्निरोधक) रासायनिक यौगिक भी बनाता है।
इसलिए, तत्काल कार्य आतिशबाज़ी बनाने की विद्याइसमें ऐसी रचनाओं को इकट्ठा करना शामिल है जो धुएं और तलछट के कम से कम उत्सर्जन के साथ जल सकें।

दहन के कारण आग लपटों या चिंगारी के रूप में प्रकट होती है; गैसों की लौ अपने आप बिल्कुल भी चमकती नहीं है (जैसे, उदाहरण के लिए, सोडियम को पानी में डुबाने पर हाइड्रोजन का जलना); अग्नि में सघन पिंडों की उपस्थिति के कारण प्रकाश और उसका रंग प्राप्त होता है। इसलिए, उदाहरण के लिए, प्रदीप्त गैस की पीली रोशनी इसलिए होती है क्योंकि इस गैस में हाइड्रोजन और कार्बन होते हैं; हाइड्रोजन में कार्बन की तुलना में अधिक ऑक्सीकरण शक्ति होती है और यह तेजी से और अधिक परिपूर्णता से जलता है, और कार्बन, आग में अधिक मात्रा में जमा होकर, लौ को हल्का और पीला रंग देता है। इसलिए, यह पता लगाने के लिए कि क्या कोई लौ धूम्रपान कर रही है, किसी विदेशी वस्तु को बीच में चिपका देना पर्याप्त है, जहां हवा की पहुंच कम से कम हो: यह तुरंत कालिख की परत से ढक जाएगा।
यह ठोस पिंड हैं जो लौ को प्रकाश देते हैं, यह निम्नलिखित से सिद्ध होता है: सभी मौजूदा पिंडों में से, हाइड्रोजन दहन के दौरान सबसे अधिक गर्मी छोड़ता है, क्योंकि प्लैटिनम और रॉक क्रिस्टल दोनों को पिघला देता है; लेकिन इसकी लौ अत्यंत पीली होती है जबकि केवल गैसें - हाइड्रोजन और जल वाष्प - ऑक्सीकरण तत्वों के रूप में काम करती हैं, लेकिन जैसे ही किसी घने पदार्थ (उदाहरण के लिए, लोहा, कोयला, संगमरमर) का मिश्रण दिखाई देता है, एक चमकदार रोशनी प्राप्त होती है (ड्रमंड की रोशनी) ).
प्रकाश की तीव्रता सीधे ऑक्सीकरण की ऊर्जा पर निर्भर करती है: उत्तरार्द्ध जितना मजबूत होगा, दहन तापमान उतना ही अधिक होगा, और इसलिए, ठोस अशुद्धियों का दहन उतना ही मजबूत होगा। इसलिए, उदाहरण के लिए, अल्कोहल की आग, गर्म हवा के साथ मिश्रित रोशन करने वाली गैस, और अंत में, एक यूनिका गैसोलीन बर्नर बहुत हल्की लौ पैदा करता है, लेकिन ज्ञात अशुद्धियों के माध्यम से महत्वपूर्ण चमकदार तीव्रता पैदा करने में सक्षम है: बिजली के प्रकाश बल्ब पीले, कमजोर रोशनी पैदा करते हैं , और बिजली की मशालें - सफेद, चमकदार चमक, क्योंकि पहले मामले में विद्युत वोल्टेजदूसरे की तुलना में अतुलनीय रूप से कम ऊर्जावान।
विशेष रुचि वाले एयूआर बर्नर हैं, जिनका उपयोग अब न केवल गैस को रोशन करने के लिए किया जाता है, बल्कि गैसोलीन, अल्कोहल, एसिटिलीन और अन्य प्रकाश स्रोतों के लिए भी किया जाता है: ये बर्नर, दुर्दम्य निकायों के मिश्रण से मिलकर, एक मजबूत ताप स्रोत की कमजोर रोशनी को एक में बदल देते हैं। चमकीला, हरा या नीला। सफेद रोशनी।
प्रकाश की चमक बढ़ाने और लौ को बढ़ाने के लिए, एंटीमोनियम, कोयला और अन्य पदार्थों का उपयोग आतिशबाज़ी रचनाओं में किया जाता है।
लौ का रंग स्वयं अशुद्धियों से नहीं आता है, बल्कि विशेष रूप से इन अशुद्धियों के दहन के परिणामस्वरूप बनने वाली गैसों से आता है; गैसें आग में प्रवेश करती हैं और लौ को विभिन्न रंगों के सफेद, पीले, लाल, हरे, नीले और बैंगनी रंग प्रदान करती हैं। ऐसी अशुद्धियाँ सोडियम, तांबा, सीसा, बेरियम, स्ट्रोंटियम, एंटीमोनियम आदि के लवण हैं। इसलिए, उदाहरण के लिए, नाइट्रेट के साथ मिश्रित सल्फर जलाने पर अनिश्चित रंग देता है, और सुरमा की उपस्थिति में यह सफेद रंग देता है; यदि आप बर्थोलेट नमक और सल्फर के मिश्रण में बेरियम नाइट्रेट मिलाते हैं, तो आपको मिलता है हरा रंगवगैरह।
रंग की अशुद्धियाँ अधिकतर धात्विक यौगिकों से बनी होती हैं, लेकिन पेंट न केवल धातु पर निर्भर करता है, बल्कि उसके साथ संयुक्त गैर-धातु पदार्थों पर भी निर्भर करता है। तांबे के साथ निम्नलिखित प्रयोग से यह सबसे स्पष्ट रूप से सिद्ध होता है। जैसा कि पहले ही कहा गया है, तांबा सल्फर गैसों में लाल लौ के साथ जलता है और कॉपर सल्फाइड में बदल जाता है। यदि तांबे को सल्फर के एक छोटे से मिश्रण के साथ ऑक्सीजन में जलाया जाता है, तो एक बैंगनी लौ बनती है। यदि आप सल्फर के स्थान पर तांबे में ठोस कार्बोहाइड्रेट (शैलैक, चीनी, आदि) मिलाते हैं, तो लौ हरी हो जाएगी।
अल्कोहल ब्लोपाइप की लौ की जीभ से एक चुटकी वर्डीग्रिस (ग्रुनस्पैन) या सल्फ्यूरिक नमक गर्म करें: अल्कोहल गैसों के प्रभाव में, एक चमकदार हरी लौ बनती है। उसी पदार्थ में थोड़ा सा कैलोमेल या अमोनिया मिलाएं: आपको एक चमकदार नीली लौ मिलती है, क्योंकि तांबा जारी क्लोरीन के साथ मिलकर बनता है और जलने पर कॉपर क्लोराइड (क्लोरकूफर) बनाता है। कॉपर क्लोराइड, अल्कोहल की आग के प्रभाव में, हरी लौ के साथ जलता है, क्योंकि अल्कोहल की आग का हाइड्रोजन तांबे से क्लोरीन ले लेता है और लौ के रंग के संबंध में इसे अमान्य कर देता है (CuCl 2 + 2H-2HCl) + घन). यदि कॉपर ऑक्साइड (कुफेरोक्साइड, CuO) को अल्कोहल की आग में जलाया जाता है, तो लौ का मूल और निचला हिस्सा सफेद होगा, और जीभ के किनारे और अंत नीला होगा। इसे इस तथ्य से समझाया गया है कि लौ का हाइड्रोजन सबसे पहले कॉपर ऑक्साइड (CuO+2H=Cu+H 2 O) को कम करता है, जिसके बाद ऑक्सीकरण के प्रभाव में तांबे की रंग क्षमता फिर से लौ के बाहरी आवरण में दिखाई देती है। खोल की क्षमता और उसमें निहित बहुत उच्च तापमान।
रंग की "मोटाई" बढ़ाने के लिए कैलोमेल, अमोनिया, मैस्टिक, शेलैक आदि का उपयोग किया जाता है।
रचना की जलने की गति मुख्य रूप से इस पर निर्भर करती है:
- आधार और डीकंपोजर के तत्वों के बीच रासायनिक संबंध से, क्योंकि अपघटन की डिग्री, और इसलिए आधार की ज्वलनशीलता, इस संबंध की डिग्री पर निर्भर करती है;
- समग्र अनुपात से, क्योंकि प्रत्येक मिश्रण के लिए एक चरम सीमा होती है, जिस पर पहुंचने पर आधार का सबसे तेज़ और सबसे पूर्ण अपघटन प्राप्त होता है, जबकि इस सीमा के बाहर, यानी। इससे पहले या उससे परे, एक बदतर परिणाम प्राप्त होता है - ऐसी सीमा को "आदर्श" कहा जाता है;
- दहन द्वारा विकसित तापमान की ऊंचाई पर;
- रचना के घनत्व और एकरूपता पर;
- से रासायनिक प्रभावअशुद्धियाँ, अर्थात् अधीनस्थ तत्व;
- वायुमंडलीय नमी और संरचना की हीड्रोस्कोपिसिटी से;
- बाहरी तापमान से;
- अंततः, कई छोटे और बड़े, मुख्य या गौण कारणों से, जिनमें से प्रत्येक का प्रभाव का अपना हिस्सा होता है सामान्य प्रक्रियाऔषधि का दहन.
दहन दर का निर्धारण आतिशबाज़ी कला के सबसे महत्वपूर्ण कार्यों में से एक है, क्योंकि इसके साथ लौ की मनमानी तीव्रता या मंदता का मुद्दा जुड़ा हुआ है, इसलिए, उपयुक्त स्थानों में, मानक पर विशेष ध्यान दिया जाता है।
कालानुक्रमिक रूप से पहला (19वीं सदी के अंत में) थर्मल सिद्धांत था, जिसके संस्थापक मलयार, ले चेटेलियर और नुसेल्ट माने जाते हैं। यह सिद्धांत रासायनिक प्रतिक्रिया की दर की तापमान निर्भरता के बारे में वैंट हॉफ की परिकल्पना पर आधारित है। थर्मल विस्फोट की स्थिति पर्यावरण में गर्मी हटाने पर प्रतिक्रिया ऊर्जा के कारण गर्मी वृद्धि की प्रबलता है। इस मामले में, सिस्टम में गर्मी जमा हो जाती है, जिससे स्व-हीटिंग होती है और, तदनुसार, प्रतिक्रिया का स्व-त्वरण होता है।
एक दहनशील प्रणाली में ऑक्सीकरण प्रतिक्रिया की घटना अक्सर एक या किसी अन्य इग्निशन स्रोत द्वारा सिस्टम के हीटिंग से जुड़ी होती है। जब एक दहनशील प्रणाली को गर्म किया जाता है, तो ईंधन और ऑक्सीजन अणुओं की ऊर्जा बढ़ जाती है और, जब यह एक निश्चित मूल्य तक पहुंच जाती है, तो वे सक्रिय हो जाते हैं, यानी। सक्रिय केंद्र (रेडिकल और परमाणु) बनते हैं जिनकी मुक्त संयोजकता होती है, जिसके परिणामस्वरूप दहनशील पदार्थ के अणु हवा में ऑक्सीजन के साथ आसानी से जुड़ जाते हैं। एक। 1898 में बाख और के. एंगलर ने स्वतंत्र रूप से ऑक्सीकरण के पेरोक्साइड सिद्धांत का प्रस्ताव रखा, जिसके अनुसार, जब एक दहनशील प्रणाली को गर्म किया जाता है, तो परमाणुओं के बीच एक बंधन को तोड़कर ऑक्सीजन सक्रिय हो जाती है, और सक्रिय अणु परमाणुओं में टूटे बिना दहनशील पदार्थ के साथ जुड़ जाता है। और इस प्रकार के पेरोक्साइड यौगिक बनाते हैं: R 1 -O-O-R 2 या R-O-O-OH।
हालाँकि, पेरोक्साइड सिद्धांत ऑक्सीकरण प्रक्रिया की कुछ विशिष्ट विशेषताओं की व्याख्या करने में सक्षम नहीं है, उदाहरण के लिए, कभी-कभी विदेशी अशुद्धियों के महत्वहीन निशान की अचानक कार्रवाई।
रासायनिक प्रतिक्रिया की गति, एम/एस, को अरहेनियस नियम के आधार पर निम्नलिखित समीकरण द्वारा व्यक्त किया जा सकता है:
![]() , (1.12)
, (1.12)
प्रतिक्रिया दर स्थिरांक कहां है (अभिकर्मक सांद्रता पर रासायनिक प्रतिक्रिया की दर एकता के लिए सामान्यीकृत);
अभिकर्मकों की सांद्रता, mol/m3;
स्टोइकोमेट्रिक गुणांक, स्टोइकोमेट्रिक प्रतिक्रिया समीकरण में प्रारंभिक अभिकर्मकों की सांद्रता के अनुपात द्वारा निर्धारित;
प्राकृतिक लघुगणक का आधार;
सार्वभौमिक गैस स्थिरांक = 8.3 J/(mol∙K);
- तापमान, के.
स्व-प्रज्वलन का थर्मल सिद्धांत (जिसे थर्मल विस्फोट का सिद्धांत भी कहा जाता है) एक्सोथर्मिक ऑक्सीकरण के दौरान गर्मी रिलीज की दर और कंटेनर की दीवार में प्रतिक्रियाशील मिश्रण से गर्मी हटाने की तुलना पर आधारित है। स्व-प्रज्वलन की स्थिति इन गतियों की समानता से निर्धारित होती है। बर्तन की दीवारों का तापमान जिस पर यह समानता हासिल की जाती है उसे ऑटो-इग्निशन तापमान कहा जाता है। इस तापमान से शुरू (प्रत्येक मामले में दी गई विशिष्ट स्थितियों के लिए विशेषता - बर्तन का आकार और आकार, गैस के थर्मोफिजिकल गुण), स्व-हीटिंग होती है, जिससे फ्लैश (स्वयं-इग्निशन) हो सकता है।
उपरोक्त को ध्यान में रखते हुए, प्रतिक्रियाशील वातावरण में स्व-हीटिंग के लिए, हम लिख सकते हैं:
स्थिर आयतन पर ऊष्मा क्षमता कहाँ है, J/K;
गैस घनत्व, किग्रा/एम3;
गैस का तापमान, के;
समय, एस;
प्रतिक्रिया का थर्मल प्रभाव, डब्ल्यू;
प्रतिक्रिया की गति, एम/एस;
प्रतिक्रिया पोत की सतह, एम2;
प्रतिक्रिया पात्र का आयतन, मी 3 ;
ऊष्मा अंतरण गुणांक, W/(m 2 ×K);
पोत की दीवार का तापमान, K.
डीए फ्रैंक-कामेनेत्स्की ने गर्मी रिलीज की पर्याप्त दर पर प्रतिक्रियाशील पोत में स्थिर तापमान वितरण के उल्लंघन के आधार पर थर्मल स्व-इग्निशन के लिए एक मानदंड प्रस्तावित किया:
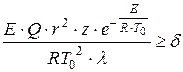 , (1.14)
, (1.14)
बर्तन का विशिष्ट आकार कहाँ है, मी;
पूर्व-घातीय कारक;
तापीय चालकता का गुणांक गैस मिश्रण, डब्ल्यू/(एम×के);
3.3 के बराबर आयामहीन मानदंड; गोलाकार, समतल-समानांतर और बेलनाकार जहाजों के लिए क्रमशः 0.88 और 2।
डी.ए. फ्रैंक-कामेनेत्स्की मानदंड को इस प्रकार समझा जाना चाहिए: यदि, निर्धारित करने वाले सभी मापदंडों को प्रतिस्थापित करते समय, हमें मूल्य मिलता है, तो कोई इग्निशन नहीं होगा, लेकिन इग्निशन होगा। मानदंड समीकरण से यह निष्कर्ष निकलता है कि प्रतिक्रिया की गर्मी और जिस बर्तन में प्रतिक्रिया होती है उसकी त्रिज्या विस्फोट में महत्वपूर्ण निर्धारण कारक हैं। जितनी बेहतर असमानताएँ संतुष्ट होती हैं, थर्मल विस्फोट उतना ही अधिक स्पष्ट होता है:
यदि इन असमानताओं को खराब तरीके से संतुष्ट किया जाता है, तो थर्मल विस्फोट खराब हो जाता है - साथ ही तापमान में वृद्धि के साथ, प्रारंभिक पदार्थ का तेजी से जलना होता है, जो विस्फोट की तस्वीर को धुंधला कर देता है।
दहन की घटना अक्सर एक या दूसरे इग्निशन स्रोत द्वारा दहनशील प्रणाली को गर्म करने से जुड़ी होती है। शिक्षाविद् एन.एन. के सिद्धांत के अनुसार। सेमेनोव के अनुसार, ऑक्सीकरण प्रक्रिया गर्मी की रिहाई के साथ होती है और, कुछ शर्तों के तहत, स्वयं तेज हो सकती है। ऑक्सीकरण प्रतिक्रिया के स्व-त्वरण के साथ दहन में परिवर्तन की इस प्रक्रिया को स्व-प्रज्वलन कहा जाता है।
थर्मल स्व-प्रज्वलन के मामले में, यह गर्मी हटाने की दर से गर्मी रिलीज की दर की अधिकता के कारण होता है।
आइए हम एक ज्वलनशील गैस या ज्वलनशील तरल वाष्प के उदाहरण का उपयोग करके थर्मल स्व-प्रज्वलन की प्रक्रिया पर विचार करें जिसमें हवा को एक बर्तन में रखा गया है। जैसे-जैसे बर्तन और दहनशील मिश्रण का तापमान बढ़ेगा, प्रतिक्रिया दर और गर्मी रिलीज में वृद्धि होगी। तापमान, जे/एस पर गर्मी रिलीज की दर की निर्भरता निर्धारित की जाती है:
![]() , (1.15)
, (1.15)
गैस के दहन की ऊष्मा कहाँ है, J;
दहनशील मिश्रण की मात्रा, एम3;
प्रतिक्रिया दर स्थिरांक;
अभिकारक की सांद्रता, किग्रा/मीटर 3;
प्रतिक्रिया क्रम;
सक्रियण ऊर्जा, J/mol;
सार्वभौमिक गैस स्थिरांक J/(mol K);
मिश्रण तापमान, के.
उत्पन्न ऊष्मा को दहनशील मिश्रण में स्थानांतरित किया जाता है, और यह गर्म हो जाता है। जैसे ही मिश्रण का तापमान बर्तन की दीवारों के तापमान से अधिक हो जाता है, मिश्रण और बर्तन की दीवारों के बीच तापमान के अंतर के अनुपात में प्रति इकाई समय में बर्तन की दीवारों के माध्यम से गर्मी को हटाया जाना शुरू हो जाएगा और निर्धारित किया जाएगा। रिश्ते से:
![]() , (1.16)
, (1.16)
बर्तन की दीवारों के माध्यम से गर्मी हटाने की दर कहां है, जे/एस;
ऊष्मा अंतरण गुणांक, J/(K m 2 ×s);
पोत की दीवारों की सतह, एम2;
मिश्रण तापमान, K;
जहाज की दीवारों का तापमान, K

चित्र 1.5 - विभिन्न दबावों पर तापमान पर गर्मी रिलीज की निर्भरता
चित्र 1.5 में, वक्र 2, 3 और 4 विभिन्न दबावों और समान मिश्रण संरचना पर तापमान पर गर्मी रिलीज की निर्भरता दिखाते हैं। बर्तन और माध्यम के स्थिर तापमान और मिश्रण की एक स्थिर संरचना पर, दहन क्षेत्र से निकाली गई गर्मी की मात्रा को सीधी रेखा 1 द्वारा दर्शाया जाता है। जब मिश्रण की संरचना बदलती है, तो गर्मी की हानि की दर और, परिणामस्वरूप, सीधी रेखा का ढलान बदल जाएगा. दबाव जितना अधिक होगा, प्रतिक्रिया के दौरान उतनी ही अधिक गर्मी निकलेगी (वक्र 4)। वक्र 2 द्वारा परिभाषित शर्तों के तहत, स्व-प्रज्वलन नहीं हो सकता है, क्योंकि इस दबाव पर गर्मी की हानि (सीधी रेखा 1) गर्मी रिलीज से अधिक है। सीधी रेखा के साथ वक्र 3 की स्पर्शरेखा का बिंदु दी गई स्थितियों के तहत किसी दहनशील प्रणाली के न्यूनतम ऑटो-इग्निशन तापमान पर उत्पन्न और हटाए गए गर्मी के बीच संतुलन से मेल खाता है। बाहर से ऊर्जा की नगण्य आपूर्ति के साथ, आत्म-प्रज्वलन संभव है। वक्र 4 उन स्थितियों को चित्रित करता है जिनके तहत स्व-प्रज्वलन अपरिहार्य है, क्योंकि हटाए जाने की तुलना में अधिक गर्मी निकलती है।
उपरोक्त आरेख का विश्लेषण करते हुए, एन.एन. सेम्योनोव ने निर्भरता स्थापित की:
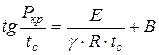 , (1.17)
, (1.17)
न्यूनतम इग्निशन दबाव कहाँ है, पा;
न्यूनतम ऑटो-इग्निशन तापमान, K;
प्रतिक्रिया क्रम;
मिश्रण की संरचना और अन्य गुणों के आधार पर स्थिर।
इस समीकरण (1.17) के आधार पर, सैद्धांतिक रूप से पहले से यह निर्धारित करना संभव है कि क्या दी गई विशिष्ट परिस्थितियों में दहनशील मिश्रण का स्व-प्रज्वलन संभव है। न्यूनतम दबाव को ऑटो-इग्निशन तापमान से जोड़ने वाले संबंध की पुष्टि कई प्रयोगों द्वारा की गई है और यह दहन प्रक्रियाओं के अध्ययन में मूल्यवान साबित हुआ है।
दहन का श्रृंखला सिद्धांत
1928 में, एन.एन. सेमेनोव ने रासायनिक प्रणालियों में दो प्रकार के विस्फोटों के अस्तित्व की संभावना का विचार सामने रखा - श्रृंखला और थर्मल।
श्रृंखला प्रतिक्रियाएं वे होती हैं जो कई चरणों (कई मध्यवर्ती प्रतिक्रियाओं के माध्यम से) से गुजरती हैं, जिसमें मुक्त संयोजकता वाले मध्यवर्ती यौगिक बनते हैं, तथाकथित सक्रिय केंद्र, जो प्रक्रिया के बाद के तीव्र चरणों के बीज होते हैं।
श्रृंखला प्रतिक्रिया का विचार पहली बार 1913 में सामने आया, जब जर्मन भौतिक रसायनज्ञ एम. बोडेनस्टीन ने स्थापित किया कि जब हाइड्रोजन और क्लोरीन के मिश्रण को रोशन किया जाता है, तो एक क्लोरीन अणु, प्रकाश ऊर्जा की एक मात्रा को अवशोषित करके, परमाणुओं में विघटित हो जाता है:
![]() .
.
क्लोरीन परमाणु तुरंत हाइड्रोजन के साथ प्रतिक्रिया करते हैं, जिससे मिश्रण फट जाता है। एक क्लोरीन अणु की सक्रियता से दो अणुओं का निर्माण होगा:
![]() .
.
हालाँकि, प्रयोगों से पता चलता है कि इससे हाइड्रोजन क्लोराइड के 100,000 अणु उत्पन्न होते हैं। इसे समझाया जा सकता है यदि हम मान लें कि जब क्लोरीन हाइड्रोजन के साथ प्रतिक्रिया करता है, तो एक उत्पाद बनता है, जो द्वितीयक प्रतिक्रियाओं में प्रवेश करके, फिर से पुनर्जीवित हो जाता है और प्रतिक्रिया जारी रख सकता है। यह धारणा निम्नलिखित प्रतिक्रिया योजना से मेल खाती है:
मैं प्राथमिक प्रतिक्रिया
IV ओपन सर्किट
इस योजना के अनुसार, एक क्लोरीन (I) अणु की सक्रियता से दो क्लोरीन परमाणुओं की उपस्थिति होती है - श्रृंखला प्रतिक्रिया के दो सक्रिय केंद्र। प्रत्येक क्लोरीन परमाणु अपनी स्वयं की श्रृंखला प्रतिक्रिया को जन्म देता है, जिसमें सक्रिय केंद्र लगातार कम होता जाता है (II, III)। इस प्रकार, आरंभ करने वाली प्रतिक्रिया (I) के प्रभाव में, क्रमिक प्रतिक्रियाएं होती हैं, जिससे एक श्रृंखला (II, III, आदि) बनती है। श्रृंखला आरंभ होने से लेकर समाप्ति तक ऐसी प्रतिक्रियाओं की संख्या को श्रृंखला की लंबाई कहा जाता है। श्रृंखला तब टूट सकती है जब क्लोरीन (IV) परमाणु या हाइड्रोजन (V) परमाणु टकराते हैं और उनसे अणु बनते हैं, या जब सक्रिय केंद्र किसी ठोस की सतह से टकराते हैं। यह एक विशिष्ट गैर-शाखा श्रृंखला प्रतिक्रिया है। इसमें, प्रत्येक सक्रिय साइट केवल एक नई सक्रिय साइट की उपस्थिति का कारण बनती है, इसलिए प्रतिक्रिया जारी रह सकती है, लेकिन तेज नहीं हो सकती।
शाखा श्रृंखला प्रतिक्रिया में, प्रत्येक सक्रिय केंद्र दो या दो से अधिक नए सक्रिय केंद्र उत्पन्न करता है।
श्रृंखला प्रतिक्रियाओं के सिद्धांत के अनुसार, ऑक्सीकरण प्रक्रिया एक ज्वलनशील पदार्थ के सक्रियण से शुरू होती है।
अभ्यास से पता चला है कि इग्निशन इज़ोटेर्मल स्थितियों के तहत हो सकता है, यानी। प्रतिक्रियाशील माध्यम का तापमान बढ़ाए बिना (मिश्रण का "ठंडा" प्रज्वलन)। इस मामले में, वे एक श्रृंखला (आइसोमेट्रिक) विस्फोट के बारे में बात करते हैं।
दो प्रारंभिक घटक: ईंधन और ऑक्सीडाइज़र, अपेक्षाकृत स्थिर आणविक अवस्था में होने के कारण, दहन उत्पादों के नए, अधिक स्थिर अणुओं में शामिल होने से पहले, जटिल मध्यवर्ती परिवर्तनों की एक पूरी श्रृंखला से गुजरते हैं, जिसके परिणामस्वरूप अस्थिर उत्पादों का निर्माण होता है: परमाणु, रेडिकल, आयनीकरण की अपेक्षाकृत बड़ी डिग्री (फॉर्मेल्डिहाइड, हाइड्रोकार्बन और हाइड्रॉक्साइड रेडिकल, परमाणु ऑक्सीजन और हाइड्रोजन) के साथ उत्तेजित अणु।
कोंडरायेव वी.एन. विभिन्न हाइड्रोकार्बन की लपटों में परमाणु ऑक्सीजन (O), हाइड्रॉक्साइड रेडिकल (OH), हाइड्रोकार्बन रेडिकल (CH 3), कार्बन मोनोऑक्साइड (CO), फॉर्मेल्डिहाइड (CH 2 O), आदि की बड़ी सांद्रता का पता लगाना संभव था। लौ में इन पदार्थों की अंतिम प्रतिक्रिया उत्पादों के लौ तापमान पर थर्मल अपघटन के दौरान उनकी संतुलन सांद्रता से हजारों और लाखों गुना अधिक हो गई, उदाहरण के लिए, एच 2 ओ → एच + ओएच।
इन अवलोकनों के परिणामों से यह निष्कर्ष निकला कि विचाराधीन परमाणु और रेडिकल प्रतिक्रियाशील गैस में उत्पादों के अंतिम अपघटन के परिणामस्वरूप नहीं दिखाई देते हैं, बल्कि प्रतिक्रिया के मध्यवर्ती उत्पाद हैं।
इस प्रकार, इग्निशन की श्रृंखला तंत्र कुछ पदार्थों के दूसरों में रासायनिक परिवर्तनों की पूरी श्रृंखला पर आधारित है, जिसके परिणामस्वरूप रासायनिक रूप से बहुत सक्रिय अस्थिर उत्पादों के कुछ मध्यवर्ती चरणों में गठन होता है, जिन्हें सक्रिय केंद्र कहा जाता है, जो आसानी से एक दूसरे के साथ प्रतिक्रिया करते हैं और शुरुआती पदार्थों के अणुओं के साथ नए सक्रिय केंद्र और अंतिम उत्पाद बनाते हैं, उदाहरण के लिए, एच 2 ओ और सीओ 2 के मीथेन-वायु मिश्रण के लिए।
उच्च जेटरेडिकल और परमाणुओं को उनकी प्रतिक्रियाओं की कम सक्रियण ऊर्जा द्वारा समझाया गया है, जो परमाणु प्रतिक्रियाओं की सक्रियण ऊर्जा के करीब है:
ओएच + एच 2 = एच 2 ओ + एच - 25 केजे/मोल
सीएच 3 + सी 3 एच 6 - 12.5 केजे/मोल
सीएच 3 + सी 6 एच 6 - 23.5 केजे/मोल
एच 2 ओ → एच + ओएच
परिणामी सक्रिय कणों (एच या ओएच) में से कोई भी, बेहद अस्थिर और इसलिए रासायनिक रूप से सक्रिय होने के कारण, मूल पदार्थ के अणु से टकराकर विभाजित हो जाता है, जिससे नए सक्रिय कण बनते हैं:
एच+ओ 2 = ओएच+ओ
ओएच+एच 2 = एच 2 ओ+एच
प्रतिक्रिया के परिणामस्वरूप प्राप्त सक्रिय कण एच और ओएच फिर से प्रतिक्रियाओं में प्रवेश करेंगे, और ओ कण हाइड्रोजन के साथ बातचीत करेंगे:
ओ+एच 2 = ओएच+एच.
अर्थात्, प्रारंभिक पदार्थों के सक्रिय कणों और अणुओं के बीच प्रतिक्रिया के परिणामस्वरूप, न केवल अंतिम उत्पाद बनते हैं, बल्कि नए सक्रिय कण भी बनते हैं। प्रतिक्रिया के परिणामस्वरूप बनने वाले सक्रिय कण रासायनिक परिवर्तन के नए चरणों को जन्म देते हैं, जो तब तक होते रहेंगे जब तक कि शुरुआती पदार्थ पूरी तरह से समाप्त न हो जाएं।
ऐसी बार-बार दोहराई जाने वाली रासायनिक प्रतिक्रियाओं को श्रृंखला प्रतिक्रिया कहा जाता है, और सक्रिय कण जो परिवर्तनों की नई श्रृंखला को जन्म देते हैं उन्हें सक्रिय केंद्र कहा जाता है।
ऊपर चर्चा की गई हाइड्रोजन दहन की श्रृंखला प्रक्रिया को एक आरेख (चित्रा 1.6) के रूप में दर्शाया जा सकता है।
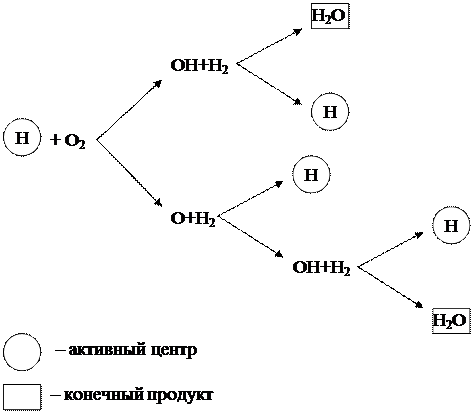
चित्र 1.6 - हाइड्रोजन की श्रृंखला दहन की योजना
आरेख से यह देखा जा सकता है कि केवल हाइड्रोजन कण (एच), जो सक्रिय केंद्र हैं, परिवर्तनों की नई श्रृंखलाओं को जन्म देते हैं। इसके अलावा, श्रृंखला प्रक्रिया के प्रत्येक लिंक में, सक्रिय केंद्र एच और ऑक्सीजन अणु ओ 2 के बीच प्रतिक्रिया के परिणामस्वरूप, अंतिम उत्पाद एच 2 ओ के अलावा, 3 नए सक्रिय केंद्र एच बनते हैं, जो नए को जन्म देते हैं। परिवर्तनों की श्रृंखला.
ऐसी श्रृंखला प्रतिक्रिया, जो सक्रिय केंद्रों में वृद्धि के साथ होती है, शाखित कहलाती है। प्रतिक्रिया हिमस्खलन की तरह विकसित होती है और बहुत तेज़ गति से आगे बढ़ती है, जो पारंपरिक आणविक प्रतिक्रियाओं की गति से काफी अधिक होती है।
एक विशिष्ट सीधी-श्रृंखला प्रतिक्रिया हाइड्रोजन के साथ क्लोरीन की प्रतिक्रिया है। इस प्रतिक्रिया के सक्रिय केंद्र बारी-बारी से क्लोरीन और हाइड्रोजन परमाणु हैं। जब एक क्लोरीन परमाणु प्रतिक्रिया करता है, तो एक हाइड्रोजन परमाणु बनता है, जैसे जब एक हाइड्रोजन परमाणु प्रतिक्रिया करता है, तो एक क्लोरीन परमाणु बनता है। इसलिए, प्रतिक्रिया जारी रह सकती है, लेकिन तेज़ नहीं।
प्रसिद्ध तथ्य यह है कि हाइड्रोजन के साथ क्लोरीन की फोटोकैमिकल प्रतिक्रिया अभी भी एक विस्फोट (स्वयं-इग्निशन) में समाप्त होती है, इस तथ्य से समझाया जाता है कि श्रृंखला प्रतिक्रिया की पर्याप्त उच्च गति पर, गर्मी रिलीज गर्मी हटाने से अधिक होती है, परिणामस्वरूप जिनमें से मिश्रण अत्यधिक गर्म हो जाता है, और तापीय स्व-प्रज्वलन के लिए आवश्यक परिस्थितियाँ उत्पन्न हो जाती हैं।
एक शाखित श्रृंखला प्रतिक्रिया के दौरान, जो हाइड्रोकार्बन के लिए विशिष्ट है, सक्रिय केंद्रों की सांद्रता प्रारंभिक शुरुआत की स्थितियों की परवाह किए बिना बढ़ सकती है और, यदि शाखा के दौरान सक्रिय केंद्रों के गठन की दर श्रृंखला समाप्ति की दर से अधिक हो जाती है, तो एक स्व-त्वरित प्रतिक्रिया हिमस्खलन जैसी प्रक्रिया होती है, जिससे आग लग जाती है।
श्रृंखला प्रतिक्रियाओं के सिद्धांत ने दहन प्रक्रियाओं की कई विशेषताओं (अशुद्धियों का मजबूत प्रभाव, आत्म-प्रज्वलन दबाव सीमा, उत्प्रेरण और दबाव निषेध, आदि) की व्याख्या करना संभव बना दिया है जिन्हें थर्मल सिद्धांत द्वारा समझाया नहीं जा सकता है। वास्तविक आग और विस्फोटों की घटना और विकास का तंत्र एक संयुक्त श्रृंखला-थर्मल प्रक्रिया की विशेषता है। एक श्रृंखलाबद्ध तरीके से शुरू होने के बाद, ऑक्सीकरण प्रतिक्रिया, इसकी ऊष्माक्षेपीता के कारण, थर्मल साधनों द्वारा त्वरित होती रहती है। इसलिए, अंततः, दहन की घटना और विकास के लिए महत्वपूर्ण (सीमित) स्थितियां पर्यावरण के साथ प्रतिक्रियाशील प्रणाली की गर्मी रिलीज और गर्मी विनिमय स्थितियों द्वारा निर्धारित की जाएंगी।
चेन पर रासायनिक प्रतिक्रिएंकई की स्थापना की गई तकनीकी प्रक्रियाएंवी रसायन उद्योग. ऐसी प्रक्रियाओं में शामिल हैं, उदाहरण के लिए, पोलीमराइजेशन प्रक्रियाएं, जो सिंथेटिक रबर, प्लास्टिक, पॉलिमर फाइबर और कई अन्य उत्पादों के उत्पादन का आधार बनती हैं। इनमें ऐसे महत्वपूर्ण भी शामिल हैं औद्योगिक प्रक्रियाएं, जैसे सिंथेटिक फैटी एसिड का उत्पादन जो डिटर्जेंट और स्नेहक के उत्पादन में पहले इस्तेमाल किए गए खाद्य वसा को प्रतिस्थापित करता है, क्रैकिंग तेल आदि से उच्च गुणवत्ता वाले ईंधन का उत्पादन करने की प्रक्रिया है।