Lý thuyết nhiệt về sự cháy. Các nguyên tắc cơ bản của lý thuyết về sự đốt cháy. Các kiểu đốt, đặc điểm của chúng
Đốt cháy- Tương tác hóa học xảy ra nhanh của chất cháy với chất oxi hóa, kèm theo đó là sự tỏa ra một lượng nhiệt lớn và phát sáng (ngọn lửa). Sự cháy chỉ có thể xảy ra khi có ba yếu tố: chất cháy, chất oxi hoá và nguồn nhiệt.
nguồn nhiệt(đánh lửa) có thể là ngọn lửa trần, tia lửa, nhiệt nóng lên do ma sát (đai trong bộ truyền động đai), va đập, áp suất. Nguồn nhiệt cũng có thể là điện (đốt nóng vật dẫn, hồ quang), năng lượng hóa học và bức xạ của mặt trời.
Chất oxy hóa là clo, flo, brom. Chất oxy hóa phổ biến nhất là oxy trong khí quyển; quá trình cháy sẽ phụ thuộc vào hàm lượng của nó trong không khí. Nếu có nhiều hơn 14-16% oxy trong không khí, thì quá trình cháy ổn định được quan sát. Khi hàm lượng ôxy nhỏ hơn 14% thì âm ỉ cháy, và khi hàm lượng ôxy nhỏ hơn 8 - 10% thì âm ỉ cũng ngừng.
chất dễ cháy. Chúng có thể là chất khí (amoniac, axetylen, hydro), chất lỏng (xăng, axeton, rượu), chất rắn (than, gỗ). Để xảy ra hỏa hoạn chất rắn hoặc chất lỏng, cần phải đun nóng chúng bằng nguồn nhiệt đến nhiệt độ sao cho thoát ra khỏi bề mặt của chúng một cách mạnh mẽ các hơi dễ cháy. Khi đạt đến một nồng độ nhất định, các hơi này sẽ sáng lên. Các chất khí trong quá trình cháy không thay đổi trạng thái tập hợp của chúng.
Có các kiểu đốt sau: 1) chớp cháy; 2) đánh lửa; 3) tự bốc cháy; 4) sự cháy tự phát; 5) phân rã; 6) vụ nổ.
1. Tốc biến gọi là sự cháy tức thời của hỗn hợp oxy trong không khí với hơi, khí, bụi, không kèm theo sự tạo thành khí nén. Điểm chớp cháy là nhiều nhất nhiệt độ thấp một chất dễ cháy, trong đó hơi hoặc khí được hình thành trên bề mặt của nó có thể bùng phát từ nguồn đánh lửa, nhưng để cháy ổn định sau đó, tốc độ hình thành của chúng là không đủ.
Tùy thuộc vào giá trị của nhiệt độ này, chất lỏng dễ cháy được chia thành:
a) dễ cháy (chất lỏng dễ cháy - xăng, axeton, rượu) - t vsp ≤ + 45 ° С;
b) chất lỏng dễ cháy (GZH - dầu, nhiên liệu điêzen, dầu nhiên liệu) - t vsp> + 45 ° С.
2. Bằng cách đánh lửađược gọi là sự cháy lâu dài ổn định của một chất từ nguồn nhiệt. Nhiệt độ tối thiểu của một chất dễ cháy mà tại đó nó bắt cháy từ nguồn bắt lửa và tiếp tục cháy sau khi loại bỏ chất này được gọi là nhiệt độ bắt lửa. Nó cao hơn điểm chớp cháy.
Nồng độ của các chất dễ cháy trong không khí, tại đó có thể bắt lửa hoặc nổ, nằm trong giới hạn nhất định: thấp hơn - NVP và trên - ERW. Không thể bắt cháy hỗn hợp dễ cháy ở nồng độ dưới NVP (không đủ phân tử của chất dễ cháy trong hỗn hợp) và trên ERW (không đủ phân tử oxy trong hỗn hợp). Sự khác biệt giữa ERW và NWP càng lớn thì chất càng nguy hiểm. Giá trị của các thông số này có thể giảm, ví dụ, khi độ ẩm của hỗn hợp bụi-không khí (DAM) tăng lên, ví dụ hỗn hợp không khí với đường, bột, than cám.
Hãy để chúng tôi đưa ra các ví dụ về các giá trị của NWP và WPW đối với một loạt các chất khí và hơi của chất lỏng:
Axetilen 3,5-82%;
Khí tự nhiên 3,8-19,2%;
Xăng dầu 1-6%;
Cacbon monoxit 12,8-75%.
3.Tự đánh lửa- quá trình bắt lửa của các chất từ nguồn bên ngoài (ngọn lửa, vật nung nóng hoặc nóng đỏ) mà không tiếp xúc trực tiếp với nó ở nhiệt độ bắt lửa. Nhiệt độ này sẽ giảm khi tăng áp suất và đối với hầu hết các loại khí dễ cháy, nó nằm trong khoảng 400-700 ° C, đối với gỗ - 340-400 ° C; than đá - 400-500 ° C. Một ví dụ về tự bốc cháy: đốt nóng và bắt lửa sau đó của gỗ, giấy nằm gần ngọn lửa trần (không tiếp xúc với nó) hoặc các vật nóng (than, mở xoắn ốc lò sưởi).
4. Tự bốc cháy chất xảy ra là kết quả của các phản ứng vật lý, hóa học và sinh học xảy ra trong chính chất (vật liệu) đó, dẫn đến sự cháy trong điều kiện không có nguồn đánh lửa.
Khi lưu trữ một lượng lớn ngũ cốc ướt, cỏ khô, rơm rạ và không đủ thông gió, các quá trình sinh hóa (thối rữa) xảy ra bên trong những vật liệu này với sự tỏa nhiệt. Nhiệt độ của các vật liệu này tăng lên, khối lượng lớn của chúng (xếp, chồng) ngăn cản sự tản nhiệt tạo thành Môi trường, nguyên nhân gây ra hỏa hoạn. Những vật liệu này cần được làm khô trước khi bảo quản. Các loại vải tiếp xúc (áo yếm, vật liệu làm sạch) có chứa vết dầu và chất thành đống mà không có hệ thống thông gió cũng tự bốc cháy. Do đó, áo yếm phải được treo sao cho đảm bảo không khí tiếp cận được tự do, và các giẻ lau dính dầu phải được dọn ra khỏi nơi làm việc một cách kịp thời.
Tùy thuộc vào tốc độ phản ứng, quá trình đốt cháy tiến hành ở dạng âm ỉ(vận tốc vài cm / s), trên thực tế sự đốt cháy(vài m / s) và nổ(vài trăm và hàng nghìn m / s).
5. Nổ- Sự thay đổi đột ngột về trạng thái vật lý và hóa học của một chất dưới tác dụng của nhiệt độ, áp suất cao, thuốc thử hóa học. Trong một vụ nổ, thể tích các chất khí và hơi được tạo thành tăng mạnh, một lượng năng lượng khổng lồ được giải phóng, dưới dạng sóng xung kích có khả năng thực hiện công việc cơ khí(phá hủy các tòa nhà, công trình kiến trúc, gây thương tích cho con người).
Quá trình đốt cháy vật liệu có thể hoàn toàn hoặc không hoàn toàn. Đốt cháy hoàn toàn (dư oxi) thì tạo thành sản phẩm không cháy (CO 2 và H 2 O), còn cháy không hoàn toàn (thiếu O 2) thì tạo thành sản phẩm của quá trình oxi hóa không hoàn toàn (CO, ancol, axit). Chúng độc hại và dễ nổ. Vì vậy, khi tổ chức quá trình đốt cháy nhiên liệu (trong lò hơi, lò nung) cần đảm bảo đủ lượng ôxy trong lò.
Năng lượng phân tử của quá trình đốt cháy
Hầu hết các quá trình đốt cháy liên quan đến sự kết hợp của chất cháy có chứa hydro và carbon với oxy trong khí quyển.
Trước khi tiếp tục xem xét các cơ sở vật lý và toán học của lý thuyết về sự đốt cháy, chúng ta sẽ cố gắng hiểu ở cấp độ phân tử năng lượng đốt cháy đến từ đâu, về sự giải phóng mà mọi thứ khác phụ thuộc: đốt nóng khí, sự xuất hiện của hoạt động các trung tâm hóa học trong đó, v.v.
Hãy xem các phản ứng chính của sự kết hợp cacbon và hydro với oxy trong khí quyển được tạo thành từ những phản ứng nóng nào.
Chúng tôi viết phù hợp với dữ liệu trong Bảng. 3.1 Cân bằng năng lượng của các phản ứng oxy hóa tuần tự của cacbon rắn, chẳng hạn như than chì:
Như vậy, trong phản ứng oxi hóa tổng của cacbon rắn, 386 kJ / mol được giải phóng:
Năng lượng giải phóng khi hiđro kết hợp với oxi cũng có độ lớn gần bằng:
Phân tử CO có lẽ là phân tử mạnh nhất, năng lượng liên kết của nó là 1016 kJ / mol. (Tiếp theo về độ mạnh là phân tử N2 có năng lượng liên kết 892 kJ / mol. Cả hai phân tử đều có ba cặp electron liên kết, nói theo ngôn ngữ hóa học là liên kết hóa trị ba. Trong phân tử CO, một electron đầu tiên đi từ O đến C, sau mà O + và C- trở nên tương tự như nguyên tử nitơ; điều này được khẳng định bởi sự hiện diện của mômen lưỡng cực trong phân tử CO.) Trong phân tử CO2, liên kết của nguyên tử oxy thứ hai yếu hơn: theo Bảng. 3.1
Năng lượng liên kết của oxy trong các hợp chất này có thể so sánh với năng lượng liên kết của phân tử oxy ban đầu. Tại vì
thì một nguyên tử oxi chỉ chiếm 240 kJ / mol. Năng lượng liên kết thấp của phân tử oxy là lý do hoạt động hóa học của nó và lý do sử dụng oxy hóa làm nguồn năng lượng.
Năng lượng liên kết của nguyên tử cacbon trong mạng tinh thể của than chì (cũng như kim cương và cacbon vô định hình) là rất cao. Năng lượng phản ứng tương đối nhỏ C (tv) + 0,5O2 = CO + 98 kJ / mol là hiệu số giữa hai giá trị rất lớn: từ năng lượng liên kết của CO (256 kJ / mol) người ta phải trừ đi một nửa năng lượng phân hủy O2 thành nguyên tử (59 kJ / mol) và trừ nhiệt hóa hơi của nguyên tử cacbon. Trên thực tế, đây là cách xác định nhiệt của sự bay hơi, bằng 671 kJ / mol. Nó cũng rất lớn.
Quá trình chuyển đổi cacbon rắn và hydro dạng khí thành nhiên liệu hydrocacbon xảy ra với một sự thay đổi nhỏ về năng lượng. Mặt khác, khi ôxy được đưa vào các phân tử hữu cơ của rượu thiếc, anđehit và xeton, axit hữu cơ, cacbohydrat, thì hầu như năng lượng được giải phóng trong quá trình đốt cháy hoàn toàn (lên đến CO2 và H2O), một cách tự nhiên, với việc tiêu thụ một lượng oxy tương đương. Do đó, chúng ta có thể gần như giả định rằng quá trình đốt cháy hoàn toàn bất kỳ nhiên liệu hữu cơ nào giải phóng 419–500 kJ / mol oxy tiêu thụ. Các ngoại lệ duy nhất là một số hợp chất thu nhiệt, giàu năng lượng, chẳng hạn như axetylen và xyanua, chẳng hạn, nhiệt đốt cháy của chúng lớn hơn.
Sự cháy không hoàn toàn không thuận lợi về mặt năng lượng không chỉ trên mỗi phân tử nhiên liệu mà còn cho mỗi phân tử oxy tiêu thụ. Trong phản ứng 2Q (tv) + O2 = 2CO, chỉ có 210 kJ / mol thoát ra thay vì 466 khi hiđro bị đốt cháy và 526 khi đốt cháy khí CO.
Liên kết bền của nguyên tử C trong cacbon rắn làm cho cacbon không bay hơi. Cacbon rời khỏi trạng thái rắn chỉ cùng với oxi dưới dạng CO hoặc CO2.
Với sự cháy không hoàn toàn và ở nhiệt độ thấp, phản ứng 2CO = CO2 + C (rắn) + 41 kJ / mol chỉ thuận lợi về mặt năng lượng khi tính cho cacbon rắn. Khi tính trên mỗi nguyên tử cacbon tự do, phản ứng tương ứng 2СО = СO2 + С - 129 kJ / mol có hàng rào năng lượng lớn. Do đó, muội than trong quá trình cháy chỉ được hình thành từ sự phân hủy của các phân tử hữu cơ có khung xương cacbon chứ không phải từ CO.
Bây giờ chúng ta hãy chuyển sang các phản ứng oxy hóa liên quan đến nitơ.
Phân tử nitơ N2 rất mạnh - năng lượng phân ly của nó là 226 kJ / mol. Do đó, phản ứng chuyển hóa N2 và O2 thành 2NO là phản ứng thu nhiệt và vì lý do nhiệt động lực học, chỉ có thể tiến hành ở nhiệt độ cao.
Sự hình thành các oxit cao hơn (NO2, N2O3, N2O4, N2O5) từ nitơ và oxy tiến hành thực tế mà không có sự thay đổi về năng lượng (so với năng lượng liên kết của N2 và O2). Do đó, từ quan điểm năng lượng, oxy đóng gói trong các hợp chất với nitơ (CH3-ONO2 là nitroether, CH3 (CeH2) (NO2) 3 là trinitrotoluene) thực tế tương đương với oxy ở thể khí. Ôxy được xây dựng trong một phân tử hữu cơ nhưng liên kết với nitơ nên có thể tạo ra các chất giải phóng năng lượng cao khi phân tử được sắp xếp lại để tạo thành N2 và ôxy được chuyển thành các phân tử CO2 và H2O. Vì lý do này, các hợp chất trong đó oxy liên kết với nitơ (cũng như với clo, trong các nhóm CIO3, ClO4) được sử dụng làm thuốc súng và thuốc nổ.
Đây là những ý tưởng chung về năng lượng phân tửđốt cháy.
Chúng ta tiếp tục nói về những điều cơ bản cổ điển của hóa học, những điều cần thiết cho bất kỳ phương pháp bắn pháo hoa nào đang thực hành. BA-BẠCH nhắc nhở rằng bất bài học thực tế Pháo hoa là một công việc nguy hiểm nếu nó không dựa trên một lý thuyết chặt chẽ. Chúng tôi khuyến nghị những độc giả coi những gì có thể trở thành cuộc sống của họ nên tham gia một khóa học chính thức, chẳng hạn như tại Viện Nghiên cứu Hóa học Ứng dụng ở Sergiev Posad.
Đề cập đến các hợp chất, chúng tôi chỉ ra rằng lý do chính của chúng là mức độ liên quan của các nguyên tố với nhau. Mặt khác, các nguyên tố vẫn không quan tâm đến sự hiện diện của một số chất và ít nhiều có mong muốn kết hợp mạnh mẽ với những chất khác. Vì vậy, ví dụ, vôi dễ dàng hấp thụ khí clo nặng, tức là kết hợp với nó thành vôi đã khử trùng bằng clo; thủy ngân kết hợp với lưu huỳnh nóng chảy tạo thành một chất màu đỏ tươi nổi tiếng được gọi là "chu sa". Cinnabar (Zinnober) có thể bị phân hủy một lần nữa thành lưu huỳnh và thủy ngân, nếu bạn kết hợp nó với một chất mà một trong các nguyên tố cấu thành (ví dụ, lưu huỳnh) sẽ có lực hút mạnh hơn một đồng chí (tức là thủy ngân), sau đó và yếu tố thứ hai liên kết với một cái gì đó có thể được giải phóng theo cách tương tự nhờ chất thứ tư. Một bản phát hành hoặc bản phát hành như vậy không phải lúc nào cũng hoàn thành, nhưng thường thì bản phát hành một phần là đủ, về mặt lý thuyết có thể tính toán bằng công thức.
Một trong những hậu quả rất phổ biến của ái lực, lặp đi lặp lại ở mỗi bước, là tính chất được gọi là "tính hút ẩm", tức là khả năng bị ướt, ẩm, nếu không - hút ẩm và tạo thành các hợp chất oxy-hydro. Nhiều chất được phân biệt bởi tính chất này, và trong số những chất khác, muối ăn và axit sunfuric, được đặt giữa khung cua sođể rút ra sự ẩm ướt vào chính mình; vôi sống, sủi bọt khi tiếp xúc với nước; gelatin, mà rượu được khử nước, v.v. Đối với pháo hoa, tính hút ẩm là một đặc tính khó chịu cần phải tính đến. Vì vậy, ví dụ, strontian clorua và nitrat, do tính hút ẩm cực cao, không phải lúc nào cũng có thể sử dụng được, mặc dù những chất này có phẩm chất pháo hoa quý; và nói chung, tất cả các tác phẩm phải được bảo vệ cẩn thận khỏi ảnh hưởng của độ ẩm. Nhưng vai trò quan trọng nhất trong hóa học pháo hoa được đóng bởi loại hợp chất gọi là "sự đốt cháy" (Verbrennung, sự đốt cháy).
Theo khái niệm "đốt cháy" hay "đốt cháy" theo nghĩa rộng nhất, hóa học nói chung có nghĩa là mọi sự kết hợp hóa học của hai cơ thể để tạo thành một phần ba; theo nghĩa gần nhất, nó có nghĩa là sự kết hợp của cơ thể với oxy.
Để làm rõ, chúng ta hãy chuyển sang thử nghiệm, như thường lệ. pha trộn một số tiền nhất định của mạt sắt với một lượng lưu huỳnh nhất định và đun nóng nhẹ hỗn hợp; thì hỗn hợp này ngay lập tức nóng lên và nhanh chóng tan chảy. Hợp kim thu được theo cách này không còn là lưu huỳnh hoặc sắt: sắt đã cháy với lưu huỳnh, tức là về mặt hóa học kết hợp với nó, và kết quả là một cơ thể mới được hình thành - sắt hoặc lưu huỳnh (tùy thuộc vào ưu thế của một hoặc một thành phần khác) pyrit.
Đun chảy lưu huỳnh trong một cái chén, đun sôi hợp kim và ném những đoạn dây đồng vào đó: sợi dây này sẽ cháy cùng với lưu huỳnh, làm nổi lên một màu đỏ tuyệt vời; kết quả là tạo ra một hợp chất đặc biệt - đồng sunfua, hoặc ánh đồng. Theo cách tương tự, bạn có thể đốt bằng đồng, tức là kết nối với nó nhiều cơ thể: chì, thiếc, kẽm, v.v.
Carbon lưu huỳnh - một chất lỏng không màu, có mùi mạnh, không đóng băng ngay cả ở 48 ° R (Điểm nóng chảy của carbon disulfide (CS 2) \ u003d -112 ° C) - được hình thành từ sự kết hợp của hơi lưu huỳnh với than nóng. Cả hai vật thể chính sẽ cháy, tức là khi kết hợp với nhau, chúng sẽ biến thành chất lỏng.
Sự giống nhau tương tự cũng tồn tại giữa các kim loại (sắt, đồng, kẽm, antimonium, asen, v.v.), ở trạng thái nóng sáng với khí được đề cập trước đó gọi là "clo": sắt, đồng, kẽm, v.v. Đốt cháy với clo thành clorua sắt, clorua đồng, clorua kẽm, clorua chì, ... vừa phát nhiệt mạnh vừa phát ra ánh sáng đặc biệt. Lưu huỳnh nóng chảy khi tiếp xúc với khí clo cháy với ngọn lửa màu xanh lam và biến thành lưu huỳnh clorua; antimon nghiền nhỏ hoặc asen mịn, được đặt trong một bình chứa đầy clo, tự bốc cháy và kết hợp thành asen clorua hoặc antimon clorua.
Trong cả hai trường hợp, do những điểm giống nhau, các vật thể khác nhau đã được kết hợp, bây giờ với lưu huỳnh, bây giờ với clo, và nhiệt và ánh sáng được giải phóng.
Trong những điều kiện hoàn toàn giống nhau, các hợp chất của các cơ thể khác nhau được tạo thành với một loại khí khác nhau - oxy.
Nối câu bắt bẻ ( bình Thủy tinhđể chưng cất), trong đó thủy ngân được đặt, bên trong có nắp thủy tinh, cách ly tuyệt đối với không khí bên ngoài. Đun nóng thủy ngân gần như đến điểm sôi: thủy ngân sẽ không cháy, nhưng sẽ mất cả ánh kim loại và màu bạc trước đây của nó, và trạng thái lỏng nhỏ giọt của nó - nó sẽ biến thành bột màu đỏ, liên quan đến kim loại cũ trong cùng cách than với gỗ. Nếu trước khi bắt đầu thí nghiệm, bạn đã cân chính xác cả thủy ngân và không khí chứa dưới nắp, và bây giờ cân lại cả hai, thì kết quả là thiếu khối lượng trong không khí và dư trong bột. , và nhiều như vậy.. Ví dụ, nếu không khí dưới mui xe nặng đúng 1000 gam, thì bây giờ nó chỉ nặng 767 gam; nhưng khối bột nặng hơn thủy ngân 233 gam. Bây giờ hãy làm thí nghiệm ngược lại: cho bột vào một bình vặn nhỏ được nối với một chai thủy tinh chứa đầy nước. Đun nóng phần phản ứng trên lửa cồn mạnh: bột sẽ chuyển thành hơi, khi đi qua nước sẽ chia thành hai phần: thành kết tủa kim loại gồm thủy ngân lỏng nguyên chất và khí oxi thu được trong một ống hình trụ.
Tương tự như ái lực với thủy ngân nóng, oxy cũng cho thấy mối quan hệ với sắt nóng hoặc đồng nóng chảy: trong quá trình tiếp xúc với không khí, các kim loại này được tham gia tẩm trên bề mặt với oxy có trong không khí và tạo thành đồng hoặc cặn sắt (xỉ), tức là. . sắt hoặc đồng "oxit" (hợp chất với oxy), đồng thời phóng ra tia lửa sáng màu.
Trong tất cả những trường hợp này, cùng một hiện tượng xảy ra: sự kết hợp với oxy, hay sự oxy hóa (sự oxy hóa) của các vật thể này - không chỉ dưới ảnh hưởng của nhiệt, mà còn với sự giải phóng nhiệt và ánh sáng, tức là nhiệt và ánh sáng. cái thường được gọi là "đốt cháy" là một tác dụng phụ, một hậu quả trực tiếp, hay đúng hơn là một biểu hiện mạnh mẽ, mà người xưa coi là một yếu tố đặc biệt, nguyên lý mà họ gọi là "phlogiston".
Nhưng quá trình oxy hóa có thể xảy ra không chỉ khi không có sự trung gian của lửa, mà thậm chí không có sự tỏa nhiệt đáng chú ý: nếu sắt tiếp xúc với không khí thì nó sẽ bị gỉ. Vết gỉ này không là gì ngoài sản phẩm của quá trình oxy hóa, cụ thể là oxit sắt hoặc sắt bị cháy.
Quá trình cháy vẫn diễn ra mà không có sự giải phóng nhiệt đáng kể chỉ vì quá trình oxy hóa diễn ra rất chậm. Quá trình oxy hóa của cây có phần dễ nhận thấy hơn: những cây thối rữa phát sáng trong bóng tối; nếu bạn đặt tay của bạn vào một đống thối rữa, bạn cảm thấy ấm áp; đống giảm dần từng ngày; nói cách khác, cây từ từ cháy (âm ỉ) trong không khí.
Dòng chảy đáng chú ý hơn nữa không khí trong lành trong quá trình âm ỉ: nếu một luồng không khí được thổi vào than nóng hoặc củi từ từ cháy âm ỉ (ví dụ, với một chiếc lông thổi phồng), thì ngay lập tức ngọn lửa sẽ xuất hiện. Quá trình này diễn ra như sau: gỗ chứa hai chất dễ cháy - cacbon và hydro; chất đầu tiên kết hợp với oxy và khi đốt cháy, biến thành carbon dioxide, hoặc carbon dioxide, và chất thứ hai thành oxy hoặc nước.
Không tí nào vật liệu dễ cháy, Trong Cuộc sống hàng ngàyđược gọi là nhiên liệu hoặc vật liệu chiếu sáng, cháy theo các quy tắc tương tự. Ví dụ, mỡ lợn và bơ có thành phần chủ yếu là cacbon và hydro; cả hai đều có ái lực đáng kể với oxy và toàn bộ quá trình đốt cháy, tức là Quá trình oxy hóa bao gồm thực tế là oxy phân hủy một chất dễ cháy thành các bộ phận thành phần của nó và kết hợp với từng chất riêng biệt.
Chính xác thì quá trình oxy hóa cũng xảy ra trong cơ thể động vật: các bộ phận chứa nitơ (chất béo) của cơ thể bị oxy hóa, hoặc bị đốt cháy, do tiếp xúc với oxy, chất dẫn của nó là máu, và hậu quả là hơi ấm của động vật.
Nhưng cũng giống như quá trình oxy hóa có thể rất chậm, nó có thể cực kỳ nhanh và mạnh mẽ. Ví dụ như phốt pho đỏ nằm trên ngoài trời, không chỉ âm ỉ và phát sáng, mà còn được đổ vào Với số lượng lớn, tan chảy từ từ và cuối cùng bốc cháy (tự bốc cháy). Bột nhỏ nhất của sắt tinh khiết về mặt hóa học bốc cháy khi tiếp xúc với không khí bên ngoài. Cuối cùng, kim loại natri, ngay khi đi vào nước, ngay lập tức bị phân hủy thành các phần cấu tạo của nó để hấp thụ oxy có trong nước, và hơn nữa, nhiệt lượng sinh ra mạnh đến mức có thể đốt cháy một khí khác, hydro, được giải phóng. bởi sự kết hợp của natri với oxy. Vì vậy, hydro bốc cháy với ngọn lửa không màu và, tái kết hợp với oxy trong khí quyển, lại biến thành nước. Do đó, natri được tìm thấy trong dầu khoáng, tại vì dầu này là một hợp chất hydrocacbon không chứa oxy.
Từ những điều trên, có thể rút ra một số kết luận mạnh mẽ:
- Cái mà chúng ta gọi là quá trình đốt cháy trong cuộc sống hàng ngày, tức là sự xuất hiện của ngọn lửa, ánh sáng và nhiệt, đòi hỏi sự hiện diện của hai thể: vật liệu cháy và oxy.
- Bản thân quá trình đốt cháy, trước hết, trong quá trình phân hủy vật liệu dễ cháy với việc giải phóng những phần đó kết hợp với oxy, và thứ hai, trong chính quá trình kết hợp này, tức là trong quá trình oxy hóa. Sản phẩm của quá trình oxy hóa các chất cháy với nhiệt độ vừa đủ chủ yếu là sự chuyển hóa các chất này thành axit cacbonic và nước.
- Tại vì trong tự nhiên, oxy không bao giờ được tìm thấy ở dạng riêng biệt, sau đó khi kết hợp, một vật liệu dễ cháy sẽ chiết xuất nó từ khí quyển, từ nước, hoặc từ bất kỳ cơ thể phức tạp nào khác có chứa oxy; Theo quan điểm này, các cơ thể giải phóng oxy được gọi là chất oxy hóa, các cơ thể bị oxy hóa được gọi là bazơ, và các chất gây ra hoặc tăng cường giải phóng oxy được gọi là chất phân hủy. Thành phần của các chế phẩm pháo hoa và hỗn hợp pháo hoa thường bao gồm các đại diện của mỗi nhóm trong số ba nhóm này, nhưng vẫn có ngoại lệ: trong một số trường hợp nhất định, một bazơ và một chất oxy hóa (ví dụ, nhôm với thuốc tím) là đủ; trong những trường hợp khác, tuy nhiên rất hiếm, chỉ có bazơ, nếu nó được cung cấp đủ oxy (ví dụ, magiê, lycopodium, v.v.).
- Nếu không có sự tham gia của chất oxi hóa, bazơ không cháy, nhưng nếu thêm một chất vào nó có thể kết hợp với bazơ và phân hủy nó, thì hỗn hợp trở nên dễ cháy. Các bazơ như vậy, bản thân chúng không dễ cháy, là: kẽm, natri, chì, bari, kali, stronti, clo và muối nitrat, v.v. Các tạp chất dễ cháy góp phần phân hủy bazơ là: lưu huỳnh, than, bồ hóng, đường, tinh bột, dextrin, shellac, gummilac, mỡ lợn, v.v. Một ví dụ là Saltpeter (kali nitrat): tự nó, Saltpeter không cháy, nhưng nếu bạn trộn nó với lưu huỳnh, bạn sẽ có một hỗn hợp dễ cháy, bởi vì. lưu huỳnh phân hủy muối và lấy đi oxy từ nó, sau đó nó kết hợp thành axit lưu huỳnh. Điều tương tự cũng được quan sát thấy khi lưu huỳnh được kết hợp với muối của Bertolet (Kali cliloricum) hoặc với thuốc tím (Kali hypemanganiucum). Nếu chế phẩm được hình thành từ than đá, bồ hóng hoặc xenluloza làm cơ sở với hỗn hợp lưu huỳnh và chất khử muối, thì chất khử muối đóng vai trò là chất oxy hóa và lưu huỳnh là chất phân hủy. Quá trình này diễn ra như sau: than đá phân hủy muối, kết hợp với ôxy của axit nitric của nó, ôxy và than kết hợp thành axit cacbonic ở thể khí, và nitơ được giải phóng. Lưu huỳnh thúc đẩy quá trình phân hủy, và quan trọng nhất, ngăn cản sự kết hợp của axit cacbonic với kali: cùng một hợp chất sẽ tạo thành một thể rắn - bồ tạt. Nếu không có sự hiện diện của lưu huỳnh, một nửa lượng axit cacbonic sẽ chuyển thành một hợp chất rắn.
- Nếu không có sự hiện diện của oxy, quá trình đốt cháy là không thể tưởng tượng được, vì vậy natri được lưu trữ dưới dầu hỏa không cháy; phốt pho, được đốt cháy dưới một cái chuông kín, bay ra ngoài khi nguồn cung cấp ôxy sẵn có bị cạn kiệt (khoảng 1/5 tổng hàm lượng không khí dưới chuông); động vật được đặt trong “Dog Grotto” chứa đầy khí carbon gây ngạt thở và. vân vân.
Nhưng mặc dù không khí trong khí quyển đóng vai trò là nguồn cung cấp oxy chính trong cuộc sống hàng ngày, nhưng hóa học chỉ ra một số tác nhân oxy hóa khác, qua đó quá trình đốt cháy có thể đạt được cả dưới nước và trong không gian - hoàn toàn không có không khí hoặc được tạo ra bởi các khí không có một nguyên tử oxy. Các chất oxy hóa như vậy, có khả năng giải phóng đủ oxy để đốt cháy hoàn toàn chế phẩm mà không có sự tham gia của không khí trong khí quyển, là muối ăn, muối bartholit, và một số chất khác đã được đề cập. Ví dụ, nhờ có muối tiêu, thuốc súng có được khả năng cháy trong họng súng hoặc đại bác mà không cần sự tham gia của không khí trong khí quyển; Quá trình đốt cháy dưới nước có thể hình dung được với điều kiện tạp chất có chứa chất oxy hóa đủ mạnh để không chỉ đốt cháy hoàn toàn chế phẩm mà còn duy trì nhiệt độ ở độ cao cần thiết trong quá trình đốt cháy dưới nước.
Dựa trên những điều đã đề cập ở trên, chúng tôi lưu ý rằng sự chuyển hóa các chất dễ cháy (ví dụ, nhiên liệu) thành khí ở mức đủ nhiệt độ cao có thể diễn ra trong bốn điều kiện: a) sưởi ấm mà không tiếp cận với không khí, và do đó, oxy (than đá, than cốc, khí đốt); b) đun nóng với sự có mặt của oxy liên kết hóa học (H 2 O, CO 2): khí nước; c) với nguồn cung cấp hạn chế oxy tự do (không khí): khí sản xuất; d) có đủ không khí tiếp cận (hộp cứu hỏa thông thường) hoặc cung cấp oxy tăng lên (gió lùa). - Quá trình oxy hóa diễn ra càng mạnh và ái lực hóa học của bazơ với chất oxy hóa và chất phân hủy càng gần thì sự biểu hiện của ánh sáng và nhiệt càng mạnh và nhanh hơn. Một trường hợp khác đã được lưu ý ở trên: trong một số trường hợp khác, xảy ra quá trình oxy hóa tùy tiện (cháy âm ỉ, rỉ sét, tự cháy), trong khi một số trường hợp khác cần tăng nhiệt độ (nung nóng vật thể) đến một định mức nhất định để gây ra sự kết hợp (oxy hóa kim loại nóng, sự kết hợp của chúng với clo và lưu huỳnh, đốt nến, củi, đèn, dầu hỏa, đốt thuốc súng, v.v.).
Ngoài ra: quá trình tiếp theo của quá trình có thể được thực hiện nhanh hoặc chậm.
Do đó, phải phân biệt hai đặc tính khác nhau về tính nhạy cảm của vật liệu dễ cháy (tức là đối với biểu hiện bên ngoài của quá trình oxy hóa): tính dễ cháy và tính dễ bắt lửa. Đầu tiên cho biết nhiệt độ mà tại đó xảy ra quá trình đánh lửa (bắt đầu quá trình oxy hóa), và thứ hai cho biết tốc độ của chính quá trình oxy hóa. Đối với một thợ bắn pháo hoa, cần phải biết chính xác cả cái này và cái kia, bởi vì ước tính hóa học của các chế phẩm phụ thuộc hoàn toàn vào kiến thức về điều này, cả về khả năng bắt lửa của chúng, cũng như liên quan đến cường độ ánh sáng và thời gian. của đốt.
Về các hiện tượng hóa học do nhiệt gây ra, Rudolf Wagner lưu ý như sau: “Khoa học về các hiện tượng nhiệt trong sự kết hợp và phân hủy hóa học,“ nhiệt hóa học ”, vẫn còn lâu mới có thể giải thích được các sự phân hủy và phương pháp điều chế khác nhau trong ngành công nghiệp hóa chất, nhưng bây giờ nó đã đưa ra các dấu hiệu về xác suất lớn hơn hoặc thấp hơn và tính khả thi của các phản ứng hóa học, vì Nói chung, các hợp chất được tạo thành với sự biến đổi của nhiệt là dễ thu được nhất, trong khi phản ứng xảy ra với sự hấp thụ nhiệt trong hầu hết các trường hợp lại khó hơn nhiều.
Một đơn vị nhiệt là lượng cần thiết để làm ấm một đơn vị trọng lượng của nước từ 0 đến 1 độ C. Theo hệ thập phân, đơn vị đo khối lượng là gam (cm 3); đơn vị hóa học của nhiệt được gọi là "calo" được biểu thị bằng ký hiệu "cal" và 1000 calo bằng ký hiệu "Cal". Kí hiệu "K" (kg) biểu thị nhiệt lượng thoát ra của 1 g nước khi nó được làm lạnh từ điểm sôi đến điểm đóng băng. Nhiệt lượng tương đương cơ học là 425 kg / m.
Hiệu ứng và các sản phẩm đốt cháy
Không tồn tại sự cháy hoàn toàn: những phần của thành phần dễ cháy chưa chuyển thành khí sẽ tạo thành khói hoặc trầm tích. Khói không gì khác hơn là vật chất không cháy, được giảm thành bụi tốt nhất và được dòng không khí mang đi. Trong số những thứ khác, cơ thể như vậy là bồ hóng (tàn tích của một cái cây chưa cháy), bồ hóng (tàn tích của một cơ thể béo chưa được đốt cháy), khói ống khói than (treo hàng nghìn pound trên các thị trấn nhà máy và hiện nay được toàn xã hội khai thác), v.v. Kết tủa thường tạo thành không chỉ không cháy mà còn tạo thành hợp chất hóa học chống cháy (chịu lửa).
Do đó, nhiệm vụ tiếp theo pháo hoa bao gồm việc hoàn thành các chế phẩm như vậy sẽ cháy với lượng khói và trầm tích ít nhất có thể.

Sự cháy làm cho lửa xuất hiện dưới dạng ngọn lửa hoặc tia lửa; ngọn lửa của các chất khí tự nó hoàn toàn không tỏa sáng (ví dụ, cháy hydro khi nhúng natri vào nước); ánh sáng và màu sắc của nó là do sự hiện diện của các vật thể dày đặc hơn trong ngọn lửa. Vì vậy, ví dụ, ánh sáng màu vàng của khí thắp sáng xuất phát từ thực tế là khí này bao gồm hydro và carbon; hydro có sức oxy hóa lớn hơn carbon và cháy nhanh hơn và hoàn hảo hơn, và carbon, tích tụ dư thừa trong ngọn lửa, tạo ra ánh sáng và màu vàng của ngọn lửa. Do đó, để tìm xem ngọn lửa nào đang bốc khói, đủ dính ở giữa, nơi ít thoáng nhất, dị vật nào: thì ngay lập tức nó sẽ được phủ một lớp muội than.
Việc các vật thể rắn cung cấp ánh sáng cho ngọn lửa chứng tỏ điều sau: trong số tất cả các vật thể hiện có, hydro giải phóng nhiệt lượng lớn nhất trong quá trình đốt cháy, bởi vì. làm tan chảy cả bạch kim và tinh thể đá; nhưng ngọn lửa của nó cực kỳ nhạt, trong khi chỉ có khí - hydro và hơi nước - đóng vai trò là các nguyên tố ôxy hóa, nhưng ngay khi một hỗn hợp của bất kỳ chất đậm đặc nào (ví dụ, sắt, than, đá cẩm thạch) xuất hiện, một ánh sáng chói lóa (ánh sáng Drummond) thu được.
Cường độ ánh sáng phụ thuộc trực tiếp vào năng lượng của quá trình oxy hóa: càng mạnh thì nhiệt độ cháy càng cao, và do đó, quá trình đốt cháy các tạp chất rắn càng mạnh. Vì vậy, ví dụ như lửa cồn, đốt khí đốt với hỗn hợp không khí đun nóng, và cuối cùng, đầu đốt chạy xăng Unica cho ngọn lửa rất nhạt, nhưng có thể cho một lượng ánh sáng đáng kể qua một số tạp chất: bóng đèn điện có màu vàng, ánh sáng yếu hơn và đèn điện - trắng, chói, vì trong trường hợp đầu tiên điện ápít năng lượng hơn so với trong lần thứ hai.
Mối quan tâm đặc biệt là đầu đốt Auer, hiện nay không chỉ được sử dụng để thắp sáng khí đốt, mà còn dùng cho xăng, rượu, axetylen và các nguồn chiếu sáng khác: những đầu đốt này, bao gồm hỗn hợp các thân chịu lửa, biến ánh sáng yếu của nguồn nhiệt mạnh thành ánh sáng sáng, xanh lục hoặc hơi xanh Ánh sáng trắng.
Để tăng cường độ sáng của ánh sáng và tăng ngọn lửa trong chế phẩm pháo hoa, người ta sử dụng antimon, than đá và các chất khác.
Màu của ngọn lửa không đến từ chính các tạp chất, mà hoàn toàn từ các khí được hình thành do quá trình đốt cháy các tạp chất này; các chất khí đi vào ngọn lửa và tạo cho ngọn lửa có màu trắng, vàng, đỏ, lục, lam, tím với nhiều sắc độ khác nhau. Các tạp chất như vậy là muối của natri, đồng, chì, bari, stronti, antimonium, v.v. Vì vậy, ví dụ, lưu huỳnh trộn với muối tiêu trong quá trình đốt cháy tạo ra một màu không xác định, và khi có mặt của antimon - màu trắng; nếu bari nitrat được thêm vào hỗn hợp muối bari và lưu huỳnh, thì chúng ta nhận được màu xanh lục vân vân.
Tạp chất tạo màu bao gồm hầu hết các hợp chất kim loại, nhưng bản thân sơn không phụ thuộc vào kim loại mà còn phụ thuộc vào các phi kim loại liên kết với nó. Điều này được chứng minh rõ ràng nhất qua thí nghiệm sau đây với đồng. Đồng, như đã đề cập, cháy trong khí sunfurơ với ngọn lửa đỏ và biến thành đồng sunfua. Nếu đốt đồng với một lượng nhỏ lưu huỳnh trong oxi, ngọn lửa màu tím được tạo thành. Nếu thay vì lưu huỳnh, người ta thêm một carbohydrate rắn (shellac, đường, v.v.) vào đồng, thì ngọn lửa sẽ có màu xanh lục.
Đun nóng một nhúm cỏ roi ngựa (Grunspan) hoặc muối sulfuric với ngọn lửa của ống thổi cồn: dưới ảnh hưởng của khí cồn, ngọn lửa màu xanh lục sáng được hình thành. Thêm một ít calomel hoặc amoniac vào cùng một chất: bạn sẽ có ngọn lửa màu xanh lam sáng, bởi vì đồng kết hợp với clo được giải phóng và khi đốt cháy, tạo thành đồng clorua (Chlorkupfer). Đồng clorua dưới tác dụng của lửa cồn cháy với ngọn lửa màu xanh lục, vì hiđro của lửa cồn lấy đi clo ra khỏi đồng và làm cho nó mất tác dụng theo màu của ngọn lửa (CuCl 2 + 2H-2HCl + Cu). Nếu đốt cháy đồng oxit (Kupferoxyd, CuO) trong ngọn lửa cồn thì lõi và đáy ngọn lửa sẽ có màu trắng, mép và đầu lưỡi có màu xanh lam. Điều này được giải thích là do hydro của ngọn lửa đầu tiên khử oxit đồng (CuO + 2H = Cu + H 2 O), sau đó khả năng tạo màu của đồng lại xuất hiện ở vỏ ngoài của ngọn lửa dưới tác dụng của chất oxi hóa. khả năng của vỏ và nhiệt độ rất cao chứa trong nó.
Để tăng cường "độ dày" của màu, người ta sử dụng calomel, amoniac, mastic, shellac, v.v.
Tốc độ cháy của chế phẩm phụ thuộc chủ yếu vào:
- từ mối quan hệ hóa học giữa các nguyên tố bazơ và các chất phân hủy, tk. mức độ phân hủy và do đó, khả năng bắt cháy của bazơ phụ thuộc vào mức độ của mối quan hệ này;
- từ tỷ lệ tổng hợp, bởi vì đối với mỗi hỗn hợp, có một giới hạn cực hạn, khi đạt đến sự phân hủy nhanh nhất và hoàn toàn nhất của bazơ, trong khi nằm ngoài giới hạn này, tức là trước nó hoặc sau nó, kết quả tồi tệ nhất thu được - một giới hạn như vậy được gọi là "chuẩn mực";
- về độ cao nhiệt độ phát triển bởi quá trình đốt cháy;
- về mật độ và độ đồng đều của chế phẩm;
- từ ảnh hưởng hóa học tạp chất, tức là các yếu tố phụ kiện;
- từ độ ẩm không khí và độ hút ẩm của chế phẩm;
- từ nhiệt độ bên ngoài;
- cuối cùng, từ toàn bộ một loạt các nguyên nhân nhỏ và lớn, chính hoặc phụ, mỗi nguyên nhân đều có phần ảnh hưởng của riêng mình đối với quy trình chungđốt thuốc.
Xác định tốc độ cháy là một trong những nhiệm vụ quan trọng nhất của nghệ thuật bắn pháo hoa, bởi vì. kết nối với nó là câu hỏi về sự tăng cường hoặc chậm lại tùy ý của ngọn lửa, do đó, ở những nơi có liên quan, quy chuẩn được đặc biệt chú ý.
Theo trình tự thời gian đầu tiên (cuối thế kỷ 19) là lý thuyết nhiệt, những người sáng lập ra là Malyard, Le Chatelier và Nusselt. Lý thuyết này dựa trên giả thuyết van't Hoff về sự phụ thuộc nhiệt độ của tốc độ phản ứng hóa học. Điều kiện để xảy ra một vụ nổ nhiệt là sự tăng nhiệt vượt trội do phản ứng tỏa nhiệt ra môi trường. Trong trường hợp này, nhiệt tích tụ trong hệ thống, dẫn đến hiện tượng tự đốt nóng và do đó, phản ứng tự tăng tốc.
Việc xảy ra phản ứng oxy hóa trong một hệ thống dễ cháy thường liên quan đến việc đốt nóng hệ thống bởi một hoặc một nguồn đánh lửa khác. Khi hệ thống nhiên liệu được đốt nóng, năng lượng của các phân tử nhiên liệu và ôxy tăng lên và khi đạt đến một giá trị nhất định, chúng sẽ được kích hoạt, tức là các trung tâm hoạt động (gốc và nguyên tử) được hình thành có các hóa trị tự do, do đó các phân tử của chất dễ cháy dễ dàng kết hợp với oxy trong khí quyển. MỘT. Bach và K. Engler vào năm 1898 đã đề xuất một cách độc lập lý thuyết oxy hóa peroxit, theo đó, khi một hệ thống cháy được đốt nóng, oxy được kích hoạt bằng cách phá vỡ một liên kết giữa các nguyên tử, và phân tử hoạt động kết hợp với một chất dễ cháy mà không bị phân hủy thành nguyên tử và tạo thành hợp chất peroxit kiểu: R 1 -O-O-R 2 hoặc R-O-O-OH.
Tuy nhiên, lý thuyết peroxit không thể giải thích một số tính năng đặc trưng của quá trình oxy hóa, ví dụ, tác động mạnh, đôi khi dấu vết của các tạp chất lạ không đáng kể.
Tốc độ của một phản ứng hóa học, m / s, có thể được biểu thị, dựa trên định luật Arrhenius, bằng phương trình sau:
![]() , (1.12)
, (1.12)
ở đâu là hằng số tốc độ phản ứng (tốc độ của một phản ứng hóa học ở nồng độ của các chất phản ứng giảm xuống mức đơn nhất);
Nồng độ thuốc thử, mol / m 3;
Hệ số đo phân cực xác định bằng tỷ lệ giữa nồng độ của các thuốc thử ban đầu trong phương trình phản ứng đo phân cực;
Cơ sở của logarit tự nhiên;
Hằng số khí phổ, = 8,3 J / (mol ∙ K);
nhiệt độ, K.
Lý thuyết nhiệt về sự tự bốc cháy (còn gọi là lý thuyết về sự bùng nổ nhiệt) dựa trên sự so sánh tốc độ tỏa nhiệt trong quá trình oxy hóa tỏa nhiệt và tỏa nhiệt ra khỏi hỗn hợp phản ứng trong thành bình chứa nó. Điều kiện tự bốc cháy được xác định bởi sự bằng nhau của các tốc độ này. Nhiệt độ của thành bình đạt được sự bằng nhau này được gọi là nhiệt độ tự cháy. Bắt đầu từ nhiệt độ này (đặc trưng trong từng trường hợp đối với các điều kiện cụ thể - kích thước và hình dạng của bình, đặc tính nhiệt lý của chất khí), hiện tượng tự đốt nóng xảy ra, có thể dẫn đến chớp cháy (tự bốc cháy).
Tính đến những điều trên, để tự nóng lên trong môi trường phản ứng, chúng ta có thể viết:
Nhiệt dung ở thể tích không đổi là J / K;
Mật độ khí, kg / m 3;
Nhiệt độ khí, K;
Thời gian, s;
Hiệu ứng nhiệt của phản ứng, W;
Tốc độ phản ứng, m / s;
Bề mặt của bình phản ứng, m 2;
Thể tích của bình phản ứng, m 3;
Hệ số truyền nhiệt, W / (m 2 × K);
Nhiệt độ thành bình, K.
D.A. Frank-Kamenetsky đã đề xuất một tiêu chí cho hiện tượng tự bốc cháy do nhiệt, dựa trên sự vi phạm phân bố nhiệt độ tĩnh trong bình phản lực ở tốc độ tỏa nhiệt đủ:
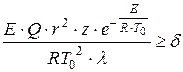 , (1.14)
, (1.14)
kích thước đặc trưng của tàu là ở đâu, m;
Cấp số nhân Preexponential;
Hệ số dẫn nhiệt hỗn hợp khí, W / (m × K);
Tiêu chí không thứ nguyên bằng 3,3; 0,88 và 2 tương ứng đối với các bình hình cầu, mặt phẳng song song và hình trụ.
Tiêu chí của D.A. Frank-Kamenetsky nên được hiểu như sau: nếu khi thay tất cả các tham số xác định ta được giá trị thì sẽ không có đánh lửa, khi đó sẽ xảy ra đánh lửa. Theo phương trình tiêu chuẩn, nhiệt của phản ứng và bán kính của bình mà phản ứng xảy ra là những yếu tố quyết định quan trọng của một vụ nổ. Sự bùng nổ nhiệt càng rõ rệt, thì các bất bình đẳng càng được thỏa mãn:
Nếu những bất đẳng thức này được thực hiện kém, thì vụ nổ nhiệt suy giảm - đồng thời với sự gia tăng nhiệt độ, sự cháy nhanh chóng của chất ban đầu xảy ra, làm mờ bức tranh của vụ nổ.
Sự xuất hiện của quá trình cháy thường liên quan đến việc đốt nóng hệ thống cháy bởi một hoặc một nguồn đánh lửa khác. Theo lý thuyết của Viện sĩ N.N. Semyonov, quá trình oxy hóa kèm theo sự tỏa nhiệt và trong những điều kiện nhất định có thể tự tăng tốc. Quá trình tự tăng tốc của phản ứng oxy hóa với quá trình chuyển sang quá trình cháy được gọi là quá trình tự cháy.
Trong trường hợp tự bốc cháy do nhiệt, nó xảy ra do tốc độ toả nhiệt vượt quá tốc độ toả nhiệt.
Hãy xem xét quá trình tự bốc cháy bằng nhiệt bằng cách sử dụng ví dụ về khí cháy hoặc hơi của chất lỏng dễ cháy với không khí đặt trong bình có thể tích. Khi nhiệt độ của bình và hỗn hợp cháy tăng lên, tốc độ phản ứng và sự tỏa nhiệt sẽ tăng lên. Sự phụ thuộc của tốc độ tỏa nhiệt vào nhiệt độ, J / s được xác định bởi:
![]() , (1.15)
, (1.15)
đâu là nhiệt của sự cháy của khí, J;
Thể tích của hỗn hợp cháy, m 3;
Hằng số tốc độ phản ứng;
Nồng độ của chất phản ứng, kg / m 3;
Thứ tự phản ứng;
Năng lượng hoạt hóa, J / mol;
Hằng số khí phổ J / (mol K);
Nhiệt độ của hỗn hợp, K.
Nhiệt giải phóng được truyền đến hỗn hợp dễ cháy, và nó nóng lên. Ngay sau khi nhiệt độ của hỗn hợp vượt quá nhiệt độ của thành bình, nhiệt sẽ bắt đầu được loại bỏ qua thành bình trong một đơn vị thời gian, tương ứng với sự chênh lệch nhiệt độ giữa hỗn hợp và thành bình và được xác định bởi sự phụ thuộc:
![]() , (1.16)
, (1.16)
tốc độ thoát nhiệt qua thành bình là J / s ở đâu;
Hệ số truyền nhiệt, J / (K m 2 × s);
Bề mặt của thành bình, m 2;
Nhiệt độ hỗn hợp, K;
Nhiệt độ thành bình, K

Hình 1.5 - Sự phụ thuộc của tỏa nhiệt vào nhiệt độ ở các áp suất khác nhau
Các đường cong 2, 3 và 4 trong hình 1.5 cho thấy sự phụ thuộc của sự tỏa nhiệt vào nhiệt độ ở các áp suất khác nhau và cùng thành phần của hỗn hợp. Ở nhiệt độ không đổi của bình và môi trường và thành phần hỗn hợp không đổi, nhiệt lượng thoát ra khỏi vùng cháy được đặc trưng bởi đường thẳng 1. Khi thành phần của hỗn hợp thay đổi, tốc độ mất nhiệt cũng thay đổi và, do đó, hệ số góc của đường thẳng. Áp suất càng cao thì nhiệt lượng tỏa ra càng nhiều trong quá trình phản ứng (đường cong 4). Trong các điều kiện được xác định bởi đường cong 2, sự tự bốc cháy không thể xảy ra, vì nhiệt mất mát (đường 1) cao hơn nhiệt tỏa ra ở áp suất này. Điểm tiếp xúc của đường cong 3 với đường thẳng tương ứng với trạng thái cân bằng giữa nhiệt lượng sinh ra và nhiệt lượng tỏa ra ở - nhiệt độ tự bốc cháy nhỏ nhất của một hệ dễ cháy nhất định trong các điều kiện đã cho. Với một nguồn cung cấp năng lượng nhẹ từ bên ngoài, có thể tự bốc cháy. Đường cong 4 đặc trưng cho các điều kiện mà hiện tượng tự bốc cháy là không thể tránh khỏi, vì nhiệt tỏa ra nhiều hơn nhiệt được loại bỏ.
Phân tích lược đồ trên, N.N. Semyonov đã thiết lập sự phụ thuộc:
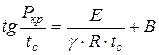 , (1.17)
, (1.17)
áp suất đánh lửa tối thiểu ở đâu, Pa;
Nhiệt độ tự cháy tối thiểu, K;
Thứ tự phản ứng;
Một hằng số phụ thuộc vào thành phần và các tính chất khác của hỗn hợp.
Dựa trên phương trình (1.17) này, về mặt lý thuyết, người ta có thể xác định trước liệu có thể tự bốc cháy hỗn hợp dễ cháy trong các điều kiện cụ thể hay không. Mối quan hệ liên quan giữa áp suất tối thiểu với nhiệt độ tự cháy đã được xác nhận bởi nhiều thí nghiệm và đã được chứng minh là có giá trị trong việc nghiên cứu các quá trình đốt cháy.
Lý thuyết dây chuyền đốt cháy
Trở lại năm 1928, N.N. Semenov đưa ra ý tưởng về khả năng tồn tại của hai loại vụ nổ trong hệ thống hóa học - chuỗi và nhiệt.
Phản ứng dây chuyền được gọi là phản ứng trải qua một loạt các giai đoạn (thông qua một loạt các phản ứng trung gian), trong đó các hợp chất trung gian có hóa trị tự do, được gọi là trung tâm hoạt động, được hình thành, là hạt nhân của các giai đoạn chảy nhanh tiếp theo của quá trình.
Lần đầu tiên, khái niệm về phản ứng dây chuyền xuất hiện vào năm 1913, khi nhà hóa học vật lý người Đức M. Bodenstein phát hiện ra rằng khi một hỗn hợp hydro và clo được chiếu sáng, phân tử clo, hấp thụ một lượng tử năng lượng ánh sáng, phân hủy thành các nguyên tử:
![]() .
.
Các nguyên tử clo ngay lập tức phản ứng với hiđro, dẫn đến một vụ nổ hỗn hợp. Việc kích hoạt một phân tử clo sẽ phải tạo ra hai phân tử:
![]() .
.
Tuy nhiên, các thí nghiệm cho thấy điều này tạo ra 100.000 phân tử hydro clorua. Điều này có thể được giải thích nếu chúng ta giả định rằng sự tương tác của clo với hydro tạo ra một sản phẩm, sản phẩm này, khi tham gia vào các phản ứng thứ cấp, được tái sinh một lần nữa và có thể tiếp tục phản ứng. Giả thiết này tương ứng với sơ đồ phản ứng sau:
Tôi phản ứng chính
IV Hở mạch
Theo sơ đồ này, việc kích hoạt một phân tử clo (I) gây ra sự xuất hiện của hai nguyên tử clo - hai trung tâm hoạt động của chuỗi phản ứng. Mỗi nguyên tử clo tạo ra phản ứng dây chuyền riêng của nó, trong đó tâm hoạt động liên tục bị khử (II, III). Do đó, dưới ảnh hưởng của phản ứng mở đầu (I), các phản ứng liên tiếp xảy ra, tạo thành một chuỗi (II, III, v.v.). Số lượng các phản ứng như vậy từ thời điểm bắt đầu chuỗi đến khi kết thúc được gọi là chiều dài chuỗi. Chuỗi có thể được kết thúc bằng sự va chạm của các nguyên tử clo (IV) hoặc hydro (V) và sự hình thành các phân tử từ chúng, hoặc do sự va chạm của các tâm hoạt động với bề mặt của chất rắn. Đây là một phản ứng dây chuyền không phân nhánh điển hình. Trong đó, mỗi vị trí hoạt động chỉ gây ra sự xuất hiện của một vị trí hoạt động mới, vì vậy phản ứng có thể tiếp tục, nhưng không tăng tốc.
Trong một chuỗi phản ứng phân nhánh, mỗi trung tâm hoạt động làm phát sinh hai hoặc nhiều trung tâm hoạt động mới.
Theo lý thuyết về phản ứng dây chuyền, quá trình oxy hóa bắt đầu bằng việc kích hoạt một chất dễ cháy.
Thực tiễn đã chỉ ra rằng sự đánh lửa có thể xảy ra trong các điều kiện đẳng nhiệt, tức là mà không làm tăng nhiệt độ của môi trường phản ứng (sự bốc cháy "nguội" của hỗn hợp). Trong trường hợp này, người ta nói về một vụ nổ dây chuyền (đẳng áp).
Hai thành phần ban đầu: nhiên liệu và chất oxy hóa, ở trạng thái phân tử tương đối ổn định, trước khi liên kết thành các phân tử mới, ổn định hơn của sản phẩm cháy, trải qua một chuỗi biến đổi trung gian phức tạp, dẫn đến hình thành các sản phẩm không ổn định: nguyên tử, gốc. , các phân tử bị kích thích với mức độ ion hóa tương đối lớn (fomandehit, gốc hydrocacbon và hydroxyl, oxy nguyên tử và hydro).
Kondratiev V.N. có thể phát hiện nồng độ cao của oxy nguyên tử (O), gốc hydroxit (OH), gốc hydrocacbon (CH 3), carbon monoxide (CO), formaldehyde (CH 2 O), v.v. trong ngọn lửa của các hydrocacbon khác nhau. nồng độ của các chất này trong ngọn lửa hóa ra lớn hơn hàng nghìn triệu lần nồng độ cân bằng của chúng trong quá trình phân hủy nhiệt ở nhiệt độ ngọn lửa của các sản phẩm phản ứng cuối cùng, ví dụ, H 2 O → H + OH.
Kết quả của những quan sát này dẫn đến kết luận rằng các nguyên tử và gốc được xem xét xuất hiện trong khí phản ứng không phải là kết quả của sự phân hủy cuối cùng của các sản phẩm, mà là sản phẩm trung gian của phản ứng.
Do đó, cơ chế chuỗi đánh lửa dựa trên toàn bộ một chuỗi biến đổi hóa học của chất này thành chất khác, kết quả của nó là sự hình thành các sản phẩm không bền về mặt hóa học rất hoạt động ở các giai đoạn trung gian riêng biệt, được gọi là trung tâm hoạt động, dễ dàng phản ứng với nhau và với các phân tử của các chất ban đầu có sự hình thành các vị trí hoạt động mới và các sản phẩm cuối cùng, ví dụ, đối với hỗn hợp khí metan gồm H 2 O và CO 2.
cao phản ứng các gốc và nguyên tử được giải thích là do năng lượng hoạt hóa của các phản ứng của chúng thấp, gần với năng lượng hoạt hóa của các phản ứng nguyên tử:
OH + H 2 \ u003d H 2 O + H - 25 kJ / mol
CH 3 + C 3 H 6 - 12,5 kJ / mol
CH 3 + C 6 H 6 - 23,5 kJ / mol
H 2 O → H + OH
Bất kỳ hạt nào trong số các hạt hoạt động tạo thành (H hoặc OH), cực kỳ không ổn định và do đó, hoạt động hóa học, va chạm với một phân tử của chất ban đầu, tách ra, tạo thành các hạt hoạt động mới:
H + O 2 \ u003d OH + O
OH + H 2 \ u003d H 2 O + H
Các phần tử H và OH hoạt động thu được từ kết quả của phản ứng sẽ lại tham gia vào các phản ứng, và các phần tử O sẽ tương tác với hydro:
O + H 2 \ u003d OH + H.
Nghĩa là, do kết quả của phản ứng giữa các phần tử hoạt động và các phân tử của chất ban đầu, không chỉ sản phẩm cuối cùng được hình thành, mà còn cả các phần tử hoạt động mới. Các phần tử hoạt động được hình thành do kết quả của phản ứng làm phát sinh các giai đoạn biến đổi hóa học mới, sẽ xảy ra cho đến khi tiêu thụ hoàn toàn các chất ban đầu.
Các phản ứng hóa học lặp đi lặp lại nhiều lần như vậy được gọi là chuỗi, và các hạt hoạt động tạo ra chuỗi biến đổi mới được gọi là trung tâm hoạt động.
Quá trình đốt cháy hydro được xem xét ở trên có thể được biểu diễn dưới dạng sơ đồ (Hình 1.6).
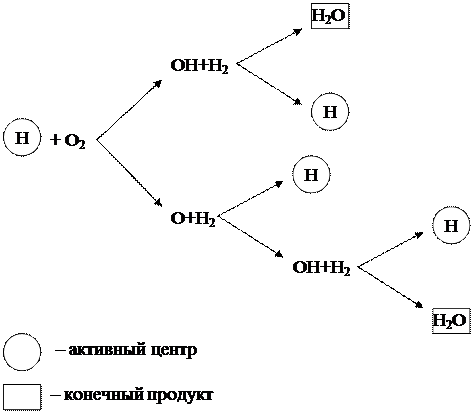
Hình 1.6 - Sơ đồ đốt cháy chuỗi hydro
Từ sơ đồ có thể thấy rằng chỉ có các hạt hydro (H), là trung tâm hoạt động, tạo ra chuỗi biến đổi mới. Đồng thời, trong mỗi mắt xích của quá trình dây chuyền, do kết quả của phản ứng giữa tâm hoạt động H và phân tử oxi O 2, ngoài sản phẩm cuối cùng là H 2 O, 3 tâm hoạt động mới H được hình thành, cho vươn lên những chuỗi biến đổi mới.
Một phản ứng dây chuyền như vậy, tiến hành với sự gia tăng các trung tâm hoạt động, được gọi là phân nhánh. Phản ứng phát triển giống như một trận tuyết lở và diễn ra với tốc độ rất cao, vượt quá tốc độ phản ứng phân tử thông thường một cách đáng kể.
Một phản ứng không phân nhánh điển hình là phản ứng của clo với hiđro. Các trung tâm hoạt động của phản ứng này là các nguyên tử clo và hydro xen kẽ. Khi một nguyên tử clo phản ứng, một nguyên tử hydro được tạo thành, cũng giống như khi một nguyên tử hydro phản ứng, một nguyên tử clo được hình thành. Do đó, phản ứng có thể tiếp tục, nhưng không tăng tốc.
Thực tế nổi tiếng là phản ứng quang hóa của clo với hydro vẫn kết thúc trong một vụ nổ (tự bốc cháy) được giải thích là do ở tốc độ đủ cao của chuỗi phản ứng, nhiệt lượng tỏa ra vượt quá nhiệt lượng tỏa ra. trong đó hỗn hợp rất nóng, và nảy sinh các điều kiện cần thiết cho quá trình tự bốc cháy do nhiệt.
Khi phản ứng chuỗi phân nhánh xảy ra, đặc trưng cho các hydrocacbon, nồng độ của các tâm hoạt động có thể tăng lên bất kể điều kiện khởi tạo ban đầu và nếu tốc độ hình thành các tâm hoạt động trong quá trình phân nhánh vượt quá tốc độ kết thúc chuỗi, thì hiện tượng tuyết lở tự tăng tốc. -Quá trình giống như xảy ra, dẫn đến đánh lửa.
Lý thuyết về phản ứng dây chuyền có thể giải thích nhiều đặc điểm của quá trình cháy (ảnh hưởng mạnh của tạp chất, giới hạn áp suất của quá trình tự bốc cháy, xúc tác và ức chế áp suất, v.v.) mà lý thuyết nhiệt không thể giải thích được. Cơ chế xuất hiện và phát triển của các vụ cháy, nổ thực sự được đặc trưng bởi một quá trình nhiệt - dây chuyền kết hợp. Đã bắt đầu theo dây chuyền, phản ứng oxi hóa do tỏa nhiệt của nó tiếp tục được tăng tốc theo đường nhiệt. Do đó, cuối cùng, các điều kiện quan trọng (hạn chế) cho sự khởi đầu và phát triển của quá trình cháy sẽ được xác định bằng sự tỏa nhiệt và các điều kiện trao đổi nhiệt giữa hệ thống phản ứng và môi trường.
Trên dây chuyền phản ứng hoá học nhiều quy trình công nghệ Trong công nghiệp hóa chất. Các quá trình như vậy bao gồm, ví dụ, các quá trình trùng hợp, tạo cơ sở cho việc sản xuất cao su tổng hợp, chất dẻo, sợi polyme và nhiều sản phẩm khác. Chúng cũng bao gồm quan trọng Quy trình công nghiệp, vì sản xuất axit béo tổng hợp thay thế chất béo ăn được sử dụng trước đây trong sản xuất chất tẩy rửa và chất bôi trơn, crackinh là quá trình thu được nhiên liệu chất lượng cao từ dầu, v.v.






