Maakaasun polttokaava. Maakaasu. palamisprosessia
A.S. Isserlin
Palamisprosessi perustuu kemialliset reaktiot polttoaineen ja hapettimen yhdistelmä. Jotta palamisprosessi voi tapahtua, kaasua on muodostettava erityisolosuhteet. Ensin on tarpeen tuoda riittävä määrä hapettavaa ainetta (useimmiten ilmaa) palavaan kaasuun ja sekoittaa ne. Toiseksi kaasu-ilmaseoksessa on oltava pitoisuusrajoja syttyvyys ja sytytyslähde on järjestettävä. Kolmanneksi on tarpeen luoda olosuhteet palamisprosessin kehittymiselle, eli tietty lämpötilataso.
Sekoitus (kaasun tasainen sekoittuminen ilman kanssa) on yksi koko palamisprosessin päävaiheista. Kaikki muut vaiheet, joiden läpi polttoaine kulkee kemiallisen energian muuntamisen aikana lämpöenergiaksi, riippuvat suurelta osin seoksen muodostusprosessista. Koska palamisvyöhykkeellä vallitsee aina korkea lämpötilataso, palamisen kemiallisiin reaktioihin kuluva aika on aina merkittävästi lyhyempi kuin seoksen muodostusprosessiin tarvittava aika.
Palaa kaasu polttoaine, kuten mikä tahansa muu, ilmavirrassa, nykyaikaisten näkemysten mukaisesti, se on mahdollista kineettisten ja diffuusioperiaatteiden perusteella.
Kaasun kokonaispalamisaika, joka määrittää palamisnopeuden,
TP TS~1"~X1
missä tc on sekoitusaika, joka tarvitaan kaasun sekoittamiseen hapettimen kanssa; tx on kemiallisten reaktioiden aika.
Jos ts<Стх, то практически тп«т*. В этом случае процесс протекает в кинетической области. Если же, наоборот, Тс^-Тх, то Тп»тс и, следовательно, процесс протекает в диффузионной области.
Kun palamisprosessi etenee kineettisellä alueella, palamisnopeus riippuu tietyn palavan seoksen ominaisuuksista, reaktiotilavuuden lämpötilasta ja reagenssien pitoisuudesta palamisvyöhykkeellä, eli sitä säätelevät kemian lait. kinetiikka. Samaan aikaan prosessin nopeus kineettisellä alueella ei riipu hydrodynaamisista tekijöistä, eli virtausnopeudesta, reaktiokammion geometrisista mitoista jne.
Päinvastoin, diffuusioalueella prosessin nopeus määräytyy hydrodynaamisten tekijöiden perusteella, eikä se riipu kineettisistä. Tällä alueella palavan seoksen ominaisuudet ja lämpötilatekijä lakkaavat olemasta ratkaisevia. Suhteellisen yksinkertaiset hydrodynaamiset keinot voivat vaikuttaa sekoituksen intensiteettiin, mikä johtaa muutokseen diffuusioliekin ominaisuuksissa.
Kineettisellä periaatteella polttimeen syntyy alustavasti homogeeninen kaasu-ilmaseos, joka syötetään polttokammioon. Siksi tällaisen seoksen palaminen etenee kaikkien pääominaisuuksien (lämpöjännitys, ylimääräinen ilma jne.) vakioarvolla. Puhtaasti kineettinen palaminen tapahtuu vain, jos ehto A^1.0. Kun<1 кинетическое горение протекает лишь на первой стадии, т. е. до тех пор, пока не израсходован весь кислород смеси. Остаток горючих компонентов, разбавленных продуктами сгорания, может быть сожжен только при условии подвода дополнительного окислителя (воздуха).
Palamisen diffuusioperiaate edellyttää sellaisten olosuhteiden luomista prosessin alkamiselle, joissa seos palaa välittömästi sen esiintyessä, eli kun polttoaine ja hapetin joutuvat kosketuksiin sopivissa määrällisissä suhteissa. Diffuusiopolttoprosessia ohjataan muuttamalla seoksen muodostumisen voimakkuutta muuttamalla polttimen rakennetta ja toimintaparametreja. Tämän seurauksena, riippuen teknologisista vaatimuksista, on mahdollista saavuttaa sekoitusvyöhykkeen lyhentäminen tai sen pidentäminen.
Käytännössä käytetään usein kaasupolttoa, jossa yhdistyvät molemmat edellä mainitut periaatteet. Tässä tapauksessa osa ilmasta esisekoitetaan polttimessa olevan kaasun kanssa, ja loput, jotka ovat välttämättömiä täydelliseen palamiseen, syötetään suoraan palamisalueelle. Tätä suhdetta muuttamalla on mahdollista vaikuttaa kaasupolttimen pituuteen. Useimmissa polttimissa kaasua syötetään jossain kulmassa ilmavirtaan nähden.
Seoksen muodostusprosessin tutkimiseen on omistettu paljon työtä. Tämä antaa meille mahdollisuuden muotoilla joitain yleisiä malleja.
Suoravirtauskaasupolttimissa mitä parempi sekoitus on, sitä suurempi polttimen poikkileikkaus on kaasusuihkujen peitossa, eli sitä suurempi kaasusuihkujen kantama. Polttimissa, joissa virtaukset pyörivät voimakkaasti, ei pidä pyrkiä suureen kaasusuihkuvalikoimaan.
Ilmavirran kierteen lisääntyminen johtaa kaasun ja ilman uudelleen jakautumiseen polttimen poikkileikkauksen yli, kaasun sekoittumisen intensiteetin lisääntymiseen ilman kanssa ja käänteisten virtojen keskialueen kasvuun polttimessa.
Ilmavirran kierteen vaikutuksen luonne seoksen muodostusprosessiin on erilainen riippuen muista määräävistä parametreista. Joten kun kaasua syötetään polttimen reuna-alueille (riippumatta sen tyypistä), virtauksen kierteen lisääntyminen johtaa huomattavaan parantumiseen seoksen muodostumisessa. Päinvastoin, kun kaasua syötetään polttimen keskialueelle, kierteen lisääntyminen ei yleensä johda prosessin parantumiseen, "ratkaisuun.
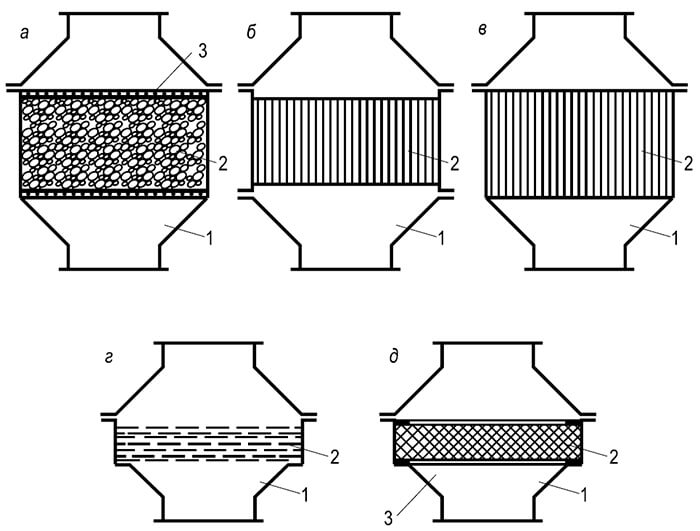
Ilmiöiden kokonaisuus, jota kutsumme palamiseksi, voi edetä vain tietyssä järjestyksessä, vaiheesta toiseen. G. F. Knorre esittää seuraavat kaaviot kaasun ja nestemäisten polttoaineiden tasaiselle polttoprosessille kiinteällä tulisijalla, jota hän kutsuu in-line-ksi (kuva 1). Yksinkertaisin virtauskaavio tapahtuu yksinkertaisista molekyyleistä (esimerkiksi vedystä) koostuvan kaasumaisen polttoaineen palamisen aikana, jotka eivät vaadi alustavaa monimutkaista pyrogeenistä hajoamista (kuva 1, MUTTA). Kun kaasua tai nestemäistä hiilivetypolttoainetta poltetaan, A 6
Palamisen virtausprosessi on monimutkainen: on toinen välivaihe - pyrogeeninen hajoaminen. Nestemäisten polttoaineiden osalta tätä vaihetta edeltää haihdutusvaihe (kuva 1.6). Virtauskaavion toteuttamiseksi vaaditaan riittävä lämpötilataso polttokammiossa, johon syötetään polttoainetta ja hapetinta jatkuvina virtauksina. Palamistuotteita poistetaan myös jatkuvasti palamislähteestä reaktioiden päättymisen jälkeen.
Tiedetään, että kaasu-ilma-seokset syttyvät vain, kun kaasupitoisuus ilmassa on tietyissä (jokaiselle kaasulle) rajoissa. Pienillä kaasupitoisuuksilla palamisen aikana vapautuva lämpö ei riitä saattamaan vierekkäisiä seoksen kerroksia syttymislämpötilaan. Sama havaitaan, kun kaasupitoisuus kaasu-ilmaseoksessa on liian korkea. Polttoilman hapenpuute johtaa lämpötilatason laskuun, minkä seurauksena seoksen viereiset kerrokset eivät lämpene
Syttymislämpötilat. Nämä kaksi tapausta vastaavat alempaa ja ylempää syttymisrajaa (taulukko 1). Siksi sen lisäksi, että kaasua sekoitetaan ilman kanssa tietyissä suhteissa, on luotava alkuolosuhteet seoksen syttymiselle.
|
Pöytä / Erilaisten ilmassa olevien kaasujen syttymisrajat ja syttymislämpötilat
|
Palavien kaasujen hapettuminen on mahdollista matalissa lämpötiloissa, mutta silloin se etenee erittäin hitaasti johtuen merkityksettömästä reaktionopeudesta. Lämpötilan noustessa hapettumisreaktion nopeus kasvaa, kunnes itsesyttyminen tapahtuu (hitaan hapettumisen sijaan alkaa itsestään syttymisprosessi). Tämä tarkoittaa, että syttymislämpötilaan lämmitetyllä palavalla seoksella on sellaista energiaa, joka ei ainoastaan kompensoi lämpöhäviötä ympäristöön, vaan myös lämmittää ja valmistaa palamisvyöhykkeelle tulevan kaasu-ilmaseoksen syttymistä varten.
Kaasun syttymislämpötila riippuu useista tekijöistä, mukaan lukien palavan kaasun pitoisuus kaasu-ilmaseoksessa, paine, seoksen kuumennustapa jne., joten se ei ole tarkka arvo. Taulukossa. Kuva 1 esittää joidenkin ilmassa olevien palavien kaasujen syttymislämpötilat.
Käytännössä palavien seosten sytyttämiseen on kaksi tapaa: itsesyttyminen ja sytytys.
klo Itsesyttyvyys palavan kaasu-ilmaseoksen koko tilavuus saatetaan vähitellen syttymislämpötilaan, minkä jälkeen seos syttyy ilman ulkoista lämpövaikutusta.
Tekniikassa toista menetelmää käytetään laajalti, ns sytytys. Tällä menetelmällä ei tarvitse lämmittää koko kaasu-ilmaseosta syttymislämpötilaan, riittää, että kylmä seos sytytetään jossain tilavuuden pisteessä jollain korkean lämpötilan lähteellä (kipinä, kuuma kappale, sytytysliekki, jne.). Tämän seurauksena sytytys välittyy koko seoksen tilavuuteen spontaanisti liekin etenemisen kautta, mikä ei tapahdu välittömästi, vaan tietyllä avaruudellisella nopeudella. Tätä nopeutta kutsutaan Liekin leviämisnopeus kaasu-ilma-seoksessa ja se on tärkein ominaisuus, joka määrää virtauksen ja palamisen stabiloinnin olosuhteet. Polttimien stabiilius, kuten alla esitetään, liittyy liekin etenemisnopeuteen.
Siten kaasumaisen polttoaineen palamisprosessi koostuu kaasun sekoittamisesta ilman kanssa, tuloksena olevan seoksen lämmittämisestä syttymislämpötilaan, sen sytyttämisestä ja palamisreaktioiden esiintymisestä, joihin liittyy lämmön vapautumista. Lisäksi kaasun sekoittaminen ilman kanssa ja seoksen kuumennus vievät suurimman osan ajasta palamisprosessissa, koska palamisreaktiot etenevät lähes välittömästi.
Teknisestä prosessista riippuen (höyryn ja kuuman veden saanti kattilayksikössä, tuotteiden lämmitys uuniasennuksessa jne.) tulee välttämättömäksi vaikuttaa palamisprosessiin muuttamalla sen lopullisia ominaisuuksia. Tämä saavutetaan erilaisilla rakentavilla tekniikoilla, jotka kuvataan kappaleessa. III.
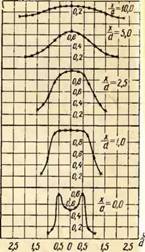
On ohjeellista verrata polttimen tilavuuden lämpötilakenttiä kaasun palamisen aikana eri ylimääräisten ilmakertoimien kanssa. Esimerkki tällaisesta vertailusta on kuvassa. 2 polttimelle, jonka poistosuuttimen halkaisija on 35 mm funktiona
|
|
Missä Ja- liekin lämpötilan nykyinen arvo, °C; tmax - liekin maksimilämpötila (mitattu), °С; X- etäisyys mittauspisteestä polttimen alkuun, m; klo- etäisyys mittauspisteestä polttimen akseliin, m; Y- poltinsuuttimen halkaisija, m.
Kuvassa Kuva 2 esittää kaavioita lämpötilan jakautumisesta kolmelle ylimääräisen ilman kertoimelle. Lisäksi koordinaatti X / v\u003d O vastaa polttimen suuttimen ulostulo-osaa ja koordinaattia K/v=0 - liekin akseli.
Kuten kuvasta näkyy, lämpötilan jakautuminen vapaassa liekissä on epätasainen. Pienillä primääriilman ylimäärillä, esimerkiksi a = 0,5, sisemmän ytimen läsnäolo liekissä vääristää suuresti lämpötilakenttää ja se tasoittuu vain etäisyydellä x / c / = 10, kun taas a = 0,75, tasaus tapahtuu jo klo X / v=2,5 ja kohdassa a=1,0 jopa aikaisemmin - klo X/d = 1,0.
Avoliekkien korkeimmat lämpötilat havaitaan alkuosissa etäisyyden päässä liekin akselista Kyllä / k \u003d 0,5 ja sitten polttimen keskelle. Lisäksi ylimääräisen ilman kertoimen kasvaessa maksimilämpötila siirtyy polttimen suulle. Siten korkein lämpötila a = 0,75 mitattiin etäisyydeltä X / v\u003d 2,5 ja \u003d 1,0 - etäisyydellä X/d = 1,0.
 Kun tarkastellaan lämpötilojen ja hiilidioksidipitoisuuksien jakautumista tulvassa yhdessä, maksimit osuvat yhteen
Kun tarkastellaan lämpötilojen ja hiilidioksidipitoisuuksien jakautumista tulvassa yhdessä, maksimit osuvat yhteen
Lämpötila ja CO2-pitoisuus. Näin ollen polttimen maksimilämpötilataso vastaa myös palamisasteen maksimiarvoa.
Osa kaasun palamisen seurauksena vapautuvasta lämmöstä on väistämätöntä. Ne voidaan kuitenkin vähentää minimiin palamisprosessin asianmukaisella ohjauksella. Mietitään, mitkä. komponentit lisäävät nämä häviöt.
Kaasumaisten polttoaineiden palamisen aikana tapahtuu seuraavia lämpöhäviöitä: pakokaasujen kanssa, kemiallisesta epätäydellisestä palamisesta ja ympäristöön. Yksittäisten lämpöhäviöiden käänteisellä tasapainolla määrityksen perusteella voidaan laskea yksikön hyötysuhde, ° / o:
Missä<72 - потери тепла с уходящими газами, %; - потери тепла
Palamisen kemiallisesta epätäydellisyydestä, %; Q5- lämpöhäviö ympäristöön, %.
Savukaasujen aiheuttama lämpöhäviö- yksiköstä lähtevien palamistuotteiden fyysinen lämpö - ovat tärkeimmät. Niitä on mahdotonta poistaa kokonaan, mutta niiden vähentämiseen on pyrittävä. Savukaasujen lämpöhäviöt riippuvat kaasujen lämpötilasta ja niiden määrästä. Mitä alhaisempi pakokaasujen lämpötila on, sitä vähemmän lämpöä häviää, joten pakokaasujen lämpötilaa tulee pyrkiä alentamaan kohtuullisissa rajoissa. Savukaasujen lämpötilan vaikutus lämpöhäviöön on nähtävissä taulukosta. 2.
taulukko 2
|
Savukaasujen lämpöhäviö maakaasun polton aikana, %
|
Pakokaasujen lämpöhäviö ilmaistaan yleensä prosentteina käytettävissä olevasta kokonaislämmöstä eli polttoaineen palamislämmöstä. Esimerkiksi jos maakaasua poltettaessa lämpöhäviö on 700 kcal/m3, niin
700-100 ___ „ 24°/
Yksiköstä poistuvien kaasujen määrä riippuu polttimen ja imukuppien ylimääräisestä ilmasuhteesta.
Ilmaa yksikössä olevien vuotojen kautta. Mitä suurempi ylimääräisen ilman kerroin polttimen ulostulossa ja ilman imu yksikköön, sitä suurempi on pakokaasujen lämpöhäviö. Taulukosta. Kuvasta 2 voidaan nähdä, että palamistuotteiden kokonaisylimääräisen ilmakertoimen muutos arvosta aa = 1,2-5-1,6 lisää savukaasujen lämpöhäviötä 10,5:stä 13,2 prosenttiin (savukaasujen vakiolämpötilassa 240 °C) .
Näin ollen pakokaasujen lämpöhäviöiden vähentämiseksi on välttämätöntä suorittaa polttoprosessi pienimmällä sallitulla ylimääräisellä ilmakertoimella, varmistaa yksikön suurin tiheys ja saavuttaa pakokaasujen lämpötilan lasku.
Kaasun kemiallisesta epätäydellisestä palamisesta aiheutuvia lämpöhäviöitä syntyy, kun ilmaa on puute, kaasupolttimessa on huono sekoittuminen ja palamisvyöhykkeen lämpötilataso laskee jyrkästi. Tämän seurauksena kaasun palaminen etenee epätäydellisesti ja palavat komponentit (esim. vety, hiilimonoksidi jne.) poistuvat palamistuotteiden mukana. Tämä johtaa polttoaineen kemiallisen energian vajaakäyttöön ja yksikön hyötysuhteen heikkenemiseen. Pienikin palavien komponenttien pitoisuus palamistuotteissa johtaa merkittäviin lämpöhäviöihin kemiallisesta epätäydellisestä palamisesta. Oletetaan, että palamistuotteet sisälsivät 0,7 % vetyä ja 0,5 % hiilimonoksidia. Yksikössä poltettiin maakaasua ylimääräisellä ilmakertoimella laitoksen jälkeen a» = 1,5. Palamisen kemiallisesta epätäydellisyydestä johtuvat lämpöhäviöt olivat ~450 kcal/m3 tai
A___ 450-100 poo/
Siten tarkastelusta esimerkistä voidaan nähdä, että palavien komponenttien tulisi olla palamistuotteissa kokonaan poissa tai olla minimaalisia.
Lämpöhäviö ympäristöön johtuu siitä, että yksikön seinien lämpötila on korkeampi kuin ympäröivän ilman. Näiden häviöiden suuruus riippuu pääasiassa yksikön ulkoseinien ja ympäröivän ilman lämpötilaerosta, seinäpinnan koosta, muurausmateriaalin lämmönjohtavuudesta ja sen paksuudesta. Ympäristöhäviöt lasketaan teoreettisesti tai lämpölaskennan normeista riippuen yksikön suunnittelusta ja suorituskyvystä.
Jos lasketaan yhteen kaikki lämpöhäviöt, jotka syntyvät kaasun palamisen aikana yksikössä ja vähennetään ne 100:sta, saadaan yksikön hyötysuhde. Esimerkiksi käyttämällä yllä olevia numeroita, olettaen<75 равным 3,60%, тогда к. п. д. агрегата
T]= 100-(8,24+5,28+3,60)=82,88 %*
8.1. PALTOREAKTIOT
Palaminen on nopeasti virtaava kemiallinen reaktio, jossa palavat komponentit yhdistetään happeen, johon liittyy voimakas lämmön vapautuminen ja palamistuotteiden lämpötilan voimakas nousu. Palamisreaktioita kuvataan ns. stoikiometriset yhtälöt, jotka kuvaavat laadullisesti ja kvantitatiivisesti reaktioon joutuvia ja siitä syntyviä aineita (Sytyttävän seoksen stoikiometrinen koostumus (kreikan sanasta stoicheion - perus, elementti ja kreikkalainen metreo - I mitta) - seoksen koostumus, jossa hapetin on täsmälleen niin paljon kuin on tarpeen polttoaineen täydelliseen hapettumiseen ). Minkä tahansa hiilivedyn palamisreaktion yleinen yhtälö
C m H n + (m + n/4) O 2 = mCO 2 + (n/2) H 2 O + Q(8,1)
missä m, n on hiili- ja vetyatomien lukumäärä molekyylissä; Q on reaktion lämpövaikutus tai palamislämpö.
Joidenkin kaasujen palamisreaktiot on esitetty taulukossa. 8.1. Nämä yhtälöt ovat tasapainoa, ja niiden perusteella on mahdotonta arvioida reaktioiden nopeutta tai kemiallisten muutosten mekanismia.
Taulukko 8.1. Kuivien kaasujen palamisreaktiot ja lämpöarvo (0°С ja 101,3 kPa)
| Kaasu | Palamisreaktio | Palamislämpö | |||||
|---|---|---|---|---|---|---|---|
| Molaari, kJ/kmol | Massa, kJ/kg | Tilavuus, kJ/m3 | |||||
| korkeampi | huonompi | korkeampi | huonompi | korkeampi | huonompi | ||
| Vety | H2 + 0,502 \u003d H20 | 286,06 | 242,90 | 141 900 | 120 080 | 12 750 | 10 790 |
| hiilimonoksidi | CO + 0,50 2 \u003d CO 2 | 283,17 | 283,17 | 10 090 | 10 090 | 12 640 | 12 640 |
| Metaani | CH 4 + 2O 2 \u003d CO 2 + 2H 2 O | 880,90 | 800,90 | 55 546 | 49 933 | 39 820 | 35 880 |
| Ethane | C 2 H 6 + 0,5 O 2 \u003d 2CO 2 + 3 H 2 O | 1560,90 | 1425,70 | 52 019 | 47 415 | 70 310 | 64 360 |
| Propaani | C 3 H 8 + 5 H 2 O \u003d 3CO 2 + 4 H 2 O | 2221,40 | 2041,40 | 50 385 | 46 302 | 101 210 | 93 180 |
| n-butaani | 2880,40 | 2655,00 | 51 344 | 47 327 | 133 800 | 123 570 | |
| Isobutaani | C 4 H 10 + 6,5 O 2 \u003d 4CO 2 + 5 H 2 O | 2873,50 | 2648,30 | 51 222 | 47 208 | 132 960 | 122 780 |
| n-pentaani | C 5 H 12 + 8O 2 \u003d 5CO 2 + 6H 2 O | 3539,10 | 3274,40 | 49 052 | 45 383 | 169 270 | 156 630 |
| Etyleeni | C 2 H 4 + 3O 2 \u003d 2CO 2 + 2H 2 O | 1412,00 | 1333,50 | 50 341 | 47 540 | 63 039 | 59 532 |
| Propyleeni | C 3 H 6 + 4,5 O 2 \u003d 3CO 2 + 3 H 2 O | 2059,50 | 1937,40 | 48 944 | 46 042 | 91 945 | 88 493 |
| Butyleeni | C 4 H 8 + 6O 2 \u003d 4CO 2 + 4H 2 O | 2720,00 | 2549,70 | 48 487 | 45 450 | 121 434 | 113 830 |
Lämpövaikutus (lämpöarvo) Q - lämpömäärä, joka vapautuu 1 kmoolin, 1 kg:n tai 1 m 3 kaasun täydellisen palamisen aikana normaaleissa fysikaalisissa olosuhteissa. On korkeampi Q in ja pienempi Q n -lämpöarvo: korkeampi lämpöarvo sisältää vesihöyryn tiivistymislämmön palamisen aikana (todellisuudessa kaasua poltettaessa vesihöyry ei tiivisty, vaan se poistuu muiden palamistuotteiden mukana) . Tyypillisesti tekniset laskelmat suoritetaan yleensä alemman lämpöarvon mukaan ottamatta huomioon vesihöyryn kondensaatiolämpöä (≈2400 kJ / kg).
Alemman lämpöarvon mukaan laskettu hyötysuhde on muodollisesti korkeampi, mutta vesihöyryn kondensaatiolämpö on melko korkea ja sen käyttö on enemmän kuin järkevää. Tämän vahvistaa kontaktilämmönvaihtimien aktiivinen käyttö lämmitystekniikassa, jotka ovat rakenteeltaan hyvin erilaisia.
Palavien kaasujen seokselle kaasujen korkeampi (ja pienempi) lämpöarvo määräytyy suhteella
Q = r 1 Q 1 + r 2 Q 2 + ... + r n Q n (8.2)
missä r 1 , r 2 , ..., r n - seokseen sisältyvien komponenttien tilavuusosuudet (moolimassat); Q 1 , Q 2 , …, Q n - komponenttien lämpöarvo.
Taulukon käyttö. 8.1, kompleksisen kaasun korkeampi ja alempi lämpöarvo, kJ / m 3, voidaan määrittää seuraavilla kaavoilla:
Q = 127,5 H 2 + 126,4 CO + 398 CH 4 + 703 C 2 H 6 + 1 012 C 8 H 8 + 1 338 C 4 H 10 + 1 329 C 4 H 10 +
+ 1693 C 5 H 12 + 630 C 2 H 4 + 919 C 3 H 6 + 1 214 C 4 H 8 (8,3)
Q n \u003d 107,9 H2 + 126,4 CO + 358,8 CH 4 + 643 C 2 H 6 + 931,8 C 8 H 8 + 1 235 C 4 H 10 + 1 227 C 4 H 10 +
+ 1566 C 5 H 12 + 595 C 2 H 4 + 884 C 8 H 6 + 1 138 C 4 H 8 (8,4)
jossa H2, CO, CH4 jne. - kaasupolttoaineen yksittäisten komponenttien pitoisuus, tilavuus. %.
Polttoprosessi on paljon monimutkaisempi kuin kaavan (8.1) mukaan, koska ketjujen haaroittumisen myötä ne katkeavat johtuen keskistabiilien yhdisteiden muodostumisesta, jotka muuttuvat edelleen korkeissa lämpötiloissa. Riittävällä happipitoisuudella muodostuu lopputuotteita: vesihöyryä H 2 O ja hiilidioksidi CO 2. Hapettavan aineen puuttuessa sekä reaktiovyöhykkeen jäähtyessä väliyhdisteet voivat stabiloitua ja päästä ympäristöön.
Lämmön vapautumisen voimakkuus ja lämpötilan nousu johtavat aktiivisten hiukkasten lisääntymiseen reagoivassa järjestelmässä. Tällainen lähes kaikille palamisprosesseille tyypillinen ketjureaktion ja lämpötilan välinen suhde johti ketjutermisen räjähdyksen käsitteen käyttöönottoon - itse palamisen kemialliset reaktiot ovat ketjuluonteisia, ja niiden kiihtyvyys johtuu lämmön vapautuminen ja lämpötilan nousu reagoivassa järjestelmässä.
Kemiallisen reaktion nopeus homogeenisessa seoksessa on verrannollinen reagoivien aineiden pitoisuuksien tuloon:
w = kС 1 С 2 (8,5)
jossa C1 ja C2 ovat reagoivien komponenttien pitoisuudet, kmol/m3; k - reaktionopeusvakio, riippuen reagoivien aineiden luonteesta ja lämpötilasta.
Kun kaasua poltetaan, lähtöaineiden pitoisuuksia voidaan pitää ehdollisesti muuttumattomina, koska palamisvyöhykkeellä tapahtuu jatkuvaa yksiarvoisen koostumuksen tuoreita komponentteja.
Reaktionopeusvakio (Arrhenius-yhtälön mukaan):
K \u003d K 0 e -E / RT (8,6)
jossa K 0 - biometrisille homogeenisille seoksille otettu preeksponentiaalinen kerroin, ≈1,0; E - aktivointienergia, kJ/kmol; R on yleiskaasuvakio, J/(kg K); T - absoluuttinen lämpötila, K (°C); e on luonnollisten logaritmien kanta.
Esieksponentiaalinen tekijä K 0 voidaan tulkita vakiona, joka heijastaa molekyylien törmäyksen täydellisyyttä, ja E - minimienergiana molekyylien sidosten katkaisemiseen ja aktiivisten hiukkasten muodostumiseen, jotka varmistavat törmäysten tehokkuuden. Tavallisille palaville seoksille se on (80÷150) 10 3 kJ/kmol.
Yhtälö (8.6) osoittaa, että kemiallisten reaktioiden nopeus kasvaa jyrkästi lämpötilan noustessa: esimerkiksi lämpötilan nousu 500 K:sta 1000 K:iin lisää palamisreaktion nopeutta kertoimella 2 10 4 ÷5 10 8 kertaa (riippuen aktivointienergiasta).
Palamisreaktioiden nopeuteen vaikuttaa niiden ketjuluonne. Aluksi reaktiossa syntyvät atomit ja radikaalit muodostavat yhdisteitä alkuaineiden kanssa ja keskenään muodostaen lopputuotteita ja uusia hiukkasia, jotka toistavat samaa reaktioketjua. Tällaisten hiukkasten lisääntyvä syntyminen johtaa kemiallisten reaktioiden "kiihtymiseen" - itse asiassa koko seoksen räjähtämiseen.
Hiilivetyjen poltto korkeassa lämpötilassa on monimutkaista ja liittyy aktiivisten hiukkasten muodostumiseen atomien ja radikaalien muodossa sekä molekyylien väliyhdisteiden muodossa. Esimerkkinä annetaan yksinkertaisimman hiilivedyn - metaanin palamisreaktiot:
- H + O 2 -› OH + O
CH4 + OH -› CH3 + H20
CH4 + O -› CH2 + H2O - CH 3 + O 2 -› HCNO + OH
CH 2 + O 2 -› HCHO + O - HCHO + OH -› HCO + H2O
HCNO + O -› CO + H2O
HCO + O 2 -› CO + O + OH - CO + O -› CO 2
CO + OH -› CO 2 + H
Yhden syklin tulos:
2CH 4 + 4O 2 -› 2CO 2 + 4H 2O
8.2. PALASTUSLASKELMAT
Polttohappi tulee sen osana ilmasta. Laskelmia varten oletetaan, että kuivan ilman tilavuuskoostumus on seuraava:
happi - 21,0%, typpi - 79,0%.
Annettujen tietojen mukaan 100/21 = 4,76 m 3 ilmaa sisältää 1 m 3 happea tai 79/21 = 3,76 m 3 typpeä 1 m 3 happea kohti. Ottaen huomioon, että 1 kmol kaasua normaaleissa olosuhteissa vie 22,4 litran tilavuuden, minkä tahansa ilmassa olevan hiilivedyn palamisreaktio (katso yhtälö 8.1) voidaan kirjoittaa yleistettynä:
C m H n + (t + n/4) (O 2 + 3,76 N 2) = tCO 2 + (n/2) H 2 O + (t + n/4) 3,76 N 2
Taulukossa on esitetty annetuista palamisreaktioista lasketut hapen ja ilman vaatimukset eri kaasujen palamisen aikana. 8.2.
Taulukko 8.2. Teoreettinen kuivan hapen ja ilman tarve m 3 ja kaasun palamistuotteiden tilavuus poltettaessa 1 m 3 kaasua
| Kaasu | Teoreettinen tarve | palamistuotteet | ||||
|---|---|---|---|---|---|---|
| happi | ilmaa | hiilidioksidi | vesihöyry | typpeä | Kaikki yhteensä | |
| Vety H2 | 0,5 | 2,38 | – | 1,0 | 1,88 | 2,88 |
| Hiilimonoksidi CO | 0,5 | 2,38 | 1,0 | – | 1,88 | 2,88 |
| Metaani CH 4 | 2,0 | 9,52 | 1,0 | 2,0 | 7,52 | 10,52 |
| Etaani C 2 H 6 | 3,5 | 16,66 | 2,0 | 3,0 | 13,16 | 18,16 |
| Propaani C 3 H 8 | 5,0 | 23,80 | 3,0 | 4,0 | 18,80 | 25,80 |
| Butaani C 4 H 10 | 6,5 | 30,94 | 4,0 | 5,0 | 24,44 | 33,44 |
| Pentaani C5H12 | 8,0 | 38,08 | 5,0 | 6,0 | 30,08 | 41,08 |
| Etyleeni C 2 H 4 | 3,0 | 14,28 | 2,0 | 2,0 | 11,28 | 15,28 |
| Propyleeni C 3 H 6 | 4,5 | 21,42 | 3,0 | 3,0 | 16,92 | 22,92 |
| Butyleeni C 4 H 8 | 6,0 | 28,56 | 4,0 | 4,0 | 22,56 | 30,56 |
| Pentyleeni C 5 H 10 | 7,5 | 35,70 | 5,0 | 5,0 | 28,20 | 38,20 |
| Asetyleeni C 2 H 2 | 2,5 | 11,90 | 2,0 | 1,0 | 9,40 | 12,40 |
Monimutkaiselle kaasulle kuivan ilman kulutus V c, m 3 / m 3 lasketaan kaavan mukaan, joka ottaa huomioon seoksen yksittäisten komponenttien hapenkulutuksen:
V c = 4,76 / 100 (0,5H2 + 0,5CO + 2CH4 + 3,5C2H6 + 5C3H8 + 6,5C4H10 + 3C2H4 + 4,5C3H6 +6C4H8 -O 2) (8.7)
Kostean ilman teoreettinen virtausnopeus V vl, m 3 / m 3, määräytyy enemmän kaavalla (8.7) sisältämän vesihöyryn tilavuudella:
V ow \u003d V s + 0,001244d V s (8,8)
missä d - ilman kosteus, g / m 3.
Kun kaasujen kemiallinen koostumus on tuntematon, mutta tunnetaan alhaisempi lämpöarvo Q n, kJ / m 3, teoreettinen ilmankulutus V t, m 3 / m 3,
Vt ≈ Q n / 3770 (8,9)
Todellinen ilmankulutus V dv, m 3 / m 3, otetaan aina jonkin verran suureksi:
V-moottori \u003d Vt α (8.10)
missä α on ylimääräisen ilman kerroin, joka vastaa GOST:n vaatimuksia. Polttoaineen täydellisessä palamisessa α:n arvon on oltava suurempi kuin 1. Palamistuotteiden koostumus ja tilavuus, joka on laskettu joidenkin kaasujen palamisreaktioista kuivassa ilmassa, on esitetty taulukossa. 8.2.
8.3 PALOLÄMPÖTILA
Lämpötekniikassa erotetaan seuraavat kaasujen palamislämpötilat: lämpöteho, kalorimetrinen, teoreettinen ja todellinen (laskettu). Lämmityskapasiteetti t w - kaasun täydellisen palamisen tuotteiden maksimilämpötila adiabaattisissa olosuhteissa ylimääräisen ilman kertoimella α = 1,0 ja kaasun ja ilman lämpötilassa 0 ° C:
t W = Q n /(∑Vc p)(8.11)
missä Q n - kaasun alempi lämpöarvo, kJ / m 3; ∑ Vc p - 1 m 3 kaasun (m 3 / m 3) palamisen aikana muodostuneiden hiilidioksidin, vesihöyryn ja typen tilavuuksien tulojen ja niiden keskimääräisten tilavuuslämpökapasiteettien summa vakiopaineessa lämpötiloissa 0:sta alkaen °C - tw (kJ/(m3o °C).
Kaasujen lämpökapasiteetin vaihtelevuuden vuoksi lämpöteho määräytyy peräkkäisten approksimaatioiden menetelmällä. Alkuparametriksi otetaan sen arvo maakaasulle (≈2000°C), arvolla α = 1,0 määritetään palamistuotteiden komponenttien tilavuudet taulukon mukaan. 8.3 lasketaan niiden keskimääräinen lämpökapasiteetti ja lasketaan sitten kaavan (8.11) mukaisesti kaasun lämpöteho. Jos laskennan tuloksena se osoittautuu alhaisemmaksi tai korkeammaksi kuin hyväksytty, asetetaan toinen lämpötila ja laskenta toistetaan.
Taulukko 8.3. Kaasujen keskimääräinen tilavuuslämpökapasiteetti, kJ / (m 3 °С)
Lämpötila, °C |
CO2 | N 2 | O2 | CO | CH 4 | H2 | H 2 O (vesihöyry) | ilmaa | |
|---|---|---|---|---|---|---|---|---|---|
| kuiva | märkä per 1 m 3 kuiva kaasu |
||||||||
| 0 | 1,5981 | 1,2970 | 1,3087 | 1,3062 | 1,5708 | 1,2852 | 1,4990 | 1,2991 | 1,3230 |
| 100 | 1,7186 | 1,2991 | 1,3209 | 1,3062 | 1,6590 | 1,2978 | 1,5103 | 1,3045 | 1,3285 |
| 200 | 1,8018 | 1,3045 | 1,3398 | 1,3146 | 1,7724 | 1,3020 | 1,5267 | 1,3142 | 1,3360 |
| 300 | 1,8770 | 1,3112 | 1,3608 | 1,3230 | 1,8984 | 1,3062 | 1,5473 | 1,3217 | 1,3465 |
| 400 | 1,9858 | 1,3213 | 1,3822 | 1,3356 | 2,0286 | 1,3104 | 1,5704 | 1,3335 | 1,3587 |
| 500 | 2,0030 | 1,3327 | 1,4024 | 1,3482 | 2,1504 | 1,3104 | 1,5943 | 1,3469 | 1,3787 |
| 600 | 2,0559 | 1,3453 | 1,4217 | 1,3650 | 2,2764 | 1,3146 | 1,6195 | 1,3612 | 1,3873 |
| 700 | 2,1034 | 1,3587 | 1,3549 | 1,3776 | 2,3898 | 1,3188 | 1,6464 | 1,3755 | 1,4020 |
| 800 | 2,1462 | 1,3717 | 1,4549 | 1,3944 | 2,5032 | 1,3230 | 1,6737 | 1,3889 | 1,4158 |
| 900 | 2,1857 | 1,3857 | 1,4692 | 1,4070 | 2,6040 | 1,3314 | 1,7010 | 1,4020 | 1,4293 |
| 1000 | 2,2210 | 1,3965 | 1,4822 | 1,4196 | 2,7048 | 1,3356 | 1,7283 | 1,4141 | 1,4419 |
| 1100 | 2,2525 | 1,4087 | 1,4902 | 1,4322 | 2,7930 | 1,3398 | 1,7556 | 1,4263 | 1,4545 |
| 1200 | 2,2819 | 1,4196 | 1,5063 | 1,4448 | 2,8812 | 1,3482 | 1,7825 | 1,4372 | 1,4658 |
| 1300 | 2,3079 | 1,4305 | 1,5154 | 1,4532 | – | 1,3566 | 1,8085 | 1,4482 | 1,4771 |
| 1400 | 2,3323 | 1,4406 | 1,5250 | 1,4658 | – | 1,3650 | 1,8341 | 1,4582 | 1,4876 |
| 1500 | 2,3545 | 1,4503 | 1,5343 | 1,4742 | – | 1,3818 | 1,8585 | 1,4675 | 1,4973 |
| 1600 | 2,3751 | 1,4587 | 1,5427 | – | – | – | 1,8824 | 1,4763 | 1,5065 |
| 1700 | 2,3944 | 1,4671 | 1,5511 | – | – | – | 1,9055 | 1,4843 | 1,5149 |
| 1800 | 2,4125 | 1,4746 | 1,5590 | – | – | – | 1,9278 | 1,4918 | 1,5225 |
| 1900 | 2,4289 | 1,4822 | 1,5666 | – | – | – | 1,9698 | 1,4994 | 1,5305 |
| 2000 | 2,4494 | 1,4889 | 1,5737 | 1,5078 | – | – | 1,9694 | 1,5376 | 1,5376 |
| 2100 | 2,4591 | 1,4952 | 1,5809 | – | – | – | 1,9891 | – | – |
| 2200 | 2,4725 | 1,5011 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2300 | 2,4860 | 1,5070 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2400 | 2,4977 | 1,5166 | 1,6002 | – | – | – | 2,0389 | – | – |
| 2500 | 2,5091 | 1,5175 | 1,6045 | – | – | – | 2,0593 | – | – |
Yleisten yksinkertaisten ja monimutkaisten kaasujen lämmöntuotto niiden palaessa kuivassa ilmassa on esitetty taulukossa. 8.4 Kun kaasua poltetaan ilmakehän ilmassa, joka sisältää noin 1 painon. % kosteutta, lämpöteho laskee 25-30°C.
Taulukko 8.4. Kaasujen lämmöntuotto kuivassa ilmassa
| yksinkertainen kaasu | Lämpöteho, °C | Yhdistetty kaasu keskimääräinen koostumus |
Arvioitu lämpöteho, °C |
|---|---|---|---|
| Vety | 2235 | maakaasukentät |
2040 |
| hiilimonoksidi | 2370 | luonnolliset öljykentät |
2080 |
| Metaani | 2043 | Koksi |
2120 |
| Ethane | 2097 | Liuskeen korkean lämpötilan tislaus |
1980 |
| Propaani | 2110 | Höyry-happipuhallus paineen alaisena |
2050 |
| Butaani | 2118 | Generaattori rasvaisista hiileistä |
1750 |
| Pentaani | 2119 | Generaattorin höyry-ilmapuhallus vähärasvaisista polttoaineista |
1670 |
| Etyleeni | 2284 | Nesteytetty (50 % C 3 H 4 + 50 % C 4 H 10) |
2115 |
| Asetyleeni | 2620 | 2210 |
Kalorimetrinen palamislämpötila t to - lämpötila, joka on määritetty ottamatta huomioon vesihöyryn ja hiilidioksidin dissosiaatiota, mutta ottaen huomioon kaasun ja ilman todellinen alkulämpötila. Se eroaa lämpöteosta t siten, että kaasun ja ilman lämpötila sekä ylimääräisen ilman kerroin α otetaan niiden todellisten arvojen mukaan. Voit määrittää t k:n kaavalla:
t k \u003d (Q n + q fyysinen) / (ΣVc p) (8.12)
missä q fysikaalinen - kaasun ja ilman lämpöpitoisuus (fyysinen lämpö), mitattuna 0 °C:sta, kJ / m3.
Luonnollisia ja nesteytettyjä hiilivetykaasuja ei yleensä lämmitetä ennen polttoa, ja niiden tilavuus on pieni verrattuna palamisilman määrään. Siksi kalorimetristä lämpötilaa määritettäessä kaasujen lämpöpitoisuus voidaan jättää huomiotta. Kun poltetaan matalalämpöarvoisia kaasuja (generaattori, masuuni jne.), niiden lämpöpitoisuudella (erityisesti ennen polttoa kuumennetuilla) on erittäin merkittävä vaikutus kalorimetriseen lämpötilaan.
Keskikoostumuksellisen maakaasun kalorimetrisen lämpötilan riippuvuus ilmassa, jonka lämpötila on 0 °C ja kosteus 1 % ylimääräisen ilman kertoimesta α on esitetty taulukossa. 8.5, nesteytetylle hiilivetykaasulle, kun sitä poltetaan kuivassa ilmassa - taulukossa. 8.7 Taulukon tiedot. 8.5–8.7 voidaan ohjata riittävän tarkasti määrittämään muiden, koostumukseltaan suhteellisen samankaltaisten maakaasujen ja lähes minkä tahansa koostumuksen mukaisten hiilivetykaasujen kalorimetriset palamislämpötilat. Jos on tarpeen saavuttaa korkea lämpötila poltettaessa kaasuja, joilla on alhainen ylimääräinen ilmakerroin, sekä lisätä uunien hyötysuhdetta, käytännössä ne lämmittävät ilmaa, mikä johtaa kalorimetrisen lämpötilan nousuun (katso taulukko 8.6).
Taulukko 8.5. Maakaasun kalorimetriset ja teoreettiset palamislämpötilat ilmassa, t = 0°C ja 1 % kosteus riippuen ylimääräisen ilman kertoimesta α
| Teoreettinen palamislämpötila t t, ° С | Ylimääräinen ilmakerroin α | Kalorimetrinen palamislämpötila t k, °С | ||
|---|---|---|---|---|
| 1,0 | 2010 | 1920 | 1,33 | 1620 |
| 1,02 | 1990 | 1900 | 1,36 | 1600 |
| 1,03 | 1970 | 1880 | 1,40 | 1570 |
| 1,05 | 1940 | 1870 | 1,43 | 1540 |
| 1,06 | 1920 | 1860 | 1,46 | 1510 |
| 1,08 | 1900 | 1850 | 1,50 | 1470 |
| 1,10 | 1880 | 1840 | 1,53 | 1440 |
| 1,12 | 1850 | 1820 | 1,57 | 1410 |
| 1,14 | 1820 | 1790 | 1,61 | 1380 |
| 1,16 | 1800 | 1770 | 1,66 | 1350 |
| 1,18 | 1780 | 1760 | 1,71 | 1320 |
| 1,20 | 1760 | 1750 | 1,76 | 1290 |
| 1,22 | 1730 | – | 1,82 | 1260 |
| 1,25 | 1700 | – | 1,87 | 1230 |
| 1,28 | 1670 | – | 1,94 | 1200 |
| 1,30 | 1650 | – | 2,00 | 1170 |
Taulukko 8.6. Maakaasun kalorimetrinen palamislämpötila t k, ° С, riippuen kuivan ilman ylimääräisestä kertoimesta ja sen lämpötilasta (pyöristetyt arvot)
| Ylimääräinen ilmakerroin α | Kuivan ilman lämpötila, °С | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| 0,5 | 1380 | 1430 | 1500 | 1545 | 1680 | 1680 | 1740 | 1810 | 1860 |
| 0,6 | 1610 | 1650 | 1715 | 1780 | 1840 | 1900 | 1960 | 2015 | 2150 |
| 0,7 | 1730 | 1780 | 1840 | 1915 | 1970 | 2040 | 2100 | 2200 | 2250 |
| 0,8 | 1880 | 1940 | 2010 | 2060 | 2130 | 2200 | 2260 | 2330 | 2390 |
| 0,9 | 1980 | 2030 | 2090 | 2150 | 2220 | 2290 | 2360 | 2420 | 2500 |
| 1,0 | 2050 | 2120 | 2200 | 2250 | 2320 | 2385 | 2450 | 2510 | 2560 |
| 1,2 | 1810 | 1860 | 1930 | 2000 | 2070 | 2140 | 2200 | 2280 | 2350 |
| 1,4 | 1610 | 1660 | 1740 | 1800 | 2870 | 1950 | 2030 | 2100 | 2160 |
| 1,6 | 1450 | 1510 | 1560 | 1640 | 1730 | 1800 | 1860 | 1950 | 2030 |
| 1,8 | 1320 | 1370 | 1460 | 1520 | 1590 | 1670 | 1740 | 1830 | 1920 |
| 2,0 | 1220 | 1270 | 1360 | 1420 | 1490 | 1570 | 1640 | 1720 | 1820 |
Taulukko 8.7. Kalorimetrinen palamislämpötila t tekniseksi propaaniksi kuivassa ilmassa, t = 0°C riippuen ylimääräisen ilman kertoimesta α
| Ylimääräinen ilmakerroin α | Kalorimetrinen palamislämpötila t k, °С | Ylimääräinen ilmakerroin α | Kalorimetrinen palamislämpötila t k, °С |
|---|---|---|---|
| 1,0 | 2110 | 1,45 | 1580 |
| 1,02 | 2080 | 1,48 | 1560 |
| 1,04 | 2050 | 1,50 | 1540 |
| 1,05 | 2030 | 1,55 | 1500 |
| 1,07 | 2010 | 1,60 | 1470 |
| 1,10 | 1970 | 1,65 | 1430 |
| 1,12 | 1950 | 1,70 | 1390 |
| 1,15 | 1910 | 1,75 | 1360 |
| 1,20 | 1840 | 1,80 | 1340 |
| 1,25 | 1780 | 1,85 | 1300 |
| 1,27 | 1750 | 1,90 | 1270 |
| 1,30 | 1730 | 1,95 | 1240 |
| 1,35 | 1670 | 2,00 | 1210 |
| 1,40 | 1630 | 2,10 | 1170 |
Teoreettinen palamislämpötila t T - maksimilämpötila, määritetty samalla tavalla kuin kalorimetrinen t k, mutta säädetty endotermisille (lämpöä vaativille) hiilidioksidin ja vesihöyryn dissosiaatioreaktioille, jotka etenevät tilavuuden kasvulla:
CO 2 ‹–› CO + 0,5O 2 - 283 mJ / mol (8,13)
H 2 O ‹–› H 2 + 0,5O 2 - 242 mJ / mol (8,14)
Korkeissa lämpötiloissa dissosiaatio voi johtaa atomien vety-, happi- ja OH-hydroksyyliryhmien muodostumiseen. Lisäksi kaasua poltettaessa muodostuu aina jonkin verran typen oksideja. Kaikki nämä reaktiot ovat endotermisiä ja johtavat palamislämpötilan laskuun.
Teoreettinen palamislämpötila voidaan määrittää seuraavalla kaavalla:
t T \u003d (Q n + q fyysinen - q dis) / (ΣVc p) (8.15)
missä q dis - lämmön kokonaiskustannus CO 2:n ja H 2 O:n dissosiaatiosta palamistuotteista, kJ / m 3; ΣVc p on palamistuotteiden tilavuuden ja keskimääräisen lämpökapasiteetin tulon summa, kun otetaan huomioon dissosiaatio 1 m 3 kaasua kohti.
Taulukko 8.8. Vesihöyryn H 2 O:n ja hiilidioksidin CO 2 dissosiaatioaste riippuen osapaineesta
| Lämpötila, °C | Osapaine, MPa | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,004 | 0,006 | 0,008 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,025 | 0,030 | 0,040 | |
| Vesihöyry H2O | ||||||||||||
| 1600 | 0,85 | 0,75 | 0,65 | 0,60 | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,42 |
| 1700 | 1,45 | 1,27 | 1,16 | 1,08 | 1,02 | 0,95 | 0,90 | 0,85 | 0,8 | 0,76 | 0,73 | 0,67 |
| 1800 | 2,40 | 2,10 | 1,90 | 1,80 | 1,70 | 1,60 | 1,53 | 1,46 | 1,40 | 1,30 | 1,25 | 1,15 |
| 1900 | 4,05 | 3,60 | 3,25 | 3,0 | 2,85 | 2,70 | 2,65 | 2,50 | 2,40 | 2,20 | 2,10 | 1,9 |
| 2000 | 5,75 | 5,05 | 4,60 | 4,30 | 4,0 | 3,80 | 3,55 | 3,50 | 3,40 | 3,15 | 2,95 | 2,65 |
| 2100 | 8,55 | 7,50 | 6,80 | 6,35 | 6,0 | 5,70 | 5,45 | 5,25 | 5,10 | 4,80 | 4,55 | 4,10 |
| 2200 | 12,3 | 10,8 | 9,90 | 9,90 | 8,80 | 8,35 | 7,95 | 7,65 | 7,40 | 6,90 | 6,50 | 5,90 |
| 2300 | 16,0 | 15,0 | 13,7 | 12,9 | 12,2 | 11,6 | 11,1 | 10,7 | 10,4 | 9,6 | 9,1 | 8,4 |
| 2400 | 22,5 | 20,0 | 18,4 | 17,2 | 16,3 | 15,6 | 15,0 | 14,4 | 13,9 | 13,0 | 12,2 | 11,2 |
| 2500 | 28,5 | 25,6 | 23,5 | 22,1 | 20,9 | 20,0 | 19,3 | 18,6 | 18,0 | 16,8 | 15,9 | 14,6 |
| 3000 | 70,6 | 66,7 | 63,8 | 61,6 | 59,6 | 58,0 | 56,5 | 55,4 | 54,3 | 51,9 | 50,0 | 47,0 |
| Hiilidioksidi CO2 | ||||||||||||
| 1500 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | – |
| 1600 | 2,0 | 1,8 | 1,6 | 1,5 | 1,45 | 1,4 | 1,35 | 1,3 | 1,25 | 1,2 | 1,1 | |
| 1700 | 3,8 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,4 | 2,3 | 2,2 | 2,0 | 1,9 | |
| 1800 | 6,3 | 5,5 | 5,0 | 4,6 | 4,4 | 4,2 | 4,0 | 3,8 | 3,7 | 3,5 | 3,3 | |
| 1900 | 10,1 | 8,9 | 8,1 | 7,6 | 7,2 | 6,8 | 6,5 | 6,3 | 6,1 | 5,6 | 5,3 | |
| 2000 | 16,5 | 14,6 | 13,4 | 12,5 | 11,8 | 11,2 | 10,8 | 10,4 | 10,0 | 9,4 | 8,8 | |
| 2100 | 23,9 | 21,3 | 19,6 | 18,3 | 17,3 | 16,5 | 15,9 | 15,3 | 14,9 | 13,9 | 13,1 | |
| 2200 | 35,1 | 31,5 | 29,2 | 27,5 | 26,1 | 25,0 | 24,1 | 23,3 | 22,6 | 21,2 | 20,1 | |
| 2300 | 44,7 | 40,7 | 37,9 | 35,9 | 34,3 | 32,9 | 31,8 | 30,9 | 30,0 | 28,2 | 26,9 | |
| 2400 | 56,0 | 51,8 | 48,8 | 46,5 | 44,6 | 43,1 | 41,8 | 40,6 | 39,6 | 37,5 | 35,8 | |
| 2500 | 66,3 | 62,2 | 59,3 | 56,9 | 55,0 | 53,4 | 52,0 | 50,7 | 49,7 | 47,3 | 45,4 | |
| 3000 | 94,9 | 93,9 | 93,1 | 92,3 | 91,7 | 90,6 | 90,1 | 89,6 | 88,5 | 87,6 | 86,8 | |
Kuten taulukosta voidaan nähdä. 8.8, lämpötiloissa 1600 ° C asti, dissosiaatioastetta ei voida ottaa huomioon, ja teoreettinen palamislämpötila voidaan pitää yhtä suurena kuin kalorimetrinen. Korkeammissa lämpötiloissa dissosiaatioaste voi merkittävästi alentaa työtilan lämpötilaa. Käytännössä tähän ei ole erityistä tarvetta, teoreettinen palamislämpötila on määritettävä vain esilämmitetyllä ilmalla toimiville korkean lämpötilan uuneille (esim. tulisijauunit). Kattilaasennuksissa tämä ei ole välttämätöntä.
Taulukko 8.9. Enimmäismäärä
nousevia lämpötiloja
vapaassa liekissä, ° С
Palamistuotteiden todellinen (laskettu) lämpötila t d- lämpötila, joka saavutetaan todellisissa olosuhteissa polttimen kuumimmassa kohdassa. Se on pienempi kuin teoreettinen ja riippuu lämpöhäviöstä ympäristöön, lämmönsiirtoasteesta palamisvyöhykkeestä säteilyn avulla, palamisprosessin pituudesta ajassa jne. Uunien ja kattiloiden todelliset keskilämpötilat ovat määräytyy lämpötasapainon tai suunnilleen teoreettisen tai kalorimetrisen palamislämpötilan mukaan, riippuen uunien lämpötilasta, kun niihin on lisätty kokeellisesti vahvistettuja korjauskertoimia:
t d = t t η(8,16)
missä η- ns. pyrometrinen kerroin rajoissa:
- hyvin tehdyille lämpö- ja lämmitysuuneille, joissa on lämpöeristys - 0,75–0,85;
- suljetuille uuneille ilman lämpöeristystä - 0,70–0,75;
- suojatuille kattilauuneille - 0,60–0,75.
Käytännössä on välttämätöntä tietää paitsi yllä olevat adiabaattiset palamislämpötilat, myös liekissä esiintyvät maksimilämpötilat. Niiden likimääräiset arvot määritetään yleensä kokeellisesti spektrografisilla menetelmillä. Vapaassa liekissä esiintyvät maksimilämpötilat 5-10 mm etäisyydellä kartiomaisen palorintaman yläosasta on esitetty taulukossa. 8.9. Annettujen tietojen analyysi osoittaa, että liekin maksimilämpötilat ovat alhaisemmat kuin lämmöntuotto (johtuen lämmön hinnasta H 2 O:n ja CO 2:n dissosioitumiseen ja lämmön poistoon liekkivyöhykkeeltä).
8.4 SYTTYMISLÄMPÖTILA
Palamisreaktioiden käynnistämiseksi tarvitaan olosuhteet polttoaineseoksen syttymiselle hapettimen kanssa. Syttyminen voi olla spontaani ja pakko (sytytys).
Itsesyttymislämpötila- minimilämpötila, jossa spontaani (eli ilman ulkoista lämmönsyöttöä) palamisprosessi alkaa kuumennetussa kaasu-ilma-seoksessa, mikä johtuu palavien kaasuhiukkasten aiheuttamasta lämmön vapautumisesta.
Itsesyttymislämpötila ei ole kiinteä tietylle kaasulle ja riippuu monista parametreistä: sen pitoisuudesta kaasu-ilmaseoksessa, seoksen homogeenisuusasteesta, astian muodosta ja koosta, jossa seosta kuumennetaan, nopeudesta ja sen lämmitysmenetelmä, astian seinien katalyyttinen vaikutus, paine, jossa seos. Näiden tekijöiden tarkka huomioon ottaminen on erittäin vaikeaa, joten käytännössä esimerkiksi räjähtävyyttä arvioitaessa käytetään kokeellisia tietoja (ks. taulukko 8.10).
Taulukko 8.10. Joidenkin kaasujen ja höyryjen alhaisimmat mitatut itsesyttymislämpötilat ilman kanssa ilmanpaineessa
Palavien kaasujen itsesyttymislämpötilat hapessa ovat jonkin verran alhaisemmat kuin ilmassa. Painolastiepäpuhtauksien (typpi ja hiilidioksidi) lisääminen kaasukoostumukseen johtaa itsesyttymislämpötilan nousuun. Alhaisen itsesyttymislämpötilan omaavien komponenttien läsnäolo monimutkaisissa kaasuissa johtaa seoksen itsesyttymislämpötilan laskuun.
Pakkosytytys (sytytys) suoritetaan syttämällä seos yhdessä tai useammassa kohdassa korkean lämpötilan lähteellä - avotulella tai sähkökipinällä kohdassa, jossa kaasua karkaa polttimien polttokanavista uunin tilavuuteen. . Sytytys eroaa itsesyttymisestä siinä, että palava seos tuodaan liekin muotoon ei koko tilavuudessaan, vaan vain pienessä osassa sitä. Lämmönpoisto lämmitetyltä vyöhykkeeltä edellyttää, että sytytyslähteen lämmön vapautumisnopeus ylittää tämän lämmönpoiston. Kun sytytys on sytytetty, sytytyslähde poistetaan ja palaminen tapahtuu levittämällä liekin eturintamaa.
8.5 SYTTYVYYS- JA RÄJÄHDYSRAJAT
Kaasu-ilma-seokset voivat syttyä (räjähtää) vain, kun seoksen kaasupitoisuus on tietyissä (jokaiselle kaasulle) rajoissa. Tässä suhteessa on syttyvyyden ala- ja yläpitoisuusrajat. Alaraja vastaa minimiä ja ylempi - seoksen kaasun enimmäismäärää, jossa ne syttyvät (sytytyksen aikana) ja spontaani (ilman lämmön tuloa ulkopuolelta) liekin leviämistä (itsesyttymistä). Samat rajat vastaavat kaasu-ilma-seosten räjähtävyysolosuhteita.
Jos kaasu-ilmaseoksen kaasupitoisuus on pienempi kuin syttyvyysraja, tällainen seos ei voi palaa ja räjähtää, koska sytytyslähteen lähellä vapautuva lämpö ei riitä lämmittämään seosta syttymislämpötilaan. Jos seoksen kaasupitoisuus on alemman ja ylemmän syttymisrajan välillä, syttynyt seos syttyy ja palaa sekä sytytyslähteen lähellä että poistettaessa. Tämä seos on räjähtävää. Mitä laajempi syttymisrajat (kutsutaan myös räjähdysrajoiksi) ja mitä pienempi alaraja on, sitä räjähdysherkempi kaasu on. Ja lopuksi, jos seoksen kaasupitoisuus ylittää ylemmän syttymisrajan, seoksen ilman määrä ei ole riittävä kaasun täydelliseen palamiseen.
Syttymisrajojen olemassaolo johtuu palamisen aikana tapahtuvasta lämpöhäviöstä. Kun palava seos laimennetaan ilmalla, hapella tai kaasulla, lämpöhäviöt kasvavat, liekin etenemisnopeus laskee ja palaminen lakkaa, kun sytytyslähde on poistettu.
Taulukko 8.11. Ilman kanssa sekoitettujen kaasujen syttymisrajat (lämpötilassa t = 20°C ja p = 101,3 kPa)
| Kaasu | Kaasupitoisuus kaasu-ilmaseoksessa, tilavuus % | Enimmäismäärä |
Ilmakerroin α syttymisrajoilla | ||||
|---|---|---|---|---|---|---|---|
| Syttymisrajojen sisällä | Seoksen stoikiometrisellä koostumuksella | Seoksen koostumus antaa suurimman räjähdyspaineen | |||||
| alempi | ylempi | alempi | ylempi | ||||
| Vety | 4,0 | 75,0 | 29,5 | 32,3 | 0,739 | 9,8 | 0,15 |
| hiilimonoksidi | 12,5 | 74,0 | 29,5 | – | – | 2,9 | 0,15 |
| Metaani | 5,0 | 15,0 | 9,5 | 9,8 | 0,717 | 1,8 | 0,65 |
| Ethane | 3,2 | 12,5 | 5,68 | 6,28 | 0,725 | 1,9 | 0,42 |
| Propaani | 2,3 | 9,5 | 4,04 | 4,60 | 0,858 | 1,7 | 0,40 |
| n-butaani | 1,7 | 8,5 | 3,14 | 3,6 | 0,858 | 1,7 | 0,35 |
| Isobutaani | 1,8 | 8,4 | 3,14 | – | – | ~1,8 | 0,35 |
| n-pentaani | 1,4 | 7,8 | 2,56 | 3,0 | 0,865 | 1,8 | 0,31 |
| Etyleeni | 3,0 | 16,0 | 6,5 | 8,0 | 0,886 | 2,2 | 0,17 |
| Propyleeni | 2,4 | 10,0 | 4,5 | ~5,1 | ~0,89 | 1,9 | 0,37 |
| Butyleeni | 1,7 | 9,0 | 3,4 | ~4,0 | ~0,88 | 1,7 | 0,35 |
| Asetyleeni | 2,5 | 80,0 | 7,75 | 14,5 | 1,03 | 3,3 | 0,019 |
Taulukko 8.12. Hapen kanssa sekoitettujen kaasujen syttymisrajat (lämpötilassa t = 20°C ja p = 101,3 kPa)
Yleisten kaasujen syttymisrajat seoksissa ilman ja hapen kanssa on esitetty taulukossa. 8.11–8.12. Seoksen lämpötilan noustessa syttymisrajat laajenevat, ja itsesyttymislämpötilan ylittävässä lämpötilassa kaasuseokset ilman tai hapen kanssa palavat millä tahansa tilavuussuhteella.
Syttymisrajat eivät riipu pelkästään palavien kaasujen tyypeistä, vaan myös kokeiden olosuhteista (astian tilavuus, sytytyslähteen lämpöteho, seoksen lämpötila, liekin eteneminen ylös, alas, vaakatasossa jne.). Tämä selittää näiden rajojen hieman erilaiset arvot eri kirjallisissa lähteissä. Taulukossa. Kuvat 8.11–8.12 esittävät suhteellisen luotettavia tietoja, jotka on saatu huoneenlämpötilassa ja ilmanpaineessa liekin leviämisen aikana alhaalta ylöspäin putkessa, jonka halkaisija on vähintään 50 mm. Kun liekki leviää ylhäältä alas tai vaakasuoraan, alarajat kasvavat hieman ja ylärajat pienenevät. Monimutkaisten palavien kaasujen, jotka eivät sisällä painolastiepäpuhtauksia, syttymisrajat määräytyvät summaussäännön mukaan:
L g \u003d (r 1 + r 2 + ... + r n) / (r 1 / l 1 + r 2 / l 2 + ... + r n / l n) (8.17)
jossa L g on kaasu-ilma- tai kaasu-happiseoksessa olevan kompleksisen kaasun syttymisraja ala- tai yläraja, tilavuus. %; r 1 , r 2 , …, r n - yksittäisten komponenttien pitoisuus kompleksisessa kaasussa, tilavuus. %; r 1 + r 2 + ... + r n \u003d 100 %; l 1, l 2, ..., l n - yksittäisten komponenttien syttymisrajat kaasu-ilma- tai kaasu-happiseoksessa taulukon mukaan. 8.11 tai 8.12, voi. %.
Jos kaasussa on painolasti-epäpuhtauksia, syttymisrajat voidaan määrittää kaavalla:
L b \u003d L g / (8,18)
jossa L b - seoksen syttymisrajat painolasti-epäpuhtauksien kanssa, tilavuus. %; L g - palavan seoksen syttyvyyden ylä- ja alarajat, tilavuus. %; B - painolastin epäpuhtauksien määrä, yksikön jakeet.
Laskennassa on usein tarpeen tietää eri syttyvyysrajojen ylimääräinen ilmakerroin α (katso Taulukko 8.11) sekä kaasu-ilmaseoksen räjähdyksen aikana muodostuva paine. Ylempää tai alempaa syttymisrajaa vastaava ylimääräinen ilmakerroin voidaan määrittää kaavalla
α = (100/L – 1) (1/V T)(8.19)
Kaasu-ilma-seosten räjähtämisestä syntyvä paine voidaan määrittää riittävällä likimäärällä seuraavilla kaavoilla:
yksinkertaisen kaasun ja ilman stoikiometriselle suhteelle:
P vz \u003d P n (1 + βt k) (m / n) (8,20)
mille tahansa monimutkaisen kaasun ja ilman suhteelle:
R vz \u003d R n (1 + βt k) V vlps / (1 + αV m) (8.21)
missä P vz - räjähdyksestä syntyvä paine, MPa; p n - alkupaine (ennen räjähdystä), MPa; β - kaasujen tilavuuslaajenemiskerroin, numeerisesti yhtä suuri kuin painekerroin (1/273); t K - kalorimetrinen palamislämpötila, °С; m on moolien lukumäärä räjähdyksen jälkeen, joka määräytyy kaasun palamisreaktion perusteella ilmassa; n on palamisreaktioon osallistuneiden moolien lukumäärä ennen räjähdystä; V vlps - märkien palamistuotteiden määrä 1 m 3 kaasua kohti, m 3; V t - teoreettinen ilmankulutus, m 3 /m 3.
Taulukko 8.13. Propaani-ilma-seoksen räjähdyksestä syntyvä paine purkauskertoimesta k sb ja suojalaitteen tyypistä riippuen
| Suojalaitteen tyyppi | Purkauskerroin k sb, m 2 / m 3 | ||
|---|---|---|---|
| 0,063 | 0,033 | 0,019 | |
| Yksittäinen kiinteä lasitus ulkokiinnityksellä 3 mm paksusta lasista | 0,005 | 0,009 | 0,019 |
| Kaksinkertainen kiinteä lasitus ulkokiinnikkeellä 3 mm paksua lasia | 0,007 | 0,015 | 0,029 |
| Kääntyvä yksittäinen ikkunakehys isolla saranalla ja jousilukolla 5 MPa/m 2 -kuormitukseen | 0,002 | – | – |
| Kääntyvä yksittäinen ikkunakehys yläsaranalla ja jousilukolla 5 MPa/m 2 -kuormitukseen | 0,003 | – | – |
| Lattialla vapaasti makaavat laatat, joiden massa, kg / m 2: | |||
| 0,023 | |||
| 0,005 | |||
| 0,018 | |||
Räjähdyspaineet taulukossa. 8.13 tai kaavoilla määritetty voi tapahtua vain, jos kaasu palaa kokonaan säiliön sisällä ja sen seinämät on suunniteltu näitä paineita varten. Muuten niitä rajoittaa seinien tai niiden helpoimmin tuhoutuvien osien lujuus - painepulssit etenevät seoksen syttymättömän tilavuuden läpi äänen nopeudella ja saavuttavat aidan paljon nopeammin kuin liekkirintama.
Tätä ominaisuutta - liekin etenemisnopeuksien ja painepulssien eroa (iskuaalto) - käytetään laajalti käytännössä suojaamaan kaasulaitteita ja tiloja tuhoutumiselta räjähdyksen aikana. Tätä varten seinien ja kattojen aukkoihin asennetaan helposti avautuvat tai romahtavat peräpeilit, kehykset, paneelit, venttiilit jne. Räjähdyksen aiheuttama paine riippuu suojalaitteiden suunnitteluominaisuuksista ja purkauskertoimesta k sb, joka on suojalaitteiden pinta-alan suhde huoneen tilavuuteen.
8.6. PALTO TYHJÄSSÄ YMPÄRISTÖSSÄ
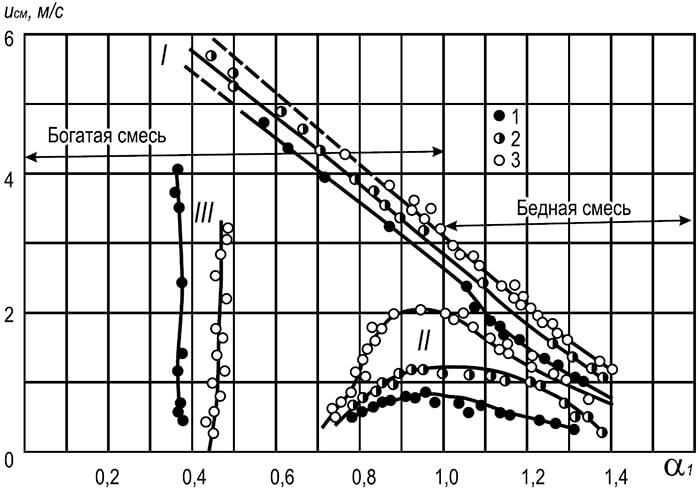
Liekkivyöhykkeen - liekkirintaman, - alueen, joka erottaa reagoimattoman palavan seoksen palamistuotteista, liike johtuu siitä, että sen edessä oleva kylmä palava seos kuumenee syttymislämpötilaan lämmönjohtavuuden ja diffuusion vuoksi. kuumia palamistuotteita kylmään seokseen. Lineaarista nopeutta, jolla liekinrintama liikkuu homogeenisen palavan seoksen läpi, kutsutaan tasainen liekin etenemisnopeus riippuen sekä kaasun tyypistä että sen pitoisuudesta kaasu-ilmaseoksessa. Kaikentyyppisten palavien kaasujen vähimmäisnopeus vastaa syttymisen ala- ja ylärajaa ja suurin - kaasujen ja ilman suhdetta.
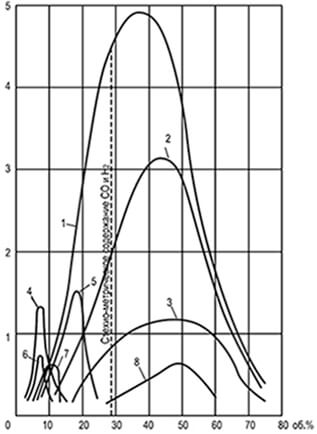
Riisi. 8.1. Tasaisten nopeuksien käyrät
liekin leviäminen u n, määritelty
putkessa, jonka halkaisija on 25,4 mm
1-vety; 2-vesikaasu; 3-hiilimonoksidi;
4-eteeni; 5-koksiuunikaasu; 6-etaani; 7-metaani;
8 generaattorin höyry-ilma puhalluskaasu
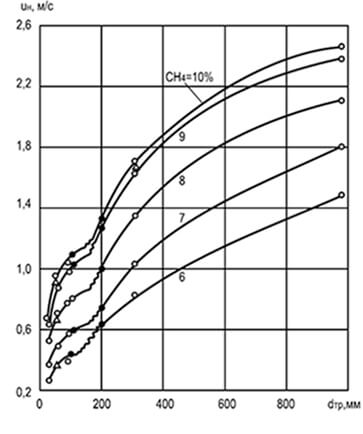
Riisi. 8.2. Halkaisijan d tr ja pitoisuuden vaikutus
metaani sekoitettuna ilmaan muuttumaan
tasainen liekin etenemisnopeus u n
Kokeet ovat osoittaneet, että liekin etenemisnopeus riippuu sylinterimäisen putken halkaisijasta, jonka läpi se etenee: mitä suurempi halkaisija, sitä suurempi etenemisnopeus. Putken halkaisijan kasvu vähentää seinien vaikutusta palamisprosessiin ja liikkuvaan liekin eturintamaan ja edistää konvektiota (kuva 8.2). Kaaviotietojen analyysi osoittaa, että erittäin pienillä putkikokoilla liekin leviäminen on yleensä mahdotonta (johtuen voimakkaasta suhteellisesta lämmönpoistosta). Putkien, kanavien ja rakojen kokoja, joissa liekki ei leviä, kutsutaan kriittisiksi.
Ne ovat erilaisia eri kaasuille:
- kylmä metaanin seos ilman kanssa - 3 mm;
- vety-ilma-seos - 0,9 mm;
- lämmitetty metaanin seos ilman kanssa - 1,2 mm.
Poikkileikkaukseltaan pienissä kanavissa tapahtuvaa sammuttamista käytetään käytännössä palosammuttimien luomiseen: liekinsammutusritilät, keraamiset huokoiset kiekot, puristetuista metallipalloista tehdyt kiekot, hienorakeisilla materiaaleilla täytetyt astiat jne.); palokanavat kaasu-ilmaseoksilla toimivien polttimien suunnittelussa.
Kaasujen palavien ominaisuuksien vertailua varten (putkien koosta riippumatta) käsite "normaali liekin etenemisnopeus"- tämä on nopeus, jolla tarkoitetaan kylmää (vielä syttymätöntä) seosta, jolla liekki liikkuu normaalia pitkin sen pintaan. Liekin etuosan oletetaan olevan tasainen ja yhtä suuri kuin putken halkaisija:
u n \u003d w p πr 2 / S (8,22)
missä u n on liekin normaali etenemisnopeus, m/s; w p - mitattu tasainen liekin etenemisnopeus, m/s; r - putken säde, m; S on liekin rintaman pinta-ala, m 2 .
Taulukko 8.14. Liekin etenemisnopeudet erilaisissa kaasu-ilma-seoksissa (lämpötilassa t=20°C ja p=103,3 kPa), m/s
| Kaasu | Seos maksimi normaalin kanssa liekin etenemisnopeus |
Stökiometrinen seos | ||||
|---|---|---|---|---|---|---|
| Seoksen pitoisuus, tilavuus % | Enimmäismäärä normaali nopeus levittäminen |
Seoksen pitoisuus, tilavuus % | Normaali nopeus levittäminen liekki |
|||
| kaasua | ilmaa | kaasua | ilmaa | |||
| Vety | 42,0 | 58,0 | 2,67 | 29,5 | 70,5 | 1,6 |
| hiilimonoksidi | 43,0 | 57,0 | 0,42 | 29,5 | 70,5 | 0,30 |
| Metaani | 10,5 | 89,0 | 0,37 | 9,5 | 90,5 | 0,28 |
| Ethane | 6,3 | 93,7 | 0,40 | 5,7 | 94,3 | 0,32 |
| Propaani | 4,3 | 95,7 | 0,38 | 4,04 | 95,96 | 0,31 |
| n-butaani | 3,3 | 96,7 | 0,37 | 3,14 | 96,86 | 0,30 |
| Etyleeni | 7,0 | 93,0 | 0,63 | 6,5 | 93,5 | 0,5 |
| Propyleeni | 4,8 | 95,2 | 0,44 | 4,5 | 95,5 | 0,37 |
| Butyleeni | 3,7 | 96,3 | 0,43 | 3,4 | 96,6 | 0,38 |
| Asetyleeni | 10,0 | 90,0 | 1,35 | 7,75 | 92,25 | 1,0 |
Kuten taulukon tiedoista voidaan nähdä. 8.14, liekin suurin etenemisnopeus vastaa kaasun ja ilman sekoituksia, joissa ei ole hapetinta (ei stoikiometrinen). Ylimääräisellä polttoaineella reagoivien hiukkasten törmäyksen tehokkuus kasvaa ja kemiallisten reaktioiden nopeus kasvaa.
Liekin etenemisnopeudet kaasu-happi-seoksilla ovat suuruusluokkaa suuremmat kuin kaasu-ilma-seoksilla. Suurin normaali liekin etenemisnopeus metaani-happiseoksella on siis 3,3 m/s ja propaanin ja butaanin seoksella hapen kanssa 3,5–3,6 m/s.
Suurin normaali liekin etenemisnopeus kompleksisen kaasun ja ilman seoksessa, m/s, määritetään kaavalla:
u n max \u003d (r 1 u 1 + r 2 u 2 + ... + r n u n) / (r 1 + r 2 + ... + r n) (8.23)
missä r 1 , r 2 ,…r n on yksittäisten komponenttien pitoisuus kompleksisessa kaasussa, tilavuus. %; u 1 , u 2 ,...u n ovat ilman kanssa sekoitettujen kaasukomponenttien suurimmat normaalit liekin etenemisnopeudet, m/s.
Annetut suhteet sopivat kaasuille, joiden liekin etenemisnopeus on lähellä normaalia, esimerkiksi luonnon- ja nesteytetyille hiilivetykaasuille. Kaasuseoksille, joilla on dramaattisesti erilaiset liekin etenemisnopeudet (esim. luonnon- ja keinotekoisten kaasujen seokset, seokset, joissa on korkea vetypitoisuus), ne antavat vain likimääräisiä arvoja.
Jos seos sisältää painolastiepäpuhtauksia (typpeä ja hiilidioksidia), liekin etenemisnopeuden likimääräiseen laskemiseen on käytettävä seuraavaa kaavaa:
u b \u003d u n max (1 - 0,01N 2 - 0,012CO 2) (8,24)
Lisää merkittävästi liekin etenemisnopeutta kuumentamalla kaasu-ilmaseosta:
u' n \u003d u n (T' / T) (8.25)
missä u’n ovat liekin etenemisnopeudet kuumennetussa seoksessa absoluuttisella lämpötilalla T’, K; ja n - sama, kylmässä seoksessa, jonka lämpötila on T, K.
Seoksen esikuumennus muuttaa sen tiheyttä käänteisesti suhteessa absoluuttiseen lämpötilaan, ja siksi liekin etenemisnopeudet kasvavat suhteessa tähän lämpötilaan. Tämä seikka on otettava huomioon laskelmissa, erityisesti niissä tapauksissa, joissa polttimien polttokanavat sijaitsevat lämmitetyssä muurauksessa tai kun niihin vaikuttaa uunin säteily, kuumat kaasut jne.
Liekin leviämisen tasaisuus on mahdollista seuraavissa olosuhteissa:
- paloputki on lyhyt;
- palaminen etenee vakiopaineessa, joka on lähellä ilmakehän painetta.
Jos putken pituus on merkittävä, liekin tasainen eteneminen joillekin seoksille voi muuttua värähteleväksi ja sitten räjähdykseksi, jolla on yliääninopeus (2000 m/s tai enemmän), kun seos syttyy. iskuaallon takia, joka lämmittää seoksen syttymislämpötilaa korkeampiin lämpötiloihin. Räjähdys tapahtuu seoksissa, joissa liekin etenemisnopeus on suuri. Räjähdyspitoisuuden rajat ovat kapeammat kuin kaasu-ilma- ja kaasu-happi-seosten syttymisrajat, tilavuus. %: propaani - 3,2-37, isobutaani - 2,8-31, vety - 15-90. Räjähdyspolton aikana syntyvä paine voi ylittää alkupaineen kymmeniä kertoja ja johtaa korkeille paineille suunniteltujen putkien ja muiden astioiden tuhoutumiseen.
8.7 PALTO LAMINAARI- JA TURBULENTTIVIRTAUKSESSA

Riisi. 8.3 polttorintama
kaasu-ilma-seos sisään
laminaarista liikettä
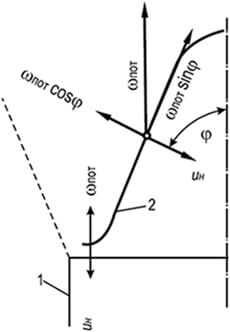
Liekin rintama voidaan pysäyttää luomalla palavan seoksen vastaantuleva liike nopeudella, joka vastaa liekin normaalia etenemisnopeutta. Hyvä esimerkki on Bunsen-polttimen sisäkartion pinta. Säätämällä polttimesta ulos virtaavan kaasu-ilma-seoksen koostumusta laminaarisella liikkeellä saadaan aikaan vakaa ja jyrkästi määritellyn palamiskartion ulkonäkö (kuva 8.3). Kartion sivupinta (liekin etu), joka on paikallaan poltinkanavan polttoreunaan nähden, liikkuu kohti ulosvirtaavaa kaasu-ilmaseosta ja liekki etenee tässä tapauksessa sytytyspintaan nähden normaalisti jokaisessa sen pisteet. Kartiomaisen liekin rintaman pinnalla nopeuksien yhtäläisyys säilyy - kaasu-ilma-seoksen virtausnopeuden projektiot normaalilla wн kartion generaattoriin ja normaali liekin etenemisnopeus eivät noudata Michelsonin lakia:
w n \u003d w hiki cosφ \u003d u n (8,26)
missä φ on virtaussuunnan ja kartiomaisen liekkirintaman pinnan normaalin välinen kulma; w hiki - polttimen läpi kulkevan kaasu-ilmaseoksen keskimääräinen virtausnopeus aikayksikköä kohti, m/s.
Liekin normaalin etenemisnopeuden pysyvyys pätee vain kartiomaisen liekkirintaman sivupinnan pääosaan. Kartion yläosassa nopeus kasvaa kaasu-ilma-seoksen kuumenemisen vuoksi liekin etuosan kartiomaisen pinnan lähekkäin sijaitsevien osien kautta ja kartion pohjassa se laskee päädyn jäähdytysvaikutuksen johdosta. osa polttimen palokanavaa.
Käytännön laskelmissa tämä ero yleensä jätetään huomiotta ja seoksen kulkunopeuden liekinrintaman läpi oletetaan olevan vakio kartion koko pinnalla ja yhtä suuri kuin u n.
Keskimääräinen normaali liekin etenemisnopeus on
u n \u003d V cm / S (8,27)
missä V cm on polttimen läpi kulkevan kaasu-ilmaseoksen tilavuus, S on kartiomaisen liekin eturintaman pinta-ala.
Käytännössä kartiomaisella liekinrintamalla ei ole säännöllistä geometrista muotoa, joten S:n tarkan määrittämiseksi liekki valokuvataan, liekin eturintama on jaettu sarjaan katkaistuja kartioita. Sivupintojen summa on kartiomaisen liekin eturintaman kokonaispinta. Sekä Bunsen-poltinmenetelmällä että muilla menetelmillä määritettyjen liekin normaalien etenemisnopeuksien arvot ovat samat ja yhtä suuret kuin taulukossa annetut normaalinopeudet. 8.14.
Kartiomaisen liekin etuosan korkeus riippuu pääasiassa polttimen palokanavan koosta. Liekin korkeutta voidaan pienentää murskaamalla suuret palokanavat useiksi pieniksi. Saman koostumuksen omaaville kaasu-ilma-seoksille pienten kanavien kartiomaisten liekkirintamien korkeus h voidaan määrittää likimäärin yhden kanavan H liekinrintaman korkeudesta:
h = H/ √n(8,28)
missä n on pienten kanavien lukumäärä.
Suuren lämpötehon omaavissa polttimissa (teollisten kattiloiden polttimet, uunit jne.) palaminen tapahtuu pääsääntöisesti pyörteisessä virtauksessa - sileä kartiomainen liekin etuosa on epäselvä ja menettää selkeän kartiomuotonsa pyörreliikkeen ja pulsaatioiden vuoksi. Tässä tapauksessa havaitaan kaksi ominaista palamistyyppiä, jotka vastaavat pienimuotoista ja laajamittaista turbulenssia.
Turbulenssiasteikoissa, jotka eivät ylitä laminaarisen palamisvyöhykkeen paksuutta, kartiomainen liekkirintama säilyttää muotonsa ja pysyy tasaisena, vaikka palamisvyöhyke kasvaa. Jos turbulenssin asteikko ylittää normaalin palamisvyöhykkeen paksuuden, kartiomaisen liekkirintaman pinta muuttuu epätasaiseksi. Tämä johtaa polttorintaman kokonaispinnan kasvuun ja suuremman palavan seoksen määrän palamiseen virtauspoikkileikkausyksikköä kohti.
Suuren mittakaavan turbulenssissa, joka on paljon suurempi kuin laminaarisen palamisvyöhykkeen paksuus, liekin rintaman pinnan häiriö johtaa kuuman seoksen yksittäisten hiukkasten erottumiseen, jotka murskaavat myöhemmillä sykkeillä. Liekin etuosa menettää eheytensä ja muuttuu erillisten palamiskeskusten järjestelmäksi palavan seoksen samanarvoisten hiukkasten muodossa, jotka hajoavat ja palavat virtauksessa.

Riisi. 8.4 Suhteellisen nopeuden muutos
koksiuunin kaasuliekin leviäminen
sekoitettuna ilman kanssa lukumäärästä riippuen
Reynolds ja seoksen liiketapa
Laajamittaisessa turbulenssissa liekkirintaman pinta, joka koostuu kaikkien palavien hiukkasten pinnoista, kasvaa, mikä johtaa liekin etenemisnopeuden jyrkäseen kasvuun (kuva 8.4). Tässä tapauksessa ei voi tapahtua vain frontaalista palamista, joka etenee normaalinopeudella v n, vaan myös tilavuuspolttoa, joka syntyy kuumien palamistuotteiden turbulenteista sykkimistä tuoreeseen seokseen. Näin ollen liekin kokonaisetenemisnopeus laajamittaisen turbulenssin aikana määräytyy yhden tai toisen frontaalisen ja tilavuuspolton elementtien yhdistelmän avulla.
Pulsaatioiden puuttuessa pyörteisestä palamisnopeudesta tulee yhtä suuri kuin liekin normaali etenemisnopeus. Päinvastoin, jos sykkimisnopeus on paljon suurempi kuin normaali, pyörteinen palamisnopeus tulee vähän riippuvaiseksi palavan seoksen fysikaalis-kemiallisista ominaisuuksista. Kokeet ovat osoittaneet pienten erilaisten homogeenisten kaasu-ilma-seosten, joiden α>1, palamisnopeudet riippuvat teollisuusuuneissa normaalista liekin etenemisnopeudesta.
8.8 PALON STABIILISUUS
Riisi. 8.5 Suora korvausjärjestelmä
u n \u003d w hiki laminaarisen liikkeen aikana
kaasu-ilma-seos
1 – polttimen seinä;
2 - liekin etuosa
Tärkeimmät palamisen vakauteen vaikuttavat tekijät ovat kaasu-ilmaseoksen ulosvirtausnopeus ja liekin leviäminen. Kaasu-ilma-seosten palamisen aikana laminaarivirrassa kartiomaisen liekin eturintaman vakaa osa on sen alaosa. Tässä vaiheessa liekkirintama käännetään ilmakehään virtaavan kaasu-ilma-seoksen laajenemisen ja kanavan seinämän hidastusvaikutuksen vuoksi vaakasuoraan ja nostetaan kanavan reunan yläpuolelle liekkirintaman paksuuden verran (kuva 1). 8.5).
Tässä etuosan osassa kaasu-ilmavirtauksen nopeus on täysin kompensoitu liekin etenemisnopeudella u n = w hiki . Liekin rintaman muualla kartiomaisella osalla kompensointi on osittainen ja se suoritetaan vain palamisrintaman normaaliin suuntaan: u n = w hiki cosφ . Komponentti w hiki sinφ pysyy epätasapainossa ja kuljettaa syttymiskohdan kartion tyvestä sen yläosaan. Kartiomaisen liekkirintaman vakaus selittyy sillä, että pohjassa oleva rengasmainen hihna toimii sytytyslähteenä, jota ilman kaasu-ilmaseoksen virtaus kuljettaisi muun etuosan pois.
Jos seoksen virtausnopeus ylittää liekin etenemisnopeuden, sytytyshihnan leveys pienenee, kunnes se muuttuu merkityksettömäksi. Tässä tapauksessa liekin etuosan vakaus rikkoutuu ja irtoaminen polttimesta tapahtuu. Jos liekin etenemisnopeus rengasmaisella lähellä seinää olevalla alueella (ei seinällä) ylittää kaasu-ilmaseoksen ulosvirtausnopeuden, liekki vedetään polttimen sekoittimeen (ylivirta).
Irrotettuna siellä on:
- liekin vika polttimesta ja sen sammuminen;
- erotus palokanavan reunasta, kun liekki saavuttaa uuden, melko vakaan aseman polttimen yläpuolella olevassa virtauksessa;
- nostetun liekin hajoaminen ja sen sammuminen;
- nostetun polttimen työntäminen polttimen palokanavan reunaan;
- muodostaen suspendoituneen liekin, kun suihku sytytetään jonkin matkan päässä polttimesta.
Kaikkia näitä ilmiöitä ei voida hyväksyä, koska ne johtavat palamattoman kaasun kertymiseen ympäröivään ilmakehään tai uuniin.
Riisi. 8.6. Yksittäisen erotusnopeuden riippuvuus
liekit avoimessa ilmakehässä luonnon sekoituksia
kaasu ilmalla palokanavan kokoiseksi ja
primääriilmapitoisuus.
Riisi. 8.7 Irtautumisnopeuden riippuvuus
monisäikeinen liekki avoimessa ilmakehässä
maakaasun ja ilman seoksia
palokanava ja pääilmasisältö.
a - poltinkaavio; b – liekin erotuskäyrät
Kuvassa 8.6 esittää kokeelliset käyrät liekin erotuksesta kylmän kaasun ja ilman seoksella toimivien ruiskupolttimien palokanavien reunoista. Näiden käyrien rajalla ja yläpuolella alkaa liekin irtoaminen, ja käyrien alapuolella alkaa vakaa palaminen.
Käytännössä yleisiä ovat usean polttimen ruiskupolttimet, joiden palokanavat ovat halkaisijaltaan 2–6 mm (kuva 8.7). Liekin erotusnopeudet w ref tällaisille polttimille voidaan määrittää seuraavan kaavan mukaan:
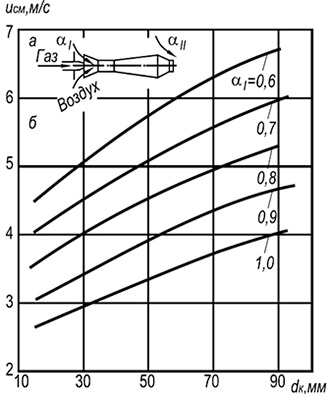
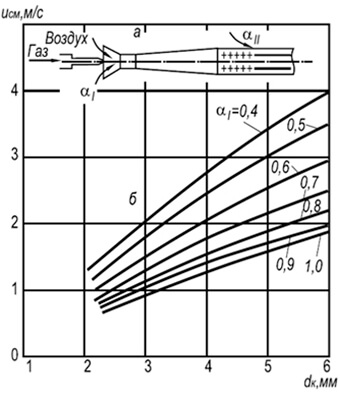
w neg = 3,5 10 -3 d k T 2 (1 + V t) / (1 + α 1 V t) (8,29)
missä d k on polttokanavien halkaisija, m; a 1 - primääriilman ylimäärän kerroin; T on kaasu-ilma-seoksen absoluuttinen lämpötila, K.
Kaavasta voidaan nähdä, että palamiskestävyys kasvaa palokanavien halkaisijoiden ja lämpötilan kasvaessa ja laskee primääriilman ylijäämäkertoimen kasvaessa. Palamisen stabiilisuus lisääntyy myös liekin keskinäisen vaikutuksen ansiosta.
Liekin irtoaminen palokanavista voi tapahtua myös muista syistä. Jos poltinta ja savukaasuja ei ole sijoitettu oikein, ne voivat päästä polttimen suuttimeen ja johtaa liekin erottumiseen (pienentämällä liekin etenemisnopeutta inertillä kaasulla laimennetussa kaasu-ilma-seoksessa). Eroamisen syynä voi olla myös liekin palokanavista puhaltavan toisioilman suuri nopeus.
Taulukko 8.15. Homogeenisen luonnollisen seoksen nopeus
kaasu ilman kanssa, jolloin tapahtuu läpimurto
liekki, m/s (seoksen lämpötila 20°C)
| Halkaisijat ampuminen kanavia |
Primääriilmasuhde | |||||
|---|---|---|---|---|---|---|
| 0,6 | 0,7 | 0,8 | 0,9 | 1,0 | 1,1 | |
| 3,5 | 0,05 | 0,10 | 0,18 | 0,22 | 0,23 | 0,21 |
| 4,0 | 0,08 | 0,12 | 0,22 | 0,25 | 0,26 | 0,20 |
| 5,0 | 0,09 | 0,16 | 0,27 | 0,31 | 0,31 | 2,23 |
| 6,0 | 0,11 | 0,18 | 0,32 | 0,38 | 0,39 | 0,26 |
| 7,0 | 0,13 | 0,22 | 0,38 | 0,44 | 0,45 | 0,30 |
| 8,0 | 0,15 | 0,25 | 0,43 | 0,50 | 0,52 | 0,35 |
| 9,0 | 0,17 | 0,28 | 0,48 | 0,57 | 0,58 | 0,39 |
| 10,0 | 0,20 | 0,30 | 0,54 | 0,64 | 0,65 | 0,43 |
Ei myöskään ole hyväksyttävää, että liekki leimahtaa poltinsekoittimen sisällä, johon yleensä liittyy poksahtelua. Liukuminen johtaa joko liekin sammumiseen ja palamattoman seoksen sinkoutumiseen huoneeseen tai uuniin tai seoksen palamiseen polttimen sisällä. Liekin taipumus leimahtaa läpi riippuu kaasun tyypistä, liekin normaalista etenemisnopeudesta, primääriilman pitoisuudesta kaasu-ilmaseoksessa, palokanavien mitoista, seoksen lämpötilasta tai seinistä. kanavat. Liekin läpimurtoon vaikuttavat myös materiaalien lämmönjohtavuus, joista palokanavat on valmistettu, niiden muoto, syvyys ja valmistus, purseet, katkenneet reunat jne.
Ilmoitettu taulukossa. 8.15 Maakaasujen ja ilman homogeenisten seosten nopeuksien arvoja, joissa tapahtuu läpimurto, voidaan käyttää myös muille kaasuille korjauksin:
w" inc \u003d w inc u" n / u n (8.30)
missä w’pr on liekin leimahdusnopeus toiselle kaasulle, m/s; w pr - maakaasun liukunopeus (taulukon 8.15 mukaan), m / s; u‘ n - normaali liekin etenemisnopeus toiselle kaasulle, m/s; u n - liekin etenemisnopeus metaanissa, m/s.
Suurin luistonopeus voidaan laskea käyttämällä likimääräistä kaavaa:
w pr \u003d 0,73 10 -3 d k T 2 (8,31)
Samaa kaavaa, käytännössä riittävällä likiarvolla, voidaan käyttää myös muille kaasuille ottamalla käyttöön liekin normaalin etenemisnopeuden muutoksen korjaus. Lukuisten kokeiden perusteella voidaan tehdä seuraava johtopäätös: polttimien vakaan toiminnan rajoja rajoittavat liekin irtoamis- ja takaiskunopeudet.
Riisi. 8.8 Kaasu-ilma-seoksen nopeuden, jolla liekin erottuminen ja takaisku tapahtuu, riippuvuus primääriilman ylimäärästä
I - liekin irtoaminen; II - liekin läpimurto; III - liekin keltaiset reunat;
1-3 polttimen palokanavien halkaisijaa, mm: 1-25, 2-25, 3-32
Kuvassa Kuvassa 8.8 on esitetty käyrät, jotka kuvaavat maakaasun ja ilman seoksen virtausnopeuksia, joilla liekin erottuminen ja takaisku tapahtuu. Käyrien luonne osoittaa liekin stabiilisuuden jyrkkää laskua, kun primääriilman pitoisuus seoksessa kasvaa. Liekin stabiilisuus lisääntyy primääriilman pitoisuuden pienentyessä ja saavuttaa maksimin, kun se laskee nollaan (diffuusiopoltto). Tällaista hiilivetykaasujen polttamista ei kuitenkaan monissa tapauksissa voida hyväksyä, koska se johtaa keltaisten liekkien ilmestymiseen, jotka luonnehtivat nokihiukkasten esiintymistä siinä.
Riisi. 8.9. Yleiset palonestoaineet
a - sylinterimäinen tunneli, jonka osa äkillisesti laajenee;
b - sama, pyörivällä virtauksella;
c – kartiomainen tunneli pyörivällä virtauksella;
d - stabilointiaine kartiomaisen rungon muodossa;
e - sama, pyöreän tangon muodossa;
e - sama, vakaan rengasmaisen liekin muodossa
1 - polttimen suutin; 2 - tunneli; 3 - sivureikä;
4 – rengasmainen kanava; 5 - rengasliekki;
6 - kaasu-ilma-seoksen päävirtauksen liekki
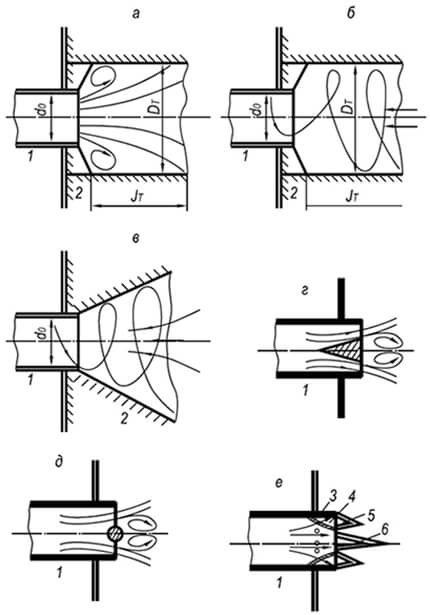
Käytännössä minkä tahansa palavan kaasu-ilma-seoksen palamisstabiilisuusalueen laajentamiseksi virtausnopeuden oletetaan olevan useita kertoja suurempi kuin erotusnopeus. Liekin erottuminen estetään käyttämällä liekin stabilointiaineita (kuva 8.9).
Injektio- ja muiden akselisymmetrisiä kaasu-ilmasuihkuja tuottavien polttimien liekin stabiloimiseksi käytetään tulenkestäviä sylinterimäisiä tunneleita, joiden poikkileikkaus laajenee äkillisesti. Tällaisen tunnelin toiminta perustuu osan kuumista palamistuotteista perifeeriseen kiertoon, joka tapahtuu suihkun synnyttämän harvinaisuuden vuoksi.
Pyörittävää kaasu-ilmaseosta tuottavien polttimien liekin stabiloimiseksi käytetään sekä lieriömäisiä että kartiomaisia tunneleita, joiden avautumiskulma on 30–60°. Pyörteisessä virtauksessa tunnelin reunalle syntyy suurempi paine kuin sen keskiosassa. Tämä johtaa joidenkin kuumien palamistuotteiden paraksiaaliseen kierrätykseen ja sisäpuolelta tunneliin virtaavan kylmän kaasu-ilma-seoksen syttymiseen.
Kun tunneleiden asentaminen ei ole mahdollista, liekin stabiloimiseksi käytetään huonosti virtaviivaistettuja kappaleita, jotka asetetaan kaasu-ilmaseoksen virtaukseen sen ulostulossa polttimen palokanavasta. Tässä tapauksessa seoksen syttyminen tapahtuu stabilisaattorin kehällä, jonka takana tapahtuu osittainen kuumien kaasujen uudelleenkierrätys, joka sytyttää palavan seoksen sisältä. Tällaisten laitteiden stabiloiva vaikutus on pienempi kuin tunneleilla.
Yksi- ja monipolttimissa ruiskupolttimissa palamisen stabilointiaineita käytetään laajalti erityisen liekkisuuttimen muodossa. Tämän laitteen stabiloiva vaikutus perustuu siihen, että estetään päävirtauksen laimeneminen liekin juuressa ylimääräisellä ilmalla, mikä kaventaa sen stabiilisuuden rajoja, sekä päävirtauksen lämmittämiseen ja sytyttämiseen rengasmaisella liekillä koko sen kehällä. . Rengasmaisen liekin stabiilisuus erotuksen aikana saavutetaan sellaisen palorenkaan ja sivureikien osien suhteen ansiosta, jossa kaasu-ilmaseoksen nopeus rengasmaisessa ontelossa ei ylitä liekin normaalia etenemisnopeutta. Jotta liekki ei välähdä poltinsekoittimeen, rengasliekin muodostavien sivureikien mitat otetaan kriittistä pienemmiksi.
8.9. TUKISUOJAIMEN JÄRJESTELMÄT
Kaasuputkeen päässyt ilma tai happi voivat muodostaa räjähtävän seoksen, joten putkistot on ehdottomasti suojattava ilman tai hapen tunkeutumiselta siihen. Kaikilla räjähdysalttiilla aloilla on luotava olosuhteet, jotka sulkevat pois syttymisimpulssien mahdollisuuden. Sytytyslähteitä, jotka aiheuttavat kaasu-ilma-seosten räjähtämisen, ovat:
- avoin liekki;
- käytettävien sähkölaitteiden sähköpurkaukset;
- oikosulku sähköjohdoissa;
- kipinät sähkölaitteissa;
- palaneet auki sulakkeet;
- staattisen sähkön purkauksia.
Räjähdysturvallisuudesta huolehtivat erilaiset liekinsammuttimet. asennettu putkiin, säiliöihin, tyhjennyskaasulinjoihin, kynttilöihin ja muihin järjestelmiin, joissa on räjähdysvaara.
Liekin sammuminen palavalla seoksella täytetyssä kanavassa tapahtuu vain kanavan minimihalkaisijalla, joka riippuu seoksen kemiallisesta koostumuksesta ja paineesta, ja selittyy lämpöhäviöllä reaktiovyöhykkeestä kanavan seiniin. Kanavan halkaisijan pienentyessä sen pinta kasvaa reagoivan seoksen massayksikköä kohti, ts. lämpöhäviöt kasvavat. Kun ne saavuttavat kriittisen arvon, palamisreaktion nopeus laskee niin paljon, että liekin eteneminen on mahdotonta.
Liekinsammuttimen liekinsammutuskyky riippuu pääasiassa sammutuskanavien halkaisijasta ja paljon vähemmän niiden pituudesta, ja liekin tunkeutumismahdollisuus sammutuskanavien läpi riippuu pääasiassa palavan seoksen ominaisuuksista ja koostumuksesta sekä paineesta. Liekin normaali etenemisnopeus on pääsuure, joka määrää sammutuskanavien koon ja liekinsammuttimen tyypin valinnan: mitä suurempi se on, sitä pienempi kanava tarvitaan liekin sammuttamiseen. Sammutuskanavien mitat riippuvat myös palavan seoksen alkupaineesta. Liekinsammuttimien palonestokyvyn arvioimiseksi ns. Peclet Re -kriteeri:
Pe \u003d w cm dc p p / (RT 0 λ 0) (8,32)
Liekin sammumisen rajalla Peclet-kriteerin kaava saa muotoa:
Re cr = w cm d cr c p p cr /(RT 0 λ 0) (8.33)
missä w cm on liekin normaali etenemisnopeus; d on vaimennuskanavan halkaisija; d kp - sammutuskanavan kriittinen halkaisija; c p on kaasun ominaislämpökapasiteetti 0 °C:ssa ja vakiopaineessa; p - kaasun paine; p cr - kriittinen kaasun paine; R on yleiskaasuvakio; T 0 - kaasun absoluuttinen lämpötila; λ 0 - alkuperäisen seoksen lämmönjohtavuus.
Näin ollen liekinsammuttimien liekinsammutuskyvyn laskemiseksi tarvitaan seuraavat alkutiedot:
- palavien kaasuseosten liekin normaalit etenemisnopeudet;
- tietyn liekinsammutuskanavien enimmäissammutuskanavien todellinen koko.
Jos saatu arvo on suurempi kuin Re cr = 65, liekinsammutin ei hidasta tämän palavan seoksen liekin leviämistä ja päinvastoin, jos Re< 65, огнепреградитель задержит распространение пламени. Запас надежности огнепреградителя, который находят из отношения Ре кр к вычисленному значению Ре, должен составлять не менее 2:
P \u003d Re cr / Re \u003d 65 / Re\u003e 2.0 (8.34)
Käyttämällä sitä tosiasiaa, että Pe cr on vakio liekin sammumisrajalla, voidaan laskea kanavien likimääräinen kriittinen halkaisija mille tahansa palavalle seokselle, jos liekin etenemisnopeus tunnetaan, samoin kuin palavan seoksen lämpökapasiteetti ja lämmönjohtavuus. kaasujärjestelmä. Seuraavia karkaisukanavan kriittisiä halkaisijoita suositellaan, mm:
- poltettaessa kaasu-ilmaseosta - 2,9 metaanille ja 2,2 propaanille ja etaanille;
- poltettaessa happiseoksia putkissa (absoluuttisella paineella 0,1 MPa palamistuotteiden vapaan laajenemisen olosuhteissa) - 1,66 metaanille ja 0,39 propaanille ja etaanille.
Riisi. 8.10. Liekinsammuttimien tyypit:
a - pakattu; b - kasetti; c - lamelli; g - verkko; e - kermetti
Liekinsammuttimet jaetaan rakenteellisesti neljään tyyppiin (kuva 8.10):
- rakeisista materiaaleista valmistetulla suuttimella;
- suorilla kanavilla;
- kermetistä tai metallikuidusta;
- verkko.
Asennusmenetelmän mukaan - kolmeen tyyppiin: putkiin kaasujen poistamiseksi ilmakehään tai taskulamppuun; viestinnässä; kaasupolttimien edessä.
Asennetun liekinsammuttimen rungossa ritilöiden välissä on suutin, jossa on täyteaine (lasi- tai posliinipallot, sora, korundi ja muut kestävästä materiaalista tehdyt rakeet). Kasettipalonsammutin on kotelo, johon on asennettu palonsammutuskasetti aallotetuista ja litteistä metalliteipeistä, jotka on kierretty tiukasti rullalle. Levyliekinsammuttimen tapauksessa - paketti tasosuuntaisia metallilevyjä, joiden välillä on tiukasti määritelty etäisyys. Rungon verkkoliekinsammuttimessa on paketti tiukasti puristettuja metalliverkkoja. Keraaminen-metalli-liekinsammutin on kotelo, jonka sisään on asennettu huokoinen metalli-keraaminen levy litteän kiekon tai putken muodossa.
Eniten käytetään verkkoliekinsammuttimia (niitä alettiin asentaa 1800-luvun alussa kaivoslamppuihin (Devi-lamput) palopatruunan räjähdyksen estämiseksi). Näitä liekinsammuttimia suositellaan kaasumaisia polttoaineita polttavien laitteistojen suojaamiseen. Liekinsammutin koostuu useista kerroksista messinkiverkkoa, jonka silmäkoko on 0,25 mm ja jotka on asetettu kahden rei'itetyn levyn väliin. Verkkopaketti on vahvistettu irrotettavassa pidikkeessä.
Liekinsammuttimen runko on valmistettu valuraudasta tai alumiiniseoksesta ja se koostuu kahdesta identtisestä osasta, jotka on yhdistetty pulteilla, joiden välissä on irrotettava pidike. Tarkasteltavien kuivien liekinsammuttimien lisäksi nestemäisiä turvalukkoja käytetään laajalti suojaamaan kaasuputkia räjähdysalttiilta aaltoilta ja liekiltä metallien kaasuliekkikäsittelyn aikana sekä kaasulla täytettyjä putkia ja laitteita kaasun tunkeutumiselta. happea ja ilmaa niihin.
Nestetiivisteiden tulee:
- estämään räjähtävän aallon eteneminen vastaiskujen ja kaasujen syttymisen aikana;
- suojaa kaasuputkistoa hapen ja ilman pääsyltä siihen;
- varmistaa minimaalisen hydraulisen vastuksen kaasuvirran kulkua vastaan. Lisäksi sulkimen nestettä ei pidä kuljettaa pois pisaroiden muodossa huomattavia määriä.
8.10. PALTOPERIAATTEET
Kaasunpolttoprosessit perustuvat periaatteisiin, joita kutsutaan perinteisesti kineettiseksi ja diffuusioksi. Kineettisellä periaatteella saadaan aikaan homogeeninen seos jonkin verran ylimääräistä ilmaa ennen palamisen alkamista. Tällaisen seoksen palaminen tapahtuu lyhyessä läpinäkyvässä liekissä ilman, että liekkiin muodostuu nokihiukkasia. Kaasunpolttoon kineettisen periaatteen mukaisesti käytetään erityisiä sekoittimia tai ruiskupolttimia, jotka valmistavat homogeenisen kaasu-ilmaseoksen, jonka primääriilman ylimäärä on α 1 = 1,02: 1,05.
Alhaisemmalla primääriilmapitoisuudella etenee kineettisen periaatteen mukaan vain palamisen alkuvaihe, kunnes käytetään happea, joka on seoksessa kaasun kanssa. Jäljelle jäävät kaasut ja epätäydellisen palamisen tuotteet poltetaan hapen ulkoisella diffuusiolla (sekundaarinen ilma), ts. d ja f u z ja o n n o m mukaan periaatteella. α 1:lle< 1 у факела есть два видимых фронта горения: внутренний, возникающий за счет первичного воздуха, и наружный, образующийся за счет диффузии кислорода из окружающей среды. Общая высота пламени при таком горении возрастает, а температура - несколько снижается. Устойчивость пламени и его прозрачность зависят от содержания первичного воздуха в смеси: чем оно выше, тем ниже устойчивость пламени, больше его прозрачность, и наоборот.
Kaasun palamisen periaate α 1:llä< 1,0 является п р о м е ж у т о ч н ы м (между кинетическим и диффузионным). С учетом этого принципа конструируются все газовые аппараты с инжекционными горелками. В таких горелках содержание первичного воздуха в смеси принимается в зависимости от вида газа таким, чтобы:
- liekissä ei ollut nokihiukkasia;
- palamisen vakaus varmistettiin lämpötehon muutoksilla käytännössä tarpeellisissa rajoissa.
Diffuusioperiaatteella (α 1 = 0) palamis- ja sekoitusprosessit kehittyvät rinnakkain. Koska sekoitusprosessit etenevät paljon hitaammin kuin palamisprosessit, palamisen nopeus ja täydellisyys määräytyvät kaasun ja ilman sekoittumisen nopeuden ja täydellisyyden mukaan. Kaasun sekoittuminen ilman kanssa voi tässä tapauksessa tapahtua diffuusion avulla (joko hidas molekyyli tai turbulentti, mukaan lukien molekyylinen viimeinen vaihe). Vastaavasti palonopeus ja diffuusioliekin rakenne eroavat toisistaan.
Tällaisen polttamisen ominaisuudet:
- liekin stabiilisuus, kun lämpöteho muuttuu nollasta erotusolosuhteiden mukaan mahdollista maksimiarvoon;
- lämpötilan pysyvyys liekin koko korkeudella;
- mahdollisuus jakaa se suurille mielivaltaisille pinnoille;
- polttimien tiiviys ja niiden valmistuksen helppous;
- merkittävä liekin korkeus ja pyrolyyttisten prosessien väistämättömyys, mikä johtaa kirkkaan nokiliekin muodostumiseen.
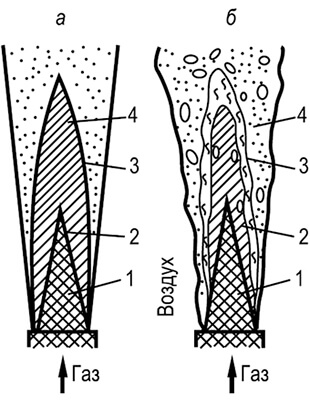
Riisi. 8.11. Vapaan liekin rakenne:
a - laminaarinen liekki; b - myrskyinen liekki
Diffuusiopoltto voidaan muuttaa kineettiseksi tai välipalaksi, jos sekoitus on polttoprosesseja edellä. Käytännössä tämä voidaan saavuttaa pakotetulla ilmansyötöllä, mikä johtaa kvasihomogeenisen kaasu-ilmaseoksen muodostumiseen, jonka α 1 > 1,0 ja joka palaa läpinäkyvässä liekissä.
Palamisperiaatteiden havainnollistamiseksi kuvassa. 8.11. vapaan liekin kaaviot on annettu: laminaarinen ja turbulentti. Laminaaripoltin syntyy kaasun ja ilman keskinäisestä molekyylidiffuusiosta. Kartioytimen 1 sisällä on puhdasta kaasua, joka virtaa ulos putkesta laminaarivirtauksen alaisena. Vyöhykkeellä 2 - kaasun ja palamistuotteiden seos, vyöhykkeellä 3 - palamistuotteiden ja ilman seos. Boundary 4 on sileä kartiomainen liekin eturintama, johon ilmamolekyylit leviävät ulkopuolelta ja kaasumolekyylit sisältä. Palamistuotteet leviävät osittain kaasua kohti lämmittäen sitä intensiivisesti esiliekkivyöhykkeellä. Tämä johtaa hiilivetyjen pyrolyysiin ja nokihiukkasten muodostumiseen, mikä antaa liekille kirkkaan kirkkauden.
Palamista voidaan tehostaa sekoitusvirtausten turbulenssilla. Myrskyisellä liekillä ei ole selkeää kartiomaista palorintamaa, se "sumentuu" ja hajoaa pulsaatioiden vaikutuksesta erillisiksi hiukkasiksi.
Liekkirakenne koostuu puhtaan kaasun ytimestä 1, suhteellisen hitaan palamisen vyöhykkeestä 2, voimakkaimman palamisen diffuusivyöhykkeestä 3, jossa on korkea palamistuotteiden pitoisuus, ja palamisvyöhykkeestä 4, jossa on vallitseva ilma. Vyöhykkeiden välillä ei ole selkeästi määriteltyjä rajoja, vaan ne muuttuvat jatkuvasti virtauksen turbulenssin asteesta riippuen. Pyörivän liekin ominaisuuksia ovat:
- palamisprosessin kulku melkein koko tilavuuden ajan;
- palamisen intensiteetin lisääminen;
- liekin korkea läpinäkyvyys;
- sen alhaisempi erottelukestävyys.
Turbulenttia kaasupolttoa käytetään laajalti erilaisten kattiloiden ja uuneissa. Palamisprosessin tehostamiseen käytetään sekä luonnollista (nousunopeuksien vuoksi) että keinotekoista virtauspyörteitä, esimerkiksi pyörittämällä ilmavirtaa ja syöttämällä siihen ohuita kaasusuihkuja eri kulmissa.
8.11. EDELLYTYKSET EPÄTÄYDELLISISTÄ PALOJEN TUOTTEIDEN MUODOSTAMISESTA JA NIIDEN HAITTAILLISTEN AINEIDEN PITOISUUDEN VÄHENTÄMISESTÄ
Palavia kaasuja poltettaessa palamistuotteet voivat sisältää sekä täydellisen (hiilidioksidi ja vesihöyry) että epätäydellisen palamisen komponentteja (hiilimonoksidi, vety, tyydyttymättömät, tyydyttyneet, aromaattiset hiilivedyt ja nokihiukkaset). Lisäksi typen oksideja löytyy aina palamistuotteista. Epätäydellisen palamisen tuotteiden esiintymistä merkittävinä pitoisuuksina ei voida hyväksyä, koska se johtaa ilman saastumiseen myrkyllisillä aineilla ja kaasupolttoaineella toimivien laitosten tehokkuuden heikkenemiseen.
Tärkeimmät syyt niiden korkeaan pitoisuuteen:
- kaasujen polttaminen riittämättömällä ilmalla;
- palavien kaasujen ja ilman huono sekoittuminen ennen palamista ja sen aikana;
- liekin liiallinen jäähtyminen ennen palamisreaktioiden päättymistä.
Metaanin palamisreaktiot (riippuen happipitoisuudesta reagoivassa seoksessa) voidaan kuvata seuraavilla yhtälöillä:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O + 800,9 MJ / mol
stoikiometrisessä suhteessa tai ylimäärällä hapettavaa ainetta;
CH 4 + O 2 \u003d CO + H 2 + H 2 O + Q ja CH 4 + 0,5O 2 \u003d CO + 2H 2 O + Q
hapettavan aineen puuttuessa.

Riisi. 8.12 Palamisen välituotteet
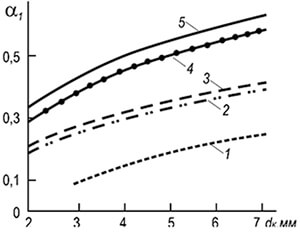
Riisi. 8.13. Pääilmapitoisuus,
joka estää muodostumisen
keltaiset kielet liekeissä
Kaasu: 1 - koksi;
2 - maakaasukentät;
3 - öljykentät;
4 - propaani; 5 - butaani
Kuvassa 8.12 esittää joidenkin välituoteyhdisteiden - vety, hiilimonoksidi, eteeni, asetyleeni ja suhteellisen pieni määrä tyydyttyneitä ja yksinkertaisia aromaattisia yhdisteitä - ja hiilidioksidin likimääräisen keskimääräisen koostumuksen, joita esiintyy liekissä maakaasun diffuusiopolton aikana (97%). Kaasu poltettiin laminaaripolttimessa, kaasu virtasi ulos halkaisijaltaan 12 mm putkesta. Kokonaisliekin korkeus 130-140 mm.
Vedyn ja asetyleenin maksimipitoisuus saavutetaan suunnilleen samalla korkeudella liekillä, ne katoavat lähes samanaikaisesti liekin valovyöhykkeen huipulla. Kaikista liekissä syntyvistä välituoteyhdisteistä (pois lukien nokihiukkaset) hiilimonoksidi katoaa viimeisenä. Tämä antaa aihetta arvioida sen indeksin perusteella kaasun palamisen täydellisyyttä. Polttotuotteissa on aina typen oksideja, joiden suurin pitoisuus esiintyy voimakkaan hiilimonoksidin ja vetypalamisen alueilla.
Hiilivetykaasujen palaminen hapettimen puuttuessa johtaa nokihiukkasten muodostumiseen, mikä antaa liekille keltaisen värin. Noen palamisprosessi etenee vaiheittain ja suhteellisen hitaasti. Joskus muodostuneiden nokihiukkasten palaminen viivästyy ja voi pysähtyä kokonaan polttimen matalan lämpötilan alueelle tai kun liekki pesee lämmönvaihtopinnat. Siten valaisevan liekin läsnäolo viittaa aina pyrolyyttisten prosessien esiintymiseen ja palamisen kemiallisen epätäydellisyyden mahdollisuuteen, erityisesti pienikokoisissa suojatuissa kattilauuneissa.
Nokihiukkasten muodostumisen estäminen saavutetaan esisekoittamalla hiilivetykaasuja riittävään määrään hapettavaa ainetta. Primääriilman pitoisuus seoksessa, jossa läpinäkyvä liekki esiintyy, ei riipu vain hiilivetyjen tyypistä, vaan myös sekundaari-ilman kanssa sekoitusolosuhteista (polttimien palamiskanavien halkaisija) (kuva 8.13). ). Reunoilla ja kaarevien yläpuolella liekki on läpinäkyvä ja käyrien alapuolella siinä on keltaisia kielekkeitä. Käyrät osoittavat, että primääriilman pitoisuus seoksessa kasvaa molekyylin hiiliatomien lukumäärän ja polttimien palamiskanavien halkaisijan kasvaessa. Seoksen primääriilmaylimäärän α 1 suhde, jossa keltaiset liekit häviävät, edellä mainituista tekijöistä riippuen voidaan määrittää pienille polttimen palokanaville:
α 1 \u003d 0,12 (m + n / 4) 0,5 (d k / d 0) 0,25 (8,35)
missä m ja n ovat hiili- ja vetyatomien lukumäärä molekyylissä tai niiden keskimääräinen lukumäärä kompleksiselle kaasulle; d k - polttimen palokanavien halkaisija, mm; d 0 - poltinkanavan vertailuhalkaisija (1 mm).
Palamisen täydellisyyden varmistaminen käytännön olosuhteissa on melko monimutkainen tehtävä, joka ei riipu vain kaasun palamisperiaatteesta, vaan myös liekin kehittymisen edellytyksistä uunin tilavuudessa. Korkeimmat vaatimukset palamisen täydellisyydelle asetetaan kodinkoneille ja muille laitteille, jotka vapauttavat palamistuotteita ilmakehään. Kaasun palaminen tällaisissa laitteistoissa on vaikeinta, koska se liittyy kylmien lämmönvaihtopintojen pesuun liekillä. Kaasunpolttoon kotitalouksien uuneissa käytetään ruiskupolttimia, jotka muodostavat homogeenisen seoksen primääriilman ylimääräisellä kertoimella α 1< 1. Недостающий для сгорания газа воздух поступает за счет диффузии из окружающей атмосферы.
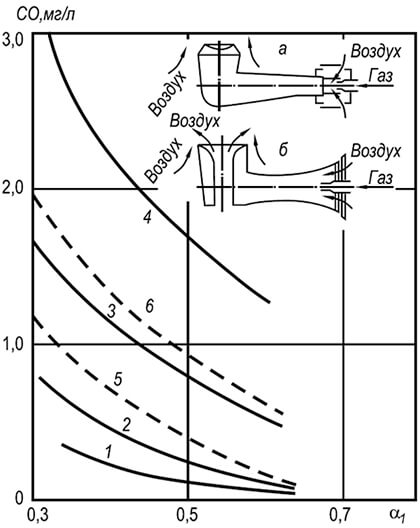
Riisi. 8.14. Hiilimonoksidipitoisuus
kaasulieden palamistuotteissa
a – poltin toisioilman reunasyötöllä;
b - keskitetyllä ja perifeerisellä toisioilmansyötöllä
1 - maakaasu, poltin oheissyöttöllä
toisioilma, etäisyys astioiden pohjasta 25 mm;
2–4 - maakaasu, poltin oheislaitteilla ja
keskitetty toisioilmansyöttö, etäisyys
astioiden pohjalle, mm: 2 - 25, 3 - 18, 4 - 10;
5 - nestekaasu, poltin keskus- ja oheislaitteilla
toissijainen ilmansyöttö, etäisyys astian pohjasta 25 mm;
6 - nestekaasu, poltin oheissyöttöllä
Kuvassa 8.14 esittää kaavioita kotitalouksien kaasuliesien 2-polttimista ja hiilimonoksidin CO:n keskimääräisestä pitoisuudesta luonnonmetaanin (95 til.%) ja propaanin (93 til.%) palamistuotteista, kun polttimet toimivat nimellislämmöllä ulostulo. Polttimien ero on se, että toissijainen ilma syötetään yhteen niistä vain kehältä ja toiseen - sekä kehältä että keskikanavasta.
Kaasun palamisen täydellisyys riippuu seoksen ylimääräisen primääriilman kertoimesta, etäisyydestä polttimen palokanavista astian pohjaan, palavan kaasun tyypistä ja toisioilman syöttötavasta. Samanaikaisesti primääriilman pitoisuuden kasvu seoksessa sekä etäisyyden kasvu polttimesta astian pohjaan johtavat hiilimonoksidin pitoisuuden laskuun palamistuotteissa. Pienin hiilimonoksidipitoisuus vastaa ylimääräisen primääriilman kerrointa α 1 = 0,6 ja enemmän ja etäisyyttä polttimesta astian pohjaan 25 mm ja maksimi - α 1 = 0,3 ja alle sekä etäisyyttä astian pohjasta. poltin astian pohjaan 10 mm. Lisäksi polttimien lämpötehon 15–20 % nousu kaasunpaineen noususta johtaa hiilimonoksidin pitoisuuden nousuun palamistuotteissa 1,2–1,3-kertaiseksi ja palamislämmön vuoksi. kaasua, 1,5–2 kertaa.
Aromaattisten yhdisteiden - bentseenin, polysyklisen bentspyreenin, bentsantraseenin jne. - esiintymiseen palamisprosessin aikana tulee kiinnittää erityistä huomiota, koska jotkut niistä ovat syöpää aiheuttavia. Niiden muodostusprosessi on erittäin monimutkainen ja etenee vaiheittain. Ensimmäisessä vaiheessa ilmestyy asetyleeni ja sen johdannaiset. Liekkivyöhykkeellä nämä aineet käyvät läpi ketjun pidentymisprosesseja, joissa kolmoishiilisidokset järjestyvät uudelleen kaksoissidoksiksi. Syklisoinnin ja dehydraation seurauksena syntyy erilaisia aromaattisia yhdisteitä, mukaan lukien polysykliset yhdisteet.
Taulukko 8.16. Keskimääräinen hiilimonoksidin ja bentso(a)pyreenin pitoisuus palamistuotteista riippuen kaasun tyypistä, polttimen tyypistä ja primääriilman ylijäämäkertoimesta (polttimen lämpökuorma - 1600 kcal / h, etäisyys polttimesta astian pohjaan - 24-26 mm)
| Polttimen tyyppi | Keskimääräinen keskittyminen | |
|---|---|---|
| hiilimonoksidi, mg/l (suhteessa α = 1,0) |
bentso(a)pyreeni, mcg / 100 m3 |
|
| Maakaasu | ||
kohdassa ai = 0,60 ÷ 0,70 |
0,10 | Ei löydetty |
kohdassa ai = 0,30 ÷ 0,35 |
1,20 | Jäljet |
kohdassa ai = 0,60 ÷ 0,70 |
0,50 | Ei löydetty |
kohdassa ai = 0,30 ÷ 0,35 |
0,12 | Ei löydetty |
| Nestekaasu | ||
| Poltin perifeerisellä toisioilmansyötöllä: | ||
kohdassa ai = 0,60 ÷ 0,70 |
0,30 | 0,03 |
kohdassa ai = 0,30 ÷ 0,35 |
1,20 | 1,10 |
| Poltin keskus- ja oheisilmansyötöllä: | ||
kohdassa ai = 0,60 ÷ 0,70 |
0,07 | 0,02 |
kohdassa ai = 0,30 ÷ 0,35 |
1,00 | 0,045 |
Taulukon tiedot. 8.16 osoittavat, että poltettaessa maakaasuja primääriilman ylikertoimella α 1 \u003d 0,6 tai enemmän molemmissa polttimissa, hiilimonoksidin pitoisuus palamistuotteissa täyttää standardin GOST 5542-87 vaatimukset.
Taulukko 8.17. Yksirivisten ruiskupolttimien polttokanavien reunojen välinen etäisyys niiden mitoista ja ylimääräisen primääriilman kertoimesta riippuen
| Palokanavien halkaisijat, mm | Kanavien reunojen väliset etäisyydet, mm ylimääräisen primääriilman kertoimen α 1 eri arvoilla | ||||
|---|---|---|---|---|---|
| 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | |
| 2,0 | 11 | 8 | 6 | 5 | 4 |
| 3,0 | 15 | 12 | 9 | 7 | 5 |
| 4,0 | 16 | 14 | 11 | 9 | 7 |
| 5,0 | 18 | 15 | 14 | 12 | 10 |
| 6,0 | 20 | 18 | 16 | 14 | 12 |
Tutkimukset ovat osoittaneet, että palokanavien reunojen väliset etäisyydet, jotka varmistavat liekin nopean leviämisen ja estävät niiden yhteensulautumisen, riippuvat niiden koosta ja primääriilman pitoisuudesta seoksessa ja pienenevät sen kasvaessa. Kanavien reunojen optimaaliset etäisyydet, jotka varmistavat kaasun palamisen riittävän täydellisyyden ja liekin nopean etenemisen, on esitetty taulukossa. 8.17. Kun ampumakanavat on järjestetty kahteen riviin ruutukuvioon, reunojen väliset etäisyydet voidaan ottaa saman taulukon mukaan. Tässä tapauksessa rivien välisten etäisyyksien tulee olla 2–3 kertaa suuremmat kuin kanavien väliset etäisyydet.
Riisi. 8.15. Hiilimonoksidin, asetyleenin,
etaanin, eteenin ja bentso(a)pyreenin palamistuotteissa
keskipaineinen kaasu ruiskupolttimessa
Lukuisten kokeellisten tietojen yleistäminen mahdollisti palamisprosessia kvalitatiivisesti ja kvantitatiivisesti karakterisoivien keskimääräisten pitoisuuskäyrien saamisen eri komponenttien palamistuotteista (kuva 8.15). Homogeenisen kaasu-ilmaseoksen täydellinen palaminen saavutetaan vain, kun primääriilman ylijäämäkerroin α = 1,05 tai suurempi. Seoksen ilmapitoisuuden pienentyessä, erityisesti α:ssa< 1,0, возрастает концентрация оксида углерода СО, ацетилена С 2 Н 2 , этилена С 2 Н 4 , пропилена С 3 Н 6 и пропана С 3 Н 8 , а также бенз(а)-пирена С 20 Н 9 . Также возрастает концентрация и других компонентов - водорода, бензола и др.
Tarkasteltavien epätäydellisen palamisen tuotteiden lisäksi kaasun palaminen tuottaa aina tietyn määrän typen oksideja, joiden muodostumista tapahtuu korkean lämpötilan vyöhykkeillä sekä pääpalamisreaktioiden päätyttyä että palamisen aikana. Suurin NO x -pitoisuus esiintyy loppuvaiheissa, mikä vastaa kaasun palamista ja välituotteiden intensiivistä palamista vedyn ja hiilimonoksidin muodossa.
Pääyhdiste kaasu-ilma-seosten palamisessa on typen oksidi. Ketjureaktion alku liittyy korkean lämpötilan vyöhykkeillä syntyvään atomiseen happeen molekyylihapen dissosioitumisen vuoksi:
O 2 -› 2O - 490 kJ / mol (8,36)
O + N 2 -› NO + N - 300 kJ / mol (8,37)
N + O 2 –› 2NO + 145 kJ/mol (8,38)
tasapainoreaktio
N 2 + O 2 -› 2NO - 177 kJ / mol (8,39)
Atomihapen muodostuminen tapahtuu myös palamistuotteiden osittaisen dissosioitumisen yhteydessä: lämpötilan laskun ja hapen läsnäolon myötä osa muodostuneesta typpioksidista (1-3 tilavuus-%) hapettuu typpidioksidiksi NO 2 . Reaktio etenee voimakkaimmin typpioksidin vapautumisen jälkeen ilmakehään. Tärkeimmät vaikuttavat tekijät:
- lämpötila reaktioalueilla;
- ylimääräinen ilmasuhde ja reagoivien komponenttien kosketusaika.
Liekin lämpötila riippuu kaasun kemiallisesta koostumuksesta, ilmapitoisuudesta kaasu-ilmaseoksessa, sen homogeenisuusasteesta ja lämmönpoistosta reaktioalueelta. Suurin mahdollinen typpioksidin pitoisuus tietyssä lämpötilassa, tilavuus. %, voidaan laskea kaavalla
NO p \u003d 4,6e -2150 / (RT) / √ O 2 N 2 (8,40)
missä NO p on typpioksidin tasapainopitoisuus, tilavuus. %; R on yleiskaasuvakio; T - absoluuttinen lämpötila, K; O 2 ja N 2 - konsentraatio, tilavuus. %, happea ja typpeä.
Tasapainoon suhteutettu korkea typpioksidipitoisuus syntyy, kun kaasua poltetaan voimakkaiden höyrynkehittimien uuneissa ja korkean lämpötilan tulisija-, koksi- ja vastaavissa uuneissa. Pienissä ja keskitehoisissa kattiloissa, pienissä lämmitys- ja lämpöuuneissa, joissa on merkittävä lämmönpoisto ja komponenttien lyhyt viipymäaika korkean lämpötilan vyöhykkeillä, typen oksidien tuotto on suuruusluokkaa pienempi. Lisäksi mitä lyhyempi reagoivien komponenttien viipymäaika korkean lämpötilan vyöhykkeellä, sitä vähemmän typpioksidia on palamistuotteissa.
Kaasun palaminen säteilypolttimissa ja leijukerroksessa on myös tehokasta: näissä tapauksissa homogeenisen kaasu-ilma-seoksen mikrosoihdutuspoltto tapahtuu ylimääräisellä ilmakertoimella α = 1,05 ja lämpöä poistuu erittäin intensiivisesti reaktiovyöhykkeestä. Typen oksidien pitoisuus kaasunpolton aikana säteilypolttimissa on noin 40 ja leijukerroksessa - 80-100 mg/m 3 . Säteilypolttimien ja tulenkestävien rakeiden palokanavien koon pienentäminen leijukerroksessa auttaa vähentämään typen oksidien tuotantoa.
Kertyneet tiedot mahdollistivat joukon muutoksia kattilan ja lämmityslaitteiden suunnittelussa, mikä tarjosi paitsi korkean hyötysuhteen ja epätäydellisen palamisen tuotteiden alhaisen pitoisuuden, myös vähentävät typen oksidien päästöjä ilmakehään. Näitä muutoksia ovat mm.
- korkean lämpötilan tunneleiden pituuden lyhentäminen ja palamisen siirtäminen niistä uuneihin;
- palamisen stabilointiaineiden käyttö keraamisten tunneleiden sijasta bluffikappaleiden tai rengasmaisen liekin muodossa;
- tasaisen liekin järjestäminen lisääntyneellä lämmönsiirtopinnalla;
- liekin hajottaminen lisäämällä polttimien määrää tai käyttämällä lohkopolttimia;
- porrastettu ilmansyöttö reaktioalueelle;
- lämpövirtojen tasainen jakautuminen uunissa, uunien seulonta ja niiden jakaminen osastoihin seulojen avulla;
- kaasupolton diffuusioperiaatteen soveltaminen (diffuusiopoltto on sallittu vain tapauksissa, joissa liekin vapaa kehitys voidaan varmistaa ilman lämmönvaihtopintojen pesua).
Tehokkain typen oksidien tuotannon vähentäminen saavutetaan useiden menetelmien samanaikaisella käytöllä.
Kaasunpoltto on yhdistelmä seuraavista prosesseista:
Palavan kaasun sekoittaminen ilman kanssa
lämmittää seosta
palavien komponenttien lämpöhajoaminen,
Palavien komponenttien sytytys ja kemiallinen yhdistäminen ilmakehän hapen kanssa, johon liittyy polttimen muodostuminen ja voimakas lämmön vapautuminen.
Metaanin palaminen tapahtuu reaktion mukaan:
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Kaasun palamiseen vaadittavat olosuhteet:
Palavan kaasun ja ilman vaaditun suhteen varmistaminen,
lämpeneminen syttymislämpötilaan.
Jos kaasu-ilmaseos on pienempi kuin syttymisraja, se ei pala.
Jos kaasu-ilmaseoksessa on enemmän kaasua kuin syttymisraja, se ei pala kokonaan.
Kaasun täydellisen palamisen tuotteiden koostumus:
CO 2 - hiilidioksidi
H 2 O - vesihöyry
* N 2 - typpi (se ei reagoi hapen kanssa palamisen aikana)
Kaasun epätäydellisen palamisen tuotteiden koostumus:
CO - hiilimonoksidi
C - noki.
1 m 3 maakaasun polttaminen vaatii 9,5 m 3 ilmaa. Käytännössä ilmankulutus on aina suurempi.
Asenne todellinen kulutus ilmaa teoreettisesti vaadittu virtaus kutsutaan ylimääräisen ilman kertoimeksi: α = L/L t .,
Missä: L- todelliset kulut;
L t - teoriassa vaadittu virtaus.
Ylimääräinen ilmakerroin on aina suurempi kuin yksi. Maakaasulla se on 1,05 - 1,2.
2. Läpivirtaavien vedenlämmittimien käyttötarkoitus, laite ja pääominaisuudet.
Virtaavat kaasulämmittimet. Ne on suunniteltu lämmittämään vettä tiettyyn lämpötilaan poiston aikana.Virtaavat vedenlämmittimet jaetaan lämpötehon kuormituksen mukaan: 33600, 75600, 105000 kJ, automaatioasteen mukaan - korkeimpiin ja ensimmäisiin luokkiin. tehokkuutta vedenlämmittimet 80 %, oksidipitoisuus enintään 0,05 %, palamistuotteiden lämpötila vetokatkaisijan takana on vähintään 180 0 C. Periaate perustuu veden lämmittämiseen poistojakson aikana.
Läpivirtauslämmittimien pääyksiköt ovat: kaasupoltin, lämmönvaihdin, automaatiojärjestelmä ja kaasun ulostulo. Matalapaineinen kaasu syötetään ruiskupolttimeen. Palamistuotteet kulkevat lämmönvaihtimen läpi ja johdetaan savupiippuun. Palamislämpö siirtyy lämmönvaihtimen läpi virtaavaan veteen. Tulikammion jäähdyttämiseen käytetään kierukkaa, jonka läpi vesi kiertää lämmittimen läpi. Kaasuvirtaavat vedenlämmittimet on varustettu kaasunpoistolaitteilla ja vetokatkaisimilla, jotka estävät kaasupolttimen liekin sammumisen lyhytaikaisessa vedon rikkomisessa. Savupiippuun liittämistä varten on savuputki.
Kaasuvirtaava vedenlämmitin - VPG. Kotelon etuseinässä on: kaasuhanan säätönuppi, painike solenoidiventtiilin käynnistämiseksi ja katseluikkuna ohjaus- ja pääpolttimen liekin tarkkailuun. Laitteen yläosassa on savunpoistolaite, alaosassa haaraputket laitteen kytkemiseksi kaasu- ja vesijärjestelmiin. Kaasu tulee solenoidiventtiiliin, vesi- ja kaasupoltinlohkon kaasusulkuventtiili käynnistää peräkkäin ohjauspolttimen ja syöttää kaasua pääpolttimeen.
Kaasun virtauksen estäminen pääpolttimeen sytyttimen pakollisella toiminnalla suoritetaan sähkömagneettisella venttiilillä, joka toimii termoparista. Kaasunsyötön estäminen pääpolttimeen, riippuen vedenoton olemassaolosta, suoritetaan venttiilillä, joka ajetaan varren läpi vesilohkoventtiilin kalvosta.
Maakaasu on nykyään eniten käytetty polttoaine. Maakaasua kutsutaan maakaasuksi, koska se saadaan maapallon suolistosta.
Kaasun palamisprosessi on kemiallinen reaktio, jossa maakaasu vuorovaikuttaa ilmassa olevan hapen kanssa.
Kaasumaisessa polttoaineessa on palava osa ja palamaton osa.
Maakaasun tärkein palava ainesosa on metaani - CH4. Sen pitoisuus maakaasussa on 98%. Metaani on hajuton, mauton ja myrkytön. Sen syttymisraja on 5-15%. Juuri nämä ominaisuudet mahdollistivat maakaasun käytön yhtenä tärkeimmistä polttoainetyypeistä. Metaanin pitoisuus on yli 10 % hengenvaarallinen, joten hapenpuute voi aiheuttaa tukehtumisvaaran.
Kaasuvuodon havaitsemiseksi kaasu hajutetaan, toisin sanoen lisätään voimakkaasti hajuista ainetta (etyylimerkaptaania). Tässä tapauksessa kaasu voidaan havaita jo 1 %:n pitoisuudessa.
Metaanin lisäksi maakaasussa voi olla palavia kaasuja, kuten propaania, butaania ja etaania.
Laadukkaan kaasun palamisen varmistamiseksi on välttämätöntä tuoda ilmaa paloalueelle riittävä määrä ja saavuttaa hyvä kaasun sekoittuminen ilman kanssa. Optimaalisena pidetään suhdetta 1: 10. Eli 10 osaa ilmaa putoaa yhdelle osalle kaasua. Lisäksi on tarpeen luoda haluttu lämpötilajärjestelmä. Jotta kaasu syttyisi, se on lämmitettävä syttymislämpötilaansa, eikä lämpötila saa jatkossa laskea syttymislämpötilan alapuolelle.
Palamistuotteiden poisto ilmakehään on tarpeen järjestää.
Täydellinen palaminen saavutetaan, jos ilmakehään vapautuneissa palamistuotteissa ei ole palavia aineita. Tässä tapauksessa hiili ja vety yhdistyvät ja muodostavat hiilidioksidia ja vesihöyryä.
Visuaalisesti täydellisen palamisen yhteydessä liekki on vaaleansininen tai sinertävän violetti.
Kaasun täydellinen palaminen.
metaani + happi = hiilidioksidi + vesi
CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Näiden kaasujen lisäksi typpi ja jäljelle jäänyt happi pääsevät ilmakehään palavien kaasujen mukana. N 2 + O 2
Jos kaasun palaminen ei ole täydellistä, ilmakehään vapautuu palavia aineita - hiilimonoksidia, vetyä, nokea.
Kaasun epätäydellinen palaminen johtuu riittämättömästä ilmasta. Samaan aikaan liekkiin ilmestyy visuaalisesti nokikieliä.
Kaasun epätäydellisen palamisen vaara on se, että häkä voi aiheuttaa kattilahuoneen henkilökunnan myrkytyksen. Ilman CO-pitoisuus 0,01-0,02 % voi aiheuttaa lievän myrkytyksen. Suuremmat pitoisuudet voivat johtaa vakavaan myrkytykseen ja kuolemaan.
Tuloksena oleva noki laskeutuu kattiloiden seinille, mikä huonontaa lämmön siirtymistä jäähdytysnesteeseen, mikä heikentää kattilarakennuksen tehokkuutta. Noki johtaa lämpöä 200 kertaa huonommin kuin metaani.
Teoriassa tarvitaan 9 m3 ilmaa 1 m3 kaasun polttamiseen. Todellisissa olosuhteissa tarvitaan enemmän ilmaa.
Eli tarvitaan liikaa ilmaa. Tämä arvo, merkitty alfa, osoittaa, kuinka monta kertaa enemmän ilmaa kuluu kuin teoreettisesti tarvitaan.
Alfa-kerroin riippuu tietyn polttimen tyypistä ja on yleensä määrätty poltinpassissa tai käyttöönottoorganisaation suositusten mukaisesti.
Kun ylimääräisen ilman määrä kasvaa suositellun yläpuolelle, lämpöhäviöt kasvavat. Ilmamäärän merkittävän lisääntymisen myötä liekin erottuminen voi aiheuttaa hätätilanteen. Jos ilmamäärä on suositeltua pienempi, palaminen on epätäydellistä, mikä aiheuttaa kattilahuoneen henkilökunnan myrkytysvaaran.
Polttoaineen palamisen laadun tarkentamiseksi on olemassa laitteita - kaasuanalysaattoreita, jotka mittaavat tiettyjen aineiden pitoisuutta pakokaasujen koostumuksessa.
Kaasuanalysaattorit voidaan toimittaa kattiloiden kanssa. Jos niitä ei ole saatavilla, käyttöönottoorganisaatio suorittaa tarvittavat mittaukset kannettavilla kaasuanalysaattoreilla. Järjestelmäkartta laaditaan, jossa on määrätty tarvittavat ohjausparametrit. Niitä noudattamalla voit varmistaa polttoaineen normaalin täydellisen palamisen.
Polttoaineen palamisen ohjauksen pääparametrit ovat:
- polttimiin syötetyn kaasun ja ilman suhde.
- ylimääräinen ilmasuhde.
- halkeama uunissa.
- Kattilan hyötysuhde.
Samalla kattilan hyötysuhde tarkoittaa hyötylämmön suhdetta kulutetun lämmön kokonaisarvoon.
Ilman koostumus
| Kaasun nimi | Kemiallinen alkuaine | Sisältöä ilmassa |
| Typpi | N2 | 78 % |
| Happi | O2 | 21 % |
| Argon | Ar | 1 % |
| Hiilidioksidi | CO2 | 0.03 % |
| Helium | Hän | alle 0,001 % |
| Vety | H2 | alle 0,001 % |
| Neon | Ne | alle 0,001 % |
| Metaani | CH4 | alle 0,001 % |
| Krypton | kr | alle 0,001 % |
| Xenon | Xe | alle 0,001 % |
Kaasumaisen polttoaineen poltto on yhdistelmä seuraavista fysikaalisista ja kemiallisista prosesseista: palavan kaasun sekoittaminen ilman kanssa, seoksen kuumennus, palavien komponenttien lämpöhajoaminen, syttyminen ja palavien alkuaineiden kemiallinen yhdistäminen ilmakehän hapen kanssa.
Kaasu-ilma-seoksen stabiili palaminen on mahdollista syöttämällä jatkuvasti tarvittavat määrät palavaa kaasua ja ilmaa palamisrintamalle, sekoittamalla niitä perusteellisesti ja lämmittämällä syttymis- tai itsesyttymislämpötilaan (taulukko 5).
Kaasu-ilma-seoksen sytytys voidaan suorittaa:
- lämmitetään koko kaasu-ilmaseoksen tilavuus itsesyttymislämpötilaan. Tätä menetelmää käytetään polttomoottoreissa, joissa kaasu-ilmaseos kuumennetaan nopealla puristamalla tiettyyn paineeseen;
- vieraiden sytytyslähteiden (sytyttimet jne.) käyttö. Tässä tapauksessa ei koko kaasu-ilmaseosta lämmitetä syttymislämpötilaan, vaan osa siitä. Tätä menetelmää käytetään poltettaessa kaasuja kaasulaitteiden polttimissa;
- olemassa olevaa poltinta jatkuvasti palamisprosessissa.
Kaasumaisen polttoaineen palamisreaktion käynnistämiseksi on tarpeen käyttää tietty määrä energiaa, joka tarvitaan molekyylisidosten rikkomiseen ja uusien luomiseen.
Kaasupolttoaineen palamisen kemiallinen kaava, joka osoittaa koko reaktiomekanismin, joka liittyy suuren määrän vapaiden atomien, radikaalien ja muiden aktiivisten hiukkasten syntymiseen ja katoamiseen, on monimutkainen. Siksi yksinkertaistamiseksi käytetään yhtälöitä, jotka ilmaisevat kaasun palamisreaktioiden alku- ja lopputilat.
Jos hiilivetykaasuja merkitään C m H n, niin näiden kaasujen hapessa palamisen kemiallisen reaktion yhtälö saa muotoa
C m H n + (m + n/4)O 2 = mCO 2 + (n/2) H20,
jossa m on hiiliatomien lukumäärä hiilivetykaasussa; n on vetyatomien lukumäärä kaasussa; (m + n/4) - kaasun täydelliseen palamiseen tarvittava hapen määrä.
Kaavan mukaisesti johdetaan kaasujen palamisen yhtälöt:
- metaani CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
- etaani C 2 H 6 + 3,5 O 2 \u003d 2CO 2 + ZH 2 O
- butaani C 4 H 10 + 6,5 O 2 \u003d 4CO 2 + 5H 2 0
- propaani C 3 H 8 + 5O 3 \u003d ZSO 2 + 4H 2 O.
Käytännön kaasun palamisolosuhteissa happea ei oteta puhtaassa muodossaan, vaan se on osa ilmaa. Koska ilma sisältää 79 tilavuusprosenttia typpeä ja 21 tilavuusprosenttia happea, 100:21 = 4,76 tilavuutta ilmaa tai 79:21 = 3,76 tilavuutta typpeä tarvitaan jokaista happitilavuutta kohden. Sitten metaanin palamisreaktio ilmassa voidaan kirjoittaa seuraavasti:
CH 4 + 2O 2 + 2 * 3,76 N 2 \u003d CO 2 + 2H 2 O + 7,52 N 2.
Yhtälö osoittaa, että 1 m 3 metaanin polttamiseen tarvitaan 1 m 3 happea ja 7,52 m 3 typpeä tai 2 + 7,52 = 9,52 m 3 ilmaa.
Polttamalla 1 m 3 metaania, 1 m 3 hiilidioksidia, 2 m 3 vesihöyryä ja 7,52 m 3 typpeä saadaan. Alla oleva taulukko näyttää nämä tiedot yleisimmistä palavista kaasuista.
Kaasu-ilmaseoksen palamisprosessissa on välttämätöntä, että kaasun ja ilman määrä kaasu-ilmaseoksessa on tietyissä rajoissa. Näitä rajoja kutsutaan syttymisrajoiksi tai räjähdysrajoiksi. Syttyvyysrajat ovat ala- ja ylärajat. Kaasu-ilmaseoksen vähimmäiskaasupitoisuutta tilavuusprosentteina ilmaistuna, jossa syttyminen tapahtuu, kutsutaan alemmaksi syttymisrajaksi. Kaasu-ilmaseoksen enimmäiskaasupitoisuutta, jonka yläpuolella seos ei syty ilman lisälämmön syöttöä, kutsutaan syttymisylirajaksi.
Hapen ja ilman määrä tiettyjen kaasujen palamisen aikana
|
Poltamiseen tarvitaan 1 m 3 kaasua, m 3 |
Palaessa vapautuu 1 m 3 kaasua, m 3 |
Palamislämpö He, kJ / m3 |
|||||
|
happi |
dioksidi hiili |
||||||
|
hiilimonoksidi |
|||||||
Jos kaasu-ilmaseoksessa on kaasua vähemmän kuin syttymisraja, se ei pala. Jos kaasu-ilmaseoksessa ei ole tarpeeksi ilmaa, palaminen ei etene täysin.
Kaasujen inertillä epäpuhtaudella on suuri vaikutus räjähdysrajojen suuruuteen. Kaasun painolastipitoisuuden (N 2 ja CO 2) lisääntyminen kaventaa syttymisrajoja, ja kun painolastipitoisuus nousee tiettyjen rajojen yläpuolelle, kaasu-ilmaseos ei syty millään kaasun ja ilman suhteella (taulukko alla) .
Inertin kaasun tilavuuksien määrä yhtä tilavuutta kohti palavaa kaasua, jossa kaasu-ilma-seos lakkaa olemasta räjähtävä
Pienintä kaasun täydelliseen palamiseen tarvittavaa ilmamäärää kutsutaan teoreettiseksi ilmavirraksi ja sitä merkitään Lt, eli jos kaasupolttoaineen lämpöarvo on 33520 kJ / m 3 , sitten teoreettisesti tarvittava ilmamäärä 1 m palamiseen 3 kaasua
L T\u003d (33 520/4190) / 1,1 \u003d 8,8 m 3.
Todellinen ilmavirta ylittää kuitenkin aina teoreettisen. Tämä selittyy sillä, että kaasun täydellistä palamista on erittäin vaikea saavuttaa teoreettisilla ilmavirtausnopeuksilla. Siksi mikä tahansa kaasupolttolaitos toimii ylimääräisellä ilmalla.
Käytännöllinen ilmavirta siis
L n = αL T,
missä L n- käytännöllinen ilmankulutus; α - ylimääräisen ilman kerroin; L T- teoreettinen ilmankulutus.
Ylimääräinen ilmakerroin on aina suurempi kuin yksi. Maakaasulle se on α = 1,05 - 1,2. Kerroin α näyttää kuinka monta kertaa todellinen ilmavirta ylittää teoreettisen yksikkönä. Jos α = 1, niin kutsutaan kaasu-ilma-seosta stoikiometrinen.
klo α = 1,2 kaasun poltto suoritetaan 20 % ilmaylimäärällä. Kaasujen palamisen tulisi yleensä tapahtua vähimmäisarvolla a, koska ylimääräisen ilman pienentyessä lämpöhäviöt pakokaasujen kanssa pienenevät. Palamiseen osallistuva ilma on primääristä ja toissijaista. Ensisijainen kutsutaan polttimeen tulevaa ilmaa sekoittumaan siinä olevan kaasun kanssa; toissijainen- palamisalueelle tulevaa ilmaa ei sekoiteta kaasun kanssa, vaan erikseen.






