Kaip matyti iš paties gaisro apibrėžimo, pagrindinis gaisro procesas yra degimas
Degimą visada lydi cheminės transformacijos. Degimas ore – tai degios medžiagos sąveika su deguonimi. Tačiau reikia turėti omenyje, kad azoto oksidai, halogenai ir ozonas degimo procese gali veikti kaip oksidatoriai. Yra žinomi degimo procesai, vykstantys dalyvaujant tik vienam pradiniam produktui - junginiui, galinčiam greitai suirti. Tokių junginių pavyzdžiai yra acetilenas ir hidrazinas.
Cheminiai procesai degimo metu vykstantys procesai yra itin sudėtingi. Net ir paprasčiausiu atveju - vandenilio degimas deguonyje, kurio apibendrinta lygtis turi formą
2H 2 + 0 2 = 2H 2 0,
Nustatyta ir ištirta kelios dešimtys pradinių etapų.
Iki šiol pakankamai išsamiai ištirti cheminių virsmų mechanizmai degant tik kelioms medžiagoms: vandenilio, anglies monoksido, metano ir etano. Šios žinios naudojamos daugelio medžiagų užsidegimo ir degimo sąlygoms prognozuoti.
2.1. Grandininės reakcijos
Grandininėms reakcijoms, skirtingai nuo įprastų cheminių virsmų, kiekviename elementariame veiksme atsiranda aktyvi dalelė: atomas su nesuporuotu elektronu, laisvasis radikalas arba jonas. Aktyvių dalelių atsiradimas sukelia pradinių medžiagų virsmo reakcijos produktais grandinę. Atomai, laisvieji radikalai ir jonai yra reaktyvesni nei molekulės, prisotintos valentiniu būdu. Todėl, nepaisant didelių energijos sąnaudų, reikalingų cheminiams ryšiams nutraukti ir aktyvioms dalelėms formuoti, reakcijos grandinės vystymasis dažnai būna energetiškai palankesnis nei tiesioginė molekulių sąveika.
Degimo procesai daugiausia vyksta per grandininį mechanizmą. Grandininės reakcijos yra sudėtingos reakcijos, vykstančios keliais etapais, kurios yra:
Grandinių branduolių susidarymas (iniciacija), kuriame susidaro aktyvios dalelės;
Tęsiasi grandinės, kuriose aktyviosios dalelės pradeda cheminę sąveiką su pirminėmis medžiagomis, dėl kurių susidaro naujos aktyvios dalelės;
Grandinės nutraukimas, kurio metu įvyksta aktyvių dalelių „mirtis“ susidarant galutiniams reakcijos produktams
Grandinių susidarymas gali vykti įvairiomis sąlygomis. Pavyzdžiui, dėl molekulių disociacijos, veikiant šiluminei energijai arba jonizuojančiai spinduliuotei, elektros iškrovoje. Aktyvių dalelių mirtis įvyksta jų rekombinacijos metu*, laisvųjų radikalų sąveikos metu (homogeninis grandinės nutraukimas), aktyvių dalelių sąveikos su kietais paviršiais metu (heterogeninis grandinės nutraukimas) arba dėl jų reakcijos su degimo inhibitoriais.
Yra nešakotų ir šakotų grandininių reakcijų. Neišsišakojusiose kiekvienai aktyviajai dalelei, sunaudotai grandinės tęsimo reakcijose, tenka viena naujai atsirandanti. Produkto molekulių, susidarančių vienoje pradinėje aktyviojoje dalelėje, skaičius vadinamas grandinės ilgiu. Degimo reakcijose vykstančių grandinių ilgis svyruoja nuo šimtų tūkstančių iki dešimčių milijonų. Neišsišakojusių grandininių reakcijų greičiui įtakos gali turėti nedideli medžiagų, galinčių efektyviai sąveikauti su aktyviosiomis dalelėmis, priemaišomis – degimo inhibitoriais.
Kai kurios medžiagos – iniciatoriai – palengvina aktyvių dalelių susidarymą ir taip pagreitina neišsišakojusias grandinines reakcijas.
Šakotosiose grandininėse reakcijose vienai aktyviajai dalelei, kuri sunaudojama grandinei tęsiantis, susidaro dvi ar daugiau aktyvių dalelių. Vienas iš jų tęsia pirminę grandinę, o kiti pradeda naujas grandines, formuojančias šakas (2.1 pav.).
„Rekombinacija – tai neutralių atomų ar molekulių susidarymo procesas iš įkrautų dalelių. Rekombinacijos metu susidarę atomai ir molekulės gali būti pradinės arba sužadintos būsenos.

Ryžiai. 2.1. Scheminis reakcijos grandinių vaizdas:
a) šakojasi kiekvienoje grandinės grandyje
6) retas išsišakojimas
Pavyzdžiui, deginant vandenilį grandinės branduolių susidarymo reakcijoje:
susidaro aktyvus atomas. Grandininės tęstinės reakcijos metu:

daugėja aktyvių atomų, kurie yra naujų grandinių pradžia.
Šakotosios grandininės reakcijos gali vykti stacionariame režime, kai šakojimosi greitis yra mažesnis nei aktyvių dalelių žūties greitis, ir nestacionariu režimu, kai mirtis vyksta lėčiau nei šakojasi. Pastaruoju atveju grandininės reakcijos greitis didėja eksponentiškai ir jį riboja tik pradinių medžiagų suvartojimas. Perėjimas iš stacionaraus į nestacionarų režimą įvyksta staiga, šiek tiek pasikeitus reakcijos sąlygoms: temperatūrai, slėgiui ar vieno iš reagentų koncentracijai. Toks greitas pagreitis laikomas savaiminiu reakcijos mišinio užsidegimu arba grandininiu sprogimu.
Kuriant degimo procesų teoriją, didelę reikšmę turėjo šakotųjų grandininių reakcijų atradimas. Įrodyta, kad yra dviejų tipų uždegimas: terminis ir grandininis. Nustatyti modeliai
2 skyrius. Cheminiai procesai metu deginimas
Grandininių procesų teorija leidžia efektyviai paveikti degimo procesų vystymąsi ir slopinimą gaisrų metu.
Grandinių kilmė. Pradinių aktyvių centrų branduolių susidarymo procesas vaidina didelį vaidmenį vystant nešakotąsias grandinines reakcijas. Jis kompensuoja aktyvių centrų praradimą grandinės nutraukimo reakcijų metu. Šis mechanizmas nustato formavimosi sąlygas stacionarus režimas pradiniu aktyvių centrų kaupimosi laikotarpiu. Esant žemam inicijavimo lygiui, šis laikotarpis gali būti reikšmingas.
Dauguma cheminių reakcijų liepsnoje išsiskiria dideliu aktyvių centrų energijos rezervu. Esant tokioms sąlygoms, aktyvių centrų inicijavimas yra susijęs su reikšmingo energetinio barjero įveikimu.
Šiuo atveju svarbų vaidmenį atlieka veiksniai, užtikrinantys reikšmingą aktyviųjų centrų susidarymo greitį: chemiškai aktyvūs priedai, radiacija, elektros iškrova, radioaktyvieji skilimo produktai.
Tarp veiksnių, kurie žymiai palengvina aktyvių centrų susidarymą, reikėtų pažymėti nevienalytes reakcijas. Degiųjų medžiagų molekulėse, adsorbuotose ant kieto paviršiaus, tarpatominiai ryšiai susilpnėja ir jiems nutraukti reikia mažiau energijos. Tokiomis sąlygomis aktyvių centrų susidarymo greitis yra žymiai didesnis nei dujų tūryje. Aktyvinimo energija heterogeninės degiojo mišinio komponentų sąveikos metu taip pat yra mažesnė nei homogeninės sąveikos metu. Heterogeninis aktyvių centrų inicijavimas realių degimo procesų sąlygomis yra svarbus veiksnys pagreitintas stacionaraus režimo pasiekimas nešakotosios grandinės procesuose.
Kai kurios savybės apibūdina nešakotąsias grandinines reakcijas, vykstančias dalyvaujant atominiams komponentams. Nesant priemaišų, kurios sąveikauja su aktyviais centrais be regeneracijos, grandinės nutraukimas tampa įmanomas tik per atomų rekombinaciją per trigubus susidūrimus ir ant paviršiaus.
Bet kurioje temperatūroje visos dujinės medžiagos yra dalinai disocijuojamos. Kai kurios molekulės skyla į atomus. Šiuo atveju yra pusiausvyra tarp disociacijos procesų ir atomų susijungimo į molekules. Disociacijos laipsnis eksponentiškai priklauso nuo temperatūros.
Jei degiajame mišinyje nėra grandinę nutraukiančių priemaišų, tai reakcijos atominių komponentų koncentracija praktiškai nekinta. Atomai, kurie patenka į reakciją, tuoj pat atsinaujina tame pačiame ko
Korolčenka A.Ya. Degimo ir sprogimo procesai
asmenybę. Pradinė iniciacija kompensuoja sureagavusius atomus tokiu pačiu skaičiumi kaip ir nereaguojančioje sistemoje. Stacionari reakcija neturi įtakos šiam procesui. Vieno iš reakcijos komponentų, pasižyminčių mažiausiai stipriu ryšiu tarp molekulėje esančių atomų, pusiausvyra yra būdingas bruožas panašus režimas. Kito atominio komponento koncentracija yra beveik stacionari, bet didesnė nei pusiausvyrinė.
Vienalyčiai inicijuojant degimo reakcijas, stacionarus režimas nusistovi tik po tam tikro laiko, nes disociacijai reikia didelės aktyvinimo energijos. Šiuo laikotarpiu disociacijos greitis viršija rekombinacijos greitį, o reaguojančioje sistemoje vyksta aktyvių centrų kaupimasis. Abiejų procesų greičiai lyginami tik padidinus aktyviųjų centrų koncentraciją iki pusiausvyros. Šis laikotarpis vadinamas indukciniu periodu.
Kieto paviršiaus, kaip katalizatoriaus, buvimas reakcijos zonoje nekeičia termodinaminės pusiausvyros būsenos. Katalizatorius vienodai veikia pirmyn ir atgal vykstančias reakcijas. Aktyvūs centrai ne tik formuojasi branduolyje ant kieto paviršiaus, bet ir baigiasi jame. Tačiau katalizatoriaus buvimas pagreitina disociacijos pusiausvyros būsenos pasiekimą.
Jei degiajame mišinyje yra aktyvių priemaišų, kurios gali dalyvauti grandinės nutraukimo reakcijose, jos sumažina aktyviųjų centrų koncentraciją. Tokiu atveju sutrinka vieno iš pradinių komponentų pusiausvyrinė disociacija, o tai sulėtina reakciją ir gali baigtis.
Eksperimentai rodo, kad nešakotą grandininę reakciją inicijuojant išoriniam šaltiniui (pavyzdžiui, šviesos šaltiniui), aktyviųjų centrų koncentracija pradiniame degimo proceso vystymosi etape gali gerokai viršyti pusiausvyrinę.
Kai vyksta šakotosios grandininės reakcijos, pradinės iniciacijos sąlygos turi didelę įtaką reakcijos vystymuisi. Lėtai vystomuose procesuose į pradinį įpylus iš dalies sureagavusio mišinio, sutrumpėja indukcijos periodas ir pagreitėja liepsnos degimo pradžios momentas.
Grandinių tęsinys. Būdingas neišsišakojusių grandininių reakcijų bruožas yra kvazistacionarus aktyvių centrų koncentracijos pobūdis. Nesant grandinės pabaigos, susidaro aktyvios dalelės
2 skyrius. Cheminiai procesai degimo metu
toks pat kiekis, kokiu jie suvartojami. Nauji atsiranda tik pradinio inicijavimo metu. Kai aktyviųjų centrų susidarymo ir grandinės nutraukimo greitis yra vienodas, nustatoma pastovi aktyvių centrų koncentracija ir stacionarus reakcijos režimas. Sunaudojus pradinius komponentus, reakcijos greitis sumažės.
Vykstant šakotajai grandininei reakcijai, aktyvių centrų koncentracija reaguojančioje sistemoje didėja nepriklausomai nuo jų pradinio inicijavimo sąlygų. Realizuojamas savaime greitėjantis reakcijos režimas, kuris turi laviną primenantį pobūdį. Šiuo atveju, norint visiškai paversti pradinius komponentus į galutinius reakcijos produktus, pakanka vieno pradinio aktyvaus centro.
Šakotosios vertingosios reakcijos kinetinė lygtis yra tokia. Stabilių pradinių komponentų koncentracijos pokyčiai laikui bėgant gali būti nepaisomi kaip pirmasis apytikslis skaičiavimas ir galima atsižvelgti tik į greitesnius aktyviųjų centrų koncentracijos pokyčius. P.Šio greičio pokyčius lemia pradinės iniciacijos greitis ir šakojimosi bei grandinės nutraukimo reakcijų greičių santykis. Pradinės iniciacijos greitis nepriklauso nuo sistemoje esančių aktyvių centrų koncentracijos. Išsišakojimų ir pasibaigimo procesų greitis proporcingas aktyviųjų centrų koncentracijai. Esant tokioms sąlygoms, bendrą aktyvių centrų formavimosi ir vartojimo balansą nulemia inicijavimo, šakojimosi ir pasibaigimo procesų greičių suma:
![]() (2.1)
(2.1)
kur ir yra šakojimosi ir pabaigos reakcijų greičio konstantos. Pažymėdami , gauname:
![]() (2.2)
(2.2)
Kai aktyviųjų centrų koncentracijos laiko išvestinė
teigiamas. Šiuo atveju reakcijos greitis laikui bėgant didėja. Ši šakotųjų grandininių reakcijų savybė atsiranda dėl aktyvių centrų dauginimosi tokiais režimais, kai šakojimosi reakcijos greitis viršija grandinės nutraukimo reakcijos greitį.
Korolčenka A.Ya. Degimo ir sprogimo procesai
Jeigu iki reakcijos pradžios sistemoje nebuvo aktyvių centrų, t.y. adresut= 0, n = 0 lygties (2.2) integravimas duoda:
![]() (2.3)
(2.3)
Bendras CO reakcijos greitis nustatomas pagal šakojimosi proceso greitį. Galutiniai produktai susidaro tik šios reakcijos metu. Kiekvienam elementariam grandinės išsišakojimui susidaro galutinio produkto molekulės. Todėl:
![]() (2.4)
(2.4)
Grandininės reakcijos raidą laikui bėgant lemia šakojimosi ir grandinės nutraukimo reakcijų greičio konstantų santykis ir At t.y. kai (2.4) lygties eksponentas yra teigiamas ir vėl
veiksmas savaime greitėja neribotai. Pradiniu reakcijos vystymosi laikotarpiu galioja toks santykis:
Dėl to, kad pradinis inicijavimo greitis yra mažas, pradiniu laikotarpiu nėra pastebimos cheminės transformacijos. Po kurio laiko vertė tampa žymiai didesnė už vienybę. Po to reakcijos greitis pagal (2.4) lygtį pradeda sparčiai didėti ir pasiekia labai aukštas reikšmes, nors prieš tai jis buvo praktiškai nepastebimas.
Vėlavimo periodo (indukcijos periodo) buvimas vystantis grandininei reakcijai yra dėl to, kad reaguojančioje sistemoje reikia sukaupti tam tikrą aktyvių centrų skaičių. Tik po to cheminė transformacija tampa pastebima.
Grandininių reakcijų indukcijos periodo dydį lemia šakojimosi ir grandinės nutraukimo procesų, o ne pradinės iniciacijos greitis. Savo ruožtu nustatomi šakojimosi ir nutraukimo reakcijų greičiai cheminės savybės kiekvienos reaguojančios sistemos priklausomybės nuo temperatūros ir pradinių komponentų koncentracijos. Grandininių reakcijų ypatumas yra
yra tai, kad šakojimosi procesams reikalinga didelė aktyvinimo energija, tuo tarpu temperatūros koeficientas Nutraukimo proceso greičio konstanta yra artima nuliui. Visų trijų tipų grandinės nutraukimo reakcijoms: tūrinės ir heterogeninės rekombinacijos metu, radikalų sąveikos su aktyviosiomis priemaišomis metu aktyvavimo energijos yra lygios nuliui.
Didėjant temperatūrai, bendram mišinio slėgiui arba keičiantis reaguojančių komponentų koncentracijai, galimas toks šakojimosi ir pasibaigimo greičio konstantų pokytis, kai reakcija pereina iš stacionaraus režimo į ne stacionarus. Šio proceso ypatumas yra staigus perėjimas iš vieno režimo į kitą, reakcijos greičio pokytis nuo nežymiai mažos vertės iki neribotai didėjančio.
Kai kurių grandininių reakcijų atsiradimą lydi tarpinių produktų susidarymas, kurie yra santykinai stabilūs, tačiau tuo pat metu turi galimybę generuoti aktyvius centrus. Tokios reakcijos apima, pavyzdžiui, angliavandenilių degimo reakcijas, kurių metu kaip tarpiniai produktai susidaro peroksidai ir aldehidai. Tai veda prie grandinės šakų. Tačiau dėl santykinio tarpinių produktų stabilumo reakcijos pagreitis ilgainiui pailgėja. Toks lėtas grandinių išsišakojimas vadinamas išsigimusiu.
Grandininės reakcijos su įprastu radikalų šakojimosi mechanizmu, kaip taisyklė, vyksta gana greitai dėl didelio radikalų aktyvumo. Susidarę radikalai arba inicijuoja greitai greitėjančią reakciją, arba rekombinuojasi ir baigia procesą.
Nutrūkusios grandinės. Aktyvi dalelė, kaip ir bet kuri dujų molekulė, reaguojančioje sistemoje vyksta chaotiškai, susidurdama su kitomis molekulėmis. Šiuo atveju yra tam tikra tikimybė, kad tam tikro susidūrimo metu sąveikauja su kita aktyvia dalele ar molekule ir susiformuoja nauja aktyvi dalelė, tęsianti ankstesnės kelią. Reakcijos grandinės vystymasis panašus į inertinių molekulių Brauno judėjimą, nors aktyvių centrų perkėlimas vyksta kartu su chemine reakcija. Grandinės vystymosi kelyje pakaitomis keičiasi dviejų ar daugiau tipų aktyvūs centrai.
Korolčenka A.Ya. Degimo ir sprogimo procesai
Reakcijų grandinė tęsiasi iki to momento, kai aktyvioji dalelė sureaguoja be regeneracijos. Tokiu atveju įvyksta vadinamasis grandinės pertraukimas. Nutraukimo procesai vaidina didelį vaidmenį grandininių reakcijų kinetikoje. Yra dvi galimos reakcijos, sukeliančios aktyvių centrų mirtį:
Homogeninis nutraukimas (mirtis reaguojančio mišinio tūryje);
Heterogeninis grandinės nutrūkimas (mirtis ant kieto paviršiaus) Homogeninis grandinės nutrūkimas galimas vienu iš dviejų procesų:
radikalų rekombinacijos metu arba įvairių chemiškai aktyvių komponentų sąveikos su aktyviais centrais metu, pastariesiems neregeneruojant.
Heterogeninis grandinės nutrūkimas atsiranda ant suodžių dalelių, susidariusių degimo metu arba ant kietų degančių medžiagų paviršiaus. Grandinės pabaiga ant kieto paviršiaus gali būti laikoma aktyvių centrų difuzija iš dujų mišinysį šį paviršių, ant kurio jie išnyksta. Rekombinacijos ant kieto paviršiaus mechanizmas yra toks, kad aktyvi dalelė su padidintu reaktyvumu yra sorbuojama* ant paviršiaus. Kaimyninėse srityse sorbuoti radikalai rekombinuojasi vienas su kitu, nes šiam procesui nėra jokių energetinių ar erdvinių kliūčių. Rekombinacijos metu susidariusios stabilių junginių molekulės nebedalyvauja vystant grandininę reakciją.
Tačiau ne kiekvienas aktyvios dalelės susidūrimas su kietu paviršiumi sukelia jos adsorbciją. Jis gali atsispindėti nuo paviršiaus. Aktyvaus centro adsorbcijos kietu paviršiumi tikimybė vadinama akomodacijos koeficientu. Šis koeficientas yra aktyviosios dalelės ir paviršiaus cheminio giminingumo charakteristika. Praktiškai svarbiais atvejais aktyvioji dalelė, atsispindėjusi nuo sienos, toli nuo jos nejuda. Galimi nauji susidūrimai su siena, kol ji atsidurs. Dėl šio proceso tam tikromis sąlygomis reakcijos greitis praktiškai nepriklauso nuo akomodacijos koeficiento. Procesas vyksta taip:
* Sorbcija yra kietos (arba skystos) medžiagos absorbcija aplinkoje. Sugeriantis kūnas vadinamas sorbentu, absorbuojamasis- sorbatas. Skiriama absorbcija pagal visą sorbento masę (absorbcija) ir pagal paviršinį sluoksnį (adsorbcija). Sorbcija dėl sąveikos cheminis tipas tarp kieto sorbento paviršiaus ir sorbato vadinama chemisorbcija.
__________________________ 2 skyrius. Cheminiai procesai degimo metu
ar kiekvieno susidūrimo metu grandinė nutrūktų. Aktyvių centrų koncentracija paviršiuje gali būti laikoma lygi nuliui.
Jei reaguojančiame mišinyje nėra aktyvių priemaišų, grandinė gali nutrūkti arba ant kietų paviršių, arba homogeniškai, rekombinuojant radikalus. Tikruose gaisruose dažniausiai įgyvendinamas antrasis būdas.
Inertinių dujų įpylimas į reaguojančią sistemą turi tam tikrą įtaką grandininių reakcijų kinetikai. Inertiniai priedai padidina susidūrimų su aktyviosiomis dalelėmis skaičių, padidina grandinės nutrūkimo tikimybę ir atitinkamai slopina bendrą reakciją.
Efektyvesnis grandininių reakcijų slopinimas pasiekiamas į reaguojantį mišinį įvedant chemiškai aktyvių priedų – inhibitorių. Inhibitoriai sąveikauja su aktyviais centrais, kurie sukelia reakciją, nutraukdami grandines. Reakcijos kinetika slopinamame mišinyje nulemta konkurencijos tarp inhibitoriaus ir pagrindinių reakcijos komponentų sąveikaujant su aktyviais centrais sąlygos. Esant dideliam inhibitorių efektyvumui ir vidutiniam naujų aktyvių centrų susidarymo greičiui, net nedideli inhibitorių priedai gali visiškai slopinti grandininę reakciją.
Slopinimo procesai turi didelę reikšmę gaisro ir sprogimo saugos praktikoje. Inhibitorių naudojimas leidžia efektyviai paveikti degimo procesus.
2.2. Cheminiai procesai vandenilio degimo metu
Vandenilio molekulės sąveika su deguonies molekule vyksta sudėtingu būdu per keletą iš eilės einančių etapų. Dabar tvirtai nustatyta, kad vandenilio degimas vyksta grandinės mechanizmu, o dalelės atlieka aktyvių centrų vaidmenį. Vandenilio degimo metu vykstančių elementariųjų reakcijų seka ir reikšmė yra labai išsamiai aprašyta įvairios sąlygos vandenilio liepsnų atsiradimas ir vystymasis.
Išsamiausią vandenilio degimo savaiminio užsidegimo režimu proceso analizę eksperimentiniais ir skaičiavimo metodais atliko profesorius A. N. Baratovas. Jis pasiūlė tokią proceso diagramą, apimančią keturiolika pagrindinių elementarių reakcijų:
Korolčenka A.Ya. Degimo ir sprogimo procesai
Aktyvių centrų branduolių susidarymas vyksta pagal reakciją
![]()
Grandinių tęsimas reakcijomis
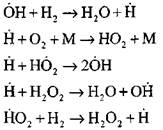
Šakojančios grandinės
 |
nutrūkusios grandinės
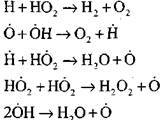 |
Vandenilio atomų koncentracija pradiniame savaiminio užsidegimo proceso etape yra nereikšminga pradinio vandenilio kiekio dalis. Vystantis grandininei reakcijai, molekulinio vandenilio konversijos greitis tampa toks didelis, kad jis sunaudojamas šimtąsias sekundės dalis.
2.3. Cheminės reakcijos anglies monoksido degimo metu
Anglies monoksido sąveika su deguonimi yra svarbiausia degimo procesų reakcija. Šios reakcijos atsiradimas
__________________________ 2 skyrius. Cheminis procesas s kai dega
daugeliu atvejų tai lemia anglies turinčių medžiagų degimo būdus. Reakcijai būdingas šakotos grandinės mechanizmas. Jis skiriasi daugybe savybių.
Ilgą laiką buvo manoma, kad visiškai sausas CO ir 0 2 mišinys negali užsidegti ir sudegti. Tačiau kruopščiai suplanuoti eksperimentai, kurių metu vandens nebuvimas buvo stebimas naudojant masės spektrografą, parodė, kad galima užsidegti ir sausam mišiniui. Reikėtų pažymėti, kad vandens ar vandenilio garų buvimas CO + 0 2 sistemoje suaktyvina užsidegimo ir degimo procesą, padidindamas galimų aktyvių centrų skaičių. Vandens greitinantis poveikis ypač pastebimas esant mažoms koncentracijoms.
Anglies monoksido degimas, esant vandens garams arba nedideliems vandenilio priedams, vyksta dalyvaujant šiems elementariems procesams:

Reakcijoje (VI) susidarę radikalai H0 2 gali tęsti grandinę (VIII reakcija) arba sukelti jos pabaigą reakcijoje (IX-XII).
Norėdami įvertinti lėtos CO oksidacijos perėjimo į grandinės sprogimą sąlygas, įvertiname grandinės nutrūkimo per H0 2 radikalą tikimybę; Tuo pačiu atsižvelgiame į tai, kad reakcijų (X) ir (XI) vaidmuo grandinės nutraukime bus nereikšmingas dėl
palyginti su reakcija (IX), nes procesų (IX-XI) greičio konstantos 1000 K temperatūroje yra artimos viena kitai, tačiau radikalų koncentracijos yra žymiai mažesnės nei vandenilio atomų koncentracija, nes radikalai turi didesnis cheminis aktyvumas. Todėl grandinės nutraukimo per H0 2 radikalą tikimybę galima parašyti taip:
Esant 1000K temperatūrai
Todėl su sąlyga, kad
![]()
![]()
dydžio įtaką
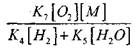
ant (2.7) lygties sprendinio bus silpnas.
2 skyrius. Cheminiai procesai degimo metu
Kada ![]() arba
arba ![]() (kuris pastebimas
(kuris pastebimas
tikrosios CO liepsnos), (2.7) lygtis paverčiama tokia forma:
![]() (2.8)
(2.8)
Taigi anglies monoksido degimo ore sąlygas daugiausia lemia vandenilio buvimas ir degimo būdai. CO oksidacija vykstant reakcijai (I) priklauso nuo OH radikalų, susidarančių reakcijose, kuriose dalyvauja vandenilis, koncentracijos.
Anglies monoksido degimo reakcijos ypatumas yra greitas jos slopinimas, kai į reaguojančią sistemą įvedami nedideli priedai medžiagų, turinčių didelį afinitetą vandenilio atomams. Tokios medžiagos, kurios slopina CO degimą, yra halogenai ir halogeninti angliavandenilių dariniai. Jų slopinamasis poveikis atsiranda dėl reakcijos grandinių nutraukimo sąveikaujant su vandenilio atomais pagal reakciją
2.4. Angliavandenilių deginimas
Vandenilio ir anglies monoksido degimo procesų svarstymas parodo degimo reakcijos mechanizmo sudėtingumą. H 2 ir CO atveju reakcija vyksta kaip grandininė reakcija, kurioje dalyvauja daug elementarių etapų ir tarpinių produktų. Todėl natūralu tikėtis, kad sudėtingesnės struktūros medžiagų – angliavandenilių – degimo reakcijų mechanizmas dar sudėtingesnis, o šių junginių užsidegimo ir degimo procesus lydintis poveikis įvairesnis.
Šiuo metu turima informacija apie angliavandenilių cheminių pertekliaus pobūdį jų degimo metu leidžia paaiškinti pastebėtus efektus apytiksliai.
Nustatyta, kad angliavandenilių liepsnose kartu su jau žinomomis aktyviosiomis dalelėmis yra daug sudėtingesnės struktūros tarpinių produktų. Kai kuriais atvejais jie tampa naujų grandinių kilmės šaltiniais. Pagrindinį vaidmenį angliavandenilių užsidegimo ir degimo procesuose atlieka šių tipų tarpiniai junginiai:
Korolčenka A.Ya. Degimo ir sprogimo procesai
1. Angliavandenilių radikalai, kurie yra anglies molekulė
vandenilio chloridas, kuriame pašalintas vienas ar keli vandenilio atomai. Šie
liekanos vadinamos alkilais (CH3 – metilas; C2H5 – etilas; C3H7 – propilas ir
ir tt). Dėl aukšto reaktyvumas laisvieji alkilai
neegzistuoja ilgą laiką. Esama liepsnoje kaip tarpinės medžiagos
Nauji produktai. Sąveikaujant su kitomis molekulėmis jie elgiasi
kaip savarankiška struktūrinė grupė. Angliavandenilių radikalai
paprastai žymimas raide R.
2. Peroksidai yra R-00-R bendrosios formulės junginiai.
3. Aldehidų tipo junginiai
![]()
Paprasčiausi aldehidai yra skruzdžių (formaldehidas) ir acto (acetaldehidas) ![]() . Šios medžiagos yra visos
. Šios medžiagos yra visos
kai yra nevisiško angliavandenilių degimo produktuose.
Bet kokia reakcija, kurios metu susidaro angliavandenilių radikalai, angliavandenilių degimo metu gali inicijuoti grandinę. Tai gali būti etano molekulės skilimo reakcija, susidarant dviem laisvoms metilo grupėms:
![]()
arba angliavandenilio reakcija su deguonimi:
![]()
Grandinių tęsimas atsiranda dėl formavimosi reakcijų | peroksidai arba hidroperoksidai:
![]()
Hidroperoksido skilimo metu vyksta grandinės išsišakojimas:
2 skyrius. Cheminiai procesai degimo metu
Pateikta reakcijų seka lemia laipsnišką peroksido junginių koncentracijos didėjimą reaguojančioje sistemoje.
Kartu su peroksidų, radikalų ir
Galimos lygiagrečios reakcijos:
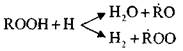
Šios reakcijos yra egzoterminės; Kai jie atsiranda, išsiskiria didelis šilumos kiekis.
Didėjant reaguojančio mišinio temperatūrai, aktyvių centrų vaidmuo iš vieno tarpinio produkto į kitą pereina tokia tvarka: alkilo hidroperoksidai, acilo hidroperoksidai, formaldehidai.
Eksperimentiniai tyrimai reaguojančio mišinio sudėties pokyčiai per tam tikrą laiką aukštoje temperatūroje (600–800°C) rodo, kad pradinių angliavandenilių pavertimo galutiniais degimo produktais procesas yra padalintas į du etapus: pirmąjį, kuris vyksta labai dideliu greičiu vyksta angliavandenilių oksidacija į CO. Antroje, lėtoje stadijoje, CO oksiduojamas iki . Tai veda prie labai svarbios išvados: daugelis angliavandenilių degimo modelių gali būti paaiškinti anglies monoksido degimo ypatybėmis.
2.5. Anglies deginimas
Anglies degimas vyksta pagal nevienalyčio proceso mechanizmą, kurio specifiškumas yra tas, kad cheminė stadija negali būti vertinama atskirai nuo dujinio oksidatoriaus (oro deguonies) perkėlimo iš aplinkinės erdvės į jo paviršių. deginimas kietas. Degimo greitis priklauso nuo abiejų cheminės savybės anglies, ir apie charakteristikas, kurios lemia deguonies tiekimo į kuro paviršių procesą. Deguonies tiekimas į degimo zoną vyksta difuzijos būdu ir todėl
Korolčenka A.Ya. Degimo ir sprogimo procesai
priklauso nuo daugelio veiksnių: degančio kūno formos ir dydžio, dujinės terpės judėjimo, deguonies ir reakcijos produktų difuzijos koeficientų tiek erdvėje virš kuro paviršiaus, tiek plyšiuose bei porose, esančiuose anglies ir kokso viduje. reikšmingus kiekius.
Norėdami iliustruoti nevienalyčio anglies degimo ypatybes, panagrinėkime atskiro anglies gabalo, įdėto į krosnį, įkaitintą iki 900 °C, elgesį. Iš pradžių anglis degs dėl deguonies, esančio šalia jos paviršiaus. Jį sunaudojus aplink šildomą paviršių susidaro degimo produktų sluoksnis -. Degimo greitis sumažės, o procesas galėtų sustoti, jei iš tolimesnių dujų erdvės vietų nebūtų tiekiamas deguonis.
Šis tiekimas vyksta difuzijos būdu, o degimo greitį lems difuzijos srauto dydis. Difuzijos intensyvumas labai priklauso nuo dujinės terpės judėjimo šalia degančio paviršiaus intensyvumo ir pobūdžio. Greitis cheminė reakcija daugiausia lemia temperatūra. Heterogeninės reakcijos, kaip ir vienalytės, paklūsta Arrhenijaus dėsniui.
At aukštos temperatūros anglies oksidacijos reakcija vyksta labai greitai, o bendrą proceso greitį ribos deguonies difuzija į paviršių.
Taigi anglies degimo procesas susideda iš dviejų skirtingo pobūdžio procesų: oro deguonies pernešimo iš dujų erdvės į jo suvartojimo vietą ir jo cheminės sąveikos su kietos anglies paviršiumi proceso. Abu šie procesai yra tarpusavyje susiję, tačiau kiekvienas turi savo modelius. Svarbiausias iš šių procesų yra deguonies suvartojimo procesas, kuriam būdingos įvairios cheminės reakcijos.
Sudėtingos deguonies sujungimo su anglimi reakcijos mechanizmas yra dviejų oksidų CO ir CO 2 susidarymas tuo pačiu metu per tarpinį C X 0 Y formos fizikinį ir cheminį kompleksą, kuris vėliau suskyla į CO ir CO. Šių oksidų santykis priklauso nuo degimo sąlygų. Atitinkamai, anglies degimo reakcijos lygtis gali būti parašyta taip:
2 skyrius. Cheminiai procesai degimo metu
Tada vyksta homogeninė anglies monoksido degimo reakcija:
kurio mechanizmas aptariamas 2.3 skyriuje.
Ši reakcija gali vykti arba šalia anglies paviršiaus, Taigi ir anglies masės viduje, jos porose ir plyšiuose.
Kita reakcija yra nevienalytė kaitinamosios anglies ir anglies dioksido reakcija:
![]()
Jis pastebimai atsiranda tose vietose, kur trūksta deguonies, bet kur anglies temperatūra gana aukšta.
Aprašytų reakcijų visuma lemia anglies degimo produktų sudėtį.
DEGIMO PROCESŲ ATSIRAŠYMAS
| G |
Degiuose mišiniuose gali užsidegti dėl jų savaiminio užsidegimo, užsidegimo nuo išorinio šaltinio arba savaiminio užsidegimo. Jei savaiminio užsidegimo ir užsiliepsnojimo procesai būdingi dujinės, skystos ar kietos būsenos medžiagoms, tai savaiminis užsidegimas būdingas kietoms medžiagoms (ypač smulkiai susmulkintoms) arba aukštos temperatūros skysčiams, paskirstytiems ant išsivysčiusio paviršiaus medžiagų. .
3.1. Savaiminis užsidegimas. Stacionari teorija
Supaprastintai kalbant, degimas suprantamas kaip greitai vykstantis egzoterminis medžiagų oksidacijos procesas atmosferos deguonimi, kai išsiskiria reikšminga sumašilumos ir šviesos emisija.
Degimas yra sudėtingas fizinis ir cheminis degiosios medžiagos ir oksidatoriaus sąveikos, taip pat tam tikrų medžiagų skilimo procesas, kuriam būdinga savaime greitėjanti transformacija su išsiskyrimu. didelis kiekisšilumos ir šviesos emisija. Paprastai šiame procese kaip oksidatorius dalyvauja oro deguonis, kurio koncentracija yra 21. apie. %. Degimo procesui atsirasti ir vystytis reikalinga degi medžiaga, oksidatorius ir uždegimo šaltinis, kuris inicijuoja tam tikrą cheminės reakcijos greitį tarp kuro ir oksidatoriaus.
Degimas, kaip taisyklė, vyksta dujinėje fazėje, todėl degios medžiagos kondensuotos būsenos (skysčiai ir kietosios medžiagos) turi būti dujofikuojamos (garuoja, skaidosi), kad pradėtų ir palaikytų degimą. Degimas išsiskiria įvairiais tipais ir ypatumais, kuriuos lemia šilumos ir masės perdavimo procesai, dujų dinaminiai veiksniai, cheminių reakcijų kinetika ir kiti veiksniai, taip pat degimas. Atsiliepimas tarp išorinės sąlygos ir proceso raidos pobūdį.
2.4.2.1. Degimo procesų klasifikacija.
Degimas gali būti vienalytis Ir nevienalytis priklausomai nuo degiųjų medžiagų ir oksidatoriaus agregacijos būklės.
Homogeninis degimas įvyksta, kai reaguojančių degiojo mišinio komponentų agregacijos būsena yra tokia pati. Homogeniškas degimas gali būti kinetinės Ir difuzija priklausomai nuo degių komponentų mišinio susidarymo sąlygų ir nuo cheminių reakcijų bei mišinio susidarymo greičių santykio. Vienoks ar kitas degimo režimas realizuojamas, pavyzdžiui, gaisro metu, priklausomai nuo to, kuris degimo proceso etapas riboja: mišinio susidarymo greitis ar cheminių reakcijų greitis.
Kinetinis – tai iš anksto sumaišytų dujų arba garų-oro mišinių degimas (proceso ribinė stadija – cheminių reakcijų greitis), kuris dažnai būna sprogstamasis (jei mišinys susidaro uždaroje erdvėje), nes Šiuo atveju išleista energija neturi laiko išsikrauti už šios erdvės ribų. Kinetinis degimas taip pat gali būti ramus, jei degusis mišinys pirmiausia sukuriamas mažoje, atviroje erdvėje, nuolat tiekiant kurą į degimo zoną.
Difuzinis degimo režimas realizuojamas, kai degus mišinys susidaro tiesiai degimo zonoje, kai oksidatorius patenka į ją dėl difuzijos procesų, pvz. nevienalytis deginimas.
Heterogeninis degimas vyksta esant skirtingoms degiosios medžiagos ir oksidatoriaus agregatinėms būsenoms. Nevienodo degimo metu svarbų vaidmenį vaidina garų, susidarančių iš kondensuotų degiųjų medžiagų (skysčių, kietųjų medžiagų) srauto į reakcijos zoną intensyvumas.
Dujų dinamikos požiūriu degimas gali būti laminarinis Ir neramus.
Laminarinis degimo procesas vyksta, kai degiojo mišinio komponentai patenka į reakcijos zoną esant žemoms Reinoldso kriterijaus reikšmėms (0< R e < 200), т.е. в основном за счёт молекулярной диффузии. Процесс характеризуется малыми скоростями газовыхkuro ir oksidatoriaus srautai ir reakcijos zonos (liepsnos fronto) sklidimas erdvėje sluoksnis po sluoksnio. Degimo greitis šiuo atveju priklauso nuo degiojo mišinio susidarymo greičio.
Turbulentinis proceso režimas realizuojamas, kai degiojo mišinio komponentai patenka į reakcijos zoną esant didelėms Reinoldso kriterijaus reikšmėms (230).< R e< 10000). Degimasšiuo režimu vyksta didėjant dujų greičiui srautai kai sutrinka jų judėjimo laminariškumas. Turbulentinio degimo režimu dujų čiurkšlių sūkurys pagerina reaguojančių komponentų maišymąsi, o paviršiaus plotas, per kurį vyksta molekulinė difuzija, didėja, todėl padidėja liepsnos sklidimo erdvėje greitis.
Pagal liepsnos plitimo erdvėje greitį degimas skirstomas į:
– defliacija(liepsnos plitimo greitis yra keli m/s);
– sprogstamasis(liepsnos plitimo greitis yra dešimtys ir šimtai m/s, bet ne daugiau kaip garso sklidimo ore greitis (344 m/s));
– detonacija(liepsnos plitimo greitis didesnis nei garso greitis ore).
Priklausomai nuo cheminių reakcijų gylio, degimas gali būti užbaigti Ir Nebaigtas.
Visiškai sudegus, reakcija vyksta iki galo, t.y. kol nesusidarys medžiagos, kurios negali toliau sąveikauti tarpusavyje, su kuru ir oksidatoriumi (pradinis degiosios medžiagos ir oksidatoriaus santykis vadinamas stechiometrinis). Kaip pavyzdį apsvarstykite visišką metano degimą, vykstantį pagal reakciją
CH 4 + 2O 2 = CO 2 + 2H 2 O+ K
Kur K – šiluma, išsiskirianti dėl egzoterminės reakcijos, J.
Kai angliavandeniliai visiškai sudeginami, reakcijos produktai yra anglies dioksidas ir vanduo, ty netoksiškos ir nedegios medžiagos. Visiškas degimas gali įvykti tiek esant stechiometriniam degalų ir oksidatoriaus santykiui, tiek esant oksidatoriaus pertekliui, palyginti su jo stechiometriniu kiekiu degiajame mišinyje.
Nepilniam degimui būdingas cheminės reakcijos neužbaigtumas, t.y. Reakcijos produktai, esant oksidatoriui, gali toliau su juo sąveikauti. Nepilnas degimas įvyksta, kai oksidatoriaus kiekis degiajame mišinyje yra nepakankamas (palyginti su stechiometriniu). Dėl nepilno degimo, pavyzdžiui, angliavandenilių, susidaro toksiškos ir degios sudedamosios dalys, pvz. CO, H 2, benzopirenas, SU(suodžių), organinių dervų ir kt., iš viso apie 300 cheminių junginių ir elementų.
Jei visi kiti dalykai yra vienodi, visiško degimo metu susidaro aukštesnė temperatūra nei nevisiško degimo atveju.
2.4.2.2. Pagrindiniai degimo procesų mechanizmai.
Degimą lydi šilumos išsiskyrimas ir šviesos išskyrimas ir vyksta laipsniško savaiminio proceso, susijusio su šilumos kaupimu sistemoje, pagreičio sąlygomis ( terminis degimas) arba katalizuoja aktyvius reakcijos tarpinius produktus ( grandininis degimas).
Šiluminis degimas galimas egzoterminės reakcijos metu, kurios greitis sparčiai didėja veikiant sistemoje besikaupiančiai šilumai, todėl pakyla temperatūra. Kai pasiekiama temperatūra, kuriai esant reakcijos šilumos prieaugis viršija šilumos nuostolius aplinką, įvyksta savaiminis sistemos įkaitimas, kuris baigiasi savaiminiu degaus mišinio užsidegimu. Tokiomis sąlygomis stebimas spontaniškas reakcijos vystymasis, lydimas susidariusių produktų kaitinimo iki temperatūros, kurioje jie pradeda skleisti šviesą (daugiau nei 900 laipsnių). °C). KAM terminis degimas apima procesus tiek su atmosferos deguonimi, tiek be jo (sprogiųjų medžiagų, ozono, acetileno, peroksidų skilimas (pvz., N 2 APIE 2), kai kurių metalų sąveika su halogenais, siera ir kt.).
Grandininis degimas galimas tik tose reakcijose, kurių užsidegimo ar sprogimo pagrindas yra grandininis procesas. Pastarąjį lydi nestabilių tarpinių reakcijos produktų susidarymas, kurie regeneruoja aktyvius centrus (atomus ir molekules su laisvais cheminiais ryšiais), kurie pagreitina procesą. Pakankamas aktyvių centrų skaičius prisideda prie grandinės proceso perėjimo prie terminio ir mišinio temperatūros padidėjimo iki savaiminio užsidegimo taško. Tokie aktyvūs centrai atsiranda dėl molekulių šiluminio vibracinio judėjimo greičio padidėjimo ir daugėja dėl grandinių išsišakojimo. Pradinėse reakcijų, vykstančių grandininiu mechanizmu, stadijose reaguojančių medžiagų cheminė energija daugiausia perkeliama į naujų aktyvių centrų susidarymą. Aktyvių centrų koncentracijos kitimo procesas apibūdinamas lygtimi:
![]() (1)
(1)
Kur n – aktyvių centrų skaičius reakcijos zonoje;
τ - laikas;
w 0 – aktyvių centrų branduolio susidarymo greitis;
φ – konstanta, apibūdinanti šakojimosi ir grandinės nutraukimo greičių skirtumą.
Medžiagos struktūros molekulinės kinetinės teorijos (MKT) požiūriu cheminės degimo reakcijos vyksta dėl kuro ir oksidatoriaus molekulių sąveikos. Dviejų degiojo mišinio komponentų molekulinės sąveikos jėgos atsiranda labai nedideliu atstumu, o didėjant atstumui jos smarkiai mažėja. Todėl kuro ir oksidatoriaus molekulių sąveika įmanoma tik visiškai sujungus, o tai gali būti laikoma susidūrimu. Vadinasi, prieš cheminę reakciją tarp degalų ir oksidatoriaus turi susimaišyti komponentai ir fizinis tampraus molekulių susidūrimo veiksmas.
Dujų molekulių susidūrimų skaičius tūrio vienete yra lengvai apskaičiuojamas. Taigi, pavyzdžiui, stechiometriniam vandenilio ir deguonies mišiniui (2 N 2 + APIE 2) 288 laipsnių temperatūroje KAM Ir Atmosferos slėgis (~ 101325 Pa) susidūrimų skaičius 1 Su 1 cm 3 pasiekia 8,3·10 28. Jei visi šie susidūrimai baigtųsi chemine reakcija, tada visas mišinys sureaguotų labai greitai. Praktika rodo, kad tokiomis sąlygomis degimo reakcija visai nevyksta, nes visi šie susidūrimai nesukelia cheminės sąveikos.
Kad įvyktų cheminė reakcija, reaguojančios molekulės turi būti sužadintos. Toks sužadinimas gali būti cheminis, kai molekulių atomai turi vieną ar du laisvus valentus (tokios molekulės vadinamos radikalais ir žymimos, pvz. CH 3 , JIS , CH 2 ir kt.) ir fizinis, kai dėl lėto kaitinimo molekulės įgyja kinetinę energiją, viršijančią kritinę vertę.
Molekulės, turinčios reikiamą energijos rezervą esamiems ryšiams nutraukti arba susilpninti, vadinamos aktyviais cheminės reakcijos centrais.
Skirtumas tarp aktyvios ir normalios būsenos molekulių vidutinių energijos lygių, t.y. neaktyvi, nesužadinta būsena, vadinama aktyvacijos energija ( E A). Kuo didesnė aktyvinimo energijos skaitinė reikšmė, tuo sunkiau priversti tam tikrą reagentų porą įsijungti į cheminę reakciją ir atvirkščiai. Todėl aktyvavimo energija yra tarsi netiesioginis laipsnio rodiklis gaisro pavojus degių medžiagų.
Įjungimo energiją galima apskaičiuoti pagal formulę:
Kur E A- aktyvinimo energija, J;
k– Boltzmanno konstanta lygi 1,38·10 –23 J/C;
T- absoliuti temperatūra, KAM.
Pagrindinio cheminio degimo proceso pobūdis priklauso nuo daugelio fizinių procesų:
– reaguojančių medžiagų ir reakcijos produktų judėjimas (difuzijos procesai);
– šilumos išleidimas ir paskirstymas (šilumos perdavimo procesai);
– aero- ir hidrodinamines sąlygas, užtikrinančias šilumos ir medžiagos perdavimą (konvekciniai procesai).
Būtinybė atsižvelgti į šiuos veiksnius labai apsunkina degimo procesų tyrimą ir teorinį aprašymą.
Degimas kietosios medžiagos, kurios kaitinant nesudaro dujų (garų) fazės, yra nevienalytės ir atsiranda fazių sąsajoje, todėl kartu su aukščiau aptartais veiksniais, turinčiais įtakos proceso pobūdžiui, kietosios fazės paviršiaus dydžiui ir pobūdžiui. vaidina nepaprastai svarbų vaidmenį (tai ypač svarbu aerozoliams).
2.4.2.3. Uždegimo impulsai.
Kad įvyktų degimas, be degiosios medžiagos ir oksidatoriaus, reikalingas pradinis energijos impulsas (dažniausiai išsiskiriantis šiluma), dėl kurio užsidega nedidelis degiojo mišinio tūris, po kurio degimas pasklinda po visą. visos erdvės, kurioje jis paskirstytas.
Uždegimo impulsas gali atsirasti, kai vyksta fiziniai, cheminiai ir mikrobiologiniai procesai, kurie prisideda prie šilumos susidarymo. Atsižvelgiant į šių procesų pobūdį, impulsai atitinkamai skirstomi į fizinis, cheminis, Ir mikrobiologinės
Kadangi fiziniam impulsui veikiant sistemą, išsiskiria šiluma, kuri nėra cheminio proceso rezultatas, šis impulsas laikomas terminiu. Šilumos impulsas, sukeliantis sistemos šildymą, gali būti:
– kontaktas– šilumos perdavimas vyksta dėl degiojo mišinio sąlyčio su jo šaltiniu;
– radiacija– šilumos perdavimas degiam mišiniui vyksta elektromagnetine spinduliuote iš šildymo šaltinio;
– konvekcija– šilumos perdavimas į degiąją sistemą vyksta dėl medžiagos (oro ar kitų judančių dujų);
– hidraulinis(dinaminis) - šilumos generavimas dėl greito dujų mišinio tūrio sumažėjimo kartu su pastarojo slėgio padidėjimu.
Pagrindiniai šilumos impulsų šaltiniai yra:
– atvira liepsna(temperatūra ~ 1500 °C);
– šildomi paviršiai (temperatūra > 900 °C);
– mechaninės kibirkštys (temperatūra ~ 1200 °C)
– elektros kibirkštys (temperatūra iki 6000 °C).
Esant cheminiams ir mikrobiologiniams impulsams, šilumos kaupimasis sistemoje vyksta dėl cheminės reakcijos, fizikinio ir cheminio proceso (pavyzdžiui, adsorbcijos) ir mikroorganizmų, kurių degioji medžiaga yra maistas, veiklos.
2.4.2.4. Degimo reakcijų greitis.
Degimo proceso greitis bendras vaizdas nustatoma pagal lygtį:
 (3)
(3)
Kur A ,b – reaguojančių komponentų koncentracija;
τ - laikas,
arba  (4)
(4)
Kur m, n – degimo produktų koncentracija.
Padidėjus degimo greičiui, padidėja šilumos kiekis, patenkantis į sistemą per laiko vienetą, ir dėl to pakyla degimo temperatūra.
2.4.2.5. Degimo temperatūra.
Degimo metu ne visa išsiskirianti šiluma išleidžiama reakcijos mišinio temperatūrai didinti, nes dalis jos nuostolių pavidalu išleidžiama:
– cheminis ir fizinis perdegimas, atsižvelgiant į perdegimo koeficientą ( β );
– liepsnos elektromagnetinis spinduliavimas, priklausomai nuo spinduliuojančio kūno temperatūros, jo agregacijos būsenos ir cheminės prigimties. Šią priklausomybę lemia spinduliuojančio kūno spinduliavimo koeficientas ( ε ) ir elektromagnetinės spinduliuotės bangos ilgį;
– laidumo-konvekciniai nuostoliai.
Remiantis tuo, yra 3 pagrindiniai degimo procesų temperatūrų tipai:
– kalorimetrinis;
– teorinis (skaičiuojamas);
– faktinis.
Kalorimetrinė temperatūra pasiekiama, kai visa degimo proceso metu išsiskirianti šiluma panaudojama degimo produktams šildyti, pavyzdžiui, degant benzenui - 2533 KAM, benzinas – 2315 KAM, vandenilis – 2503 KAM, gamtinių dujų – 2293 KAM.
Teorinė (skaičiuojama) temperatūra nustatoma atsižvelgiant į šilumos nuostolius dėl degimo produktų disociacijos. Didelė angliavandenilių degių medžiagų degimo produktų disociacija prasideda esant > 2000 KAM. Tokios aukštos temperatūros gaisrų metu pramoninėmis sąlygomis praktiškai nebūna, todėl į šilumos nuostolius dėl disociacijos šiais atvejais paprastai neatsižvelgiama.
Faktinė degimo temperatūra nustatoma atsižvelgiant į šilumos nuostolius į aplinką ir beveik visoms degioms medžiagoms ji yra ~ 1300 – 1700 KAM.
Sąvokos aiškinimo skirtumai degimo sukeltas autorių mokslinių interesų krypties. Mūsų nuomone, labiausiai atitinka praktiniai Valstybinės priešgaisrinės tarnybos darbuotojų interesai sekantį apibrėžimą degimas:
Degimas yra savaime išsilaikantis sudėtingas fizinis ir cheminis procesas, kurio pagrindas yra greitai vykstančios cheminės oksidacijos reakcijos, lydimos didelio šilumos ir šviesos kiekio išsiskyrimo.
Degimo metu dominuojantis procesas yra cheminė oksidacijos reakcija, kurios metu vyksta įvairūs fizikiniai procesai: šilumos perdavimas, reagentų perdavimas, spinduliuotė ir kt. Šie fizikiniai procesai vystosi pagal savo dėsnius. Cheminės oksidacijos procesai turi didelį potencialą, atsižvelgiant į jų atsiradimo greitį, tačiau tikras greitis degimas tikruose gaisruose yra mažesnis, nes riboja fizinių procesų greitis.
Cheminės reakcijos degimo metu yra daugiapakopės, ...
ir, svarbiausia, grandinė. Nesuprantant vykstančių procesų mechanizmo, neįmanoma suprasti liepsnos plitimo priežasčių, jos greičio skirtumo, degimo temperatūros reikšmės ir kt.
Cheminių reakcijų mechanizmas degimo metu
Temoje „Cheminė kinetika“ pažymėjome, kad cheminės reakcijos vyksta tiesiogiai kontaktuojant reaguojantiems komponentams (molekulėms, atomams, radikalams), tačiau tik tais atvejais, kai jų energija viršija tam tikrą energijos ribą, vadinamą aktyvacijos energija E a. Grafiškai pavaizduokime reaguojančių komponentų (kuro ir oksidatoriaus) ir reakcijos produktų energijos kitimą degimo metu (1.1 pav.)
X ašis rodo degimo reakcijos kelią, o y ašis – energiją. – reaguojančių komponentų vidutinė pradinė energija, – vidutinė degimo produktų energija.
 |
1.1 pav. Reagentų ir reakcijos produktų energijos pokytis degimo metu
Į degimo reakciją pateks tik aktyvios kuro ir oksidatoriaus dalelės, kurios turės energijos, reikalingos sąveikai, t.y. galintis įveikti energetinį barjerą. Aktyvių dalelių energijos perteklius, palyginti su vidutine energija, vadinamas aktyvacijos energija. Kadangi degimo metu vykstančios reakcijos yra egzoterminės ![]() . Energijos skirtumas tarp susidarančių degimo produktų ir pradinių medžiagų (kuro ir oksidatoriaus) lemia šiluminį reakcijos efektą:
. Energijos skirtumas tarp susidarančių degimo produktų ir pradinių medžiagų (kuro ir oksidatoriaus) lemia šiluminį reakcijos efektą:
 |
Aktyvių molekulių dalis didėja didėjant degiojo mišinio temperatūrai.
1.2 pav. rodo energijų pasiskirstymą tarp molekulių esant temperatūrai. Jei, veikiant šilumos šaltiniui, mišinio temperatūra pakyla iki vertės, tada padidės ir aktyvių molekulių dalis, taigi, padidės degimo reakcijos greitis.
Tačiau yra cheminių reakcijų, kurioms atsirasti nereikia didelio pakaitinimo. Tai yra grandininės reakcijos.
Grandininių reakcijų teorijos pagrindas yra prielaida, kad pradinės medžiagos į galutinį produktą virsta ne iš karto, o susidarant aktyviems tarpiniams produktams.
Pirminės cheminės reakcijos produktas turi didelį energijos atsargą, kuri gali išsisklaidyti supančioje erdvėje susidūrus reakcijos produktų molekulėms arba veikiant spinduliuotei arba gali būti perkelta į reaguojančių komponentų molekules, jas perkeliant. į aktyvią būseną. Šios aktyvios reaguojančių medžiagų molekulės (atomai, radikalai) sukuria reakcijų grandinę, kai energija perduodama iš vienos molekulės į kitą. Todėl tokios reakcijos vadinamos grandininėmis.
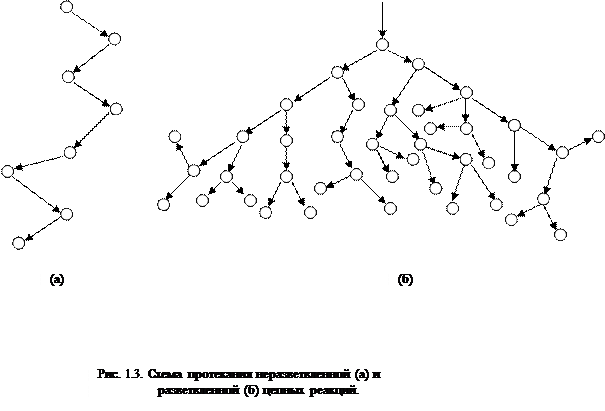
Chemiškai aktyvios molekulės, atomai, radikalai, susidarę elementariose grandininės reakcijos stadijose – grandininėmis grandimis – vadinami aktyviais centrais. Dauguma aktyvių centrų yra atomai ir radikalai, kurie yra aktyviausi. Tačiau dėl to jie taip pat yra nestabilūs, nes gali pradėti rekombinacijos reakcijas, susidarant mažai aktyviems produktams.
Vieno pradinio aktyvaus centro suformuotos grandinės ilgis gali siekti kelis šimtus tūkstančių vienetų. Kinetiniai grandininių reakcijų modeliai labai priklauso nuo to, kiek aktyvių centrų susidaro vienoje grandinės grandyje. Jeigu, dalyvaujant pirminiam aktyviajam centrui, susidaro tik vienas aktyvusis centras, tai tokia grandininė reakcija vadinama nešakota, bet jeigu vienoje grandinės grandyje susidaro du ar daugiau aktyvių centrų, tai tokia grandininė reakcija vadinama šakotas. Šakotųjų grandininių reakcijų greitis didėja kaip lavina, dėl kurios degimo metu savaime įsibėgėja cheminės oksidacijos reakcijos, nes daugumai jų būdingas šakotųjų grandininių reakcijų mechanizmas.
Beveik bet kuri degimo reakcija vienu metu gali turėti ir šiluminės, ir grandininės reakcijos mechanizmo požymių. Pirmųjų aktyvių centrų branduolių susidarymas gali būti terminio pobūdžio, o aktyvių dalelių reakcija grandininiu mechanizmu sukelia šilumos išsiskyrimą, degiojo mišinio kaitinimą ir naujų aktyvių centrų terminį branduolį.
Bet kokia grandininė reakcija susideda iš elementarių pradžios, tęsimo ir grandinės nutraukimo etapų.
Grandinės inicijavimas yra endoterminė reakcija. Laisvųjų radikalų susidarymas (t. y. atomai arba atomų grupės, turinčios laisvųjų valentų, pvz. ![]() ) iš pradinių medžiagų molekulių, galbūt dėl monomolekulinės ar bimolekulinės sąveikos, taip pat dėl bet kokios pašalinės įtakos degiam mišiniui, inicijavimas.
) iš pradinių medžiagų molekulių, galbūt dėl monomolekulinės ar bimolekulinės sąveikos, taip pat dėl bet kokios pašalinės įtakos degiam mišiniui, inicijavimas.
Iniciacija gali būti atliekama pridedant specialių medžiagų - iniciatoriai, lengvai formuojantys laisvuosius radikalus (pavyzdžiui, peroksidus, reaktyviąsias dujas), veikiant jonizuojančiai spinduliuotei, veikiant šviesai – fotocheminė iniciacija. Pavyzdžiui, vandenilio sąveika su chloru
![]()
normaliomis sąlygomis jis vyksta labai lėtai ir esant stipriam apšvietimui ( saulės šviesa, deginant magnį) vyksta sprogimu.
Į reakcijas grandinės tęsinys Tai yra pagrindiniai grandininės reakcijos etapai, kurie tęsiasi išsaugant laisvą valentingumą ir sukelia pradinių medžiagų suvartojimą bei reakcijos produktų susidarymą.
grandinės inicijavimas:
![]()
grandinės šaka:
![]()
![]()
atvira grandinė:
vienalytis
![]()
nevienalytis
Vystantis grandinei, kai aktyviųjų centrų koncentracija tampa pakankamai didelė, galima suformuoti grandį, kurioje aktyvusis centras sureaguos negeneruodamas naujo aktyvaus centro. Šis reiškinys vadinamas atvira grandine.
Atvira grandinė gali būti vienalytis ir nevienalytis.
Homogeniškas grandinės nutraukimas galimas arba radikalams ar atomams sąveikaujant tarpusavyje, kad susidarytų stabilūs produktai, arba aktyviojo centro reakcijos metu su pagrindiniam procesui svetima molekule, nesukuriant naujų aktyvių centrų.
Heterogeninis grandinės nutraukimas įvyksta ant indo sienelių, kur vyksta degimo reakcija, arba ant dujinėje fazėje esančių kietųjų mikrodalelių paviršiaus, kartais specialiai įterptų (pavyzdžiui, gesinant milteliais). Heterogeninės grandinės nutraukimo mechanizmas yra susijęs su aktyvių centrų adsorbcija kietųjų dalelių ar medžiagų paviršiuje. Heterogeninės grandinės nutraukimo greitis labai priklauso nuo sienelių paviršiaus ploto ir indo, kuriame vyksta degimas, tūrio santykio. Taigi, sumažinus indo skersmenį, degimo reakcijos greitis žymiai sumažėja iki visiško jos nutraukimo. Tuo remiasi ugniagesių kūrimas.
Šakotosios grandininės reakcijos pavyzdys yra vandenilio degimas deguonyje.
grandinės inicijavimas:
![]()
grandinės šaka:
![]()
![]()
atvira grandinė:
vienalytis
![]()
nevienalytis
Angliavandenilių deginimas
Vandenilio ir anglies monoksido degimo procesų svarstymas parodo degimo reakcijos mechanizmo sudėtingumą. H 2 ir CO atveju reakcija vyksta kaip grandininė reakcija, kurioje dalyvauja daug elementarių etapų ir tarpinių produktų. Todėl natūralu tikėtis, kad sudėtingesnės struktūros medžiagų – angliavandenilių – degimo reakcijų mechanizmas dar sudėtingesnis, o šių junginių užsidegimo ir degimo procesus lydintis poveikis įvairesnis.
Šiuo metu turima informacija apie angliavandenilių cheminių virsmų pobūdį jų degimo metu leidžia paaiškinti pastebėtus efektus tam tikru apytiksliu būdu.
Nustatyta, kad angliavandenilių liepsnose kartu su jau žinomomis aktyviosiomis dalelėmis H×, OH×, O× yra daug sudėtingesnės struktūros tarpinių produktų. Kai kuriais atvejais jie tampa naujų grandinių kilmės šaltiniais. Pagrindinį vaidmenį angliavandenilių užsidegimo ir degimo procesuose atlieka šių tipų tarpiniai junginiai:
1. Angliavandenilių radikalai, kurie yra angliavandenilio molekulė, iš kurios pašalintas vienas ar daugiau vandenilio atomų. Šios liekanos vadinamos alkilais (CH3 – metilas; C 2 H 5 – etilas; C 3 H 7 – propilas ir kt.). Dėl didelio reaktyvumo alkilai laisvos formos ilgą laiką neegzistuoja. Atsiranda liepsnoje kaip tarpiniai produktai. Sąveikaujant su kitomis molekulėmis, jos elgiasi kaip nepriklausoma struktūrinė grupė. Angliavandenilių radikalai
paprastai žymimas raide R.
2. Peroksidai yra R-OO-R bendrosios formulės junginiai.
3. Aldehidų tipo junginiai
Paprasčiausi aldehidai yra skruzdžių (formaldehidas) HCOOH ir acto (acetaldehidas) CH 3 COH. Šių medžiagų visada yra nevisiško angliavandenilių degimo produktuose.
Bet kokia reakcija, kurios metu susidaro angliavandenilių radikalai, angliavandenilių degimo metu gali inicijuoti grandinę. Tai gali būti etano molekulės skilimo reakcija, susidarant dviem laisvoms metilo grupėms:
C 2 H 6 ® × CH 3
arba angliavandenilio reakcija su deguonimi:
RH + O 2 ® ×HO 2 + ×R
Grandinių tęsimas atsiranda dėl formavimosi reakcijų | peroksidai arba hidroperoksidai:
R + O 2 ® ROO×
ROO× + RH ® ROOH + R×
Hidroperoksido skilimo metu vyksta grandinės išsišakojimas:
ROOH ® ×RO + ×OH
Pateikta reakcijų seka lemia laipsnišką peroksido junginių koncentracijos didėjimą reaguojančioje sistemoje.
Kartu su peroksidų, radikalų, ×OH ir ×H kaupimu pradeda vykti lygiagrečios reakcijos:
ROOH + ×OH ® RОО× + Н 2 О
Šios reakcijos yra egzoterminės; Kai jie atsiranda, išsiskiria didelis šilumos kiekis.
Didėjant reaguojančio mišinio temperatūrai, aktyvių centrų vaidmuo iš vieno tarpinio produkto į kitą pereina tokia tvarka: alkilo hidroperoksidai, acilo hidroperoksidai, aldehidai.
Eksperimentiniai reaguojančio mišinio sudėties pokyčių laikui bėgant aukštos temperatūros regione (600-800°C) tyrimai rodo, kad pradinių angliavandenilių pavertimo galutiniais CO 2 ir H 2 O degimo produktais procesas yra padalintas į dvi dalis. etapai: pirmajame, kuris vyksta labai dideliu greičiu, angliavandenilių oksidacija į CO. Antroje, lėtoje stadijoje, CO oksiduojamas iki CO 2
Įvairių veiksnių įtaka cheminių reakcijų greičiui degimo metu
Degimo reakcijos greičio priklausomybę nuo reagentų koncentracijos galima pavaizduoti išraiška
![]() (1)
(1)
kur: k 0 – reakcijos greičio konstanta,
Iš kalnų – degių medžiagų koncentracija, kmol/m 3,
C ok – oksidatoriaus koncentracija, kmol/m3,
x,y – atitinkamai kuro ir oksidatoriaus reakcijos eilės.
Kaip minėta aukščiau, bendra reakcijos lygtis (1) neatspindi tikrojo degimo reakcijos mechanizmo, kuris yra daugiapakopis ir dažnai grandininis, todėl (2) lygties reakcijos eilės ne visada sutampa su reikšmėmis. stechiometrinių koeficientų (1) lygtyje.
Iš to išplaukia, kad kuo didesnė degios medžiagos koncentracija, tuo didesnis degimo greitis.
Degimo reakcijos greitis priklauso nuo temperatūros:
e – natūraliojo logaritmo pagrindas
E a – aktyvacijos energija, kJ/kmol,
R – universali dujų konstanta, R=8,314 kJ/(K.kmol)
T – temperatūra, K.
Ši lygtis yra Arrhenijaus dėsnio dėl cheminių reakcijų greičio priklausomybės nuo temperatūros išraiška. Supaprastinta forma siauram temperatūros diapazonui galite naudoti van't Hoff taisyklę: cheminės reakcijos greitis padidėja 2–4 kartus, kai temperatūra didėja kas 10 0.
Taigi, degios medžiagos oksidacijos cheminės reakcijos greitis degimo metu smarkiai didėja didėjant temperatūrai, o kuo didesnis greitis, tuo mažesnė aktyvacijos energija.
Oksidacijos reakcijų greitis degimo metu taip pat priklauso nuo slėgio.
Padidėjus slėgiui, padidėja degiųjų dujinių medžiagų ir oksidatoriaus tūrinė koncentracija. Praktiškai tai lemia tai, kad didėjant slėgiui daugumos medžiagų degimo reakcijų greitis didėja.
At aukšto slėgio pasirodo karštos liepsnos.
Kaip minėta pirmiau, cheminės oksidacijos reakcijos yra labai egzoterminės, todėl degimą lydi didelis šilumos kiekis, todėl jis vyksta aukštoje temperatūroje. Pavyzdžiui, medienos degimo temperatūra yra 700-800 0 C, naftos produktų - dar aukštesnė - 1300-1500 0 C.
At žemas slėgis Gali kilti vadinamosios šaltos liepsnos. Cheminės grandininės degimo reakcijos savaiminis pagreitis vyksta izoterminiu režimu. Tai įvyksta esant tam tikrai degiojo mišinio sudėčiai ir tam tikra būsena aplinką. Izoterminis savaiminis pagreitis būdingas mišiniams, kuriuose yra pakankamai didelė aktyvių, bet gana stabilių tarpinių produktų koncentracija, todėl sumažėja grandinės išsišakojimas ir atitinkamai sumažėja šilumos išsiskyrimas, kuris dėl šilumos pašalinimo išsisklaido į aplinką ir iš dalies sunaudojama stabiliems tarpiniams produktams šildyti. Atsiranda švytėjimas, kuris yra chemiliuminescencija, o ne įkaitusių degimo produktų šiluminė spinduliuotė, kuri atsiranda karštoje liepsnoje.
Be to, šaltų liepsnų atsiradimas didelę įtaką kurį veikia indo, kuriame vyksta degimas, sienelės. Jie kataliziškai veikia aktyvių centrų naikinimo procesą, t.y. įvyksta nevienalytis grandinės nutraukimas. Šio proceso intensyvumą lemia aktyvių centrų difuzijos į kraujagyslės sieneles greitis. Slėgio sumažėjimas skatina šį procesą. Sumažėjus slėgiui, gali ne tik susidaryti šalta liepsna, o ne karšta, bet tam tikromis sąlygomis (pavyzdžiui, siauruose induose) netgi visiškai nutrūksta degimas.
Kaip minėta aukščiau, dėl cheminių virsmų degimo proceso metu atsiranda įvairių fizikinių procesų: šilumos perdavimas dėl konvekcijos, šilumos laidumas ir spinduliuotė, reaguojančių medžiagų pernešimas ir kt.
Taigi, degimo Galima apibūdinti kaip sudėtingą savaime išsilaikantį fizikinį ir cheminį procesą, kuriam būdingos trys charakteristikos: cheminė transformacija, šilumos išsiskyrimas ir spinduliavimas (įskaitant dažniausiai šviesą, t. y. matomoje spektro dalyje). Nė vieno iš šių požymių nebuvimas rodo, kad nagrinėjamas procesas nėra susijęs su degimu, pavyzdžiui, elektros lemputės „degimas“ (nėra cheminės transformacijos), metalų korozija (neskleidžiama šviesa ir šilumos išskyrimas praktiškai nereikšmingas) ir kt.
Pasidalink su draugais:






