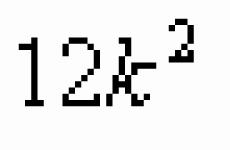Spojevi silicija su neophodni. Silicij i njegovi spojevi - hipermarket znanja. Raspodjela silicija u prirodi
Silicij je čvrsti nemetal koji je dio stijena. U normalnim uvjetima inertan je, ali pri zagrijavanju pokazuje oksidacijska i redukcijska svojstva. Kemijska svojstva silicija industrija silikata koristi za proizvodnju stakla, ogledala, elektronike i građevinskog materijala.
Opći opis elementa
Silicij se nalazi u četvrtoj skupini i trećem razdoblju periodnog sustava. Jezgra atoma silicija ima pozitivan naboj +14. 14 negativno nabijenih elektrona kreće se oko jezgre.
Atom može prijeći u uzbuđeno stanje zbog slobodnog d-podnivoa. Stoga element pokazuje dva pozitivna oksidacijska stanja (+2 i +4) i jedno negativno (-4). Elektronička konfiguracija - 1s 2 2s 2 2p 6 3s 2 3p 2.

Riža. 1. Struktura atoma silicija.
Silicij je krhki poluvodič s visokim temperaturama ključanja i ploče. Relativno lagan nemetal: gustoća je 2,33 g / cm 3.
Silicij se ne nalazi u čistom obliku. Dio je pijeska, kvarca, ahata, ametista i drugih stijena.

Riža. 2. Ahat.
Reakcije s nemetalima
U interakciji s nemetalima silicij ima reducirajuća svojstva - odriče se elektrona. Reakcije su moguće samo uz jako zagrijavanje. U normalnim uvjetima silicij reagira samo s fluorom. Reakcije s osnovnim nemetalima prikazane su u tablici.
Silicij hidrid - silan (SiH 4) - može se dobiti razgradnjom silicija s kiselinom. Na primjer, Mg 2 Si + 2H 2 SO 4 → SiH 4 - + 2MgSO 4.
Interakcija s metalima
Silicij pokazuje oksidacijska svojstva samo u reakcijama s metalima. Tijekom fuzije nastaju soli - siliciji:
- Si + 2Mg → Mg 2 Si;
- Si + 2Ca → Ca 2 Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi 2.
Silicidi se industrijski koriste za proizvodnju legura i materijala. Vanadij -silicij (V 3 Si) koristi se kao supravodič, a renijev silicij (ReSi) kao poluvodič.
Reakcije sa složenim tvarima
Osim s jednostavnim tvarima, silicij reagira sa složenim spojevima - kiselinama i lužinama. Glavne reakcije opisane su u tablici.
Na 1200 ° C silicij reagira s dioksidom tvoreći monoksid: Si + SiO 2 → SiO.

Riža. 3. Korištenje silicija.
Što smo naučili?
Silicij je krhki nemetal koji stupa u interakciju s metalima, nemetalima i složenim tvarima. U reakcijama s metalima pokazuje svojstva oksidanta, s nemetalima - redukcijskog sredstva. U normalnim uvjetima reagira samo s fluorom, fluorovodičnom kiselinom (uključujući zajedno s dušičnom kiselinom), s lužinama. Ostatak reakcija odvija se na povišenim temperaturama.
Test po temi
Ocjena izvješća
Prosječna ocjena: 4.6. Ukupan broj primljenih ocjena: 204.
Silicij je kemijski element skupine IV Periodnog sustava elemenata D.I. Mendeljejev. Otvorili 1811. J. Gay-Lusac i L. Ternard. Njegov serijski broj je 14, atomska masa 28,08, atomska zapremina 12,04 10 -6 m 3 / mol. Silicij je metaloid, pripada ugljikovoj podskupini. Njegova valencija kisika je +2 i +4. Što se tiče rasprostranjenosti u prirodi, silicij je odmah iza kisika. Njegov maseni udio u zemljinoj kori iznosi 27,6%. Zemljina kora, prema V.I. Vernadsky, više od 97% sastoji se od silicija i silikata. Spojevi kisika i organskog silicija također se nalaze u biljkama i životinjama.
Umjetno proizveden silicij može biti amorfni ili kristalni. Amorfni silicij je smeđi, fino raspršen, visoko higroskopni prah; prema podacima difrakcije X zraka, sastoji se od najmanjih kristala silicija. Može se dobiti redukcijom na visokim temperaturama SiCl 4 s parom cinka.
Kristalni silicij ima čelično sivu boju i metalni sjaj. Gustoća kristalnog silicija pri 20 ° C je 2,33 g / cm 3, tekućeg silicija pri 1723 - 2,51 i pri 1903 K - 2,445 g / cm 3. Talište silicija je 1690 K, vrelište je 3513 K. Prema podacima, tlak pare silicija pri T = 2500 ÷ 4000 K opisan je jednadžbom log p Si = -20130 / T + 7.736, kPa . Toplina sublimacije silicija 452610, taljenje 49790, isparavanje 385020 J / mol.
Polikristali silicija karakteriziraju visoka tvrdoća (pri 20 ° C HRC = 106). Međutim, silicij je vrlo krhak, stoga ima visoku tlačnu čvrstoću (σ SJ B ≈ 690 MPa) i vrlo nisku vlačnu čvrstoću (σ B ≈ 16,7 MPa).
Na sobnoj temperaturi silicij je inertan, reagira samo s fluorom, tvoreći hlapljivi 81P4. Od kiselina reagira samo s dušičnom kiselinom pomiješanom sa fluorovodičnom kiselinom. Međutim, silicij prilično lako reagira s lužinama. Jedna od njegovih reakcija s lužinama
Si + NaOH + H20 = Na2SiO3 + 2H2
koristi za proizvodnju vodika. Uz to, silicij je sposoban proizvesti veliki broj kemijski jakih spojeva s nemetalima. Od ovih spojeva potrebno je navesti halogenide (od SiX 4 do Si n X 2n + 2, gdje je X halogen, i n ≤ 25), njihove mješovite spojeve SiCl 3 B, SiFCl 3 itd., Oksihloride Si 2 OCl 3, Si3O2Cl3 i dr., nitridi Si 3 N 4, Si 2 N 3, SiN i hidridi opće formule Si n H 2n + 2, a od spojeva koji se nalaze u proizvodnji ferolegura - hlapljivi sulfidi SiS i SiS 2 i vatrostalni karbid SiC .
Silicij je također sposoban proizvoditi spojeve s metalima - silicide, od kojih su najvažniji silicidi željeza, kroma, mangana, molibdena, cirkonija, kao i rijetki zemni metali i alkalni metali. Ovo svojstvo silicija - sposobnost davanja kemijski vrlo jakih spojeva i otopina s metalima - naširoko se koristi u tehnologiji za proizvodnju niskougljičnih ferolegura, kao i za reduciranje alkalijske zemlje niskog ključanja (Ca, Mg, Ba) i metale koji se teško oporabljuju (Zr, Al itd.).
Legure silicija i željeza proučavao je P.V. Geldu i njegovoj školi, posebna pozornost posvećena je dijelu sustava Fe-Si koji se odnosi na legure s visokim sadržajem. To je zbog činjenice da se, kao što se može vidjeti iz dijagrama Fe-Si (slika 1), u legurama ovog sastava događaju brojne transformacije koje značajno utječu na kvalitetu ferosilicija raznih marki. Tako je disilicid FeSi 2 stabilan samo pri niskim temperaturama (< 918 или 968 °С, см. рисунок 1). При высоких температурах устойчива его высокотемпературная модификация - лебоит. Содержание кремния в этой фазе колеблется в пределах 53-56 %. В дальнейшем лебоит будем обозначать химической формулой Fe 2 Si 5 , что практически соответствует максимальной концентрации кремния в лебоите.
Kod hlađenja legura sa sadržajem Si> 55,5%, leboit pri T< 1213 К разлагается по эвтектоидной реакции
Fe 2 Si 5 → FeSi 2 + Si (2)
i legure 33,86-50,07% Si pri T< 1255 К - по перитектоидной реакции
Fe 2 Si 5 + FeSi = ZFeSi 2 (3)
Legure srednjeg sastava (50,15-55,5% Si) prvo prolaze peritektoid (3) pri 1255 K, a zatim, pri 1213 K, eutektoidne (2) transformacije. Ove transformacije Fe 2 Si 5 reakcijama (2) i (3) popraćene su promjenama u volumenu silicija. Takva je promjena osobito velika tijekom reakcije (2) - oko 14%; stoga legure koje sadrže leboit gube kontinuitet, pucaju, pa se čak i raspadaju. S usporenom, ravnotežnom kristalizacijom (vidi sliku 1), leboit se može istaložiti tijekom kristalizacije i legura FS75 i FS45.
Međutim, pucanje povezano s eutektoidnim raspadanjem leboita samo je jedan od uzroka raspadanja. Drugi razlog, koji je očito glavni, je taj što stvaranje pukotina duž granica zrna stvara priliku za tekućine koje se oslobađaju duž ovih granica - fosfor, arsen, aluminij sulfidi i karbidi itd. - da reagiraju s vlagom zraka reakcijama, kao uslijed čega se u atmosferi oslobađa H 2, PH 3, PH 4, AsH 4 itd., a u pukotinama - labavi oksidi Al 2 O 3, SiO 2 i drugi spojevi koji ih pucaju. Širenje legura može se spriječiti mijenjanjem magnezijem, legiranjem dodacima elemenata koji oplemenjuju zrno (V, Ti, Zg itd.) Ili ga čine plastičnijim. Prečišćavanje zrna smanjuje koncentraciju nečistoća i njihovih spojeva na njezinim granicama i utječe na svojstva legura na isti način kao i općenito smanjenje koncentracije nečistoća (P, Al, Ca) u leguri, koje potiču raspadanje. Termodinamička svojstva legura Fe-Si (toplina miješanja, aktivnost, topljivost u ugljiku) detaljno su proučena, mogu se pronaći u radovima. Podaci o topljivosti ugljika u legurama Fe -Si prikazani su na slici 2, o aktivnosti silicija - u tablici 1.


Fizikalno -kemijska svojstva spojeva silicija kisika proučavao je P.V. Geld sa osobljem. Unatoč važnosti Si-O sustava, njegov dijagram još nije izgrađen. Trenutno su poznata dva spoja kisika silicija - silicijev dioksid SiO 2 i monoksid SiO. U literaturi postoje i indicije o postojanju drugih kisikovih spojeva silicija - Si 2 O 3 i Si 3 O 4, ali nema podataka o njihovim kemijskim i fizičkim svojstvima.
U prirodi silicij predstavlja samo silicijev dioksid SiO 2. Ovaj spoj silicija je drugačiji:
1) visoka tvrdoća (na Mohsovoj ljestvici 7) i vatrostalna (T pl = 1996 K);
2) visoko vrelište (T KIP = 3532 K). Tlak pare silicijevog dioksida može se opisati jednadžbama (Pa):
3) formiranje velikog broja izmjena:
 Značajka alotropnih transformacija SiO 2 je da su popraćene značajnim promjenama u gustoći i volumenu tvari, što može uzrokovati pucanje i drobljenje stijene;
Značajka alotropnih transformacija SiO 2 je da su popraćene značajnim promjenama u gustoći i volumenu tvari, što može uzrokovati pucanje i drobljenje stijene;
4) visoka sklonost hipotermiji. Stoga je moguće, kao rezultat brzog hlađenja, popraviti strukturu i tekućeg talina (stakla) i visokotemperaturnih modifikacija β-kristobalita i tridimita. Naprotiv, brzim zagrijavanjem kvarc se može otopiti zaobilazeći strukture tridimita i kristobalita. Talište SiO 2 u ovom slučaju se smanjuje za oko 100 ° C;
5) veliki električni otpor. Na primjer, pri 293 K to je 1 10 12 Ohm * m. Međutim, kako temperatura raste, električni otpor SiO 2 opada, a u tekućem stanju silicijev dioksid je dobar vodič;
6) visoka viskoznost. Dakle, pri 2073 K viskoznost je 1 10 4 Pa s, a pri 2273 K - 280 Pa s.
Potonji, prema N.V. Solomin, objašnjava se činjenicom da je SiO 2, poput organskih polimera, sposoban formirati lance, koji se pri 2073 K sastoje od 700, a pri 2273 K - od 590 molekula Si02;
7) visoka toplinska stabilnost. Gibbsova energija stvaranja SiO 2 od elemenata, uzimajući u obzir njihovo agregatno stanje, u skladu s podacima, s velikom točnošću opisuje se jednadžbama: 
Ti se podaci, kao što se može vidjeti iz tablice 2, neznatno razlikuju od podataka autora. Dvočlane jednadžbe također se mogu koristiti za termodinamičke proračune:

Silicij monoksid SiO otkrio je Potter 1895. godine u plinskoj fazi električnih peći. Sada je pouzdano utvrđeno da SiO postoji i u kondenziranim fazama. Prema istraživanju P.V. Gelda, oksid ima nisku gustoću (2,15 g / cm 3), veliki električni otpor (10 5 -10 6 Ohm * m). Kondenzirani oksid je lomljiv, njegova tvrdoća prema Mohsovoj ljestvici je ~ 5. Talište se, zbog velike hlapljivosti, nije moglo eksperimentalno odrediti. Prema O. Kubashevskom, jednako je 1875 K, prema Berezhnyju, - 1883 K. Toplina topljenja SiO je nekoliko puta veća od ΔH 0 SiO2, prema podacima jednaka je 50242 J / mol. Očigledno je zbog nestabilnosti precijenjeno. Ima staklasti prijelom, boja mu se mijenja iz bijele u čokoladnu, što je vjerojatno posljedica oksidacije atmosferskim kisikom. Svježi prijelom SiO obično ima boju graška s masnim sjajem. Oksid je termodinamički stabilan samo pri visokim temperaturama u obliku SiO (G). Kada se ohladi, oksid disproporcionira prema reakciji
2SiO (G) = SiO (L) + SiO2 (6)

Vrelište SiO može se ugrubo procijeniti iz jednadžbe:
Plin silicijevog oksida je termodinamički vrlo stabilan. Gibbsova energija njezina stvaranja može se opisati jednadžbama (vidi tablicu 2):

iz čega se može vidjeti da kemijska čvrstoća SiO, poput CO, raste s porastom temperature, što ga čini izvrsnim redukcijskim sredstvom za mnoge tvari.
Dvočlane jednadžbe također se mogu koristiti za termodinamičku analizu:
 Sastav plinova nad SiO 2 procijenio je I.S. Kulikov. Ovisno o temperaturi, sadržaj SiO2 iznad SiO2 opisan je jednadžbama:
Sastav plinova nad SiO 2 procijenio je I.S. Kulikov. Ovisno o temperaturi, sadržaj SiO2 iznad SiO2 opisan je jednadžbama:
Silicijev karbid, poput SiO, jedan je od međuprodukata nastalih tijekom redukcije SiO2. Karbid ima visoku talište.
Ovisno o tlaku, otporan je do 3033-3103 K (slika 3). Na visokim temperaturama, silicijev karbid sublimira. Međutim, tlak pare Si (G), Si 2 C (G), SiC 2 (G) nad karbidom pri T< 2800К невелико, что следует из уравнения
Karbid postoji u dvije modifikacije-kubični niskotemperaturni β-SiC i heksagonalni visokotemperaturni α-SiC. U pećima od ferolegura obično se nalazi samo β-SiC. Izračuni pomoću podataka pokazali su da je Gibbsova energija stvaranja opisana jednadžbama:

koji se izrazito razlikuju od podataka. Iz ovih jednadžbi proizlazi da je karbid termički stabilan do 3194 K. Prema svojim fizikalnim svojstvima, karbid se odlikuje velikom tvrdoćom (~ 10), visokim električnim otporom (pri 1273K p≈ 0,13 ⋅ 10 4 μOhm ⋅ m), povećanom gustoće (3,22 g / cm 3) i velike otpornosti u reducirajućoj i oksidirajućoj atmosferi.
Po izgledu, čisti karbid je bezbojan i ima poluvodička svojstva koja se zadržavaju čak i pri visokim temperaturama. Tehnički silicijev karbid sadrži nečistoće i stoga je obojen u zelenu ili crnu boju. Dakle, zeleni karbid sadrži 0,5-1,3% nečistoća (0,1-0,3% C, 0,2-1,2% Si + SiO 2, 0,05-0,20% Fe 2 O 3, 0,01-0,08% Al 2 O 3 itd.). U crnom karbidu sadržaj nečistoća je veći (1-2%).
Ugljik se koristi kao redukcijsko sredstvo u proizvodnji silicijevih legura. To je ujedno i glavna tvar od koje se izrađuju elektrode i obloge električnih peći, topi silicij i njegove legure. Ugljik je u prirodi dosta uobičajen, njegov sadržaj u zemljinoj kori iznosi 0,14%. U prirodi se javlja i u slobodnom stanju i u obliku organskih i anorganskih spojeva (uglavnom karbonata).
Ugljik (grafit) ima šesterokutnu kubičnu rešetku. Gustoća rentgenskog zračenja grafita je 2.666 g / cm 3, piknometrijska gustoća je 2.253 g / cm 3. Odlikuje ga visoko taljenje (~ 4000 ° C) i vrelište (~ 4200 ° C), električni otpor koji raste s porastom temperature (pri 873 K p≈9,6 μΩ⋅m, pri 2273 K p≈ 15,0 μΩ⋅m) je dosta izdržljiv. Njegov privremeni otpor na brkovima može biti 480-500 MPa. Međutim, grafit elektrode ima σ b = 3,4 ÷ 17,2 MPa. Tvrdoća grafita na Mohsovoj ljestvici je ~ 1.
Ugljik je izvrsno redukcijsko sredstvo. To je zbog činjenice da snaga jednog od njegovih spojeva kisika (CO) raste s porastom temperature. To se može vidjeti iz Gibbsove energije njezina stvaranja, koja je, kako pokazuju naši izračuni pomoću podataka, dobro opisana kao tročlana
i dvočlane jednadžbe:

Ugljikov dioksid CO 2 je termodinamički jak samo do 1300 K. Gibbsova energija stvaranja CO 2 opisana je jednadžbama:

Kao neovisni kemijski element, silicij je postao poznat čovječanstvu tek 1825. godine. Što, naravno, nije spriječilo uporabu spojeva silicija u tolikom broju sfera da je lakše navesti one u kojima se element ne koristi. Ovaj će članak osvijetliti fizikalna, mehanička i korisna kemijska svojstva silicija i njegovih spojeva, primjene, a također ćemo govoriti o tome kako silicij utječe na svojstva čelika i drugih metala.
Prvo se usredotočimo na opće karakteristike silicija. Od 27,6 do 29,5% mase zemljine kore čini silicij. U morskoj vodi koncentracija elementa je također velika - do 3 mg / l.
Silicij zauzima drugo počasno mjesto u litosferi nakon kisika. Međutim, njegov najpoznatiji oblik, silicij dioksid, je dioksid, a njegova su svojstva postala temelj za tako široku upotrebu.
Ovaj video će vam reći što je silicij:
Koncept i značajke
Silicij je nemetal, ali pod različitim uvjetima može pokazati i kisela i bazična svojstva. Tipičan je poluvodič i iznimno se široko koristi u elektrotehnici. Njegova fizikalna i kemijska svojstva uvelike su određena alotropnim stanjem. Najčešće se bave kristalnim oblikom, budući da su njegove kvalitete više tražene u nacionalnoj ekonomiji.
- Silicij je jedan od osnovnih makronutrijenata u ljudskom tijelu. Njegov nedostatak ima štetan učinak na stanje koštanog tkiva, kose, kože, noktiju. Osim toga, silicij utječe na rad imunološkog sustava.
- U medicini, element, ili bolje rečeno, njegovi spojevi, našli su svoju prvu primjenu u tom svojstvu. Voda iz bunara obloženih silicijem razlikovala se ne samo po čistoći, već je i pozitivno utjecala na otpornost na zarazne bolesti. Danas spoj sa silicijem služi kao osnova za lijekove protiv tuberkuloze, ateroskleroze i artritisa.
- Općenito, nemetal je neaktivan, međutim, teško ga je pronaći u čistom obliku. To je zbog činjenice da se u zraku brzo pasivira slojem dioksida i prestaje reagirati. Kada se zagrije, kemijska aktivnost se povećava. Kao rezultat toga, čovječanstvo je mnogo poznatije sa spojevima tvari, a ne sa samim sobom.
Dakle, silicij tvori legure s gotovo svim metalima - silicidi. Svi se oni razlikuju po vatrostalnosti i tvrdoći te se koriste u odgovarajućim područjima: plinskim turbinama, grijačima peći.
Nemetal se nalazi u tablici D. I. Mendelejeva u skupini 6 zajedno s ugljikom, germanijem, što ukazuje na određeno zajedništvo s tim tvarima. Dakle, s ugljikom je "povezan" sposobnošću stvaranja spojeva tipa organskog. Istodobno, silicij, poput germanija, može pokazati svojstva metala u nekim kemijskim reakcijama, koji se koristi u sintezi.
Za i protiv
Kao i svaka druga tvar sa stajališta uporabe u nacionalnoj ekonomiji, silicij ima određene korisne ili ne baš dobre osobine. Oni su važni upravo za određivanje opsega uporabe.
- Značajna prednost tvari je njezina dostupnost... Istina je da u prirodi nije u slobodnom obliku, ali unatoč tome tehnologija proizvodnje silicija nije toliko komplicirana, iako troši energiju.
- Druga najvažnija prednost je stvaranje mnogih spojeva s neobično korisnim svojstvima. To su silani, silikoidi, dioksid i, naravno, razni silikati. Sposobnost silicija i njegovih spojeva da tvore složene krute otopine praktički je beskrajna, što omogućuje beskonačnu proizvodnju najrazličitijih varijacija stakla, kamena i keramike.
- Svojstva poluvodiča nemetal mu osigurava mjesto osnovnog materijala u elektrotehnici i radiotehnici.
- Nemetal je netoksičan, koji dopušta primjenu u bilo kojoj industriji, a istodobno ne pretvara tehnološki proces u potencijalno opasan.
Nedostaci materijala uključuju samo relativnu krhkost s dobrom tvrdoćom. Silicij se ne koristi za potporne konstrukcije, ali ova kombinacija omogućuje pravilnu obradu kristalne površine, što je važno za instrumente.
Razgovarajmo sada o osnovnim svojstvima silicija.
Svojstva i karakteristike
 Budući da se kristalni silicij najčešće koristi u industriji, njegova su svojstva važnija, a ona su navedena u tehničkim specifikacijama. Fizička svojstva tvari su sljedeća:
Budući da se kristalni silicij najčešće koristi u industriji, njegova su svojstva važnija, a ona su navedena u tehničkim specifikacijama. Fizička svojstva tvari su sljedeća:
- talište - 1417 C;
- vrelište - 2600 C;
- gustoća je 2,33 g / cc. cm, što ukazuje na krhkost;
- toplinski kapacitet, kao ni toplinska vodljivost, nisu konstantni čak ni u najčišćim uzorcima: 800 J / (kg K), ili 0,191 cal / (g stupnjeva) i 84-126 W / (m K), odnosno 0,20-0, 30 kal / (cm · sek · stupnja), respektivno;
- prozirno do dugovalno infracrveno zračenje, koje se koristi u infracrvenoj optici;
- dielektrična konstanta - 1,17;
- tvrdoća na Mohsovoj ljestvici - 7.
Električna svojstva nemetala uvelike ovise o nečistoćama. U industriji se ova značajka koristi moduliranjem željene vrste poluvodiča. Pri normalnim temperaturama silicij je lomljiv, ali pri zagrijavanju iznad 800 C moguća je plastična deformacija.
Svojstva amorfnog silicija izrazito su različita: izrazito je higroskopan i puno aktivnije reagira čak i pri normalnim temperaturama.
O strukturi i kemijskom sastavu, kao i o svojstvima silicija, govori se u videu ispod:
Sastav i struktura
Silicij postoji u dva alotropna oblika, koji su jednako stabilni na normalnim temperaturama.
- Kristal izgleda poput tamno sivog praha. Tvar, iako ima kristalnu rešetku nalik dijamantu, krhka je zbog pretjerano duge veze između atoma. Zanimljiva su njegova svojstva poluvodiča.
- Pri vrlo visokim pritiscima možete dobiti šesterokutni modifikacija s gustoćom od 2,55 g / cc. vidi. Međutim, ova faza još nije našla praktični značaj.
- Amorfna- smeđe-smeđi prah. Za razliku od kristalnog oblika, on reagira mnogo aktivnije. To nije posljedica toliko inertnosti prvog oblika koliko činjenice da je tvar u zraku prekrivena slojem dioksida.
Osim toga, potrebno je uzeti u obzir drugu vrstu klasifikacije povezane s veličinom kristala silicija, koji zajedno tvore tvar. Kristalna rešetka, kao što je poznato, pretpostavlja poredanje ne samo atoma, već i struktura koje ti atomi tvore-takozvani red velikog dometa. Što je veća, tvar će biti homogenija po svojstvima.
- Monokristalni- uzorak je jedan kristal. Njegova je struktura maksimalno uređena, svojstva su ujednačena i dobro predvidljiva. Upravo je ovaj materijal najtraženiji u elektrotehnici. Međutim, također spada u najskuplje vrste, budući da je proces dobivanja kompliciran, a stopa rasta niska.
- Višekristalni- uzorak je određena količina velikih kristalnih zrna. Granice između njih tvore dodatne razine nedostataka, što smanjuje performanse uzorka kao poluvodiča i dovodi do bržeg trošenja. Tehnologija uzgoja multikristala je jednostavnija, pa je samim tim i materijal jeftiniji.
- Polikristalni- sastoji se od velikog broja zrna smještenih nasumično jedno prema drugom. Ovo je najčišći tip industrijskog silicija koji se koristi u mikroelektronici i solarnoj energiji. Često se koristi kao sirovina za uzgoj više- i monokristala.
- Amorfni silicij također zauzima zasebnu poziciju u ovoj klasifikaciji. Ovdje se redoslijed rasporeda atoma održava samo na najkraćim udaljenostima. Međutim, u elektrotehnici se još uvijek koristi u obliku tankih filmova.
Proizvodnja nemetala
S obzirom na inertnost njegovih spojeva i visoka tališta većine njih, nije tako lako dobiti čisti silicij. U industriji se najčešće pribjegava smanjenju ugljika iz dioksida. Reakcija se provodi u lučnim pećima na temperaturi od 1800 C. Tako se dobiva nemetal čistoće 99,9%, što nije dovoljno za njegovu uporabu.
Rezultirajući materijal se klorira kako bi se dobili kloridi i hidrokloridi. Zatim se spojevi pročiste od nečistoća svim mogućim metodama i reduciraju vodikom.
Tvar se također može pročistiti dobivanjem magnezijevog silicija. Silicid je izložen klorovodičnoj ili octenoj kiselini. Dobiva se silan, a potonji se pročišćava raznim metodama - sorpcijom, ispravljanjem itd. Zatim se silan razgrađuje u vodik i silicij na temperaturi od 1000 C. U tom slučaju dobiva se tvar s udjelom nečistoće 10 -8 -10 -6%.
Primjena tvari
 Za industriju su najzanimljivije elektrofizičke karakteristike nemetala. Njegov jednokristalni oblik je poluvodič s neizravnim razmakom. Njegova svojstva određena su nečistoćama, što omogućuje dobivanje kristala silicija sa željenim svojstvima. Dakle, dodatak bora, indija omogućuje uzgoj kristala s rupčastom vodljivošću, a uvođenje fosfora ili arsena omogućuje uzgoj kristala s elektroničkom vodljivošću.
Za industriju su najzanimljivije elektrofizičke karakteristike nemetala. Njegov jednokristalni oblik je poluvodič s neizravnim razmakom. Njegova svojstva određena su nečistoćama, što omogućuje dobivanje kristala silicija sa željenim svojstvima. Dakle, dodatak bora, indija omogućuje uzgoj kristala s rupčastom vodljivošću, a uvođenje fosfora ili arsena omogućuje uzgoj kristala s elektroničkom vodljivošću.
- Silicij je doslovno temelj moderne elektrotehnike. Od njega se izrađuju tranzistori, fotoćelije, integrirana kola, diode i tako dalje. Štoviše, funkcionalnost uređaja gotovo uvijek određuje samo površinski sloj kristala, koji određuje vrlo specifične zahtjeve za površinsku obradu.
- U metalurgiji se tehnički silicij koristi i kao modifikator legura - daje veću čvrstoću, i kao komponenta - u, na primjer, i kao dezoksidans - u proizvodnji lijevanog željeza.
- Ultračista i rafinirana metalurgija čini osnovu solarne energije.
- Nemetalni dioksid prirodno se javlja u vrlo različitim oblicima. Njegove kristalne sorte - opal, ahat, karneol, ametist, gorski kristal - našle su svoje mjesto u nakitu. Vanjski ne tako atraktivne modifikacije - kremen, kvarc, koriste se u metalurgiji, u graditeljstvu i radio -elektrotehnici.
- Spoj nemetala s ugljikovim karbidom koristi se u metalurgiji, proizvodnji instrumenata i kemijskoj industriji. To je poluprovodnik širokog raspona, visoke tvrdoće - 7 na Mohsovoj ljestvici i čvrstoće, što mu omogućuje da se koristi kao abrazivni materijal.
- Silikati - to jest soli silicijeve kiseline. Nestabilno, lako se raspada pod utjecajem temperature. Izvanredni su po činjenici da tvore brojne i različite soli. No potonji su osnova za proizvodnju stakla, keramike, zemljanog posuđa, kristala itd. Možemo sa sigurnošću reći da se moderna gradnja temelji na raznim silikatima.
- Staklo je ovdje najzanimljiviji slučaj. Temelji se na aluminosilikatima, ali zanemarive nečistoće drugih tvari - obično oksida, daju materijalu puno različitih svojstava, uključujući boju. -, fajansa, porculan, naime, ima istu formulu, iako s drugačijim omjerom komponenti, a i njezina je raznolikost nevjerojatna.
- Nemetal ima još jednu sposobnost: tvori spojeve poput ugljika, u obliku dugog lanca atoma silicija. Takvi spojevi nazivaju se silicijevi silicijevi spojevi. Područje njihove primjene nije ništa manje poznato - to su silikoni, brtvila, maziva itd.
Silicij je vrlo raširen element i od iznimne je važnosti u mnogim područjima nacionalne ekonomije. Štoviše, ne koristi se samo sama tvar, već i svi njezini razni i brojni spojevi.
Ovaj video će vam reći o svojstvima i upotrebi silicija:
silikati. Među njima su najčešće aluminosilikati (jasno je da ti silikati sadrže aluminij). Aluminosilikati uključuju granit, razne vrste glina, tinjac. Ne-aluminijski silikat je, na primjer, azbest.
SiO2 oksid bitan je za život biljaka i životinja. Daje snagu biljnim stabljikama i zaštitnim omotačima životinja. Riblje ljuske, ljuske insekata, krila leptira, ptičje perje i životinjska dlaka izdržljive su jer sadrže silicijev dioksid.
3) Rhinestone
Kameni kristal je bezbojan, proziran, obično kemijski čist, gotovo bez nečistoća, svojevrsna niskotemperaturna modifikacija kvarca - SiO2, kristalizira se u trigonalnom sustavu. Nalazi se u obliku monokristala ili kristala prizmatično-šesterokutnog oblika, sakupljenih u bubnjevima, čija masa ponekad doseže tonu ili više.
Kvarc je jedan od najobilnijih minerala u zemljinoj kori, mineral koji tvori stijene većine magmatskih i metamorfnih stijena. Kemijska formula: SiO2.
Sorte kvarca: bezbojan, ružičasti kvarc, "dlakavi", karneol, ahat, "tigrovo oko", polirani kamenčići.
5) Karneolska formula - SiO2, vrsta kalcedona. Kemijski sastav - sadržaj SiO2 - 90-99%; zabilježene su nečistoće Fe2O3, Al2O3, MgO, CaO, H2O. Karneol, poput ahata, agregati su u osnovi kalcedon sastava složene strukture.
Jaspis je neprozirna sorta kvarca - silicijevog dioksida SiO2 - s vlaknastom strukturom, uključujući najrazličitije minerale: granate, hematit, pirit itd. Stoga se jaspis odlikuje velikom raznolikošću boje, uključujući sve tonove osim čistog plava.
7) Ametist
Ametisti su ljubičasti ili crvenkasti kristali kvarca, koji su silicijev dioksid i pripadaju trigonalnom kristalnom sustavu.
Opal je amorfni tip kvarcnog SiO2 s promjenjivim sadržajem vode (6-10%). Kemijski naziv za opal je silicijev dioksid polihidrat. Glavna prednost opala je sposobnost emitiranja uzastopno različitih zraka pod utjecajem sunčeve svjetlosti, što uzrokuje raznoliku igru boja. Postoje tri vrste opala: crni opal, koji ima vrlo tamno plavu boju s "bljeskovima" boja; vatreni opal narančastocrveni i bijeli opal.
7) Citrin Naziv kamena, izveden iz riječi citreus - "limun", ukazuje na žutu nijansu ove vrste kvarca, koja daje citrinske nečistoće željeznog željeza. Citrin je dobar za koncentraciju i koncentraciju.
Žad je proziran bijeli i zeleni mineral. S mineraloškog gledišta, žad je spoj silicija.
9) Ahat je vrsta prozirnog kvarca. Kemijska formula: SiO2.
Primjena silicijevih spojeva:
Silicij se koristi u silikatnoj industriji:
Prirodni spojevi silicija - pijesak (SiO2) i silikati koriste se za proizvodnju keramike, stakla i cementa.


Silikatno ljepilo nadaleko je poznato, koristi se u građevinarstvu kao sušilica, te u pirotehnici i u svakodnevnom životu za lijepljenje papira.
Silikonska ulja i silikoni postali su široko rasprostranjeni - materijali na bazi organosilicijevih spojeva.
54) Fizičke i kemijske osnove korozije betona i mineralnih materijala.
Korozija betona glavni je neprijatelj svih mineralnih građevinskih materijala i konstrukcija (beton, armirani beton, opeka, azbestni cement, silikat, pjenasti beton i blokovi od gaziranog betona). Najozbiljniji problem je utjecaj atmosfersko-kemijskog faktora-utjecaj agresivnih atmosferskih tvari (karbonati, sulfati, kloridi), kao i česti ciklusi smrzavanja i odmrzavanja.
Građevinski materijali na bazi minerala kapilarno su porozni. Kao rezultat agresivnog atmosferskog djelovanja, unutar porozne strukture nastaju kristali čiji rast dovodi do pojave pukotina. Kao posljedica izloženosti vodi, solima i ugljičnom dioksidu - korozija betona i uništavanje građevinskih konstrukcija.
Zaštita mineralnih površina globalni je izazov u projektiranju, izgradnji i radu bilo kojeg objekta. Relevantan je za sve vrste zgrada, građevina i građevina koje se koriste u modernoj gradnji.
Karakteristika elementa
14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
Izotopi: 28 Si (92,27%); 29 Si (4,68%); 30 Si (3,05%)
Silicij je drugi najrasprostranjeniji element u zemljinoj kori nakon kisika (27,6% po težini). U prirodi se ne javlja u slobodnom stanju, nalazi se uglavnom u obliku SiO 2 ili silikata.
Si spojevi su otrovni; udisanje najmanjih čestica SiO 2 i drugih spojeva silicija (na primjer, azbesta) uzrokuje opasnu bolest - silikozu
U osnovnom stanju atom silicija ima valenciju = II, a u pobuđenom stanju IV.
Najstabilnije oksidacijsko stanje Si je +4. U spojevima s metalima (silicidi) S.O. -4.
Metode dobivanja silicija
Najčešći prirodni spoj silicija je silicijev dioksid (silicijev dioksid) SiO 2. To je glavna sirovina za proizvodnju silicija.
1) Redukcija SiO 2 s ugljikom u lučnim pećima na 1800 "C: SiO 2 + 2C = Si + 2CO
2) Si visoke čistoće iz tehničkog proizvoda dobiva se prema shemi:
a) Si → SiCl 2 → Si
b) Si → Mg 2 Si → SiH 4 → Si
Fizička svojstva silicija. Alotropne modifikacije silicija
1) Kristalni silicij je srebrnosiva tvar s metalnim sjajem, kristalna rešetka tipa dijamanta; t. pl. 1415 "C, tt 3249" C, gustoća 2,33 g / cc; je poluvodič.
2) Amorfni silicij je smeđi prah.
Kemijska svojstva silicija
U većini reakcija Si djeluje kao redukcijsko sredstvo:
Na niskim temperaturama silicij je kemijski inertan; pri zagrijavanju njegova se reaktivnost naglo povećava.
1. U interakciji je s kisikom pri T iznad 400 ° C:
Si + O 2 = SiO 2 silicijev oksid
2. Reagira s fluorom već na sobnoj temperaturi:
Si + 2F 2 = SiF 4 silicijev tetrafluorid
3. S ostalim halogenima reakcije se odvijaju na temperaturi = 300 - 500 ° C
Si + 2Hal 2 = SiHal 4
4. S parom sumpora na 600 ° C tvori disulfid:
5. Reakcija s dušikom događa se iznad 1000 ° C:
3Si + 2N 2 = Si 3 N 4 silicijev nitrid
6. Na temperaturi = 1150 ° C, reagira s ugljikom:
SiO 2 + 3C = SiC + 2CO
Tvrdoća je karborundum blizak dijamantu.
7. Silicij ne reagira izravno s vodikom.
8. Silicij je otporan na kiseline. U interakciji je samo sa smjesom dušične i fluorovodične (fluorovodične) kiseline:
3Si + 12HF + 4HNO 3 = 3SiF 4 + 4NO + 8H20
9. reagira s lužinskim otopinama pri čemu nastaju silikati i oslobađa vodik:
Si + 2NaOH + H20 = Na2SiO3 + 2H2
10. Reducirajuća svojstva silicija koriste se za izolaciju metala od njihovih oksida:
2MgO = Si = 2Mg + SiO2
U reakcijama s metalima, Si je oksidant:
Silicij tvori silicide sa s-metalima i većinom d-metala.
Sastav silicida ovog metala može biti različit. (Na primjer, FeSi i FeSi 2; Ni 2 Si i NiSi 2.) Jedan od najpoznatijih silicija je magnezijev silicij, koji se može dobiti izravnom interakcijom jednostavnih tvari:
2Mg + Si = Mg 2 Si
Silan (monosilan) SiH 4
Silani (silicij) Si n H 2n + 2, (usporedite s alkanima), gdje je n = 1-8. Silani su analozi alkana, koji se od njih razlikuju po nestabilnosti -Si-Si- lanaca.
Monosilan SiH 4 je bezbojni plin s neugodnim mirisom; otapa se u etanolu, benzinu.
Načini dobivanja:
1. Razlaganje magnezijevog silicijida s klorovodičnom kiselinom: Mg 2 Si + 4HCI = 2MgCI 2 + SiH 4
2. Redukcija Si halogenida s litij aluminij hidridom: SiCl 4 + LiAlH 4 = SiH 4 + LiCl + AlCl 3
Kemijska svojstva.
Silane je moćno redukcijsko sredstvo.
1.SiH 4 oksidira kisik čak i pri vrlo niskim temperaturama:
SiH 4 + 2O 2 = SiO 2 + 2H 2 O
2. SiH 4 se lako hidrolizira, osobito u alkalnom okruženju:
SiH 4 + 2H2O = SiO 2 + 4H 2
SiH 4 + 2NaOH + H 2 O = Na 2 SiO 3 + 4H 2
Silicij (IV) oksid (silicijev dioksid) SiO 2
Silicij postoji u različitim oblicima: kristalni, amorfni i staklasti. Najčešći kristalni oblik je kvarc. Kad se kvarcne stijene unište, nastaje kvarcni pijesak. Monokristali kvarca su prozirni, bezbojni (gorski kristal) ili obojeni nečistoćama u raznim bojama (ametist, ahat, jaspis itd.).
Amorfni SiO 2 javlja se u obliku minerala opala: umjetno se dobiva silika gel, koji se sastoji od koloidnih čestica SiO 2 i vrlo je dobar adsorbent. Stakleno SiO 2 poznato je kao kvarcno staklo.
Fizička svojstva
SiO 2 se vrlo malo otapa u vodi i praktički se ne otapa u organskim otapalima. Silicij je dielektrik.
Kemijska svojstva
1. Si02 je kiseli oksid, pa se amorfni silicijev dioksid otapa polako u vodenoj otopini lužina:
SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O
2. SiO 2 također stupa u interakciju pri zagrijavanju s bazičnim oksidima:
SiO2 + K2O = K2 SiO3;
SiO 2 + CaO = CaSiO 3
3. Budući da je nehlapljivi oksid, SiO 2 istiskuje ugljikov dioksid iz Na 2 CO 3 (fuzijom):
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2
4. Silicij reagira s fluorovodičnom kiselinom pri čemu nastaje hidrofluorosilicijeva kiselina H 2 SiF 6:
SiO 2 + 6HF = H 2 SiF 6 + 2H 2 O
5. Na 250 - 400 ° C SiO2 stupa u interakciju s plinovitim HF i F 2, tvoreći tetrafluorosilan (silicijev tetrafluorid):
Si02 + 4HF (plin) = SiF4 + 2H20
SiO 2 + 2F 2 = SiF 4 + O 2
Silicijeva kiselina
Znan:
Ortosilicilatna kiselina H 4 SiO 4;
Metasilicijska (silicijeva) kiselina H 2 SiO 3;
Di- i polisilicilne kiseline.
Sve silicijeve kiseline slabo su topljive u vodi i lako tvore koloidne otopine.
Metode dobivanja
1. Taloženje kiselinama iz otopina silikata alkalnih metala:
Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl
2. Hidroliza klorosilana: SiCl 4 + 4H 2 O = H 4 SiO 4 + 4HCl
Kemijska svojstva
Silicijske kiseline su vrlo slabe kiseline (slabije od ugljične kiseline).
Kad se zagriju, dehidriraju i tvore silicij kao konačni proizvod.
H 4 SiO 4 → H 2 SiO 3 → SiO 2
Silikati - soli silicijeve kiseline
Budući da su silicijeve kiseline izrazito slabe, njihove soli u vodenim otopinama su jako hidrolizirane:
Na 2 SiO 3 + H 2 O = NaHSiO 3 + NaOH
SiO 3 2- + H 2 O = HSiO 3 - + OH - (alkalni medij)
Iz istog razloga, kada se ugljikov dioksid propušta kroz silikatne otopine, silicijeva kiselina se istiskuje iz njih:
K 2 SiO 3 + CO 2 + H 2 O = H 2 SiO 3 ↓ + K 2 CO 3
SiO 3 + CO 2 + H 2 O = H 2 SiO 3 ↓ + CO 3
Ova se reakcija može smatrati kvalitativnom reakcijom za silikatne ione.
Među silikatima samo su Na 2 SiO 3 i K 2 SiO 3 visoko topljivi, koji se nazivaju topljivim staklom, a njihove vodene otopine nazivaju se tekućim staklom.
Staklo
Obično prozorsko staklo ima sastav Na 2 O CaO 6SiO 2, odnosno mješavina je natrijevih i kalcijevih silikata. Dobiva se topljenjem sode Na 2 CO 3, vapnenca CaCO 3 i pijeska SiO 2;
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O CaO 6SiO 2 + 2CO 2
Cement
Vezivo u prahu, koje pri interakciji s vodom stvara plastičnu masu, koja se s vremenom pretvara u čvrsto tijelo nalik kamenu; osnovni građevinski materijal.
Kemijski sastav najčešćeg portlandskog cementa (u mas.%) Je 20 - 23% SiO 2; 62-76% CaO; 4 - 7% Al203; 2-5% Fe2O3; 1-5% MgO.