Các nguyên tắc cơ bản của lý thuyết về sự đốt cháy. Các dạng đốt, đặc điểm của chúng. Năng lượng phân tử của quá trình đốt cháy
Theo trình tự thời gian đầu tiên (cuối thế kỷ 19) là lý thuyết nhiệt, những người sáng lập ra là Malyard, Le Chatelier và Nusselt. Lý thuyết này dựa trên giả thuyết van't Hoff về sự phụ thuộc nhiệt độ của vận tốc phản ứng hóa học. Điều kiện để xảy ra một vụ nổ nhiệt là sự tăng nhiệt chiếm ưu thế do phản ứng năng lượng hơn sự loại bỏ nhiệt trong Môi trường. Trong trường hợp này, nhiệt tích tụ trong hệ thống, dẫn đến hiện tượng tự đốt nóng và do đó, phản ứng tự tăng tốc.
Việc xảy ra phản ứng oxy hóa trong một hệ thống dễ cháy thường liên quan đến việc đốt nóng hệ thống bởi một hoặc một nguồn đánh lửa khác. Khi hệ thống nhiên liệu được đốt nóng, năng lượng của các phân tử nhiên liệu và ôxy tăng lên và khi đạt đến một giá trị nhất định, chúng sẽ được kích hoạt, tức là các trung tâm hoạt động (gốc và nguyên tử) được hình thành có các hóa trị tự do, do đó các phân tử của chất dễ cháy dễ dàng kết hợp với oxy trong khí quyển. MỘT. Bach và K. Engler vào năm 1898 đã đề xuất một cách độc lập lý thuyết oxy hóa peroxit, theo đó, khi một hệ thống cháy được đốt nóng, oxy được kích hoạt bằng cách phá vỡ một liên kết giữa các nguyên tử, và phân tử hoạt động kết hợp với một chất dễ cháy mà không bị phân hủy thành nguyên tử và tạo thành hợp chất peroxit kiểu: R 1 -O-O-R 2 hoặc R-O-O-OH.
Tuy nhiên, lý thuyết peroxide không giải thích được một số đặc điểm quá trình oxy hóa, ví dụ, một hành động sắc nét, đôi khi dấu vết của các tạp chất lạ không đáng kể.
Tốc độ của một phản ứng hóa học, m / s, có thể được biểu thị, dựa trên định luật Arrhenius, bằng phương trình sau:
![]() , (1.12)
, (1.12)
ở đâu là hằng số tốc độ phản ứng (tốc độ của một phản ứng hóa học ở nồng độ của các chất phản ứng giảm xuống mức đơn nhất);
Nồng độ thuốc thử, mol / m 3;
Hệ số đo phân cực xác định bằng tỷ lệ giữa nồng độ của các thuốc thử ban đầu trong phương trình phản ứng đo phân cực;
Cơ sở của logarit tự nhiên;
Hằng số khí phổ, = 8,3 J / (mol ∙ K);
nhiệt độ, K.
Lý thuyết nhiệt tự bốc cháy (còn gọi là lý thuyết về sự bùng nổ nhiệt) dựa trên sự so sánh giữa tốc độ tỏa nhiệt trong quá trình oxy hóa tỏa nhiệt và tỏa nhiệt ra khỏi hỗn hợp phản ứng trong thành bình chứa nó. Điều kiện tự bốc cháy được xác định bởi sự bằng nhau của các tốc độ này. Nhiệt độ của thành bình đạt được sự bằng nhau này được gọi là nhiệt độ tự cháy. Bắt đầu từ nhiệt độ này (đặc trưng trong từng trường hợp đối với các điều kiện cụ thể - kích thước và hình dạng của bình, đặc tính nhiệt lý của chất khí), hiện tượng tự đốt nóng xảy ra, có thể dẫn đến chớp cháy (tự bốc cháy).
Tính đến những điều trên, để tự nóng lên trong môi trường phản ứng, chúng ta có thể viết:
Nhiệt dung ở thể tích không đổi là J / K;
Mật độ khí, kg / m 3;
Nhiệt độ khí, K;
Thời gian, s;
Hiệu ứng nhiệt của phản ứng, W;
Tốc độ phản ứng, m / s;
Bề mặt của bình phản ứng, m 2;
Thể tích của bình phản ứng, m 3;
Hệ số truyền nhiệt, W / (m 2 × K);
Nhiệt độ thành bình, K.
D.A. Frank-Kamenetsky đã đề xuất một tiêu chí cho hiện tượng tự bốc cháy do nhiệt, dựa trên sự vi phạm phân bố nhiệt độ tĩnh trong bình phản lực ở tốc độ tỏa nhiệt đủ:
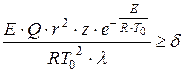 , (1.14)
, (1.14)
kích thước đặc trưng của tàu là ở đâu, m;
Cấp số nhân Preexponential;
Hệ số dẫn nhiệt hỗn hợp khí, W / (m × K);
Tiêu chí không thứ nguyên bằng 3,3; 0,88 và 2 tương ứng đối với các bình hình cầu, mặt phẳng song song và hình trụ.
Tiêu chí của D.A. Frank-Kamenetsky nên được hiểu như sau: nếu khi thay tất cả các tham số xác định ta được giá trị thì sẽ không có đánh lửa, khi đó sẽ xảy ra đánh lửa. Theo phương trình tiêu chuẩn, nhiệt của phản ứng và bán kính của bình mà phản ứng xảy ra là những yếu tố quyết định quan trọng của một vụ nổ. Sự bùng nổ nhiệt càng rõ rệt, thì các bất bình đẳng càng được thỏa mãn:
Nếu những bất đẳng thức này được thực hiện kém, thì vụ nổ nhiệt suy giảm - đồng thời với sự gia tăng nhiệt độ, sự cháy nhanh chóng của chất ban đầu xảy ra, làm mờ bức tranh của vụ nổ.
Sự xuất hiện của quá trình cháy thường liên quan đến việc đốt nóng hệ thống cháy bởi một hoặc một nguồn đánh lửa khác. Theo lý thuyết của Viện sĩ N.N. Semyonov, quá trình oxy hóa kèm theo sự tỏa nhiệt và trong những điều kiện nhất định có thể tự tăng tốc. Quá trình tự tăng tốc của phản ứng oxy hóa với quá trình chuyển sang quá trình cháy được gọi là quá trình tự cháy.
Trong trường hợp tự bốc cháy do nhiệt, nó xảy ra do tốc độ toả nhiệt vượt quá tốc độ toả nhiệt.
Hãy xem xét quá trình tự bốc cháy bằng nhiệt sử dụng ví dụ về khí hoặc hơi dễ cháy chất lỏng dễ cháy với không khí đặt trong bình có thể tích. Khi nhiệt độ của bình và hỗn hợp cháy tăng lên, tốc độ phản ứng và sự tỏa nhiệt sẽ tăng lên. Sự phụ thuộc của tốc độ tỏa nhiệt vào nhiệt độ, J / s được xác định bởi:
![]() , (1.15)
, (1.15)
đâu là nhiệt của sự cháy của khí, J;
Thể tích của hỗn hợp cháy, m 3;
Hằng số tốc độ phản ứng;
Nồng độ của chất phản ứng, kg / m 3;
Thứ tự phản ứng;
Năng lượng hoạt hóa, J / mol;
Hằng số khí phổ J / (mol K);
Nhiệt độ của hỗn hợp, K.
Nhiệt giải phóng được truyền đến hỗn hợp dễ cháy, và nó nóng lên. Ngay sau khi nhiệt độ của hỗn hợp vượt quá nhiệt độ của thành bình, nhiệt sẽ bắt đầu được loại bỏ qua thành bình trong một đơn vị thời gian, tương ứng với sự chênh lệch nhiệt độ giữa hỗn hợp và thành bình và được xác định bởi sự phụ thuộc:
![]() , (1.16)
, (1.16)
tốc độ thoát nhiệt qua thành bình là J / s ở đâu;
Hệ số truyền nhiệt, J / (K m 2 × s);
Bề mặt của thành bình, m 2;
Nhiệt độ hỗn hợp, K;
Nhiệt độ thành bình, K

Hình 1.5 - Sự phụ thuộc của tỏa nhiệt vào nhiệt độ ở các áp suất khác nhau
Các đường cong 2, 3 và 4 trong hình 1.5 cho thấy sự phụ thuộc của sự tỏa nhiệt vào nhiệt độ ở các áp suất khác nhau và cùng thành phần của hỗn hợp. Ở nhiệt độ không đổi của bình và môi trường và thành phần hỗn hợp không đổi, nhiệt lượng thoát ra khỏi vùng cháy được đặc trưng bởi đường thẳng 1. Khi thành phần của hỗn hợp thay đổi, tốc độ mất nhiệt cũng thay đổi và, do đó, hệ số góc của đường thẳng. Áp suất càng cao thì nhiệt lượng tỏa ra càng nhiều trong quá trình phản ứng (đường cong 4). Trong các điều kiện được xác định bởi đường cong 2, sự tự bốc cháy không thể xảy ra, vì nhiệt mất mát (đường 1) cao hơn nhiệt tỏa ra ở áp suất này. Điểm tiếp xúc của đường cong 3 với đường thẳng tương ứng với trạng thái cân bằng giữa nhiệt lượng sinh ra và nhiệt lượng tỏa ra ở - nhiệt độ tự bốc cháy nhỏ nhất của một hệ dễ cháy nhất định trong các điều kiện đã cho. Với một nguồn cung cấp năng lượng nhẹ từ bên ngoài, có thể tự bốc cháy. Đường cong 4 đặc trưng cho các điều kiện mà hiện tượng tự bốc cháy là không thể tránh khỏi, vì nhiệt tỏa ra nhiều hơn nhiệt được loại bỏ.
Phân tích lược đồ trên, N.N. Semyonov đã thiết lập sự phụ thuộc:
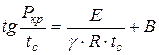 , (1.17)
, (1.17)
áp suất đánh lửa tối thiểu ở đâu, Pa;
Nhiệt độ tự cháy tối thiểu, K;
Thứ tự phản ứng;
Một hằng số phụ thuộc vào thành phần và các tính chất khác của hỗn hợp.
Dựa trên phương trình (1.17) này, về mặt lý thuyết, người ta có thể xác định trước liệu có thể tự bốc cháy hỗn hợp dễ cháy trong các điều kiện cụ thể hay không. Mối quan hệ liên quan giữa áp suất tối thiểu với nhiệt độ tự cháy đã được xác nhận bởi nhiều thí nghiệm và đã được chứng minh là có giá trị trong việc nghiên cứu các quá trình đốt cháy.
Lý thuyết dây chuyền đốt cháy
Trở lại năm 1928, N.N. Semenov đưa ra ý tưởng về khả năng tồn tại của hai loại vụ nổ trong hệ thống hóa học - chuỗi và nhiệt.
Phản ứng dây chuyền được gọi là phản ứng trải qua một loạt các giai đoạn (thông qua một loạt các phản ứng trung gian), trong đó các hợp chất trung gian có hóa trị tự do, được gọi là trung tâm hoạt động, được hình thành, là hạt nhân của các giai đoạn chảy nhanh tiếp theo của quá trình.
Lần đầu tiên, khái niệm về phản ứng dây chuyền xuất hiện vào năm 1913, khi nhà hóa học vật lý người Đức M. Bodenstein phát hiện ra rằng khi một hỗn hợp hydro và clo được chiếu sáng, phân tử clo, hấp thụ một lượng tử năng lượng ánh sáng, phân hủy thành các nguyên tử:
![]() .
.
Các nguyên tử clo ngay lập tức phản ứng với hiđro, dẫn đến một vụ nổ hỗn hợp. Việc kích hoạt một phân tử clo sẽ phải tạo ra hai phân tử:
![]() .
.
Tuy nhiên, các thí nghiệm cho thấy điều này tạo ra 100.000 phân tử hydro clorua. Điều này có thể được giải thích nếu chúng ta giả định rằng sự tương tác của clo với hydro tạo ra một sản phẩm, sản phẩm này, khi tham gia vào các phản ứng thứ cấp, được tái sinh một lần nữa và có thể tiếp tục phản ứng. Giả thiết này tương ứng với sơ đồ phản ứng sau:
Tôi phản ứng chính
IV Hở mạch
Theo sơ đồ này, việc kích hoạt một phân tử clo (I) gây ra sự xuất hiện của hai nguyên tử clo - hai trung tâm hoạt động của chuỗi phản ứng. Mỗi nguyên tử clo tạo ra phản ứng dây chuyền riêng của nó, trong đó tâm hoạt động liên tục bị khử (II, III). Do đó, dưới ảnh hưởng của phản ứng mở đầu (I), các phản ứng liên tiếp xảy ra, tạo thành một chuỗi (II, III, v.v.). Số lượng các phản ứng như vậy từ thời điểm bắt đầu chuỗi đến khi kết thúc được gọi là chiều dài chuỗi. Chuỗi có thể được kết thúc bằng sự va chạm của các nguyên tử clo (IV) hoặc hydro (V) và sự hình thành các phân tử từ chúng, hoặc do sự va chạm của các tâm hoạt động với bề mặt của chất rắn. Đây là một phản ứng dây chuyền không phân nhánh điển hình. Trong đó, mỗi vị trí hoạt động chỉ gây ra sự xuất hiện của một vị trí hoạt động mới, vì vậy phản ứng có thể tiếp tục, nhưng không tăng tốc.
Trong một chuỗi phản ứng phân nhánh, mỗi trung tâm hoạt động làm phát sinh hai hoặc nhiều trung tâm hoạt động mới.
Theo lý thuyết về phản ứng dây chuyền, quá trình oxy hóa bắt đầu bằng việc kích hoạt một chất dễ cháy.
Thực tiễn đã chỉ ra rằng sự đánh lửa có thể xảy ra trong các điều kiện đẳng nhiệt, tức là mà không làm tăng nhiệt độ của môi trường phản ứng (sự bốc cháy "nguội" của hỗn hợp). Trong trường hợp này, người ta nói về một vụ nổ dây chuyền (đẳng áp).
Hai thành phần ban đầu: nhiên liệu và chất oxy hóa, ở trạng thái phân tử tương đối ổn định, trước khi liên kết thành các phân tử mới, ổn định hơn của sản phẩm cháy, trải qua một chuỗi biến đổi trung gian phức tạp, dẫn đến hình thành các sản phẩm không ổn định: nguyên tử, gốc. , các phân tử bị kích thích với mức độ ion hóa tương đối lớn (fomandehit, gốc hydrocacbon và hydroxyl, oxy nguyên tử và hydro).
Kondratiev V.N. có thể phát hiện nồng độ cao của oxy nguyên tử (O), gốc hydroxit (OH), gốc hydrocacbon (CH 3), carbon monoxide (CO), formaldehyde (CH 2 O), v.v. trong ngọn lửa của các hydrocacbon khác nhau. nồng độ của các chất này trong ngọn lửa hóa ra lớn hơn hàng nghìn triệu lần nồng độ cân bằng của chúng trong quá trình phân hủy nhiệt ở nhiệt độ ngọn lửa của các sản phẩm phản ứng cuối cùng, ví dụ, H 2 O → H + OH.
Kết quả của những quan sát này dẫn đến kết luận rằng các nguyên tử và gốc được xem xét xuất hiện trong khí phản ứng không phải là kết quả của sự phân hủy cuối cùng của các sản phẩm, mà là sản phẩm trung gian của phản ứng.
Do đó, cơ chế chuỗi đánh lửa dựa trên toàn bộ một chuỗi biến đổi hóa học của chất này thành chất khác, kết quả của nó là sự hình thành các sản phẩm không bền về mặt hóa học rất hoạt động ở các giai đoạn trung gian riêng biệt, được gọi là trung tâm hoạt động, dễ dàng phản ứng với nhau và với các phân tử của các chất ban đầu có sự hình thành các vị trí hoạt động mới và các sản phẩm cuối cùng, ví dụ, đối với hỗn hợp khí metan gồm H 2 O và CO 2.
Khả năng phản ứng cao của các gốc và nguyên tử được giải thích là do năng lượng hoạt hóa của các phản ứng của chúng thấp, gần với năng lượng hoạt hóa của các phản ứng nguyên tử:
OH + H 2 \ u003d H 2 O + H - 25 kJ / mol
CH 3 + C 3 H 6 - 12,5 kJ / mol
CH 3 + C 6 H 6 - 23,5 kJ / mol
H 2 O → H + OH
Bất kỳ hạt nào trong số các hạt hoạt động tạo thành (H hoặc OH), cực kỳ không ổn định và do đó, hoạt động hóa học, va chạm với một phân tử của chất ban đầu, tách ra, tạo thành các hạt hoạt động mới:
H + O 2 \ u003d OH + O
OH + H 2 \ u003d H 2 O + H
Các phần tử H và OH hoạt động thu được từ kết quả của phản ứng sẽ lại tham gia vào các phản ứng, và các phần tử O sẽ tương tác với hydro:
O + H 2 \ u003d OH + H.
Nghĩa là, do kết quả của phản ứng giữa các phần tử hoạt động và các phân tử của chất ban đầu, không chỉ sản phẩm cuối cùng được hình thành, mà còn cả các phần tử hoạt động mới. Các phần tử hoạt động được hình thành do kết quả của phản ứng làm phát sinh các giai đoạn biến đổi hóa học mới, sẽ xảy ra cho đến khi tiêu thụ hoàn toàn các chất ban đầu.
Các phản ứng hóa học lặp đi lặp lại nhiều lần như vậy được gọi là chuỗi, và các hạt hoạt động tạo ra chuỗi biến đổi mới được gọi là trung tâm hoạt động.
Quá trình dây chuyền đốt cháy hydro được thảo luận ở trên có thể được biểu diễn dưới dạng sơ đồ (Hình 1.6).
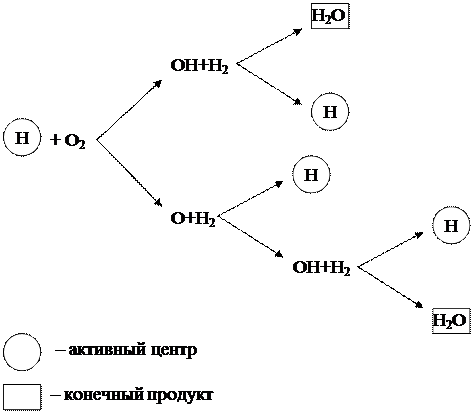
Hình 1.6 - Sơ đồ đốt cháy chuỗi hydro
Từ sơ đồ có thể thấy rằng chỉ có các hạt hydro (H), là trung tâm hoạt động, tạo ra chuỗi biến đổi mới. Đồng thời, trong mỗi mắt xích của quá trình dây chuyền, do kết quả của phản ứng giữa tâm hoạt động H và phân tử oxi O 2, ngoài sản phẩm cuối cùng là H 2 O, 3 tâm hoạt động mới H được hình thành, cho vươn lên những chuỗi biến đổi mới.
Một phản ứng dây chuyền như vậy, tiến hành với sự gia tăng các trung tâm hoạt động, được gọi là phân nhánh. Phản ứng phát triển giống như một trận tuyết lở và diễn ra với tốc độ rất cao, vượt quá tốc độ phản ứng phân tử thông thường một cách đáng kể.
Một phản ứng không phân nhánh điển hình là phản ứng của clo với hiđro. Các trung tâm hoạt động của phản ứng này là các nguyên tử clo và hydro xen kẽ. Khi một nguyên tử clo phản ứng, một nguyên tử hydro được tạo thành, cũng giống như khi một nguyên tử hydro phản ứng, một nguyên tử clo được hình thành. Do đó, phản ứng có thể tiếp tục, nhưng không tăng tốc.
Thực tế nổi tiếng là phản ứng quang hóa của clo với hydro vẫn kết thúc trong một vụ nổ (tự bốc cháy) được giải thích là do ở tốc độ đủ cao của phản ứng dây chuyền, nhiệt lượng tỏa ra vượt quá nhiệt lượng tỏa ra. trong đó hỗn hợp rất nóng, và nảy sinh các điều kiện cần thiết cho quá trình tự bốc cháy do nhiệt.
Khi phản ứng chuỗi phân nhánh xảy ra, đặc trưng cho các hydrocacbon, nồng độ của các tâm hoạt động có thể tăng lên bất kể điều kiện khởi tạo ban đầu và nếu tốc độ hình thành các tâm hoạt động trong quá trình phân nhánh vượt quá tốc độ kết thúc chuỗi, thì hiện tượng tuyết lở tự tăng tốc. -Quá trình giống như xảy ra, dẫn đến đánh lửa.
Lý thuyết về phản ứng dây chuyền có thể giải thích nhiều đặc điểm của quá trình cháy (ảnh hưởng mạnh của tạp chất, giới hạn áp suất của quá trình tự bốc cháy, xúc tác và ức chế áp suất, v.v.) mà lý thuyết nhiệt không thể giải thích được. Cơ chế xuất hiện và phát triển của các vụ cháy, nổ thực sự được đặc trưng bởi một quá trình nhiệt - dây chuyền kết hợp. Đã bắt đầu theo dây chuyền, phản ứng oxi hóa do tỏa nhiệt của nó tiếp tục được tăng tốc theo đường nhiệt. Do đó, cuối cùng, các điều kiện tới hạn (giới hạn) cho sự khởi đầu và phát triển của quá trình cháy sẽ được xác định bởi sự tỏa nhiệt và các điều kiện trao đổi nhiệt giữa hệ thống phản ứng và môi trường.
Nhiều phản ứng dựa trên chuỗi phản ứng hóa học. quy trình công nghệ Trong công nghiệp hóa chất. Các quá trình này bao gồm, ví dụ, các quá trình trùng hợp, tạo cơ sở cho việc sản xuất cao su tổng hợp, chất dẻo, sợi polyme và nhiều sản phẩm khác. Chúng cũng bao gồm quan trọng Quy trình công nghiệp, vì sản xuất axit béo tổng hợp thay thế chất béo ăn được sử dụng trước đây trong sản xuất chất tẩy rửa và chất bôi trơn, crackinh là quá trình thu được nhiên liệu chất lượng cao từ dầu, v.v.
Năng lượng nổ
Ưu điểm chính của chất nổ so với các nguồn năng lượng khác là tính nhỏ gọn, khả năng vận chuyển và thực tế là việc giải phóng năng lượng có thể diễn ra trong thời gian ngắn cho phép phát triển các năng lực khổng lồ. Vì vậy, trong vụ nổ của một điện tích hình cầu có khối lượng 1 kg và mật độ 1,65 g / cm3, được tạo ra từ một chất nổ mạnh - hexogen, được kích thích (bắt đầu) ở trung tâm, tốc độ lan truyền của chất nổ biến đổi qua chất điểm (nổ) là 8300 m / s. Đường dẫn r(bán kính điện tích) mà vụ nổ sẽ đi qua được xác định từ đẳng thức
ở đâu gup- khối lượng và mật độ điện tích tương ứng.
Thời gian thực hiện quy trình - τ = r / D (D là vận tốc kích nổ).
Quyền lực N(kJ / e), được phát triển trong vụ nổ, có thể được ước tính khi biết lượng nhiệt tỏa ra q trong sự biến đổi bùng nổ của 1 kg hexogen:
Đối với RDX q= 5420 kJ / kg. Công suất tính toán được đánh giá quá cao, vì thời gian mà khí nở ra hoạt động không được tính đến. Cần lưu ý rằng nó vượt quá công suất của các nhà máy điện lớn nhất trên thế giới. Chất nổ có khả năng biến đổi nhanh như vậy được gọi là nổ mìn.
Từ chất nổ cao, chất nổ khởi đầu được cô lập, mà thực tế không có ứng dụng độc lập và chỉ được sử dụng để điều chế chất nổ. Các thiết bị nổ (mũ nổ, hộp đạn nổ, cầu chì, dây nổ, v.v.) được kết hợp thành một phân nhóm đặc biệt. Nổ thuốc nổ, thuốc súng và thuốc nổ tạo thành một nhóm vật liệu nổ. Cả trong quá trình kích nổ và đốt cháy trong quá trình bắn, các điều kiện bổ sung được đặt ra đối với sự chuyển hóa chất nổ thành khí: đối với thuốc súng - cháy ổn định với tốc độ tính toán ở các áp suất khác nhau, đối với nổ chất nổ - tốc độ lan truyền chuyển hóa qua chất cực cao.
Tuy nhiên, thuốc nổ không chỉ có khả năng biến hình nhanh chóng. Nếu bạn đốt một lượng nhỏ chất nổ bằng các phương pháp thông thường và để nó cháy trong điều kiện khí quyển, không cản trở việc loại bỏ các chất khí, thì quá trình đốt cháy sẽ diễn ra từ từ và bình tĩnh. Đây là cơ sở cho phương pháp tiêu hủy vật liệu nổ không dùng được bằng cách đốt, nếu thực hiện đúng cách thì khá an toàn và tiện lợi. Với quá trình đốt cháy không đúng cách, các trường hợp có thể phát sinh trong đó quá trình đốt cháy tự phát thành quá trình kích nổ với sự chuyển hóa chất nổ thành khí nhanh hơn.
Sự bùng nổ là gì? Vụ nổ là một sự biến đổi vật lý hoặc hóa học của một chất, trong đó năng lượng của nó được chuyển hóa nhanh chóng thành năng lượng nén và chuyển động của chính chất đó hoặc sản phẩm của quá trình biến đổi của nó và của môi trường. Năng lượng của vụ nổ có thể khác nhau. Sự giải phóng các năng lượng hóa học, điện, hạt nhân, nhiệt hạch, nhiệt năng, động năng, năng lượng nén đàn hồi có thể kèm theo các quá trình nổ. Ví dụ, trong phương pháp phá hủy vật liệu bằng dấu điện cực, các vụ nổ vi mô được sử dụng, nguồn năng lượng của nó là sự phóng điện, và chất mang năng lượng là sản phẩm của sự bay hơi và phân hủy hoặc chỉ đơn giản là làm nóng môi trường mà sự phóng điện được thực hiện. . Nổ do phá hủy bình khí nén, nồi hơi, bình chứa khí áp suất cao, cũng có thể chảy với tốc độ cao và gây thiệt hại nghiêm trọng cho khu vực xung quanh.
Tuy nhiên, điều quan trọng hàng đầu là việc sử dụng năng lượng hóa học tiềm năng, mà ở nhiều chất trong những điều kiện nhất định (kết quả của một phản ứng hóa học) có thể nhanh chóng chuyển thành năng lượng của khí nén. Những chất có khả năng biến đổi như vậy được gọi là chất nổ, và một vụ nổ được gọi là chất hóa học. Trong tương lai, bằng sự bùng nổ, không cần đặt trước đặc biệt, chúng tôi sẽ chỉ hiểu vụ nổ hóa chất, và tất cả các quá trình được xem xét đều là do các quá trình xảy ra trong một vụ nổ hóa chất.
Một vụ nổ có thể được đặc trưng bởi lượng năng lượng được giải phóng. Vì quá trình này đôi khi được xác định bởi các thông số của thiết bị (ví dụ, đối với bộ phát khí nén, thể tích của buồng và áp suất của khí nén), nên người ta phải xác định được năng lượng của nó. Đối với bộ phát khí nén, nó bằng PV /(k- 1), ở đâu R là áp suất của khí nén; V- thể tích buồng; k- hệ số hiệu chỉnh (đối với không khí k= 1,4), đối với bộ phát dấu ấn điện tử - UC 2/2, ở đâu TỪ- dung tích, U- Vôn. Năng lượng của chất nổ hóa học thường được tính bằng nhiệt lượng của vụ nổ tính bằng kilojoules trên kilogam. Đương nhiên, việc so sánh các nguồn liên quan đến việc chuyển năng lượng từ đơn vị này sang đơn vị khác (calo thành jun, v.v.).
Liên quan đến việc xem xét vụ nổ, chúng ta hãy đề cập đến một quá trình ở một mức độ nhất định đối lập với nó, sự bao hàm, đang bắt đầu được sử dụng trong công nghệ. Khi một điện tích nổ phát nổ, mức năng lượng cho phép các khí, do giãn nở, hoạt động môi trường bên ngoài. Trong tạp chất, chất của môi trường xung quanh nguồn có áp suất cao hơn áp suất của chính nguồn đó, và khi hàng rào ngăn cách bị loại bỏ, chất này có thể lao vào nguồn. Quá trình như vậy có thể gây ra nhiễu loạn sóng. Ví dụ đơn giản nhất về hiện tượng nhiễu là bóng của bóng đèn điện (nó bị hút chân không), bị vỡ trong không khí. Áp suất của môi chất càng cao, năng lượng có thể được giải phóng trong quá trình xẹp của khoang càng nhiều. Trong các giếng sâu, nó trở nên đáng kể ngay cả trong các hốc nhỏ. Hiện tượng tương tự cũng được quan sát thấy trong một vụ nổ dưới nước, khi các sản phẩm nổ nở quá mức sẽ sụp đổ dưới tác dụng của áp suất thủy tĩnh. Trong địa chấn, đây được ghi nhận là tác động thứ hai của một vụ nổ được tạo ra trong một hồ chứa, với độ sâu đủ lớn của điện tích trong đó.
vụ nổ hóa chất- Sự biến đổi hóa học tự lan truyền của một chất, tiến hành với tốc độ cao, tỏa nhiệt và tạo thành các chất khí được nén đến áp suất cao. Kích nổ là một trường hợp đặc biệt của một vụ nổ được thực hiện với tốc độ không đổi, tốc độ tối đa đối với một chất nhất định.
Trước hết, cần ước lượng năng lượng (nhiệt lượng) tỏa ra trong quá trình nổ. Phản ứng có hai loại - tỏa nhiệt (tỏa nhiệt) và hấp thụ (thu nhiệt). Nhiệt hình thành phân tử - hợp chất từ nguyên tử (nhiệt hình thành phân tử bằng không) - có thể vừa âm (sự hình thành chúng từ các nguyên tố đòi hỏi năng lượng bổ sung) vừa dương. Sự giải phóng nhiệt trong thuốc nổ thường là do phản ứng giữa các thành phần dễ cháy và chất oxy hóa (oxy) là một phần của nó. Nếu thuốc nổ là một hợp chất hóa học riêng lẻ thì chúng sẽ là các nhóm khác nhau trong phân tử, nếu trộn lẫn thì sẽ là các chất khác nhau tạo nên hỗn hợp. Tỷ lệ của chúng quyết định cân bằng oxy của chất. Khi ôxy không đủ để ôxy hoá hoàn toàn thành phần dễ cháy của thuốc nổ, thì cân bằng là âm. Trong các chất có cân bằng oxy dương, một phần oxy vẫn không được sử dụng trong quá trình nổ và bị mất đi một cách vô ích. Các đặc tính của thuốc nổ hỗn hợp có thể được thay đổi bằng cách chọn chất oxy hóa và chất cháy thích hợp.
Cân bằng oxy được định nghĩa là sự thiếu hoặc thừa (tính bằng gam) oxy cần thiết cho quá trình oxy hóa hoặc còn lại trong quá trình oxy hóa 100 g thuốc nổ. Đối với tetranitromethap C (ΝO2) 4 là +49, amoni nitrat ΝH4ΝΟ3 - +20, trotyl С7Н5N3O6 - -74, hexogen (СH2N2) 3 - -21,6. Theo định nghĩa, cân bằng oxy âm cực đại là với hydro (-794), dương cực đại là với oxy (+100).
Một ví dụ về chất nổ có cân bằng oxy âm là TNT, một loại thuốc nổ cao thông thường. Tên hóa học của nó là trinitrotoluene, có tên là tol, TNT. Có thể thấy từ công thức cấu tạo, các thành phần dễ cháy - nguyên tử hydro và cacbon và chất oxy hóa - oxy, là một phần của nhóm nitro (NO2), trong phân tử TNT chưa liên kết với nhau:
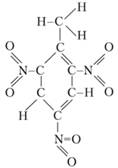
Dựa vào công thức của một chất, người ta có thể cho biết phản ứng sẽ diễn ra theo chiều nào, những sản phẩm nào có thể tạo thành trong trường hợp này. Đối với TNT, phản ứng phân hủy thuốc nổ có dạng sau:
Thành phần của sản phẩm phụ thuộc vào điều kiện nổ và trạng thái cuối cùng của chúng (mức độ giãn nở). Trong nhiều hệ thống nổ, những phản ứng được đặc trưng bởi sự giải phóng năng lượng tối đa là phản ứng đầu tiên được thực hiện. Vì vậy, trong một chất có công thức dạng CaH4McOd, với sự thiếu oxy tương đối nhỏ [ d< (2a + b / 2)], trước hết, phản ứng của hydro với oxy xảy ra, là phản ứng có lợi nhất, vì sự tạo thành H2O giải phóng 255 kJ trên một đơn vị oxy và sự tạo thành CO2 - 187 kJ (nhiệt tạo thành CO2 là 379 kJ / mol).
Cách tiếp cận để tính toán nhiệt chuyển hóa của thuốc nổ, trong đó ghi lại các sản phẩm phản ứng có thể xảy ra, sự hình thành của nó đảm bảo hiệu ứng nhiệt lớn nhất của nó, được gọi là nguyên tắc làm việc cực đại. Việc tính toán ở một mức độ nhất định sẽ lý tưởng hóa quá trình và cho độ chính xác cao nhất đối với các hệ thống có cân bằng oxy dương hoặc hơi âm. Trong thực tế, thành phần của các sản phẩm nổ (EP) thường không tương ứng với cách tính như vậy. Nguyên nhân là do tương tác tiếp tục trong HP một thời gian sau vụ nổ và trạng thái cân bằng được thiết lập giữa các sản phẩm của phản ứng xảy ra với cả hiệu ứng nhiệt dương và âm. Một ví dụ về sau là các phản ứng
Để tính toán gần đúng hệ có cân bằng oxy âm, người ta có thể sử dụng phương pháp Le Chatelier dựa trên nguyên tắc thể tích cực đại, và nếu các thể tích bằng nhau thì phản ứng tỏa nhiệt lớn được ưu tiên. Phương pháp này có giá trị nhất để xác định trạng thái cuối cùng của sản phẩm nổ. Phản ứng chủ yếu là quá trình oxy hóa cacbon thành CO. Nếu oxy được sử dụng ít hơn, thì nó sẽ được tiêu thụ như nhau để oxy hóa thêm CO và H2. Phản ứng phân hủy hexogen trong trường hợp này được viết như sau:
Việc tính toán chính xác hơn các thành phần của sản phẩm nổ được thực hiện có tính đến động học và điều kiện của phản ứng. Độ chính xác của những tính toán này không phải lúc nào cũng đủ do thiếu thông tin đáng tin cậy về trạng thái của vật chất tại nhiệt độ cao và những áp lực. Dữ liệu về nhiệt và thành phần của các sản phẩm nổ cũng được thu thập bằng thực nghiệm, do đó các phương pháp đặc biệt để nghiên cứu vụ nổ đã được phát triển và áp dụng thành công.
Như đã nói, năng lượng của vụ nổ được đặc trưng bởi nhiệt của quá trình biến đổi chất nổ của chất nổ. Biết nhiệt tạo thành các chất ban đầu và sản phẩm nổ và sử dụng định luật Hess (hiệu ứng nhiệt của quá trình không phụ thuộc vào đường chuyển hóa mà phụ thuộc vào trạng thái đầu và trạng thái cuối của các chất), có thể tính được nhiệt lượng và một số thông số khác của vụ nổ. Những tính toán như vậy cũng có thể gặp trong thực hành của một nhà địa vật lý, vì hỗn hợp thuốc nổ và thuốc súng được sử dụng và sẽ được sử dụng với số lượng ngày càng tăng.
Hãy để chúng tôi tính toán một hỗn hợp nổ rẻ tiền của loại igdanite từ amoni nitrat dạng hạt với nhiên liệu lỏng. Để dễ tính toán, thay vì các sản phẩm dầu được sử dụng - dầu mặt trời hoặc dầu hỏa, là một hỗn hợp của các chất - chúng ta lấy benzen (C6H6). Chúng ta hãy xem xét trường hợp khi hỗn hợp nổ được xác định bằng cách xác định các thành phần và cân bằng oxy. Cho hỗn hợp benzen và amoni nitrat phải có số oxi dư là -10, nếu không để oxi hóa hoàn toàn 100 g hỗn hợp thì cần 10 g oxi. Để bắt đầu, chúng tôi xác định thành phần hỗn hợp nên có để đáp ứng nhiệm vụ.
Để đơn giản hóa giải pháp, hãy tưởng tượng rằng thuốc nổ của chúng ta bao gồm hai phần - một trong các thành phần (trong trường hợp đang xem xét là nhiên liệu, vì số dư là âm), được lấy với một lượng cung cấp sự cân bằng mong muốn và một hỗn hợp của các chất đã cho của cân bằng oxy bằng không (chất sau đôi khi được gọi là cân bằng phân tử). Nếu chúng ta thêm một hỗn hợp như vậy vào lượng nhiên liệu đã tính toán, nâng tổng trọng lượng lên 100 g, chúng ta nhận được một chế phẩm có cân bằng oxy cho trước.
Hãy thực hiện các phép tính từng cái một.
Về số oxi hóa của phân tử benzen (khối lượng phân tử của nó là 78)
15 nguyên tử oxy là cần thiết. Theo đó, lượng benzen x 1, quá trình oxy hóa trong đó cần 10 g oxy, chúng tôi thu được từ tỷ lệ "benzen - oxy là cần thiết":
![]()
Thêm vào số này (100 - X 1) g hỗn hợp có cân bằng oxi bằng không, ta được hỗn hợp có thành phần đã cho.
Hãy tiến hành tính hàm lượng các thành phần trong 96,75 g hỗn hợp đo phân tử. Hãy xác định lượng dư oxi trong chất oxi hóa. Saltpeter, phân hủy, giải phóng oxy:
Hơn nữa, 80 g một chất oxi hóa (khối lượng phân tử của amoni nitrat là 80) sẽ giải phóng 16 g oxi. Phản ứng giữa benzen và amoni nitrat trong hỗn hợp cân bằng oxi bằng không được viết là
Sau đó, chúng tôi nhận được tỷ lệ: ![]()
Do đó, 96,75 g hỗn hợp sẽ gồm 5,85 g benzen và 90,85 g amoni nitrat. Do đó, thành phần cuối cùng của hỗn hợp với một cân bằng oxy cho trước và thành phần của các sản phẩm nổ, được tính theo nguyên tắc làm việc tối đa, sẽ là:
Không cần dùng đến tính toán, có thể ghi lại ngay hàm lượng cacbon tự do trong các sản phẩm nổ, vì chính sự hiện diện của nó sẽ xác định cân bằng ôxy âm của hỗn hợp. Vì cần 32 gam oxi để oxi hóa hoàn toàn 12 gam cacbon nên 10 gam oxi có thể oxi hóa a gam cacbon hoặc một phần nhỏ số mol cacbon. Sẽ rất tốt nếu bạn sử dụng những cân nhắc này để kiểm tra tính đúng đắn của các phép tính được thực hiện.
Chuẩn bị một hỗn hợp như vậy rất đơn giản: đúng số lượng Saltpeter phải được trộn với benzen. Có các thành phần ban đầu và biết thành phần của các sản phẩm nổ, dễ dàng tính toán nhiệt nổ của hệ thống. Nhiệt hình thành các thành phần ban đầu và các sản phẩm nổ được tìm thấy trong các sách tham khảo có liên quan. Vì vậy, đối với 1 mol benzen, đó là (tính bằng kJ / mol) -39,1, amoni nitrat - +410,8, CO2 - +444,2, H2O - +271,7.
Hiệu ứng nhiệt của vụ nổ QĐiện tích x trong bài toán có thể được xác định từ phương trình
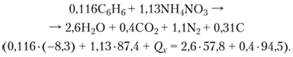 (4.29)
(4.29)
Nó sẽ là 374 kJ / 100 g hỗn hợp, hoặc 3740 kJ / kg.
Có thể tính thể tích sản phẩm ở thể khí (đơn vị là lít) từ phương trình phản ứng nhân số mol khí với 22,4 (thể tích a gam phân tử). Đương nhiên, trong trường hợp này, người ta nên tính đến trạng thái của chất đó. Vì vậy, cacbon (nhiệt độ thăng hoa trên 3700 ° C ở áp suất khí quyển bình thường) sẽ không tạo ra một pha khí, nước, tự nhiên, sẽ là hơi nước. Thể tích của các sản phẩm nổ, quy về điều kiện khí quyển bình thường, được gọi là khối lượng cho trước. Trong bài toán được xem xét ở trên, nó sẽ là khoảng 800 l / kg.
Nếu biết nhiệt và thành phần của các sản phẩm nổ thì nhiệt độ của chúng T vz có thể được xác định từ mối quan hệ T vz == Q / C vcr, ở đâu TỪ v cp là nhiệt dung trung bình của sản phẩm nổ (ở thể tích không đổi) trong khoảng thời gian Τ 0–Τ vz. Điều quan trọng cần lưu ý là nhiệt dung là một hàm của nhiệt độ.
Phần sau giới thiệu một số phức tạp (thuần túy kỹ thuật) vào tính toán, vì dạng của sự phụ thuộc đã được biết đến. Tuy nhiên, sẽ dễ dàng hơn khi sử dụng dữ liệu làm sẵn về hàm lượng nhiệt của các chất khí ở các nhiệt độ khác nhau (Bảng 4.1).
Bảng 4.1
Sự thay đổi nhiệt năng (nội năng) của một số chất khí (kJ / mol)
|
Nhiệt độ, K |
C (than chì) |
||||||
Với nhiệt độ và biết thành phần của các sản phẩm nổ, người ta có thể tìm ra nhiệt lượng của chúng và so sánh với nhiệt của vụ nổ. Việc so sánh sẽ xác định bản chất của sai số được thực hiện trong việc chọn nhiệt độ. Bằng cách lặp lại thao tác, nhưng với nhiệt độ khác (đã hiệu chỉnh), có thể tìm nhiệt độ nổ bằng phương pháp gần đúng.
Cần lưu ý rằng năng lượng giải phóng trong quá trình nổ là tương đối nhỏ: thuốc nổ mạnh nhất có nhiệt lượng khi nổ là 6500-6700 kJ / kg. Khi 1 kg TNT nổ trong không khí, nhiệt lượng được giải phóng khoảng 4000 kJ, và khi đốt cháy 1 kg dầu mặt trời, khoảng 44.000 kJ được giải phóng. Nhưng nhiệt lượng đốt cháy 1 kg hỗn hợp dầu mặt trời với oxy sẽ chỉ là 10.000 kJ, và 1 kg hỗn hợp dầu mặt trời và không khí - 2670 kJ. Người ta đã nhiều lần nhấn mạnh rằng, ngoài việc giải phóng năng lượng, một vụ nổ còn được đặc trưng bởi sự hình thành các sản phẩm ở trạng thái khí ở cùng nhiệt độ đạt được trong vụ nổ.
Mặc dù nhiệt của phản ứng nhiệt
cao hơn khoảng 2,3 lần so với nhiệt phân hủy thuốc nổ TNT, quá trình cháy của nó diễn ra bình tĩnh; các sản phẩm tạo thành, ngay cả ở nhiệt độ mà chúng được đun nóng, vẫn ở dạng lỏng. Nhưng người ta chỉ có thể làm ướt nhiệt điện tử, như hình vẽ thay đổi: nhiệt biến nước thành hơi, và quá trình cháy đi kèm với các quá trình bùng nổ. Trong một vụ nổ, trong thể tích chiếm bởi điện tích, trong quá trình nổ, các chất khí bị nén đến áp suất cực lớn ngay lập tức được hình thành - các sản phẩm phản ứng, đảm bảo thực hiện năng lượng giải phóng dưới dạng công do các chất khí nở ra.
Khi tạo ra một vụ nổ, chúng tôi tự nhiên quan tâm đến thực tế là trong một trăm vụ nổ, năng lượng sẽ được giải phóng nhiều hơn và khí nén có khả năng hiện thực hóa năng lượng theo đúng cách. Đôi khi những yêu cầu này xung đột. Do đó, năng lượng phân hủy thuốc nổ có thể được tăng lên bằng cách lựa chọn chất cháy thích hợp, cụ thể là bằng cách đưa kim loại vào thành phần của thuốc nổ, ví dụ, nhôm (nhiệt tạo thành A12O3 là 1599 kJ / mol). Sản phẩm oxi hóa của nhôm là chất rắn. Việc bổ sung (đến một giới hạn nhất định) nhôm vào thành phần của một số hỗn hợp nổ có thể làm tăng hiệu quả của hỗn hợp sau này. Có những loại thuốc nổ tăng nhiệt khi nổ, có chứa kim loại trong thành phần của chúng. Như đã lưu ý, thành phần của các sản phẩm nổ không chỉ phụ thuộc vào chất nổ mà còn phụ thuộc vào các điều kiện của vụ nổ: phương pháp bắt đầu, kích thước và thiết kế của điện tích và vỏ, và các điều kiện của môi trường trong đó nổ được thực hiện. Nếu các sản phẩm ban đầu không đổi, và thành phần của các sản phẩm nổ thay đổi, thì hiệu ứng nhiệt của vụ nổ cũng sẽ thay đổi, do đó, đối với một số chất nổ, những nghĩa khác nhau nhiệt của vụ nổ tùy thuộc vào điều kiện mà nó được thực hiện. Ví dụ, trong Table. 4.2 cho thấy (theo R. Schmidt) thành phần của các sản phẩm nổ của TNT (mật độ 1,52) khi vụ nổ điện tích được kích thích bởi các chất khơi mào yếu và mạnh.
Để sự chuyển hóa chất nổ do bắt đầu phản ứng hóa học diễn ra nhanh trên toàn bộ điện tích thì quá trình đó phải tự lan truyền. Để làm được điều này, phản ứng hóa học phải có đặc tính động học thích hợp, và sự giải phóng năng lượng phải bù đắp những tổn thất không thể tránh khỏi. Tốc độ phản ứng, khả năng tự truyền, tỏa nhiệt, tạo khí có quan hệ mật thiết với nhau và ảnh hưởng lẫn nhau và là ranh giới của quá trình nổ.
Bảng 4.2
Thành phần của sản phẩm nổ TNT
Trong bảng. 4.3 cho thấy các đặc tính của một số chất nổ và thuốc súng được sử dụng trong ngành công nghiệp.
Bảng 4.3
Đặc điểm nổ của một số loại thuốc nổ
Một chất nổ giải phóng năng lượng trong một vụ nổ do một thể tích nhỏ của chất rắn hoặc chất nổ lỏng biến thành một thể tích khí khổng lồ được nung nóng đến nhiệt độ hàng nghìn độ. Vì các loại khác nhau Thể tích khí nổ trên 1 kg thuốc nổ có thể tích ban đầu không quá 0,8-1 l, từ 300 đến 1000 l trở lên. Các sản phẩm phân hủy ở dạng khí nóng của thuốc nổ được hình thành trong quá trình nổ bắt đầu nở ra, tạo ra công việc cơ khí. Do đó, chất nổ có một kho năng lượng hóa học tiềm ẩn được giải phóng trong một vụ nổ. Tuy nhiên, năng lượng tiềm ẩn không chỉ được sở hữu bởi chất nổ, mà, ví dụ, xăng, than, củi và các chất dễ cháy khác. Năng lượng này của các chất cháy có thể được giải phóng trong quá trình cháy. Vậy tại sao chất nổ và thuốc súng lại được sử dụng cho mục đích hủy diệt và ném, chứ không phải xăng chẳng hạn? Được biết, 1 kg xăng chứa năng lượng gấp 10 lần 1 kg thuốc nổ TNT, và gấp 12 lần bột pyroxylin không khói. Tuy nhiên, chất nổ và thuốc súng biến thành chất khí với tốc độ cực lớn, và xăng hay bất kỳ loại nhiên liệu nào không thể cháy nếu không có đủ không khí hoặc ôxy tự do. Quá trình đốt cháy 1 kg xăng cần bao nhiêu oxi vì nó chứa trong 15,5 kg không khí. Do đó, nhiệt đốt cháy (năng lượng) của nhiên liệu phải được tính trên 1 kg hỗn hợp của nó với lượng ôxy cần thiết để đốt cháy hoàn toàn. Với cách tính này, sự chênh lệch giữa năng lượng đốt cháy hỗn hợp xăng với ôxy và năng lượng của một vụ nổ của một lượng điện tích nổ tương tự nhỏ hơn so với giá trị nêu trên, tuy nhiên, trong trường hợp này, lượng năng lượng giải phóng trong Sự cháy của xăng lớn hơn: bột không khói - 2860 kJ / kg, TNT - 4100 kJ / kg, hỗn hợp xăng với oxy - 11.000 kJ / kg. Do đó, không phải lượng năng lượng chứa trong thuốc nổ và thuốc súng là nguyên nhân chính để chúng được sử dụng cho các mục đích hủy diệt và ném. Lý do chính không phải là lượng năng lượng, mà là sự giải phóng rất nhanh của nó. Nếu đốt cháy 1 kg xăng ở động cơ xe xảy ra (tùy thuộc vào công suất động cơ và tải trọng của nó) trong 10-60 phút, sau đó 1 kg thuốc súng cháy trong buồng nạp của súng pháo trong vài phần nghìn giây, và vụ nổ của 1 kg thuốc nổ TNT chỉ kéo dài 30 -40 phần trăm nghìn giây. Năng lượng trong một vụ nổ được giải phóng nhanh hơn hàng chục triệu lần trong quá trình đốt cháy nhiên liệu. Điều này giải thích sức mạnh to lớn của vụ nổ. Tuy nhiên, đúng hơn là tính toán công suất nổ không phải bằng thời gian phát nổ của cả lần sạc mà tính theo thời gian các sản phẩm nổ vượt mức bình thường. áp suất không khí, việc đạt được mức độ như vậy theo kết quả của các cuộc khảo sát tốc độ cao về quá trình nổ xảy ra trong vòng vài mili giây. Trong trường hợp này, công suất của 1 kg TNT được biểu thị bằng hơn 1 MW. Nhưng ngay cả sức mạnh này trong điều kiện thực tế cũng không thể được thực hiện đầy đủ do thời gian tác dụng ngắn của nó, quán tính của các khối lượng vật liệu bị di chuyển hoặc bị phá hủy mà nó hoạt động, cũng như tổn thất do làm nóng môi trường, do mài quá mức. và lan truyền nó, đối với nhiệt dư trong các sản phẩm nổ sau khi chúng giãn nở cuối cùng và tổn thất hóa học không thể tránh khỏi. Kết quả là, công cơ học hữu ích thường không vượt quá 1-2%, và trong các vụ nổ ở môi trường rắn - 8-9% năng lượng chứa trong thuốc nổ. Tuy nhiên, nguồn năng lượng khổng lồ chứa trong thuốc nổ và thuốc súng khiến chúng trở nên không thể thiếu, dù chúng chưa được sử dụng hết trong vụ nổ. Sức mạnh cao cũng là đặc điểm của thuốc nổ trong trường hợp chúng được sử dụng cho mục đích ném đạn. Công suất của chất nổ do bắn pháo cỡ lớn là 10 MW.
1. Các khái niệm cơ bản của lý thuyết về sự cháy.
1. Đặc điểm của các quá trình cháy.
Quá trình đốt cháy rất phức tạp quá trình vật lý và hóa học, trong đó sự biến đổi hóa học
Quá trình đốt cháy đi kèm với sự giải phóng năng lượng (chủ yếu dưới dạng nhiệt và bức xạ)
và truyền nhiệt và khối lượng với môi trường.
Quá trình đốt cháy dựa trên một phản ứng hóa học có thể tiến hành với sa-
tăng tốc. Các lý do cho sự tự tăng tốc có thể là:
1. Tích tụ nhiệt trong hệ thống - hiện tượng tự gia tốc nhiệt
2. Tích lũy các hạt hoạt động - chuỗi tự gia tốc
3. Quá trình tự thẩm phân là sự tăng tốc của một phản ứng bởi các sản phẩm của nó.
Trong nhiều trường hợp, các quá trình đốt cháy thực tế quan trọng phụ thuộc vào
Các quy luật vật lý, do thực tế là ở nhiệt độ cao, một quá trình biến đổi hóa học có thể diễn ra ở tốc độ cao và quá trình hóa học tuân theo các quy luật vật lý thuần túy, chẳng hạn như truyền nhiệt và khuếch tán và được điều chỉnh bởi chúng. Điều này có nghĩa là một phản ứng hóa học có thể xảy ra với tốc độ cao
do đó, có một tốc độ hạn chế và tuân theo luật của một hoặc khác
hiện tượng địa lí.
Đặc điểm chính của các quá trình đốt cháy là các điều kiện để tự gia tốc
phản ứng hóa học do chính nó tạo ra. Trong điều khiển học, hiện tượng này được gọi là phản hồi tích cực, nghĩa là, với một sự thay đổi nhỏ của điều kiện bên ngoài, sự chuyển đổi từ chế độ tĩnh phản ứng tiến hành với tốc độ thấp so với chế độ, để o-
khi tốc độ phản ứng tăng cấp số nhân. Hiện tượng tương tự Sự thay đổi mạnh mẽ của phương thức phản ứng với một sự thay đổi nhỏ của điều kiện bên ngoài được gọi là
là sự kiện quan trọng và các điều kiện mà chúng được quan sát được gọi là
điều kiện quan trọng.
Các sự kiện quan trọng bao gồm:
1. Tự đánh lửa
2. Đánh lửa
3. Nồng độ giới hạn của sự lan truyền ngọn lửa.
Các hiện tượng quan trọng không xuất phát từ thực tế là các quy luật tự nhiên thay đổi đột ngột, nhưng
là kết quả của sự mất cân bằng giữa hệ thống phản ứng và môi trường
môi trường canh bắp cải.
Điều kiện tự bốc cháy là không thể cân bằng nhiệt hoặc khuếch tán
cân bằng với môi trường, điều kiện bốc cháy là sự vi phạm cân bằng trong các điều kiện ban đầu nhất định.
Đặc điểm thứ hai của các quá trình đốt cháy là khả năng phát tán của chúng
niyu trong không gian. Tại chế độ nhiệt sự lan truyền cháy xảy ra bằng cách truyền nhiệt, trong trường hợp dây chuyền hoặc tự xúc tác - bằng cách khuếch tán các hạt hoạt động.
2. Các dạng và chế độ đốt.
1. Theo trạng thái tổng hợp của những người tham gia:
một. Đốt cháy hệ thống khí đốt- đốt cháy đồng nhất
b. Đốt cháy chất cháy rắn và lỏng (hệ rắn - lỏng và rắn - khí) - cháy không đồng nhất
c. Đốt cháy hệ thống cô đặc (hệ thống rắn-lỏng,
lỏng - lỏng, rắn - lỏng).
2. Theo tốc độ lan truyền của quá trình:
một. Đốt cháy khử hơi - quá trình lan truyền chậm (sử dụng dẫn nhiệt hoặc khuếch tán)
b. Quá trình đốt cháy nổ - sự lan truyền nhanh chóng của quá trình (với
công suất sóng xung kích).
3. Theo điều kiện khí động học:
một. Đốt laminar là một mặt trước ngọn lửa mịn.
b. Đốt hỗn loạn là một ngọn lửa có độ cong cao phía trước.
Các ví dụ các loạiđốt cháy theo trạng thái tổng hợp của những người tham gia:
Đốt cháy đồng nhất:
Đốt cháy các chất hữu cơ trong oxy
CH4 (g) + 2O2 (g) = CO2 (g) + 2H2 O (hơi nước)
Đốt cháy với sự có mặt của các chất oxy hóa thể khí khác
H2 (g) + Cl2 (g) = 2HCl (g)
Sự phân hủy các chất không ổn định (ozon)
2O3 (g) = 3O2 (g)
Đốt cháy không đồng nhất:
Quá trình đốt cháy hydrazine lỏng:
N2 H4 (l.) + O2 (g.) = N2 (g.) + 2H2 O (hơi nước)
Đốt cacbon:
C (s) + O2 (g) = CO2 (g)
Sự phân hủy các chất không ổn định (axetylen)
C2 H2 (g) = 2C (rắn) + H2 (g)
Quá trình đốt cháy hệ thống cô đặc:
KClO3 (s.) + Al (s.) = KCl (s.) + Al2 O3 (s.) 2NH4 NO3 (s.) = 2N2 (g.) + 4H2 O (hơi nước) + O2 (g.)
3. Nhiệt động học của các quá trình cháy. Cân bằng nhiệt.
Nhiệt độ đốt cháy: Thông thường, mô tả các quá trình đốt cháy với bốn chủ đề
nhiệt độ đốt cháy
lý thuyết | T Theor | Nó được xác định bằng nhiệt lượng đo phân tích (tức là |
||
tương ứng với phương trình phản ứng) của hỗn hợp, có tính đến độ nóng và sự phân ly của nó |
||||
sản phẩm cháy mà không tính đến quá trình trao đổi nhiệt với môi trường. |
||||
Nhiệt lượng T Calor - được xác định bằng nhiệt đốt cháy của nhiệt lượng kế |
||||
hỗn hợp có nhiệt độ ban đầu T 0 273K chưa tính đến sự trao đổi nhiệt với môi trường
môi trường sống.
3. Địa ngục Tg đoạn nhiệt - được xác định bằng nhiệt đốt cháy hỗn hợp có thành phần tùy ý mà không tính đến sự trao đổi nhiệt với môi trường.
4. T g thực tế - nhiệt độ thực tế quan sát (đo được) của go-
Mối quan hệ giữa các định nghĩa nhiệt độ cháy khác nhau
Cân bằng nhiệt của các quá trình đốt cháy dựa trên việc xác định nhiệt lượng hấp thụ
sản phẩm đốt cháy. Phương trình cân bằng nhiệt giống như:
Q pgQ pQ ref Q mồ hôi, |
trong đó Q pg là nhiệt do sản phẩm cháy hấp thụ, Q p là nhiệt của phản ứng hóa học,
Q ref - nhiệt lượng nhận được từ các nguồn bên ngoài, Q mồ hôi - nhiệt lượng thất thoát.

đốt cháy. Trong thực tế, sự phân ly của các sản phẩm cháy chỉ đóng góp đáng kể ở nhiệt độ trên 20.000 C.
Phân biệt giữa nhiệt trị cao hơn và nhiệt trị thấp hơn. Trong trường hợp đầu tiên, nước, là sản phẩm của quá trình đốt cháy, được lấy ở dạng lỏng, ở dạng thứ hai - ở dạng hơi. Vì số lượng của bạn
nhiệt phân hạch phụ thuộc vào lượng chất bị đốt cháy, có số mol
bè của quá trình cháy và nhiệt dung riêng của quá trình cháy. Những thứ kia. nhiệt tỏa ra trong quá trình đốt cháy 1
mol hoặc kilôgam chất cháy.
Để tính nhiệt dung riêng của quá trình cháy (tính bằng kJ / kg), người ta thường sử dụng công thức D.I.
Mendeleev
Q tr 339, 4C 1257H 108,9O N S 25 9H W, |
Trong đó X là hàm lượng của nguyên tố trong thành phần của nhiên liệu tính bằng% (khối lượng), W là độ ẩm.
Cách tiếp cận chung để tính toán độ nóng của phản ứng dựa trên nhiệt động lực học hóa học.
do hệ thống thực hiện. Sau đó, từ định luật đầu tiên của nhiệt động lực học (định luật bảo toàn cơ năng
gee) nên | |||
trong đó Q là nhiệt lượng mà hệ nhận được, U là độ thay đổi nội năng, W là công, |
|||
do hệ thống thực hiện. Đối với những thay đổi nhỏ, chúng tôi có | |||
dU - tổng chênh lệch của năng lượng bên trong (không phụ thuộc vào đường dẫn dòng |
|||
quá trình) Q, W - lượng nhiệt và công vô cùng nhỏ, | |||
trường hợp, phụ thuộc vào đường chuyển đổi của hệ thống từ trạng thái này sang trạng thái khác. | |||
Để hệ thống chỉ thực hiện công cơ học là giãn nở. | |||
pdv. | |||
Thay (1.6) thành (1.5) ta được | |||
Với một quá trình đẳng tích V = const dV = 0 và tích phân (1.7), chúng ta thu được | |||
trong quá trình đẳng tích p = const tích hợp (1.7) và các phép biến đổi đơn giản cho
Theo (1.8) và (1.10), trong các quá trình đẳng tích và đẳng tích, nhiệt thu được các đặc tính của một hàm trạng thái, tức là không phụ thuộc vào đường đi của quá trình. Vị trí này được gọi là luật G.I. Hess. Trạng thái đầu và cuối của phản ứng hóa học
phần là chất bắt đầu và sản phẩm của phản ứng. Entanpi của các chất đơn giản, us-
khả năng chống chịu trong điều kiện tiêu chuẩn (298K và 0,10113 MPa) được lấy bằng không. Đối với các chất phức tạp, hãy xem xét sự thay đổi entanpi trong quá trình hình thành chúng từ các nguyên tố.
Ca (rắn) + С (rắn) + 1.5O2 = CaCO3 | |||||||||||||||
Quy tắc tính nhiệt của phản ứng từ entanpi tạo thành các chất tuân theo |
|||||||||||||||
Luật Hess. | |||||||||||||||
hệ số cân bằng của sản phẩm phản ứng và nguyên liệu ban đầu |
|||||||||||||||
tương ứng. Đồng thời, theo quy ước ký hiệu, nếu | 0 thì phản ứng- |
||||||||||||||
tỏa nhiệt (tạo ra nhiệt).
4. Nhiệt dung. Sự phụ thuộc của hiệu ứng nhiệt của phản ứng vào nhiệt độ
Nhiệt dung - chúng gọi là nhiệt lượng cần thiết để đốt nóng một đơn vị
khối lượng của một chất trên 1 K. Có nhiệt dung mol riêng, tức là nhiệt lượng cần thiết để nung nóng 1 kg. Hoặc 1 mol chất trên 1 K.
Nhiệt dung mol thực được xác định như sau
C (1,12) dT
trong đó C là nhiệt dung mol, mol K.
Đối với nhiệt dung ở thể tích và áp suất không đổi (đẳng áp và đẳng áp) với
tính đến (1.8) và (1.10), chúng tôi thu được
; Cp | ||||||

Xét sự phụ thuộc của nhiệt quá trình vào nhiệt độ ở thể tích hoặc áp suất không đổi. Tính đến các phương trình (1.13), chúng tôi thu được
Phương trình (1.14) được gọi là Phương trình Kirchhoff.
Sự thay đổi nhiệt dung trong quá trình phản ứng được xác định bằng biểu thức
tôi Cp, tôi (sản phẩm) | jC p, j (tham chiếu), | ||
những thứ kia. sự khác biệt giữa tổng nhiệt dung của sản phẩm phản ứng và nguyên liệu ban đầu.
Từ phương trình (1.14) suy ra rằng nếu sự thay đổi nhiệt dung trong quá trình phản ứng là
âm (tức là nhiệt dung của các sản phẩm nhỏ hơn nhiệt dung của các chất ban đầu) thì hiệu ứng nhiệt của phản ứng càng âm thì phản ứng càng hiệu suất
đẳng nhiệt.
Để tính toán hiệu ứng nhiệt của quá trình ở T 2 (p = const), Kirchhoff- |
|||||
fa phải được tích hợp. | |||||
CpdT, | |||||
Cần lưu ý rằng trong khoảng nhiệt độ T 1 - T 2 | không nên có quá trình chuyển đổi giai đoạn |
||||
chất dove. | |||||
Thường thì T 1 chọn 298K, sau đó | r H 0 - hiệu ứng nhiệt của phản ứng trong trạm |
||||
trong điều kiện tiêu chuẩn, được tính theo (1.11).
Nhiệt dung của chất thực phụ thuộc vào nhiệt độ một cách phức tạp, do đó
Do đó, các phép gần đúng sau được sử dụng để tích phân phương trình Kirchhoff: | ||||
Bằng không - nhiệt dung của các sản phẩm bằng nhiệt dung của các chất ban đầu, |
||||
những thứ kia. C p 0 và hiệu ứng nhiệt của phản ứng không phụ thuộc vào nhiệt độ. | ||||
Đơn hàng đầu tiên - C p | một const, sau đó | |||
một T2 T1 | ||||
Đốt cháy- Tương tác hóa học xảy ra nhanh của chất cháy với chất oxi hóa, kèm theo đó là sự tỏa ra một lượng nhiệt lớn và phát sáng (ngọn lửa). Sự cháy chỉ có thể xảy ra khi có ba yếu tố: chất cháy, chất oxi hoá và nguồn nhiệt.
nguồn nhiệt(đánh lửa) có thể là ngọn lửa trần, tia lửa, nhiệt nóng lên do ma sát (đai trong bộ truyền động đai), va đập, áp suất. Nguồn nhiệt cũng có thể là điện (đốt nóng vật dẫn, hồ quang), năng lượng hóa học và bức xạ của mặt trời.
Chất oxy hóa là clo, flo, brom. Chất oxy hóa phổ biến nhất là oxy trong khí quyển; quá trình cháy sẽ phụ thuộc vào hàm lượng của nó trong không khí. Nếu có nhiều hơn 14-16% oxy trong không khí, thì quá trình cháy ổn định được quan sát. Khi hàm lượng ôxy nhỏ hơn 14% thì âm ỉ cháy, và khi hàm lượng ôxy nhỏ hơn 8 - 10% thì âm ỉ cũng ngừng.
chất dễ cháy. Chúng có thể là chất khí (amoniac, axetylen, hydro), chất lỏng (xăng, axeton, rượu), chất rắn (than, gỗ). Để chất rắn hoặc chất lỏng có thể bốc cháy, cần phải đốt nóng chúng bằng nguồn nhiệt đến nhiệt độ sao cho giải phóng mạnh các hơi dễ cháy từ bề mặt của chúng. Khi đạt đến một nồng độ nhất định, các hơi này sẽ sáng lên. Các chất khí trong quá trình cháy không thay đổi trạng thái tập hợp của chúng.
Có các kiểu đốt sau: 1) chớp cháy; 2) đánh lửa; 3) tự bốc cháy; 4) sự cháy tự phát; 5) phân rã; 6) vụ nổ.
1. Tốc biến gọi là sự cháy tức thời của hỗn hợp oxy trong không khí với hơi, khí, bụi, không kèm theo sự tạo thành khí nén. Điểm chớp cháy là nhiều nhất nhiệt độ thấp một chất dễ cháy, trong đó hơi hoặc khí được hình thành trên bề mặt của nó có thể bùng phát từ nguồn đánh lửa, nhưng để cháy ổn định sau đó, tốc độ hình thành của chúng là không đủ.
Tùy thuộc vào giá trị của nhiệt độ này, chất lỏng dễ cháy được chia thành:
a) dễ cháy (chất lỏng dễ cháy - xăng, axeton, rượu) - t vsp ≤ + 45 ° С;
b) chất lỏng dễ cháy (GZH - dầu, nhiên liệu điêzen, dầu nhiên liệu) - t vsp> + 45 ° С.
2. Bằng cách đánh lửađược gọi là sự cháy lâu dài ổn định của một chất từ nguồn nhiệt. Nhiệt độ tối thiểu của một chất dễ cháy mà tại đó nó bắt cháy từ nguồn bắt lửa và tiếp tục cháy sau khi loại bỏ chất này được gọi là nhiệt độ bắt lửa. Nó cao hơn điểm chớp cháy.
Nồng độ của các chất dễ cháy trong không khí, tại đó có thể bắt lửa hoặc nổ, nằm trong giới hạn nhất định: thấp hơn - NVP và trên - ERW. Không thể bắt cháy hỗn hợp dễ cháy ở nồng độ dưới NVP (không đủ phân tử của chất dễ cháy trong hỗn hợp) và trên ERW (không đủ phân tử oxy trong hỗn hợp). Sự khác biệt giữa ERW và NWP càng lớn thì chất càng nguy hiểm. Giá trị của các thông số này có thể giảm, ví dụ, khi độ ẩm của hỗn hợp bụi-không khí (DAM) tăng lên, ví dụ hỗn hợp không khí với đường, bột, than cám.
Hãy để chúng tôi đưa ra các ví dụ về các giá trị của NWP và WPW đối với một loạt các chất khí và hơi của chất lỏng:
Axetilen 3,5-82%;
Khí tự nhiên 3,8-19,2%;
Xăng dầu 1-6%;
Cacbon monoxit 12,8-75%.
3.Tự đánh lửa- quá trình bắt lửa của các chất từ nguồn bên ngoài (ngọn lửa, vật nung nóng hoặc nóng đỏ) mà không tiếp xúc trực tiếp với nó ở nhiệt độ bắt lửa. Nhiệt độ này sẽ giảm khi tăng áp suất và đối với hầu hết các loại khí dễ cháy, nó nằm trong khoảng 400-700 ° C, đối với gỗ - 340-400 ° C; than đá - 400-500 ° C. Một ví dụ về tự bốc cháy: đốt nóng và bắt lửa sau đó của gỗ, giấy nằm gần ngọn lửa trần (không tiếp xúc với nó) hoặc các vật nóng (than, mở xoắn ốc lò sưởi).
4. Tự bốc cháy chất xảy ra là kết quả của các phản ứng vật lý, hóa học và sinh học xảy ra trong chính chất (vật liệu) đó, dẫn đến sự cháy trong điều kiện không có nguồn đánh lửa.
Khi lưu trữ một lượng lớn ngũ cốc ướt, cỏ khô, rơm rạ và không đủ thông gió, các quá trình sinh hóa (thối rữa) xảy ra bên trong những vật liệu này với sự tỏa nhiệt. Nhiệt độ của các vật liệu này tăng lên, khối lượng lớn của chúng (xếp, chồng) ngăn cản quá trình tản nhiệt sinh ra ra môi trường, là nguyên nhân gây cháy. Những vật liệu này cần được làm khô trước khi bảo quản. Các loại vải tiếp xúc (áo yếm, vật liệu làm sạch) có chứa vết dầu và chất thành đống mà không có hệ thống thông gió cũng tự bốc cháy. Do đó, áo yếm phải được treo sao cho đảm bảo không khí tiếp cận được tự do, và các giẻ lau dính dầu phải được dọn ra khỏi nơi làm việc một cách kịp thời.
Tùy thuộc vào tốc độ phản ứng, quá trình đốt cháy tiến hành ở dạng âm ỉ(vận tốc vài cm / s), trên thực tế sự đốt cháy(vài m / s) và nổ(vài trăm và hàng nghìn m / s).
5. Nổ- Sự thay đổi đột ngột về trạng thái vật lý và hóa học của một chất dưới tác dụng của nhiệt độ, áp suất cao, thuốc thử hóa học. Trong một vụ nổ, thể tích khí và hơi được tạo thành tăng mạnh, một lượng năng lượng rất lớn được giải phóng, dưới dạng sóng xung kích có khả năng thực hiện công cơ học (phá hủy các công trình, công trình kiến trúc, gây thương tích cho con người).
Quá trình đốt cháy vật liệu có thể hoàn toàn hoặc không hoàn toàn. Đốt cháy hoàn toàn (dư oxi) thì tạo thành sản phẩm không cháy (CO 2 và H 2 O), còn cháy không hoàn toàn (thiếu O 2) thì tạo thành sản phẩm của quá trình oxi hóa không hoàn toàn (CO, ancol, axit). Chúng độc hại và dễ nổ. Vì vậy, khi tổ chức quá trình đốt cháy nhiên liệu (trong lò hơi, lò nung) cần đảm bảo đủ lượng ôxy trong lò.
Chúng ta tiếp tục nói về nền tảng cổ điển hóa học, cần thiết cho bất kỳ bác sĩ pháo hoa hành nghề nào. BA-BẠCH nhắc nhở rằng bất bài học thực tế Pháo hoa là một công việc nguy hiểm nếu nó không dựa trên một lý thuyết chặt chẽ. Chúng tôi khuyến nghị những độc giả coi những gì có thể trở thành cuộc sống của họ nên tham gia một khóa học chính thức, chẳng hạn như tại Viện Nghiên cứu Hóa học Ứng dụng ở Sergiev Posad.
Đề cập đến các hợp chất, chúng tôi chỉ ra rằng lý do chính của chúng là mức độ liên quan của các nguyên tố với nhau. Mặt khác, các nguyên tố vẫn không quan tâm đến sự hiện diện của một số chất và ít nhiều có mong muốn kết hợp mạnh mẽ với những chất khác. Vì vậy, ví dụ, vôi dễ dàng hấp thụ khí clo nặng, tức là kết hợp với nó thành vôi đã khử trùng bằng clo; thủy ngân kết hợp với lưu huỳnh nóng chảy tạo thành một chất màu đỏ tươi nổi tiếng được gọi là "chu sa". Cinnabar (Zinnober) có thể bị phân hủy một lần nữa thành lưu huỳnh và thủy ngân, nếu bạn kết hợp nó với một chất mà một trong các nguyên tố cấu thành (ví dụ, lưu huỳnh) sẽ có lực hút mạnh hơn một đồng chí (tức là thủy ngân), sau đó và yếu tố thứ hai liên kết với một cái gì đó có thể được giải phóng theo cách tương tự nhờ chất thứ tư. Một bản phát hành hoặc bản phát hành như vậy không phải lúc nào cũng hoàn thành, nhưng thường thì bản phát hành một phần là đủ, về mặt lý thuyết có thể tính toán bằng công thức.
Một trong những hậu quả rất phổ biến của ái lực, lặp đi lặp lại ở mỗi bước, là tính chất được gọi là "tính hút ẩm", tức là khả năng bị ướt, ẩm, nếu không - hút ẩm và tạo thành các hợp chất oxy-hydro. Nhiều chất được phân biệt bởi tính chất này, và trong số những chất khác, muối ăn và axit sunfuric, được đặt giữa khung cua sođể rút ra sự ẩm ướt vào chính mình; vôi sống, sủi bọt khi tiếp xúc với nước; gelatin, mà rượu được khử nước, v.v. Đối với pháo hoa, tính hút ẩm là một đặc tính khó chịu cần phải tính đến. Vì vậy, ví dụ, strontian clorua và nitrat, do tính hút ẩm cực cao, không phải lúc nào cũng có thể sử dụng được, mặc dù những chất này có phẩm chất pháo hoa quý; và nói chung, tất cả các tác phẩm phải được bảo vệ cẩn thận khỏi ảnh hưởng của độ ẩm. Nhưng vai trò quan trọng nhất trong hóa học pháo hoa được đóng bởi loại hợp chất gọi là "sự đốt cháy" (Verbrennung, sự đốt cháy).
Theo khái niệm "đốt cháy" hay "đốt cháy" theo nghĩa rộng nhất, hóa học nói chung có nghĩa là mọi sự kết hợp hóa học của hai cơ thể để tạo thành một phần ba; theo nghĩa gần nhất, nó có nghĩa là sự kết hợp của cơ thể với oxy.
Để làm rõ, chúng ta hãy chuyển sang thử nghiệm, như thường lệ. Trộn một lượng mạt sắt với một lượng lưu huỳnh nhất định và đun nóng nhẹ hỗn hợp; thì hỗn hợp này ngay lập tức nóng lên và nhanh chóng tan chảy. Hợp kim thu được theo cách này không còn là lưu huỳnh hoặc sắt: sắt đã cháy với lưu huỳnh, tức là về mặt hóa học kết hợp với nó, và kết quả là một cơ thể mới được hình thành - sắt hoặc lưu huỳnh (tùy thuộc vào ưu thế của một hoặc một thành phần khác) pyrit.
Đun chảy lưu huỳnh trong một cái chén, đun sôi hợp kim và ném những đoạn dây đồng vào đó: sợi dây này sẽ cháy cùng với lưu huỳnh, làm nổi lên một màu đỏ tuyệt vời; kết quả là tạo ra một hợp chất đặc biệt - đồng sunfua, hoặc ánh đồng. Theo cách tương tự, bạn có thể đốt bằng đồng, tức là kết nối với nó nhiều cơ thể: chì, thiếc, kẽm, v.v.
Carbon lưu huỳnh - một chất lỏng không màu, có mùi mạnh, không đóng băng ngay cả ở 48 ° R (Điểm nóng chảy của carbon disulfide (CS 2) \ u003d -112 ° C) - được hình thành từ sự kết hợp của hơi lưu huỳnh với than nóng. Cả hai vật thể chính sẽ cháy, tức là khi kết hợp với nhau, chúng sẽ biến thành chất lỏng.
Sự giống nhau tương tự cũng tồn tại giữa các kim loại (sắt, đồng, kẽm, antimonium, asen, v.v.), ở trạng thái nóng sáng với khí được đề cập trước đó gọi là "clo": sắt, đồng, kẽm, v.v. Đốt cháy với clo thành clorua sắt, clorua đồng, clorua kẽm, clorua chì, ... vừa phát nhiệt mạnh vừa phát ra ánh sáng đặc biệt. Lưu huỳnh nóng chảy khi tiếp xúc với khí clo cháy với ngọn lửa màu xanh lam và biến thành lưu huỳnh clorua; antimon nghiền nhỏ hoặc asen mịn, được đặt trong một bình chứa đầy clo, tự bốc cháy và kết hợp thành asen clorua hoặc antimon clorua.
Trong cả hai trường hợp, do những điểm giống nhau, các vật thể khác nhau đã được kết hợp, bây giờ với lưu huỳnh, bây giờ với clo, và nhiệt và ánh sáng được giải phóng.
Trong những điều kiện hoàn toàn giống nhau, các hợp chất của các cơ thể khác nhau được tạo thành với một loại khí khác nhau - oxy.
Nối bình chưng cất (bình chưng cất thủy tinh) trong đó thủy ngân được đặt vào bên trong của một chiếc chuông thủy tinh, được bịt kín không cho không khí bên ngoài vào. Đun nóng thủy ngân gần như đến điểm sôi: thủy ngân sẽ không cháy, nhưng sẽ mất cả ánh kim loại và màu bạc trước đây của nó, và trạng thái lỏng nhỏ giọt của nó - nó sẽ biến thành bột màu đỏ, liên quan đến kim loại cũ trong cùng cách than với gỗ. Nếu trước khi bắt đầu thí nghiệm, bạn đã cân chính xác cả thủy ngân và không khí chứa dưới nắp, và bây giờ cân lại cả hai, thì kết quả là thiếu khối lượng trong không khí và dư trong bột. , và nhiều như vậy.. Ví dụ, nếu không khí dưới mui xe nặng đúng 1000 gam, thì bây giờ nó chỉ nặng 767 gam; nhưng khối bột nặng hơn thủy ngân 233 gam. Bây giờ hãy làm thí nghiệm ngược lại: cho bột vào một bình vặn nhỏ được nối với một chai thủy tinh chứa đầy nước. Đun nóng phần phản ứng trên lửa cồn mạnh: bột sẽ chuyển thành hơi, khi đi qua nước sẽ chia thành hai phần: thành kết tủa kim loại gồm thủy ngân lỏng nguyên chất và khí oxi thu được trong một ống hình trụ.
Tương tự như ái lực với thủy ngân nóng, oxy cũng cho thấy mối quan hệ với sắt nóng hoặc đồng nóng chảy: trong quá trình tiếp xúc với không khí, các kim loại này được tham gia tẩm trên bề mặt với oxy có trong không khí và tạo thành đồng hoặc cặn sắt (xỉ), tức là. . sắt hoặc đồng "oxit" (hợp chất với oxy), đồng thời phóng ra tia lửa sáng màu.
Trong tất cả những trường hợp này, cùng một hiện tượng xảy ra: sự kết hợp với oxy, hay sự oxy hóa (sự oxy hóa) của các vật thể này - không chỉ dưới ảnh hưởng của nhiệt, mà còn với sự giải phóng nhiệt và ánh sáng, tức là nhiệt và ánh sáng. cái thường được gọi là "đốt cháy" là một tác dụng phụ, một hậu quả trực tiếp, hay đúng hơn là một biểu hiện mạnh mẽ, mà người xưa coi là một yếu tố đặc biệt, nguyên lý mà họ gọi là "phlogiston".
Nhưng quá trình oxy hóa có thể xảy ra không chỉ khi không có sự trung gian của lửa, mà thậm chí không có sự tỏa nhiệt đáng chú ý: nếu sắt tiếp xúc với không khí thì nó sẽ bị gỉ. Vết gỉ này không là gì ngoài sản phẩm của quá trình oxy hóa, cụ thể là oxit sắt hoặc sắt bị cháy.
Quá trình cháy vẫn diễn ra mà không có sự giải phóng nhiệt đáng kể chỉ vì quá trình oxy hóa diễn ra rất chậm. Quá trình oxy hóa của cây có phần dễ nhận thấy hơn: những cây thối rữa phát sáng trong bóng tối; nếu bạn đặt tay của bạn vào một đống thối rữa, bạn cảm thấy ấm áp; đống tự giảm dần từng ngày; nói cách khác, cây từ từ cháy (âm ỉ) trong không khí.
Dòng vào thậm chí còn đáng chú ý hơn không khí trong lành trong quá trình âm ỉ: nếu một luồng không khí được thổi vào than nóng hoặc củi từ từ cháy âm ỉ (ví dụ, với một chiếc lông thổi phồng), thì ngay lập tức ngọn lửa sẽ xuất hiện. Quá trình này diễn ra như sau: gỗ chứa hai chất dễ cháy - cacbon và hydro; chất đầu tiên kết hợp với oxy và khi đốt cháy, biến thành carbon dioxide, hoặc carbon dioxide, và chất thứ hai thành oxy hoặc nước.
Không tí nào vật liệu dễ cháy, Trong Cuộc sống hàng ngàyđược gọi là nhiên liệu hoặc vật liệu chiếu sáng, cháy theo các quy tắc tương tự. Ví dụ, mỡ lợn và bơ có thành phần chủ yếu là cacbon và hydro; cả hai đều có ái lực đáng kể với oxy và toàn bộ quá trình đốt cháy, tức là Quá trình oxy hóa bao gồm thực tế là oxy phân hủy một chất dễ cháy thành các bộ phận thành phần của nó và kết hợp với từng chất riêng biệt.
Chính xác thì quá trình oxy hóa cũng xảy ra trong cơ thể động vật: các bộ phận chứa nitơ (chất béo) của cơ thể bị oxy hóa, hoặc bị đốt cháy, do tiếp xúc với oxy, chất dẫn của nó là máu, và hậu quả là hơi ấm của động vật.
Nhưng cũng giống như quá trình oxy hóa có thể rất chậm, nó có thể cực kỳ nhanh và mạnh mẽ. Ví dụ như phốt pho đỏ, nằm trên ngoài trời, không chỉ âm ỉ và phát sáng, mà còn được đổ vào Với số lượng lớn, tan chảy từ từ và cuối cùng bốc cháy (tự bốc cháy). Bột nhỏ nhất của sắt tinh khiết về mặt hóa học bốc cháy khi tiếp xúc với không khí bên ngoài. Cuối cùng, kim loại natri, ngay khi đi vào nước, ngay lập tức bị phân hủy thành các phần cấu tạo của nó để hấp thụ oxy có trong nước, và hơn nữa, nhiệt lượng sinh ra mạnh đến mức có thể đốt cháy một khí khác, hydro, được giải phóng. bởi sự kết hợp của natri với oxy. Vì vậy, hydro bốc cháy với ngọn lửa không màu và, tái kết hợp với oxy trong khí quyển, lại biến thành nước. Do đó, natri được tìm thấy trong dầu khoáng, tại vì dầu này là một hợp chất hydrocacbon không chứa oxy.
Từ những điều trên, có thể rút ra một số kết luận mạnh mẽ:
- Cái mà chúng ta gọi là quá trình đốt cháy trong cuộc sống hàng ngày, tức là sự xuất hiện của ngọn lửa, ánh sáng và nhiệt, đòi hỏi sự hiện diện của hai thể: vật liệu cháy và oxy.
- Bản thân quá trình đốt cháy, trước hết, trong quá trình phân hủy vật liệu dễ cháy với việc giải phóng những phần đó kết hợp với oxy, và thứ hai, trong chính quá trình kết hợp này, tức là trong quá trình oxy hóa. Sản phẩm của quá trình oxy hóa các chất cháy với nhiệt độ vừa đủ chủ yếu là sự chuyển hóa các chất này thành axit cacbonic và nước.
- Tại vì trong tự nhiên, oxy không bao giờ được tìm thấy ở dạng riêng biệt, sau đó khi kết hợp, một vật liệu dễ cháy sẽ chiết xuất nó từ khí quyển, từ nước, hoặc từ bất kỳ cơ thể phức tạp nào khác có chứa oxy; Theo quan điểm này, các cơ thể giải phóng oxy được gọi là chất oxy hóa, các cơ thể bị oxy hóa được gọi là bazơ, và các chất gây ra hoặc tăng cường giải phóng oxy được gọi là chất phân hủy. Thành phần của các chế phẩm pháo hoa và hỗn hợp pháo hoa thường bao gồm các đại diện của mỗi nhóm trong số ba nhóm này, nhưng vẫn có ngoại lệ: trong một số trường hợp nhất định, một bazơ và một chất oxy hóa (ví dụ, nhôm với thuốc tím) là đủ; trong những trường hợp khác, tuy nhiên rất hiếm, chỉ có bazơ, nếu nó được cung cấp đủ oxy (ví dụ, magiê, lycopodium, v.v.).
- Nếu không có sự tham gia của chất oxi hóa, bazơ không cháy, nhưng nếu thêm một chất vào nó có thể kết hợp với bazơ và phân hủy nó, thì hỗn hợp trở nên dễ cháy. Các bazơ như vậy, bản thân chúng không dễ cháy, là: kẽm, natri, chì, bari, kali, stronti, clo và muối nitrat, v.v. Các tạp chất dễ cháy góp phần phân hủy bazơ là: lưu huỳnh, than, bồ hóng, đường, tinh bột, dextrin, shellac, gummilac, mỡ lợn, v.v. Một ví dụ là Saltpeter (kali nitrat): tự nó, Saltpeter không cháy, nhưng nếu bạn trộn nó với lưu huỳnh, bạn sẽ có một hỗn hợp dễ cháy, bởi vì. lưu huỳnh phân hủy muối và lấy đi oxy từ nó, sau đó nó kết hợp thành axit lưu huỳnh. Điều tương tự cũng được quan sát thấy khi lưu huỳnh được kết hợp với muối của Bertolet (Kali cliloricum) hoặc với thuốc tím (Kali hypemanganiucum). Nếu chế phẩm được hình thành từ than đá, bồ hóng hoặc xenluloza làm cơ sở với hỗn hợp lưu huỳnh và chất tạo muối, thì chất khử muối đóng vai trò là chất oxy hóa và lưu huỳnh là chất phân hủy. Quá trình này diễn ra như sau: than đá phân hủy muối, kết hợp với ôxy của axit nitric của nó, ôxy và than kết hợp thành axit cacbonic ở thể khí, và nitơ được giải phóng. Lưu huỳnh thúc đẩy quá trình phân hủy, và quan trọng nhất, ngăn cản sự kết hợp của axit cacbonic với kali: cùng một hợp chất sẽ tạo thành một thể rắn - bồ tạt. Nếu không có sự hiện diện của lưu huỳnh, một nửa lượng axit cacbonic sẽ chuyển thành một hợp chất rắn.
- Nếu không có sự hiện diện của oxy, quá trình đốt cháy là không thể tưởng tượng được, vì vậy natri được lưu trữ dưới dầu hỏa không cháy; phốt pho, được đốt cháy dưới một cái chuông kín, bay ra ngoài khi nguồn cung cấp ôxy sẵn có bị cạn kiệt (khoảng 1/5 tổng hàm lượng không khí dưới chuông); động vật được đặt trong “Dog Grotto” chứa đầy khí carbon gây ngạt thở và. vân vân.
Nhưng mặc dù không khí trong khí quyển đóng vai trò là nguồn cung cấp oxy chính trong cuộc sống hàng ngày, nhưng hóa học chỉ ra một số tác nhân oxy hóa khác, qua đó quá trình đốt cháy có thể đạt được cả dưới nước và trong không gian - hoàn toàn không có không khí hoặc được tạo ra bởi các khí không có một nguyên tử oxy. Các chất oxy hóa như vậy, có khả năng giải phóng đủ oxy để đốt cháy hoàn toàn chế phẩm mà không có sự tham gia của không khí trong khí quyển, là muối ăn, muối bartholit, và một số chất khác đã được đề cập. Ví dụ, nhờ có muối tiêu, thuốc súng có được khả năng cháy trong họng súng hoặc đại bác mà không cần sự tham gia của không khí trong khí quyển; Quá trình đốt cháy dưới nước có thể hình dung được với điều kiện tạp chất có chứa chất oxy hóa đủ mạnh để không chỉ đốt cháy hoàn toàn chế phẩm mà còn duy trì nhiệt độ ở độ cao cần thiết trong quá trình đốt cháy dưới nước.
Dựa trên những điều đã đề cập ở trên, chúng tôi lưu ý rằng sự chuyển hóa các chất dễ cháy (ví dụ, nhiên liệu) thành khí ở nhiệt độ đủ cao có thể diễn ra trong bốn điều kiện: khí đốt); b) đun nóng với sự có mặt của oxy liên kết hóa học (H 2 O, CO 2): khí nước; c) với nguồn cung cấp hạn chế oxy tự do (không khí): khí sản xuất; d) có đủ không khí tiếp cận (hộp cứu hỏa thông thường) hoặc cung cấp oxy tăng lên (gió lùa). - Quá trình oxy hóa diễn ra càng mạnh và ái lực hóa học của bazơ với chất oxy hóa và chất phân hủy càng gần thì sự biểu hiện của ánh sáng và nhiệt càng mạnh và nhanh hơn. Một trường hợp khác đã được lưu ý ở trên: trong một số trường hợp khác, xảy ra quá trình oxy hóa tùy tiện (cháy âm ỉ, rỉ sét, tự cháy), trong khi một số trường hợp khác cần tăng nhiệt độ (nung nóng vật thể) đến một định mức nhất định để gây ra sự kết hợp (oxy hóa kim loại nóng, sự kết hợp của chúng với clo và lưu huỳnh, đốt nến, củi, đèn, dầu hỏa, đốt thuốc súng, v.v.).
Ngoài ra: quá trình tiếp theo của quá trình có thể được thực hiện nhanh hoặc chậm.
Do đó, phải phân biệt hai đặc tính khác nhau về tính nhạy cảm của vật liệu dễ cháy (tức là đối với biểu hiện bên ngoài của quá trình oxy hóa): tính dễ cháy và tính dễ bắt lửa. Đầu tiên cho biết nhiệt độ mà tại đó xảy ra quá trình đánh lửa (bắt đầu quá trình oxy hóa), và thứ hai cho biết tốc độ của chính quá trình oxy hóa. Đối với một thợ bắn pháo hoa, cần phải biết chính xác cả cái này và cái kia, bởi vì ước tính hóa học của các chế phẩm phụ thuộc hoàn toàn vào kiến thức về điều này, cả về khả năng bắt lửa của chúng, cũng như liên quan đến cường độ ánh sáng và thời gian. của đốt.
Về các hiện tượng hóa học do nhiệt gây ra, Rudolf Wagner lưu ý như sau: “Khoa học về các hiện tượng nhiệt trong sự kết hợp và phân hủy hóa học,“ nhiệt hóa học ”, vẫn còn lâu mới có thể giải thích được sự phân hủy và các phương pháp điều chế khác nhau trong các ngành công nghiệp hóa chất, nhưng giờ đây nó đã đưa ra các dấu hiệu về xác suất tương đối lớn hơn hoặc thấp hơn và tính khả thi của các phản ứng hóa học, vì Nói chung, các hợp chất được tạo thành với sự biến đổi của nhiệt là dễ thu được nhất, trong khi phản ứng xảy ra với sự hấp thụ nhiệt trong hầu hết các trường hợp lại khó hơn nhiều.
Một đơn vị nhiệt là lượng cần thiết để làm ấm một đơn vị trọng lượng của nước từ 0 đến 1 độ C. Theo hệ thập phân, đơn vị đo khối lượng là gam (cm 3); đơn vị hóa học của nhiệt được gọi là "calo" được biểu thị bằng ký hiệu "cal" và 1000 calo bằng ký hiệu "Cal". Kí hiệu "K" (kg) biểu thị nhiệt lượng thoát ra của 1 g nước khi nó được làm lạnh từ điểm sôi đến điểm đóng băng. Nhiệt lượng tương đương cơ học là 425 kg / m.
Hiệu ứng và sản phẩm đốt cháy
Không tồn tại sự cháy hoàn toàn: những phần của thành phần dễ cháy chưa chuyển thành khí sẽ tạo thành khói hoặc trầm tích. Khói không gì khác hơn là vật chất không cháy, được giảm thành bụi tốt nhất và được dòng không khí mang đi. Trong số những thứ khác, cơ thể như vậy là bồ hóng (tàn tích của một cái cây chưa cháy), bồ hóng (tàn tích của một cơ thể béo chưa được đốt cháy), khói ống khói than (treo hàng nghìn pound trên các thị trấn nhà máy và hiện nay được toàn xã hội khai thác), v.v. Kết tủa thường tạo thành không chỉ không cháy mà còn tạo thành hợp chất hóa học chống cháy (chịu lửa).
Do đó, nhiệm vụ tiếp theo pháo hoa bao gồm việc hoàn thành các chế phẩm như vậy sẽ cháy với lượng khói và trầm tích ít nhất có thể.

Sự cháy làm cho lửa xuất hiện dưới dạng ngọn lửa hoặc tia lửa; ngọn lửa của các chất khí tự nó hoàn toàn không tỏa sáng (ví dụ, cháy hydro khi nhúng natri vào nước); ánh sáng và màu sắc của nó là do sự hiện diện của các vật thể dày đặc hơn trong ngọn lửa. Vì vậy, ví dụ, ánh sáng màu vàng của khí thắp sáng xuất phát từ thực tế là khí này bao gồm hydro và carbon; hydro có sức oxy hóa lớn hơn carbon và cháy nhanh hơn và hoàn hảo hơn, và carbon, tích tụ dư thừa trong ngọn lửa, tạo ra ánh sáng và màu vàng của ngọn lửa. Do đó, để tìm xem ngọn lửa nào đang bốc khói, đủ dính ở giữa, nơi ít thoáng nhất, dị vật nào: thì ngay lập tức nó sẽ được phủ một lớp muội than.
Những gì chính xác cơ thể rắn cho ngọn lửa sáng, chứng minh điều sau: trong tất cả các vật thể hiện có, hiđro tỏa nhiệt lớn nhất trong quá trình cháy, vì. làm tan chảy cả bạch kim và tinh thể đá; nhưng ngọn lửa của nó cực kỳ nhạt, trong khi chỉ có khí - hydro và hơi nước - đóng vai trò là các nguyên tố ôxy hóa, nhưng ngay khi một hỗn hợp của bất kỳ chất đậm đặc nào (ví dụ, sắt, than, đá cẩm thạch) xuất hiện, một ánh sáng chói lóa (ánh sáng Drummond) thu được.
Cường độ ánh sáng phụ thuộc trực tiếp vào năng lượng của quá trình oxy hóa: càng mạnh thì nhiệt độ cháy càng cao, và do đó, quá trình đốt cháy các tạp chất rắn càng mạnh. Vì vậy, ví dụ như lửa cồn, đốt khí đốt với hỗn hợp không khí đun nóng, và cuối cùng, đầu đốt chạy xăng Unica cho ngọn lửa rất nhạt, nhưng có thể cho một lượng ánh sáng đáng kể qua một số tạp chất: bóng đèn điện có màu vàng, ánh sáng yếu hơn, và đèn điện - màu trắng, sáng chói, vì trong trường hợp thứ nhất, lực căng điện ít năng lượng hơn so với trường hợp thứ hai.
Mối quan tâm đặc biệt là đầu đốt Auer, hiện nay không chỉ được sử dụng để thắp sáng khí đốt, mà còn dùng cho xăng, rượu, axetylen và các nguồn chiếu sáng khác: những đầu đốt này, bao gồm hỗn hợp các thân chịu lửa, biến ánh sáng yếu của nguồn nhiệt mạnh thành ánh sáng sáng, xanh lục hoặc hơi xanh Ánh sáng trắng.
Để tăng cường độ sáng của ánh sáng và tăng ngọn lửa trong chế phẩm pháo hoa, người ta sử dụng antimon, than đá và các chất khác.
Màu của ngọn lửa không đến từ chính các tạp chất, mà hoàn toàn từ các khí được hình thành do quá trình đốt cháy các tạp chất này; các chất khí đi vào ngọn lửa và tạo cho ngọn lửa có màu trắng, vàng, đỏ, lục, lam, tím với nhiều sắc độ khác nhau. Các tạp chất như vậy là muối của natri, đồng, chì, bari, stronti, antimonium, v.v. Vì vậy, ví dụ, lưu huỳnh trộn với muối tiêu trong quá trình đốt cháy tạo ra một màu không xác định, và khi có mặt của antimon - màu trắng; nếu bari nitrat được thêm vào hỗn hợp muối bari và lưu huỳnh, thì chúng ta nhận được màu xanh lục vân vân.
Tạp chất tạo màu bao gồm hầu hết các hợp chất kim loại, nhưng bản thân sơn không phụ thuộc vào kim loại mà còn phụ thuộc vào các chất phi kim loại liên kết với nó. Điều này được chứng minh rõ ràng nhất qua thí nghiệm sau đây với đồng. Đồng, như đã đề cập, cháy trong khí sunfurơ với ngọn lửa đỏ và biến thành đồng sunfua. Nếu đốt đồng với một lượng nhỏ lưu huỳnh trong oxi, ngọn lửa màu tím được tạo thành. Nếu thay vì lưu huỳnh, người ta thêm một carbohydrate rắn (shellac, đường, v.v.) vào đồng, thì ngọn lửa sẽ có màu xanh lục.
Đun nóng một nhúm cỏ roi ngựa (Grunspan) hoặc muối sulfuric với ngọn lửa của ống thổi cồn: dưới ảnh hưởng của khí cồn, ngọn lửa màu xanh lục sáng được hình thành. Thêm một ít calomel hoặc amoniac vào cùng một chất: bạn sẽ có ngọn lửa màu xanh lam sáng, bởi vì đồng kết hợp với clo được giải phóng và khi đốt cháy, tạo thành đồng clorua (Chlorkupfer). Đồng clorua dưới tác dụng của ngọn lửa cồn cháy với ngọn lửa màu xanh lục, vì hiđro của lửa cồn lấy đi clo ra khỏi đồng và làm cho nó mất tác dụng liên quan đến màu của ngọn lửa (CuCl 2 + 2H-2HCl + Cu). Nếu đốt cháy đồng oxit (Kupferoxyd, CuO) trong ngọn lửa cồn thì lõi và đáy ngọn lửa sẽ có màu trắng, mép và đầu lưỡi có màu xanh lam. Điều này được giải thích là do ngọn lửa hydro đầu tiên khử oxit đồng (CuO + 2H = Cu + H 2 O), sau đó khả năng tạo màu của đồng lại xuất hiện ở vỏ ngoài của ngọn lửa dưới tác dụng của khả năng oxi hóa của vỏ và nhiệt độ rất cao chứa trong nó.
Để tăng cường "độ dày" của màu, người ta sử dụng calomel, amoniac, mastic, shellac, v.v.
Tốc độ cháy của chế phẩm phụ thuộc chủ yếu vào:
- từ mối quan hệ hóa học giữa các nguyên tố bazơ và các chất phân hủy, tk. mức độ phân hủy và do đó, khả năng bắt cháy của bazơ phụ thuộc vào mức độ của mối quan hệ này;
- từ tỷ lệ tổng hợp, bởi vì đối với mỗi hỗn hợp, có một giới hạn cực hạn, khi đạt đến sự phân hủy nhanh nhất và hoàn toàn nhất của bazơ, trong khi nằm ngoài giới hạn này, tức là trước nó hoặc sau nó, kết quả tồi tệ nhất thu được - một giới hạn như vậy được gọi là "chuẩn mực";
- về độ cao nhiệt độ phát triển bởi quá trình đốt cháy;
- về mật độ và độ đồng đều của chế phẩm;
- từ ảnh hưởng hóa học tạp chất, tức là các yếu tố phụ kiện;
- từ độ ẩm không khí và độ hút ẩm của chế phẩm;
- từ nhiệt độ bên ngoài;
- cuối cùng, từ toàn bộ một loạt các nguyên nhân nhỏ và lớn, chính hoặc phụ, mỗi nguyên nhân đều có phần ảnh hưởng của riêng mình đối với quy trình chungđốt thuốc.
Xác định tốc độ cháy là một trong những nhiệm vụ quan trọng nhất của nghệ thuật bắn pháo hoa, bởi vì. kết nối với nó là câu hỏi về sự tăng cường hoặc chậm lại tùy ý của ngọn lửa, do đó, ở những nơi có liên quan, quy chuẩn được đặc biệt chú ý.






