Ovisnost tlaka zasićene pare o temperaturi. Vrenje - Hipermarket znanja. Isparavanje Isparavanje čvrstih tvari
Stanja materije Željezna para i čvrsti zrak
Nije li to čudna kombinacija riječi? No, to uopće nije besmislica: i željezna para i čvrsti zrak postoje u prirodi, ali ne u uobičajenim uvjetima.
O kakvim uvjetima govorimo? Agregatno stanje određuju dvije okolnosti: temperatura i tlak.
Naš se život odvija u relativno malo promjenjivim uvjetima. Tlak zraka varira unutar nekoliko postotaka oko jedne atmosfere; temperatura zraka, recimo, u moskovskom području leži u rasponu od -30 do + 30 ° C; u apsolutnoj temperaturnoj ljestvici, u kojoj se najniža moguća temperatura (-273 °C) uzima kao nula; ovaj će interval izgledati manje impresivno: 240-300 K, što je također samo ±10% prosječne vrijednosti.
Sasvim je prirodno da smo navikli na te uobičajene uvjete, pa stoga, kada kažemo jednostavne istine poput: "željezo je čvrsta tvar, zrak je plin" itd., zaboravimo dodati: "u normalnim uvjetima".
Ako se željezo zagrijava, prvo se topi, a zatim isparava. Ako se zrak ohladi, prvo će se pretvoriti u tekućinu, a zatim skrutiti.
Čak i ako se čitatelj nikad nije susreo s parama željeza i krutim zrakom, vjerojatno će lako povjerovati da se svaka tvar, promjenom temperature, može dobiti u krutom, tekućem i plinovitom stanju, ili, kako se kaže, u krutom, tekućem odnosno plinovite faze.
U to je lako povjerovati jer jednu tvar, bez koje bi život na Zemlji bio nemoguć, svi su promatrali i u obliku plina, i kao tekućinu, i u obliku čvrstog tijela. Naravno, govorimo o vodi.
Koji su uvjeti pod kojima tvar prelazi iz jednog agregatnog stanja u drugo?
Ključanje
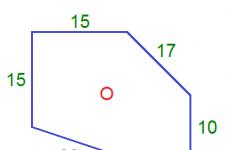
Spustimo li termometar u vodu koja je ulivena u kuhalo za vodu, uključimo električni štednjak i pratimo živu na termometru, vidjet ćemo sljedeće: gotovo odmah će se razina žive podići. Već je 90, 95, konačno 100°C. Voda proključa, a ujedno prestaje dizanje žive. Voda je ključala mnogo minuta, ali se razina žive ne mijenja. Sve dok sva voda ne prokuha, temperatura se neće promijeniti (slika 4.1).
Riža. 4.1
Kamo odlazi toplina ako se temperatura vode ne mijenja? Odgovor je očit. Proces pretvaranja vode u paru zahtijeva energiju.
Usporedimo energiju grama vode i grama pare koja iz nje nastaje. Molekule pare udaljenije su jedna od druge od molekula vode. Jasno je da će se zbog toga potencijalna energija vode razlikovati od potencijalne energije pare.
Potencijalna energija privučenih čestica opada kako se približavaju jedna drugoj. Stoga je energija pare veća od energije vode, a za pretvaranje vode u paru potrebna je energija. Ovaj višak energije električni štednjak prenosi na kipuću vodu u kuhalu za vodu.
Energija potrebna za pretvaranje vode u paru; zove toplina isparavanja. Potrebno je 539 kalorija da se 1 g vode pretvori u paru (ovo je brojka za temperaturu od 100°C).
Ako 539 cal ide na 1 g, tada će se 18 * 539 \u003d 9700 cal potrošiti na 1 mol vode. Ova količina topline mora se potrošiti za kidanje međumolekulskih veza.
Ovu brojku možete usporediti s količinom rada potrebnom za kidanje intramolekularnih veza. Da bi se 1 mol vodene pare rastavio na atome, potrebno je oko 220 000 kalorija, odnosno 25 puta više energije. Ovo izravno dokazuje slabost sila koje vežu molekule jedne za druge, u usporedbi sa silama koje privlače atome zajedno u molekulu.
Temperatura vrenja prema tlaku
Vrelište vode je 100°C; Moglo bi se pomisliti da je ovo svojstvo vode, da će voda, gdje god i pod kojim uvjetima bila, uvijek ključati na 100 °C.
Ali to nije tako i to dobro znaju stanovnici visokoplaninskih sela.
U blizini vrha Elbrusa nalazi se kuća za turiste i znanstvena stanica. Početnici se ponekad pitaju "kako je teško skuhati jaje u kipućoj vodi" ili "zašto kipuća voda ne gori". Pod tim uvjetima, rečeno im je da voda ključa na vrhu Elbrusa već na 82°C.
Što je ovdje? Koji fizikalni faktor ometa pojavu vrenja? Koje je značenje nadmorske visine?
Ovaj fizički faktor je pritisak koji djeluje na površinu tekućine. Ne morate se penjati na vrh planine da provjerite valjanost onoga što je rečeno.
Stavljanjem zagrijane vode ispod zvona i upumpavanjem zraka u ili iz njega, može se uvjeriti da vrelište raste s povećanjem tlaka i pada s smanjenjem tlaka.
Voda ključa na 100°C samo pri određenom tlaku - 760 mm Hg. Umjetnost. (ili 1 atm).
Krivulja vrelišta u odnosu na tlak prikazana je na sl. 4.2. Na vrhu Elbrusa tlak je 0,5 atm, a taj tlak odgovara vrelištu od 82 ° C.

Riža. 4.2
Ali voda koja ključa na 10-15 mm Hg. Art., Možete se osvježiti po vrućem vremenu. Pri tom će tlaku vrelište pasti na 10-15°C.
Možete dobiti čak i "kipuću vodu", koja ima temperaturu vode koja se smrzava. Da biste to učinili, morat ćete smanjiti tlak na 4,6 mm Hg. Umjetnost.
Zanimljiva slika može se vidjeti ako stavite otvorenu posudu s vodom ispod zvona i ispumpate zrak. Pumpanjem će voda prokuhati, ali za kuhanje je potrebna toplina. Nema se odakle uzeti, a voda će se morati odreći svoje energije. Temperatura kipuće vode počet će padati, ali kako se pumpanje nastavlja, tako će padati i tlak. Stoga vrenje neće prestati, voda će se nastaviti hladiti i na kraju smrznuti.
Takvo ključanje hladne vode događa se ne samo kada se zrak ispumpava. Na primjer, kada se brodski propeler okreće, tlak u sloju vode koji se brzo kreće u blizini metalne površine naglo pada i voda u tom sloju vrije, tj. u njemu se pojavljuju brojni mjehurići ispunjeni parom. Ova pojava naziva se kavitacija (od latinske riječi cavitas - šupljina).
Smanjenjem tlaka snižavamo vrelište. Što je s povećanjem? Grafikon poput našeg odgovara na ovo pitanje. Tlak od 15 atm može odgoditi ključanje vode, ono će početi tek na 200°C, a pritisak od 80 atm će dovesti do ključanja vode tek na 300°C.
Dakle, određeni vanjski tlak odgovara određenom vrelištu. No, ova se tvrdnja također može "okrenuti", govoreći ovo: svaka točka ključanja vode odgovara vlastitom specifičnom tlaku. Taj se tlak naziva tlakom pare.
Krivulja koja prikazuje vrelište kao funkciju tlaka također je krivulja tlaka pare kao funkcija temperature.
Brojke iscrtane na grafu vrelišta (ili grafu tlaka pare) pokazuju da se tlak pare vrlo brzo mijenja s temperaturom. Na 0°C (tj. 273 K), tlak pare je 4,6 mm Hg. Art., na 100 ° C (373 K) jednako je 760 mm Hg. Art., tj. povećava se za 165 puta. Kada se temperatura udvostruči (s 0 °C, tj. 273 K, na 273 °C, tj. 546 K), tlak pare raste s 4,6 mm Hg. Umjetnost. do gotovo 60 atm, tj. oko 10 000 puta.
Stoga se, naprotiv, vrelište prilično sporo mijenja s pritiskom. Kad se tlak udvostruči s 0,5 atm na 1 atm, vrelište se poveća s 82°C (355 K) na 100°C (373 K), a kad se tlak udvostruči s 1 na 2 atm, sa 100°C (373 K) do 120°C (393 K).
Ista krivulja koju sada razmatramo također kontrolira kondenzaciju (zgušnjavanje) pare u vodu.
Para se može pretvoriti u vodu kompresijom ili hlađenjem.
I tijekom vrenja i tijekom kondenzacije, točka se neće pomaknuti s krivulje sve dok se ne završi pretvorba pare u vodu ili vode u paru. To se također može formulirati na sljedeći način: pod uvjetima naše krivulje, i samo pod tim uvjetima, moguća je koegzistencija tekućine i pare. Ako se pritom ne dodaje niti oduzima toplina, tada će količine pare i tekućine u zatvorenoj posudi ostati nepromijenjene. Kaže se da su takva para i tekućina u ravnoteži, a za paru u ravnoteži sa svojom tekućinom kaže se da je zasićena.
Krivulja vrenja i kondenzacije, kao što vidimo, ima još jedno značenje: to je krivulja ravnoteže tekućine i pare. Krivulja ravnoteže dijeli polje dijagrama na dva dijela. Lijevo i gore (prema višim temperaturama i nižim tlakovima) je područje stacionarnog stanja pare. Desno i dolje - područje stabilnog stanja tekućine.
Krivulja ravnoteže para-tekućina, tj. ovisnost vrelišta o tlaku ili, što je isto, tlaka pare o temperaturi, približno je jednaka za sve tekućine. U nekim slučajevima promjena može biti nešto naglija, u drugima - nešto sporija, ali uvijek se tlak pare brzo povećava s porastom temperature.
Mnogo smo puta koristili riječi "plin" i "para". Ove dvije riječi su prilično iste. Možemo reći: vodeni plin je para vode, plin kisik je para tekućeg kisika. Ipak, razvila se neka navika u korištenju ove dvije riječi. Budući da smo navikli na određeni relativno mali temperaturni raspon, riječ "plin" obično koristimo za one tvari čiji je tlak pare pri uobičajenim temperaturama iznad atmosferskog tlaka. Naprotiv, o pari govorimo kada je pri sobnoj temperaturi i atmosferskom tlaku tvar stabilnija u obliku tekućine.
Isparavanje
Kuhanje je brz proces i u kratkom vremenu nema ni traga kipućoj vodi, pretvara se u paru.
Ali postoji još jedan fenomen pretvaranja vode ili druge tekućine u paru - to je isparavanje. Isparavanje se događa na bilo kojoj temperaturi, bez obzira na tlak, koji je u normalnim uvjetima uvijek blizu 760 mm Hg. Umjetnost. Isparavanje je, za razliku od vrenja, vrlo spor proces. Boca kolonjske vode koju smo zaboravili zatvoriti bit će prazna za nekoliko dana; više vremena o tanjurić s vodom će stajati, ali prije ili kasnije će se pokazati da je suh.
Zrak ima važnu ulogu u procesu isparavanja. Sam po sebi ne sprječava isparavanje vode. Čim otvorimo površinu tekućine, molekule vode će se početi kretati u najbliži sloj zraka.
Gustoća pare u ovom sloju brzo će se povećati; nakon kratkog vremena tlak pare će postati jednak elastičnoj karakteristici temperature medija. U tom će slučaju tlak pare biti točno isti kao u odsutnosti zraka.
Prijelaz pare u zrak ne znači, naravno, povećanje tlaka. Ukupni tlak u prostoru iznad vodene površine ne raste, samo se povećava udio u tom tlaku koji preuzima para, a sukladno tome smanjuje se udio zraka koji je istisnut parom.
Iznad vode je para pomiješana sa zrakom, iznad su slojevi zraka bez pare. Oni će se neizbježno pomiješati. Vodena para će se neprestano kretati prema višim slojevima, a umjesto nje će zrak strujati u niži sloj koji ne sadrži molekule vode. Stoga će se u sloju koji je najbliži vodi uvijek oslobađati mjesta za nove molekule vode. Voda će neprekidno isparavati, održavajući tlak vodene pare na površini jednak elastičnosti, a proces će se nastaviti sve dok voda potpuno ne ispari.
Počeli smo s primjerom kolonjske vode i vode. Dobro je poznato da oni isparavaju različitim brzinama. Eter izuzetno brzo isparava, alkohol prilično brzo, a voda znatno sporije. Odmah ćemo shvatiti u čemu je stvar ako u referentnoj knjizi pronađemo vrijednosti tlaka pare ovih tekućina, recimo, na sobnoj temperaturi. Evo brojeva: eter - 437 mm Hg. Čl., alkohol - 44,5 mm Hg. Umjetnost. i voda - 17,5 mm Hg. Umjetnost.
Što je veća elastičnost, to je više pare u susjednom sloju zraka i tekućina brže isparava. Znamo da tlak pare raste s temperaturom. Jasno je zašto se brzina isparavanja povećava zagrijavanjem.
Na brzinu isparavanja može se utjecati i na drugi način. Ako želimo pomoći isparavanju, moramo brzo ukloniti paru iz tekućine, tj. ubrzati miješanje zraka. Zato se upuhivanjem tekućine jako ubrzava isparavanje. Voda će, iako ima relativno mali tlak pare, vrlo brzo nestati ako se tanjurić stavi na vjetar.
Razumljivo je stoga zašto plivač koji izađe iz vode osjeća hladnoću na vjetru. Vjetar ubrzava miješanje zraka s parom i, prema tome, ubrzava isparavanje, a toplinu za isparavanje prisiljeno je odreći ljudsko tijelo.
Dobrobit čovjeka ovisi o tome ima li u zraku puno ili malo vodene pare. I suho i vlažan zrak neugodan. Vlažnost se smatra normalnom kada je 60%. To znači da je gustoća vodene pare 60% gustoće zasićene vodene pare pri istoj temperaturi.
Ako se vlažan zrak ohladi, tada će na kraju tlak vodene pare u njemu biti jednak tlaku pare na ovoj temperaturi. Para će postati zasićena i, kako temperatura bude dalje padala, počet će se kondenzirati u vodu. Jutarnja rosa, koja vlaži travu i lišće, pojavljuje se upravo zbog ove pojave.
Pri 20°C gustoća zasićene vodene pare iznosi oko 0,00002 g/cm 3 . Osjećat ćemo se dobro ako zrak sadrži 60% ovog broja vodene pare - što znači tek nešto više od stotisućitog dijela grama u 1 cm3.
Iako je ova brojka mala, dovest će do impresivnih količina pare za sobu. Lako je izračunati da u prostoriju srednje veličine površine 12 m 2 i visine 3 m može "stati" oko kilogram vode u obliku zasićene pare.
Dakle, ako takvu prostoriju dobro zatvorite i stavite otvorenu bačvu s vodom, onda će litra vode ispariti, bez obzira na kapacitet bačve.
Zanimljivo je usporediti ovaj rezultat za vodu s odgovarajućim brojkama za živu. Pri istoj temperaturi od 20°C gustoća zasićene živine pare iznosi 10 -8 g/cm 3 .
U prostoriji o kojoj smo upravo razgovarali neće stati više od 1 g živine pare.
Inače, živine pare su vrlo otrovne, a 1 g živinih para može ozbiljno naštetiti zdravlju svake osobe. Pri radu sa živom treba paziti da se i najmanja kap žive ne prolije.
Kritična temperatura
Kako plin pretvoriti u tekućinu? Na ovo pitanje odgovara graf vrenja. Plin možete pretvoriti u tekućinu snižavanjem temperature ili povećanjem tlaka.
U 19. stoljeću podizanje tlaka činilo se lakšim od snižavanja temperature. Početkom ovog stoljeća veliki engleski fizičar Michael Farada uspio je sabiti plinove na vrijednosti tlaka pare i na taj način mnoge plinove (klor, ugljični dioksid i dr.) pretvoriti u tekućinu.
Međutim, neki plinovi - vodik, dušik, kisik - nisu bili podložni ukapljivanju. Koliko god se pritisak povećavao, nisu se pretvorile u tekućinu. Moglo se pomisliti da kisik i drugi plinovi ne mogu biti tekući. Klasificirani su kao pravi ili trajni plinovi.
Zapravo, neuspjesi su uzrokovani nerazumijevanjem jedne važne okolnosti.
Razmotrimo tekućinu i paru u ravnoteži i razmotrimo što im se događa kako vrelište raste i, naravno, kako tlak raste u skladu s tim. Drugim riječima, zamislite da se točka na grafu vrenja pomiče prema gore duž krivulje. Jasno je da se tekućina s povećanjem temperature širi i njezina gustoća opada. Što se tiče pare, povećanje vrelišta? naravno, doprinosi njegovom širenju, ali, kao što smo već rekli, tlak zasićene pare raste mnogo brže od točke vrelišta. Zbog toga gustoća pare ne pada, već, naprotiv, brzo raste s povećanjem vrelišta.
Budući da gustoća tekućine pada, a gustoća pare raste, tada ćemo, krećući se "gore" duž krivulje vrenja, neizbježno doći do točke u kojoj gustoće tekućine i pare postaju jednake (sl. 4.3).

Riža. 4.3
U ovoj značajnoj točki, koja se naziva kritična točka, krivulja vrenja završava. Budući da su sve razlike između plina i tekućine posljedica razlike u gustoći, u kritičnoj točki svojstva tekućine i plina postaju ista. Svaka tvar ima svoju kritičnu temperaturu i svoj kritični tlak. Dakle, za vodu kritična točka odgovara temperaturi od 374 ° C i tlaku od 218,5 atm.
Ako komprimirate plin čija je temperatura ispod kritične, tada će proces njegove kompresije biti prikazan strelicom koja prelazi krivulju vrenja (slika 4.4). To znači da će se u trenutku postizanja tlaka jednakog tlaku pare (točka sjecišta strelice s krivuljom vrenja) plin početi kondenzirati u tekućinu. Da je naša posuda prozirna, tada bismo u ovom trenutku vidjeli početak stvaranja tekućeg sloja na dnu posude. Pri stalnom tlaku sloj tekućine će rasti sve dok se na kraju sav plin ne pretvori u tekućinu. Daljnja kompresija će zahtijevati povećanje tlaka.

Riža. 4.4
Posve je drugačija situacija kada se komprimira plin čija je temperatura viša od kritične. Proces kompresije opet se može prikazati kao strelica koja ide odozdo prema gore. Ali sada ova strelica ne prelazi krivulju vrenja. To znači da se tijekom kompresije para neće kondenzirati, već će se samo kontinuirano kondenzirati.
Na temperaturi iznad kritične nemoguće je postojanje tekućine i plina odvojenih sučeljem: kada se stisne na bilo koju gustoću, ispod klipa će biti homogena tvar, a teško je reći kada se može nazvati plin i kada se može nazvati tekućinom.
Prisutnost kritične točke pokazuje da ne postoji temeljna razlika između tekućeg i plinovitog stanja. Na prvi pogled moglo bi se činiti da te fundamentalne razlike nema samo u slučaju kada je riječ o temperaturama iznad kritične. To, međutim, nije tako. Postojanje kritične točke ukazuje na mogućnost transformacije tekućine - prave tekućine koja se može natočiti u čašu - u plinovito stanje bez ikakvog privida vrenja.
Ovaj put transformacije prikazan je na sl. 4.4. Poznata tekućina označena je križićem. Ako malo smanjite tlak (strelica prema dolje), kuhat će, kuhat će ako malo povisite temperaturu (strelica desno). No, mi ćemo učiniti nešto sasvim drugo, tekućinu ćemo jako stisnuti, na tlak iznad kritičnog. Točka koja predstavlja stanje tekućine ići će okomito prema gore. Zatim zagrijavamo tekućinu - ovaj proces je prikazan vodoravnom linijom. Sada, nakon što smo se našli desno od Kritične temperature, spustit ćemo tlak na početni. Ako sada smanjimo temperaturu, tada možemo dobiti najpravu paru, koja bi se iz ove tekućine mogla dobiti jednostavnijim i kraćim putem.
Stoga je uvijek moguće, mijenjanjem tlaka i temperature da se zaobiđe kritična točka, dobiti paru kontinuiranim prijelazom iz tekućine ili tekućinu iz pare. Takav kontinuirani prijelaz ne zahtijeva vrenje ili kondenzaciju.
Rani pokušaji ukapljivanja plinova kao što su kisik, dušik, vodik su stoga bili neuspješni jer nije bilo poznato postojanje kritične temperature. Ovi plinovi imaju vrlo niske kritične temperature: dušik ima -147°C, kisik ima -119°C, vodik ima -240°C, odnosno 33 K. Rekorder je helij, njegova kritična temperatura je 4,3 K. Pretvorite te plinove u tekućine može se učiniti samo na jedan način - potrebno je smanjiti njihovu temperaturu ispod navedene.
Dobivanje niskih temperatura
Može se postići značajno smanjenje temperature različiti putevi. Ali ideja svih metoda je ista: moramo natjerati tijelo koje želimo ohladiti da troši svoju unutarnju energiju.
Kako to učiniti? Jedan od načina je da tekućina vrije bez dovođenja topline izvana. Da biste to učinili, kao što znamo, potrebno je smanjiti tlak - smanjiti ga na vrijednost tlaka pare. Toplina utrošena za vrenje bit će posuđena od tekućine i temperature tekućine i pare, a s njom će pasti i tlak pare. Dakle, da vrenje ne bi prestalo i da bi se brže odvijalo, iz posude s tekućinom potrebno je neprekidno ispumpavati zrak.
Međutim, postoji ograničenje pada temperature tijekom ovog procesa: tlak pare na kraju postaje potpuno beznačajan, pa čak ni najjače crpke ne mogu stvoriti potrebni tlak.
Da bi se nastavilo snižavanje temperature, moguće je plin hlađenjem dobivenom tekućinom pretvoriti u tekućinu nižeg vrelišta.
Sada se proces pumpanja može ponoviti s drugom tvari i tako se mogu postići niže temperature. Ako je potrebno, takav "kaskadni" način dobivanja niske temperature može se produžiti.
Upravo to su činili krajem prošlog stoljeća; ukapljivanje plinova odvijalo se u fazama: etilen, kisik, dušik, vodik, tvari s vrelištem od -103, -183, -196 i -253°C, sukcesivno su prevedene u tekućinu. Uz tekući vodik možete dobiti i tekućinu s najnižim vrelištem - helij (-269 ° C). Susjed s "lijeva" pomogao je da se susjed s "desna" uhvati.
Metoda kaskadnog hlađenja stara je gotovo sto godina. Godine 1877. ovom je metodom dobiven tekući zrak.
Godine 1884-1885. prvi put je proizveden tekući vodik. Konačno, nakon još dvadesetak godina, zauzeta je posljednja tvrđava: 1908. Kamerling-Onnes u gradu Leidenu u Nizozemskoj pretvorio je helij u tekućinu - tvar s najnižom kritičnom temperaturom. Nedavno je obilježena 70. obljetnica ovog važnog znanstvenog postignuća.
Laboratorij u Leidenu je dugi niz godina bio jedini "niskotemperaturni" laboratorij. Sada u svim zemljama postoje deseci takvih laboratorija, a da ne spominjemo postrojenja koja proizvode tekući zrak, dušik, kisik i helij za tehničke potrebe.
Kaskadna metoda za postizanje niskih temperatura sada se rijetko koristi. NA tehničke instalacije za snižavanje temperature koristi se druga metoda snižavanja unutarnje energije plina: plin se tjera da se brzo širi i vrši rad na račun unutarnje energije.
Ako se, na primjer, zrak komprimiran na nekoliko atmosfera stavi u ekspander, tada će se prilikom rada pomicanja klipa ili rotacije turbine zrak ohladiti tako naglo da će se pretvoriti u tekućinu. Ugljični dioksid, ako se brzo oslobodi iz cilindra, toliko se naglo ohladi da se u hodu pretvara u "led".
Tekući plinovi naširoko se koriste u tehnici. Tekući kisik se koristi u eksplozivnoj tehnici kao komponenta gorive smjese u mlaznim motorima.
Ukapljivanje zraka koristi se u tehnici za odvajanje plinova koji čine zrak.
NA razna područja potrebna je oprema za rad na temperaturi tekućeg zraka. Ali za mnoge fizikalne studije ova temperatura nije dovoljno niska. Doista, ako Celzijeve stupnjeve prevedemo u apsolutnu ljestvicu, vidjet ćemo da je temperatura tekućeg zraka oko 1/3 sobne temperature. Za fiziku su mnogo zanimljivije temperature "vodika", tj. temperature reda veličine 14-20 K, a posebno temperature "helija". Najniža temperatura dobivena ispumpavanjem tekućeg helija je 0,7 K.
Fizičari su se uspjeli približiti apsolutnoj nuli. Trenutno su postignute temperature koje prelaze apsolutnu nulu za samo nekoliko tisućinki stupnja. Međutim, te ultra niske temperature se postižu na načine koji nisu slični onima koje smo gore opisali.
NA posljednjih godina fizika niskih temperatura dovela je do posebne grane industrije koja se bavi proizvodnjom opreme koja omogućuje održavanje velikih količina na temperaturi blizu apsolutne nule; razvijena strujni kablovi, čije vodljive sabirnice rade na temperaturi nižoj od 10 K.
Prehlađena para i pregrijana tekućina
Na prijelazu vrelišta, para se mora kondenzirati, pretvoriti u tekućinu. Međutim,; Ispada da ako para ne dođe u kontakt s tekućinom, a ako je para vrlo čista, tada je moguće dobiti prehlađenu ili prezasićenu paru - paru koja je davno trebala postati tekućina.
Prezasićena para je vrlo nestabilna. Ponekad je dovoljan pritisak ili zrnce pare bačeno u svemir da započne zakašnjela kondenzacija.
Iskustvo pokazuje da je kondenzacija molekula pare znatno olakšana uvođenjem malih stranih čestica u paru. U prašnjavom zraku ne dolazi do prezasićenja vodene pare. Može uzrokovati kondenzaciju s oblacima dima. Uostalom, dim se sastoji od malih čvrstih čestica. Ulazeći u paru, te čestice skupljaju molekule oko sebe i postaju središta kondenzacije.
Dakle, iako nestabilna, para može postojati u temperaturnom rasponu prilagođenom za "život" tekućine.
Može li tekućina pod istim uvjetima "živjeti" u području pare? Drugim riječima, je li moguće pregrijati tekućinu?
Ispostavilo se da možete. Da biste to učinili, potrebno je osigurati da se molekule tekućine ne odvoje od njegove površine. Radikalni lijek je eliminirati slobodnu površinu, odnosno staviti tekućinu u posudu gdje bi bila stisnuta sa svih strana čvrstim stijenkama. Na taj način moguće je postići pregrijavanje reda veličine nekoliko stupnjeva, odnosno pomaknuti točku koja prikazuje stanje tekućina desno od krivulje vrenja (slika 4.4).
Pregrijavanje je prelazak tekućine u područje pare, pa se pregrijavanje tekućine može postići i dovođenjem topline i smanjenjem tlaka.
Posljednji način na koji možete postići nevjerojatne rezultate. Voda ili druga tekućina, pažljivo oslobođena od otopljenih plinova (to nije lako učiniti), stavlja se u posudu s klipom koji dopire do površine tekućine. Posuda i klip moraju biti natopljeni tekućinom. Ako sada povučete klip prema sebi, tada će voda zalijepljena za dno klipa slijediti njega. Ali sloj vode, koji se drži klipa, povući će sljedeći sloj vode, ovaj sloj će povući onaj ispod, kao rezultat toga, tekućina će se rastegnuti.
Na kraju će stupac vode puknuti (s klipa će sići stupac vode, a ne voda), ali to će se dogoditi kada sila po jedinici površine dosegne desetke kilograma. Drugim riječima, u tekućini se stvara podtlak od desetaka atmosfera.
Čak i pri niskim pozitivnim tlakovima, parno stanje tvari je stabilno. Tekućina se može dovesti do negativnog tlaka. Više svijetli primjer"pregrijavanje" je nezamislivo.
Topljenje
Ne postoji tako čvrsto tijelo koje bi se koliko god je potrebno oduprlo porastu temperature. Prije ili kasnije čvrsti se komad pretvori u tekućinu; točno, u nekim slučajevima nećemo moći doći do tališta - može doći do kemijske razgradnje.
Kako temperatura raste, molekule se kreću sve brže i brže. Konačno, dolazi trenutak kada održavanje reda "među snažno" zamahnutim "molekulama postaje nemoguće. Krutina se topi. Volfram ima najvišu točku taljenja: 3380 °C. Zlato se tali na 1063°C, željezo na 1539°C. su metali s niskim talištem.Živa, kao što je poznato, tali se već na temperaturi od -39 ° C. Organske tvari nemaju visoke točke taljenja.Naftalen se tali na 80 ° C, toluen - na -94,5 ° C.
Nije nimalo teško izmjeriti talište nekog tijela, pogotovo ako se ono topi u temperaturnom području koje se mjeri običnim termometrom. Uopće nije potrebno pratiti tijelo koje se topi očima. Dovoljno je pogledati živin stupac termometra. Sve dok topljenje ne počne, temperatura tijela raste (slika 4.5). Čim topljenje počne, porast temperature prestaje i temperatura će ostati nepromijenjena do završetka procesa taljenja.

Riža. 4.5
Poput transformacije tekućine u paru, transformacija krutine u tekućinu zahtijeva toplinu. Toplina potrebna za to naziva se latentna toplina taljenja. Primjerice, za topljenje jednog kilograma leda potrebno je 80 kcal.
Led je jedno od tijela s visokom toplinom taljenja. Za topljenje leda potrebno je, primjerice, 10 puta više energije nego za topljenje iste mase olova. Naravno, govorimo o samom topljenju, ovdje ne kažemo da se prije nego počne topljenje olova mora zagrijati na +327 °C. Zbog velike topline topljenja leda usporava se i topljenje snijega. Zamislite da bi toplina taljenja bila 10 puta manja. Tada bi proljetne poplave svake godine donosile nezamislive katastrofe.
Dakle, toplina topljenja leda je velika, ali je i mala u usporedbi sa specifičnom toplinom isparavanja od 540 kcal/kg (sedam puta manje). Međutim, ova razlika je sasvim prirodna. Pri pretvaranju tekućine u paru moramo molekule otrgnuti jednu od druge, a kod taljenja moramo samo uništiti red u rasporedu molekula, ostavljajući ih na gotovo istim udaljenostima. Jasno je da je u drugom slučaju potrebno manje rada.
Prisutnost određene točke tališta važna je značajka kristalnih tvari. Na temelju toga ih je lako razlikovati od ostalih čvrstih tvari, koje nazivamo amorfnim ili staklom. Stakla se nalaze i među anorganskim i među organskim tvarima. staklo prozora obično se izrađuju od natrijevih i kalcijevih silikata; na radni stolčesto stavljaju organsko staklo (također se naziva pleksiglas).
Amorfne tvari, za razliku od kristala, nemaju određeno talište. Staklo se ne topi, već omekšava. Kad se zagrije, komad stakla prvo postane mekan od tvrdog, može se lako saviti ili rastegnuti; pri višoj temperaturi komad počinje mijenjati svoj oblik pod utjecajem vlastite gravitacije. Zagrijavanjem gusta viskozna staklena masa poprima oblik posude u kojoj leži. Ova masa je isprva gusta, poput meda, zatim poput kiselog vrhnja, da bi na kraju postala tekuća gotovo kao voda niske viskoznosti. Uz svu našu želju, ovdje ne možemo naznačiti određenu temperaturu prijelaza krutine u tekućinu. Razlozi za to leže u temeljnoj razlici između strukture stakla i strukture kristalnih tijela. Kao što je gore spomenuto, atomi u amorfnim tijelima raspoređeni su nasumično. Stakla po strukturi podsjećaju na tekućine. Čak iu čvrstom staklu molekule su raspoređene nasumično. To znači da povećanje temperature stakla samo povećava raspon vibracija njegovih molekula, dajući im postupno sve veću slobodu kretanja. Stoga staklo omekšava postupno i ne pokazuje oštar prijelaz "čvrsto" - "tekuće", što je karakteristično za prijelaz s rasporeda molekula u strogom redoslijedu u slučajni raspored.
Kad je riječ o krivulji vrenja, rekli smo da tekućina i para mogu, iako u nestabilnom stanju, živjeti u stranim regijama - para se može prehladiti i prenijeti ulijevo od krivulje vrenja, tekućina se može pregrijati i povući udesno ove krivulje.
Jesu li slične pojave moguće iu slučaju kristala s tekućinom? Ispada da je analogija ovdje nepotpuna.
Ako zagrijete kristal, on će se početi topiti na svojoj točki taljenja. Kristal se ne može pregrijati. Naprotiv, hlađenjem tekućine moguće je, ako se poduzmu određene mjere, relativno lako “provući” talište. U nekim tekućinama mogu se postići velika pothlađenja. Postoje čak i tekućine koje je lako super ohladiti, ali ih je teško kristalizirati. Kako se takva tekućina hladi, postaje sve viskoznija i na kraju se skrutne bez kristalizacije. Takvo je staklo.
Također možete ponovno ohladiti vodu. Kapljice magle možda se neće smrznuti čak ni pri jakim mrazima. Ako se kristal tvari, sjemenka, baci u prehlađenu tekućinu, odmah će početi kristalizacija.
Konačno, u mnogim slučajevima odgođena kristalizacija može biti pokrenuta trešenjem ili drugim slučajnim događajima. Poznato je, na primjer, da je kristalni glicerol prvi put dobiven tijekom transporta kroz željeznička pruga. Čaše se nakon dužeg stajanja mogu početi kristalizirati (devitrificirati, ili "kolabirati", kako kažu u tehnici).
Kako uzgojiti kristal
Gotovo svaka tvar može dati kristale pod određenim uvjetima. Kristali se mogu dobiti iz otopine ili taline određene tvari, kao i iz njezinih para (na primjer, kristali joda u obliku crnog dijamanta lako se talože iz njegovih para pri normalnom tlaku bez prijelaza u tekuće stanje) .
Počnite otapati kuhinjsku sol ili šećer u vodi. Na sobnoj temperaturi (20°C) u fasetiranoj čaši moći ćete otopiti samo 70 g soli. Daljnji dodaci soli neće se otopiti i taložit će se na dnu u obliku taloga. Otopina u kojoj ne dolazi do daljnjeg otapanja naziva se zasićena. .Ako promijenite temperaturu, tada će se promijeniti i stupanj topljivosti tvari. Svima je dobro poznato da vruća voda mnogo lakše otapa većinu tvari nego hladna voda.
Zamislite sada - da ste pripremili zasićenu otopinu, recimo, šećera na temperaturi od 30 °C i počeli je hladiti na 20 °C. Na 30°C mogli ste otopiti 223 g šećera u 100 g vode, na 20°C se otopi 205 g. Zatim, kada se ohladi s 30 na 20°C, 18 g će biti "ekstra" i, kao kažu, ispast će iz rješenja. Dakle, jedan od mogućih načina dobivanja kristala je hlađenje zasićene otopine.
Možete to učiniti drugačije. Pripremite zasićenu otopinu soli i ostavite je u otvorenoj čaši. Nakon nekog vremena vidjet ćete pojavu kristala. Zašto su nastali? Pažljivo promatranje pokazat će da se istodobno s nastankom kristala dogodila još jedna promjena - smanjila se količina vode. Voda je isparila, a "ekstra" tvar se pojavila u otopini. Dakle drugo mogući način stvaranje kristala je isparavanje otopine.
Kako nastaju kristali iz otopine?
Rekli smo da kristali "ispadaju" iz otopine; Treba li to shvatiti na način da kristala nije bilo tjedan dana, au jednom trenutku odjednom se pojavio? Ne, to nije slučaj: kristali rastu. Nije moguće, naravno, okom otkriti početne trenutke rasta. Isprva se nekoliko nasumično gibajućih molekula ili atoma otopljene tvari okuplja približno redoslijedom koji je potreban za formiranje kristalne rešetke. Takva skupina atoma ili molekula naziva se jezgra.
Iskustvo pokazuje da se jezgre češće stvaraju u prisutnosti bilo kakvih stranih sitnih čestica prašine u otopini. Najbrža i najlakša kristalizacija počinje kada se mala klica kristala stavi u zasićenu otopinu. U ovom slučaju, izolacija krutine iz otopine neće se sastojati u stvaranju novih kristala, već u rastu klice.
Rast embrija se, naravno, ne razlikuje od rasta sjemena. Smisao korištenja sjemenke je u tome da ona oslobođenu tvar "navuče" na sebe i tako spriječi istovremeni nastanak većeg broja jezgri. Ako se formira mnogo jezgri, tada će one ometati jedna drugu tijekom rasta i neće nam dopustiti da dobijemo velike kristale.
Kako su dijelovi atoma ili molekula oslobođeni iz otopine raspoređeni na površini jezgre?
Iskustvo pokazuje da se rast jezgre ili sjemena sastoji, takoreći, u pomicanju stranica paralelnih sa sobom u smjeru okomitom na površinu. U tom slučaju kutovi između ploha ostaju konstantni (već znamo da je konstantnost kutova najvažnije svojstvo kristala, što proizlazi iz njegove rešetkaste strukture).
Na sl. 4.6 dani su obrisi triju kristala iste tvari koji nastaju tijekom njihova rasta. Slični uzorci mogu se promatrati pod mikroskopom. U slučaju prikazanom lijevo, broj lica je očuvan tijekom rasta. Srednji crtež daje primjer novog lica koje se pojavljuje (gore desno) i ponovno nestaje.

Riža. 4.6
Vrlo je važno napomenuti da brzina rasta lica, odnosno brzina njihovog kretanja paralelno sa samim sobom, nije ista za različita lica. U tom slučaju "prerastu" (nestanu) upravo ona lica koja se najbrže kreću, npr. donje lijevo lice na srednjoj slici. Naprotiv, sporo rastuća lica su najšira, kako kažu, najrazvijenija.
To je posebno jasno na posljednjoj slici. Bezobličan ulomak dobiva isti oblik kao i drugi kristali upravo zbog anizotropije brzine rasta. Dobro definirane fasete najjače se razvijaju na račun drugih i daju kristalu oblik karakterističan za sve uzorke ove tvari.
Vrlo lijepi prijelazni oblici opažaju se kada se kao sjemenka uzme kuglica, a otopina se naizmjenično malo ohladi i zagrije. Zagrijavanjem otopina postaje nezasićena, a sjeme se djelomično otapa. Hlađenje dovodi do zasićenja otopine i rasta sjemena. Ali molekule se talože na drugačiji način, kao da daju prednost određenim mjestima. Tvar se tako prenosi s jednog mjesta lopte na drugo.
Prvo se na površini lopte pojavljuju mala lica u obliku kruga. Krugovi se postupno povećavaju i, dodirujući se, stapaju se duž ravnih rubova. Lopta se pretvara u poliedar. Tada neka lica potiskuju druga, neka lica prerastaju, a kristal dobiva svoj karakterističan oblik (slika 4.7).

Riža. 4.7
Pri promatranju rasta kristala upada u oči glavna značajka rasta - paralelno kretanje lica. Ispostavilo se da oslobođena tvar izgrađuje lice u slojevima: dok se jedan sloj ne završi, sljedeći se ne počinje graditi.
Na sl. 4.8 prikazuje "nedovršeno" pakiranje atoma. U kojem će od položaja označenih slovima novi atom biti najčvršće pričvršćen za kristal? Nema sumnje u A, budući da ovdje doživljava privlačnost susjeda s tri strane, dok u B - s dvije, a u C - samo s jedne strane. Dakle, prvo se dovršava stup, zatim cijela ravnina, a tek onda počinje polaganje nove ravnine.

Riža. 4.8
U nizu slučajeva kristali nastaju iz rastaljene mase - iz taline. U prirodi se to događa u ogromnim razmjerima: bazalti, graniti i mnoge druge stijene nastale su iz vatrene magme.
Počnimo zagrijavati neku kristalnu tvar, na primjer, kamenu sol. Kristali do 804°C kamena sol malo će se promijeniti: samo se malo šire, a tvar ostaje čvrsta. Mjerač temperature postavljen u posudu s nekom tvari pokazuje kontinuirano povećanje temperature pri zagrijavanju. Na 804°C odmah ćemo otkriti dva nova, međusobno povezana fenomena: tvar će se početi topiti, a porast temperature će prestati. Dok se sva materija ne pretvori u tekućinu,; temperatura se neće promijeniti; daljnji porast temperature već zagrijava tekućinu. Sve kristalne tvari imaju određeno talište. Led se topi na 0°C, željezo se topi na 1527°C, živa se topi na -39°C itd.
Kao što već znamo, u svakom kristalu atomi ili molekule tvari tvore uređeno G pakiranje i prave male vibracije oko svojih prosječnih položaja. Kako se tijelo zagrijava, brzina titrajnih čestica raste zajedno s amplitudom oscilacija. Ovo povećanje brzine čestica s povećanjem temperature jedan je od osnovnih zakona prirode, koji vrijedi za materiju u bilo kojem stanju - krutom, tekućem ili plinovitom.
Kada se postigne određena, dovoljno visoka temperatura kristala, vibracije njegovih čestica postaju toliko energične da točan raspored čestica postaje nemoguć - kristal se topi. S početkom taljenja, dovedena toplina više se ne koristi za povećanje brzine čestica, već za uništavanje kristalne rešetke. Stoga je porast temperature suspendiran. Naknadno zagrijavanje je povećanje brzine čestica tekućine.
U slučaju kristalizacije iz taline koja nas zanima, gore navedeni fenomeni promatraju se obrnutim redoslijedom: kako se tekućina hladi, njezine čestice usporavaju svoje kaotično gibanje; kad se postigne određena, dovoljno niska temperatura, brzina čestica je već toliko mala da se neke od njih, pod utjecajem privlačnih sila, počinju međusobno spajati, stvarajući kristalne jezgre. Sve dok se sva tvar ne kristalizira, temperatura ostaje konstantna. Ova temperatura je općenito ista kao i točka taljenja.
Ako se ne poduzmu posebne mjere, tada će kristalizacija iz taline odmah započeti na mnogim mjestima. Kristali će rasti u obliku pravilnih poliedra karakterističnih za njih na točno isti način kao što smo gore opisali. Međutim, slobodni rast ne traje dugo: rastući, kristali se sudaraju jedni s drugima, rast se zaustavlja na mjestima dodira, a otvrdnulo tijelo dobiva zrnastu strukturu. Svako zrno je zaseban kristal koji nije uspio poprimiti ispravan oblik.
Ovisno o mnogim uvjetima, a prije svega o brzini hlađenja, čvrsto tijelo može imati više ili manje krupna zrna: što je sporije hlađenje, to su zrna veća. Veličine zrna kristalnih tijela kreću se od milijuntog dijela centimetra do nekoliko milimetara. U većini slučajeva, granularna kristalna struktura može se promatrati pod mikroskopom. Čvrste tvari obično imaju upravo takvu sitnozrnatu strukturu.
Za tehnologiju je proces skrućivanja metala od velikog interesa. Događaje koji se događaju tijekom lijevanja i tijekom skrućivanja metala u kalupima fizičari su vrlo detaljno proučavali.
Uglavnom, tijekom skrućivanja, rastu monokristali poput stabla, koji se nazivaju dendriti. U drugim slučajevima, dendriti su orijentirani nasumično, u drugim slučajevima su paralelni jedan s drugim.
Na sl. 4.9 prikazuje faze rasta jednog dendrita. Ovakvim ponašanjem dendrit može prerasti prije nego što se susretne s drugim sličnim. Tada u odljevku nećemo naći dendrite. Događaji se mogu razvijati i različito: dendriti se mogu susresti i rasti jedan u drugom (ogranci jednog u međuprostorima između ogranaka drugog) dok su još "mladi".

Riža. 4.9
Na taj način mogu nastati odljevci čija zrna (prikazana na sl. 2.22) imaju vrlo različitu strukturu. A svojstva metala značajno ovise o prirodi ove strukture. Moguće je kontrolirati ponašanje metala tijekom skrućivanja promjenom brzine hlađenja i sustava za odvođenje topline.
Sada razgovarajmo o tome kako uzgojiti veliki pojedinačni kristal. Jasno je da se moraju poduzeti mjere kako bi se osiguralo da kristal raste s jednog mjesta. A ako je nekoliko kristala već počelo rasti, tada je u svakom slučaju potrebno osigurati da su uvjeti rasta povoljni samo za jedan od njih.
Evo, na primjer, kako se postupa pri uzgoju kristala metala s niskim talištem. Metal se topi u staklenoj epruveti s izvučenim krajem. Epruveta obješena na konac unutar okomite cilindrične peći polako se spušta. Izvučeni kraj postupno izlazi iz peći i hladi se. Počinje kristalizacija. U početku se formira nekoliko kristala, ali oni koji rastu postrance prislone na stijenku epruvete i njihov rast se usporava. U povoljnim će uvjetima biti samo onaj kristal koji raste uzduž osi epruvete, tj. duboko u talinu. Kako se epruveta spušta, novi dijelovi taline, padajući u područje niskih temperatura, "hranit će" ovaj monokristal. Stoga, od svih kristala, on jedini preživljava; kako se cijev spušta, ona nastavlja rasti duž svoje osi. Na kraju se sav rastaljeni metal skrutne u obliku jednog kristala.
Ista ideja je u osnovi rasta vatrostalnih kristala rubina. Kroz plamen se raspršuje fini prah tvari. Istovremeno se prašci tope; sitne kapi padaju na vatrostalnu podlogu vrlo male površine, tvoreći mnogo kristala. Kako kapljice padaju dalje na postolje, rastu svi kristali, ali opet raste samo onaj koji je u najpovoljnijem položaju za "primanje" padajućih kapi.
Čemu služe veliki kristali?
Industrija i znanost često trebaju velike pojedinačne kristale. Velika važnost za tehnologiju imaju kristale Rochelle soli i kvarca, koji imaju izvanrednu osobinu pretvaranja mehanička djelovanja(npr. tlak) u električni napon.
Optička industrija treba velike kristale kalcita, kamene soli, fluorita itd.
Industrija satova treba kristale rubina, safira i nekih drugih. drago kamenje. Činjenica je da pojedini pokretni dijelovi običnih satova naprave i do 20.000 titraja na sat. Tako veliko opterećenje postavlja neobično visoke zahtjeve za kvalitetu vrhova osovina i ležajeva. Abrazija će biti najmanja kada rubin ili safir služi kao ležaj za vrh osovine promjera 0,07-0,15 mm. Umjetni kristali ovih tvari vrlo su izdržljivi i čelik ih vrlo malo haba. Super je to umjetno kamenje stoga su bolji od istog prirodnog kamenja.
No, za industriju je od najveće važnosti rast monokristala poluvodiča - silicija i germanija.
Utjecaj tlaka na talište
Ako se tlak promijeni, promijenit će se i talište. Susreli smo se s istom pravilnošću kada smo govorili o vrenju. Kako veći pritisak; što je vrelište veće. To u pravilu vrijedi i za topljenje. Međutim, postoji mali broj tvari koje se ponašaju nenormalno: njihovo talište opada s povećanjem tlaka.
Činjenica je da je velika većina čvrstih tvari gušća od tekućina. Izuzetak od ove dravile su upravo one tvari čije se talište ne mijenja sasvim normalno s promjenom tlaka, primjerice voda. Led je lakši od vode, a talište leda opada s povećanjem tlaka.
Kompresija potiče stvaranje gušćeg stanja. Ako je krutina gušća od tekućine, tada kompresija pomaže skrućivanju i sprječava taljenje. Ali ako je taljenje otežano kompresijom, to znači da tvar ostaje čvrsta, dok bi se ranije na ovoj temperaturi već rastalila, tj. s povećanjem tlaka, talište se povećava. U anomalnom slučaju tekućina je gušća od krutine, a tlak pomaže nastajanju tekućine, tj. snižava talište.
Učinak tlaka na točku taljenja mnogo je manji od utjecaja vrenja. Povećanje tlaka za više od 100 kgf / cm 2 snižava točku taljenja leda za 1 °C.
Zašto klizaljke klize samo po ledu, ali ne i po jednako glatkom parketu? Navodno je jedino objašnjenje stvaranje vode koja podmazuje klizaljku. Da bismo razumjeli proturječje koje se pojavilo, moramo zapamtiti sljedeće: tupe klizaljke vrlo slabo klize po ledu. Za rezanje leda potrebno je naoštriti klizaljke. U ovom slučaju samo vrh ruba grebena pritišće led. Pritisak na led doseže desetke tisuća atmosfera, led se i dalje topi.
Isparavanje čvrstih tvari
Kada se kaže "neka tvar isparava", obično se misli da tekućina isparava. Ali krute tvari također mogu ispariti. Ponekad se isparavanje krutih tvari naziva sublimacijom.
Krutina koja isparava je, na primjer, naftalen. Naftalen se tali na 80°C, a isparava na sobnoj temperaturi. Upravo to svojstvo naftalina omogućuje njegovu upotrebu za istrebljenje moljaca.
Krzneni kaput prekriven naftalinom zasićen je naftalinskim parama i stvara atmosferu koju moljci ne podnose. Svaka čvrsta supstanca koja miriši sublimira u velikoj mjeri. Uostalom, miris stvaraju molekule koje su se odvojile od tvari i dospjele u naš nos. Međutim, češći su slučajevi kada je tvar sublimirana u neznatnom stupnju, ponekad do stupnja koji se ne može otkriti ni vrlo pažljivim istraživanjem. U principu, svaka čvrsta tvar (točno bilo koja, čak i željezo ili bakar) isparava. Ako ne otkrijemo sublimacije, to samo znači da je gustoća zasićene pare vrlo niska.
Može se vidjeti da brojne tvari koje imaju oštar miris na sobnoj temperaturi gube ga na niskoj temperaturi.
Gustoća zasićene pare u ravnoteži s krutom tvari brzo raste s porastom temperature. Ovo smo ponašanje ilustrirali krivuljom za led prikazanom na sl. 4.10. Istina, led ne miriše ...

Riža. 4.10
U većini slučajeva nemoguće je značajno povećati gustoću zasićene pare krutine iz jednostavnog razloga - tvar će se ranije rastopiti.
Led također isparava. To dobro znaju domaćice koje po hladnom vremenu vješaju mokro rublje da se suši, voda se prvo smrzne, a zatim led ispari i rublje ispadne suho.
trostruka točka
Dakle, postoje uvjeti pod kojima para, tekućina i kristal mogu postojati u parovima u ravnoteži. Mogu li sva tri stanja biti u ravnoteži? Takva točka na dijagramu tlak-temperatura postoji, naziva se trostruka. Gdje je ona?
Ako vodu s plutajućim ledom stavite u zatvorenu posudu na nula stupnjeva, tada će vodena (i "ledena") para početi izlaziti u slobodni prostor. Pri tlaku pare od 4,6 mm Hg. Umjetnost. Isparavanje će prestati i započet će zasićenje. Sada će tri faze - led, voda i para - biti u ravnoteži. Ovo je trostruka točka.
Odnos između različitih stanja jasno je i jasno prikazan dijagramom za vodu prikazanom na sl. 4.11.

Riža. 4.11
Takav se dijagram može konstruirati za bilo koje tijelo.
Krivulje na slici su nam poznate - to su krivulje ravnoteže između leda i pare, leda i vode, vode i pare. Kao i obično, tlak se iscrtava okomito, a temperatura vodoravno.
Tri krivulje sijeku se u trojnoj točki i dijele dijagram na tri područja – životne prostore leda, vode i vodene pare.
Dijagram stanja je sažeta referenca. Svrha mu je odgovoriti na pitanje koje je stanje tijela stabilno pri tom i tom tlaku i toj i toj temperaturi.
Ako se voda ili para stave u uvjete "lijeve regije", one će postati led. Ako se tekućina ili čvrsto tijelo uvede u "donji dio", tada će se dobiti para. U "pravom području" para će se kondenzirati i led će se otopiti.
Dijagram postojanja faza omogućuje vam da odmah odgovorite što se događa s tvari kada se zagrije ili kada se komprimira. Zagrijavanje pri konstantnom tlaku prikazano je vodoravnom linijom na dijagramu. Točka se pomiče duž ove linije slijeva nadesno, predstavljajući stanje tijela.
Slika prikazuje dvije takve linije, jedna od njih se zagrijava pri normalnom tlaku. Crta se nalazi iznad trostruka točka. Stoga će prvo prijeći krivulju taljenja, a zatim, izvan crteža, krivulju isparavanja. Led pri normalnom tlaku otopit će se na 0°C, a nastala voda će ključati na 100°C.
Situacija će biti drugačija za led koji se zagrijava pri vrlo niskom tlaku, recimo ispod 5 mm Hg. Umjetnost. Proces zagrijavanja je prikazan linijom ispod trojne točke. Krivulje taljenja i vrenja ne sijeku se s tom linijom. Pri tako malom pritisku zagrijavanje će dovesti do izravnog prijelaza leda u paru.
Na sl. 4.12, isti dijagram pokazuje kakav će se zanimljiv fenomen dogoditi kada se vodena para komprimira u stanju označenom križićem na slici. Para će se prvo pretvoriti u led, a zatim otopiti. Slika vam omogućuje da odmah kažete pri kojem će tlaku početi rast kristala i kada će doći do taljenja.

Riža. 4.12
Dijagrami stanja svih tvari međusobno su slični. Velike, sa svakodnevne točke gledišta, razlike nastaju zbog činjenice da položaj trojne točke na dijagramu može biti vrlo različit za različite tvari.
Uostalom, postojimo u blizini "normalnih uvjeta", to jest prvenstveno na tlaku blizu jedne atmosfere. Za nas je vrlo važno kako se trojna točka materije nalazi u odnosu na liniju normalnog tlaka.
Ako je tlak u trojnoj točki manji od atmosferskog, tada se za nas, koji živimo u "normalnim" uvjetima, tvar topi. Kad temperatura poraste, prvo se pretvara u tekućinu, a zatim proključa.
U suprotnom slučaju - kada je tlak u trojnoj točki veći od atmosferskog - nećemo vidjeti tekućinu pri zagrijavanju, krutina će izravno prijeći u paru. Tako se ponaša "suhi led", što je vrlo zgodno za prodavače sladoleda. Blokovi sladoleda mogu se pomaknuti komadima "suhog leda" i ne bojte se da će sladoled postati mokar. "Suhi led" je čvrsti ugljikov dioksid CO 2 . Trojna točka ove tvari nalazi se na 73 atm. Stoga, kada se kruti CO 2 zagrijava, točka koja prikazuje njegovo stanje pomiče se vodoravno, prelazeći samo krivulju isparavanja krutine (isto kao za obični led pri tlaku od oko 5 mm Hg. Umjetnost.).
Već smo rekli čitatelju kako se jedan stupanj temperature određuje na Kelvinovoj ljestvici, ili, kako sada zahtijeva SI sustav, jedan kelvin. Ipak se radilo o principu određivanja temperature. Nemaju svi mjeriteljski instituti idealne plinske termometre. Stoga se temperaturna ljestvica gradi uz pomoć ravnotežnih točaka koje je priroda odredila između različitih stanja tvari.
Posebnu ulogu u tome ima trostruka točka vode. Kelvinov stupanj sada se definira kao 273,16 termodinamičke temperature trojne točke vode. Uzeta je da je trostruka točka kisika jednaka 54,361 K. Temperatura skrućivanja zlata postavljena je na 1337,58 K. Pomoću ovih referentnih točaka svaki se termometar može točno kalibrirati.
Isti atomi, ali ... različiti kristali
Crni mat mekani grafit kojim pišemo, te sjajni prozirni, tvrdi, rezanje stakla dijamant je izgrađen od istih atoma ugljika. Zašto su svojstva ove dvije identične tvari toliko različita?
Prisjetimo se rešetke slojevitog grafita, čiji svaki atom ima tri najbliža susjeda, i rešetke dijamanta, čiji atom ima četiri najbliža susjeda. Ovaj primjer jasno pokazuje da su svojstva kristala određena međusobni dogovor atomi. Grafit se koristi za izradu vatrostalnih lonaca koji mogu izdržati temperature do dvije do tri tisuće stupnjeva, a dijamant gori na temperaturama iznad 700 ° C; gustoća dijamanta je 3,5, a grafita 2,3; grafit provodi struju, dijamant ne itd.
Nije samo ugljik taj koji ima tu osobinu da proizvodi različite kristale. Skoro svaki kemijski element, i ne samo element, već i svaka kemijska tvar, može postojati u nekoliko varijanti. Poznato je šest vrsta leda, devet vrsta sumpora, četiri vrste željeza.
Kada smo razgovarali o dijagramu stanja, nismo govorili o različiti tipovi kristale i nacrtao jedno područje krutine. I ovo područje za vrlo mnogo tvari podijeljeno je na dijelove, od kojih svaki odgovara određenom "razredu" čvrstog tijela ili, kako kažu, određenoj čvrstoj fazi (određenoj kristalnoj modifikaciji).
Svaka kristalna faza ima svoje područje stabilnog stanja, ograničeno određenim rasponom tlakova i temperatura. Zakoni pretvorbe jedne kristalne varijante u drugu isti su kao i zakoni taljenja i isparavanja.
Za svaki pritisak možete odrediti temperaturu na kojoj će obje vrste kristala mirno koegzistirati. Ako se temperatura poveća, kristal jedne vrste će se pretvoriti u kristal druge vrste. Ako se temperatura snizi, doći će do obrnute transformacije.
Da bi crveni sumpor požutio pri normalnom tlaku, potrebna je temperatura ispod 110 °C. Iznad te temperature, sve do tališta, raspored atoma karakterističan za crveni sumpor je stabilan. Temperatura pada, vibracije atoma se smanjuju, a počevši od 110 °C priroda pronalazi prikladniji raspored atoma. Dolazi do transformacije jednog kristala u drugi.
Nitko nije smislio imena za šest različitih ledova. Pa kažu: led jedan, led dva, ...., led sedam. Što kažete na sedam, ako postoji samo šest vrsta? Činjenica je da led četiri nije otkriven tijekom ponovljenih eksperimenata.
Ako se voda komprimira na temperaturi od oko nule, tada se pri tlaku od oko 2000 atm formira led pet, a pri tlaku od oko 6000 atm nastaje led šest.
Led dva i led tri stabilni su na temperaturama ispod nula stupnjeva.
Led sedam - vrući led; događa se kada se vruća voda komprimira na tlak od oko 20 000 atm.
Sav led, osim običnog leda, teži je od vode. Led proizveden u normalnim uvjetima ponaša se nenormalno; naprotiv, led dobiven pod uvjetima različitim od norme ponaša se normalno.
Kažemo da svaku kristalnu modifikaciju karakterizira određeno područje postojanja. Ali ako je tako, kako grafit i dijamant postoje pod istim uvjetima?
Takvo "bezakonje" u svijetu kristala vrlo je uobičajeno. Sposobnost življenja u "stranim" uvjetima za kristale gotovo je pravilo. Ako se za prijenos pare ili tekućine u druga područja postojanja mora poslužiti raznim trikovima, tada se kristal, naprotiv, gotovo nikada ne može prisiliti da ostane unutar granica koje mu je priroda dodijelila.
Pregrijavanje i superhlađenje kristala objašnjavaju se poteškoćama pretvaranja jednog reda u drugi u uvjetima ekstremne gužve. Žuti sumpor trebao bi postati crven na 95,5°C. Manje ili više brzim zagrijavanjem "preskočit" ćemo ovu točku transformacije i dovesti temperaturu do tališta sumpora 113°C.
Pravu temperaturu transformacije najlakše je otkriti kada kristali dođu u kontakt. Ako se tijesno stave jedna na drugu i drže na 96°C, žuto će pojesti crveno, a na 95°C žuto će upiti crveno. Za razliku od prijelaza "kristal-tekućina", transformacije "kristal-kristal" obično kasne i tijekom prehlađenja i pregrijavanja.
U nekim slučajevima imamo posla s takvim agregatnim stanjima, koja bi trebala živjeti na potpuno drugačijim temperaturama.
Bijeli lim trebao bi postati siv kad temperatura padne na +13°C. Obično imamo posla s bijelom limom i znamo da se zimi s njom ništa ne radi. Savršeno podnosi hipotermiju od 20-30 stupnjeva. Međutim, u teškim zimskim uvjetima bijeli lim se pretvara u sivi. Nepoznavanje ove činjenice bila je jedna od okolnosti koja je upropastila Scottovu ekspediciju na Južni pol (1912.). Tekuće gorivo koje je uzela ekspedicija bilo je u posudama zalemljenim kositrom. U velikim hladnoćama bijeli se kositar pretvarao u sivi prah – posude su bile odlemljene; a gorivo se izlilo. Nije ni čudo što se pojava sivih mrlja na bijelom limu naziva limenom kugom.
Baš kao i u slučaju sumpora, bijeli kositar može se pretvoriti u sivi na temperaturi malo ispod 13 °C; ako samo sićušno zrnce sive sorte padne na predmet od kositra.
Postojanje više varijanti iste tvari i kašnjenja u njihovim međusobnim transformacijama od velike su važnosti za tehnologiju.
Na sobnoj temperaturi, atomi željeza tvore kubičnu rešetku u središtu tijela u kojoj atomi zauzimaju položaje na vrhovima iu središtu kocke. Svaki atom ima 8 susjeda. Na visokim temperaturama atomi željeza stvaraju gušće "pakiranje" - svaki atom ima 12 susjeda. Željezo s 8 susjeda je meko, željezo s 12 susjeda je tvrdo. Ispada da je moguće dobiti željezo druge vrste na sobnoj temperaturi. Ova metoda - kaljenje - naširoko se koristi u metalurgiji.
Stvrdnjavanje se provodi vrlo jednostavno - metalni predmet se užari, a zatim baci u vodu ili ulje. Hlađenje se događa tako brzo da se transformacija strukture, koja je stabilna na visokoj temperaturi, nema vremena dogoditi. Dakle, visokotemperaturna struktura postojat će neograničeno u uvjetima neuobičajenim za nju: rekristalizacija u stabilnu strukturu odvija se tako sporo da je praktički neprimjetna.
Govoreći o stvrdnjavanju željeza, nismo bili sasvim precizni. Čelik je kaljen, tj. željezo koje sadrži frakcije postotka ugljika. Prisutnost vrlo malih primjesa ugljika usporava transformaciju tvrdog željeza u meko i omogućuje otvrdnjavanje. Što se tiče potpuno čistog željeza, nije ga moguće očvrsnuti - transformacija strukture ima vremena da se dogodi čak i uz naglo hlađenje.
Ovisno o vrsti dijagrama stanja, promjenom tlaka ili temperature postižu se određene transformacije.
Mnoge transformacije kristala u kristal opažaju se samo promjenom tlaka. Na taj način se dobivao crni fosfor.

Riža. 4.13
Grafit je bilo moguće pretvoriti u dijamant samo koristeći oboje visoka temperatura, i veliki pritisak. Na sl. 4.13 prikazuje dijagram stanja ugljika. Pri tlaku ispod deset tisuća atmosfera i na temperaturama ispod 4000 K, grafit je stabilna modifikacija. Dakle, dijamant živi u "tuđim" uvjetima, pa se lako može pretvoriti u grafit. Ali obrnuti problem je od praktičnog interesa. Pretvorbu grafita u dijamant nije moguće izvršiti samo povećanjem tlaka. Fazna transformacija u čvrstom stanju očito se odvija presporo. Izgled dijagrama stanja sugerira ispravno rješenje: istodobno povećati tlak i toplinu. Tada dobivamo (desni kut dijagrama) rastaljeni ugljik. Hlađenje visokotlačni, moramo ući u područje dijamanta.
Praktična mogućnost takvog procesa dokazana je 1955. godine, a danas se problem smatra tehnički riješenim.
Nevjerojatna tekućina
Ako snizite tjelesnu temperaturu, prije ili kasnije će se stvrdnuti i dobiti kristalnu strukturu. Nije važno pri kojem tlaku dolazi do hlađenja. Ova se okolnost čini sasvim prirodnom i razumljivom s gledišta zakona fizike, s kojima smo se već upoznali. Doista, snižavanjem temperature smanjujemo intenzitet toplinskog gibanja. Kada kretanje molekula postane toliko slabo da više ne ometa sile međudjelovanja među njima, molekule se poredaju u uredan red - formiraju kristal. Daljnje hlađenje će oduzeti molekulama svu energiju njihovog kretanja, a na apsolutnoj nuli tvar mora postojati u obliku mirujućih molekula raspoređenih u pravilnu rešetku.
Iskustvo pokazuje da se sve tvari tako ponašaju. Svi, osim jednog i jedinog: takva "nakaza" je helij.
Već smo čitatelju dali neke informacije o heliju. Helij drži rekord za svoju kritičnu temperaturu. Nijedna tvar nema kritičnu temperaturu nižu od 4,3 K. Međutim, ovaj rekord sam po sebi ne znači ništa iznenađujuće. Još jedna stvar je frapantna: hlađenjem helija ispod kritične temperature, dostizanjem gotovo apsolutne nule, nećemo dobiti čvrsti helij. Helij ostaje tekući čak i na apsolutnoj nuli.
Ponašanje helija potpuno je neobjašnjivo sa stajališta zakona gibanja koje smo iznijeli i jedan je od znakova ograničene valjanosti takvih zakona prirode, koji su se činili univerzalnima.
Ako je tijelo tekuće, tada su njegovi atomi u pokretu. Ali nakon svega, ohladivši tijelo na apsolutnu nulu, oduzeli smo mu svu energiju kretanja. Moramo priznati da helij ima takvu energiju gibanja koja mu se ne može oduzeti. Taj je zaključak nespojiv s mehanikom kojom smo se dosad bavili. Prema ovoj mehanici koju smo proučavali, kretanje tijela uvijek se može usporiti do potpunog zaustavljanja oduzimanjem sve njegove kinetičke energije; na isti način moguće je zaustaviti kretanje molekula oduzimanjem njihove energije pri sudaru sa stijenkama ohlađene posude. Za helij takva mehanika očito nije prikladna.
"Čudno" ponašanje helija pokazatelj je činjenice od velike važnosti. Najprije smo se susreli s nemogućnošću primjene osnovnih zakona mehanike, utvrđenih izravnim proučavanjem gibanja vidljivih atoma, u svijetu atoma. tijela, zakoni, koji se činio nepokolebljivim temeljem fizike.
Činjenica da helij "odbija" kristalizirati na apsolutnoj nuli ne može se nikako uskladiti s mehanikom koju smo dosad proučavali. Proturječje s kojim smo se prvi put susreli - neposluh svijeta atoma zakonima mehanike - samo je prva karika u lancu sve oštrijih i oštrijih proturječja u fizici.
Ove kontradikcije dovode do potrebe za revizijom temelja mehanike nuklearni svijet. Ova revizija je vrlo duboka i dovodi do promjene u našem cjelokupnom razumijevanju prirode.
Potreba za radikalnom revizijom mehanike atomskog svijeta ne znači da trebamo dokinuti zakone mehanike koje smo proučavali. Bilo bi nepravedno tjerati čitatelja da uči nepotrebne stvari. Stara mehanika je sasvim poštena u svijetu velika tijela. Već je to dovoljno da se s punim poštovanjem postupa s relevantnim poglavljima fizike. No, također je važno da niz zakona "stare" mehanike prelazi u "novu" mehaniku. To posebno uključuje zakon održanja energije.
Prisutnost "neuklonjive" energije na apsolutnoj nuli nije posebno svojstvo helija. Ispada; "nulta" energija prisutna je u svim tvarima.
Samo je u heliju ta energija dovoljna da spriječi atome da formiraju ispravnu kristalnu rešetku.
Nije potrebno misliti da helij ne može biti u kristalnom stanju. Za kristalizaciju helija potrebno je samo povećati tlak na oko 25 atm. Hlađenje pri višem tlaku dovest će do stvaranja krutog kristalnog helija sasvim običnih svojstava. Helij tvori kubičnu rešetku usmjerenu na lice.
Na sl. 4.14 prikazuje dijagram stanja helija. Oštro se razlikuje od dijagrama svih drugih tvari u odsutnosti trojne točke. Krivulje taljenja i vrenja se ne sijeku.

Riža. 4.14
A ovaj jedinstveni dijagram stanja ima još jednu značajku: postoje dvije različite tekućine helija. Koja je njihova razlika - naučit ćete malo kasnije.
Iz gornjeg razmišljanja jasno je da vrelište tekućine mora ovisiti o vanjskom tlaku. Promatranja to potvrđuju.
Što je veći vanjski tlak, to je viša točka vrelišta. Dakle, u parnom kotlu pri tlaku koji doseže 1,6 10 6 Pa voda ne ključa ni pri temperaturi od 200 °C. NA medicinske ustanove kipuće vode u hermetički zatvorenim posudama – autoklavima (sl. 6.11) također dolazi pri povišenom tlaku. Stoga je vrelište mnogo više od 100 °C. Autoklavi se koriste za sterilizaciju kirurških instrumenata, zavoja itd.
Obrnuto, smanjenjem vanjskog tlaka snižavamo vrelište. Ispod zvona zračne pumpe možete kuhati vodu na sobnoj temperaturi (Sl. 6.12). Kako se penjete na planine, atmosferski tlak opada, pa se smanjuje vrelište. Na nadmorskoj visini od 7134 m (Lenjinov vrh u Pamiru), tlak je približno 4 10 4 Pa (300 mm Hg). Tamo voda ključa na oko 70°C. Nemoguće je kuhati, primjerice, meso u takvim uvjetima.

Na slici 6.13 prikazana je ovisnost vrelišta vode o vanjskom tlaku. Lako je vidjeti da je ova krivulja ujedno i krivulja koja izražava ovisnost tlaka zasićene vodene pare o temperaturi.

Razlika u vrelištima tekućina
Svaka tekućina ima svoje vrelište. Razlika u vrelištima tekućina određena je razlikom u tlaku njihovih zasićenih para pri istoj temperaturi. Na primjer, para etera već na sobnoj temperaturi ima tlak veći od polovine atmosferskog tlaka. Stoga, da bi tlak pare etera postao jednak atmosferskom, potrebno je lagano povećanje temperature (do 35 ° C). Kod žive, zasićene pare imaju vrlo zanemariv tlak na sobnoj temperaturi. Tlak pare žive postaje jednak atmosferskom tek uz značajno povećanje temperature (do 357 ° C). Na toj temperaturi, ako je vanjski tlak 105 Pa, živa vrije.
Razlika u vrelištima tvari je od velike koristi u tehnici, na primjer, u odvajanju naftnih derivata. Zagrijavanjem ulja prije svega ispare njegovi najvrjedniji, hlapljivi dijelovi (benzin), koji se tako mogu odvojiti od “teških” ostataka (ulja, lož ulja).
Tekućina vrije kada se njezin tlak zasićene pare izjednači s tlakom unutar tekućine.
§ 6.6. Toplina isparavanja
Je li potrebna energija za pretvaranje tekućine u paru? Vjerojatno da! Nije li?
Napomenuli smo (vidi § 6.1) da je isparavanje tekućine popraćeno njezinim hlađenjem. Da bi se temperatura tekućine koja isparava održala nepromijenjenom, toplina joj se mora dovoditi izvana. Naravno, sama toplina se može prenijeti na tekućinu s okolnih tijela. Dakle, voda u čaši ispari, ali temperatura vode, koja je nešto niža od temperature okolnog zraka, ostaje nepromijenjena. Toplina se prenosi iz zraka u vodu sve dok sva voda ne ispari.
Da voda (ili bilo koja druga tekućina) ne bi ključala, mora joj se stalno dovoditi toplina, na primjer, zagrijavanjem plamenikom. U tom slučaju temperatura vode i posude ne raste, ali se svake sekunde stvara određena količina pare.
Dakle, da bi se tekućina pretvorila u paru isparavanjem ili vrenjem, potreban je dotok topline. Količina topline potrebna za pretvaranje određene mase tekućine u paru pri istoj temperaturi naziva se toplina isparavanja te tekućine.
Za što se troši energija dovedena u tijelo? Prije svega, povećati njegovu unutarnju energiju tijekom prijelaza iz tekućeg u plinovito stanje: na kraju krajeva, u ovom slučaju, volumen tvari povećava se od volumena tekućine do volumena zasićene pare. Posljedično se povećava prosječna udaljenost između molekula, a time i njihova potencijalna energija.
Osim toga, kada se volumen tvari povećava, vrši se rad protiv sila vanjskog pritiska. Ovaj dio topline isparavanja na sobnoj temperaturi obično iznosi nekoliko postotaka ukupne topline isparavanja.
Toplina isparavanja ovisi o vrsti tekućine, njezinoj masi i temperaturi. Ovisnost topline isparavanja o vrsti tekućine karakterizira vrijednost koja se naziva specifična toplina isparavanja.
Specifična toplina isparavanja određene tekućine je omjer topline isparavanja tekućine i njezine mase:
 (6.6.1)
(6.6.1)
gdje r- specifična toplina isparavanja tekućine; t- masa tekućine; Q n je njegova toplina isparavanja. SI jedinica za specifičnu toplinu isparavanja je džul po kilogramu (J/kg).
Specifična toplina isparavanja vode je vrlo visoka: 2,256 10 6 J/kg pri temperaturi od 100 °C. Za ostale tekućine (alkohol, eter, živa, kerozin itd.) specifična toplina isparavanja je 3-10 puta manja.
Jeste li ikada ostavili bocu vode nekoliko sati ispod užareno sunce i čuli ste "šištanje" kad ste ga otvorili? Ovaj zvuk je uzrokovan pritiskom pare. U kemiji, tlak pare je tlak koji stvara para tekućine koja isparava u hermetički zatvorenoj posudi. Za pronalaženje tlaka pare pri danoj temperaturi upotrijebite Clausius-Clapeyronovu jednadžbu: .
Koraci
Korištenje Clausius-Clapeyronove jednadžbe
- Na primjer, posuda sadrži tekućinu na temperaturi od 295 K, a njezin tlak pare je 1 atmosfera (1 atm). Pronađite tlak pare pri 393 K. Ovdje su vam dane dvije vrijednosti temperature i vrijednost tlaka, tako da možete pronaći drugu vrijednost tlaka pomoću Clausius-Clapeyronove jednadžbe. Zamjenom vrijednosti koje su vam dane u formulu, dobit ćete: ln(1/P2) = (ΔH vap /R)((1/393) - (1/295)).
- Imajte na umu da se u Clausius-Clapeyronovoj jednadžbi temperatura uvijek mjeri u kelvinima, a tlak u svim mjernim jedinicama (ali one moraju biti iste za P1 i P2).
-
Zamjenske konstante. Clausius-Clapeyronova jednadžba sadrži dvije konstante: R i ΔH vap . R je uvijek 8,314 J/(K×mol). Vrijednost ΔH vap (entalpija isparavanja) ovisi o tvari čiji tlak pare pokušavate pronaći; ova se konstanta, u pravilu, može naći u tablici u udžbenicima kemije ili na stranicama (na primjer,).
- U našem primjeru, recimo da se u posudi nalazi voda. ΔH vap vode je 40,65 kJ/mol ili jednako 40650 J/mol.
- Uključite konstante u formulu i dobit ćete: ln(1/P2) = (40650/8314)((1/393) - (1/295)).
-
Riješite jednadžbu pomoću algebarskih operacija.
- U našem primjeru, nepoznata varijabla je pod predznakom prirodnog logaritma (ln). Da biste se riješili prirodnog logaritma, pretvorite obje strane jednadžbe u potenciju matematičke konstante "e". Drugim riječima, ln(x) = 2 → e ln(x) = e 2 → x = e 2 .
- Sada riješite jednadžbu:
- ln(1/P2) = (40650/8,314)((1/393) - (1/295))
- ln(1/P2) = (4889,34)(-0,00084)
- (1/P2) = e(-4,107)
- 1/P2 = 0,0165
- P2 = 0,0165 -1 = 60,76 atm. To ima smisla, jer će podizanje temperature u hermetički zatvorenoj posudi za 100 stupnjeva povećati proizvodnju pare, što će uvelike povećati tlak pare.
Proračun tlaka pare u otopinama
-
Napiši Raoultov zakon. NA stvaran životčiste tekućine su rijetke; često se bavimo rješenjima. Otopina se dobiva dodavanjem male količine određene kemikalije koja se naziva "otopljena tvar" u veću količinu druge kemikalije koja se naziva "otapalo". U slučajevima rješenja upotrijebite Raoultov zakon: , gdje je:
- P otopina je tlak pare otopine.
- P solvent je tlak pare otapala.
- X otapalo je molni udio otapala.
- Ako ne znate što je "molna frakcija", čitajte dalje.
-
Odredite koja će tvar biti otapalo, a koja otopljena tvar. Podsjetimo se da je otopljena tvar tvar koja se otapa u otapalu, a otapalo je tvar koja otapa otopljenu tvar.
Odredite temperaturu otopine jer će to utjecati na njezin tlak pare.Što je viša temperatura, to je veći i tlak pare, jer se s povećanjem temperature povećava isparavanje.
- U našem primjeru, recimo da je temperatura sirupa 298 K (oko 25°C).
-
Odredite tlak pare otapala. Kemijski priručnici daju vrijednosti tlaka pare za mnoge uobičajene kemikalije, ali obično se te vrijednosti daju na 25°C/298 K ili njihovim vrelištima. Ako su vam u zadatku zadane takve temperature, koristite vrijednosti iz priručnika; inače morate izračunati tlak pare pri danoj temperaturi tvari.
Pronađite molni udio otapala. Da biste to učinili, pronađite omjer broja molova tvari prema ukupni broj molova svih tvari prisutnih u otopini. Drugim riječima, molski udio svake tvari je (broj molova tvari)/(ukupan broj molova svih tvari).
-
Sada uključite podatke i pronađene vrijednosti u Raoultovu jednadžbu danu na početku ovog odjeljka ( P otopina = P otapalo X otapalo).
- U našem primjeru:
- P otopina = (23,8 mm Hg) (0,947)
- P otopina = 22,54 mmHg Umjetnost. To ima smisla, budući da je mala količina šećera otopljena u velikoj količini vode (mjereno u molovima; jednake su količine u litrama), pa će se tlak pare malo smanjiti.
Proračun tlaka pare u posebnim slučajevima
-
Definicija standardnih uvjeta.Često se u kemiji temperatura i tlak koriste kao neka vrsta "zadane" vrijednosti. Te se vrijednosti nazivaju standardna temperatura i tlak (ili standardni uvjeti). Problemi s tlakom pare često se odnose na standardne uvjete, pa je najbolje zapamtiti standardne vrijednosti:
- Temperatura: 273,15K/0˚C/32F
- Tlak: 760 mm Hg / 1 atm / 101,325 kPa
-
Prepišite Clausius-Clapeyronovu jednadžbu da biste pronašli druge varijable. Prvi dio ovog članka pokazao je kako izračunati tlakove pare čistih tvari. Međutim, ne zahtijevaju svi problemi pronalaženje tlaka P1 ili P2; u mnogim problemima potrebno je izračunati temperaturu ili vrijednost ΔH vap . U takvim slučajevima, prepišite Clausius-Clapeyronovu jednadžbu, izolirajući nepoznatu količinu na jednoj strani jednadžbe.
- Na primjer, dana je nepoznata tekućina čiji je tlak pare 25 Torr pri 273 K i 150 Torr pri 325 K. Trebate pronaći entalpiju isparavanja te tekućine (tj. ΔH vap). Rješenje ovog problema:
- ln(P1/P2) = (ΔH vap /R)((1/T2) - (1/T1))
- (ln(P1/P2))/((1/T2) - (1/T1)) = (ΔH vap /R)
- R × (ln(P1/P2))/((1/T2) - (1/T1)) = ΔH vap Sada zamijenite zadane vrijednosti za vas:
- 8,314 J/(K × mol) × (-1,79)/(-0,00059) = ΔH vap
- 8,314 J/(K × mol) × 3033,90 = ΔH vap = 25223,83 J/mol
-
Uzmite u obzir tlak pare otopljene tvari. U našem primjeru iz drugog odjeljka ovog članka otopljena tvar - šećer - ne isparava, ali ako otopljena tvar stvara paru (isparava), treba uzeti u obzir tlak pare. Da biste to učinili, upotrijebite modificirani oblik Raoultove jednadžbe: P otopina = Σ(P tvar X tvar), gdje simbol Σ (sigma) znači da je potrebno zbrojiti tlakove pare svih tvari koje čine otopinu.
- Na primjer, razmotrite otopinu koja se sastoji od dvije kemikalije: benzena i toluena. Ukupni volumen otopine je 120 mililitara (ml); 60 ml benzena i 60 ml toluena. Temperatura otopine je 25°C, a tlak pare pri 25°C je 95,1 mmHg. za benzen i 28,4 mm Hg. za toluen. Mora se izračunati tlak pare otopine. To možemo učiniti koristeći gustoće tvari, njihove molekularne težine i vrijednosti tlaka pare:
- Masa (benzen): 60 ml = 0,06 L × 876,50 kg / 1000 L = 0,053 kg = 53 g
- Težina (toluen): 0,06 L × 866,90 kg / 1000 L = 0,052 kg = 52 g
- Mol (benzen): 53 g × 1 mol / 78,11 g = 0,679 mol
- Mol (toluen): 52 g × 1 mol / 92,14 g = 0,564 mol
- Ukupan broj molova: 0,679 + 0,564 = 1,243
- Molni udio (benzen): 0,679/1,243 = 0,546
- Molni udio (toluen): 0,564/1,243 = 0,454
- Rješenje: P otopina = P benzen X benzen + P toluen X toluen
- P otopina = (95,1 mmHg)(0,546) + (28,4 mmHg)(0,454)
- P otopina = 51,92 mmHg Umjetnost. + 12,89 mmHg Umjetnost. = 64,81 mmHg Umjetnost.
- Za korištenje Clausiusove jednadžbe, temperatura mora biti specificirana u stupnjevima Kelvina (označeno s K). Ako imate temperaturu u Celzijevim stupnjevima, trebate je pretvoriti pomoću sljedeće formule: T k = 273 + T c
- Gore navedena metoda funkcionira jer je energija izravno proporcionalna količini topline. Temperatura tekućine je jedini faktor okoliš o kojem ovisi tlak pare.
Zapišite Clausius-Clapeyronovu jednadžbu koja se koristi za izračunavanje tlaka pare koja se mijenja tijekom vremena. Ova se formula može koristiti u većini fizičkih i kemijskih problema. Jednadžba izgleda ovako: ln(P1/P2) = (ΔH vap /R)((1/T2) - (1/T1)), gdje:
Zamijenite zadane vrijednosti količina u Clapeyron-Clausiusovu jednadžbu. Većina zadataka daje dvije vrijednosti temperature i vrijednost tlaka ili dvije vrijednosti tlaka i vrijednost temperature.
IZGARANJE TEKUĆINA
Izgaranje tekućina karakteriziraju dvije međusobno povezane pojave - isparavanje i izgaranje smjese pare i zraka iznad površine tekućine. Posljedično, izgaranje tekućina prati ne samo kemijska reakcija(oksidacija, prelazak u plameno izgaranje), ali i fizikalne pojave (isparavanje i stvaranje parozračne smjese iznad površine tekućine), bez kojih je izgaranje nemoguće.
Prijelaz tvari iz tekućeg stanja u stanje pare naziva se isparavanje. Postoje dva oblika ovog procesa: isparavanje i vrenje. Isparavanje- ovo je prijelaz tekućine u paru sa slobodne površine na temperaturi ispod vrelišta tekućine (vidi sl. 4.1). Isparavanje se događa kao rezultat toplinskog kretanja molekula tekućine. Brzina kretanja molekula jako varira, snažno odstupajući u oba smjera od svoje prosječne vrijednosti. Dio molekula s dovoljno velikom kinetičkom energijom bježi iz površinskog sloja tekućine u plinski (zračni) medij. Višak energije molekula koji izgubi tekućina troši se na svladavanje sila međudjelovanja između molekula i rada ekspanzije (povećanja volumena) pri prijelazu tekućine u paru. Ključanje- to je isparavanje ne samo s površine, već i iz volumena tekućine stvaranjem mjehurića pare u cijelom volumenu i njihovim oslobađanjem. Isparavanje se opaža pri bilo kojoj temperaturi tekućine. Vrenje se događa tek pri temperaturi pri kojoj tlak zasićene pare dostiže vrijednost vanjskog (atmosferskog) tlaka.
Zbog Brownovog gibanja u zoni plina odvija se i obrnuti proces - kondenzacija. Ako je volumen iznad tekućine zatvoren, tada se pri bilo kojoj temperaturi tekućine uspostavlja dinamička ravnoteža između procesa isparavanja i kondenzacije.
Para u ravnoteži s tekućinom naziva se zasićena para. Stanje ravnoteže odgovara koncentraciji pare određenoj za danu temperaturu. Tlak pare u ravnoteži s tekućinom naziva se tlak zasićene pare.

Riža. 4.1. Shema isparavanja tekućine u: a) otvorenoj posudi, b) zatvorenoj posudi
Tlak zasićene pare (p n.p.) dane tekućine pri konstantnoj temperaturi za nju je konstantan i nepromijenjen. Vrijednost tlaka zasićene pare određena je temperaturom tekućine: s povećanjem temperature raste tlak zasićene pare. To je zbog povećanja kinetičke energije molekula tekućine s povećanjem temperature. U ovom slučaju, sve veći udio molekula ima dovoljno energije da prijeđe u paru.
Dakle, iznad površine (zrcala) tekućine uvijek postoji parozračna smjesa, koju u stanju ravnoteže karakterizira tlak zasićenih para tekućine ili njihova koncentracija. S povećanjem temperature, tlak zasićene pare raste prema Claiperon-Clasiusovoj jednadžbi:
 , (4.1)
, (4.1)
ili u integralnom obliku:
 , (4.2)
, (4.2)
gdje je p n.p. – tlak zasićene pare, Pa;
DH isp je toplina isparavanja, količina topline koja je potrebna za pretvaranje jedinice mase tekućine u stanje pare, kJ / mol;
T je temperatura tekućine, K.
Koncentracija zasićene pare C iznad površine tekućine povezana je s njezinim tlakom odnosom:
 . (4.3)
. (4.3)
Iz (4.1 i 4.2) proizlazi da s porastom temperature tekućine tlak zasićenih para (odnosno njihova koncentracija) eksponencijalno raste. U tom smislu, pri određenoj temperaturi, iznad površine tekućine stvara se koncentracija pare, jednaka donjoj granici koncentracije širenja plamena. Ta se temperatura naziva donja granica temperature širenja plamena (LTLP).
Dakle, za svaku tekućinu uvijek postoji takav temperaturni interval pri kojem će koncentracija zasićenih para iznad zrcala biti u području paljenja, tj. HKPRP £ j n £ VKPRP.
Za regulaciju tlaka isparavanja koristite KVP regulator, koji je instaliran na usisnom vodu iza isparivača (slika 6.13).
Uz svoju glavnu funkciju, regulator tlaka isparavanja osigurava zaštitu u slučaju jakog pada tlaka isparavanja kako bi se spriječilo smrzavanje ohlađene vode na putu izmjene topline isparivača vodenih rashladnih uređaja.
Regulator radi na sljedeći način: kada tlak poraste iznad zadanog tlaka, regulator se otvara, a kada tlak padne ispod zadane vrijednosti, zatvara se. Upravljački signal je samo tlak na ulazu u regulator.
U instalacijama s više isparivača i radom na različitim tlakovima isparavanja, regulator se ugrađuje iza isparivača u kojem je tlak najveći. Kako bi se izbjegla kondenzacija rashladnog sredstva tijekom zaustavljanja, nepovratni ventil montiran je na usisnom vodu neposredno nakon isparivača s minimalnim tlakom. U instalacijama s paralelnim isparivačima i zajedničkim kompresorom, na usisnom vodu se ugrađuje regulator za održavanje istog tlaka u isparivačima.
Osim ove vrste regulatora, tlak isparavanja se stabilizira pomoću jednog ili više elektroničkih sustava upravljanja rashladne prostorije, ormari, itd., pružajući visoku točnost održavanja zadane temperature (±0,5 K) u širokom rasponu kapaciteta hlađenja - od 10 do 100% nazivne vrijednosti.
8. Regulatori učinka.
Regulatori kapaciteta (sl. 6.14) pomažu kapacitetu hlađenja kompresora da se prilagodi promjeni toplinskog opterećenja na isparivaču u instalacijama s vrlo niskim punjenjem rashladnog sredstva. Izbjegavaju nizak usisni tlak i beskorisna pokretanja.

Kako se toplinsko opterećenje isparivača smanjuje, usisni tlak pada, što uzrokuje vakuum u krugu, što dovodi do opasnosti od prodora vlage u instalaciju. Kada usisni tlak padne ispod zadane vrijednosti, regulator se otvara, uzrokujući prelazak određene količine vrućih plinova iz tlačnog u usisni. Zbog toga se usisni tlak povećava, a rashladni kapacitet smanjuje. Regulator reagira samo na tlak u usisnom vodu, tj. na izlazu iz njega.
9. Regulatori pokretanja.
Regulatori pokretanja omogućuju izbjegavanje rada i pokretanja kompresora pri previsokim vrijednostima usisnog tlaka, što se događa nakon dužeg zaustavljanja stroja ili nakon odmrzavanja isparivača.
Regulator pokretanja KVL pripada vrsti regulatora prigušnog tlaka "poslije sebe". Održava konstantan tlak u usisnom vodu između regulatora i kompresora i rasterećuje kompresor pri pokretanju.
Ulazni tlak regulatora djeluje na mijeh odozdo, a na ploču ventila odozgo. Budući da je efektivna površina mijeha jednaka površini otvora, ulazni tlak se neutralizira. Izlazni tlak (u kućištu radilice) djeluje na ploču ventila odozdo, suprotstavljajući se sili zatezanja podesive opruge. Ove dvije sile su aktivne snage regulator. Kada se regulirani tlak na izlazu (u kućištu radilice) smanji, ventil se otvara, propuštajući paru rashladnog sredstva u kompresor. Za rashladne jedinice veliki kapacitet, moguća je paralelna montaža KVL start-up kontrolera. U ovom slučaju, regulatori se biraju iz uvjeta istog pada tlaka u svakom cjevovodu i ekvivalentne izvedbe. 
Regulator je podešen na maksimalne vrijednosti, međutim, bez prekoračenja vrijednosti koje preporučuje proizvođač za kompresor ili kondenzacijsku jedinicu. Podešavanje se provodi prema očitanjima manometra na usisnom vodu kompresora.
Regulator pokretanja ugrađen je na usisnom vodu između isparivača i kompresora (Sl. 6.15).
Kod ovog regulatora moguće je spojiti cijev za odvod pare kroz manometrijski izlaz na ulaznoj cijevi promjera provrta 1/4". Kod ovog načina regulacije odvod pare se vrši "poslije sebe".
Izbor startnog regulatora određen je pet glavnih pokazatelja:
Vrsta rashladnog sredstva
performanse sustava,
proračunski tlak usisavanja,
Maksimalni projektirani tlak,
pad pritiska u regulatoru.
Razlika između projektnog i maksimalnog projektnog usisnog tlaka određuje koliko će dugo ventil biti otvoren. Pad tlaka na regulatoru važan je čimbenik jer gubici tlaka u usisnom vodu utječu na rad stroja. Stoga pad tlaka na regulatoru mora biti minimalan. Tipično, u rashladnim sustavima niske temperature, pad tlaka je 3...7 kPa. Maksimalni pad tlaka za većinu rashladnih sustava je 14 kPa.
Pri maksimalnom otvaranju ventila regulator s jedne strane daje maksimalan učinak, a s druge strane uzrokuje velike gubitke tlaka što smanjuje učinak sustava. Stoga pad tlaka na regulatoru mora biti što niži.