Kao što proizlazi iz same definicije požara, glavni proces koji se događa u požaru je izgaranje
Gorenje je uvijek popraćeno kemijskim transformacijama. Izgaranje u zraku je međudjelovanje zapaljive tvari s kisikom. Međutim, treba imati na umu da dušikovi oksidi, halogeni i ozon mogu djelovati kao oksidansi u procesu izgaranja. Poznati su procesi izgaranja koji se odvijaju uz sudjelovanje samo jednog početnog produkta - spoja sposobnog za brzu razgradnju. Primjeri takvih spojeva su acetilen i hidrazin.
Kemijski procesi procesi koji se odvijaju tijekom izgaranja izuzetno su složeni. Čak i za najjednostavniji slučaj - izgaranje vodika u kisiku, čija generalizirana jednadžba ima oblik
2H 2 + 0 2 = 2H 2 0,
Utvrđeno je i proučavano nekoliko desetaka osnovnih stadija.
Do danas su dovoljno detaljno proučeni mehanizmi kemijskih transformacija tijekom izgaranja samo nekoliko tvari: vodik, ugljikov monoksid, metan i etan. Ovo se znanje koristi za predviđanje paljenja i uvjeta izgaranja za mnoge tvari.
2.1. Lančane reakcije
Lančane reakcije, za razliku od običnih kemijskih transformacija, karakterizira pojava aktivne čestice u svakom elementarnom činu: atom s nesparenim elektronom, slobodni radikal ili ion. Pojava aktivnih čestica uzrokuje lanac transformacija polaznih tvari u produkte reakcije. Atomi, slobodni radikali i ioni reaktivniji su od valentno zasićenih molekula. Stoga, unatoč značajnim troškovima energije potrebnim za kidanje kemijskih veza i stvaranje aktivnih čestica, lančani razvoj reakcije često se pokaže energetski povoljnijim od izravne interakcije među molekulama.
Procesi izgaranja uglavnom se odvijaju lančanim mehanizmom. Lančane reakcije su složene reakcije koje se odvijaju u nekoliko faza, a to su:
Nukleacija lanaca (inicijacija), u kojoj nastaju aktivne čestice;
Nastavak lanaca, u kojima aktivne čestice stupaju u kemijsku interakciju s izvornim tvarima, što rezultira stvaranjem novih aktivnih čestica;
Prekid lanca, u kojem dolazi do "smrti" aktivnih čestica uz stvaranje konačnih produkata reakcije
Nukleacija lanaca može se dogoditi pod različitim uvjetima. Na primjer, kao rezultat disocijacije molekula pod utjecajem toplinske energije, odnosno ionizirajućeg zračenja, u električnom pražnjenju. Smrt aktivnih čestica događa se tijekom njihove rekombinacije*, tijekom međudjelovanja slobodnih radikala (homogena terminacija lanca), tijekom interakcije aktivnih čestica s čvrstim površinama (heterogena terminacija lanca) ili kao rezultat njihove reakcije s inhibitorima izgaranja.
Postoje nerazgranate i razgranate lančane reakcije. U nerazgranatim, za svaku aktivnu česticu utrošenu u reakcijama nastavka lanca postoji jedna novonastala. Broj molekula produkta formiranih po početnoj aktivnoj čestici naziva se duljina lanca. Duljina lanaca u reakcijama izgaranja kreće se od stotina tisuća do desetaka milijuna. Na brzinu nerazgranatih lančanih reakcija mogu utjecati manje nečistoće tvari koje mogu učinkovito komunicirati s aktivnim česticama - inhibitorima izgaranja.
Neke tvari - inicijatori - olakšavaju stvaranje aktivnih čestica i time ubrzavaju nerazgranate lančane reakcije.
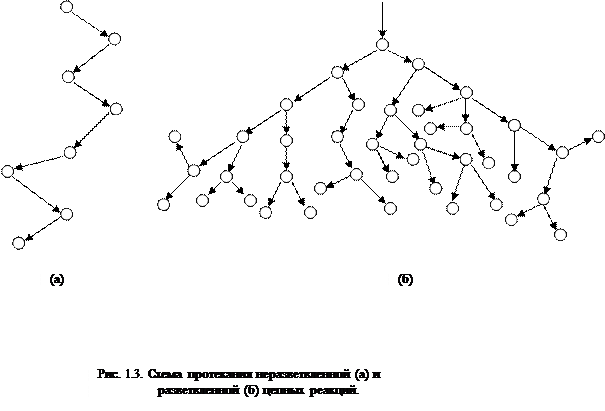
U razgranatim lančanim reakcijama, jedna aktivna čestica, koja se troši dok se lanac nastavlja, proizvodi dvije ili više aktivnih čestica. Jedan od njih nastavlja primarni lanac, dok drugi započinju nove lance, tvoreći grane (Slika 2.1).
"Rekombinacija je proces nastanka neutralnih atoma ili molekula iz nabijenih čestica. Atomi i molekule nastali tijekom rekombinacije mogu biti u osnovnom ili pobuđenom stanju.

Riža. 2.1. Shematski prikaz reakcijskih lanaca:
a) grananje u svakoj karici lanca
6) rijetko grananje
Na primjer, pri izgaranju vodika u reakciji lančane nukleacije:
nastaje aktivni atom. U reakciji nastavka lanca:

dolazi do povećanja broja aktivnih atoma, koji su početak novih lanaca.
Razgranate lančane reakcije mogu se dogoditi u stacionarnom načinu, u kojem je brzina grananja manja od brzine smrti aktivnih čestica, i u nestacionarnom načinu, u kojem se smrt događa sporije od grananja. U potonjem slučaju, brzina lančane reakcije raste eksponencijalno i ograničena je samo potrošnjom polaznih tvari. Prijelaz iz stacionarnog u nestacionarni način događa se naglo s laganom promjenom uvjeta reakcije: temperature, tlaka ili koncentracije jednog od reaktanata. Takvo brzo ubrzanje smatra se spontanim paljenjem reakcijske smjese ili lančanom eksplozijom.
Otkriće razgranatih lančanih reakcija bilo je od velike važnosti za stvaranje teorije procesa izgaranja. Dokazano je da postoje dvije vrste paljenja: toplinsko i lančano. Obrasci uspostavljeni u
Poglavlje 2. Kemijski procesi tijekom gori
Teorija lančanih procesa omogućuje učinkovito djelovanje na razvoj i suzbijanje procesa izgaranja tijekom požara.
Podrijetlo lanaca. Proces nukleacije početnih aktivnih centara ima veliku ulogu u razvoju nerazgranatih lančanih reakcija. Nadoknađuje gubitak aktivnih centara tijekom reakcija prekida lanca. Ovaj mehanizam određuje uvjete za nastanak stacionarni način rada tijekom početnog razdoblja nakupljanja aktivnih centara. Uz nisku stopu inicijacije, ovo razdoblje može biti značajno.
Većina kemijskih reakcija u plamenu odlikuje se značajnom rezervom energije aktivnih centara. Pod tim uvjetima, pokretanje aktivnih centara povezano je s prevladavanjem značajne energetske barijere.
U ovom slučaju važnu ulogu igraju čimbenici koji osiguravaju značajnu stopu stvaranja aktivnih centara: kemijski aktivni aditivi, zračenje, električno pražnjenje, proizvodi radioaktivnog raspada.
Među čimbenicima koji značajno olakšavaju stvaranje aktivnih centara treba istaknuti heterogene reakcije. U molekulama zapaljivih tvari adsorbiranih na čvrstu površinu, međuatomske veze su oslabljene i potrebno je manje energije za njihovo prekidanje. Pod tim uvjetima, brzina stvaranja aktivnih centara je znatno veća nego u volumenu plina. Energija aktivacije tijekom heterogenog međudjelovanja komponenata zapaljive smjese također je niža nego kod homogenog međudjelovanja. Heterogena inicijacija aktivnih centara u uvjetima realnih procesa izgaranja je važan faktor ubrzano postizanje stacionarnog režima u nerazgranatim lančanim procesima.
Neke značajke karakteriziraju nerazgranate lančane reakcije koje se odvijaju uz sudjelovanje atomskih komponenti. U nedostatku nečistoća koje međudjeluju s aktivnim centrima bez regeneracije, prekid lanca postaje moguć samo rekombinacijom atoma kroz trostruke sudare i na površini.
Na bilo kojoj temperaturi sve su plinovite tvari djelomično disocirane. Neke se molekule raspadaju na atome. U ovom slučaju postoji ravnoteža između procesa disocijacije i spajanja atoma u molekule. Stupanj disocijacije eksponencijalno ovisi o temperaturi.
Ako u zapaljivoj smjesi nema nečistoća koje završavaju lanac, tada se koncentracija atomskih komponenti reakcije praktički ne mijenja. Atomi koji ulaze u reakciju odmah se regeneriraju u istoj ko-
Korolchenko A.Ya. Procesi izgaranja i eksplozije
osobnost. Početna inicijacija kompenzira izreagirane atome u istom broju kao u sustavu koji ne reagira. Stacionarna reakcija ne utječe na ovaj proces. Ravnoteža jedne od komponenti reakcije, koju karakterizira najmanje jaka veza između atoma u molekuli, je karakteristična značajka sličan režim. Koncentracija druge atomske komponente je kvazistacionarna, ali veća od ravnotežne.
Kod homogenog pokretanja reakcija izgaranja, stacionarni režim će se uspostaviti tek nakon određenog vremena, jer je za disocijaciju potrebna velika aktivacijska energija. Tijekom tog razdoblja, brzina disocijacije premašuje brzinu rekombinacije, a aktivni centri se nakupljaju u reakcijskom sustavu. Brzine oba procesa uspoređuju se tek nakon što se koncentracija aktivnih centara poveća do ravnoteže. Ovo vremensko razdoblje naziva se indukcijsko razdoblje.
Prisutnost čvrste površine kao katalizatora u reakcijskoj zoni ne mijenja stanje termodinamičke ravnoteže. Katalizator podjednako utječe na prednju i obrnutu reakciju. Aktivni centri ne samo da nukleiraju na čvrstoj površini, već i završavaju na njoj. Međutim, prisutnost katalizatora ubrzava postizanje ravnotežnog stanja disocijacije.
Ako zapaljiva smjesa sadrži aktivne nečistoće koje mogu sudjelovati u reakcijama prekida lanca, tada one smanjuju koncentraciju aktivnih centara. U tom slučaju dolazi do poremećaja ravnotežne disocijacije jedne od polaznih komponenti, što usporava reakciju i može dovesti do njezina prekida.
Eksperimenti pokazuju da kada se nerazgranata lančana reakcija pokrene vanjskim izvorom (na primjer, izvorom svjetlosti), koncentracija aktivnih centara u početnoj fazi razvoja procesa izgaranja može značajno premašiti ravnotežnu.
Kada se pojave razgranate lančane reakcije, uvjeti početnog pokretanja imaju značajan utjecaj na razvoj reakcije. U procesima koji se sporo odvijaju, dodavanjem djelomično izreagirane smjese izvornoj skraćuje se indukcijski period i ubrzava trenutak plamenog izgaranja.
Nastavak lanaca. Karakteristična značajka nerazgranatih lančanih reakcija je kvazistacionarna priroda koncentracije aktivnih centara. U nedostatku prekida lanca, stvaraju se aktivne čestice
Poglavlje 2. Kemijski procesi tijekom izgaranja
istoj količini u kojoj se konzumiraju. Novi nastaju samo tijekom početne inicijacije. Kada su brzine stvaranja aktivnih centara i prekida lanca jednake, uspostavlja se stalna koncentracija aktivnih centara i stacionarni način reakcije. Brzina reakcije će se smanjivati kako se polazne komponente troše.
U slučaju razgranate lančane reakcije, koncentracija aktivnih centara u reakcijskom sustavu raste bez obzira na uvjete njihovog početnog pokretanja. Realizira se samoubrzavajući način reakcije, koji ima lavinski karakter. U tom slučaju za potpunu pretvorbu početnih komponenti u konačne produkte reakcije dovoljan je jedan početni aktivni centar.
Kinetička jednadžba razgranate vrijednosne reakcije je sljedeća. Promjene koncentracija stabilnih polaznih komponenti tijekom vremena mogu se zanemariti kao prva aproksimacija, a mogu se uzeti u obzir samo brže promjene koncentracija aktivnih centara P. Promjene u ovoj stopi određene su brzinom inicijalne inicijacije i omjerom brzina reakcija grananja i prekida lanca. Brzina inicijalne inicijacije ne ovisi o koncentraciji aktivnih centara prisutnih u sustavu. Brzine procesa grananja i završetka proporcionalne su koncentracijama aktivnih centara. Pod ovim uvjetima, ukupna ravnoteža formiranja i potrošnje aktivnih centara određena je zbrojem stopa procesa inicijacije, grananja i završetka:
![]() (2.1)
(2.1)
gdje su i konstante brzine za reakcije grananja i prekidanja. Označavajući , dobivamo:
![]() (2.2)
(2.2)
Kada je vremenska derivacija koncentracije aktivnih centara
pozitivan. U tom se slučaju brzina reakcije s vremenom povećava. Ova značajka reakcija razgranatog lanca posljedica je umnažanja aktivnih centara pod takvim režimima kada brzina reakcije grananja premašuje brzinu reakcije prekida lanca.
Korolchenko A.Ya. Procesi izgaranja i eksplozije
Ako prije početka reakcije sustav nije sadržavao aktivne centre, tj. nat= 0, n = 0 integracija jednadžbe (2.2) daje:
![]() (2.3)
(2.3)
Ukupna brzina CO reakcije određena je brzinom procesa grananja. Konačni produkti nastaju tek tijekom te reakcije. Za svaki elementarni čin grananja lanca nastaju molekule konačnog produkta. Stoga:
![]() (2.4)
(2.4)
Razvoj lančane reakcije tijekom vremena određen je omjerom konstanti brzine za reakcije grananja i prekida lanca i At, tj. kada je eksponent u jednadžbi (2.4) pozitivan i re-
radnja se samoubrzava unedogled. U početnom razdoblju razvoja reakcije vrijedi sljedeći omjer:
Zbog činjenice da je početna stopa inicijacije niska, nema zamjetne kemijske transformacije u početnom razdoblju. Nakon nekog vremena vrijednost postaje znatno veća od jedinice. Nakon toga, brzina reakcije, u skladu s jednadžbom (2.4), počinje brzo rasti i doseže vrlo visoke vrijednosti, iako je prije toga bila praktički neprimjetna.
Prisutnost razdoblja kašnjenja (indukcijskog razdoblja) tijekom razvoja lančane reakcije posljedica je potrebe akumulacije određenog broja aktivnih centara u reakcijskom sustavu. Tek nakon toga postaje vidljiva kemijska transformacija.
Veličina indukcijskog razdoblja u lančanim reakcijama određena je omjerom brzina procesa grananja i prekida lanca, a ne brzinom početnog pokretanja. S druge strane, određuju se brzine reakcija grananja i završetka kemijske značajke svakog reakcijskog sustava određene su ovisnostima o temperaturi i koncentracijama polaznih komponenti. Osobitost lančanih reakcija je
je da procesi grananja zahtijevaju značajnu aktivacijsku energiju, dok temperaturni koeficijent Konstanta brzine procesa završetka je blizu nule. Za reakcije prekida lanca sva tri tipa: tijekom skupne i heterogene rekombinacije, tijekom interakcije radikala s aktivnim nečistoćama, energije aktivacije jednake su nuli.
S porastom temperature, ukupnog tlaka smjese ili promjenom koncentracije reagirajućih komponenata, moguća je takva promjena konstanti brzine grananja i završetka, pri kojoj reakcija prelazi iz stacionarnog načina u ne- stacionarni. Osobitost ovog procesa leži u naglom prijelazu s jednog načina na drugi, u promjeni brzine reakcije od zanemarive vrijednosti do neograničeno rastuće.
Pojava nekih lančanih reakcija popraćena je stvaranjem intermedijarnih produkata koji su relativno stabilni, ali istodobno imaju sposobnost generiranja aktivnih centara. Takve reakcije uključuju, na primjer, reakcije izgaranja ugljikovodika, u kojima nastaju peroksidi i aldehidi kao međuproizvodi. To dovodi do grananja lanca. Međutim, zbog relativne stabilnosti intermedijarnih produkata, ubrzanje reakcije je produženo tijekom vremena. Takvo sporo grananje lanaca naziva se degeneriranim.
Lančane reakcije s uobičajenim mehanizmom grananja radikala u pravilu se odvijaju prilično brzo zbog visoke aktivnosti radikala. Rezultirajući radikali ili započinju brzo ubrzanu reakciju ili se rekombiniraju i izlaze iz procesa.
Prekinuti strujni krugovi. Aktivna čestica, kao i svaka molekula plina, prolazi kroz kaotična kretanja unutar sustava koji reagira, sudarajući se s drugim molekulama. U tom slučaju postoji određena vjerojatnost da će tijekom nekog sudara doći do interakcije s drugom aktivnom česticom ili molekulom i stvaranja nove aktivne čestice, nastavljajući put prethodne. Razvoj reakcijskog lanca sličan je Brownovom gibanju inertnih molekula, iako prijenos aktivnih centara prati kemijska reakcija. Na putu razvoja lanca izmjenjuju se dva ili više tipova aktivnih centara.
Korolchenko A.Ya. Procesi izgaranja i eksplozije
Lanac reakcija se nastavlja do trenutka kada aktivna čestica reagira bez regeneracije. U tom slučaju dolazi do takozvanog prekida strujnog kruga. Terminacijski procesi igraju veliku ulogu u kinetici lančanih reakcija. Postoje dvije moguće vrste reakcija koje dovode do smrti aktivnih centara:
Homogeno prekidanje (smrt u volumenu reakcijske smjese);
Heterogeni prekid strujnog kruga (smrt na čvrstoj površini) Homogeni prekid strujnog kruga moguć je u jednom od dva procesa:
tijekom rekombinacije radikala ili tijekom interakcije različitih kemijski aktivnih komponenti s aktivnim centrima bez regeneracije potonjih.
Heterogeni prekid strujnog kruga događa se na česticama čađe koje nastaju tijekom izgaranja ili na površini krutih gorućih materijala. Završetak lanca na čvrstoj površini može se smatrati difuzijom aktivnih centara iz plinska smjesa ovoj površini na kojoj nestaju. Mehanizam rekombinacije na čvrstoj površini je da se aktivna čestica s povećanom reaktivnošću sorbira* na površini. Radikali nakupljeni u susjednim područjima međusobno se rekombiniraju, budući da tom procesu nema energetskih ni prostornih prepreka. Molekule stabilnih spojeva nastale kao rezultat rekombinacije više ne sudjeluju u odvijanju lančane reakcije.
Međutim, svaki sraz aktivne čestice s čvrstom površinom ne dovodi do njezine adsorpcije. Može se reflektirati od površine. Vjerojatnost adsorpcije aktivnog centra na čvrstu površinu naziva se akomodacijskim koeficijentom. Ovaj koeficijent je karakteristika kemijskog afiniteta aktivne čestice i površine. U praktično važnim slučajevima aktivna se čestica nakon refleksije od stijenke ne udaljava od nje. Postoji mogućnost novih sudara sa zidom dok ne dođe do njegove akomodacije. Zbog ovog procesa, pod određenim uvjetima, brzina reakcije je praktički neovisna o koeficijentu akomodacije. Proces se odvija na sljedeći način:
* Sorpcija je apsorpcija krutine (ili tekućine) tvari iz okoline. Apsorbirajuće tijelo naziva se sorbent, apsorbirano- sorbat. Razlikuje se apsorpcija cjelokupnom masom sorbensa (apsorpcija) i površinskim slojem (adsorpcija). Sorpcija uslijed interakcije kemijski tip između površine čvrstog sorbenta i sorbata naziva se kemisorpcija.
__________________________ Poglavlje 2. Kemijski procesi tijekom izgaranja
bi li pri svakom sudaru došlo do prekida strujnog kruga. Koncentracija aktivnih centara na površini može se uzeti jednakom nuli.
U nedostatku aktivnih nečistoća u reakcijskoj smjesi, prekid lanca može se dogoditi ili na čvrstim površinama ili homogeno rekombinacijom radikala u masi. U stvarnim požarima uglavnom se provodi drugi način.
Dodaci inertnih plinova u reakcijski sustav imaju određeni utjecaj na kinetiku lančanih reakcija. Inertni aditivi povećavaju broj sudara s aktivnim česticama, povećavaju vjerojatnost loma lanca i, sukladno tome, inhibiraju ukupnu reakciju.
Učinkovitije inhibiranje lančanih reakcija postiže se uvođenjem kemijski aktivnih dodataka - inhibitora - u reakcijsku smjesu. Inhibitori stupaju u interakciju s aktivnim centrima koji vode reakciju, prekidajući lance. Kinetika reakcije u inhibiranoj smjesi određena je uvjetima natjecanja između inhibitora i glavnih komponenti reakcije pri interakciji s aktivnim centrima. Uz visoku učinkovitost inhibitora i umjerenu brzinu stvaranja novih aktivnih centara, čak i mali dodaci inhibitora mogu potpuno potisnuti lančanu reakciju.
Procesi inhibicije imaju veliki značaj u praksi zaštite od požara i eksplozija. Korištenje inhibitora omogućuje učinkovito djelovanje na procese izgaranja.
2.2. Kemijski procesi pri izgaranju vodika
Interakcija molekule vodika s molekulom kisika odvija se na složen način kroz više uzastopnih faza. Sada je čvrsto utvrđeno da se izgaranje vodika odvija lančanim mehanizmom, pri čemu čestice igraju ulogu aktivnih centara. Redoslijed i značaj elementarnih reakcija tijekom izgaranja vodika vrlo su detaljno opisani za raznim uvjetima pojava i razvoj vodikovog plamena.
Najdetaljniju analizu procesa izgaranja vodika u načinu samozapaljenja eksperimentalnim i računalnim metodama proveo je profesor A. N. Baratov. Predložio je sljedeću shemu procesa, uključujući četrnaest osnovnih elementarnih reakcija:
Korolchenko A.Ya. Procesi izgaranja i eksplozije
U skladu s reakcijom dolazi do nukleacije aktivnih centara
![]()
Nastavak lanaca reakcijama
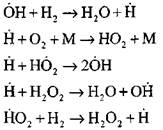
Razgranati lanci
 |
prekinuti strujni krugovi
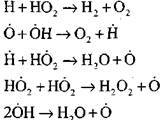 |
Koncentracija vodikovih atoma u početnoj fazi procesa samozapaljenja je neznatan dio početnog sadržaja vodika. Kako se lančana reakcija razvija, brzina pretvorbe molekularnog vodika postaje toliko visoka da se troši u stotinkama sekunde.
2.3. Kemijske reakcije pri izgaranju ugljikovog monoksida
Međudjelovanje ugljičnog monoksida s kisikom najvažnija je reakcija za procese izgaranja. Pojava ove reakcije u
__________________________ Poglavlje 2. Kemijski proces s kada gori
u mnogim slučajevima određuje obrasce izgaranja tvari koje sadrže ugljik. Reakciju karakterizira mehanizam razgranatog lanca. Razlikuje se u nizu značajki.
Dugo je vladalo uvjerenje da se apsolutno suha smjesa CO i 0 2 ne može zapaliti i izgorjeti. Međutim, pažljivo postavljeni pokusi u kojima je odsutnost vode praćena pomoću spektrografa masa pokazali su da je paljenje moguće i za suhu smjesu. Treba napomenuti da prisutnost vode ili vodikove pare u sustavu CO + 0 2 aktivira proces paljenja i izgaranja povećanjem broja mogućih aktivnih centara. Ubrzavajući učinak vode posebno je uočljiv pri niskim koncentracijama.
Izgaranje ugljičnog monoksida u prisutnosti vodene pare ili malih dodataka vodika odvija se uz sudjelovanje sljedećih elementarnih procesa:

Radikali, H0 2 nastali u reakciji (VI) mogu nastaviti lanac (reakcija VIII) ili dovesti do njegovog prekida u reakciji (IX-XII).
Za procjenu uvjeta za prijelaz spore oksidacije CO u lančanu eksploziju, procjenjujemo vjerojatnost prekida lanca kroz H0 2 radikal; Istovremeno, uzimamo u obzir da će uloga reakcija (X) i (XI) u prekidanju lanca biti beznačajna zbog
u usporedbi s reakcijom (IX), budući da su konstante brzine procesa (IX-XI) na temperaturama reda 1000 K bliske jedna drugoj, ali su koncentracije radikala znatno niže od koncentracije vodikovih atoma, budući da radikali imaju veća kemijska aktivnost. Stoga se vjerojatnost prekida lanca kroz H0 2 radikal može napisati kao:
Na temperaturi od 1000K
Prema tome, pod uvjetom da
![]()
![]()
utjecaj veličine
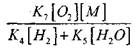
na rješenje jednadžbe (2.7) bit će slab.
Poglavlje 2. Kemijski procesi tijekom izgaranja
Kada ![]() ili
ili ![]() (što se uočava u
(što se uočava u
pravi CO plamen), jednadžba (2.7) se transformira u oblik:
![]() (2.8)
(2.8)
Dakle, uvjet za izgaranje ugljičnog monoksida u zraku uvelike je određen prisutnošću i obrascima izgaranja vodika. Oksidacija CO reakcijom (I) ovisi o koncentraciji OH radikala nastalih u reakcijama s vodikom.
Osobitost reakcije izgaranja ugljičnog monoksida je njegova brza inhibicija kada se u reakcijski sustav uvedu mali dodaci tvari s visokim afinitetom za vodikove atome. Takve tvari koje inhibiraju izgaranje CO su halogeni i halogenirani derivati ugljikovodika. Njihov inhibitorni učinak je zbog prekida reakcijskih lanaca u interakciji s atomima vodika prema reakciji
2.4. Izgaranje ugljikovodika
Razmatranje procesa izgaranja vodika i ugljikovog monoksida pokazuje složenost mehanizma reakcije izgaranja. U slučaju H 2 i CO, reakcija se odvija kao lančana reakcija uz sudjelovanje mnogih elementarnih faza i međuproizvoda. Stoga je prirodno očekivati da je mehanizam reakcija gorenja tvari složenije strukture - ugljikovodika - još složeniji, a učinci koji prate procese paljenja i gorenja ovih spojeva raznolikiji.
Trenutno dostupne informacije o prirodi kemijskih viška ugljikovodika tijekom njihovog izgaranja omogućuju objašnjenje opaženih učinaka s određenom aproksimacijom.
Utvrđeno je da u plamenu ugljikovodika, uz već poznate aktivne čestice, postoji veliki broj međuproizvoda složenije strukture. U nekim slučajevima oni postaju izvori podrijetla novih lanaca. Glavnu ulogu u procesima paljenja i izgaranja ugljikovodika igraju sljedeće vrste intermedijarnih spojeva:
Korolchenko A.Ya. Procesi izgaranja i eksplozije
1. Ugljikovodični radikali, koji su molekula ugljika
klorovodik iz kojeg je uklonjen jedan ili više atoma vodika. ove
ostaci se nazivaju alkili (CH3 - metil; C2H5 - etil; C3H7 - propil i
itd.). Zbog visoke reaktivnost slobodni alkili
ne postoje već duže vrijeme. Prisutan u plamenu kao intermedijer
novi proizvodi. U interakciji s drugim molekulama ponašaju se
kao samostalna strukturna grupa. Ugljikovodični radikali
obično se predstavlja slovom R.
2. Peroksidi su spojevi opće formule R-00-R."
3. Spojevi tipa aldehida
![]()
Najjednostavniji aldehidi su mravlja (formaldehid) i octena (acetaldehid) ![]() . Ove tvari su sve
. Ove tvari su sve
kada su prisutni u produktima nepotpunog izgaranja ugljikovodika.
Svaka reakcija u kojoj nastaju ugljikovodični radikali može pokrenuti lanac tijekom izgaranja ugljikovodika. To može biti reakcija razgradnje molekule etana s stvaranjem dviju slobodnih metilnih skupina:
![]()
ili reakcija ugljikovodika s kisikom:
![]()
Nastavak lanaca nastaje kao rezultat reakcija stvaranja | peroksidi ili hidroperoksidi:
![]()
Tijekom razgradnje hidroperoksida dolazi do grananja lanca:
Poglavlje 2. Kemijski procesi tijekom izgaranja
Zadani slijed reakcija dovodi do postupnog povećanja koncentracije peroksidnih spojeva u reakcijskom sustavu.
Istodobno s nakupljanjem peroksida, radikala i
Moguće su paralelne reakcije:
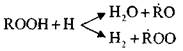
Ove reakcije su egzotermne; Kada se pojave, oslobađa se velika količina topline.
Kako se temperatura reakcijske smjese povećava, uloga aktivnih centara prelazi s jednog međuproizvoda na drugi sljedećim redom: alkil hidroperoksidi, acil hidroperoksidi, formaldehidi.
Eksperimentalne studije promjene u sastavu reakcijske smjese tijekom vremena u području visokih temperatura (600-800°C) pokazuju da se proces pretvaranja početnih ugljikovodika u konačne produkte izgaranja dijeli u dvije faze: u prvoj, koja se odvija na vrlo velike brzine, dolazi do oksidacije ugljikovodika u CO. U drugom, sporom stupnju, CO se oksidira do . To dovodi do vrlo važnog zaključka: mnogi obrasci izgaranja ugljikovodika mogu se objasniti karakteristikama izgaranja ugljičnog monoksida.
2.5. Izgaranje ugljika
Izgaranje ugljika odvija se prema mehanizmu heterogenog procesa, čija je specifičnost u tome što se kemijski stadij ne može promatrati odvojeno od procesa prijenosa plinovitog oksidansa (kisika iz zraka) iz okolnog prostora na površinu. gori čvrsta. Pokazalo se da brzina gorenja ovisi o oboje kemijska svojstva ugljika, te o karakteristikama koje određuju proces opskrbe kisikom površine goriva. Dovod kisika u zonu izgaranja događa se difuzijom i stoga
Korolchenko A.Ya. Procesi izgaranja i eksplozije
ovisi o mnogim čimbenicima: obliku i veličini gorućeg tijela, kretanju plinovitog medija, koeficijentima difuzije kisika i produkata reakcije kako u prostoru iznad površine goriva tako iu pukotinama i porama ugljena i koksa u značajne količine.
Da bismo ilustrirali značajke heterogenog izgaranja ugljika, razmotrimo ponašanje pojedinačnog komada ugljena stavljenog u ložište zagrijano na temperaturu od 900°C. U početnom trenutku doći će do izgaranja ugljena zbog kisika koji se nalazi blizu njegove površine. Nakon što se potroši, oko zagrijane površine stvara se sloj produkata izgaranja -. Brzina izgaranja će se smanjiti, a proces bi se mogao zaustaviti da nema dovoda kisika iz udaljenijih područja plinskog prostora.
Do ove opskrbe dolazi difuzijom, a brzina izgaranja bit će određena veličinom difuzijskog toka. Intenzitet difuzije uvelike ovisi o intenzitetu i prirodi kretanja plinovitog medija u blizini goruće površine. Ubrzati kemijska reakcija određena uglavnom temperaturom. Heterogene reakcije, kao i one homogene, podliježu Arrheniusovom zakonu.
Na visoka temperatura reakcija oksidacije ugljika odvija se vrlo brzo, a ukupna brzina procesa bit će ograničena difuzijom kisika na površinu.
Dakle, proces izgaranja ugljika sastoji se od dva procesa različite prirode: procesa prijenosa kisika zraka iz plinskog prostora do mjesta njegove potrošnje i procesa njegove kemijske interakcije s površinom čvrstog ugljika. Oba ova procesa su međusobno povezana, ali svaki ima svoje obrasce. Najvažniji od tih procesa je proces potrošnje kisika, koji karakterizira niz kemijskih reakcija.
Mehanizam složene reakcije spajanja kisika s ugljikom je istovremeno stvaranje dvaju oksida CO i CO 2 kroz intermedijarni fizikalno-kemijski kompleks oblika C X 0 Y, koji se zatim cijepa na CO i. Omjer između ovih oksida ovisi o uvjetima izgaranja. Prema tome, jednadžba za reakciju izgaranja ugljika može se napisati na sljedeći način:
Poglavlje 2. Kemijski procesi tijekom izgaranja
Zatim dolazi do homogene reakcije izgaranja ugljičnog monoksida:
čiji se mehanizam raspravlja u odjeljku 2.3.
Ova reakcija se može dogoditi blizu površine ugljika, Tako i unutar ugljene mase, u njenim porama i pukotinama.
Druga reakcija je heterogena reakcija između užarenog ugljika i ugljičnog dioksida:
![]()
Javlja se znatnom brzinom na mjestima gdje nedostaje kisika, ali gdje je temperatura ugljika prilično visoka.
Ukupnost opisanih reakcija određuje sastav produkata izgaranja ugljika.
POJAVA PROCESA IZGARANJA
| G |
Gorenje u zapaljivim smjesama može nastati kao posljedica njihovog samozapaljenja, paljenja vanjskim izvorom ili samozapaljenja. Ako su procesi samozapaljenja i paljenja karakteristični za tvari u plinovitom, tekućem ili krutom stanju, onda je samozapaljenje karakteristično za čvrste materijale (osobito one u fino usitnjenom stanju) ili tekućine visokog vrelišta raspoređene na materijalima s razvijenom površinom. .
3.1. Samozapaljivost. Stacionarna teorija
Pojednostavljeno rečeno, izgaranje se podrazumijeva kao brzotekući egzotermni proces oksidacije tvari atmosferskim kisikom uz oslobađanje značajna količina emisija topline i svjetlosti.
Izgaranje je složen fizikalno-kemijski proces interakcije između zapaljive tvari i oksidansa, kao i razgradnje određenih tvari, karakteriziran samoubrzavajućom transformacijom uz oslobađanje velika količina emisija topline i svjetlosti. Obično je kisik iz zraka s koncentracijom 21 uključen kao oksidacijsko sredstvo u ovaj proces. oko. %. Za nastanak i razvoj procesa izgaranja potrebna je zapaljiva tvar, oksidans i izvor paljenja koji pokreće određenu brzinu kemijske reakcije između goriva i oksidansa.
Izgaranje se, u pravilu, događa u plinovitoj fazi, stoga zapaljive tvari u kondenziranom stanju (tekućine i krutine) moraju proći kroz rasplinjavanje (isparavanje, raspadanje) kako bi došlo do i održavanja gorenja. Izgaranje se odlikuje nizom vrsta i značajki koje određuju procesi prijenosa topline i mase, čimbenici plinske dinamike, kinetika kemijskih reakcija i drugi čimbenici, kao i Povratne informacije između vanjski uvjeti i prirodu razvoja procesa.
2.4.2.1. Podjela procesa izgaranja.
Izgaranje može biti homogena I heterogena ovisno o agregatnom stanju zapaljivih tvari i oksidansa.
Homogeno izgaranje nastaje kada komponente zapaljive smjese koje reagiraju imaju isto agregatno stanje. Homogeno izgaranje može biti kinetički I difuziju ovisno o uvjetima nastanka smjese zapaljivih komponenata i o omjeru brzina kemijskih reakcija i stvaranja smjese. Jedan ili drugi način izgaranja ostvaruje se, na primjer, tijekom požara, ovisno o tome koji je stupanj procesa izgaranja ograničavajući: brzina stvaranja smjese ili brzina kemijskih reakcija.
Kinetičko je izgaranje prethodno pomiješanih plinskih ili parozračnih smjesa (ograničavajuća faza procesa je brzina kemijskih reakcija), koje često ima eksplozivnu prirodu (ako smjesa nastaje u zatvorenom prostoru), jer Energija oslobođena u ovom slučaju nema vremena da se isprazni izvan ovog prostora. Kinetičko izgaranje može biti i mirno ako se zapaljiva smjesa najprije stvara u malom, otvorenom prostoru uz kontinuirani dotok goriva u zonu izgaranja.
Difuzijski način izgaranja ostvaruje se kada se zapaljiva smjesa stvara izravno u zoni izgaranja, kada oksidans ulazi u nju zbog difuzijskih procesa, npr. heterogena gori.
Heterogeno izgaranje događa se pri različitim agregatnim stanjima zapaljive tvari i oksidatora. Kod heterogenog izgaranja važnu ulogu ima intenzitet strujanja para koje nastaju iz kondenziranih zapaljivih tvari (tekućine, krutine) u reakcijsku zonu.
S plinodinamičkog gledišta izgaranje može biti laminaran I turbulentan.
Laminarni proces izgaranja događa se kada komponente zapaljive smjese uđu u reakcijsku zonu pri niskim vrijednostima Reynoldsovog kriterija (0< R e < 200), т.е. в основном за счёт молекулярной диффузии. Процесс характеризуется малыми скоростями газовыхprotok goriva i oksidatora te sloj po sloj širenje zone reakcije (fronta plamena) u prostoru. Brzina gorenja u ovom slučaju ovisi o brzini stvaranja zapaljive smjese.
Turbulentni način procesa ostvaruje se kada komponente zapaljive smjese uđu u reakcijsku zonu pri visokim vrijednostima Reynoldsovog kriterija (230< R e< 10000). Izgaranje u ovom načinu rada događa se s povećanjem brzine plina potoci kada je laminarnost njihovog kretanja poremećena. U turbulentnom načinu izgaranja, turbulencija plinskih mlaznica poboljšava miješanje reagirajućih komponenata, dok se površina kroz koju dolazi do molekularne difuzije povećava, što rezultira povećanjem brzine širenja plamena u prostoru.
Prema brzini širenja plamena u prostoru izgaranje se dijeli na:
– deflagracija(brzina širenja plamena je nekoliko m/s);
– Eksplozivno(brzina širenja plamena je desetke i stotine m/s, ali ne više od brzine širenja zvuka u zraku (344 m/s));
– detonacija(brzina širenja plamena veća je od brzine zvuka u zraku).
Ovisno o dubini kemijskih reakcija, izgaranje može biti potpuna I nepotpun.
S potpunim izgaranjem, reakcija se odvija do kraja, tj. do stvaranja tvari koje ne mogu dalje međusobno djelovati, s gorivom i oksidansom (početni omjer zapaljive tvari i oksidansa naziva se stehiometrijski). Kao primjer, razmotrimo potpuno izgaranje metana koje se odvija u skladu s reakcijom
CH 4 + 2O 2 = CO 2 + 2H 2 O+ Q
Gdje Q – toplina koja se oslobađa kao rezultat egzotermne reakcije, J.
Kad ugljikovodici potpuno izgore, produkti reakcije su ugljikov dioksid i voda, odnosno neotrovne i nezapaljive tvari. Potpuno izgaranje može se dogoditi i sa stehiometrijskim omjerom goriva i oksidansa, i s viškom oksidansa u odnosu na njegov stehiometrijski sadržaj u zapaljivoj smjesi.
Nepotpuno izgaranje karakterizira nepotpunost kemijske reakcije, tj. Produkti reakcije, u prisutnosti oksidirajućeg sredstva, mogu s njim dalje djelovati u interakciji. Nepotpuno izgaranje nastaje kada je sadržaj oksidansa u zapaljivoj smjesi nedovoljan (u usporedbi sa stehiometrijskim). Kao posljedica nepotpunog izgaranja, npr. ugljikovodika, nastaju otrovne i zapaljive komponente, kao npr. CO, H 2, benzopiren, S(čađ), organske smole i dr., ukupno oko 300 kemijskih spojeva i elemenata.
Uz sve ostale uvjete, kod potpunog izgaranja razvijaju se više temperature nego kod nepotpunog izgaranja.
2.4.2.2. Osnovni mehanizmi procesa izgaranja.
Izgaranje je popraćeno oslobađanjem topline i emisijom svjetlosti i događa se u uvjetima progresivnog samoubrzavanja procesa povezanog s akumulacijom topline u sustavu ( toplinsko izgaranje) ili kataliziranje aktivnih intermedijera reakcije ( lančano sagorijevanje).
Toplinsko izgaranje moguće je tijekom egzotermne reakcije, čija se brzina brzo povećava pod utjecajem topline koja se akumulira u sustavu, što dovodi do povećanja temperature. Kada se postigne temperatura pri kojoj dobitak topline iz reakcije premašuje gubitak topline u okoliš, dolazi do samozagrijavanja sustava, što završava samozapaljenjem zapaljive smjese. U tim uvjetima opaža se spontani razvoj reakcije, popraćen zagrijavanjem nastalih proizvoda do temperature na kojoj počinju emitirati svjetlost (više od 900 °C). DO toplinsko izgaranje uključuju procese sa i bez sudjelovanja atmosferskog kisika (razgradnja eksploziva, ozona, acetilena, peroksida (npr. N 2 OKO 2), interakcija nekih metala s halogenima, sumporom itd.).
Lančano izgaranje moguće je samo u reakcijama kojima je temelj paljenja ili eksplozije lančani proces. Potonji je popraćen stvaranjem nestabilnih intermedijarnih produkata reakcije koji regeneriraju aktivne centre (atome i molekule sa slobodnim kemijskim vezama), što ubrzava proces. Akumulacija dovoljnog broja aktivnih centara pridonosi prijelazu lančanog procesa u toplinski i povećanju temperature smjese do točke njezina samozapaljenja. Takvi aktivni centri nastaju kao rezultat povećanja brzine toplinskog vibracijskog gibanja molekula, a umnožavaju se zbog grananja lanaca. U početnim fazama reakcija koje se odvijaju lančanim mehanizmom, kemijska energija reagirajućih tvari prenosi se uglavnom na stvaranje novih aktivnih centara. Proces promjene koncentracije aktivnih centara opisuje se jednadžbom:
![]() (1)
(1)
Gdje n – broj aktivnih centara u reakcijskoj zoni;
τ - vrijeme;
w 0 – brzina nukleacije aktivnih centara;
φ – konstanta koja karakterizira razliku u stopama grananja i prekida lanca.
Sa stajališta molekularne kinetičke teorije (MKT) strukture tvari, kemijske reakcije izgaranja nastaju kao rezultat međudjelovanja molekula goriva i oksidansa. Sile molekularne interakcije između dviju komponenti zapaljive smjese pojavljuju se na vrlo maloj udaljenosti, a s povećanjem udaljenosti naglo opadaju. Stoga je međudjelovanje između molekula goriva i oksidansa moguće samo kada su potpuno spojene, što se može smatrati sudarom. Prema tome, kemijskoj reakciji između goriva i oksidansa mora prethoditi miješanje komponenata i fizički čin elastičnog sudara molekula.
Broj sudara molekula plina po jedinici volumena lako se izračunava. Tako, na primjer, za stehiometrijsku smjesu vodika i kisika (2 N 2 + OKO 2) na temperaturi od 288 DO I atmosferski pritisak (~ 101325 Godišnje) broj sudara u 1 S u 1 cm 3 doseže 8,3·10 28. Kad bi svi ti sudari rezultirali kemijskom reakcijom, tada bi cijela smjesa reagirala vrlo brzo. Praksa pokazuje da u tim uvjetima reakcija izgaranja uopće ne dolazi, jer svi ti sudari ne dovode do kemijske interakcije.
Da bi došlo do kemijske reakcije, molekule koje reagiraju moraju biti u pobuđenom stanju. Takva ekscitacija može biti kemijska kada atomi molekula imaju jednu ili dvije slobodne valencije (takve se molekule nazivaju radikali i označavaju, na primjer, CH 3 , ON , CH 2, itd.) i fizičke kada, kao rezultat sporog zagrijavanja, molekule dobivaju kinetičku energiju iznad kritične vrijednosti.
Molekule koje imaju potrebnu rezervu energije za kidanje ili slabljenje postojećih veza nazivaju se aktivnim centrima kemijske reakcije.
Razlika između prosječnih energetskih razina molekula u aktivnom stanju i onih u normalnom stanju, tj. neaktivno, nepobuđeno stanje, naziva se aktivacijska energija ( E A). Što je brojčana vrijednost aktivacijske energije veća, to je teže natjerati dani par reagensa da stupi u kemijsku reakciju i obrnuto. Stoga je aktivacijska energija, takoreći, neizravan pokazatelj stupnja opasnost od požara zapaljive tvari.
Energija aktivacije može se procijeniti pomoću formule:
Gdje E A– aktivacijska energija, J;
k– Boltzmannova konstanta jednaka 1,38·10 –23 J/C;
T– apsolutna temperatura, DO.
Priroda glavnog kemijskog procesa izgaranja ovisi o nizu fizičkih procesa:
– kretanje tvari koje reagiraju i produkata reakcije (procesi difuzije);
– oslobađanje i raspodjela topline (procesi prijenosa topline);
– aero- i hidrodinamički uvjeti koji osiguravaju prijenos topline i tvari (konvekcijski procesi).
Potreba uzimanja u obzir ovih čimbenika uvelike otežava proučavanje i teorijski opis procesa izgaranja.
Izgaranje čvrste tvari, koji grijanjem ne stvara plin (paru) fazu, heterogen je i javlja se na granici faza, stoga, zajedno s gore razmotrenim čimbenicima koji utječu na prirodu procesa, veličinu i prirodu površine čvrste faze imaju izuzetno važnu ulogu (ovo je posebno važno za aerosole).
2.4.2.3. Impulsi paljenja.
Za izgaranje, osim gorive tvari i oksidansa, potreban je početni energetski impuls (najčešće uz oslobađanje topline) koji uzrokuje paljenje malog volumena gorive smjese, nakon čega se izgaranje širi po cijelom prostoru. cijeli prostor u kojem se distribuira.
Puls paljenja može se pojaviti kada se pojave fizički, kemijski i mikrobiološki procesi koji pridonose stvaranju topline. Ovisno o prirodi tih procesa, impulsi se sukladno tome dijele na fizički, kemijski, I mikrobiološki
Budući da se pri djelovanju fizičkog impulsa na sustav oslobađa toplina koja nije rezultat kemijskog procesa, taj se impuls smatra toplinskim. Djelovanje toplinskog impulsa koje uzrokuje zagrijavanje sustava može biti:
– kontakt– prijenos topline se provodi zbog kontakta zapaljive smjese s njezinim izvorom;
– radijacija– prijenos topline na zapaljivu smjesu događa se elektromagnetskim zračenjem iz izvora grijanja;
– konvekcija– prijenos topline u gorivi sustav odvija se pomoću tvari (zrak ili drugi plin u gibanju);
– hidraulički(dinamički) - stvaranje topline zbog brzog smanjenja volumena plinske smjese, praćeno povećanjem tlaka potonjeg.
Glavni izvori toplinskih impulsa su:
– otvoreni plamen(temperatura ~ 1500 °C);
– grijane površine (temperatura > 900 °C);
– mehanička iskra (temperatura ~ 1200 °C)
– električna iskra (temperatura do 6000 °C).
Kod kemijskih i mikrobioloških impulsa dolazi do nakupljanja topline u sustavu zbog kemijske reakcije, fizikalno-kemijskog procesa (primjerice adsorpcije) i djelovanja mikroorganizama kojima je zapaljiva tvar hrana.
2.4.2.4. Brzina reakcija izgaranja.
Brzina procesa izgaranja u opći pogled određeno jednadžbom:
 (3)
(3)
Gdje A ,b – koncentracija komponenti koje reagiraju;
τ - vrijeme,
ili  (4)
(4)
Gdje m, n – koncentracija produkata izgaranja.
Povećanje brzine izgaranja popraćeno je povećanjem količine topline koja ulazi u sustav po jedinici vremena i, kao posljedica toga, povećanjem temperature izgaranja.
2.4.2.5. Temperatura izgaranja.
Tijekom izgaranja ne troši se sva oslobođena toplina na povećanje temperature reakcijske smjese, jer se dio troši u obliku gubitaka na:
– kemijsko i fizičko nedogorevanje, uzeto u obzir koeficijentom nedogorevanja ( β );
– elektromagnetsko zračenje plamena, ovisno o temperaturi emitirajućeg tijela, njegovom agregatnom stanju i kemijskoj prirodi. Ova ovisnost određena je koeficijentom emisivnosti tijela koje zrači ( ε ) i valna duljina elektromagnetskog zračenja;
– konduktivno-konvektivni gubici.
Na temelju toga postoje 3 glavne vrste temperatura u procesima izgaranja:
– kalorimetrijski;
– teorijski (izračunati);
– činjenično.
Kalorimetrijska temperatura se postiže kada se sva toplina oslobođena tijekom procesa izgaranja troši na zagrijavanje produkata izgaranja, na primjer, tijekom izgaranja benzena - 2533 DO, benzin – 2315 DO, vodik – 2503 DO, prirodni gas – 2293 DO.
Teorijska (izračunata) temperatura određena je uzimajući u obzir gubitke topline zbog disocijacije produkata izgaranja. Značajna disocijacija produkata izgaranja ugljikovodičnih zapaljivih tvari počinje na temperaturama > 2000 DO. Tako visoke temperature tijekom požara u industrijskim uvjetima praktički se ne pojavljuju, pa se gubici topline zbog disocijacije u tim slučajevima u pravilu ne uzimaju u obzir.
Stvarna temperatura izgaranja određena je uzimajući u obzir gubitak topline u okoliš i za gotovo sve zapaljive tvari iznosi ~ 1300 – 1700 DO.
Razlike u tumačenju pojma izgaranje uzrokovane smjerom znanstvenih interesa autora. Po našem mišljenju, praktični interesi zaposlenika Državne vatrogasne službe najpotpunije su zadovoljeni sljedeća definicija izgaranje:
Izgaranje je samoodrživi kompleksni fizikalno-kemijski proces čija je osnova brze kemijske oksidacijske reakcije praćene oslobađanjem velike količine topline i svjetlosti.
Dominantan proces pri izgaranju je reakcija kemijske oksidacije, koja podrazumijeva nastanak različitih fizikalnih procesa: prijenos topline, prijenos reaktanata, zračenje itd. Ti se fizikalni procesi odvijaju prema vlastitim zakonitostima. Procesi kemijske oksidacije imaju veliki potencijal u pogledu brzine odvijanja, ali stvarna brzina izgaranje u pravim požarima je manje, jer ograničena brzinom fizičkih procesa.
Kemijske reakcije tijekom izgaranja su višestupanjske, ...
i što je najvažnije, lanac. Bez razumijevanja mehanizma procesa koji se odvijaju nemoguće je razumjeti razloge širenja plamena, razliku u njegovoj brzini, vrijednost temperature izgaranja itd.
Mehanizam kemijskih reakcija tijekom izgaranja
U temi “Kemijska kinetika” primijetili smo da se kemijske reakcije odvijaju izravnim kontaktom reagirajućih komponenata (molekula, atoma, radikala), ali samo u slučajevima kada njihova energija prelazi određenu energetsku granicu, koja se naziva aktivacijska energija E a. Prikažimo grafički promjenu energije reagirajućih komponenata (goriva i oksidansa) i produkata reakcije tijekom izgaranja (sl. 1.1.)
X-os prikazuje putanju reakcije izgaranja, a y-os prikazuje energiju. – prosječna početna energija komponenti koje reagiraju, – prosječna energija produkata izgaranja.
 |
Slika 1.1. Promjena energije reaktanata i produkata reakcije tijekom izgaranja
U reakciju izgaranja ući će samo aktivne čestice goriva i oksidansa, koje će imati potrebnu energiju da uđu u interakciju, tj. sposobni prevladati energetsku barijeru. Višak energije aktivnih čestica u odnosu na prosječnu energiju naziva se aktivacijska energija. Budući da su reakcije koje se odvijaju tijekom izgaranja egzotermne ![]() . Razlika energije između nastalih produkata izgaranja i početnih materijala (goriva i oksidansa) određuje toplinski učinak reakcije:
. Razlika energije između nastalih produkata izgaranja i početnih materijala (goriva i oksidansa) određuje toplinski učinak reakcije:
 |
Udio aktivnih molekula raste s porastom temperature zapaljive smjese.
Na slici 1.2. prikazuje raspodjelu energija između molekula pri temperaturi Ako duž energetske osi označimo vrijednost jednaku aktivacijskoj energiji, dobit ćemo udio aktivnih molekula u smjesi pri danoj temperaturi. Ako se pod utjecajem izvora topline temperatura smjese poveća na vrijednost, tada će se povećati i udio aktivnih molekula, a posljedično će se povećati i brzina reakcije izgaranja.
Međutim, postoje kemijske reakcije koje ne zahtijevaju značajno prethodno zagrijavanje da bi se razvile. To su lančane reakcije.
Osnova teorije lančanih reakcija je pretpostavka da se polazne tvari ne pretvaraju u konačni proizvod odmah, već uz stvaranje aktivnih međuprodukta.
Produkt primarne kemijske reakcije ima veliku zalihu energije, koja se može raspršiti u okolnom prostoru tijekom sudaranja molekula produkata reakcije ili zbog zračenja, ili se može prenijeti na molekule reagirajućih komponenata, prenoseći ih u aktivno stanje. Ove aktivne molekule (atomi, radikali) tvari koje reagiraju generiraju lanac reakcija gdje se energija prenosi s jedne molekule na drugu. Stoga se takve reakcije nazivaju lančane reakcije.
Kemijski aktivne molekule, atomi, radikali nastali u elementarnim fazama lančane reakcije - karike lanca - nazivaju se aktivnim centrima. Većina aktivnih centara su atomi i radikali, koji su najreaktivniji. Ali kao rezultat toga oni su također nestabilni, jer mogu ući u reakcije rekombinacije uz stvaranje nisko aktivnih proizvoda.
Duljina lanca koju čini jedan početni aktivni centar može doseći nekoliko stotina tisuća jedinica. Kinetički obrasci lančanih reakcija značajno ovise o tome koliko se aktivnih centara formira u jednoj karici lanca. Ako uz sudjelovanje izvornog aktivnog centra nastane samo jedno aktivno središte, tada se takva lančana reakcija naziva nerazgranata, ali ako se u jednoj karici lanca formiraju dva ili više aktivnih središta, tada se takva lančana reakcija naziva razgranata. Brzina razgranatih lančanih reakcija raste poput lavine, što je razlog samoubrzavanja kemijskih oksidacijskih reakcija tijekom izgaranja, budući da je većina njih karakterizirana mehanizmom razgranatih lančanih reakcija.
Gotovo svaka reakcija izgaranja može istodobno imati znakove i toplinskog i lančanog mehanizma reakcije. Nukleacija prvih aktivnih centara može biti toplinske prirode, a reakcija aktivnih čestica lančanim mehanizmom dovodi do oslobađanja topline, zagrijavanja gorive smjese i toplinske nukleacije novih aktivnih centara.
Svaka lančana reakcija sastoji se od elementarnih faza inicijacije, nastavka i prekida lanca.
Inicijacija lanca je endotermna reakcija. Stvaranje slobodnih radikala (tj. atoma ili skupina atoma sa slobodnim valencijama, npr. ![]() ) iz molekula polaznih tvari, eventualno kao rezultat monomolekularne ili bimolekularne interakcije, kao i kao rezultat bilo kakvih vanjskih utjecaja na zapaljivu smjesu - inicijacija.
) iz molekula polaznih tvari, eventualno kao rezultat monomolekularne ili bimolekularne interakcije, kao i kao rezultat bilo kakvih vanjskih utjecaja na zapaljivu smjesu - inicijacija.
Inicijacija se može provesti dodavanjem posebnih tvari - inicijatori, lako stvarajući slobodne radikale (na primjer, perokside, reaktivne plinove), pod utjecajem ionizirajućeg zračenja, pod utjecajem svjetlosti - fotokemijska inicijacija. Na primjer, interakcija vodika s klorom
![]()
u normalnim uvjetima odvija se izuzetno sporo, a pri jakom osvjetljenju ( sunčeva svjetlost, spaljivanje magnezija) nastavlja se s eksplozijom.
Na reakcije nastavak lanca To su elementarni stupnjevi lančane reakcije koji se odvijaju uz očuvanje slobodne valencije i dovode do trošenja polaznih tvari i stvaranja produkata reakcije.
inicijacija lanca:
![]()
grana lanca:
![]()
![]()
otvoreni krug:
homogena
![]()
heterogena
Tijekom razvoja lanca, kada koncentracija aktivnih centara postane dovoljno velika, moguće je formirati kariku u kojoj će aktivni centar reagirati bez stvaranja novog aktivnog centra. Ova pojava se naziva otvoreni krug.
Otvoreni krug mogu biti homogeni i heterogeni.
Homogeno prekidanje lanca moguće je bilo tijekom međusobne interakcije radikala ili atoma kako bi se formirali stabilni produkti, ili tijekom reakcije aktivnog centra s molekulom stranom glavnom procesu bez stvaranja novih aktivnih centara.
Heterogeni prekid lanca događa se na stijenkama posude gdje se odvija reakcija izgaranja ili na površini krutih mikročestica prisutnih u plinovitoj fazi, ponekad posebno unesenih (npr. kod gašenja prahom). Mehanizam prekidanja heterogenog lanca povezan je s adsorpcijom aktivnih centara na površini čvrstih čestica ili materijala. Brzina prekidanja heterogenog lanca jako ovisi o omjeru površine stijenki i volumena posude u kojoj dolazi do izgaranja. Dakle, smanjenje promjera posude značajno smanjuje brzinu reakcije izgaranja, sve do njezinog potpunog prestanka. Na tome se temelji izrada odvodnika požara.
Primjer razgranate lančane reakcije je izgaranje vodika u kisiku.
inicijacija lanca:
![]()
grana lanca:
![]()
![]()
otvoreni krug:
homogena
![]()
heterogena
Izgaranje ugljikovodika
Razmatranje procesa izgaranja vodika i ugljikovog monoksida pokazuje složenost mehanizma reakcije izgaranja. U slučaju H 2 i CO, reakcija se odvija kao lančana reakcija uz sudjelovanje mnogih elementarnih faza i međuproizvoda. Stoga je prirodno očekivati da je mehanizam reakcija gorenja tvari složenije strukture - ugljikovodika - još složeniji, a učinci koji prate procese paljenja i gorenja ovih spojeva raznolikiji.
Trenutačno dostupne informacije o prirodi kemijskih transformacija ugljikovodika tijekom njihovog izgaranja omogućuju objašnjenje uočenih učinaka uz određenu aproksimaciju.
Utvrđeno je da u plamenu ugljikovodika, uz već poznate aktivne čestice H×, OH×, O×, postoji veliki broj međuproizvoda složenije strukture. U nekim slučajevima oni postaju izvori podrijetla novih lanaca. Glavnu ulogu u procesima paljenja i izgaranja ugljikovodika igraju sljedeće vrste intermedijarnih spojeva:
1. Ugljikovodični radikali, koji su molekule ugljikovodika iz kojih je uklonjen jedan ili više atoma vodika. Ti se ostaci nazivaju alkili (CH3 - metil; C 2 H 5 - etil; C 3 H 7 - propil itd.). Zbog svoje visoke reaktivnosti, alkili dugo ne postoje u slobodnom obliku. Prisutan u plamenu kao međuprodukt. U interakciji s drugim molekulama ponašaju se kao neovisna strukturna skupina. Ugljikovodični radikali
obično se predstavlja slovom R.
2. Peroksidi su spojevi opće formule R-OO-R’.
3. Spojevi tipa aldehida
Najjednostavniji aldehidi su mravlja (formaldehid) HCOOH i octena (acetaldehid) CH 3 COH. Ove tvari uvijek su prisutne u produktima nepotpunog izgaranja ugljikovodika.
Svaka reakcija u kojoj nastaju ugljikovodični radikali može pokrenuti lanac tijekom izgaranja ugljikovodika. To može biti reakcija razgradnje molekule etana s stvaranjem dviju slobodnih metilnih skupina:
C2H6® ×CH3
ili reakcija ugljikovodika s kisikom:
RH + O 2 ® × HO 2 + × R
Nastavak lanaca nastaje kao rezultat reakcija stvaranja | peroksidi ili hidroperoksidi:
R + O 2 ® ROO×
ROO× + RH ® ROOH + R×
Tijekom razgradnje hidroperoksida dolazi do grananja lanca:
ROOH ® ×RO + ×OH
Zadani slijed reakcija dovodi do postupnog povećanja koncentracije peroksidnih spojeva u reakcijskom sustavu.
Istodobno s nakupljanjem peroksida, radikala, ×OH i ×H, počinju se odvijati paralelne reakcije:
ROOH + ×OH ® ROO× + N 2 O
Ove reakcije su egzotermne; Kada se pojave, oslobađa se velika količina topline.
Kako se temperatura reakcijske smjese povećava, uloga aktivnih centara prelazi s jednog međuprodukta na drugi sljedećim redom: alkil hidroperoksidi, acil hidroperoksidi, aldehidi.
Eksperimentalna istraživanja promjena u sastavu reakcijske smjese tijekom vremena u području visokih temperatura (600-800°C) pokazuju da se proces pretvorbe početnih ugljikovodika u konačne produkte izgaranja CO 2 i H 2 O dijeli na dva dijela: faze: u prvoj, koja se odvija vrlo velikom brzinom, oksidacija ugljikovodika u CO. U drugoj, sporoj fazi, CO se oksidira u CO 2
Utjecaj različitih čimbenika na brzinu kemijskih reakcija tijekom izgaranja
Ovisnost brzine reakcije izgaranja o koncentraciji reaktanata može se prikazati izrazom
![]() (1)
(1)
gdje je: k 0 – konstanta brzine reakcije,
S planina - koncentracija zapaljive tvari, kmol/m 3,
C ok – koncentracija oksidirajućeg sredstva, kmol/m3,
x,y – redoslijed reakcija goriva i oksidatora.
Kao što je gore rečeno, ukupna reakcijska jednadžba (1) ne odražava pravi mehanizam reakcije izgaranja, koja je višestupanjska i često lančana, stoga se redovi reakcija u jednadžbi (2) ne podudaraju uvijek s vrijednostima stehiometrijskih koeficijenata u jednadžbi (1).
Iz toga slijedi da što je veća koncentracija zapaljive tvari, to je veća brzina gorenja.
Brzina reakcije izgaranja ovisi o temperaturi:
e – baza prirodnog logaritma
E a – energija aktivacije, kJ/kmol,
R – univerzalna plinska konstanta, R=8,314 kJ/(K.kmol)
T – temperatura, K.
Ova jednadžba je izraz Arrheniusovog zakona o ovisnosti brzine kemijskih reakcija o temperaturi. U pojednostavljenom obliku, za uski temperaturni raspon, možete koristiti van’t Hoffovo pravilo: brzina kemijske reakcije povećava se 2-4 puta sa svakim 10 0 porastom temperature.
Dakle, brzina kemijske reakcije oksidacije zapaljive tvari tijekom izgaranja naglo raste s porastom temperature, a što je brzina veća, to je niža energija aktivacije.
Brzina oksidacijskih reakcija tijekom izgaranja također ovisi o tlaku.
Povećanje tlaka dovodi do povećanja volumetrijske koncentracije zapaljivih plinovitih tvari i oksidatora. U praksi to dovodi do činjenice da se s povećanjem tlaka povećava brzina reakcija izgaranja većine tvari.
Na visoki pritisci pojavljuju se vreli plamenovi.
Kao što je gore navedeno, kemijske oksidacijske reakcije vrlo su egzotermne, pa je izgaranje popraćeno oslobađanjem velike količine topline i stoga se odvija na visokoj temperaturi. Na primjer, temperatura izgaranja drva je 700-800 0 C, naftnih derivata je čak i viša - 1300-1500 0 C.
Na niski pritisci Može doći do takozvanog hladnog plamena. Samoubrzanje kemijske lančane reakcije izgaranja odvija se u izotermnom načinu. To se događa pri određenom sastavu zapaljive smjese i određeno stanje okoliš. Izotermno samoubrzanje karakteristično je za smjese s dovoljno visokom koncentracijom aktivnih, ali prilično stabilnih međuproizvoda, što dovodi do smanjenja razgranatosti lanca, a posljedično i do smanjenja oslobađanja topline, koja se, zbog odvođenja topline, rasipa se u okoliš i djelomično se troši na zagrijavanje stabilnih međuproizvoda. Pojavljuje se sjaj, koji je kemiluminiscencija, a ne toplinsko zračenje zagrijanih produkata izgaranja, koje se javlja u vrućem plamenu.
Osim toga, pojava hladnog plamena veliki utjecaj koje vrše stijenke posude u kojoj dolazi do izgaranja. Imaju katalitički učinak na proces razaranja aktivnih centara, tj. dolazi do prekida heterogenog lanca. Intenzitet ovog procesa određen je brzinom difuzije aktivnih centara na stijenke posude. Smanjenje tlaka potiče ovaj proces. Smanjenje tlaka može dovesti ne samo do stvaranja hladnog plamena umjesto vrućeg, već pod određenim uvjetima (na primjer, u uskim posudama) čak i do potpunog prestanka izgaranja.
Kao što je gore navedeno, kemijske transformacije tijekom procesa izgaranja dovode do pojave različitih fizikalnih procesa: prijenosa topline zbog konvekcije, toplinske vodljivosti i zračenja, prijenosa reagirajućih tvari itd.
Tako, izgaranje može se okarakterizirati kao složen samoodrživ fizikalno-kemijski proces, koji karakteriziraju tri karakteristike: kemijska transformacija, oslobađanje topline i zračenje (uključujući, najčešće, svjetlost, tj. u vidljivom dijelu spektra). Odsutnost bilo kojeg od ovih znakova ukazuje na to da se predmetni proces ne odnosi na izgaranje, na primjer, "gorenje" električne žarulje (nema kemijske transformacije), korozija metala (nema emisije svjetlosti i emisija topline je praktički beznačajna) itd.
Podijeli sa prijateljima:






