"Détermination de la charge électronique. Détermination de la charge électrique élémentaire par électrolyse Mesure de la charge élémentaire
Note méthodique... Les élèves connaissent déjà l'électron du cours de chimie et de la section correspondante du programme de 7e année. Il faut maintenant approfondir la compréhension de la première particule élémentaire de matière, rappeler ce qui a été étudié, la relier au premier thème de la section "Électrostatique" et passer à un niveau supérieur d'interprétation de la charge élémentaire. Il faut garder à l'esprit la complexité de la notion de charge électrique. L'excursion proposée peut aider à révéler ce concept et à entrer dans le vif du sujet.
Electron a une histoire complexe. Pour arriver au but le plus rapidement possible, il est conseillé de mener l'histoire comme suit.
La découverte de l'électron est le résultat de nombreuses expériences. Au début du XXe siècle. l'existence de l'électron a été établie dans un certain nombre d'expériences indépendantes. Mais, malgré le matériel expérimental colossal accumulé par des écoles nationales entières, l'électron restait une particule hypothétique, car l'expérience n'avait pas encore répondu à nombre de questions fondamentales.
Tout d'abord, il n'y avait pas une seule expérience à laquelle des électrons individuels participeraient. La charge élémentaire a été calculée à partir de mesures de la charge microscopique, en supposant la validité d'un certain nombre d'hypothèses.
L'incertitude était à un point crucial. Tout d'abord, l'électron est apparu à la suite de l'interprétation atomistique des lois de l'électrolyse, puis il a été découvert dans une décharge gazeuse. Il n'était pas clair si la physique traitait réellement du même objet. Un grand groupe de naturalistes sceptiques croyaient que la charge élémentaire est la moyenne statistique des charges des magnitudes les plus diverses. De plus, aucune des expériences de mesure de la charge électronique n'a donné de valeurs strictement répétées.
Il y avait des sceptiques qui ignoraient généralement la découverte de l'électron. L'académicien AF Ioffe, dans ses mémoires sur son professeur VK Roentgen, a écrit : « Jusqu'en 1906-1907, le mot électron n'aurait pas dû être prononcé à l'Institut de physique de l'Université de Munich. besoins ».
La question de la masse de l'électron n'a pas été résolue; il n'a pas été prouvé que les charges sur les conducteurs et les diélectriques sont constituées d'électrons. Le concept d'« électron » n'avait pas d'interprétation univoque, car l'expérience n'avait pas encore révélé la structure de l'atome (le modèle planétaire de Rutherford apparaîtra en 1911, et la théorie de Bohr en 1913).
L'électron n'est pas encore entré dans les constructions théoriques. La théorie des électrons de Lorentz présentait une densité de charge distribuée en continu. Dans la théorie de la conductivité métallique, développée par Drude, il s'agissait de charges discrètes, mais il s'agissait de charges arbitraires, sur la valeur desquelles aucune restriction n'était imposée.
L'électron n'a pas encore dépassé le cadre de la science « pure ». Rappelons que le premier tube électronique n'est apparu qu'en 1907.
Pour le passage de la foi à la conviction, il fallait d'abord isoler l'électron, inventer une méthode de mesure directe et précise de la charge élémentaire.
Ce problème a été résolu par le physicien américain Robert Millikan (1868-1953) dans une série d'expériences subtiles qui ont commencé en 1906.
Robert Millikan est né en 1868 dans l'Illinois dans une famille sacerdotale pauvre. Il passe son enfance dans la ville de province de Macvocket, où l'on accorde une grande attention aux sports et est mal enseigné. Le directeur d'un lycée, qui enseignait la physique, disait par exemple à ses jeunes auditeurs : « Comment pouvez-vous faire du son avec des ondes ?
Oberdeen College n'était pas mieux, mais Millikan, qui n'avait aucun soutien financier, a dû lui-même enseigner la physique au lycée. En Amérique, il n'y avait alors que deux manuels de physique, traduits du français, et le jeune homme talentueux n'a eu aucune difficulté à les étudier et à enseigner avec succès. En 1893, il entre à l'université de Columbia, puis part étudier en Allemagne.
Millikan avait 28 ans lorsqu'il a reçu une offre d'A. Michelson pour occuper un poste d'assistant à l'Université de Chicago. Au début, il s'est engagé ici presque exclusivement dans un travail pédagogique et ce n'est qu'à l'âge de quarante ans qu'il a commencé des recherches scientifiques, ce qui lui a valu une renommée mondiale.
Les premières expériences se résumaient aux suivantes. Entre les plaques du condensateur plat, auxquelles une tension de 4000 V a été appliquée, un nuage s'est créé, constitué de gouttelettes d'eau déposées sur les ions. On a d'abord observé que le sommet du nuage tombait en l'absence de champ électrique. Ensuite, un nuage a été créé avec la tension allumée. La chute du nuage a eu lieu sous l'influence de la gravité et de la force électrique.
Le rapport de la force agissant sur une goutte dans un nuage à la vitesse qu'elle acquiert est le même dans le premier et le deuxième cas. Dans le premier cas, la force est mg, dans le second mg + qE, où q est la charge de la goutte, E est l'intensité du champ électrique. Si la vitesse dans le premier cas est égale à v 1 dans le second v 2, alors
Connaissant la dépendance de la vitesse de chute du nuage v sur la viscosité de l'air, on peut calculer la charge requise q. Cependant, cette méthode n'a pas donné la précision souhaitée, car elle contenait des hypothèses hypothétiques qui échappaient au contrôle de l'expérimentateur.
Afin d'augmenter la précision des mesures, il fallait tout d'abord trouver un moyen de prendre en compte l'évaporation du nuage, qui se produisait inévitablement lors de la mesure.
En réfléchissant à ce problème, Millikan a proposé la méthode classique du drop, qui a ouvert un certain nombre de possibilités inattendues. Nous laisserons l'histoire de l'invention à l'auteur lui-même :
"Réalisant que le taux d'évaporation des gouttelettes restait inconnu, j'ai essayé de trouver une méthode qui éliminerait complètement cette valeur indéterminée. Mon plan était le suivant. Dans les expériences précédentes, le champ électrique ne pouvait que légèrement augmenter ou diminuer le taux de chute du sommet du nuage sous l'influence de la gravité. Maintenant, je voulais amplifier ce champ pour que la surface supérieure du nuage reste à une hauteur constante. Dans ce cas, il est devenu possible de déterminer avec précision le taux d'évaporation de le nuage et en tenir compte dans les calculs." Pour mettre en œuvre cette idée, Millikan a conçu une batterie rechargeable de petite taille, qui a donné une tension allant jusqu'à 104 V (pour l'époque, c'était une réalisation exceptionnelle de l'expérimentateur). Elle a dû créer un champ suffisamment fort pour que le nuage se maintienne, comme le « cercueil de Mahomet », dans les limbes.
« Quand j'avais tout prêt », explique Millikan, « et lorsque le nuage s'est formé, j'ai allumé l'interrupteur et le nuage était dans le champ électrique. va faire. Comme il m'a semblé au début, la disparition du nuage sans laisser de trace dans le champ électrique entre les plaques supérieure et inférieure signifiait que l'expérience s'est terminée en vain ... "
Cependant, comme cela s'est souvent produit dans l'histoire des sciences, l'échec a donné naissance à une idée nouvelle. Elle a conduit à la fameuse méthode du drop. "Des expériences répétées", écrit Millikan, "ont montré qu'après que le nuage ait été dispersé dans un champ électrique puissant, à sa place, il était possible de distinguer plusieurs gouttes d'eau séparées" (souligné par moi - V.D.).
L'expérience "infructueuse" a conduit à la découverte de la possibilité de maintenir en équilibre et d'observer des gouttelettes individuelles pendant un temps suffisamment long.
Mais pendant la période d'observation, la masse de la goutte d'eau a considérablement changé en raison de l'évaporation, et Millikan, après plusieurs jours de recherche, est passé à des expériences avec des gouttelettes d'huile.
La procédure expérimentale s'est avérée simple. Un nuage se forme entre les plaques du condenseur par expansion adiabatique. Il se compose de gouttelettes avec des charges de magnitude et de signe différents. Lorsque le champ électrique est activé, les gouttes avec des charges du même nom que la charge sur la plaque supérieure du condensateur tombent rapidement et les gouttes avec la charge opposée sont attirées par la plaque supérieure. Mais un certain nombre de gouttes ont une charge telle que la force de gravité est équilibrée par la force électrique.
Au bout de 7 ou 8 minutes, le nuage se dissipe, et il reste dans le champ de vision un petit nombre de gouttes dont la charge correspond audit rapport de forces.
Millikan a observé ces gouttes comme des points lumineux distincts. "L'histoire de ces gouttes se déroule généralement comme ceci, écrit-il. Dans le cas d'une légère prédominance de la gravité sur la force du champ, elles commencent à tomber lentement, mais comme elles s'évaporent progressivement, leur mouvement descendant cesse bientôt, et elles deviennent immobiles assez longtemps. Puis le champ commence à s'imposer, et les gouttes commencent à monter lentement. Vers la fin de leur vie dans l'espace entre les plaques, ce mouvement ascendant devient très fortement accéléré, et elles sont attirées à grande vitesse jusqu'au plateau supérieur."
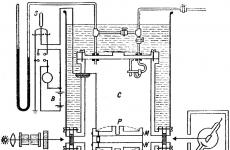
Le schéma de l'appareil Millikan, à l'aide duquel des résultats décisifs ont été obtenus en 1909, est représenté sur la figure 17.

La chambre C contenait un condensateur plat constitué de plaques rondes en laiton M et N d'un diamètre de 22 cm (la distance entre elles était de 1,6 cm). Un petit trou p a été pratiqué au centre de la plaque supérieure à travers lequel les gouttelettes d'huile passaient. Ces derniers ont été formés en insufflant un jet d'huile à l'aide d'un spray. Dans ce cas, l'air a été préalablement purifié de la poussière en le faisant passer dans un tuyau avec de la laine de verre. Les gouttelettes d'huile avaient un diamètre d'environ 10 à 4 cm.
Une tension de 104 V était fournie par l'accumulateur B aux plaques du condensateur.A l'aide d'un interrupteur, il était possible de court-circuiter les plaques et de détruire ainsi le champ électrique.
Les gouttes d'huile tombant entre les plaques M et N étaient éclairées par une source puissante. Le comportement des gouttes a été observé perpendiculairement à la direction des rayons à travers le télescope.
Les ions nécessaires à la condensation des gouttelettes ont été créés par le rayonnement d'un morceau de radium de 200 mg de masse situé à une distance de 3 à 10 cm du côté des plaques.
À l'aide d'un dispositif spécial, le gaz a été détendu en abaissant le piston. Après 1 à 2 s après l'expansion, le radium a été retiré ou masqué par un blindage de plomb. Ensuite, le champ électrique a été activé et l'observation des gouttes dans le télescope a commencé.
Le tuyau avait une échelle grâce à laquelle il était possible de compter la distance parcourue par la goutte pendant une certaine période de temps. L'heure a été enregistrée par une montre précise avec une serrure.
Au cours des observations, Millikan a découvert un phénomène qui a servi de clé à toute la série de mesures précises ultérieures des charges élémentaires individuelles.
"En travaillant sur des gouttelettes en suspension", écrit Millikan, "j'ai oublié de les bloquer des rayons du radium à plusieurs reprises. dans le premier cas c'était un ion positif, et dans le second cas c'était un ion négatif.
En effet, mesurant la vitesse d'une même goutte deux fois, une fois avant et la deuxième fois après la capture de l'ion, j'ai pu évidemment exclure totalement les propriétés de la goutte et les propriétés du milieu et opérer avec une quantité proportionnelle uniquement à la charge de l'ion capturé. "
La charge élémentaire a été calculée par Millikan sur la base des considérations suivantes. La vitesse de la goutte est proportionnelle à la force agissant sur elle et ne dépend pas de la charge de la goutte.
Si une goutte tombait entre les plaques du condensateur sous l'action de la seule gravité avec une vitesse v 1, alors
Lorsque le champ est activé, dirigé contre la force de gravité, la force agissante sera la différence qE = mg, où q est la charge de la goutte, E est le module de l'intensité du champ.
La vitesse des gouttes sera égale à :
v 2 = k (qE - mg) (2)
Si on divise l'égalité (1) par (2), on obtient


Soit la goutte capter un ion et sa charge devient égale à q' et à la vitesse de déplacement v 2'. La charge de cet ion piégé est notée e.Alors e = q ′ - q.
En utilisant (3), on obtient

La valeur est constante pour une goutte donnée.
Par conséquent, toute charge capturée par la goutte sera proportionnelle à la différence de vitesses (v 2 -v 2), c'est-à-dire proportionnelle au changement de vitesse de la goutte dû à la capture d'un ion !
Ainsi, la mesure de la charge élémentaire se réduisait à la mesure de la distance parcourue par la goutte et du temps pendant lequel cette distance a été parcourue.
De nombreuses observations ont montré la validité de la formule (4). Il s'est avéré que la valeur de e ne peut changer que par sauts ! Les charges e, 2e, 3e, 4e, etc. sont toujours respectées.
"Dans de nombreux cas", écrit Millikan, "la goutte a été observée pendant cinq ou six heures, et pendant ce temps, elle a capturé non pas huit ou dix ions, mais des centaines. Au total, j'ai observé la capture de plusieurs milliers d'ions dans de cette façon, et dans tous les cas, la charge capturée... était soit exactement égale à la plus petite de toutes les charges capturées, soit elle était égale à un petit multiple entier de cette valeur. C'est la preuve directe et irréfutable que l'électron n'est pas une "moyenne statistique", mais que toutes les charges électriques sur les ions sont soit exactement égales à la charge d'un électron, soit sont de petits multiples entiers de cette charge. "
Ainsi, l'atomisme, la discrétion ou, en termes modernes, la quantification d'une charge électrique est devenu un fait expérimental. Or, il importait de montrer que l'électron est pour ainsi dire omniprésent. Toute charge électrique dans un corps de toute nature est la somme des mêmes charges élémentaires.
La méthode de Millikan a permis de répondre sans équivoque à cette question.
Dans les premières expériences, des charges ont été créées en ionisant des molécules de gaz neutre avec un flux de rayonnement radioactif. La charge des ions capturés par les gouttelettes a été mesurée.
Lorsque le liquide est pulvérisé avec un flacon pulvérisateur, les gouttelettes sont électrifiées en raison de la friction. C'était bien connu au XIXe siècle. Ces charges sont-elles aussi quantifiées que les charges des ions ?
Millikan "pese" les gouttelettes après pulvérisation et mesure les charges de la manière décrite ci-dessus. L'expérience révèle la même discrétion de la charge électrique.
En pulvérisant des gouttes d'huile (diélectrique), de glycérine (semi-conducteur), de mercure (conducteur), Millikan prouve que les charges sur les corps de toute nature physique sont dans tous les cas sans exception des portions élémentaires individuelles de valeur strictement constante.
En 1913, Millikan résuma les résultats de nombreuses expériences et donna la valeur suivante pour une charge élémentaire : e = 4,774 · 10 -10 unités. Tarif CGSE.
C'est ainsi qu'a été établie l'une des constantes les plus importantes de la physique moderne. La détermination de la charge électrique est devenue un simple problème arithmétique.
Visualisation électronique... Un rôle important dans le renforcement de l'idée de la réalité de l'électron a été joué par la découverte par G.A. Wilson de l'effet de la condensation de la vapeur d'eau sur les ions, ce qui a conduit à la possibilité de photographier des traces de particules.
Ils disent que A. Compton lors de la conférence ne pouvait en aucun cas convaincre un auditeur sceptique de la réalité de l'existence des microparticules. Il a insisté sur le fait qu'il ne croirait que lorsqu'il les verrait de ses propres yeux.
Ensuite, Compton a montré la photographie avec une piste de particules alpha, à côté de laquelle se trouvait une empreinte digitale. "Savez-vous ce que cela est?" a demandé Compton. « Doigt », a répondu l'auditeur. « Dans ce cas, déclara solennellement Compton, cette bande de lumière est la particule.
Les photographies des pistes des électrons n'étaient pas seulement indicatives de la réalité des électrons. Ils ont confirmé l'hypothèse sur la petite taille des électrons et ont permis de comparer avec l'expérience les résultats de calculs théoriques, dans lesquels apparaissait le rayon des électrons. Les expériences, qui ont été initiées par Lenard dans l'étude du pouvoir de pénétration des rayons cathodiques, ont montré que des électrons très rapides émis par des substances radioactives donnent des traces dans le gaz sous forme de lignes droites. La longueur de la piste est proportionnelle à l'énergie de l'électron. Les photographies des traces de particules alpha de haute énergie montrent que les traces sont composées d'un grand nombre de points. Chaque point est une goutte d'eau apparaissant sur un ion, qui se forme à la suite de la collision d'un électron avec un atome. Connaissant la taille de l'atome et sa concentration, on peut calculer le nombre d'atomes par lesquels la particule doit passer à une distance donnée. Un calcul simple montre qu'une particule doit passer environ 300 atomes avant de rencontrer l'un des électrons qui composent la couche atomique sur son chemin et de s'ioniser.
Ce fait indique de manière convaincante que le volume des électrons est une fraction négligeable du volume d'un atome. La trajectoire d'un électron de basse énergie est courbe ; par conséquent, un électron lent est dévié par le champ intra-atomique. Il produit plus d'actes d'ionisation sur son chemin.
A partir de la théorie de la diffusion, des données peuvent être obtenues pour estimer les angles de déviation en fonction de l'énergie des électrons. Ces données sont bien étayées par l'analyse de pistes réelles. La coïncidence de la théorie avec l'expérience a renforcé l'idée de l'électron comme la plus petite particule de matière.
La mesure de la charge électrique élémentaire a ouvert la possibilité d'une détermination précise d'un certain nombre des constantes physiques les plus importantes.
Connaître la valeur de e permet de déterminer automatiquement la valeur de la constante fondamentale - la constante d'Avogadro. Avant les expériences de Millikan, il n'y avait que des estimations approximatives de la constante d'Avogadro, qui étaient données par la théorie cinétique des gaz. Ces estimations étaient basées sur des calculs du rayon moyen d'une molécule d'air et variaient dans une fourchette assez large de 2 · 10 23 à 20 · 10 23 1 / mol.
Supposons que nous connaissions la charge Q qui a traversé la solution électrolytique et la quantité de substance M qui se dépose sur l'électrode. Alors, si la charge de l'ion est Ze 0 et sa masse est m 0, l'égalité

Si la masse de la substance déposée est égale à une mole, alors Q = F est la constante de Faraday, et F = N 0 e, d'où N 0 = F / e. De toute évidence, la précision de la détermination de la constante d'Avogadro est donnée par la précision avec laquelle la charge électronique est mesurée.
La pratique nécessitait une augmentation de la précision de la détermination des constantes fondamentales, et c'était l'une des incitations à continuer d'améliorer la méthode de mesure du quantum de charge électrique. Ce travail, qui est déjà de nature purement métrologique, se poursuit à ce jour.
Les valeurs les plus précises sont actuellement :
e = (4,8029 ± 0,0005) 10 -10 unités. redevance CGSE ;
N 0 = (6,0230 ± 0,0005) 10 23 1 / mol.
Connaissant N 0, il est possible de déterminer le nombre de molécules de gaz dans 1 cm 3, puisque le volume occupé par 1 mole de gaz est une constante déjà connue.
Connaître le nombre de molécules de gaz dans 1 cm 3, à son tour, a permis de déterminer l'énergie cinétique moyenne du mouvement thermique d'une molécule.
Enfin, la charge électronique peut être utilisée pour déterminer la constante de Planck et la constante de Stefan-Boltzmann dans la loi du rayonnement thermique.
L'œuvre a été ajoutée au site du site : 2016-03-13Est libre
Connaître le coût des travaux
Robot de laboratoire
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> CHARGE ÉLÉMENTAIRE ET EXPÉRIENCE DE MILLIKEN
; font-family: "Arial" "xml: lang =" uk-UA "lang =" uk-UA "> Cible du robot; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">:; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> étude du mouvement des gouttes chargées dans les champs électriques et gravitationnels (expérience de Millikan). Détermination de la charge élémentaire.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Équipement; font-family : "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">: appareil Millikan, multimètre, source de tension 0 600 V, micromètre 1 mm - 100 divisions, 2 chronomètres, lunettes 18 x 18 mm, interrupteur, trépied, tube.
; font-family: "Arial"; text-decoration: underline "xml: lang =" ru-RU "lang =" ru-RU "> Détermination des rayons et charges des gouttes chargées. Mesure de la vitesse de déplacement des gouttes à diverses tensions et directions du champ électrique ...
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 1. Allumez le système optique de l'installation Millikan et calibrez le micromètre à l'aide d'un verre de graduation spécial.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 2. Réglez la tension sur 300 V sur l'installation Millikan. Injectez des gouttes d'huile dans l'espace d'observation de l'installation. En ajustant légèrement le système optique, observez le mouvement des gouttelettes d'huile. Pour changer la direction des gouttelettes, utilisez l'interrupteur pour changer la direction du champ électrique. Parmi les gouttelettes visibles, sélectionnez celle qui se déplace strictement verticalement et à faible Étant donné que les tailles des gouttelettes résultantes sont petites, on peut considérer avec une grande précision que le mouvement observé est déjà constant (la gouttelette se déplace à une vitesse constante).
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 3. Déterminez la durée du mouvement à l'aide du chronomètre; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> t; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> la liste déroulante sélectionnée lors du passage d'une certaine distance; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> S; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, ainsi que le temps de mouvement; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> t; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> la même liste déroulante en passant une certaine distance; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> S; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">. La distance parcourue par une goutte est déterminée comme le produit de la valeur de division micrométrique (voir élément 1 de la tâche ) par le nombre de divisions d'échelle passées. Entrez les données dans le tableau 1. Répétez l'expérience avec quelques gouttes (4 6 gouttes).
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Tableau 1.
|
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Pas de chute |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> U; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, В |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> S; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 1; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> mm |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> t; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 1; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> с |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> S; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 2; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> mm |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> t; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, avec |
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 4. Répétez l'expérience pour quelques gouttes (4 6 gouttes) à des tensions sur l'appareil Milliken de 400 V et 500 V. Remplissez les données du tableau 1.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 5. En utilisant les données du tableau 1, calculez les vitesses; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> gouttes selon les formules (6) et (7) et, ensuite, rayons et charges de gouttes selon les formules ( 8) et (9). Puisque la charge d'une goutte est un nombre entier; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> n; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> charge élémentaire; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> (charge électronique):
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> (; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">)
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> alors vous pouvez déterminer cette charge élémentaire. Remplissez le tableau 2.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Tableau 2.
|
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Pas de chute |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, m / s |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, m / s |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> Q; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, cl |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> r; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> м |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> n |
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, Кл |
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 6. Effectuez un traitement mathématique des résultats. Tenez le graphique. Un exemple de l'expérience est illustré à la Fig. 1 .
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 7. Analysez les résultats obtenus et formulez des conclusions conformément aux directives. Faites attention à la cohérence des conclusions avec l'objectif fixé.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Fig. 1.; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Un exemple d'expérience pour déterminer la charge de différentes gouttes; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">
Brèves matières théoriques
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> L'idée de la discrétion de la charge électrique a été exprimée pour la première fois par B. Franklin (1752). des charges a été prouvée expérimentalement par M. Faraday (1834) sur la base des lois de l'électrolyse La valeur numérique de la charge élémentaire (la plus petite charge électrique trouvée dans la nature) a été théoriquement calculée à l'aide du nombre d'Avogadro Une mesure expérimentale directe de la charge élémentaire a été réalisée par R. Millikan (1908-1916) en utilisant la méthode des gouttelettes d'huile La méthode est basée sur l'étude du mouvement de gouttelettes d'huile chargées dans un champ électrique uniforme de force connue; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Ē; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">. Selon les concepts de base de la théorie électronique, la charge d'un corps change en raison d'un changement de la nombre d'électrons qu'il contient (ou, dans certains phénomènes, d'ions dont l'amplitude de la charge est un multiple de la charge d'un électron.) Par conséquent, la charge de tout corps doit changer brusquement et par portions contenant un entier nombre de charges électroniques.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Millikan a mesuré la charge électrique concentrée sur de petites gouttelettes sphériques individuelles formées par le spray; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> P; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et a acquis une charge électrique par électrification due au frottement contre les parois de l'atomiseur, comme le montre la figure 2. À travers un petit trou dans le condensateur plat de la plaque supérieure; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> K; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ils sont tombés dans l'espace entre les plaques. Le mouvement de la goutte a été observé au microscope; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> M; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Fig. 2:; famille de polices: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Schéma d'installation. P - atomiseur à gouttelettes, K - condenseur, IP - alimentation, M - microscope, h; font-family: "Symbol" "xml: lang =" ru-RU "lang =" ru-RU "> ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - source de rayonnement, P - surface de la table.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">
Afin de protéger les gouttelettes des courants d'air de convection, le condenseur était enfermé dans une enveloppe protectrice dont la température et la pression étaient maintenues constantes. Lors de la réalisation des expérimentations, il était tenu de respecter les conditions suivantes :
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 1. Les gouttes doivent être microscopiques pour :
- ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> la force électrostatique agissant sur la goutte chargée, lorsque le champ électrique était activé, dépassait la force de gravité ;
- ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> la charge de chute, ainsi que ses changements pendant l'irradiation (à l'aide d'un ioniseur) étaient égaux à un assez petit nombre de charges élémentaires.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Cela facilite la définition de la multiplicité de la charge de chute à une charge élémentaire ;
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 2. Densité de goutte; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> = 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, 03 * 10; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> kg / m; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> doit être supérieure à la densité d'un milieu visqueux; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, dans lequel il se déplace (air -; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> = 1; famille de polices : "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, 293 kg / m; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">);
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 3. La masse de la goutte ne doit pas changer pendant toute l'expérience. Pour cela, l'huile qui compose le goutte ne doit pas s'évaporer (l'huile s'évapore beaucoup plus lentement que l'eau).
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Si les plaques du condensateur n'étaient pas chargées (intensité du champ électrique; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Ē; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> = 0), puis la goutte est tombée lentement, se déplaçant de la plaque supérieure vers le bas.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Dès que les plaques du condensateur ont été chargées, des changements se sont produits dans le mouvement de la goutte : dans le cas d'un charge sur la goutte et une charge positive sur la plaque supérieure du condensateur, la goutte a ralenti et, à un moment donné, elle a changé le sens de son mouvement dans l'autre sens - elle a commencé à monter vers la plaque supérieure.
L'équation du mouvement pour une goutte
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Connaître le taux de chute en l'absence de champ électrostatique (sa charge n'a joué aucun rôle) et le taux de chute dans un champ électrostatique donné et connu, Millikan a pu calculer la charge de la goutte. Pour déterminer la charge, il faut d'abord considérer le mouvement de la goutte en l'absence de champ électrostatique; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Ē; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> = 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">) L'équilibre des pouvoirs est illustré à la figure 3.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Dans ce cas, trois forces agissent sur la goutte (voir Fig. 3.a):
- ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> gravité; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> mg, g; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 9,81 m / s; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">;
- ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Force d'Archimède; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Vg; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> m; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> g; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> F; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> A; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">,
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> où; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - densité de l'air,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> V; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> = (4/3); font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> πr; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - volume de baisse,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> V; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> m; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - la masse d'air déplacée par la goutte ;
- ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> force de résistance visqueuse exprimée par la formule de Stokes; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> kv; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 6; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> πηrv; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> FC; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, où; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> η; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> = 1,82 * 10; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> - 5; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> kg / m * s - viscosité de l'air,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> r; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - rayon de chute,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - vitesse de chute.
; font-family : "Arial" ; text-decoration : soulignez "xml: lang =" ru-RU "lang =" ru-RU "> Remarque; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">: La formule de Stokes est valable pour une balle se déplaçant dans le gaz, à condition que le rayon de la balle soit plusieurs fois plus grand que le libre parcours Dans l'expérience de Millikan, les gouttelettes étaient si petites qu'il a dû introduire les corrections nécessaires dans les calculs.La densité effective d'une gouttelette peut différer considérablement de la densité de sa substance.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 2 Loi de Newton projetée sur l'axe; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> X; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> pour le cas correspondant à la figure 3.a :
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 0; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">); font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> g; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> +; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> kv; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> g; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> =; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> - ma; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (2)
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> où; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> a; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - l'accélération avec laquelle la goutte tombe.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> En raison de la résistance visqueuse, la chute presque immédiatement après le début du mouvement ou un changement des conditions de mouvement acquiert une vitesse constante (stable) et se déplace uniformément.; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> a; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> = 0, et à partir de (1) vous pouvez trouver la vitesse de la gouttelette. Dénotons le module de la stabilité -vitesse d'état en l'absence de champ électrostatique; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> g; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">. Ensuite :
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> g; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> = (; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 0; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">); font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> g; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> /; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> k; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (3)
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Si vous fermez le circuit électrique d'un condensateur (Fig. 3.b), alors il sera chargé et un un champ électrostatique y sera créé; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Ē; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">.; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> q; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> (que ce soit positif) une force supplémentaire agira; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> qE; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, dirigé vers le haut (Fig. 3.b).
- "xml: lang =" uk-UA "lang =" uk-UA "> force du côté du champ électrique (le champ d'un condensateur chargé), où est la charge de la goutte,Ē - l'intensité du champ électrique, U - tension aux bornes des plaques du condensateur, ré est la distance entre les plaques.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> a); font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> b); font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Fig. 3:; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Forces agissant sur la chute :; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> a); font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> en l'absence de champ électrostatique ;; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> b); font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> en présence d'un champ électrostatique.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Comme dans le cas de la chute libre d'une goutte, considérons l'état stable du mouvement. La loi de Newton en projection sur le axe; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> X; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et en tenant compte de cela; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> a; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> = 0, prendra la forme :
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 0; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">); font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> g; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> +; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> qE; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> +; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> kv; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> = 0 (4)
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> = [; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> - q; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> m; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 0; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">); font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> g; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">]; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> /; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> k; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (5)
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> où; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> E; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - vitesse en régime permanent d'une goutte d'huile dans le champ électrostatique d'un condensateur :; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">< ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 0, si le drop descend,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">>; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 0 si le blob monte.
"xml: lang =" ru-RU " lang =" ru-RU " > (6)
"xml: lang =" ru-RU "lang =" ru-RU "> (7)
; font-family: "Arial"; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> A partir des formules (6) et (7), vous pouvez obtenir des formules pour déterminer la charge et le rayon de gouttes par la vitesse de la goutte de haut en bas :
; font-family: "Arial"; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU ">,; font-family: "Arial"; color: # 000000 "xml: lang =" en-US "lang =" en-US ">; font-family : "Arial" ; couleur : # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> (8)
; font-family: "Arial"; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> où kg m; font-family : "Arial" ; vertical-align : super ; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> 0.5; font-family: "Arial"; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> с; font-family : "Arial" ; vertical-align : super ; couleur : # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> - 0.5; font-family: "Arial"; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> et
; font-family: "Arial"; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU ">,; font-family: "Arial"; color: # 000000 "xml: lang =" en-US "lang =" en-US ">; font-family : "Arial" ; couleur : # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> (9)
; font-family : "Arial" ; color : # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> où (ms); font-family : "Arial" ; vertical-align : super ; color: # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> 0.5
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Détermination de la charge élémentaire au moyen d'une expérience informatique
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> De l'équation (5), il s'ensuit qu'en mesurant les vitesses en régime permanent; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> g; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> E; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> en l'absence de champ électrostatique et en sa présence, respectivement, il est possible de déterminer la chute de charge si le le coefficient est connu; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> k; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 6; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> πηr; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">. Il semblerait trouver; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> k; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> il suffit de mesurer le rayon de la goutte (la viscosité de l'air est connue par d'autres expériences). Cependant, la mesure directe de ce rayon à l'aide d'un microscope est impossible :; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> r; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> a un ordre de grandeur de 10; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 4; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ÷; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 10; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 6; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> cm, ce qui est comparable à la longueur d'onde de la lumière. Par conséquent, le microscope ne donne qu'une image de diffraction de la goutte, pas permettant de mesurer sa taille réelle.Des informations sur le rayon d'une goutte peuvent être obtenues à partir de données expérimentales sur son mouvement en l'absence de champ électrostatique.; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> g; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et étant donné que; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> m - m; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> = 4; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> /; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> πr; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> (; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ - ρ; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">); font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">;
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> où; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ρ; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - la densité de la goutte d'huile, à partir de (3) nous obtenons :
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> (10)
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Dans ses expériences, Millikan a modifié la charge de la goutte en apportant un morceau de radium au condenseur. ...; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 1), à la suite de quoi la goutte pourrait capturer une charge positive ou négative supplémentaire. il est clair qu'avec une plus grande probabilité qu'elle s'attache des ions positifs. En revanche, l'ajout d'ions négatifs n'est pas exclu. Dans les deux cas, la charge de la goutte va changer et -; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> brusquement; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - la vitesse de son mouvement; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> v; font-family : "Arial" ; vertical-align : super "xml: lang =" en-US "lang =" en-US "> I; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> E; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">.; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> q; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> les frais de chute modifiés conformément à (5) sont déterminés par le rapport :
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> q; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 0; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> = (; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family : "Arial" ; vertical-align : super "xml: lang =" en-US "lang =" en-US "> I; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> +; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> g; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">); font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> k; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> /; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (11)
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> De (5) et (11) la valeur de la charge attachée par la goutte est déterminée :
; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> Δ; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> q; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> =; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> q; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> q; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> 0; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> =; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> k; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family : "Arial" ; vertical-align : super "xml: lang =" en-US "lang =" en-US "> I; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> -; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">) /; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> =; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> k; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> Δ; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> v; font-family: "Arial"; vertical-align: sub "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> /; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> E; font-family: "Arial" "xml: lang =" en-US "lang =" en-US "> (12)
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> En comparant les valeurs de charge d'une même goutte, on peut s'assurer que le changement de charge et la charge de baisse lui-même sont des multiples du même montant; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> - charge élémentaire. Dans ses nombreuses expériences, Millikan a reçu différentes valeurs de charges; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> q; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> q; font-family: "Arial"; vertical-align: sub "xml: lang =" ru-RU "lang =" ru-RU "> 0; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">, mais ils étaient toujours un multiple de; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> ≈; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 7 * 10; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 19; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Cl selon (1). Par conséquent, Millikan a conclu que la valeur; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> représente la plus petite quantité d'électricité possible dans la nature, c'est-à-dire " une portion ou un atome d'électricité. "
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> La signification moderne de " l'atome " d'électricité; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">,; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 602 * 10; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family : "Arial" ; vertical-align : super "xml: lang =" ru-RU "lang =" ru-RU "> 19; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Cl. Cette quantité est la charge électrique élémentaire portée par un électron avec une charge négative; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et un proton avec une charge; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">.
; font-family : "Arial" ; text-decoration : soulignez "xml: lang =" ru-RU "lang =" ru-RU "> Remarque; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">:; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> les particules subnucléaires appelées" quarks ont des charges égales à 2/3 en module; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> et 1/3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">. Ainsi, le quantum de charge électrique doit être considéré comme 1/3; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">. Mais dans les processus atomiques et moléculaires, toutes les charges sont multiples; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> e; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">.
"xml: lang =" ru-RU "lang =" ru-RU "> Installation expérimentale
Millikan a mesuré la charge électrique sur des gouttelettes sphériques formées par un spray et chargées par friction contre les parois du spray. À travers un trou dans la plaque supérieure du condenseur, des gouttes sont tombées dans l'espace entre les plaques et ont été observées à l'aide d'un microscope. Si les plaques ne sont pas chargées, la goutte tombera lentement. Avec des plaques chargées, le mouvement des gouttelettes a ralenti et a changé de direction.
Le travail en laboratoire est tout à fait conforme à l'expérience de Millikan. L'expérience est recommandée pour deux étudiants. Assemblez l'installation comme indiqué sur la Fig. 4.
; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> Connectez le permanent (300; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> В; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">) et réglable (de 0 à; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 300; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> В; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">) sorties de source de tension, afin que vous puissiez recevoir une tension dans; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 300 600; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> В; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">. Grâce au commutateur de direction de champ, la source est connectée à l'appareil Millikan. Un voltmètre est connecté en parallèle. Le système optique de l'appareil Millikan est connecté à la sortie; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> 6,3; font-family: "Arial" "xml: lang =" en-US "lang =" en-US ">; font-family: "Arial" "xml: lang =" ru-RU "lang =" ru-RU "> В; font-family: "Arial '" xml: lang = "ru-RU" lang = "ru-RU"> source de tension.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> Fig. 4. Installation expérimentale moderne pour déterminer la charge élémentaire à l'aide du dispositif Millikan
; font-family : 'Arial' ; text-decoration : soulignez "xml: lang =" ru-RU "lang =" ru-RU "> Faites attention; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> -; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> dans le champ du microscope (Fig.; font-family: 'Arial' "xml: lang =" en-US "lang =" en-US ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 5) l'image est inversée.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> Fig.; font-family: 'Arial' "xml: lang =" en-US "lang =" en-US ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 5. Gouttes d'huile (points blancs) entre les plaques du condenseur. La distance entre les marques de verre de graduation dans le champ oculaire est de 0,029; font-family: 'Arial' "xml: lang =" en-US "lang =" en-US ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> mm.
"xml: lang =" uk-UA "lang =" uk-UA "> Contrôle"xml: lang =" ru-RU " lang =" ru-RU " > th"xml: lang =" uk-UA "lang =" uk-UA ">"xml: lang =" ru-RU " lang =" ru-RU "> questions"xml: lang =" uk-UA "lang =" uk-UA ">"xml: lang =" ru-RU "lang =" ru-RU "> et"xml: lang =" uk-UA "lang =" uk-UA "> définir"xml: lang =" ru-RU "lang =" ru-RU "> et"xml: lang =" uk-UA "lang =" uk-UA "> je
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 1. Formuler la loi de discrétion de la charge.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 2. Formulez la loi de Stokes.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 3. Quelle est la signification physique de la viscosité ? De quelle loi physique pouvons-nous obtenir sa dimension ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 4. Quelles forces agissent sur une goutte dans l'expérience de Millikan ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 5. Comment calculer la force agissant sur une particule chargée dans le champ électrique d'un condensateur ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 6. Pourquoi dans cette expérience la vitesse des gouttelettes peut-elle être considérée comme constante ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 7. Pourquoi l'air dans le condenseur est-il exposé aux rayons X, aux rayons ultraviolets ou aux rayonnements de médicaments radioactifs ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 8. Pourquoi la vitesse des gouttelettes en régime permanent change-t-elle d'une valeur spécifique pendant l'irradiation ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 9. Obtenez la formule (6).
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 10. Obtenez la formule (7).
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 11. Pourquoi, lorsqu'elle est irradiée, une goutte peut capturer une charge du même signe que sa propre charge, car les charges La fréquence de capture par une goutte de même charge dépend-elle de la température, de la charge de la goutte, de la charge de l'ion capturé ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 12. Pourquoi ne pouvez-vous pas mesurer le rayon d'une goutte directement avec un microscope ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 13. Formule de Stokes; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> F; font-family: 'Arial' "xml: lang =" en-US "lang =" en-US ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> =; font-family: 'Arial' "xml: lang =" en-US "lang =" en-US ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 6πη; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> rv; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> non applicable si le rayon de la goutte est inférieur au libre parcours des molécules; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> λ; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU ">. Estimez le libre parcours moyen à la pression atmosphérique et à la température ambiante. Après avoir calculé le rayon des gouttelettes à partir des données expérimentales, évaluez si la condition est satisfaite que le rayon de la goutte; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> r; font-family: 'Arial' "xml: lang =" en-US "lang =" en-US ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU ">>>; font-family: 'Arial' "xml: lang =" en-US "lang =" en-US ">; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> λ; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> (c'est-à-dire que la formule de Stokes est applicable et le traitement des données par les formules (5 et 11) est acceptable.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 14. Expliquez comment déterminer la charge élémentaire sur la base de données expérimentales.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 15. Sélectionnez le système d'unités pour traiter les données reçues et recalculez toutes les valeurs des constantes nécessaires dans ce système.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 16. À l'aide de la formule (5), estimez la tension requise pour soulever des gouttes portant une charge égale à 3 charges d'électrons ?
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 17. En utilisant la méthode Millikan, vous pouvez déterminer la charge d'un électron. Quelles autres méthodes pour déterminer la charge de un électron tu connais ?
Littérature
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 1; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU ">. Ioffe AF Rencontres avec des physiciens. Mes souvenirs d'étrangers
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> physicists. L., Nauka, 1983.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 2; font-family : 'Arial' "xml: lang =" ru-RU "lang =" ru-RU ">. Mitchell W. American Scientists and Inventors. M., Knowledge, 1975.
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 3; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU ">.; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> http://www.phywe.de
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 4; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU ">. Sivukhin D.V.; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> Cours de physique générale: 5 volumes - M., 1979. - Vol. 3, " Electricité ".
; font-family: 'Arial' "xml: lang =" ru-RU "lang =" ru-RU "> 5.; font-family : 'Arial' ; color : # 000000 "xml: lang =" ru-RU "lang =" ru-RU "> Règles de formalisation des résultats d'études expérimentales à la vison des robots de laboratoire du cours" Primaire physique ". Vorobyova N. V., Gorchinsky O.D., Kovalenko V.F., 2004.; font-family : 'Arial' ; couleur : # 000000 "xml: lang =" ru-RU "lang =" ru-RU ">
Commandez des travaux aujourd'hui avec une remise allant jusqu'à 25 %
Est libre
Connaître le coût des travaux
Parshina Anna, Sevalnikov Alexey, Luzyanin Roman.
But du travail : apprendre à déterminer la valeur d'une charge élémentaire par électrolyse ; examiner méthodes de détermination des chargesélectron.
Équipement: récipient cylindrique avec une solution de sulfate de cuivre, lampe, électrodes, balances, ampèremètre, source de tension constante, rhéostat, horloge, clé, fils de connexion.
Télécharger:
Aperçu:
Pour utiliser l'aperçu des présentations, créez vous-même un compte Google (compte) et connectez-vous : https://accounts.google.com
Légendes des diapositives :
Travaux de laboratoire Détermination de la charge élémentaire par électrolyse Les élèves de l'école secondaire Chuchkovskaya de 10e année : Parshina Anna, Sevalnikov Aleksey, Luzyanin Roman. Responsable : professeur de physique Chekalina O.Yu.
But du travail : apprendre à déterminer la valeur d'une charge élémentaire par la méthode de l'électrolyse ; étudier les méthodes de détermination de la charge d'un électron. Équipement : un récipient cylindrique avec une solution de sulfate de cuivre, une lampe, des électrodes, une balance, un ampèremètre, une source de tension constante, un rhéostat, une horloge, une clé, des fils de connexion.
Nous avons assemblé la chaîne : Avancement :
Le résultat de notre travail
Nous avons appris à déterminer la valeur d'une charge élémentaire par la méthode de l'électrolyse, étudié les méthodes de détermination de la charge d'un électron. Sortir:
V. Ya. Bryusov "Le monde de l'électron" Peut-être que ces électrons sont des Mondes où il y a cinq continents, Arts, savoirs, guerres, trônes Et la mémoire de quarante siècles ! Aussi, peut-être, chaque atome est l'Univers, où il y a cent planètes ; Il y a tout ce qui est ici, dans un volume compressé, Mais aussi ce qui n'est pas là. Leurs mesures sont petites, mais toujours les mêmes Leur infinité, comme ici ; Il y a du chagrin et de la passion, comme ici, et même il y a la même arrogance mondiale. Leurs sages, mettant leur monde sans fin au centre de l'être, Se hâtent de pénétrer dans les étincelles du mystère Et méditent, comme je le fais maintenant ; Et au moment où des courants de forces nouvelles sont créés à partir de la destruction, Ils crient, dans des rêves d'auto-hypnose, Que Dieu a éteint sa lumière !
Ministère de l'Éducation de la Fédération de Russie
Université pédagogique d'État de l'Amour
Méthodes de détermination de la charge électrique élémentaire
Complété par l'étudiant 151g.
Venzelev A.A.
Vérifié par: Cheraneva T.G
Introduction.
1. Préhistoire de la découverte de l'électron
2. Histoire de la découverte de l'électron
3. Expériences et méthodes de découverte d'électrons
3.1 L'expérience de Thomson
3.2 L'expérience de Rutherford
3.3. La méthode de Millikan
3.3.1. courte biographie
3.3.2. Description de l'installation
3.3.3. Calcul de la charge élémentaire
3.3.4. Conclusions de la méthode
3.4. Méthode d'imagerie Compton
Conclusion.
Introduction:
ELECTRON - la première particule élémentaire au moment de la découverte ; support matériel de la plus petite masse et de la plus petite charge électrique dans la nature; partie constitutive de l'atome.
La charge électronique est de 1,6021892. 10 -19 cl
4.803242. 10 -10 unités SGSE
La masse d'un électron est de 9.109534. 10 -31kg
Charge spécifique e / m e 1.7588047. 10 11cl. kg -1
Le spin de l'électron est 1/2 (en unités de h) et a deux projections ± 1/2 ; les électrons obéissent à la statistique de Fermi-Dirac, les fermions. Ils sont soumis au principe d'exclusion de Pauli.
Le moment magnétique de l'électron est égal à - 1,00116 m b, où m b est le magnéton de Bohr.
Un électron est une particule stable. D'après les données expérimentales, la durée de vie est t e> 2. 10 22 ans.
Ne participe pas aux interactions fortes, lepton. La physique moderne considère l'électron comme une particule véritablement élémentaire qui n'a ni structure ni taille. Si ces derniers sont non nuls, alors le rayon de l'électron r e< 10 -18 м
1.Contexte de la découverte
La découverte de l'électron est le résultat de nombreuses expériences. Au début du XXe siècle. l'existence de l'électron a été établie dans un certain nombre d'expériences indépendantes. Mais, malgré le matériel expérimental colossal accumulé par des écoles nationales entières, l'électron restait une particule hypothétique, car l'expérience n'avait pas encore répondu à nombre de questions fondamentales. En fait, la « découverte » de l'électron a duré plus d'un demi-siècle et n'a été achevée qu'en 1897 ; de nombreux scientifiques et inventeurs y ont participé.
Tout d'abord, il n'y avait pas une seule expérience à laquelle des électrons individuels participeraient. La charge élémentaire a été calculée à partir de mesures de la charge microscopique, en supposant la validité d'un certain nombre d'hypothèses.
L'incertitude était à un point crucial. Tout d'abord, l'électron est apparu à la suite de l'interprétation atomistique des lois de l'électrolyse, puis il a été découvert dans une décharge gazeuse. Il n'était pas clair si la physique traitait réellement du même objet. Un grand groupe de naturalistes sceptiques croyaient que la charge élémentaire est la moyenne statistique des charges des magnitudes les plus diverses. De plus, aucune des expériences de mesure de la charge électronique n'a donné de valeurs strictement répétées.
Il y avait des sceptiques qui ignoraient généralement la découverte de l'électron. L'académicien A.F. Ioffe dans ses mémoires sur son professeur V.K. Roentgen a écrit : « Jusqu'en 1906 - 1907. le mot électron n'aurait pas dû être prononcé à l'Institut de physique de l'Université de Munich. Roentgen la considérait comme une hypothèse non prouvée, souvent utilisée sans fondement suffisant et inutilement. »
La question de la masse de l'électron n'a pas été résolue; il n'a pas été prouvé que les charges sur les conducteurs et les diélectriques sont constituées d'électrons. Le concept d'« électron » n'avait pas d'interprétation univoque, car l'expérience n'avait pas encore révélé la structure de l'atome (le modèle planétaire de Rutherford apparaîtra en 1911, et la théorie de Bohr en 1913).
L'électron n'est pas encore entré dans les constructions théoriques. La théorie des électrons de Lorentz présentait une densité de charge distribuée en continu. Dans la théorie de la conductivité métallique, développée par Drude, il s'agissait de charges discrètes, mais il s'agissait de charges arbitraires, sur la valeur desquelles aucune restriction n'était imposée.
L'électron n'a pas encore dépassé le cadre de la science « pure ». Rappelons que la première lampe électronique n'est apparue qu'en 1907. Pour passer de la foi à la conviction, il a fallu tout d'abord isoler l'électron, inventer une méthode de mesure directe et précise de la charge élémentaire.
La solution à ce problème ne s'est pas fait attendre. En 1752, l'idée de la discrétion de la charge électrique a été exprimée pour la première fois par B. Franklin. La discrétion des charges a été confirmée expérimentalement par les lois de l'électrolyse découvertes par M. Faraday en 1834. La valeur numérique d'une charge élémentaire (la plus petite charge électrique trouvée dans la nature) a été théoriquement calculée sur la base des lois de l'électrolyse à l'aide de l'Avogadro numéro. R. Milliken a effectué une mesure expérimentale directe de la charge élémentaire dans des expériences classiques réalisées en 1908 - 1916. Ces expériences ont également fourni une preuve irréfutable de l'atomisme de l'électricité. Selon les concepts de base de la théorie électronique, la charge de tout corps résulte d'une modification du nombre d'électrons qu'il contient (ou d'ions positifs dont la valeur de charge est un multiple de la charge électronique). Par conséquent, la charge de tout corps devrait changer brusquement et dans des parties contenant un nombre entier de charges électroniques. Ayant établi expérimentalement le caractère discret du changement de charge électrique, R. Millikan a pu obtenir la confirmation de l'existence des électrons et déterminer l'amplitude de la charge d'un électron (charge élémentaire) en utilisant la méthode des gouttes d'huile. La méthode est basée sur l'étude du mouvement de gouttelettes d'huile chargées dans un champ électrique uniforme de force connue E.
2.Découverte de l'électron :
Si l'on ignore ce qui a précédé la découverte de la première particule élémentaire - l'électron, et ce qui a accompagné cet événement marquant, on peut dire brièvement : en 1897, le célèbre physicien anglais THOMSON Joseph John (1856-1940) a mesuré la charge spécifique q/m particules de rayons cathodiques - "corpuscules", comme il les appelait, par la déviation des rayons cathodiques *) dans les champs électriques et magnétiques.
En comparant le nombre obtenu avec la charge spécifique d'un ion hydrogène monovalent connu à l'époque, par un raisonnement indirect, il est arrivé à la conclusion que la masse de ces particules, appelées plus tard "électrons", est bien moindre (plus de mille fois ) la masse de l'ion hydrogène le plus léger.
La même année 1897, il a émis l'hypothèse que les électrons font partie intégrante des atomes et que les rayons cathodiques ne sont pas des atomes ou un rayonnement électromagnétique, comme le croyaient certains chercheurs sur les propriétés des rayons. Thomson a écrit : « Ainsi, les rayons cathodiques représentent un nouvel état de la matière, sensiblement différent de l'état gazeux habituel... ; dans ce nouvel état, la matière est la substance à partir de laquelle tous les éléments sont construits.
Depuis 1897, le modèle corpusculaire des rayons cathodiques a commencé à être largement accepté, bien qu'il y ait eu une grande variété de jugements sur la nature de l'électricité. Ainsi, le physicien allemand E. Wichert croyait que « l'électricité est quelque chose d'imaginaire, n'existant que dans les pensées », et le célèbre physicien anglais Lord Kelvin la même année, 1897, a écrit sur l'électricité comme une sorte de « fluide continu ».
L'idée de Thomson des corpuscules cathodiques comme principaux composants de l'atome n'a pas été accueillie avec beaucoup d'enthousiasme. Certains de ses collègues pensaient qu'il les mystifiait lorsqu'il suggéra que les particules des rayons cathodiques devaient être considérées comme des composants possibles de l'atome. Le véritable rôle des corpuscules de Thomson dans la structure de l'atome pourrait être compris en combinaison avec les résultats d'autres études, notamment avec les résultats de l'analyse des spectres et de l'étude de la radioactivité.
Le 29 avril 1897, Thomson prononça son célèbre message lors d'une réunion de la Royal Society de Londres. L'heure exacte de la découverte de l'électron - jour et heure - ne peut être nommée compte tenu de son originalité. Cet événement est le résultat de nombreuses années de travail de Thomson et de ses collaborateurs. Ni Thomson ni personne d'autre n'ont jamais observé un électron au sens littéral, personne n'a été capable d'isoler une particule individuelle d'un faisceau de rayons cathodiques et de mesurer sa charge spécifique. L'auteur de la découverte est J.J. Thomson car ses idées sur l'électron étaient proches des idées modernes. En 1903, il proposa l'un des premiers modèles de l'atome - "le pudding aux raisins secs", et en 1904, il suggéra que les électrons d'un atome soient divisés en groupes, formant diverses configurations qui déterminent la périodicité des éléments chimiques.
Le lieu de la découverte est précisément connu - le Cavendish Laboratory (Cambridge, Grande-Bretagne). Créé en 1870 par J.C. Maxwell, il devint au cours des cent années suivantes le "berceau" de toute une chaîne de brillantes découvertes dans divers domaines de la physique, notamment atomique et nucléaire. Ses directeurs étaient : Maxwell J.K. - de 1871 à 1879, Lord Rayleigh - de 1879 à 1884, Thomson J.J. - de 1884 à 1919, Rutherford E. - de 1919 à 1937, Bragg L. - de 1938 à 1953 ; Directeur adjoint en 1923-1935 - Chadwick J.
La recherche expérimentale scientifique a été menée par un scientifique ou un petit groupe dans une atmosphère de recherche créative. Laurence Bragg a rappelé plus tard son travail en 1913 avec son père Henry Bragg : . le début de la guerre *), qui a mis fin à notre travail commun."
3. Méthodes d'ouverture d'un électron :
3.1 L'expérience de Thomson
Joseph John Thomson, 1856-1940
Physicien anglais, mieux connu simplement sous le nom de J.J. Thomson. Né à Cheetham Hill, une banlieue de Manchester, fils d'un bouquiniste et antiquaire. En 1876, il obtient une bourse pour étudier à Cambridge. En 1884-1919, il était professeur au Département de physique expérimentale de l'Université de Cambridge et, en même temps, à la tête du Laboratoire Cavendish, qui, grâce aux efforts de Thomson, est devenu l'un des centres de recherche les plus célèbres au monde. Parallèlement, en 1905-1918, il est professeur au Royal Institute de Londres. Lauréat du prix Nobel de physique en 1906 avec la formulation "pour l'étude du passage de l'électricité à travers les gaz", qui inclut bien entendu la découverte de l'électron. Le fils de Thomson, George Paget Thomson (1892-1975) est également devenu le lauréat du prix Nobel de physique - en 1937 pour la découverte expérimentale de la diffraction des électrons par des cristaux.
En 1897, le jeune physicien anglais J.J. Thomson est devenu célèbre pendant des siècles comme le découvreur de l'électron. Dans son expérience, Thomson a utilisé un tube cathodique amélioré, dont la conception a été complétée par des bobines électriques qui ont créé (selon la loi d'Ampère) un champ magnétique à l'intérieur du tube, et un ensemble de plaques de condensateurs électriques parallèles qui ont créé un champ électrique à l'intérieur du tube. Cela a permis d'étudier le comportement des rayons cathodiques sous l'influence à la fois des champs magnétiques et électriques.
En utilisant une nouvelle conception de tube, Thomson a constamment montré que : (1) les rayons cathodiques sont déviés dans un champ magnétique en l'absence d'un champ électrique ; (2) les rayons cathodiques sont déviés dans un champ électrique en l'absence de champ magnétique ; et (3) sous l'action simultanée de champs électriques et magnétiques d'intensité équilibrée, orientés dans des directions qui provoquent séparément des déviations dans des directions opposées, les rayons cathodiques se propagent en ligne droite, c'est-à-dire que l'action des deux champs est mutuellement équilibrée.
Thomson a découvert que la relation entre les champs électriques et magnétiques, à laquelle leur action est équilibrée, dépend de la vitesse à laquelle les particules se déplacent. Grâce à une série de mesures, Thomson a pu déterminer la vitesse de déplacement des rayons cathodiques. Il s'est avéré qu'ils se déplacent beaucoup plus lentement que la vitesse de la lumière, d'où il ressort que les rayons cathodiques ne peuvent être que des particules, puisque tout rayonnement électromagnétique, y compris la lumière elle-même, se propage à la vitesse de la lumière (voir Spectre du rayonnement électromagnétique). Ce sont des particules inconnues. Thomson a appelé "corpuscules", mais bientôt ils ont commencé à être appelés "électrons".
Il est immédiatement devenu évident que les électrons doivent exister dans la composition des atomes - sinon, d'où viendraient-ils ? Le 30 avril 1897 - date à laquelle Thomson a rendu compte de ses résultats lors d'une réunion de la Royal Society de Londres - est considéré comme l'anniversaire de l'électron. Et ce jour-là, l'idée de "l'indivisibilité" des atomes est devenue une chose du passé (voir Théorie atomique de la structure de la matière). Avec la découverte du noyau atomique qui a suivi un peu plus de dix ans plus tard (voir l'expérience de Rutherford), la découverte de l'électron a jeté les bases du modèle moderne de l'atome.
La "cathode" décrite ci-dessus, ou plutôt les tubes à rayons cathodiques, sont devenus les prédécesseurs les plus simples des kinéscopes de télévision et des écrans d'ordinateur modernes, dans lesquels des quantités strictement contrôlées d'électrons sont éliminées de la surface d'une cathode chaude, sous l'influence de variables magnétiques. les champs dévient à des angles strictement déterminés et bombardent les cellules phosphorescentes des écrans, formant sur elles une image nette résultant de l'effet photoélectrique, dont la découverte serait également impossible sans notre connaissance de la véritable nature des rayons cathodiques.
3.2 L'expérience de Rutherford
Ernest Rutherford, premier baron Rutherford de Nelson, 1871-1937
Physicien néo-zélandais. Né à Nelson, fils d'un agriculteur artisan. A remporté une bourse pour étudier à l'Université de Cambridge en Angleterre. Après ses études, il a été affecté à l'Université canadienne McGill, où, avec Frederick Soddy (1877-1966), il a établi les lois fondamentales du phénomène de la radioactivité, pour lequel il a reçu le prix Nobel de chimie en 1908. Bientôt, le scientifique s'installa à l'Université de Manchester, où, sous sa direction, Hans Geiger (1882-1945) inventa son célèbre compteur Geiger, commença des recherches sur la structure de l'atome et découvrit en 1911 l'existence du noyau atomique. Pendant la Première Guerre mondiale, il s'est engagé dans le développement de sonars (radars acoustiques) pour détecter les sous-marins ennemis. En 1919, il est nommé professeur de physique et directeur du laboratoire Cavendish de l'université de Cambridge et, la même année, découvre la désintégration nucléaire à la suite d'un bombardement de particules lourdes de haute énergie. À ce poste, Rutherford est resté jusqu'à la fin de sa vie, tout en servant pendant de nombreuses années en tant que président de la Royal Scientific Society. Inhumé dans l'abbaye de Westminster à côté de Newton, Darwin et Faraday.
Ernest Rutherford est un scientifique unique dans le sens où il a fait ses principales découvertes après avoir reçu le prix Nobel. En 1911, il a réussi une expérience qui a non seulement permis aux scientifiques d'examiner en profondeur l'atome et de se faire une idée de sa structure, mais est également devenu un modèle de grâce et de profondeur de conception.
 En utilisant une source naturelle de rayonnement radioactif, Rutherford a construit un canon qui a produit un flux de particules dirigé et concentré. Le pistolet était une boîte en plomb avec une fente étroite, à l'intérieur de laquelle des matières radioactives étaient placées. Pour cette raison, les particules (dans ce cas, les particules alpha, constituées de deux protons et de deux neutrons) émises par la substance radioactive dans toutes les directions, sauf une, ont été absorbées par le bouclier de plomb, et seul un faisceau dirigé de particules alpha a volé par la fente.
En utilisant une source naturelle de rayonnement radioactif, Rutherford a construit un canon qui a produit un flux de particules dirigé et concentré. Le pistolet était une boîte en plomb avec une fente étroite, à l'intérieur de laquelle des matières radioactives étaient placées. Pour cette raison, les particules (dans ce cas, les particules alpha, constituées de deux protons et de deux neutrons) émises par la substance radioactive dans toutes les directions, sauf une, ont été absorbées par le bouclier de plomb, et seul un faisceau dirigé de particules alpha a volé par la fente.
|
direction donnée. En conséquence, un faisceau parfaitement focalisé de particules alpha a volé jusqu'à la cible, et la cible elle-même était la feuille d'or la plus mince. Le rayon alpha la frappa. Après être entrées en collision avec les atomes de la feuille, les particules alpha ont poursuivi leur chemin et ont heurté un écran luminescent installé derrière la cible, sur lequel des flashs ont été enregistrés lorsque les particules alpha la frappaient. À partir d'eux, l'expérimentateur a pu juger de la quantité et de la quantité de particules alpha qui s'écartent de la direction du mouvement rectiligne à la suite de collisions avec des atomes de feuille.
Rutherford, cependant, a remarqué qu'aucun de ses prédécesseurs n'a même essayé de tester expérimentalement si certaines particules alpha étaient déviées à de très grands angles. Le modèle de grille aux raisins secs ne permettait tout simplement pas l'existence d'éléments structurels si denses et lourds dans l'atome qu'ils pouvaient dévier les particules alpha rapides à des angles importants, donc personne n'a pris la peine de tester cette possibilité. Rutherford a demandé à l'un de ses étudiants de rééquiper l'installation de manière à ce qu'il soit possible d'observer la diffusion de particules alpha à de grands angles de déviation - juste pour se soulager la conscience, pour éliminer complètement cette possibilité. Le détecteur était un écran recouvert de sulfure de sodium, un matériau qui émet un flash fluorescent lorsqu'une particule alpha le frappe. Imaginez la surprise non seulement de l'étudiant menant directement l'expérience, mais aussi de Rutherford lui-même lorsqu'il s'est avéré que certaines particules sont déviées à des angles allant jusqu'à 180° !
L'image de l'atome, dressée par Rutherford à partir des résultats de l'expérience, nous est bien connue aujourd'hui. Un atome est constitué d'un noyau superdense et compact qui porte une charge positive et d'électrons légers chargés négativement autour de lui. Plus tard, les scientifiques ont fourni une base théorique fiable pour cette image (voir Bora Atom), mais tout a commencé par une simple expérience avec un petit échantillon de matière radioactive et un morceau de feuille d'or.
3.2 Méthode Milliken
3.2.1. Courte biographie:
Robert Millikan est né en 1868 dans l'Illinois dans une famille sacerdotale pauvre. Il passe son enfance dans la ville de province de Macvocket, où l'on accorde une grande attention aux sports et est mal enseigné. Un directeur de lycée qui enseignait la physique disait par exemple à ses jeunes auditeurs : « Comment peut-on faire du son avec des ondes ? Non-sens, les garçons, c'est tout un non-sens! "
Oberdeen College n'était pas mieux, mais Millikan, qui n'avait aucun soutien financier, a dû lui-même enseigner la physique au lycée. En Amérique, il n'y avait alors que deux manuels de physique, traduits du français, et le jeune homme talentueux n'a eu aucune difficulté à les étudier et à enseigner avec succès. En 1893, il entre à l'université de Columbia, puis part étudier en Allemagne.
Millikan avait 28 ans lorsqu'il a reçu une offre d'A. Michelson pour occuper un poste d'assistant à l'Université de Chicago. Au début, il s'est engagé ici presque exclusivement dans un travail pédagogique et ce n'est qu'à l'âge de quarante ans qu'il a commencé des recherches scientifiques, ce qui lui a valu une renommée mondiale.
3.2.2. Premières expériences et résolution de problèmes :
Les premières expériences se résumaient aux suivantes. Entre les plaques du condensateur plat, auxquelles une tension de 4000 V a été appliquée, un nuage s'est créé, constitué de gouttelettes d'eau déposées sur les ions. On a d'abord observé que le sommet du nuage tombait en l'absence de champ électrique. Ensuite, un nuage a été créé avec la tension allumée. La chute du nuage a eu lieu sous l'influence de la gravité et de la force électrique.
Le rapport de la force agissant sur une goutte dans un nuage à la vitesse qu'elle acquiert est le même dans le premier et le deuxième cas. Dans le premier cas, la force est mg, dans le second mg + qE, où q est la charge de la goutte, E est l'intensité du champ électrique. Si la vitesse dans le premier cas est égale à 1 dans le second 2, alors
Connaissant la dépendance de la vitesse de chute du nuage υ sur la viscosité de l'air, nous pouvons calculer la charge requise q. Cependant, cette méthode n'a pas donné la précision souhaitée, car elle contenait des hypothèses hypothétiques qui échappaient au contrôle de l'expérimentateur.
Afin d'augmenter la précision des mesures, il fallait tout d'abord trouver un moyen de prendre en compte l'évaporation du nuage, qui se produisait inévitablement lors de la mesure.
En réfléchissant à ce problème, Millikan a proposé la méthode classique du drop, qui a ouvert un certain nombre de possibilités inattendues. Nous laisserons l'histoire de l'invention à l'auteur lui-même :
« Réalisant que le taux d'évaporation des gouttelettes restait inconnu, j'ai essayé de trouver une méthode qui exclurait complètement cette valeur indéterminée. Mon plan était le suivant. Dans les expériences précédentes, le champ électrique ne pouvait que légèrement augmenter ou diminuer la vitesse de chute du sommet du nuage sous l'influence de la gravité. Maintenant, je voulais renforcer ce champ pour que la surface supérieure du nuage reste à une hauteur constante. Dans ce cas, il est devenu possible de déterminer avec précision le taux d'évaporation du nuage et d'en tenir compte dans les calculs. »
Pour mettre en œuvre cette idée, Millikan a conçu une batterie rechargeable de petite taille, qui a donné une tension allant jusqu'à 10 4 V (pour l'époque, c'était une réalisation exceptionnelle de l'expérimentateur). Elle a dû créer un champ suffisamment fort pour que le nuage se maintienne, comme le « cercueil de Mahomet », dans les limbes. « Quand j'avais tout prêt », dit Millikan, et lorsque le nuage s'est formé, j'ai tourné l'interrupteur et le nuage était dans le champ électrique. Et à ce moment-là, il a fondu sous mes yeux, en d'autres termes, il ne restait même pas un petit morceau de tout le nuage, qui pouvait être observé à l'aide d'un dispositif de contrôle optique, comme Wilson l'avait fait et j'allais le faire. Au début, il m'a semblé que la disparition du nuage sans laisser de trace dans le champ électrique entre les plaques supérieure et inférieure signifiait que l'expérience s'était terminée en vain... nouvelle idée. Elle a conduit à la fameuse méthode du drop. « Des expériences répétées », écrit Millikan, « ont montré qu'après la dissipation du nuage dans un puissant champ électrique, à sa place plusieurs gouttelettes d'eau distinctes ont pu être discernées"(Souligné par moi. - V. D.). L'expérience "infructueuse" a conduit à la découverte de la possibilité de maintenir en équilibre et d'observer des gouttelettes individuelles pendant un temps suffisamment long.
Mais pendant la période d'observation, la masse de la goutte d'eau a considérablement changé en raison de l'évaporation, et Millikan, après plusieurs jours de recherche, est passé à des expériences avec des gouttelettes d'huile.
La procédure expérimentale s'est avérée simple. Un nuage se forme entre les plaques du condenseur par expansion adiabatique. Il se compose de gouttelettes avec des charges de magnitude et de signe différents. Lorsque le champ électrique est activé, les gouttes avec des charges du même nom que la charge sur la plaque supérieure du condensateur tombent rapidement et les gouttes avec la charge opposée sont attirées par la plaque supérieure. Mais un certain nombre de gouttes ont une charge telle que la force de gravité est équilibrée par la force électrique.
Après 7 ou 8 minutes. le nuage se dissipe et il reste dans le champ de vision un petit nombre de gouttes dont la charge correspond au rapport de forces indiqué.
Millikan a observé ces gouttes comme des points lumineux distincts. "L'histoire de ces gouttes se déroule généralement comme ceci, écrit-il. Dans le cas d'une légère prédominance de la gravité sur la force du champ, elles commencent à tomber lentement, mais comme elles s'évaporent progressivement, leur mouvement descendant cesse bientôt, et ils restent immobiles assez longtemps. ... Puis le champ commence à s'imposer et les gouttes commencent à monter lentement. En fin de vie dans l'espace entre les plaques, ce mouvement ascendant devient très fortement accéléré, et ils sont attirés à grande vitesse vers la plaque supérieure."
3.2.3. Descriptif de l'installation :
Le schéma de l'appareil Millikan, à l'aide duquel des résultats décisifs ont été obtenus en 1909, est représenté sur la figure 17.
La chambre C contenait un condensateur plat constitué de plaques rondes en laiton M et N d'un diamètre de 22 cm (la distance entre elles était de 1,6 cm). Un petit trou p a été pratiqué au centre de la plaque supérieure à travers lequel les gouttelettes d'huile passaient. Ces derniers ont été formés en insufflant un jet d'huile à l'aide d'un spray. Dans ce cas, l'air a été préalablement purifié de la poussière en le faisant passer dans un tuyau avec de la laine de verre. Les gouttelettes d'huile avaient un diamètre d'environ 10 -4 cm.
 Une tension de 10 4 V a été appliquée aux plaques du condensateur à partir de la batterie d'accumulateurs B. Un interrupteur pouvait être utilisé pour court-circuiter les plaques et détruire ainsi le champ électrique.
Une tension de 10 4 V a été appliquée aux plaques du condensateur à partir de la batterie d'accumulateurs B. Un interrupteur pouvait être utilisé pour court-circuiter les plaques et détruire ainsi le champ électrique.
Les gouttes d'huile tombant entre les plaques M et N étaient éclairées par une source puissante. Le comportement des gouttes a été observé perpendiculairement à la direction des rayons à travers le télescope.
Les ions nécessaires à la condensation des gouttelettes ont été créés par le rayonnement d'un morceau de radium de 200 mg de masse situé à une distance de 3 à 10 cm du côté des plaques.
À l'aide d'un dispositif spécial, le gaz a été détendu en abaissant le piston. En 1 à 2 s après l'expansion, le radium a été retiré ou masqué par un écran de plomb. Ensuite, le champ électrique a été activé et l'observation des gouttes dans le télescope a commencé. Le tuyau avait une échelle grâce à laquelle il était possible de compter la distance parcourue par la goutte pendant une certaine période de temps. L'heure a été enregistrée par une montre précise avec une serrure.
Au cours des observations, Millikan a découvert un phénomène qui a servi de clé à toute la série de mesures précises ultérieures des charges élémentaires individuelles.
« En travaillant sur des gouttelettes en suspension, écrit Millikan, j'ai oublié plusieurs fois de les bloquer des rayons du radium. Puis il m'est arrivé de remarquer que de temps en temps une des gouttes changeait brusquement de charge et commençait à se déplacer le long du champ ou contre lui, capturant évidemment dans le premier cas un ion positif et dans le second cas un ion négatif. Cela ouvrait la possibilité de mesurer avec certitude non seulement les charges de gouttes individuelles, comme je l'avais fait jusque-là, mais aussi la charge d'un ion atmosphérique individuel.
En effet, mesurant deux fois la vitesse d'une même goutte, une fois avant et la deuxième fois après la capture de l'ion, j'ai pu évidemment exclure totalement les propriétés de la goutte et les propriétés du milieu et opérer avec une valeur proportionnelle uniquement à la charge de l'ion capturé. "
3.2.4. Calcul de la charge élémentaire :
La charge élémentaire a été calculée par Millikan sur la base des considérations suivantes. La vitesse de la goutte est proportionnelle à la force agissant sur elle et ne dépend pas de la charge de la goutte.
Si une goutte tombait entre les plaques du condensateur sous l'action de la seule gravité avec une vitesse , alors
Lorsque le champ est activé, dirigé contre la force de gravité, la force agissante sera la différence qE - mg, où q est la charge de la goutte, E est le module de l'intensité du champ.
La vitesse des gouttes sera égale à :
2 = k (qE-mg) (2)
Si on divise l'égalité (1) par (2), on obtient
![]() D'ici
D'ici
Soit la goutte d'avoir capturé un ion et sa charge est devenue égale à q ", et la vitesse de déplacement 2. La charge de cet ion capturé sera notée e.
Alors e = q "-q.
En utilisant (3), on obtient
![]()
La valeur est constante pour une goutte donnée.
3.2.5. Conclusions de la méthode Millikan
Par conséquent, toute charge capturée par la goutte sera proportionnelle à la différence de vitesses (υ "2 - υ 2), c'est-à-dire proportionnelle au changement de vitesse de la goutte dû à la capture d'un ion ! De nombreuses observations ont montré la validité de la formule (4) Il s'est avéré que la valeur de e ne peut changer que par sauts !Les charges e, 2e, 3e, 4e, etc. sont toujours observées.
« Dans de nombreux cas », écrit Millikan, « la goutte a été observée pendant cinq ou six heures, et pendant ce temps, elle a capturé non pas huit ou dix ions, mais des centaines d'entre eux. Au total, j'ai observé la capture de plusieurs milliers d'ions de cette manière, et dans tous les cas la charge capturée... était soit exactement égale à la plus petite de toutes les charges capturées, soit elle était égale à un petit multiple entier de cette valeur . C'est une preuve directe et irréfutable que l'électron n'est pas une "moyenne statistique", mais que toutes les charges électriques sur les ions sont soit exactement égales à la charge de l'électron, soit représentent de petits multiples entiers de cette charge."
Ainsi, l'atomisme, la discrétion ou, en termes modernes, la quantification d'une charge électrique est devenu un fait expérimental. Or, il importait de montrer que l'électron est pour ainsi dire omniprésent. Toute charge électrique dans un corps de toute nature est la somme des mêmes charges élémentaires.
La méthode de Millikan a permis de répondre sans équivoque à cette question. Dans les premières expériences, des charges ont été créées en ionisant des molécules de gaz neutre avec un flux de rayonnement radioactif. La charge des ions capturés par les gouttelettes a été mesurée.
Lorsque le liquide est pulvérisé avec un flacon pulvérisateur, les gouttelettes sont électrifiées en raison de la friction. C'était bien connu au XIXe siècle. Ces charges sont-elles aussi quantifiées que les charges des ions ? Millikan "pese" les gouttelettes après pulvérisation et mesure les charges de la manière décrite ci-dessus. L'expérience révèle la même discrétion de la charge électrique.
En pulvérisant des gouttes d'huile (diélectrique), de glycérine (semi-conducteur), de mercure (conducteur), Millikan prouve que les charges sur les corps de toute nature physique sont dans tous les cas sans exception des portions élémentaires individuelles de valeur strictement constante. En 1913, Millikan résume les résultats de nombreuses expériences et donne la valeur suivante pour la charge élémentaire : e = 4,774. 10 -10 unités Tarif CGSE. C'est ainsi qu'a été établie l'une des constantes les plus importantes de la physique moderne. La détermination de la charge électrique est devenue un simple problème arithmétique.
3.4 Méthode d'imagerie Compton :
Un grand rôle dans le renforcement de l'idée de la réalité de l'électron a été joué par la découverte de Ch.T.R. Wilson de l'effet de la condensation de la vapeur d'eau sur les ions, ce qui a conduit à la possibilité de photographier des traces de particules.
Ils disent que A. Compton lors de la conférence ne pouvait en aucun cas convaincre un auditeur sceptique de la réalité de l'existence des microparticules. Il a insisté sur le fait qu'il ne croirait que lorsqu'il les verrait de ses propres yeux.
Ensuite, Compton a montré une photographie avec une piste de particules alpha, à côté de laquelle se trouvait une empreinte digitale. "Savez-vous ce que cela est?" a demandé Compton. « Doigt », a répondu l'auditeur. « Dans ce cas, déclara solennellement Compton, cette bande de lumière est la particule.
Les photographies des pistes d'électrons n'étaient pas seulement indicatives de la réalité des électrons. Ils ont confirmé l'hypothèse sur la petite taille des électrons et ont permis de comparer avec l'expérience les résultats de calculs théoriques, dans lesquels apparaissait le rayon des électrons. Les expériences, qui ont été initiées par Lenard dans l'étude de la capacité de pénétration des rayons cathodiques, ont montré que des électrons très rapides émis par des substances radioactives donnent des traces dans le gaz sous forme de lignes droites. La longueur de la piste est proportionnelle à l'énergie des électrons. Des photographies de traces de particules alpha à haute énergie montrent que les traces sont composées d'un grand nombre de points. Chaque point est une goutte d'eau apparaissant sur un ion, qui se forme à la suite de la collision d'un électron avec un atome. Connaissant la taille de l'atome et sa concentration, on peut calculer le nombre d'atomes par lesquels la particule doit passer à une distance donnée. Un calcul simple montre qu'une particule doit passer environ 300 atomes avant de rencontrer l'un des électrons qui composent la couche atomique sur son chemin et de s'ioniser.
Ce fait indique de manière convaincante que le volume des électrons est une fraction négligeable du volume d'un atome. La trajectoire d'un électron de basse énergie est courbe ; par conséquent, un électron lent est dévié par un champ intra-atomique. Il produit plus d'actes d'ionisation sur son chemin.
A partir de la théorie de la diffusion, des données peuvent être obtenues pour estimer les angles de déviation en fonction de l'énergie des électrons. Ces données sont bien confirmées par l'analyse de pistes réelles.La coïncidence de la théorie avec l'expérience a renforcé le concept de l'électron comme la plus petite particule de matière.
Conclusion:
La mesure de la charge électrique élémentaire a ouvert la possibilité d'une détermination précise d'un certain nombre des constantes physiques les plus importantes.
Connaître la valeur de e permet de déterminer automatiquement la valeur de la constante fondamentale - la constante d'Avogadro. Avant les expériences de Millikan, il n'y avait que des estimations approximatives de la constante d'Avogadro, qui étaient données par la théorie cinétique des gaz. Ces estimations étaient basées sur des calculs du rayon moyen d'une molécule d'air et variaient dans une fourchette assez large allant de 2. 10 23 à 20. 10 23 1 / mol.
Supposons que nous connaissions la charge Q qui a traversé la solution électrolytique et la quantité de substance M qui se dépose sur l'électrode. Alors, si la charge de l'ion est Ze 0 et sa masse est m 0, l'égalité
Si la masse de la substance déposée est égale à une mole,
alors Q = F est la constante de Faraday, et F = N 0 e, d'où :
De toute évidence, la précision de la détermination de la constante d'Avogadro est donnée par la précision avec laquelle la charge électronique est mesurée. La pratique exigeait une augmentation de la précision de la détermination des constantes fondamentales, et c'était l'une des incitations à continuer d'améliorer la méthode de mesure du quantum de charge électrique. Ce travail, qui est déjà de nature purement métrologique, se poursuit à ce jour.
Les valeurs les plus précises sont actuellement :
e = (4,8029 ± 0,0005) 10 -10. unités redevance CGSE ;
N 0 = (6,0230 ± 0,0005) 10 23 1 / mol.
Connaissant N o , il est possible de déterminer le nombre de molécules de gaz dans 1 cm 3 , puisque le volume occupé par 1 mole de gaz est une constante déjà connue.
Connaître le nombre de molécules de gaz dans 1 cm 3, à son tour, a permis de déterminer l'énergie cinétique moyenne du mouvement thermique d'une molécule. Enfin, la charge électronique peut être utilisée pour déterminer la constante de Planck et la constante de Stefan-Boltzmann dans la loi du rayonnement thermique.
Ministère de l'Éducation de la Fédération de Russie
Université pédagogique d'État de l'Amour
Méthodes de détermination de la charge électrique élémentaire
Complété par l'étudiant 151g.
Venzelev A.A.
Vérifié par: Cheraneva T.G
Introduction.
1. Préhistoire de la découverte de l'électron
2. Histoire de la découverte de l'électron
3. Expériences et méthodes de découverte d'électrons
3.1 L'expérience de Thomson
3.2 L'expérience de Rutherford
3.3. La méthode de Millikan
3.3.1. courte biographie
3.3.2. Description de l'installation
3.3.3. Calcul de la charge élémentaire
3.3.4. Conclusions de la méthode
3.4. Méthode d'imagerie Compton
Conclusion.
Introduction:
ELECTRON - la première particule élémentaire au moment de la découverte ; support matériel de la plus petite masse et de la plus petite charge électrique dans la nature; partie constitutive de l'atome.
La charge électronique est de 1,6021892. 10 -19 cl
4.803242. 10 -10 unités SGSE
La masse d'un électron est de 9.109534. 10 -31kg
Charge spécifique e / m e 1.7588047. 10 11cl. kg -1
Le spin de l'électron est 1/2 (en unités de h) et a deux projections ± 1/2 ; les électrons obéissent à la statistique de Fermi-Dirac, les fermions. Ils sont soumis au principe d'exclusion de Pauli.
Le moment magnétique de l'électron est égal à - 1,00116 m b, où m b est le magnéton de Bohr.
Un électron est une particule stable. D'après les données expérimentales, la durée de vie est t e> 2. 10 22 ans.
Ne participe pas aux interactions fortes, lepton. La physique moderne considère l'électron comme une particule véritablement élémentaire qui n'a ni structure ni taille. Si ces derniers sont non nuls, alors le rayon de l'électron r e< 10 -18 м
1.Contexte de la découverte
La découverte de l'électron est le résultat de nombreuses expériences. Au début du XXe siècle. l'existence de l'électron a été établie dans un certain nombre d'expériences indépendantes. Mais, malgré le matériel expérimental colossal accumulé par des écoles nationales entières, l'électron restait une particule hypothétique, car l'expérience n'avait pas encore répondu à nombre de questions fondamentales. En fait, la « découverte » de l'électron a duré plus d'un demi-siècle et n'a été achevée qu'en 1897 ; de nombreux scientifiques et inventeurs y ont participé.
Tout d'abord, il n'y avait pas une seule expérience à laquelle des électrons individuels participeraient. La charge élémentaire a été calculée à partir de mesures de la charge microscopique, en supposant la validité d'un certain nombre d'hypothèses.
L'incertitude était à un point crucial. Tout d'abord, l'électron est apparu à la suite de l'interprétation atomistique des lois de l'électrolyse, puis il a été découvert dans une décharge gazeuse. Il n'était pas clair si la physique traitait réellement du même objet. Un grand groupe de naturalistes sceptiques croyaient que la charge élémentaire est la moyenne statistique des charges des magnitudes les plus diverses. De plus, aucune des expériences de mesure de la charge électronique n'a donné de valeurs strictement répétées.
Il y avait des sceptiques qui ignoraient généralement la découverte de l'électron. L'académicien A.F. Ioffe dans ses mémoires sur son professeur V.K. Roentgen a écrit : « Jusqu'en 1906 - 1907. le mot électron n'aurait pas dû être prononcé à l'Institut de physique de l'Université de Munich. Roentgen la considérait comme une hypothèse non prouvée, souvent utilisée sans fondement suffisant et inutilement. »
La question de la masse de l'électron n'a pas été résolue; il n'a pas été prouvé que les charges sur les conducteurs et les diélectriques sont constituées d'électrons. Le concept d'« électron » n'avait pas d'interprétation univoque, car l'expérience n'avait pas encore révélé la structure de l'atome (le modèle planétaire de Rutherford apparaîtra en 1911, et la théorie de Bohr en 1913).
L'électron n'est pas encore entré dans les constructions théoriques. La théorie des électrons de Lorentz présentait une densité de charge distribuée en continu. Dans la théorie de la conductivité métallique, développée par Drude, il s'agissait de charges discrètes, mais il s'agissait de charges arbitraires, sur la valeur desquelles aucune restriction n'était imposée.
L'électron n'a pas encore dépassé le cadre de la science « pure ». Rappelons que la première lampe électronique n'est apparue qu'en 1907. Pour passer de la foi à la conviction, il a fallu tout d'abord isoler l'électron, inventer une méthode de mesure directe et précise de la charge élémentaire.
La solution à ce problème ne s'est pas fait attendre. En 1752, l'idée de la discrétion de la charge électrique a été exprimée pour la première fois par B. Franklin. La discrétion des charges a été confirmée expérimentalement par les lois de l'électrolyse découvertes par M. Faraday en 1834. La valeur numérique d'une charge élémentaire (la plus petite charge électrique trouvée dans la nature) a été théoriquement calculée sur la base des lois de l'électrolyse à l'aide de l'Avogadro numéro. R. Milliken a effectué une mesure expérimentale directe de la charge élémentaire dans des expériences classiques réalisées en 1908 - 1916. Ces expériences ont également fourni une preuve irréfutable de l'atomisme de l'électricité. Selon les concepts de base de la théorie électronique, la charge de tout corps résulte d'une modification du nombre d'électrons qu'il contient (ou d'ions positifs dont la valeur de charge est un multiple de la charge électronique). Par conséquent, la charge de tout corps devrait changer brusquement et dans des parties contenant un nombre entier de charges électroniques. Ayant établi expérimentalement le caractère discret du changement de charge électrique, R. Millikan a pu obtenir la confirmation de l'existence des électrons et déterminer l'amplitude de la charge d'un électron (charge élémentaire) en utilisant la méthode des gouttes d'huile. La méthode est basée sur l'étude du mouvement de gouttelettes d'huile chargées dans un champ électrique uniforme de force connue E.
2.Découverte de l'électron :
Si l'on ignore ce qui a précédé la découverte de la première particule élémentaire - l'électron, et ce qui a accompagné cet événement marquant, on peut dire brièvement : en 1897, le célèbre physicien anglais THOMSON Joseph John (1856-1940) a mesuré la charge spécifique q/m particules de rayons cathodiques - "corpuscules", comme il les appelait, par la déviation des rayons cathodiques *) dans les champs électriques et magnétiques.
En comparant le nombre obtenu avec la charge spécifique d'un ion hydrogène monovalent connu à l'époque, par un raisonnement indirect, il est arrivé à la conclusion que la masse de ces particules, appelées plus tard "électrons", est bien moindre (plus de mille fois ) la masse de l'ion hydrogène le plus léger.
La même année 1897, il a émis l'hypothèse que les électrons font partie intégrante des atomes et que les rayons cathodiques ne sont pas des atomes ou un rayonnement électromagnétique, comme le croyaient certains chercheurs sur les propriétés des rayons. Thomson a écrit : « Ainsi, les rayons cathodiques représentent un nouvel état de la matière, sensiblement différent de l'état gazeux habituel... ; dans ce nouvel état, la matière est la substance à partir de laquelle tous les éléments sont construits.
Depuis 1897, le modèle corpusculaire des rayons cathodiques a commencé à être largement accepté, bien qu'il y ait eu une grande variété de jugements sur la nature de l'électricité. Ainsi, le physicien allemand E. Wichert croyait que « l'électricité est quelque chose d'imaginaire, n'existant que dans les pensées », et le célèbre physicien anglais Lord Kelvin la même année, 1897, a écrit sur l'électricité comme une sorte de « fluide continu ».
L'idée de Thomson des corpuscules cathodiques comme principaux composants de l'atome n'a pas été accueillie avec beaucoup d'enthousiasme. Certains de ses collègues pensaient qu'il les mystifiait lorsqu'il suggéra que les particules des rayons cathodiques devaient être considérées comme des composants possibles de l'atome. Le véritable rôle des corpuscules de Thomson dans la structure de l'atome pourrait être compris en combinaison avec les résultats d'autres études, notamment avec les résultats de l'analyse des spectres et de l'étude de la radioactivité.
Le 29 avril 1897, Thomson prononça son célèbre message lors d'une réunion de la Royal Society de Londres. L'heure exacte de la découverte de l'électron - jour et heure - ne peut être nommée compte tenu de son originalité. Cet événement est le résultat de nombreuses années de travail de Thomson et de ses collaborateurs. Ni Thomson ni personne d'autre n'ont jamais observé un électron au sens littéral, personne n'a été capable d'isoler une particule individuelle d'un faisceau de rayons cathodiques et de mesurer sa charge spécifique. L'auteur de la découverte est J.J. Thomson car ses idées sur l'électron étaient proches des idées modernes. En 1903, il proposa l'un des premiers modèles de l'atome - "le pudding aux raisins secs", et en 1904, il suggéra que les électrons d'un atome soient divisés en groupes, formant diverses configurations qui déterminent la périodicité des éléments chimiques.
Le lieu de la découverte est précisément connu - le Cavendish Laboratory (Cambridge, Grande-Bretagne). Créé en 1870 par J.C. Maxwell, il devint au cours des cent années suivantes le "berceau" de toute une chaîne de brillantes découvertes dans divers domaines de la physique, notamment atomique et nucléaire. Ses directeurs étaient : Maxwell J.K. - de 1871 à 1879, Lord Rayleigh - de 1879 à 1884, Thomson J.J. - de 1884 à 1919, Rutherford E. - de 1919 à 1937, Bragg L. - de 1938 à 1953 ; Directeur adjoint en 1923-1935 - Chadwick J.
La recherche expérimentale scientifique a été menée par un scientifique ou un petit groupe dans une atmosphère de recherche créative. Laurence Bragg a rappelé plus tard son travail en 1913 avec son père Henry Bragg : . le début de la guerre *), qui a mis fin à notre travail commun."
3. Méthodes d'ouverture d'un électron :
3.1 L'expérience de Thomson
Joseph John Thomson, 1856-1940
Physicien anglais, mieux connu simplement sous le nom de J.J. Thomson. Né à Cheetham Hill, une banlieue de Manchester, fils d'un bouquiniste et antiquaire. En 1876, il obtient une bourse pour étudier à Cambridge. En 1884-1919, il était professeur au Département de physique expérimentale de l'Université de Cambridge et, en même temps, à la tête du Laboratoire Cavendish, qui, grâce aux efforts de Thomson, est devenu l'un des centres de recherche les plus célèbres au monde. Parallèlement, en 1905-1918, il est professeur au Royal Institute de Londres. Lauréat du prix Nobel de physique en 1906 avec la formulation "pour l'étude du passage de l'électricité à travers les gaz", qui inclut bien entendu la découverte de l'électron. Le fils de Thomson, George Paget Thomson (1892-1975) est également devenu le lauréat du prix Nobel de physique - en 1937 pour la découverte expérimentale de la diffraction des électrons par des cristaux.