Основы теории горения. Виды горения, их характеристика. Молекулярная энергетика горения
Первой хронологически (конец ХIХ века) была тепловая теория, основоположниками которой считаются Маляр, Ле Шателье и Нуссельт. В основу этой теории положена гипотеза Вант-Гофа о температурной зависимости скорости химической реакции. Условием теплового взрыва является преобладание теплоприхода за счет энергии реакции над отводом тепла в окружающую среду. В этом случае в системе накапливается тепло, что приводит к саморазогреву и соответственно к саморазгону реакции.
Возникновение в горючей системе реакции окисления связано чаще всего с нагреванием системы тем или иным источником воспламенения. При нагревании горючей системы энергия молекул горючего и кислорода увеличивается и, когда она достигает некоторой величины, происходит их активизация, т.е. образуются активные центры (радикалы и атомы), имеющие свободные валентности, в результате чего молекулы горючего вещества легко вступают в соединение с кислородом воздуха. А.Н. Бах и К. Энглер в 1898 г. независимо друг от друга предложили перекисную теорию окисления, согласно которой при нагревании горючей системы происходит активизация кислорода путём разрыва одной связи между атомами, причём активная молекула вступает в соединение с горючим веществом, не распадаясь на атомы и образуя перекисные соединения типа: R 1 -O-O-R 2 или R-O-O-OH.
Однако, перекисная теория не в состоянии объяснить некоторые характерные особенности процесса окисления, например, резкое действие, иногда ничтожных следов посторонних примесей.
Скорость химической реакции , м/с может быть выражена, исходя из закона Аррениуса, следующим уравнением:
![]() , (1.12)
, (1.12)
где - константа скорости реакции (скорость химической реакции при концентрациях реагентов, приведенных к единице);
Концентрации реагентов, моль/м 3 ;
Стехиометрические коэффициенты, определяемые соотношением концентраций исходных реагентов в стехиометрическом уравнении реакции;
Основание натуральных логарифмов;
Универсальная газовая постоянная, = 8,3 Дж/(моль∙К);
– температура, К.
Тепловая теория самовоспламенения (называемая также теорией теплового взрыва) основана на сопоставлении скоростей процессов тепловыделения при экзотермическом окислении и теплоотвода от реагирующей смеси в стенке содержащего его сосуда. Условие самовоспламенения определяется равенством этих скоростей. Температура стенок сосуда, при которой достигается это равенство, называется температурой самовоспламенения. Начиная с этой температуры (характерной в каждом случае для данных конкретных условий - размера и формы сосуда, теплофизических свойств газа) происходит саморазогрев, который может привести к вспышке (самовоспламенению).
С учётом изложенного для саморазогрева в реагирующей среде можно записать:
где - теплоемкость при постоянном объёме, Дж/К;
Плотность газа, кг/м 3 ;
Температура газа, К;
Время, с;
Тепловой эффект реакции, Вт;
Скорость реакции, м/с;
Поверхность реакционного сосуда, м 2 ;
Объем реакционного сосуда, м 3 ;
Коэффициент теплоотдачи, Вт/(м 2 ×К);
Температура стенки сосуда, К.
Д.А.Франк-Каменецким был предложен критерий теплового самовоспламенения, основанный на нарушении стационарного распределения температур в реактивном сосуде при достаточной скорости тепловыделения:
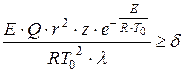 , (1.14)
, (1.14)
где - характерный размер сосуда, м;
Предэкспоненциальный множитель;
Коэффициент теплопроводности газовой смеси, Вт/(м×К);
Безразмерный критерий, равный 3,3; 0,88 и 2 соответственно для сферического, плоскопараллельного и цилиндрического сосудов.
Критерий Д.А.Франк-Каменецкого следует понимать так: если при подстановке всех параметров, определяющих , мы получим значение , то воспламенения не будет, при произойдет воспламенение. Из уравнения критерия следует, что теплота реакции и радиус сосуда , в котором происходит реакция, - важные определяющие факторы взрыва. Тепловой взрыв выражен тем ярче, чем лучше выполняются неравенства:
Если эти неравенства выполняются плохо, то тепловой взрыв вырождается – одновременно с ростом температуры происходит быстрое выгорание исходного вещества, которое смазывает картину взрыва.
Возникновение горения чаще всего связано с нагреванием горючей системы тем или иным источником воспламенения. Согласно теории академика Н.Н. Семёнова, процесс окисления сопровождается выделением тепла и при определенных условиях может самоускоряться. Этот процесс самоускорения реакции окисления с переходом её в горение называется самовоспламенением.
В случае теплового самовоспламенения оно возникает вследствие превышения скорости тепловыделения над скоростью теплоотвода.
Рассмотрим процесс теплового самовоспламенения на примере горючего газа или паров горючей жидкости с воздухом, помещенных в сосуд объёмом . При повышении температуры сосуда и горючей смеси скорость реакции и выделение тепла увеличится. Зависимость скорости выделения тепла от температуры , Дж/с определяются:
![]() , (1.15)
, (1.15)
где - теплота сгорания газа, Дж;
Объём горючей смеси, м 3 ;
Константа скорости реакции;
Концентрация реагирующего вещества, кг/м 3 ;
Порядок реакции;
Энергия активации, Дж/моль;
Универсальная газовая постоянная Дж/(моль·К);
Температура смеси, К.
Выделяющееся тепло передаётся горючей смеси, и она нагревается. Как только температура смеси превысит температуру стенок сосуда, начнётся отвод тепла через стенки сосуда в единицу времени, пропорционально разности температур смеси и стенок сосуда и определяются зависимостью:
![]() , (1.16)
, (1.16)
где - скорость отвода тепла через стенки сосуда, Дж/с;
Коэффициент теплопередачи, Дж/(К·м 2 ×с);
Поверхность стенок сосуда, м 2 ;
Температура смеси, К;
Температура стенок сосуда, К

Рисунок 1.5 – Зависимость тепловыделения от температуры при разных давлениях
На рисунке 1.5 кривые 2, 3 и 4 показывают зависимость тепловыделения от температуры при разных давлениях и одинаковом составе смеси. При постоянных температурах сосуда и среды и постоянном составе смеси количество отводимого из зоны горения тепла характеризуется прямой 1. При изменении состава смеси изменится и скорость теплопотерь и, следовательно, наклон прямой. Чем выше давление, тем больше выделяется тепла при реакции (кривая 4). В условиях, определяемых кривой 2, самовоспламенение возникнуть не может, так как теплопотери (прямая 1) выше тепловыделений при этом давлении. Точка касания кривой 3 с прямой соответствует равновесию между выделяемым и отводимым теплом при - минимальной температуре самовоспламенения данной горючей системы в заданных условиях. При незначительном подводе энергии извне возможно самовоспламенение. Кривая 4 характеризует условия, при которых неизбежно самовоспламенение, так как выделяется тепло больше, чем отводится.
Анализируя приведённую схему, Н.Н. Семёнов установил зависимость:
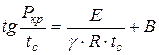 , (1.17)
, (1.17)
где - минимальное давление воспламенения, Па;
Минимальная температура самовоспламенения, К;
Порядок реакции;
Постоянная, зависящая от состава и других свойств смеси.
На основании этого уравнения (1.17) можно теоретически заранее определить, возможно ли самовоспламенение горючей смеси в данных конкретных условиях. Соотношение, связывающее минимальное давление с температурой самовоспламенения, было подтверждено многочисленными экспериментами и оказалось ценным при изучении процессов горения.
Цепная теория горения
Еще в 1928 г. Н.Н.Семенов выдвинул идею о возможности существования в химических системах двух типов взрывов – цепных и тепловых.
Цепными называются реакции, идущие через ряд стадий (через ряд промежуточных реакций), в которых образуются промежуточные соединения со свободными валентностями, так называемые активные центры, являющиеся зародышами последующих быстропротекающих стадий процесса.
Впервые представление о цепной реакции появилось в 1913 г., когда немецкий физико-химик М. Боденштейн установил, что при освещении смеси водорода с хлором молекула хлора, поглощая квант световой энергии , распадается на атомы:
![]() .
.
Атомы хлора мгновенно вступают в реакцию с водородом, в результате чего происходит взрыв смеси. Активация одной молекулы хлора должна была бы вызвать образование двух молекул :
![]() .
.
Однако, опыты показывают, что при этом образуется 100000 молекул хлористого водорода. Это можно объяснить, если предположить, что при взаимодействии хлора с водородом образуется продукт, который, вступая во вторичные реакции, вновь возрождается и может продолжать реакцию. Этому предположению соответствует такая схема реакции:
I Первичная реакция
IV Обрыв цепи
По этой схеме активация одной молекулы хлора (I) вызывает появление двух атомов хлора – двух активных центров цепной реакции. Каждый из атомов хлора дает начало своей цепной реакции, в которой активный центр непрерывно восстанавливается (II, III). Таким образом, под влиянием инициирующей реакции (I) возникают следующие друг за другом реакции, образующие цепь (II, III и т.д.). Число таких реакций от момента зарождения цепи до ее обрыва называют длиной цепи. Цепь может обрываться при столкновении атомов хлора (IV) или атомов водорода (V) и образования из них молекул, или при столкновении активных центров с поверхностью твердого вещества. Это типичная неразветвляющаяся цепная реакция. В ней каждый активный центр вызывает появление только одного нового активного центра, поэтому реакция может продолжаться, но не ускоряться.
В разветвляющейся цепной реакции каждый активный центр зарождает два и более новых активных центра.
Согласно теории цепных реакций, процесс окисления начинается с активизации горючего вещества.
Практика показала, что воспламенение может происходить в изотермических условиях, т.е. без повышения температуры реагирующей среды («холодное» воспламенение смеси). В этом случае говорят о цепном (изометрическом) взрыве.
Два исходных компонента: горючее и окислитель, находясь в относительно устойчивом молекулярном состоянии, прежде чем ассоциироваться в новые, более устойчивые молекулы продуктов горения, претерпевают целую цепь сложных промежуточных превращений, результатом которых является образование неустойчивых продуктов: атомов, радикалов, возбужденных молекул с относительно большой степенью ионизации (формальдегид, углеводородный и гидрокислый радикалы, атомарный кислород и водород).
Кондратьеву В.Н. удалось обнаружить в пламени различных углеводородов большие концентрации атомарного кислорода (О), гидрокислого радикала (ОН), углеводородных радикалов (СН 3), окиси углерода (СО), формальдегида (СН 2 О) и др. Концентрации этих веществ в пламени оказались в тысячи и миллионы раз большими их равновесных концентраций при термическом разложении при температуре пламени конечных продуктов реакции, например, Н 2 О → Н+ОН.
Результаты этих наблюдений позволили сделать вывод, что рассматриваемые атомы и радикалы появляются в реагирующем газе не вследствие конечного распада продуктов, а являются промежуточными продуктами реакции.
Таким образом, в основе цепного механизма воспламенения лежит целая цепь химических превращений одних веществ в другие, результатом которых является образование на отдельных промежуточных стадиях химически очень активных неустойчивых продуктов, получивших название активных центров, которые легко реагируют между с собой и с молекулами исходных веществ с образованием новых активных центров и конечных продуктов, например, для метановоздушной смеси Н 2 О и СО 2 .
Высокая реакционная способность радикалов и атомов объясняется малой энергией активизации их реакций, близкой к энергии активации атомных реакций:
ОН + Н 2 = Н 2 О + Н - 25 кДж/моль
СН 3 + С 3 Н 6 - 12,5 кДж/моль
СН 3 + С 6 Н 6 - 23,5 кДж/моль
Н 2 О → Н + ОН
Любая из полученных активных частиц (Н или ОН) будучи крайне неустойчивой и, следовательно, химически активной, сталкиваясь с молекулой исходного вещества, расщепляется, образуя новые активные частицы:
Н+О 2 = ОН+О
ОН+Н 2 = Н 2 О+Н
Полученные в результате реакции активные частицы Н и ОН снова вступят в реакции, а частицы О взаимодействуют с водородом:
О+Н 2 = ОН+Н.
Т.е., в результате реакции между активными частицами и молекулами исходных веществ образуются не только конечные продукты, но и новые активные частицы. Образующиеся в результате реакции активные частицы дают начало новым стадиям химического превращения, которые будут происходить до полного расхода исходных веществ.
Такие многократно повторяющиеся химические реакции называются цепными, а активные частицы, дающие начало новым цепям превращений, активными центрами.
Рассмотренный выше цепной процесс горения водорода можно представить в виде схемы (рисунок 1.6).
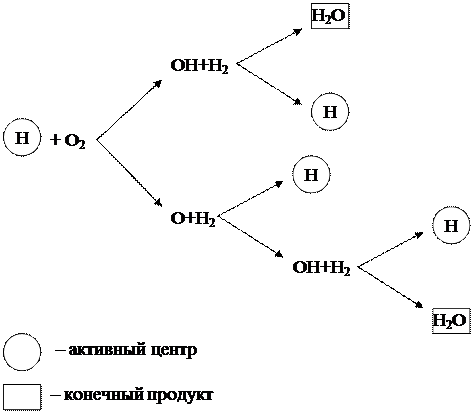
Рисунок 1.6 - Схема цепного горения водорода
Из схемы видно, что начало новым цепям превращений дают только частицы водорода (Н), которые являются активными центрами. При этом в каждом звене цепного процесса в результате реакции между активным центром Н и молекулой кислорода О 2 кроме конечного продукта Н 2 О образуются 3 новых активных центра Н, дающие начало новым цепям превращений.
Такая цепная реакция, протекающая с увеличением активных центров, называется разветвлённой. Реакция развивается лавинообразно и протекает с очень высокими скоростями, значительно превышающими скорость обычных молекулярных реакций.
Типичной реакцией с неразветвляющейся цепью является взаимодействие хлора с водородом. Активными центрами этой реакции служат чередующиеся атомы хлора и водорода. При реагировании атома хлора образуется один атом водорода так же, как при реагировании атома водорода образуется один атом хлора. Поэтому реакция может продолжаться, но не ускоряться.
Тот общеизвестный факт, что фотохимическая реакция хлора с водородом всё же оканчивается взрывом (самовоспламенением), объясняется тем, что при достаточно большой скорости цепной реакции тепловыделения превышают теплоотвод, в результате чего смесь сильно нагревается, и возникают условия, необходимые для теплового самовоспламенения.
При протекании разветвлённой цепной реакции, которая характерна для углеводородов, концентрация активных центров может возрастать независимо от условий начального инициирования и, если скорость образования активных центров при разветвлениях превосходит скорость обрыва цепи, то возникает самоускоряющийся процесс лавинообразного характера, приводящий к воспламенению.
Теория цепных реакций позволила объяснить многие особенности процессов горения (сильное влияние примесей, пределы самовоспламенения по давлению, катализ и ингибирование давления и др.), которые нельзя объяснить тепловой теорией. Механизм возникновения и развития реальных пожаров и взрывов характеризуется комбинированным цепочечно-тепловым процессом. Начавшись цепным путём, реакция окисления за счёт её экзотермичности продолжает ускоряться тепловым путём. Поэтому, в конечном счете, критические (предельные) условия возникновения и развития горения будут определяться тепловыделением и условиями теплообмена реагирующей системы с окружающей средой.
На цепных химических реакциях основаны многие технологические процессы в химической промышленности. К таким процессам относятся, например, процессы полимеризации, составляющие основу производства синтетических каучуков, пластмасс, полимерных волокон и многих других изделий. К ним также относятся такие важные промышленные процессы, как производство синтетических жирных кислот, заменяющих ранее применяемые пищевые жиры в производстве моющих смазочных средств, крекинг – процесс получения высококачественного топлива из нефти и т. д.
Энергия взрыва
Главные преимущества ВВ перед другими источниками энергии заключаются в компактности, транспортабельности и в том, что выделение энергии может протекать за короткие времена, позволяя развивать огромные мощности. Так, при взрыве сферического заряда массой 1 кг и плотностью 1,65 г/см3, который изготовлен из мощного ВВ – гексогена, возбуждаемого (инициируемого) в центре, скорость распространения взрывчатого превращения по веществу (детонация) составляет 8300 м/с. Путь r (радиус заряда), который пройдет детонация, определяется из равенства
где Gup – соответственно масса и плотность заряда.
Время реализации процесса – τ = r/D (D – скорость детонации).
Мощность N (кДж/e), развиваемую при взрыве, можно оценить, зная выделяющееся количество тепла q при взрывчатом превращении 1 кг гексогена:
Для гексогена q = 5420 кДж/кг. Рассчитанная мощность завышена, так как не было учтено время, в течение которого расширяющиеся газы совершают работу. Следует отметить, что она превышает мощность самых больших электростанций мира. Взрывчатые вещества, способные к столь быстрому превращению, называют бризантными.
Из бризантных взрывчатых веществ выделяют инициирующие ВВ, практически не имеющие самостоятельного применения и используемые лишь для приготовления средств взрывания. Средства взрывания (капсюли-детонаторы, взрывные патроны, взрыватели, детонирующие шнуры и т.д.) объединяют в специальную подгруппу. Бризантные ВВ, пороха и средства взрывания составляют группу взрывчатых материалов. Как при детонации, так и при сгорании при выстреле, на превращение ВВ в газы накладываются дополнительные условия: для порохов – устойчивое с расчетной скоростью горение при разных давлениях, для бризантных ВВ – чрезвычайно большая скорость распространения превращения по веществу.
Однако взрывчатые вещества способны не только к быстрым превращениям. Если поджечь небольшое количество ВВ обычными средствами и дать ему гореть в атмосферных условиях, не затрудняя отвод газов, то сгорание пройдет медленно и спокойно. На этом основан метод уничтожения негодных ВВ сжиганием, при квалифицированном выполнении достаточно безопасный и удобный. При неправильном сжигании могут возникнуть обстоятельства, при которых горение самопроизвольно перейдет в детонацию с более быстрым превращением ВВ в газы.
Что же такое взрыв? Взрывом называют физическое или химическое превращение вещества, при котором его энергия быстро переходит в энергию сжатия и движения самого вещества или продуктов его превращения и окружающей среды Энергия взрыва может быть различной. Выделение химической, электрической, ядерной, термоядерной, тепловой, кинетической энергий, энергии упругого сжатия способно сопровождаться взрывными процессами. Например, при электроискровом способе разрушения материалов используются микровзрывы, источником энергии которых служит электрический разряд, а носителем энергии – продукты испарения и разложения или просто нагрева среды, в которой разряд осуществляется. Взрыв, вызванный разрушением баллонов со сжатым газом, паровых котлов, сосудов высокого давления, также может протекать с большой скоростью и вызывать серьезные повреждения в окружающем пространстве.
Однако основное значение имеет использование потенциальной химической энергии, которая у многих веществ в определенных условиях (в результате химической реакции) может быстро переходить в энергию сжатых газов. Вещества, способные к таким превращениям, называются взрывчатыми, а взрыв – химическим. В дальнейшем под взрывом, без специальных оговорок, будем понимать только химический взрыв, а все рассматриваемые процессы относить к процессам, протекающим при химическом взрыве.
Взрыв можно характеризовать количеством выделяющейся энергии. Поскольку этот процесс иногда задается параметрами аппаратуры (например, у пневматических излу чателей – объемом камеры и давлением сжатого воздуха), нужно уметь определять его энергию. Для пневматического излучателя она равна PV/ (k – 1), где Р – давление сжатого газа; V – объем камеры; k – поправочный коэффициент (для воздуха k = 1,4), для электроискрового излучателя – UC 2/2, где С – емкость, U – напряжение. Энергию химических взрывчатых веществ чаще всего задают теплотой взрыва в килоджоулях на килограмм. Естественно, что сравнение источников предполагает перевод энергии из одних единиц в другие (калорий в джоули и др.).
В связи с рассмотрением взрыва коснемся процесса, в известной мере противоположного ему, – имплюзиона, который начинают применять в технике. При взрыве заряда ВВ уровень энергии позволяет газам благодаря расширению совершать работу над внешней средой. При имплюзионе вещество среды, окружающей источник, обладает более высоким давлением, чем в самом источнике, и при снятии разделяющей преграды получает возможность устремляться внутрь источника. Такой процесс может стать причиной волновых возмущений. Простейший пример имплюзиона – колба электрической лампочки (она вакуумирована), разбиваемая на воздухе. Чем выше давление среды, тем больше энергии может выделиться при схлопывании полости. В глубоких скважинах она становится значительной даже у малых полостей. Аналогичное явление наблюдается при подводном взрыве, когда происходит схлопывание перерасширившихся продуктов взрыва под действием гидростатического давления. В сейсмике это регистрируется как второй удар взрыва, производимого в водоеме, при достаточной глубине расположения заряда в нем.
Химический взрыв – самораспространяющееся химическое превращение вещества, протекающее с большой скоростью, выделением тепла и образованием газов, сжатых до высокого давления. Детонация – частный случай взрыва, осуществляемого с постоянной, максимальной для данного вещества скоростью.
Прежде всего нужно оценить энергию (количество тепла), выделяющуюся при взрыве. Реакции бывают двух типов – с выделением тепла (экзотермические) и с поглощением (эндотермические). Теплоты образования молекул – соединений из атомов (теплота образования последних равна нулю) – могут быть как отрицательные (на их образование из элементов нужно дополнительно тратить энергию), так и положительные. Выделение тепла у ВВ обычно вызывается реакцией между горючими составляющими и окислителем (кислородом), входящим в его состав. Если ВВ – индивидуальное химическое соединение, то ими будут разные группы в молекуле, если смесевое – то разные вещества, входящие в состав смеси. Их соотношение определяет кислородный баланс вещества. Когда кислорода недостаточно для полного окисления горючей составляющей ВВ – баланс отрицательный. У веществ с положительным кислородным балансом часть кислорода при взрыве остается неиспользованной и непроизводительно теряется. Свойства смесевых взрывчатых веществ можно менять путем подбора соответствующих окислителей и горючих.
Кислородный баланс определяется как недостаток или избыток (в граммах) кислорода, необходимого для окисления или остающийся при окислении 100 г взрывчатого вещества. Для тетранитрометапа C(ΝO2)4 он равен +49, аммиачной селитры ΝH4ΝΟ3 – +20, тротила С7Н5N3O6 – -74, гексогена (СH2N2)3 – -21,6. Максимальный отрицательный кислородный баланс, по определению, – у водорода (-794), максимальный положительный – у кислорода (+100).
Примером ВВ, имеющего отрицательный кислородный баланс, может служить тротил – распространенное бризантное взрывчатое вещество. Химическое название его – тринитротолуол, встречаются названия тол, ТНТ. Как видно из структурной формулы, горючие составляющие – атомы водорода и углерода и окислитель – кислород, входящий в состав нитрогруппы (NO2), в молекуле тротила еще не связаны между собой:
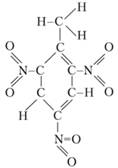
Исходя из формулы вещества, можно указать, по какому направлению пойдет в нем реакция, какие продукты могут образоваться при этом. Для тротила реакция взрывчатого разложения имеет следующий вид:
Состав продуктов зависит от условия взрыва и их конечного состояния (степени расширения). У многих взрывчатых систем первыми реализуются те реакции, которые характеризуются максимальным выделением энергии. Так, в веществе, имеющем формулу вида СаН4МcОd, при сравнительно небольшой нехватке кислорода [d < (2а + b/2 )] в первую очередь происходит реакция водорода с кислородом, как наиболее выгодная, поскольку при образовании Н2O на единицу кислорода выделяется 255 кДж, а при образовании СO2 – 187 кДж (теплота образования СО2 – 379 кДж/моль).
Подход к расчету теплоты превращения ВВ, при котором записываются те из возможных продуктов реакции, образование которых обеспечивает ее максимальный тепловой эффект, называют принципом максимальной работы. Расчет в известной мере идеализирует процесс и дает наибольшую точность для систем с положительным или со слабоотрицательным кислородным балансом. В действительности состав продуктов взрыва (ПВ) обычно не отвечает такому расчету. Последнее обусловлено тем, что в ПВ некоторое время после взрыва продолжается взаимодействие и устанавливается равновесие между продуктами реакций, идущих как с положительными, так и с отрицательными тепловыми эффектами. Примером последних служат реакции
Для приближенных расчетов систем с отрицательным кислородным балансом можно воспользоваться методом Ле Шателье, основанным на принципе максимального объема, причем если объемы одинаковы, то приоритет имеет реакция с большим выделением тепла. Метод наиболее справедлив для определения конечного состояния продуктов взрыва. Преобладающей реакцией считается окисление углерода до СО. Если кислород недорасходован, то он в равной степени расходуется на доокисление СО и Н2. Реакция разложения гексогена в этом случае записывается так:
Более точный расчет составов продуктов взрыва выполняется с учетом кинетики и условий протекания реакций. Точность этих вычислений не всегда достаточна из-за отсутствия достоверных сведений о состоянии вещества при высоких температурах и давлениях. Данные о теплоте и о составе продуктов взрыва получают и экспериментально, для чего разработаны и успешно применяются специальные методы исследования взрыва.
Как уже отмечалось, энергию взрыва характеризуют теплотой взрывчатого превращения ВВ. Зная теплоту образования исходных веществ и продуктов взрыва и пользуясь законом Гесса (тепловой эффект процесса зависит не от пути превращения, а от начального и конечного состояний веществ), можно рассчитать теплоту и ряд других параметров взрыва. Такие расчеты могут встретиться и в практике работы инженера-геофизика, поскольку смесевые ВВ и пороха применяются и будут применяться в увеличивающихся количествах.
Выполним расчет дешевой взрывчатой смеси типа игданитов из гранулированной аммиачной селитры с жидким горючим. Для простоты расчета вместо используемых нефтепродуктов – солярового масла или керосина, являющихся смесью веществ, – возьмем бензол (C6H6). Рассмотрим случай, когда взрывчатая смесь задается указанием компонентов и кислородного баланса. Пусть дано, что смесь из бензола и аммиачной селитры должна иметь кислородный баланс -10, иначе у нее для полного окисления 100 г смеси будет не хватать 10 г кислорода. Для начала определим, какой состав должна иметь смесь, чтобы удовлетворить заданию.
С целью упрощения решения представим, что наше ВВ как бы состоит из двух частей – одного из компонентов (в рассматриваемом случае – горючего, поскольку баланс отрицательный), взятого в количестве, обеспечивающем нужный баланс, и смеси заданных веществ нулевого кислородного баланса (последнюю иногда называют стехиометрической). Если к расчетному количеству горючего добавить такой смеси, доведя общий вес до 100 г, получим состав с заданным кислородным балансом.
Последовательно проведем вычисления.
На окисление молекулы бензола (его молекулярный вес – 78)
потребуется 15 атомов кислорода. Соответственно количество бензола x 1, на окисление которого нужно 10 г кислорода, получим из пропорции "бензол – требуется кислорода":
![]()
Добавив к этому количеству (100 – х 1) г смеси нулевого кислородного баланса, получим смесь заданного состава.
Перейдем к вычислению содержания компонентов в 96,75 г стехиометрической смеси. Определим избыток кислорода в окислителе. Селитра, разлагаясь, выделяет кислород:
причем 80 г окислителя (молекулярный вес аммиачной селитры 80) выделит 16 г кислорода. Реакция между бензолом и аммиачной селитрой в смеси нулевого кислородного баланса запишется в виде
Тогда получаем пропорцию: ![]()
Следовательно, в 96,75 г смеси будут входить 5,85 г бензола и 90,85 г аммиачной селитры. Таким образом, окончательный состав смеси с заданным кислородным балансом и состав продуктов взрыва, рассчитанный по принципу максимальной работы, будут:
Не прибегая к расчету, можно было сразу записать содержание в продуктах взрыва свободного углерода, поскольку именно его наличие и будет определять отрицательный кислородный баланс смеси. Поскольку для полного окисления 12 г углерода требуется 32 г кислорода, 10 г кислорода смогут окислить г углерода, или долей моля углерода. Эти соображения хорошо использовать для проверки правильности сделанных вычислений.
Приготовить подобную смесь весьма просто: нужное количество селитры надо смешать с бензолом. Имея исходные компоненты и зная состав продуктов взрыва, легко рассчитать теплоту взрыва системы. Теплоту образования исходных компонентов и продуктов взрыва находят в соответствующих справочниках. Так, для 1 моля бензола она составляет (в кДж/моль) -39,1, аммиачной селитры – +410,8, СO2 – +444,2, Н2O – +271,7.
Тепловой эффект взрыва Q x заряда в задаче можно определить из уравнения
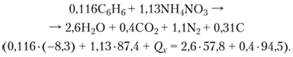 (4.29)
(4.29)
Он составит 374 кДж/100 г смеси, или 3740 кДж/кг.
Объем образующихся газообразных продуктов (в литрах) можно рассчитать по уравнению реакции путем перемножения числа молей газа на 22,4 (объем граммолекулы). Естественно, что при этом следует учитывать, в каком состоянии находится вещество. Так, углерод (температура возгонки выше 3700°С при нормальном атмосферном давлении) не даст газовой фазы, вода, естественно, будет паром. Объем продуктов взрыва, отнесенный к нормальным атмосферным условиям, называют приведенным объемом. В задаче, рассмотренной выше, он составит около 800 л/кг.
Если известны теплота и состав продуктов взрыва, то их температура Т вз может быть определена из соотношения Т вз = = Q/C vcр, где С v cp – средняя теплоемкость продуктов взрыва (при постоянном объеме) для интервала Τ 0–Τ вз. Существенно отметить, что теплоемкость является функцией температуры.
Последнее вносит некоторые (чисто технические) усложнения в расчет, поскольку вид зависимости известен. Однако проще воспользоваться готовыми данными по теплосодержанию газов при разных температурах (табл. 4.1).
Таблица 4.1
Изменение теплосодержания (внутренняя энергия) некоторых газов (кДж/моль)
|
Температура, К |
С (графит) |
||||||
Задавшись температурой и зная состав продуктов взрыва, можно найти их теплосодержание и сопоставить его с теплотой взрыва. Сравнение позволит определить характер ошибки, сделанной при выборе температуры. Повторяя операцию, но уже с иной (скорректированной) температурой, можно методом приближений найти температуру взрыва.
Следует заметить, что энергия, выделяющаяся при взрыве, сравнительно невелика: наиболее мощные ВВ имеют теплоту взрыва 6500-6700 кДж/кг. При взрыве 1 кг тротила на воздухе выделяется приблизительно 4000 кДж тепла, при сгорании 1 кг солярового масла – около 44 000 кДж. Но теплота сгорания 1 кг смеси солярового масла с кислородом составит уже только 10 000 кДж, а 1 кг смеси солярового масла и воздуха – 2670 кДж. Неоднократно подчеркивалось, что кроме выделения энергии взрыв характеризуется образованием продуктов, находящихся в газообразном состоянии при тех температурах, которые достигаются при взрыве.
Хотя теплота реакции термита
примерно в 2,3 раза выше теплоты взрывного разложения тротила, его горение протекает спокойно; образующиеся продукты, даже при тех температурах, до которых они разогреваются, остаются жидкими. Но стоит только подмочить термит, как картина меняется: тепло превращает воду в пар, и горение сопровождается взрывоподобными процессами. У взрывчатого вещества в объеме, занимаемом зарядом, при взрыве сразу образуются сжатые до огромного давления газы – продукты реакции, обеспечивая реализацию выделившейся энергии в форме работы, совершаемой расширяющимися газами.
Создавая взрывчатое вещество, мы, естественно, заинтересованы в том, чтобы при сто взрыве выделялось больше энергии и образовывались сжатые газы, способные реализовать энергию нужным образом. Иногда эти требования вступают в противоречие. Так, энергию взрывчатого разложения можно увеличить за счет подбора соответствующих горючих, в частности введения в состав ВВ металлов, например алюминия (теплота образования А12О3 – 1599 кДж/моль). Продукты окисления алюминия – твердые вещества. Добавка (до определенного предела) алюминия в состав некоторых взрывчатых смесей способна повышать работоспособность последних. Существуют взрывчатые вещества с повышенной теплотой взрыва, содержащие в своем составе металлы. Как уже отмечалось, состав продуктов взрыва зависит не только от взрывчатого вещества, но и от условий взрыва: способа инициирования, размеров и конструкции заряда и оболочки, условий среды, в которой проводится взрыв. Если исходные продукты остаются постоянными, а состав продуктов взрыва меняется, то будет меняться и тепловой эффект взрыва, поэтому для некоторых ВВ приводятся разные значения теплот взрыва в зависимости от условий, в которых он осуществляется. В качестве примера в табл. 4.2 приведен (по данным Р. Шмидта) состав продуктов взрыва тротила (плотность 1,52) при возбуждении взрыва заряда слабым и сильным инициаторами.
Чтобы превращение ВВ вследствие начавшейся быстрой химической реакции прошло по всему заряду, процесс должен быть самораспространяющимся. Для этого химическая реакция должна обладать соответствующими кинетическими характеристиками, а выделение энергии – компенсировать неизбежные потери. Скорость реакции, способность к самораспространению, экзотермичность, газообразование тесно взаимосвязаны и влияют друг на друга и на границы осуществления взрывного процесса.
Таблица 4.2
Состав продуктов взрыва тротила
В табл. 4.3 приведены характеристики ряда взрывчатых веществ и порохов, используемых промышленностью.
Таблица 4.3
Взрывные характеристики некоторых взрывчатых веществ
ВВ при взрыве выделяет энергию за счет того, что небольшой объем твердого или жидкого ВВ превращается в огромный объем газов, нагретых до температуры тысяч градусов. Для разных типов ВВ объем выделяющихся газов на 1 кг ВВ, имеющего начальный объем не более 0,8-1 л, составляет величину от 300 до 1000 л и более. Образовавшиеся при взрыве горячие газообразные продукты распада ВВ начинают расширяться, производя механическую работу. Таким образом, ВВ имеют запас скрытой химической энергии, освобождающийся при взрыве. Однако скрытой энергией обладают не только ВВ, а, например, бензин, уголь, дрова и другие горючие вещества. Эта энергия горючих веществ может выделяться при горении. Почему же для целей разрушения и метания применяются ВВ и пороха, а не, например, бензин? Известно, что в 1 кг бензина энергии содержится в 10 раз больше, чем в 1 кг тротила, и в 12 раз больше, чем в бездымном пироксилиновом порохе. Но заряд ВВ и заряд пороха с громадной скоростью превращаются в газы, а бензин или любое топливо не может гореть без достаточного количества воздуха или свободного кислорода. Для сгорания 1 кг бензина требуется столько кислорода, сколько его содержится в 15,5 кг воздуха. Поэтому теплоту горения (энергию) топлива нужно рассчитывать на 1 кг его смеси с необходимым для его полного сгорания кислородом. При таком расчете разница в энергии сгорания смеси бензина с кислородом и энергии взрыва заряда ВВ того же количества меньше, чем приведено выше, однако и в этом случае количество выделяющейся при сгорании бензина энергии больше: бездымный порох – 2860 кДж/кг, тротил – 4100 кДж/кг, смесь бензина с кислородом – 11 000 кДж/кг. Следовательно, не величина энергии, заключенная в ВВ и порохах, является основной причиной их применения для целей разрушения и метания. Основная причина заключается не в величине энергии, а в очень быстром ее выделении. Если сгорание 1 кг бензина в автомобильном двигателе происходит (в зависимости от мощности двигателя и его нагрузки) за 10– 60 мин, то 1 кг пороха сгорает в зарядной камере артиллерийского орудия за несколько тысячных долей секунды, а взрыв 1 кг тротила длится всего лишь 30-40 стотысячных долей секунды. Энергия при взрыве выделяется в десятки миллионов раз быстрее, чем при сгорании топлив. Этим и объясняется колоссальная мощность взрыва. Однако мощность взрыва правильнее вычислять не по времени детонации всего заряда, а но времени превышения продуктами взрыва уровня нормального атмосферного давления, достижение такого уровня по результатам скоростных съемок взрывного процесса возникает в течение нескольких миллисекунд. В этом случае мощность 1 кг тротила выражается величиной более 1 МВт. Но и эта мощность в реальных условиях не может быть реализована полностью из-за кратковременности ее действия, инерции масс перемещаемого или разрушаемого материала, на которые она действует, а также потерь на нагрев окружающей среды, на излишнее измельчение и разбрасывание ее, на остаточное тепло в продуктах взрыва после их окончательного расширения и на неизбежные химические потери. В итоге полезная механическая работа часто не превышает 1-2%, а при взрывах в твердой среде – 8-9% энергии, содержащейся в ВВ. Однако огромное количество потенциальной энергии, содержащейся в ВВ и порохах, делает их незаменимыми, несмотря на неполное се использование при взрыве. Большая мощность характерна для ВВ и в случае применения их для целей метания снарядов. Мощность порохового заряда артиллерийского выстрела крупного калибра составляет 10 МВт.
1. Основные понятия теории горения.
1. Особенности процессов горения.
Горение – сложный физико-химический процесс, при котором химическое превра-
щение сопровождается выделением энергии (главным образом в виде тепла и излучения)
и тепло- и массообменном с окружающей средой.
В основе процесса горения лежит химическая реакция, способная протекать с са-
моускорением. Причинами самоускорения могут быть:
1. Накопление тепла в системе – тепловое самоускорение
2. Накопление активных частиц – цепное самоускорение
3. Автокатализ – ускорение реакции еѐ продуктами.
Во многих случаях практически важные процессы горения подчиняются чисто фи-
зическим закономерностям, вследствие того, что при высоких температурах химическое превращение может протекать с большими скоростями и химический процесс оказывается подчинѐн чисто физическим закономерностям, таким как перенос тепла и диффузия и ими регулируется. Это означает, что химическая реакция, могущая протекать с высокой скоро-
стью, имеет ограниченную скорость и подчиняется закономерностям того или иного фи-
зического явления.
Основная особенность процессов горения состоит в том, что условия самоускоре-
ния химической реакции созданы ею самою. В кибернетике это явление носит название положительной обратной связи, то есть при малом изменении внешних условий возможен переход от стационарного режима протекания реакции с малой скоростью к режиму, к о-
гда скорость реакции возрастает в геометрической прогрессии. Подобные явления резкого изменения режима протекания реакции при малом изменении внешних условий называ-
ются критическими явлениями , а условия, при которых они наблюдаются, называются
критическими условиями.
К критическим явлениям относят:
1. Самовоспламенение
2. Зажигание
3. Концентрационные пределы распространения пламени.
Критические явления происходят не от того, что резко меняются законы природы, а
являются следствием нарушения равновесия между реагирующей системой и окружаю-
щей средой.
Условие самовоспламенения – невозможность теплового или диффузионного рав-
новесия с окружающей средой, условие зажигания – нарушение равновесия при заданных начальных условиях.
Второй особенностью процессов горения является их способность к распростране-
нию в пространстве. При тепловом режиме горения распространение происходит путѐм передачи тепла, при цепном или автокаталитическом – путѐм диффузии активных частиц.
2. Виды и режимы горения.
1. По агрегатному состоянию участников:
a. Горение газовых систем – гомогенное горение
b. Горение твѐрдых и жидких горючих (системы твѐрдое тело – жидкость и твѐрдое тело – газ) – гетерогенное горение
c. Горение конденсированных систем (системы твѐрдое тело – жидкость,
жидкость – жидкость, твѐрдое тело – жидкость).
2. По скорости распространения процесса:
a. Дефлаграционное горение – медленное распространение процесса (при помощи теплопроводности или диффузии)
b. Детонационное горение – быстрое распространение процесса (при по-
мощи ударной волны).
3. По аэродинамическим условиям:
a. Ламинарное горение – гладкий фронт пламени.
b. Турбулентное горение – сильно искривлѐнный фронт пламени.
Примеры различных видов горения по агрегатному состоянию участников:
Гомогенное горение:
Горение органических веществ в кислороде
CH4 (г.)+ 2O2 (г.) = CO2 (г.) + 2H2 O (пар)
Горение в присутствии других газообразных окислителей
H2 (г.) + Cl2 (г.) = 2HCl (г.)
Разложение нестойких веществ (озона)
2O3 (г.) = 3O2 (г.)
Гетерогенное горение:
Горение жидкого гидразина:
N2 H4 (ж.) + O2 (г.) = N2 (г.) + 2H2 O(пар)
Горение углерода:
C(тв.) + O2 (г.) = CO2 (г.)
Разложение нестойких веществ (ацетилена)
C2 H2 (г.) = 2C (тв.) + H2 (г.)
Горение конденсированных систем:
KClO3 (тв.) + Al(тв.) = KCl(тв.) + Al2 O3 (тв.) 2NH4 NO3 (тв.) =2N2 (г.) + 4H2 O(пар) + O2 (г.)
3. Термодинамика процессов горения. Тепловой баланс.
Температура горения: Принято характеризовать процессы горения четырьмя тем-
пературами горения
Теоретическая | T Теор | Определяется по теплоте сгорания стехиометрической (т.е. |
||
отвечающей уравнению реакции) смеси с учѐтом еѐ нагрева и диссоциации |
||||
продуктов горения без учѐта теплообмена с окружающей средой. |
||||
Калориметрическая T калор - определяется по теплоте сгорания стехиометриче- |
||||
ской смеси с начальной температурой T 0 273K без учѐта теплообмена с окру-
жающей средой.
3. Адиабатическая T г ад - определяется по теплоте сгорания смеси произвольного состава без учѐта теплообмена с окружающей средой.
4. Действительная T г действ - реально наблюдающаяся (измеренная) температура го-
Соотношение между различными определениями температуры горения
Тепловой баланс процессов горения основан на определении тепла, поглощѐнного
продуктами горения. Уравнение теплового баланса имеет вид:
Q пгQ рQ исхQ пот, |
где Q пг -теплота, поглощенная продуктами горения,Q р - теплота химической реакции,
Q исх - теплота, поступившая из внешних источников,Q пот - тепловые потери.

горения. Практически диссоциация продуктов горения вносит заметный вклад лишь при температуре выше 20000 С.
Различают высшую и низшую теплоту сгорания. В первом случае вода, как продукт горения, берѐтся в жидком виде, во втором – в парообразном. Поскольку количество вы-
делившейся теплоты зависит от количества сгоревшего вещества, различают мольную те-
плоту сгорания и удельную теплоту сгорания. Т.е. теплоту, выделившеюся при сгорании 1
моля или килограмма горючего вещества.
Для расчѐта удельной теплоты сгорания (в кДж/кг) часто используют формулу Д.И.
Менделеева
Q р 339, 4С 1257H 108,9O N S 25 9H W , |
где X - содержание элемента в составе горючего в %(масс.),W – влажность.
Общий подход к вычислению теплот реакций основан на химической термодина-
вершѐнную системой. Тогда из первого начала термодинамики (закона сохранения энер-
гии) следует | |||
где Q – теплота, полученная системой,U - изменение внутренней энергии,W – работа, |
|||
совершѐнная системой. Для бесконечно малых изменений имеем | |||
dU - полный дифференциал внутренней энергии (не зависит от пути протекания |
|||
процесса) Q ,W - бесконечно малые количества теплоты и работы, которые, | |||
случае, зависят от пути перехода системы из одного состояния в другое. | |||
Пусть система совершает только механическую работу расширения. | |||
pdV . | |||
Подставляя (1.6) в (1.5) получим | |||
При изохорном процессе V=const dV=0 и интегрируя (1.7) получим | |||
в изобарном процессе p=const интегрирование (1.7) и простые преобразования дают
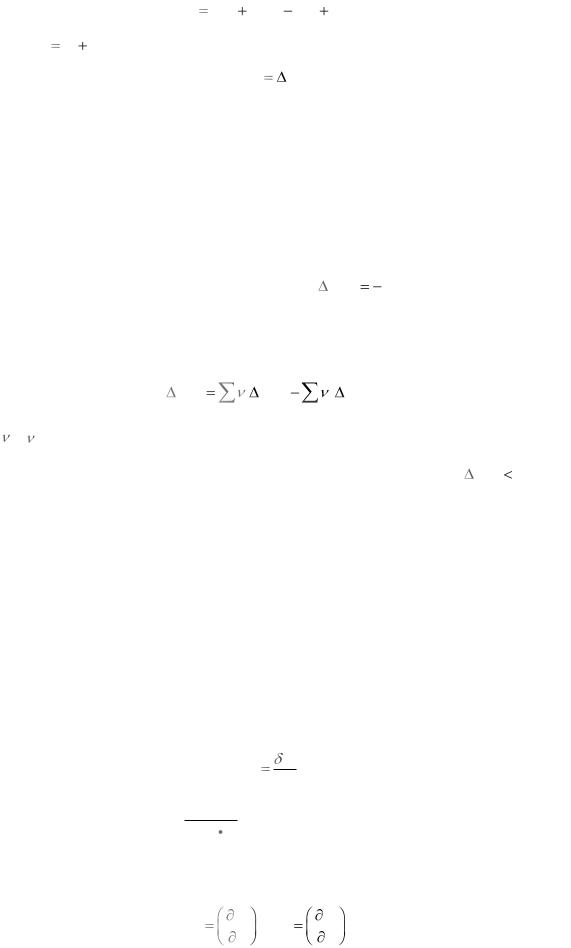
Из (1.8) и (1.10) следует, что в изохорном и изобарном процессах теплота приобретает свойства функции состояния, т.е. не зависит от пути протекания процесса. Это положение получило название закона Г.И. Гесса . Начальным и конечным состоянием химической ре-
акции являются исходные вещества и продукты реакции. Энтальпии простых веществ, ус-
тойчивых при стандартных условиях (298К и 0,10113 МПа) приняты равными нулю. Для сложных веществ рассматривают изменение энтальпии при их образовании из элементов.
Ca(тв.) + С(тв.) + 1,5O2 = CaCO3 | |||||||||||||||
Правило вычисления теплот реакции по энтальпиям образовния веществ следует из |
|||||||||||||||
закона Гесса. | |||||||||||||||
стехиометрические коэффициенты продуктов реакции и исходных веществ |
|||||||||||||||
соответственно. При этом в соответствии с соглашением о знаках если | 0 то реак- |
||||||||||||||
ция экзотермическая (выделяет тепло).
4. Теплоёмкость. Зависимость теплового эффекта реакции от температу-
Теплоѐмкостью – называют количество теплоты, необходимое для нагрева едини-
цы массы вещества на 1 К. Различают удельную имолярную теплоѐмкости, т.е. количество теплоты, необходимое для нагрева 1 кг. Или 1 моля вещества на 1 К.
Истинная молярная теплоѐмкость определяется следующим образом
С (1.12)dT
где С – молярная теплоѐмкость,моль К .
Для теплоѐмкостей при постоянном объѐме и давлении (изохорной и изобарной) с
учѐтом (1.8) и (1.10) получаем
;C p | ||||||

Рассмотрим зависимость теплоты процесса от температуры при постоянном объѐме или давлении. Учитывая уравнения (1.13) получим
Уравнения (1.14) называют уравнениями Кирхгоффа.
Изменение теплоѐмкости в ходе реакции определяется выражением
i Cp , i (прод) | jC p, j(исх ) , | ||
т.е. разностью между суммой теплоѐмкостей продуктов реакции и исходных веществ.
Из уравнения (1.14) следует, что если изменение теплоѐмкости в ходе реакции от-
рицательно (т.е. теплоѐмкость продуктов меньше теплоѐмкости исходных веществ) то и тепловой эффект реакции становится более отрицательным, реакция становится более эк-
зотермичной.
Для вычисления теплового эффекта процесса при T 2 (p=const) уравнение Кирхгоф- |
|||||
фа надо проинтегрировать. | |||||
Cp dT, | |||||
Нужно иметь ввиду, что в интервале температур Т 1 - Т 2 | не должно быть фазовых перехо- |
||||
дов веществ. | |||||
Обычно Т 1 выбирают 298К, тогда | r H 0 - тепловой эффект реакции в стан- |
||||
дартных условиях, вычисляемый по (1.11).
Теплоѐмкость реальных веществ сложным образом зависит от температуры, поэто-
му для интегрирования уравнения Кирхгоффа используют следующие приближения: | ||||
Нулевое – теплоѐмкость продуктов равна теплоѐмкости исходных веществ, |
||||
т.е. C p 0 и тепловой эффект реакции не зависит от температуры. | ||||
Первого порядка - C p | a const , тогда | |||
a T2 T1 | ||||
Горение - быстро протекающее химическое взаимодействие горючих веществ с окислителем, сопровождающееся выделением большого количества тепла и ярким свечением (пламенем). Горение возможно лишь при наличии трех факторов: горючего вещества, окислителя, источника тепла.
Источником тепла (возгорания) может быть открытое пламя, искра, тепло, нагретое в результате трения (ремни в ременной передаче), удара, давления. Источником тепла может быть также электрическая (нагрев проводников, дуга), химическая и лучистая энергия солнца.
Окислителями являются хлор, фтор, бром. Наиболее распространенный окислитель - кислород воздуха, от его содержания в воздухе будет зависеть процесс горения. Если в воздухе кислорода более 14-16%, то наблюдается устойчивое горение. При содержании кислорода менее 14% наблюдается тление, а при содержании его менее 8-10% прекращается и тление.
Горючее вещество . Ими могут быть газы (аммиак, ацетилен, водород), жидкости (бензин, ацетон, спирт), твердые вещества (уголь, дерево). Для того чтобы произошло возгорание твердого вещества или жидкости, необходимо с помощью источника тепла нагреть их до такой температуры, чтобы из их поверхностей происходило интенсивное выделение горючих паров. При достижении определённой концентрации эти пары загораются. Газы в процессе горения не меняют своего агрегатного состояния.
Различают следующие виды горения: 1) вспышка; 2) воспламенение; 3)самовоспламенение; 4) самовозгорание; 5) тление; 6) взрыв.
1. Вспышкой называется мгновенное сгорание смеси кислорода воздуха с парами, газами, пылью, не сопровождающееся образованием сжатых газов. Температура вспышки – самая низкая температура горючего вещества, при которой над его поверхностью образуются пары или газы, способные вспыхивать от источника зажигания, но для последующего устойчивого горения скорость их образования недостаточна.
В зависимости от величины этой температуры пожароопасные жидкости делятся на:
а) легковоспламеняющиеся (ЛВЖ – бензин, ацетон, спирт) – t всп ≤ + 45° С;
б) горючие жидкости (ГЖ - масла, дизельное топливо, мазут) - t всп >+45° С.
2. Воспламенением называется устойчивое продолжительное горение вещества от источника тепла. Минимальная температура горючего вещества, при которой оно загорается от источника воспламенения и продолжает гореть после его удаления называется температурой воспламенения. Она выше, чем температура вспышки.
Концентрации горючих веществ в воздухе, при которой возможно воспламенение или взрыв, находятся в определённых пределах: нижнем - НВП и верхнем – ВПВ. Воспламенение горючих смесей невозможно при концентрациях ниже НВП (недостаточно молекул горючего вещества в смеси) и выше ВПВ (недостаточно молекул кислорода в смеси). Чем больше разница между ВПВ и НВП, тем опаснее вещество. Значения этих параметров могут снижаться, например, при повышении влажности пылевоздушной смеси (ПЛВС), например, смеси воздуха с пылью сахарной, мучной, угольной.
Приведем примеры значений НВП и ВПВ для рада газов и паров жидкостей:
Ацетилен 3,5-82 %;
Природный газ 3,8-19,2%;
Бензин 1-6%;
Окись углерода 12,8-75%.
3.Самовоспламенение – процесс воспламенения веществ от внешнего источника (пламя, нагретое или раскаленное тело) без непосредственного соприкосновения с ним при температуре воспламенения. Эта температура будет уменьшаться с ростом давления и для большинства горючих газов находится в пределах 400-700°С, для дерева- 340-400 ° С; угля- 400-500° С. Пример самовоспламенения: нагрев и последующие возгорание древесины, бумаги, находящихся вблизи открытого пламени (без контакта с ним) или раскаленных предметов (угли, открытая спираль нагревателя).
4. Самовозгорание веществ происходит в результате протекающих в самом веществе (материале) физических, химических и биологических реакций, приводящих к горению при отсутствии источника зажигания.
При хранении в больших количествах влажного зерна, сена, соломы и недостаточной их вентиляции внутри этих материалов происходят биохимические процессы (гниение) с выделением тепла. Температура этих материалов возрастает, большая их масса (скирда, стог) препятствуют рассеиванию образующегося тепла в окружающую среду, что и вызывает возгорание. Такие материалы перед хранением следует хорошо просушивать. Контакт тканей (спецодежда, обтирочный материал), содержащие пятна масла и сложенные в кучу без вентиляции также самовозгораются. Поэтому спецодежду следует развешивать так, чтобы обеспечить свободный доступ воздуха, а промасленную ветошь своевременно удалять из рабочих помещений.
В зависимости от скорости реакции процесс горения протекает в виде тления (скорость несколько см/с), собственно горение (несколько м/с) и взрыв (несколько сотен и тысяч м/c).
5. Взрыв - внезапное изменение физического и химического состояния вещества под влиянием высокой температуры, давления, химических реагентов. При взрыве резко увеличивается объем образующихся газов и паров, выделяется огромное количество энергии, которая в виде ударной волны способна выполнять механическую работу (разрушать здания, сооружения, травмировать людей).
Сгорание материалов может быть полным или неполным. При полном сгорании (избыток кислорода) образуются негорючие продукты (СО 2 и Н 2 О) При неполном сгорании (недостаток О 2) образуются продукты неполного окисления (СО, спирты, кислоты). Они токсичны и взрывоопасны. Поэтому при организации процесса сжигания топлива (в котлах, печах) следует обеспечить достаточное количество кислорода в топке.
Продолжаем рассказывать об классических основах химии, которые необходимы любому практикующему пиротехнику. БА-БАХ напоминает, что любая практическое занятие пиротехникой - опасная затея, если оно не основывается на строгой теории. Мы рекомендуем тем читателям, которые считают, что может стать их жизненным призванием, пройти полноценный курс обучения, например, в НИИ Прикладной Химии в г.Сергиев Посад.
Упоминая о соединениях, мы указали, что основной причиной их служит степень родства элементов между собой. Иначе - элементы остаются безразличными в присутствии одних веществ и подвержены более или менее сильному влечению соединиться с другими. Так, например, известь охотно поглощает тяжелый хлорный газ, т.е. соединяется с ним в хлориновую известь; ртуть соединяется с расплавленной серой в известное ярко-красное вещество, называемое «киноварью». Киноварь (Zinnober) можно снова разложить на серу и ртуть, если соединить ее с веществом, к которому один из составляющих элементов (например, сера) имел бы более сильное влечение, чем к товарищу (т.е. к ртути), - после чего и второй с чем-либо связанный элемент можно таким же порядком освободить посредством четвертого вещества. Такое выделение или освобождение не всегда является полным, но чаще всего достаточно частичного высвобождения, теоретически рассчитать которое возможно посредством формул.
Одним из весьма обычных последствий сродственности, повторяющихся на каждом шагу, является свойство, называемое «гигроскопичностью», т.е. способность овлажняться, сыреть, иначе - втягивать в себя влагу и образовать кисло-водородные соединения. Таким свойством отличается множество веществ, и, между прочим, поваренная соль и серная кислота, которые помещаются между оконными рамами для втягивания сырости в себя; негашёная известь, вскипающая от соприкосновения с водой; желатин, с помощью которого обезвоживают спирт, и т.д. Для пиротехника гигроскопичность - скверное свойство, с которым необходимо считаться. Так, например, хлористый и азотнокислый стронциан из-за крайней гигроскопичности не всегда возможно употреблять, хотя вещества эти обладают драгоценными пиротехническими качествами; да и вообще все составы приходится тщательно оберегать от влияния сырости. Но главнейшую роль играет в пиротехнической химии тот вид соединений, который называется «горением» (Verbrennung, combustion).
Под выражением «горение» или «сжигание» в наиболее обширном смысле химия подразумевает вообще каждое химическое соединение двух тел для образования третьего; в наиболее же тесном смысле имеется в виду соединение какого-либо тела с кислородом.
Для пояснения обратимся, по обычаю, к опытам. Смешайте определенное количество железных опилок с определённым же количеством серы и слегка подогрейте смесь; тогда смесь эта сразу накалится и быстро расплавится. Полученный таким образом сплав уже не сера и не железо: железо сгорело с серой, т.е. химически соединилось с ним, и в результате образовалось новое тело - железный или серный (в зависимости от преобладания того или другого ингредиента) колчедан.
Растопите в тигеле серу, доведите сплав до кипения и бросьте в него куски медной проволоки: проволока эта сгорит с серой, выделяя чудный красный цвет; в результате получится особое соединение - сернистая медь, или медный блеск. Таким же образом можно сжечь с медью, т.е. соединить с ней множество тел: свинец, олово, цинк и т.д.
Сернистый углерод - бесцветная, сильно вонючая жидкость, не замерзающая даже при 48°R (Температура плавления сероуглерода (CS 2) = -112°С) - образуется от соединения серных паров с горячими угольями. Оба основные тела сгорят, т.е., соединившись, превратятся в жидкость.
Такое же сходство является и между металлами (железом, медью, цинком, антимонием, мышьяком и т.д.), находящимися в состоянии каления с уже раньше упомянутым газом, называемым «хлор»: железо, медь, цинк и т.д. сгорают с хлором в хлористое железо, хлористую медь, хлористый цинк, хлористый свинец и т.д., развивая при этом сильное тепло и выделяя особый свет. Расплавленная сера в соприкосновении с хлорным газом сгорает синим пламенем и превращается в хлористую серу; истолчённая сурьма или мелкий мышьяк, помещённые в наполненный хлором сосуд, загораются сами и соединяются в хлористый мышьяк или хлористую сурьму.
В обоих случаях состоялось - благодаря сходству - соединение различных тел то с серой, то с хлором, причём появлялось выделение тепла и света.
При точно таких же условиях образуются соединения различных тел с иным газом - кислородом.
Соедините реторту (стеклянный сосуд для дистиллирования), в которой помещена ртуть, с внутренностью стеклянного колпака, герметично изолированного от внешнего воздуха. Нагрейте ртуть почти до точки кипения: ртуть не станет гореть, но потеряет и металлический блеск, и прежний серебристый цвет, и капельно-жидкое состояние - она превратится в красноватый порошок, относящийся к прежнему металлу так же, как уголь к дереву. Если вы до начала опыта точно взвесили как ртуть, так и воздух, содержавшийся под колпаком, и теперь снова взвесите как то, так и другое, то окажется, что в воздухе появился недочёт веса, а в порошке - перевес, и как раз настолько же. Если, например, воздух под колпаком весил ровно 1000 грамм, то теперь он весит всего 767 грамм; зато порошок весит более ртути на 233 грамма. Теперь сделайте обратный опыт: поместите порошок в маленькую реторту, соединенную со стеклянным баллоном, до половины наполненным водой. Подогрейте реторту на сильном спиртовом огне: порошок превратится в пар, который, проходя сквозь воду, разделится на две части: на металлический осадок, состоящий из чистой капельно-жидкой ртути и из кислорода, собирающегося в баллоне.
Такое же сродство, как к горячей ртути, кислород проявляет и в отношении горячего железа или расплавленной меди: во время соприкосновения с воздухом эти металлы жадно пропитываются на поверхности кислородом, содержащимся в воздухе, и образуют медную или железную окалину (шлак), т.е. железную или медную «окись» (соединение с кислородом), выделяя при этом яркие цветные искры.
Во всех этих случаях произошло одно и то же явление: соединение с кислородом, или окисление (oxydation) данных тел - не только под влиянием теплоты, но и с выделением тепла и света, так что тепло и свет, т.е. то, что обыкновенно принято называть «горением», являются побочным явлением, прямым последствием или, вернее, силовым проявлением, которое древние считали особой стихией, принцип которой они называли «флогистон».
Но окисление может происходить не только без посредства огня, а даже без заметного выделения тепла: если железо подвергнуть действию воздуха, то оно покроется ржавчиной. Эта ржавчина - не что иное, как продукт окисления, а именно - железная окись или сгоревшее железо.
Процесс сгорания остался без ощутимого выделения тепла только потому, что само окисление происходило очень медленно. Несколько ощутимее происходит окисление дерева: гнилушки светятся в темноте; если сунуть руку в груду перегнили, то ощущается тепло; самая груда день ото дня уменьшается; иначе говоря, дерево медленно сгорает (тлеет) на воздухе.
Ещё заметнее приток свежего воздуха во время тления: если на горячие угли или на медленно тлеющие дрова пустить струю воздуха (например, раздувальным мехом), то тотчас же покажется пламя. Процесс такой: древесина содержит два горючих тела - углерод и водород; первый соединяется с кислородом и, сгорая, превращается в углекислород, или углекислоту, а второй - в кисловодород, или воду.
Любой горючий материал, в обыденной жизни называемый топливом или осветительным материалом, горит на основании тех же правил. Например, сало и масло состоят преимущественно из углерода и водорода; как тот, так и другой обладают значительным родством с кислородом, и весь процесс горения, т.е. окисления, заключается в том, что кислород разлагает горючее вещество на его составные части и соединяется с каждым из них отдельно.
Точь-в-точь такое же окисление происходит и в животном организме: азотистые (жировые) части организма окисляются, или сгорают, от соприкосновения с кислородом, проводником которого служит кровь, а последствием является животная теплота.
Но так же, как окисление может происходить очень медленно, оно может быть и крайне быстрым и энергичным. Красный фосфор, например, лёжа на открытом воздухе, не только тлеет и светится, но, будучи насыпан в большом количестве, медленно тает и, наконец, возгорается (самовоспламенение). Мельчайший порошок химически чистого железа распаляется при одном соприкосновении с внешним воздухом. Наконец, металл натрий, как только попадет в воду, тотчас же разлагает ее на составные части, чтобы вобрать в себя содержащийся в воде кислород, и притом так энергично, что выделяемое тепло в состоянии воспламенить другой газ, водород, освобожденный соединением натрия с кислородом. Так что водород загорается бесцветным пламенем и, вновь соединяясь с атмосферным кислородом, опять превращается в воду. Поэтому натрий содержится под минеральным маслом, т.к. масло это представляет углеводородное соединение, не содержащее кислорода.
Из всего вышесказанного можно вывести несколько веских заключений:
- То, что мы в обыденной жизни называем горением, т.е. появление пламени, света и тепла, требует наличия двух тел: горючего материала и кислорода.
- Сам процесс горения заключается, во-первых, в разложении горючего материала с выделением тех частей, которые вступают в соединение с кислородом, а во-вторых, в самом процессе этого соединения, т.е. в окислении. Продуктом окисления горючих веществ при достаточном нагревании является, главным образом, превращение данных веществ в угольную кислоту и воду.
- Т.к. в природе кислород никогда не встречается в обособленном виде, то при соединении горючий материал извлекает его из атмосферы, из воды или из какого-либо иного сложного тела, в состав которого входит кислород; ввиду этого тела, выделяющие кислород, называются окислителями, тела окисляемые - основами, а вещества, вызывающие или усиливающие выделение кислорода, - разлагателями. В состав пиротехнических препаратов и фейерверочных смесей обыкновенно входят представители каждой из этих трёх групп, но бывают и исключения: в известных случаях достаточно основы и окислителя (например, алюминий с марганцевокислым калием); в других, впрочем очень редких случаях, - одной только основы, если она достаточно кислородиста (например, магний, ликоподий и др.).
- Без участия окислителя основа не горит, но если присоединить к ней вещество, способное соединиться с основой и разложить ее, тогда смесь становится горючей. Такими основами, которые сами по себе не горючи, являются: цинк, натрий, свинец, барий, калий, стронций, хлорновато- и азотнокислые соли и т.д. Горючими примесями, способствующими разложению основы, служат: сера, уголь, сажа, сахар, крахмал, декстрин, шеллак, гуммилак, сало и т.п. Примером может служить селитра (азотнокислый калий): сама по себе селитра не горит, но если смешать ее с серой, то получается горючая смесь, т.к. сера разлагает селитру и отнимает у неё кислород, с которым соединяется в сернистую кислоту. То же самое наблюдается при соединении серы с бертолетовой солью (Kali cliloricum) или с марганцевокислым калием (Kali hypemanganiucum). Если же состав образуется из угля, сажи или целлюлозы в качестве основы с примесью серы и селитры, то селитра служит окислителем, а сера - разлагателем. Процесс следующий: уголь разлагает селитру, соединяясь с кислородом её азотной кислоты, причём кислород и уголь соединяются в газообразную угольную кислоту, а азот выделяется. Сера же способствует разложению, а главное, препятствует соединению угольной кислоты с калием: так же соединение образовало бы твёрдое тело - поташ. Без наличия серы половина угольной кислоты перешла бы в твёрдое соединение.
- Без наличия кислорода горение немыслимо, поэтому натрий, сохраняемый под керосином, не горит; фосфор, зажжённый под герметично закрытым колпаком, гаснет по истощении наличного запаса кислорода (около 1/5 всего кубического содержания воздуха под колпаком); животные, помещаемые в «Собачьем гроте», наполненном углеродом, задыхаются и. т.д.
Но хотя в обыденной жизни главным резервуаром кислорода служит атмосферный воздух, химия указывает на целый ряд других окислителей, при посредстве которых можно достичь горения как под водой, так и в пространстве - либо вовсе безвоздушном, либо наделённом газами, в которых не имеется ни атома кислорода. Такими окислителями, способными выделить достаточное количество кислорода для полного сжигания состава без участия атмосферного воздуха, являются селитра, бертолетова соль и несколько других уже упомянутых тел. Благодаря, например, селитре, порох приобретает способность сгорать в дуле ружья или пушки без участия атмосферного воздуха; горение же под водой мыслимо при том условии, чтобы в примеси находился окислитель, достаточно сильный не только для полного сжигания состава, но и для поддержки температуры на требуемой высоте во время процесса горения под водой.
На основании вышесказанного заметим, что превращение горючих веществ (например, топлива) в газ при достаточно высоких температурах может состояться при четырёх условиях: а) нагревание без доступа воздуха, а, следовательно, и кислорода (каменный уголь, кокс, светильный газ); б) нагревание в присутствии химически связанного кислорода (Н 2 О, СО 2): водяной газ; в) с ограниченным притоком свободного кислорода (воздуха): генераторный газ; г) с достаточным доступом воздуха (обыкновенная топка) или с усиленным притоком кислорода (тяга). - Чем энергичнее происходит процесс окисления и чем ближе химическое сродство основы с окислителем и разлагателем, тем сильнее и быстрее проявление света и тепла. Выше было отмечено ещё одно обстоятельство: в иных случаях происходит произвольное окисление (тление, ржавчина, самовозгорание), в других же требуется поднять температуру (нагреть предмет) до известной нормы, чтобы вызвать соединение (окисление горячих металлов, соединение их с хлором и серой, горение свечи, дров, лампы, керосина, воспламенение пороха и т.д.).
Кроме того: дальнейший ход процесса может совершаться то быстро, то медленно.
Поэтому следует различать два различных свойства восприимчивости горючего материала к огню (т.е. к внешнему проявлению окисления): воспламеняемость и горючесть. Первая обозначает температуру, при которой происходит загорание (начало окисления), а вторая - быстроту совершения самого процесса окисления. Для пиротехника необходимо точно знать как то, так и другое, потому что от знания этого всецело зависит химическая смета составов, как в смысле их воспламенения, так и относительно силы света и длительности горения.
Относительно химических явлений, вызываемых теплотой, Рудольф Вагнер замечает следующее: «Наука о тепловых явлениях при химических соединениях и разложениях, «термохимия», ещё далеко не в состоянии объяснить различного разложения и способа приготовления в химических производствах, но она уже теперь даёт указания относительно большей или меньшей вероятности и выполнимости химических реак ций, т.к. вообще легче всего получаются соединения, образующиеся с выделением тепла, между тем как реакция, происходящая с поглощением тепла, в большинстве случаев гораздо труднее».
Единицей тепла считается его количество, необходимое для согревания единицы веса воды от 0 до 1 градуса по Цельсию. По десятичной системе единицей веса служит грамм (см 3); химическая единица тепла называемая «калорией», обозначается символом «cal», а 1000 калорий - символом «Cal». Символом «K» (кг) выражается количество тепла, выделяемое 1 г воды при охлаждении от точки кипения её до точки замерзания. Механический эквивалент теплоты равняется 425 кг/м.
Эффекты и продукты горения
Полного сгорания не существует: те части горючего состава, которые не превратились в газы, образуют либо дым, либо осадок. Дым - не что иное, как несгоревший материал, превращённый в мельчайшую пыль и увлечённый потоком воздуха. Таким телом является, между прочим, сажа (остаток несгоревшего дерева), копоть (остаток несгоревшего жирного тела), каменноугольный трубный дым (висящий над фабричными городами тысячами пудов и ныне эксплуатируемый целыми обществами) и т.п. Осадок чаще всего образует не только несгоревшее, но и несгораемое (огнеупорное) химическое соединение.
Следовательно, ближайшая задача пиротехника заключается в комплектовании таких составов, которые сгорали бы с возможно меньшим выделением дыма и осадка.

Горение вызывает появление огня в виде пламени или искр; пламя газов само по себе вовсе не светит (как, например, горящий водород при погружении натрия в воду); свет же и окраска его получаются благодаря присутствию в огне более плотных тел. Так, например, жёлтый свет светильного газа происходит оттого, что газ этот состоит из водорода и углерода; водород обладает большей окислительной способностью, чем углерод, и сгорает быстрее и совершеннее, а углерод, накопляясь в избытке в огне, придаёт пламени свет и жёлтую краску. Поэтому, чтобы узнать, дымит ли какое-либо пламя, достаточно сунуть в середину, где менее всего открыт доступ воздуху, какое-либо постороннее тело: оно тотчас же покроется налётом сажи.
Что именно твёрдые тела дают пламени свет, доказывает следующее: из всех существующих тел водород выделяет наибольшую теплоту при горении, т.к. плавит и платину, и горный хрусталь; но пламя его крайне бледно, пока элементами окисления служат только газы - водород и водяной пар, но как только появится примесь какого-либо плотного вещества (например, железа, угля, мрамора), то получается ослепительный свет (Друммондов свет).
Сила света находится в прямой зависимости от энергичности окисления: чем последняя сильнее, тем выше температура горения, а следовательно, тем сильнее и горение твёрдых примесей. Так, например, спиртовой огонь, светильный газ с примесью подогретого воздуха, наконец, бензиновая горелка «Уника» дают очень бледное пламя, но способны дать значительную силу света при посредстве известных примесей: электрические лампочки дают жёлтый, более слабый свет, а электрические фонари - белый, ослепительного блеска, потому что в первом случае электрическое напряжение несравненно менее энергично, чем во втором.
Особый интерес возбуждают Ауэровы горелки, ныне применяемые не только к светильному газу, но и к бензину, спирту, ацетилену и другим светильным источникам: горелки эти, состоящие из смеси огнеупорных тел, превращают слабый свет сильного теплового источника в яркий, зеленовато- или синевато-белый свет.
Для усиления яркости света и увеличения пламени в пиротехнических составах служат антимоний, уголь и другие вещества.
Окраска пламени происходит не от самих примесей, а исключительно от газов, образующихся вследствие горения этих примесей; газы поступают в огонь и сообщают пламени белую, жёлтую, красную, зелёную, синюю, фиолетовую окраску всевозможных оттенков. Такими примесями служат соли натрия, меди, свинца, бария, стронция, антимония и т.д. Так, например, сера в смеси с селитрой при горении даёт неопределённый цвет, а при наличии антимония - белый; если к смеси из бертолетовой соли и серы прибавить азотнокислого бария, то получится зелёный цвет и т.д.
Окрашивающие примеси состоят по большей части из металлических соединений, но сама краска зависит не от одного только металла, а и от соединенных с ним неметаллических веществ. Нагляднее всего доказывается это следующим опытом с медью. Медь, как уже сказано, горит в серных газах красным пламенем и превращается в сернистую медь. Если медь с небольшой примесью серы сжечь в кислороде, то образуется фиолетовое пламя. Если же вместо серы прибавить к меди твёрдый углевод (шеллак, сахар и т.д.), то пламя получит зелёную окраску.
Раскалите языком пламени спиртовой паяльной трубки щепотку яри- медянки (Grunspan) или серной соли: под влиянием спиртовых газов образуется ярко-зелёное пламя. Прибавьте к тому же веществу немного каломеля или нашатыря: получится ярко-синее пламя, потому что медь соединяется с освобождающимся хлором и, сгорая, образует хлористую медь (Chlorkupfer). Хлористая медь под влиянием спиртового огня сгорает зелёным пламенем, потому что водород спиртового огня отнимает у меди хлор и делает его в отношении окраски пламени недействительным (CuCl 2 +2H-2HCl+Cu). Если же окись меди (Kupferoxyd, CuO) сжечь в спиртовом огне, то сердцевина и низ у пламени будут иметь белую окраску, а края и конец язычка - синюю. Объясняется это тем, что водород пламени сначала восстанавливает окись меди (CuO+2Н=Cu+H 2 O), после чего красящая способность меди проявляется снова во внешней оболочке пламени под влиянием окисляющей способности оболочки и содержащейся в ней очень высокой температуры.
Для усиления «густоты» окраски употребляются каломель, нашатырь, мастика, шеллак и т.п.
Быстрота горения состава зависит главным образом:
- от химического родства между элементами основы и разлагателей, т.к. от степени этого родства зависит степень разлагаемости, а следовательно, и горючести основы;
- от составных пропорций, т.к. для каждой смеси существует крайний предел, при достижении которого получается быстрейшее и полнейшее разложение основы, тогда как вне этого предела, т.е. до него или за ним, получается худший результат, - такой предел называется «нормой»;
- от высоты температуры, развиваемой горением;
- от плотности и однородности состава;
- от химического влияния примеси, т.е. придаточных элементов;
- от атмосферной влаги и гигроскопичности состава;
- от внешней температуры;
- наконец, от целого ряда мелких и крупных, главных или второстепенных причин, имеющих каждая свою долю влияния на общий процесс горения препарата.
Определение нормы горения образует одну из главнейших задач пиротехнического искусства, т.к. с ним связан вопрос о произвольном усилении или замедлении пламени, поэтому в подлежащих местах на норму обращено особое внимание.






