Тепловая теория горения. Основы теории горения. Виды горения, их характеристика
Горение - быстро протекающее химическое взаимодействие горючих веществ с окислителем, сопровождающееся выделением большого количества тепла и ярким свечением (пламенем). Горение возможно лишь при наличии трех факторов: горючего вещества, окислителя, источника тепла.
Источником тепла (возгорания) может быть открытое пламя, искра, тепло, нагретое в результате трения (ремни в ременной передаче), удара, давления. Источником тепла может быть также электрическая (нагрев проводников, дуга), химическая и лучистая энергия солнца.
Окислителями являются хлор, фтор, бром. Наиболее распространенный окислитель - кислород воздуха, от его содержания в воздухе будет зависеть процесс горения. Если в воздухе кислорода более 14-16%, то наблюдается устойчивое горение. При содержании кислорода менее 14% наблюдается тление, а при содержании его менее 8-10% прекращается и тление.
Горючее вещество . Ими могут быть газы (аммиак, ацетилен, водород), жидкости (бензин, ацетон, спирт), твердые вещества (уголь, дерево). Для того чтобы произошло возгорание твердого вещества или жидкости, необходимо с помощью источника тепла нагреть их до такой температуры, чтобы из их поверхностей происходило интенсивное выделение горючих паров. При достижении определённой концентрации эти пары загораются. Газы в процессе горения не меняют своего агрегатного состояния.
Различают следующие виды горения: 1) вспышка; 2) воспламенение; 3)самовоспламенение; 4) самовозгорание; 5) тление; 6) взрыв.
1. Вспышкой называется мгновенное сгорание смеси кислорода воздуха с парами, газами, пылью, не сопровождающееся образованием сжатых газов. Температура вспышки – самая низкая температура горючего вещества, при которой над его поверхностью образуются пары или газы, способные вспыхивать от источника зажигания, но для последующего устойчивого горения скорость их образования недостаточна.
В зависимости от величины этой температуры пожароопасные жидкости делятся на:
а) легковоспламеняющиеся (ЛВЖ – бензин, ацетон, спирт) – t всп ≤ + 45° С;
б) горючие жидкости (ГЖ - масла, дизельное топливо, мазут) - t всп >+45° С.
2. Воспламенением называется устойчивое продолжительное горение вещества от источника тепла. Минимальная температура горючего вещества, при которой оно загорается от источника воспламенения и продолжает гореть после его удаления называется температурой воспламенения. Она выше, чем температура вспышки.
Концентрации горючих веществ в воздухе, при которой возможно воспламенение или взрыв, находятся в определённых пределах: нижнем - НВП и верхнем – ВПВ. Воспламенение горючих смесей невозможно при концентрациях ниже НВП (недостаточно молекул горючего вещества в смеси) и выше ВПВ (недостаточно молекул кислорода в смеси). Чем больше разница между ВПВ и НВП, тем опаснее вещество. Значения этих параметров могут снижаться, например, при повышении влажности пылевоздушной смеси (ПЛВС), например, смеси воздуха с пылью сахарной, мучной, угольной.
Приведем примеры значений НВП и ВПВ для рада газов и паров жидкостей:
Ацетилен 3,5-82 %;
Природный газ 3,8-19,2%;
Бензин 1-6%;
Окись углерода 12,8-75%.
3.Самовоспламенение – процесс воспламенения веществ от внешнего источника (пламя, нагретое или раскаленное тело) без непосредственного соприкосновения с ним при температуре воспламенения. Эта температура будет уменьшаться с ростом давления и для большинства горючих газов находится в пределах 400-700°С, для дерева- 340-400 ° С; угля- 400-500° С. Пример самовоспламенения: нагрев и последующие возгорание древесины, бумаги, находящихся вблизи открытого пламени (без контакта с ним) или раскаленных предметов (угли, открытая спираль нагревателя).
4. Самовозгорание веществ происходит в результате протекающих в самом веществе (материале) физических, химических и биологических реакций, приводящих к горению при отсутствии источника зажигания.
При хранении в больших количествах влажного зерна, сена, соломы и недостаточной их вентиляции внутри этих материалов происходят биохимические процессы (гниение) с выделением тепла. Температура этих материалов возрастает, большая их масса (скирда, стог) препятствуют рассеиванию образующегося тепла в окружающую среду, что и вызывает возгорание. Такие материалы перед хранением следует хорошо просушивать. Контакт тканей (спецодежда, обтирочный материал), содержащие пятна масла и сложенные в кучу без вентиляции также самовозгораются. Поэтому спецодежду следует развешивать так, чтобы обеспечить свободный доступ воздуха, а промасленную ветошь своевременно удалять из рабочих помещений.
В зависимости от скорости реакции процесс горения протекает в виде тления (скорость несколько см/с), собственно горение (несколько м/с) и взрыв (несколько сотен и тысяч м/c).
5. Взрыв - внезапное изменение физического и химического состояния вещества под влиянием высокой температуры, давления, химических реагентов. При взрыве резко увеличивается объем образующихся газов и паров, выделяется огромное количество энергии, которая в виде ударной волны способна выполнять механическую работу (разрушать здания, сооружения, травмировать людей).
Сгорание материалов может быть полным или неполным. При полном сгорании (избыток кислорода) образуются негорючие продукты (СО 2 и Н 2 О) При неполном сгорании (недостаток О 2) образуются продукты неполного окисления (СО, спирты, кислоты). Они токсичны и взрывоопасны. Поэтому при организации процесса сжигания топлива (в котлах, печах) следует обеспечить достаточное количество кислорода в топке.
Молекулярная энергетика горения
Большинство процессов горения представляет собой соединение горючих, содержащих водород и углерод, с кислородом воздуха.
Прежде чем перейти к рассмотрению физических и математических основ теории горения, постараемся понять на молекулярном уровне, откуда происходит энергия горения, от выделения которой зависит все остальное: нагрев газа, появление в нем активных химических центров и т.д.
Посмотрим, из чего складываются теплоты основных реакций соединения углерода и водорода с кислородом воздуха.
Запишем в соответствии с данными табл. 3.1 энергетический баланс реакций последовательного окисления твердого углерода, например графита:
Таким образом, в суммарной реакции окисления твердого углерода выделяется 386 кДж/моль:
Близка по величине и энергия, выделяющаяся при соединении водорода с кислородом:
Молекула СО является едва ли не самой прочной, ее энергия связи равна 1016 кДж/моль. (Следующей по прочности является молекула N2 с энергией связи 892 кДж/моль. В обеих молекулах имеются три пары связывающих электронов, на химическом языке – три валентные связи. В молекуле СО сначала один электрон переходит от О к С, после чего O+ и С- становятся похожими на атомы азота; это подтверждается наличием у молекулы СО дипольного момента.) В молекуле СO2 связь второго атома кислорода слабее: согласно табл. 3.1
Энергии связи кислорода в этих соединениях сравнимы с энергией связи исходной молекулы кислорода. Так как
то на один атом кислорода приходится всего 240 кДж/моль. В малой энергии связи молекулы кислорода причина его химической активности и причина применения окисления в качестве источника энергии.
Энергия связи атома углерода в кристаллической решетке графита (а также алмаза и аморфного углерода) очень велика. Сравнительно небольшая энергия реакции С(тв) + 0,5О2 = = СО + 98 кДж/моль есть разность двух очень больших величин: из энергии связи СО (256 кДж/моль) нужно вычесть половину энергии разрыва O2 на атомы (59 кДж/моль) и вычесть теплоту испарения атома углерода. Собственно, так и определяется теплота испарения, равная 671 кДж/моль. Это также очень большая величина.
Превращение твердого углерода и газообразного водорода в углеводородные топлива происходит с малым изменением энергии. С другой стороны, при введении кислорода в органические молекулы тина спиртов, альдегидов и кетонов, органических кислот, углеводов выделяется почти столько же энергии, сколько выделяется при полном сгорании (до СO2 и Н2O), естественно, при потреблении равного количества кислорода. Поэтому приближенно можно считать, что при полном сгорании любого органического топлива выделяется 419-500 кДж/моль израсходованного кислорода. Исключение составляют только некоторые эндотермические, богатые энергией соединения, такие, например, как ацетилен и дициан, их теплота горения больше.
Неполное сгорание энергетически невыгодно не только в расчете на молекулу горючего, но и на молекулу затраченного кислорода. В реакции 2Q(тв) + O2 = 2СО выделяется только 210 кДж/моль вместо 466 при сжигании водорода и 526 при сжигании СО.
Сильная связь атома С в твердом углероде приводит к тому, что углерод не испаряется. Углерод покидает твердое состояние только вместе с кислородом в форме СО или СO2.
При неполном сгорании и низкой температуре реакция 2СО = СO2+ С(тв)) + 41 кДж/моль энергетически выгодна лишь при расчете на твердый углерод. При расчете на свободный атом углерода соответствующая реакция 2СО = СO2 + С – 129 кДж/моль имеет большой энергетический барьер. Поэтому сажа и копоть при горении образуются лишь от разложения органических молекул, имеющих углеродный скелет, но не из СО.
Теперь обратимся к реакциям окисления с участием азота.
Молекула азота N2 является очень прочной – ее энергия диссоциации равна 226 кДж/моль. Поэтому реакция превращения N2 и O2 в 2NO является эндотермической и уже по термодинамическим соображениям может идти только при высокой температуре.
Образование высших оксидов (NO2, N2O3, N2O4, N2O5) из азота и кислорода идет практически без изменения энергии (по сравнению с энергией связи N2 и O2). Поэтому с энергетической точки зрения кислород, упакованный в соединения с азотом (CH3-ONO2 – нитроэфир, CH3(CeH2)(NO2)3 – тринитротолуол), практически равноценен газообразному кислороду. Встроенный в органическую молекулу, но связанный с азотом кислород позволяет создать вещества, выделяющие большую энергию при перегруппировке молекулы с образованием N2 и переходом кислорода в молекулы СO2 и Н2O. По этой причине соединения, в которых кислород связан с азотом (а также с хлором, в группах СЮ3, СlO4), используются в качестве порохов и взрывчатых веществ.
Таковы общие представления о молекулярной энергетике горения.
Продолжаем рассказывать об классических основах химии, которые необходимы любому практикующему пиротехнику. БА-БАХ напоминает, что любая практическое занятие пиротехникой - опасная затея, если оно не основывается на строгой теории. Мы рекомендуем тем читателям, которые считают, что может стать их жизненным призванием, пройти полноценный курс обучения, например, в НИИ Прикладной Химии в г.Сергиев Посад.
Упоминая о соединениях, мы указали, что основной причиной их служит степень родства элементов между собой. Иначе - элементы остаются безразличными в присутствии одних веществ и подвержены более или менее сильному влечению соединиться с другими. Так, например, известь охотно поглощает тяжелый хлорный газ, т.е. соединяется с ним в хлориновую известь; ртуть соединяется с расплавленной серой в известное ярко-красное вещество, называемое «киноварью». Киноварь (Zinnober) можно снова разложить на серу и ртуть, если соединить ее с веществом, к которому один из составляющих элементов (например, сера) имел бы более сильное влечение, чем к товарищу (т.е. к ртути), - после чего и второй с чем-либо связанный элемент можно таким же порядком освободить посредством четвертого вещества. Такое выделение или освобождение не всегда является полным, но чаще всего достаточно частичного высвобождения, теоретически рассчитать которое возможно посредством формул.
Одним из весьма обычных последствий сродственности, повторяющихся на каждом шагу, является свойство, называемое «гигроскопичностью», т.е. способность овлажняться, сыреть, иначе - втягивать в себя влагу и образовать кисло-водородные соединения. Таким свойством отличается множество веществ, и, между прочим, поваренная соль и серная кислота, которые помещаются между оконными рамами для втягивания сырости в себя; негашёная известь, вскипающая от соприкосновения с водой; желатин, с помощью которого обезвоживают спирт, и т.д. Для пиротехника гигроскопичность - скверное свойство, с которым необходимо считаться. Так, например, хлористый и азотнокислый стронциан из-за крайней гигроскопичности не всегда возможно употреблять, хотя вещества эти обладают драгоценными пиротехническими качествами; да и вообще все составы приходится тщательно оберегать от влияния сырости. Но главнейшую роль играет в пиротехнической химии тот вид соединений, который называется «горением» (Verbrennung, combustion).
Под выражением «горение» или «сжигание» в наиболее обширном смысле химия подразумевает вообще каждое химическое соединение двух тел для образования третьего; в наиболее же тесном смысле имеется в виду соединение какого-либо тела с кислородом.
Для пояснения обратимся, по обычаю, к опытам. Смешайте определенное количество железных опилок с определённым же количеством серы и слегка подогрейте смесь; тогда смесь эта сразу накалится и быстро расплавится. Полученный таким образом сплав уже не сера и не железо: железо сгорело с серой, т.е. химически соединилось с ним, и в результате образовалось новое тело - железный или серный (в зависимости от преобладания того или другого ингредиента) колчедан.
Растопите в тигеле серу, доведите сплав до кипения и бросьте в него куски медной проволоки: проволока эта сгорит с серой, выделяя чудный красный цвет; в результате получится особое соединение - сернистая медь, или медный блеск. Таким же образом можно сжечь с медью, т.е. соединить с ней множество тел: свинец, олово, цинк и т.д.
Сернистый углерод - бесцветная, сильно вонючая жидкость, не замерзающая даже при 48°R (Температура плавления сероуглерода (CS 2) = -112°С) - образуется от соединения серных паров с горячими угольями. Оба основные тела сгорят, т.е., соединившись, превратятся в жидкость.
Такое же сходство является и между металлами (железом, медью, цинком, антимонием, мышьяком и т.д.), находящимися в состоянии каления с уже раньше упомянутым газом, называемым «хлор»: железо, медь, цинк и т.д. сгорают с хлором в хлористое железо, хлористую медь, хлористый цинк, хлористый свинец и т.д., развивая при этом сильное тепло и выделяя особый свет. Расплавленная сера в соприкосновении с хлорным газом сгорает синим пламенем и превращается в хлористую серу; истолчённая сурьма или мелкий мышьяк, помещённые в наполненный хлором сосуд, загораются сами и соединяются в хлористый мышьяк или хлористую сурьму.
В обоих случаях состоялось - благодаря сходству - соединение различных тел то с серой, то с хлором, причём появлялось выделение тепла и света.
При точно таких же условиях образуются соединения различных тел с иным газом - кислородом.
Соедините реторту (стеклянный сосуд для дистиллирования), в которой помещена ртуть, с внутренностью стеклянного колпака, герметично изолированного от внешнего воздуха. Нагрейте ртуть почти до точки кипения: ртуть не станет гореть, но потеряет и металлический блеск, и прежний серебристый цвет, и капельно-жидкое состояние - она превратится в красноватый порошок, относящийся к прежнему металлу так же, как уголь к дереву. Если вы до начала опыта точно взвесили как ртуть, так и воздух, содержавшийся под колпаком, и теперь снова взвесите как то, так и другое, то окажется, что в воздухе появился недочёт веса, а в порошке - перевес, и как раз настолько же. Если, например, воздух под колпаком весил ровно 1000 грамм, то теперь он весит всего 767 грамм; зато порошок весит более ртути на 233 грамма. Теперь сделайте обратный опыт: поместите порошок в маленькую реторту, соединенную со стеклянным баллоном, до половины наполненным водой. Подогрейте реторту на сильном спиртовом огне: порошок превратится в пар, который, проходя сквозь воду, разделится на две части: на металлический осадок, состоящий из чистой капельно-жидкой ртути и из кислорода, собирающегося в баллоне.
Такое же сродство, как к горячей ртути, кислород проявляет и в отношении горячего железа или расплавленной меди: во время соприкосновения с воздухом эти металлы жадно пропитываются на поверхности кислородом, содержащимся в воздухе, и образуют медную или железную окалину (шлак), т.е. железную или медную «окись» (соединение с кислородом), выделяя при этом яркие цветные искры.
Во всех этих случаях произошло одно и то же явление: соединение с кислородом, или окисление (oxydation) данных тел - не только под влиянием теплоты, но и с выделением тепла и света, так что тепло и свет, т.е. то, что обыкновенно принято называть «горением», являются побочным явлением, прямым последствием или, вернее, силовым проявлением, которое древние считали особой стихией, принцип которой они называли «флогистон».
Но окисление может происходить не только без посредства огня, а даже без заметного выделения тепла: если железо подвергнуть действию воздуха, то оно покроется ржавчиной. Эта ржавчина - не что иное, как продукт окисления, а именно - железная окись или сгоревшее железо.
Процесс сгорания остался без ощутимого выделения тепла только потому, что само окисление происходило очень медленно. Несколько ощутимее происходит окисление дерева: гнилушки светятся в темноте; если сунуть руку в груду перегнили, то ощущается тепло; самая груда день ото дня уменьшается; иначе говоря, дерево медленно сгорает (тлеет) на воздухе.
Ещё заметнее приток свежего воздуха во время тления: если на горячие угли или на медленно тлеющие дрова пустить струю воздуха (например, раздувальным мехом), то тотчас же покажется пламя. Процесс такой: древесина содержит два горючих тела - углерод и водород; первый соединяется с кислородом и, сгорая, превращается в углекислород, или углекислоту, а второй - в кисловодород, или воду.
Любой горючий материал, в обыденной жизни называемый топливом или осветительным материалом, горит на основании тех же правил. Например, сало и масло состоят преимущественно из углерода и водорода; как тот, так и другой обладают значительным родством с кислородом, и весь процесс горения, т.е. окисления, заключается в том, что кислород разлагает горючее вещество на его составные части и соединяется с каждым из них отдельно.
Точь-в-точь такое же окисление происходит и в животном организме: азотистые (жировые) части организма окисляются, или сгорают, от соприкосновения с кислородом, проводником которого служит кровь, а последствием является животная теплота.
Но так же, как окисление может происходить очень медленно, оно может быть и крайне быстрым и энергичным. Красный фосфор, например, лёжа на открытом воздухе, не только тлеет и светится, но, будучи насыпан в большом количестве, медленно тает и, наконец, возгорается (самовоспламенение). Мельчайший порошок химически чистого железа распаляется при одном соприкосновении с внешним воздухом. Наконец, металл натрий, как только попадет в воду, тотчас же разлагает ее на составные части, чтобы вобрать в себя содержащийся в воде кислород, и притом так энергично, что выделяемое тепло в состоянии воспламенить другой газ, водород, освобожденный соединением натрия с кислородом. Так что водород загорается бесцветным пламенем и, вновь соединяясь с атмосферным кислородом, опять превращается в воду. Поэтому натрий содержится под минеральным маслом, т.к. масло это представляет углеводородное соединение, не содержащее кислорода.
Из всего вышесказанного можно вывести несколько веских заключений:
- То, что мы в обыденной жизни называем горением, т.е. появление пламени, света и тепла, требует наличия двух тел: горючего материала и кислорода.
- Сам процесс горения заключается, во-первых, в разложении горючего материала с выделением тех частей, которые вступают в соединение с кислородом, а во-вторых, в самом процессе этого соединения, т.е. в окислении. Продуктом окисления горючих веществ при достаточном нагревании является, главным образом, превращение данных веществ в угольную кислоту и воду.
- Т.к. в природе кислород никогда не встречается в обособленном виде, то при соединении горючий материал извлекает его из атмосферы, из воды или из какого-либо иного сложного тела, в состав которого входит кислород; ввиду этого тела, выделяющие кислород, называются окислителями, тела окисляемые - основами, а вещества, вызывающие или усиливающие выделение кислорода, - разлагателями. В состав пиротехнических препаратов и фейерверочных смесей обыкновенно входят представители каждой из этих трёх групп, но бывают и исключения: в известных случаях достаточно основы и окислителя (например, алюминий с марганцевокислым калием); в других, впрочем очень редких случаях, - одной только основы, если она достаточно кислородиста (например, магний, ликоподий и др.).
- Без участия окислителя основа не горит, но если присоединить к ней вещество, способное соединиться с основой и разложить ее, тогда смесь становится горючей. Такими основами, которые сами по себе не горючи, являются: цинк, натрий, свинец, барий, калий, стронций, хлорновато- и азотнокислые соли и т.д. Горючими примесями, способствующими разложению основы, служат: сера, уголь, сажа, сахар, крахмал, декстрин, шеллак, гуммилак, сало и т.п. Примером может служить селитра (азотнокислый калий): сама по себе селитра не горит, но если смешать ее с серой, то получается горючая смесь, т.к. сера разлагает селитру и отнимает у неё кислород, с которым соединяется в сернистую кислоту. То же самое наблюдается при соединении серы с бертолетовой солью (Kali cliloricum) или с марганцевокислым калием (Kali hypemanganiucum). Если же состав образуется из угля, сажи или целлюлозы в качестве основы с примесью серы и селитры, то селитра служит окислителем, а сера - разлагателем. Процесс следующий: уголь разлагает селитру, соединяясь с кислородом её азотной кислоты, причём кислород и уголь соединяются в газообразную угольную кислоту, а азот выделяется. Сера же способствует разложению, а главное, препятствует соединению угольной кислоты с калием: так же соединение образовало бы твёрдое тело - поташ. Без наличия серы половина угольной кислоты перешла бы в твёрдое соединение.
- Без наличия кислорода горение немыслимо, поэтому натрий, сохраняемый под керосином, не горит; фосфор, зажжённый под герметично закрытым колпаком, гаснет по истощении наличного запаса кислорода (около 1/5 всего кубического содержания воздуха под колпаком); животные, помещаемые в «Собачьем гроте», наполненном углеродом, задыхаются и. т.д.
Но хотя в обыденной жизни главным резервуаром кислорода служит атмосферный воздух, химия указывает на целый ряд других окислителей, при посредстве которых можно достичь горения как под водой, так и в пространстве - либо вовсе безвоздушном, либо наделённом газами, в которых не имеется ни атома кислорода. Такими окислителями, способными выделить достаточное количество кислорода для полного сжигания состава без участия атмосферного воздуха, являются селитра, бертолетова соль и несколько других уже упомянутых тел. Благодаря, например, селитре, порох приобретает способность сгорать в дуле ружья или пушки без участия атмосферного воздуха; горение же под водой мыслимо при том условии, чтобы в примеси находился окислитель, достаточно сильный не только для полного сжигания состава, но и для поддержки температуры на требуемой высоте во время процесса горения под водой.
На основании вышесказанного заметим, что превращение горючих веществ (например, топлива) в газ при достаточно высоких температурах может состояться при четырёх условиях: а) нагревание без доступа воздуха, а, следовательно, и кислорода (каменный уголь, кокс, светильный газ); б) нагревание в присутствии химически связанного кислорода (Н 2 О, СО 2): водяной газ; в) с ограниченным притоком свободного кислорода (воздуха): генераторный газ; г) с достаточным доступом воздуха (обыкновенная топка) или с усиленным притоком кислорода (тяга). - Чем энергичнее происходит процесс окисления и чем ближе химическое сродство основы с окислителем и разлагателем, тем сильнее и быстрее проявление света и тепла. Выше было отмечено ещё одно обстоятельство: в иных случаях происходит произвольное окисление (тление, ржавчина, самовозгорание), в других же требуется поднять температуру (нагреть предмет) до известной нормы, чтобы вызвать соединение (окисление горячих металлов, соединение их с хлором и серой, горение свечи, дров, лампы, керосина, воспламенение пороха и т.д.).
Кроме того: дальнейший ход процесса может совершаться то быстро, то медленно.
Поэтому следует различать два различных свойства восприимчивости горючего материала к огню (т.е. к внешнему проявлению окисления): воспламеняемость и горючесть. Первая обозначает температуру, при которой происходит загорание (начало окисления), а вторая - быстроту совершения самого процесса окисления. Для пиротехника необходимо точно знать как то, так и другое, потому что от знания этого всецело зависит химическая смета составов, как в смысле их воспламенения, так и относительно силы света и длительности горения.
Относительно химических явлений, вызываемых теплотой, Рудольф Вагнер замечает следующее: «Наука о тепловых явлениях при химических соединениях и разложениях, «термохимия», ещё далеко не в состоянии объяснить различного разложения и способа приготовления в химических производствах, но она уже теперь даёт указания относительно большей или меньшей вероятности и выполнимости химических реак ций, т.к. вообще легче всего получаются соединения, образующиеся с выделением тепла, между тем как реакция, происходящая с поглощением тепла, в большинстве случаев гораздо труднее».
Единицей тепла считается его количество, необходимое для согревания единицы веса воды от 0 до 1 градуса по Цельсию. По десятичной системе единицей веса служит грамм (см 3); химическая единица тепла называемая «калорией», обозначается символом «cal», а 1000 калорий - символом «Cal». Символом «K» (кг) выражается количество тепла, выделяемое 1 г воды при охлаждении от точки кипения её до точки замерзания. Механический эквивалент теплоты равняется 425 кг/м.
Эффекты и продукты горения
Полного сгорания не существует: те части горючего состава, которые не превратились в газы, образуют либо дым, либо осадок. Дым - не что иное, как несгоревший материал, превращённый в мельчайшую пыль и увлечённый потоком воздуха. Таким телом является, между прочим, сажа (остаток несгоревшего дерева), копоть (остаток несгоревшего жирного тела), каменноугольный трубный дым (висящий над фабричными городами тысячами пудов и ныне эксплуатируемый целыми обществами) и т.п. Осадок чаще всего образует не только несгоревшее, но и несгораемое (огнеупорное) химическое соединение.
Следовательно, ближайшая задача пиротехника заключается в комплектовании таких составов, которые сгорали бы с возможно меньшим выделением дыма и осадка.

Горение вызывает появление огня в виде пламени или искр; пламя газов само по себе вовсе не светит (как, например, горящий водород при погружении натрия в воду); свет же и окраска его получаются благодаря присутствию в огне более плотных тел. Так, например, жёлтый свет светильного газа происходит оттого, что газ этот состоит из водорода и углерода; водород обладает большей окислительной способностью, чем углерод, и сгорает быстрее и совершеннее, а углерод, накопляясь в избытке в огне, придаёт пламени свет и жёлтую краску. Поэтому, чтобы узнать, дымит ли какое-либо пламя, достаточно сунуть в середину, где менее всего открыт доступ воздуху, какое-либо постороннее тело: оно тотчас же покроется налётом сажи.
Что именно твёрдые тела дают пламени свет, доказывает следующее: из всех существующих тел водород выделяет наибольшую теплоту при горении, т.к. плавит и платину, и горный хрусталь; но пламя его крайне бледно, пока элементами окисления служат только газы - водород и водяной пар, но как только появится примесь какого-либо плотного вещества (например, железа, угля, мрамора), то получается ослепительный свет (Друммондов свет).
Сила света находится в прямой зависимости от энергичности окисления: чем последняя сильнее, тем выше температура горения, а следовательно, тем сильнее и горение твёрдых примесей. Так, например, спиртовой огонь, светильный газ с примесью подогретого воздуха, наконец, бензиновая горелка «Уника» дают очень бледное пламя, но способны дать значительную силу света при посредстве известных примесей: электрические лампочки дают жёлтый, более слабый свет, а электрические фонари - белый, ослепительного блеска, потому что в первом случае электрическое напряжение несравненно менее энергично, чем во втором.
Особый интерес возбуждают Ауэровы горелки, ныне применяемые не только к светильному газу, но и к бензину, спирту, ацетилену и другим светильным источникам: горелки эти, состоящие из смеси огнеупорных тел, превращают слабый свет сильного теплового источника в яркий, зеленовато- или синевато-белый свет.
Для усиления яркости света и увеличения пламени в пиротехнических составах служат антимоний, уголь и другие вещества.
Окраска пламени происходит не от самих примесей, а исключительно от газов, образующихся вследствие горения этих примесей; газы поступают в огонь и сообщают пламени белую, жёлтую, красную, зелёную, синюю, фиолетовую окраску всевозможных оттенков. Такими примесями служат соли натрия, меди, свинца, бария, стронция, антимония и т.д. Так, например, сера в смеси с селитрой при горении даёт неопределённый цвет, а при наличии антимония - белый; если к смеси из бертолетовой соли и серы прибавить азотнокислого бария, то получится зелёный цвет и т.д.
Окрашивающие примеси состоят по большей части из металлических соединений, но сама краска зависит не от одного только металла, а и от соединенных с ним неметаллических веществ. Нагляднее всего доказывается это следующим опытом с медью. Медь, как уже сказано, горит в серных газах красным пламенем и превращается в сернистую медь. Если медь с небольшой примесью серы сжечь в кислороде, то образуется фиолетовое пламя. Если же вместо серы прибавить к меди твёрдый углевод (шеллак, сахар и т.д.), то пламя получит зелёную окраску.
Раскалите языком пламени спиртовой паяльной трубки щепотку яри- медянки (Grunspan) или серной соли: под влиянием спиртовых газов образуется ярко-зелёное пламя. Прибавьте к тому же веществу немного каломеля или нашатыря: получится ярко-синее пламя, потому что медь соединяется с освобождающимся хлором и, сгорая, образует хлористую медь (Chlorkupfer). Хлористая медь под влиянием спиртового огня сгорает зелёным пламенем, потому что водород спиртового огня отнимает у меди хлор и делает его в отношении окраски пламени недействительным (CuCl 2 +2H-2HCl+Cu). Если же окись меди (Kupferoxyd, CuO) сжечь в спиртовом огне, то сердцевина и низ у пламени будут иметь белую окраску, а края и конец язычка - синюю. Объясняется это тем, что водород пламени сначала восстанавливает окись меди (CuO+2Н=Cu+H 2 O), после чего красящая способность меди проявляется снова во внешней оболочке пламени под влиянием окисляющей способности оболочки и содержащейся в ней очень высокой температуры.
Для усиления «густоты» окраски употребляются каломель, нашатырь, мастика, шеллак и т.п.
Быстрота горения состава зависит главным образом:
- от химического родства между элементами основы и разлагателей, т.к. от степени этого родства зависит степень разлагаемости, а следовательно, и горючести основы;
- от составных пропорций, т.к. для каждой смеси существует крайний предел, при достижении которого получается быстрейшее и полнейшее разложение основы, тогда как вне этого предела, т.е. до него или за ним, получается худший результат, - такой предел называется «нормой»;
- от высоты температуры, развиваемой горением;
- от плотности и однородности состава;
- от химического влияния примеси, т.е. придаточных элементов;
- от атмосферной влаги и гигроскопичности состава;
- от внешней температуры;
- наконец, от целого ряда мелких и крупных, главных или второстепенных причин, имеющих каждая свою долю влияния на общий процесс горения препарата.
Определение нормы горения образует одну из главнейших задач пиротехнического искусства, т.к. с ним связан вопрос о произвольном усилении или замедлении пламени, поэтому в подлежащих местах на норму обращено особое внимание.
Первой хронологически (конец ХIХ века) была тепловая теория, основоположниками которой считаются Маляр, Ле Шателье и Нуссельт. В основу этой теории положена гипотеза Вант-Гофа о температурной зависимости скорости химической реакции. Условием теплового взрыва является преобладание теплоприхода за счет энергии реакции над отводом тепла в окружающую среду. В этом случае в системе накапливается тепло, что приводит к саморазогреву и соответственно к саморазгону реакции.
Возникновение в горючей системе реакции окисления связано чаще всего с нагреванием системы тем или иным источником воспламенения. При нагревании горючей системы энергия молекул горючего и кислорода увеличивается и, когда она достигает некоторой величины, происходит их активизация, т.е. образуются активные центры (радикалы и атомы), имеющие свободные валентности, в результате чего молекулы горючего вещества легко вступают в соединение с кислородом воздуха. А.Н. Бах и К. Энглер в 1898 г. независимо друг от друга предложили перекисную теорию окисления, согласно которой при нагревании горючей системы происходит активизация кислорода путём разрыва одной связи между атомами, причём активная молекула вступает в соединение с горючим веществом, не распадаясь на атомы и образуя перекисные соединения типа: R 1 -O-O-R 2 или R-O-O-OH.
Однако, перекисная теория не в состоянии объяснить некоторые характерные особенности процесса окисления, например, резкое действие, иногда ничтожных следов посторонних примесей.
Скорость химической реакции , м/с может быть выражена, исходя из закона Аррениуса, следующим уравнением:
![]() , (1.12)
, (1.12)
где - константа скорости реакции (скорость химической реакции при концентрациях реагентов, приведенных к единице);
Концентрации реагентов, моль/м 3 ;
Стехиометрические коэффициенты, определяемые соотношением концентраций исходных реагентов в стехиометрическом уравнении реакции;
Основание натуральных логарифмов;
Универсальная газовая постоянная, = 8,3 Дж/(моль∙К);
– температура, К.
Тепловая теория самовоспламенения (называемая также теорией теплового взрыва) основана на сопоставлении скоростей процессов тепловыделения при экзотермическом окислении и теплоотвода от реагирующей смеси в стенке содержащего его сосуда. Условие самовоспламенения определяется равенством этих скоростей. Температура стенок сосуда, при которой достигается это равенство, называется температурой самовоспламенения. Начиная с этой температуры (характерной в каждом случае для данных конкретных условий - размера и формы сосуда, теплофизических свойств газа) происходит саморазогрев, который может привести к вспышке (самовоспламенению).
С учётом изложенного для саморазогрева в реагирующей среде можно записать:
где - теплоемкость при постоянном объёме, Дж/К;
Плотность газа, кг/м 3 ;
Температура газа, К;
Время, с;
Тепловой эффект реакции, Вт;
Скорость реакции, м/с;
Поверхность реакционного сосуда, м 2 ;
Объем реакционного сосуда, м 3 ;
Коэффициент теплоотдачи, Вт/(м 2 ×К);
Температура стенки сосуда, К.
Д.А.Франк-Каменецким был предложен критерий теплового самовоспламенения, основанный на нарушении стационарного распределения температур в реактивном сосуде при достаточной скорости тепловыделения:
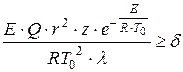 , (1.14)
, (1.14)
где - характерный размер сосуда, м;
Предэкспоненциальный множитель;
Коэффициент теплопроводности газовой смеси, Вт/(м×К);
Безразмерный критерий, равный 3,3; 0,88 и 2 соответственно для сферического, плоскопараллельного и цилиндрического сосудов.
Критерий Д.А.Франк-Каменецкого следует понимать так: если при подстановке всех параметров, определяющих , мы получим значение , то воспламенения не будет, при произойдет воспламенение. Из уравнения критерия следует, что теплота реакции и радиус сосуда , в котором происходит реакция, - важные определяющие факторы взрыва. Тепловой взрыв выражен тем ярче, чем лучше выполняются неравенства:
Если эти неравенства выполняются плохо, то тепловой взрыв вырождается – одновременно с ростом температуры происходит быстрое выгорание исходного вещества, которое смазывает картину взрыва.
Возникновение горения чаще всего связано с нагреванием горючей системы тем или иным источником воспламенения. Согласно теории академика Н.Н. Семёнова, процесс окисления сопровождается выделением тепла и при определенных условиях может самоускоряться. Этот процесс самоускорения реакции окисления с переходом её в горение называется самовоспламенением.
В случае теплового самовоспламенения оно возникает вследствие превышения скорости тепловыделения над скоростью теплоотвода.
Рассмотрим процесс теплового самовоспламенения на примере горючего газа или паров горючей жидкости с воздухом, помещенных в сосуд объёмом . При повышении температуры сосуда и горючей смеси скорость реакции и выделение тепла увеличится. Зависимость скорости выделения тепла от температуры , Дж/с определяются:
![]() , (1.15)
, (1.15)
где - теплота сгорания газа, Дж;
Объём горючей смеси, м 3 ;
Константа скорости реакции;
Концентрация реагирующего вещества, кг/м 3 ;
Порядок реакции;
Энергия активации, Дж/моль;
Универсальная газовая постоянная Дж/(моль·К);
Температура смеси, К.
Выделяющееся тепло передаётся горючей смеси, и она нагревается. Как только температура смеси превысит температуру стенок сосуда, начнётся отвод тепла через стенки сосуда в единицу времени, пропорционально разности температур смеси и стенок сосуда и определяются зависимостью:
![]() , (1.16)
, (1.16)
где - скорость отвода тепла через стенки сосуда, Дж/с;
Коэффициент теплопередачи, Дж/(К·м 2 ×с);
Поверхность стенок сосуда, м 2 ;
Температура смеси, К;
Температура стенок сосуда, К

Рисунок 1.5 – Зависимость тепловыделения от температуры при разных давлениях
На рисунке 1.5 кривые 2, 3 и 4 показывают зависимость тепловыделения от температуры при разных давлениях и одинаковом составе смеси. При постоянных температурах сосуда и среды и постоянном составе смеси количество отводимого из зоны горения тепла характеризуется прямой 1. При изменении состава смеси изменится и скорость теплопотерь и, следовательно, наклон прямой. Чем выше давление, тем больше выделяется тепла при реакции (кривая 4). В условиях, определяемых кривой 2, самовоспламенение возникнуть не может, так как теплопотери (прямая 1) выше тепловыделений при этом давлении. Точка касания кривой 3 с прямой соответствует равновесию между выделяемым и отводимым теплом при - минимальной температуре самовоспламенения данной горючей системы в заданных условиях. При незначительном подводе энергии извне возможно самовоспламенение. Кривая 4 характеризует условия, при которых неизбежно самовоспламенение, так как выделяется тепло больше, чем отводится.
Анализируя приведённую схему, Н.Н. Семёнов установил зависимость:
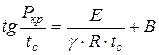 , (1.17)
, (1.17)
где - минимальное давление воспламенения, Па;
Минимальная температура самовоспламенения, К;
Порядок реакции;
Постоянная, зависящая от состава и других свойств смеси.
На основании этого уравнения (1.17) можно теоретически заранее определить, возможно ли самовоспламенение горючей смеси в данных конкретных условиях. Соотношение, связывающее минимальное давление с температурой самовоспламенения, было подтверждено многочисленными экспериментами и оказалось ценным при изучении процессов горения.
Цепная теория горения
Еще в 1928 г. Н.Н.Семенов выдвинул идею о возможности существования в химических системах двух типов взрывов – цепных и тепловых.
Цепными называются реакции, идущие через ряд стадий (через ряд промежуточных реакций), в которых образуются промежуточные соединения со свободными валентностями, так называемые активные центры, являющиеся зародышами последующих быстропротекающих стадий процесса.
Впервые представление о цепной реакции появилось в 1913 г., когда немецкий физико-химик М. Боденштейн установил, что при освещении смеси водорода с хлором молекула хлора, поглощая квант световой энергии , распадается на атомы:
![]() .
.
Атомы хлора мгновенно вступают в реакцию с водородом, в результате чего происходит взрыв смеси. Активация одной молекулы хлора должна была бы вызвать образование двух молекул :
![]() .
.
Однако, опыты показывают, что при этом образуется 100000 молекул хлористого водорода. Это можно объяснить, если предположить, что при взаимодействии хлора с водородом образуется продукт, который, вступая во вторичные реакции, вновь возрождается и может продолжать реакцию. Этому предположению соответствует такая схема реакции:
I Первичная реакция
IV Обрыв цепи
По этой схеме активация одной молекулы хлора (I) вызывает появление двух атомов хлора – двух активных центров цепной реакции. Каждый из атомов хлора дает начало своей цепной реакции, в которой активный центр непрерывно восстанавливается (II, III). Таким образом, под влиянием инициирующей реакции (I) возникают следующие друг за другом реакции, образующие цепь (II, III и т.д.). Число таких реакций от момента зарождения цепи до ее обрыва называют длиной цепи. Цепь может обрываться при столкновении атомов хлора (IV) или атомов водорода (V) и образования из них молекул, или при столкновении активных центров с поверхностью твердого вещества. Это типичная неразветвляющаяся цепная реакция. В ней каждый активный центр вызывает появление только одного нового активного центра, поэтому реакция может продолжаться, но не ускоряться.
В разветвляющейся цепной реакции каждый активный центр зарождает два и более новых активных центра.
Согласно теории цепных реакций, процесс окисления начинается с активизации горючего вещества.
Практика показала, что воспламенение может происходить в изотермических условиях, т.е. без повышения температуры реагирующей среды («холодное» воспламенение смеси). В этом случае говорят о цепном (изометрическом) взрыве.
Два исходных компонента: горючее и окислитель, находясь в относительно устойчивом молекулярном состоянии, прежде чем ассоциироваться в новые, более устойчивые молекулы продуктов горения, претерпевают целую цепь сложных промежуточных превращений, результатом которых является образование неустойчивых продуктов: атомов, радикалов, возбужденных молекул с относительно большой степенью ионизации (формальдегид, углеводородный и гидрокислый радикалы, атомарный кислород и водород).
Кондратьеву В.Н. удалось обнаружить в пламени различных углеводородов большие концентрации атомарного кислорода (О), гидрокислого радикала (ОН), углеводородных радикалов (СН 3), окиси углерода (СО), формальдегида (СН 2 О) и др. Концентрации этих веществ в пламени оказались в тысячи и миллионы раз большими их равновесных концентраций при термическом разложении при температуре пламени конечных продуктов реакции, например, Н 2 О → Н+ОН.
Результаты этих наблюдений позволили сделать вывод, что рассматриваемые атомы и радикалы появляются в реагирующем газе не вследствие конечного распада продуктов, а являются промежуточными продуктами реакции.
Таким образом, в основе цепного механизма воспламенения лежит целая цепь химических превращений одних веществ в другие, результатом которых является образование на отдельных промежуточных стадиях химически очень активных неустойчивых продуктов, получивших название активных центров, которые легко реагируют между с собой и с молекулами исходных веществ с образованием новых активных центров и конечных продуктов, например, для метановоздушной смеси Н 2 О и СО 2 .
Высокая реакционная способность радикалов и атомов объясняется малой энергией активизации их реакций, близкой к энергии активации атомных реакций:
ОН + Н 2 = Н 2 О + Н - 25 кДж/моль
СН 3 + С 3 Н 6 - 12,5 кДж/моль
СН 3 + С 6 Н 6 - 23,5 кДж/моль
Н 2 О → Н + ОН
Любая из полученных активных частиц (Н или ОН) будучи крайне неустойчивой и, следовательно, химически активной, сталкиваясь с молекулой исходного вещества, расщепляется, образуя новые активные частицы:
Н+О 2 = ОН+О
ОН+Н 2 = Н 2 О+Н
Полученные в результате реакции активные частицы Н и ОН снова вступят в реакции, а частицы О взаимодействуют с водородом:
О+Н 2 = ОН+Н.
Т.е., в результате реакции между активными частицами и молекулами исходных веществ образуются не только конечные продукты, но и новые активные частицы. Образующиеся в результате реакции активные частицы дают начало новым стадиям химического превращения, которые будут происходить до полного расхода исходных веществ.
Такие многократно повторяющиеся химические реакции называются цепными, а активные частицы, дающие начало новым цепям превращений, активными центрами.
Рассмотренный выше цепной процесс горения водорода можно представить в виде схемы (рисунок 1.6).
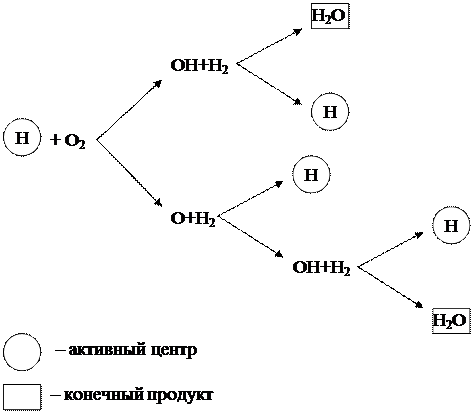
Рисунок 1.6 - Схема цепного горения водорода
Из схемы видно, что начало новым цепям превращений дают только частицы водорода (Н), которые являются активными центрами. При этом в каждом звене цепного процесса в результате реакции между активным центром Н и молекулой кислорода О 2 кроме конечного продукта Н 2 О образуются 3 новых активных центра Н, дающие начало новым цепям превращений.
Такая цепная реакция, протекающая с увеличением активных центров, называется разветвлённой. Реакция развивается лавинообразно и протекает с очень высокими скоростями, значительно превышающими скорость обычных молекулярных реакций.
Типичной реакцией с неразветвляющейся цепью является взаимодействие хлора с водородом. Активными центрами этой реакции служат чередующиеся атомы хлора и водорода. При реагировании атома хлора образуется один атом водорода так же, как при реагировании атома водорода образуется один атом хлора. Поэтому реакция может продолжаться, но не ускоряться.
Тот общеизвестный факт, что фотохимическая реакция хлора с водородом всё же оканчивается взрывом (самовоспламенением), объясняется тем, что при достаточно большой скорости цепной реакции тепловыделения превышают теплоотвод, в результате чего смесь сильно нагревается, и возникают условия, необходимые для теплового самовоспламенения.
При протекании разветвлённой цепной реакции, которая характерна для углеводородов, концентрация активных центров может возрастать независимо от условий начального инициирования и, если скорость образования активных центров при разветвлениях превосходит скорость обрыва цепи, то возникает самоускоряющийся процесс лавинообразного характера, приводящий к воспламенению.
Теория цепных реакций позволила объяснить многие особенности процессов горения (сильное влияние примесей, пределы самовоспламенения по давлению, катализ и ингибирование давления и др.), которые нельзя объяснить тепловой теорией. Механизм возникновения и развития реальных пожаров и взрывов характеризуется комбинированным цепочечно-тепловым процессом. Начавшись цепным путём, реакция окисления за счёт её экзотермичности продолжает ускоряться тепловым путём. Поэтому, в конечном счете, критические (предельные) условия возникновения и развития горения будут определяться тепловыделением и условиями теплообмена реагирующей системы с окружающей средой.
На цепных химических реакциях основаны многие технологические процессы в химической промышленности. К таким процессам относятся, например, процессы полимеризации, составляющие основу производства синтетических каучуков, пластмасс, полимерных волокон и многих других изделий. К ним также относятся такие важные промышленные процессы, как производство синтетических жирных кислот, заменяющих ранее применяемые пищевые жиры в производстве моющих смазочных средств, крекинг – процесс получения высококачественного топлива из нефти и т. д.