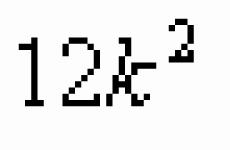Räniühendid on asendamatud. Räni ja selle ühendid - teadmiste hüpermarket. Räni levik looduses
Räni on tahke mittemetall, mis on kivimite osa. Normaaltingimustes on see inertne, kuid kuumutamisel on sellel oksüdeerivad ja redutseerivad omadused. Räni keemilisi omadusi kasutab silikaattööstus klaasi, peeglite, elektroonika ja ehitusmaterjalide tootmiseks.
Elemendi üldine kirjeldus
Räni asub perioodilisustabeli neljandas rühmas ja kolmandas perioodis. Räni aatomi tuuma positiivne laeng on +14. 14 negatiivselt laetud elektroni liigub tuuma ümber.
Aatom võib vaba d-alamtaseme tõttu minna ergastatud olekusse. Seetõttu on elemendil kaks positiivset oksüdatsiooniastet (+2 ja +4) ja üks negatiivne (-4). Elektrooniline konfiguratsioon - 1s 2 2s 2 2p 6 3s 2 3p 2.

Riis. 1. Räni aatomi struktuur.
Räni on habras pooljuht, millel on kõrge keemistemperatuur ja plaadi temperatuur. Suhteliselt kerge mittemetall: tihedus on 2,33 g / cm 3.
Räni ei leidu puhtal kujul. See on osa liivast, kvartsist, ahhaadist, ametüstist ja muudest kivimitest.

Riis. 2. Ahhaat.
Reaktsioonid mittemetallidega
Mittemetallidega suhtlemisel avaldab räni redutseerivaid omadusi - see loobub elektronidest. Reaktsioonid on võimalikud ainult tugeva kuumutamise korral. Normaalsetes tingimustes reageerib räni ainult fluoriga. Tabelis on näidatud reaktsioonid põhiliste mittemetallidega.
Ränihüdriidi - silaani (SiH 4) - saab silikoosi happega lagundades. Näiteks Mg 2 Si + 2H 2 SO 4 → SiH 4 - + 2 MgSO 4.
Vastastikmõju metallidega
Ränil on oksüdeerivaid omadusi ainult metallidega reageerimisel. Sulamise ajal moodustuvad soolad - silitsiidid:
- Si + 2Mg → Mg 2 Si;
- Si + 2Ca → Ca 2 Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi 2.
Silitsiide kasutatakse tööstuslikult sulamite ja materjalide tootmiseks. Ülijuhina kasutatakse vanaadiumsiidiidi (V 3 Si) ja pooljuhina reeniumsilikaati (ReSi).
Reaktsioonid keeruliste ainetega
Lisaks lihtsatele ainetele reageerib räni keeruliste ühenditega - hapete ja leelistega. Peamisi reaktsioone on kirjeldatud tabelis.
1200 ° C juures reageerib räni dioksiidiga, moodustades monoksiidi: Si + SiO 2 → SiO.

Riis. 3. Räni kasutamine.
Mida oleme õppinud?
Räni on habras mittemetall, mis suhtleb metallide, mittemetallide ja komplekssete ainetega. Reaktsioonides metallidega on sellel oksüdeeriva aine omadused, mittemetallidega - redutseerija. Reageerib normaaltingimustes ainult fluori, vesinikfluoriidhappega (sh koos lämmastikhappega), leelistega. Ülejäänud reaktsioonid toimuvad kõrgendatud temperatuuridel.
Testi teema järgi
Aruande hindamine
Keskmine hinne: 4.6. Saadud hinnanguid kokku: 204.
Räni on elementide perioodilise tabeli IV rühma keemiline element D.I. Mendelejev. Avasid 1811 J. Gay-Lusac ja L. Ternard. Selle seerianumber on 14, aatommass 28,08, aatommaht 12,04 10 -6 m 3 / mol. Räni on metalloid, kuulub süsiniku alarühma. Selle hapniku valents on +2 ja +4. Looduses levimise poolest on räni hapniku järel teisel kohal. Selle massiosa maapõues on 27,6%. Maakoor, vastavalt V.I. Vernadsky, rohkem kui 97% koosneb ränidioksiidist ja silikaatidest. Hapnikku ja orgaanilisi räniühendeid leidub ka taimedes ja loomades.
Kunstlikult toodetud räni võib olla kas amorfne või kristalne. Amorfne räni on pruun, peeneks hajutatud, väga hügroskoopne pulber; röntgendifraktsiooniandmete kohaselt koosneb see väikseimatest ränikristallidest. Seda on võimalik saada SiCl4 kõrgel temperatuuril redutseerimisel tsingiauruga.
Kristalliline räni on terashalli värvi ja metalse läikega. Kristalse räni tihedus temperatuuril 20 ° C on 2,33 g / cm 3, vedela räni temperatuuril 1723 - 2,51 ja temperatuuril 1903K - 2,445 g / cm 3. Räni sulamistemperatuur on 1690 K, keemistemperatuur on 3513 K. Andmete kohaselt kirjeldatakse räni aururõhku T = 2500 ÷ 4000 K juures võrrandiga log p Si = -20130 / T + 7,736, kPa . Räni sublimatsiooni soojus 452610, sulamine 49790, aurustamine 385020 J / mol.
Räni polükristalle iseloomustab kõrge kõvadus (temperatuuril 20 ° С HRC = 106). Räni on aga väga habras, seetõttu on sellel suur survetugevus (σ SJ B ≈ 690 MPa) ja väga madal tõmbetugevus (σ B ≈ 16,7 MPa).
Toatemperatuuril on räni inertne, reageerib ainult fluoriga, moodustades lenduva 81P4. Hapetest reageerib see ainult lämmastikhappega, mis on segatud vesinikfluoriidhappega. Kuid räni reageerib leelistega üsna kergesti. Üks tema reaktsioonidest leelistega
Si + NaOH + H 2 = Na 2 SiO 3 + 2H 2
kasutatakse vesiniku tootmiseks. Koos sellega võib räni toota suure hulga mittemetallidega keemiliselt tugevaid ühendeid. Nendest ühenditest tuleb märkida halogeniidid (SiX 4 kuni Si n X 2n + 2, kus X on halogeen ja n ≤ 25), nende segaühendid SiCl 3 B, SiFCl 3 jne, oksükloriidid Si 2 OCl 3, Si302CI3 et al., nitriidid Si 3 N 4, Si 2 N 3, SiN ja hüdriidid üldvalemiga Si n H 2n + 2 ning ferrosulamite tootmisel leitud ühenditest - lenduvad sulfiidid SiS ja SiS 2 ning tulekindel karbiid SiC .
Samuti on räni võimeline tootma metallidega ühendeid - silitsiide, millest olulisemad on raua, kroom, mangaan, molübdeen, tsirkoonium, samuti haruldased muldmetallid ja leelismetallid. Seda räni omadust - võimet anda metallidega keemiliselt väga tugevaid ühendeid ja lahuseid - kasutatakse laialdaselt vähese süsinikusisaldusega ferrosulamite tootmise tehnoloogias, samuti madala keemistemperatuuriga leelismuldade (Ca, Mg, Ba) ja raskesti taastatavad metallid (Zr, Al jne).
Räni-rauasulameid uuris P.V. Geld ja tema kool pöörasid erilist tähelepanu Fe-Si süsteemi osale, mis oli seotud sulamitega oma suure sisaldusega. See on tingitud asjaolust, et nagu võib näha Fe-Si diagrammilt (joonis 1), toimub selle koostise sulamites mitmeid teisendusi, mis mõjutavad oluliselt erinevate klasside ferrosiliconi kvaliteeti. Seega on FeSi 2 disilitsiid stabiilne ainult madalatel temperatuuridel (< 918 или 968 °С, см. рисунок 1). При высоких температурах устойчива его высокотемпературная модификация - лебоит. Содержание кремния в этой фазе колеблется в пределах 53-56 %. В дальнейшем лебоит будем обозначать химической формулой Fe 2 Si 5 , что практически соответствует максимальной концентрации кремния в лебоите.
Sulamite jahutamisel, mille Si sisaldus on> 55,5%, leboiit temperatuuril T< 1213 К разлагается по эвтектоидной реакции
Fe 2 Si 5 → FeSi 2 + Si (2)
ja sulamid 33,86-50,07% Si juures T< 1255 К - по перитектоидной реакции
Fe 2 Si 5 + FeSi = ЗFeSi 2 (3)
Vahekompositsiooni sulamid (50,15–55,5% Si) läbivad esmalt peritektoidi (3) temperatuuril 1255 K ja seejärel temperatuuril 1213 K eutektoidseid (2) muundumisi. Nende Fe 2 Si 5 muundumistega reaktsioonides (2) ja (3) kaasnevad muutused silitsiidi mahus. Selline muutus on eriti suur reaktsiooni (2) käigus - umbes 14%; seetõttu kaotavad leboiti sisaldavad sulamid oma järjepidevuse, pragunevad ja isegi lagunevad. Aeglase tasakaalukristalliseerumise korral (vt joonis 1) võib leboiit nii FS75 kui ka FS45 sulamite kristalliseerumisel sadestuda.
Leboidi eutektoidse lagunemisega seotud pragunemine on aga ainult üks lagunemise põhjusi. Teine põhjus, ilmselt peamine, on see, et pragude tekkimine piki terade piire loob võimaluse nende piiride kaudu eralduvatele vedelikele - fosforile, arseenile, alumiiniumsulfiididele ja karbiididele jne - reageerida õhuniiskusega reaktsioonide kaudu. mille tagajärjel atmosfääri eraldub H 2, PH 3, PH 4, AsH 4 jne ning pragudes - lahtised oksiidid Al 2 O 3, SiO 2 ja muud ühendid, lõhkudes neid. Sulamite levikut saab vältida, muutes neid magneesiumiga, legeerides elementide lisanditega, mis viimistlevad tera (V, Ti, Zg jne) või muudavad selle plastilisemaks. Tera viimistlemine vähendab lisandite ja nende ühendite kontsentratsiooni selle piiridel ning mõjutab sulamite omadusi samamoodi nagu üldine lagunemist soodustavate lisandite (P, Al, Ca) kontsentratsiooni vähenemine sulamis. Fe-Si sulamite termodünaamilisi omadusi (segamissoojus, aktiivsus, süsiniku lahustuvus) on üksikasjalikult uuritud, neid võib leida töödest. Teave süsiniku lahustuvuse kohta Fe -Si sulamites on näidatud joonisel 2, räni aktiivsuse kohta - tabelis 1.


Hapniku räniühendite füüsikalis -keemilisi omadusi uuris P.V. Koos töötajatega. Vaatamata Si-O süsteemi tähtsusele ei ole selle skeemi veel üles ehitatud. Praegu on teada kaks räni hapnikuühendit - ränidioksiid SiO 2 ja monoksiid SiO. Kirjanduses on märke ka teiste räni hapnikuühendite - Si 2 O 3 ja Si 3 O 4 - olemasolust, kuid puudub teave nende keemiliste ja füüsikaliste omaduste kohta.
Looduses esindab räni ainult ränidioksiid SiO 2. See räniühend on erinev:
1) kõrge kõvadus (Mohsi skaalal 7) ja tulekindel (T pl = 1996 K);
2) kõrge keemistemperatuur (T KIP = 3532 K). Ränidioksiidi aururõhku saab kirjeldada võrranditega (Pa):
3) suure hulga muudatuste moodustamine:
 SiO 2 allotroopsete muundamiste eripära on see, et nendega kaasnevad olulised muutused aine tiheduses ja mahus, mis võivad põhjustada kivimi pragunemist ja purunemist;
SiO 2 allotroopsete muundamiste eripära on see, et nendega kaasnevad olulised muutused aine tiheduses ja mahus, mis võivad põhjustada kivimi pragunemist ja purunemist;
4) kõrge kalduvus hüpotermiale. Seetõttu on kiire jahutamise tõttu võimalik fikseerida nii vedela sulatise (klaasi) struktuur kui ka β-kristobaliidi ja tridümiidi modifikatsioonid kõrgel temperatuuril. Vastupidi, kiire kuumutamise korral saab kvartsi sulatada, vältides tridüümi ja kristobaliidi struktuure. SiO2 sulamistemperatuur langeb sel juhul umbes 100 ° C;
5) kõrge elektritakistus. Näiteks 293 K juures on see 1 10 12 oomi * m. Kuid temperatuuri tõustes SiO 2 elektriline takistus väheneb ja vedelas olekus on ränidioksiid hea juht;
6) kõrge viskoossus. Seega on 2073 K juures viskoossus 1 10 4 Pa s ja temperatuuril 2273 K - 280 Pa s.
Viimane, vastavalt N.V. Solomini seletatakse asjaoluga, et SiO 2 on sarnaselt orgaanilistele polümeeridele võimeline moodustama ahelaid, mis 2073 K juures koosnevad 700 ja 2273 K juures 590 SiO 2 molekulist;
7) kõrge termiline stabiilsus. Elementidest SiO 2 moodustumise Gibbsi energiat, võttes arvesse nende üldist olekut, vastavalt andmetele kirjeldatakse suure täpsusega võrranditega: 
Need andmed, nagu on näha tabelist 2, erinevad pisut autorite andmetest. Kahemõõtmelisi võrrandeid saab kasutada ka termodünaamiliste arvutuste jaoks:

Silikoonmonooksiidi SiO avastas Potter 1895. aastal elektriahjude gaasifaasis. Nüüd on usaldusväärselt kindlaks tehtud, et SiO eksisteerib ka kondenseerunud faasides. Uuringute kohaselt P.V. Gelda, oksiidi iseloomustab madal tihedus (2,15 g / cm 3), kõrge elektritakistus (10 5 -10 6 oomi * m). Kondenseerunud oksiid on habras, selle kõvadus Mohsi skaala järgi on ~ 5. Sulamistemperatuuri ei olnud selle suure lenduvuse tõttu võimalik katseliselt määrata. O. Kubaševski sõnul on see Berežnõi järgi võrdne 1875 K -ga, - 1883 K. SiO sulamissoojus on mitu korda suurem kui ΔH 0 SiO2 andmetel võrdub see 50242 J / mol. Ilmselt on see volatiilsuse tõttu ülehinnatud. Sellel on klaasjas murd, selle värvus muutub valgest šokolaadiks, mis on tõenäoliselt tingitud selle oksüdeerumisest atmosfääri hapnikuga. Värske murru SiO -l on tavaliselt rasvase läikega herne värv. Oksiid on termodünaamiliselt stabiilne ainult kõrgetel temperatuuridel SiO (G) kujul. Jahutamisel on oksiid reaktsiooni järgi ebaproportsionaalne
2SiO (G) = SiO (L) + SiO2 (6)

SiO keemistemperatuuri saab ligikaudselt hinnata võrrandist:
Ränioksiidgaas on termodünaamiliselt väga stabiilne. Selle moodustumise Gibbsi energiat saab kirjeldada võrranditega (vt tabel 2):

millest on näha, et SiO, nagu ka CO, keemiline tugevus suureneb temperatuuri tõustes, mis teeb sellest suurepärase redutseerija paljude ainete jaoks.
Termodünaamiliseks analüüsiks saab kasutada ka kaheliikmelisi võrrandeid:
 Gaaside koostist SiO 2 kohal hindas I.S. Kulikov. Sõltuvalt temperatuurist kirjeldatakse SiO2 sisaldust SiO2 -s võrranditega:
Gaaside koostist SiO 2 kohal hindas I.S. Kulikov. Sõltuvalt temperatuurist kirjeldatakse SiO2 sisaldust SiO2 -s võrranditega:
Ränikarbiid, nagu SiO, on üks vaheühenditest, mis moodustuvad SiO2 redutseerimisel. Karbiidil on kõrge sulamistemperatuur.
Sõltuvalt rõhust on see vastupidav kuni 3033-3103 K (joonis 3). Kõrgel temperatuuril sublimeerub ränikarbiid. Si (G), Si 2 C (G), SiC 2 (G) aururõhk karbiidi kohal temperatuuril T< 2800К невелико, что следует из уравнения
Karbiid eksisteerib kahes modifikatsioonis-kuupmeetri madalal temperatuuril β-SiC ja kuusnurkne kõrge temperatuuriga α-SiC. Ferrosulamist ahjudes leidub tavaliselt ainult β-SiC. Andmeid kasutavad arvutused on näidanud, et Gibbsi moodustumise energiat kirjeldavad võrrandid:

mis erinevad oluliselt andmetest. Nendest võrranditest järeldub, et karbiid on termiliselt stabiilne kuni 3194 K. Vastavalt oma füüsikalistele omadustele iseloomustab karbiidi kõrge kõvadus (~ 10), kõrge elektriline takistus (1273K p≈0,13 ⋅ 10 4 μOhm ⋅ m), suurenenud tihedus (3,22 g / cm 3) ja kõrge vastupidavus nii redutseerivas kui ka oksüdeerivas atmosfääris.
Välimuselt on puhas karbiid värvitu ja pooljuhtivate omadustega, mis säilivad isegi kõrgel temperatuuril. Tehniline ränikarbiid sisaldab lisandeid ja on seetõttu rohelise või musta värvi. Niisiis, roheline karbiid sisaldab 0,5-1,3% lisandeid (0,1-0,3% C, 0,2-1,2% Si + SiO 2, 0,05-0,20% Fe 2 O 3, 0,01-0,08% Al 2 O 3 jne). Mustkarbiidis on lisandite sisaldus suurem (1-2%).
Räni sulamite tootmisel kasutatakse redutseerijana süsinikku. See on ka peamine aine, millest valmistatakse elektriahjude elektroodid ja vooder, sulatades räni ja selle sulamid. Süsinik on looduses üsna tavaline, selle sisaldus maapõues on 0,14%. Looduses esineb seda nii vabas olekus kui ka orgaaniliste ja anorgaaniliste ühendite (peamiselt karbonaatide) kujul.
Süsinikul (grafiidil) on kuusnurkne kuupvõre. Grafiidi röntgenikiirgustihedus on 2,666 g / cm 3, püknomeetriline tihedus 2,253 g / cm 3. Seda eristab kõrge sulamistemperatuur (~ 4000 ° C) ja keemistemperatuur (~ 4200 ° C), elektritakistus suureneb temperatuuri tõustes (873 K p≈9,6 μΩ⋅m, 2273 K p≈ 15,0 μΩ⋅m) üsna vastupidav. Selle ajutine takistus vuntsidel võib olla 480–500 MPa. Elektroodgrafiidil on aga σ b = 3,4 ÷ 17,2 MPa. Grafiidi kõvadus Mohsi skaalal on ~ 1.
Süsinik on suurepärane redutseerija. See on tingitud asjaolust, et ühe selle hapnikuühendi (CO) tugevus suureneb temperatuuri tõustes. Seda võib näha selle moodustumise Gibbsi energiast, mida, nagu näitavad meie arvutused, kasutades andmeid, kirjeldatakse hästi kui kolme tähtajaga
ja kaheliikmelised võrrandid:

Süsinikdioksiid CO 2 on termodünaamiliselt tugev vaid kuni 1300 K. CO 2 moodustumise Gibbsi energiat kirjeldavad võrrandid:

Sõltumatu keemilise elemendina sai räni inimkonnale teatavaks alles 1825. aastal. Mis muidugi ei takistanud räniühendite kasutamist nii paljudes valdkondades, et on lihtsam loetleda need, kus elementi ei kasutata. See artikkel valgustab räni ja selle ühendite füüsikalisi, mehaanilisi ja kasulikke keemilisi omadusi, rakendusi ning räägime ka sellest, kuidas räni mõjutab terase ja muude metallide omadusi.
Esiteks keskendume räni üldistele omadustele. 27,6–29,5% maakoore massist on räni. Merevees on ka elemendi kontsentratsioon kopsakas - kuni 3 mg / l.
Räni on litosfääris hapniku järel teisel kohal. Selle kõige kuulsam vorm, ränidioksiid, on aga dioksiid ja just selle omadused on saanud sellise laialdase kasutamise aluseks.
See video ütleb teile, mis on räni:
Kontseptsioon ja omadused
Räni on mittemetall, kuid erinevatel tingimustel võib sellel olla nii happelisi kui ka aluselisi omadusi. See on tüüpiline pooljuht ja seda kasutatakse laialdaselt elektrotehnikas. Selle füüsikalised ja keemilised omadused määravad suuresti allotroopne olek. Kõige sagedamini tegelevad nad kristalse vormiga, kuna selle omadused on rahvamajanduses nõutumad.
- Räni on üks peamisi makrotoitaineid inimkehas. Selle puudumine avaldab kahjulikku mõju luukoe, juuste, naha, küünte seisundile. Lisaks mõjutab räni immuunsüsteemi jõudlust.
- Meditsiinis leidis element või õigemini selle ühendid oma esimest rakendust selles mahus. Räniga vooderdatud kaevude vesi erines mitte ainult puhtuse poolest, vaid avaldas positiivset mõju ka resistentsusele nakkushaiguste suhtes. Tänapäeval on räniühend tuberkuloosi, ateroskleroosi ja artriidi vastaste ravimite aluseks.
- Üldiselt on mittemetall mitteaktiivne, kuid seda on puhtal kujul raske leida. See on tingitud asjaolust, et õhus see passiivub kiiresti dioksiidikihiga ja lakkab reageerimast. Kuumutamisel suureneb keemiline aktiivsus. Sellest tulenevalt on inimkond aineühenditega palju tuttavam, mitte iseendaga.
Niisiis moodustab räni sulamid peaaegu kõigi metallidega - silitsiididega. Kõik need erinevad tulekindluse ja kõvaduse poolest ning neid kasutatakse vastavatel aladel: gaasiturbiinid, ahjukütteseadmed.
Mittemetall asub D.I. Mendelejevi tabelis rühmas 6 koos süsiniku, germaaniumiga, mis näitab teatud ühisosa nende ainetega. Niisiis, süsinikuga on see "seotud" võimega moodustada orgaanilisi ühendeid. Samal ajal võib räni, nagu germaanium, teatud keemilistes reaktsioonides näidata metalli omadusi, mida kasutatakse sünteesis.
Plussid ja miinused
Nagu igal teisel ainel rahvamajanduses kasutamise seisukohast, on ka ränil teatud kasulikke või mitte väga häid omadusi. Need on olulised just kasutusala määramisel.
- Aine märkimisväärne eelis on see kättesaadavus... Looduses on see tõsi, see ei ole vabas vormis, kuid sellegipoolest ei ole räni tootmise tehnoloogia nii keeruline, kuigi see võtab palju energiat.
- Teine kõige olulisem eelis on paljude ühendite moodustumine ebatavaliselt kasulike omadustega. Need on silaanid, silitsiidid, dioksiid ja loomulikult mitmesugused silikaadid. Räni ja selle ühendite võime moodustada keerulisi tahkeid lahuseid on praktiliselt lõputu, mis võimaldab lõputult toota klaasi, kivi ja keraamika kõige erinevamaid variante.
- Pooljuhtide omadused mittemetall annab sellele koha elektri- ja raadiotehnika alusmaterjalina.
- Mittemetall on mittetoksiline, mis võimaldab rakendamist mis tahes tööstusharus ja samal ajal ei muuda tehnoloogilist protsessi potentsiaalselt ohtlikuks.
Materjali puudused hõlmavad ainult suhtelist haprust ja head kõvadust. Räni ei kasutata tugistruktuuride jaoks, kuid see kombinatsioon võimaldab kristallpinda korralikult töödelda, mis on mõõteriistade jaoks oluline.
Räägime nüüd räni põhiomadustest.
Omadused ja omadused
 Kuna tööstuses kasutatakse kõige sagedamini kristalset räni, on selle omadused olulisemad ja just need on toodud tehnilistes kirjeldustes. Aine füüsikalised omadused on järgmised:
Kuna tööstuses kasutatakse kõige sagedamini kristalset räni, on selle omadused olulisemad ja just need on toodud tehnilistes kirjeldustes. Aine füüsikalised omadused on järgmised:
- sulamistemperatuur - 1417 C;
- keemistemperatuur - 2600 C;
- tihedus on 2,33 g / cm3. cm, mis näitab haprust;
- soojusmahtuvus ja soojusjuhtivus pole isegi kõige puhtamates proovides konstantsed: 800 J / (kg K) või 0,191 cal / (g °) ja 84-126 W / (m K) või 0,20-0, Vastavalt 30 cal / (cm · sec · deg);
- läbipaistev pikalainelise infrapunakiirguse suhtes, mida kasutatakse infrapunaoptikas;
- dielektriline konstant - 1,17;
- kõvadus Mohsi skaalal - 7.
Mittemetalli elektrilised omadused sõltuvad suuresti lisanditest. Tööstuses kasutatakse seda funktsiooni soovitud tüüpi pooljuhtide moduleerimisel. Normaaltemperatuuril on räni habras, kuid kuumutamisel üle 800 C on võimalik plastiline deformatsioon.
Amorfse räni omadused on silmatorkavalt erinevad: see on väga hügroskoopne ja reageerib palju aktiivsemalt isegi normaaltemperatuuril.
Räni struktuuri ja keemilist koostist ning omadusi käsitletakse allpool olevas videos:
Koostis ja struktuur
Räni esineb kahes allotroopses vormis, mis on normaaltemperatuuril võrdselt stabiilsed.
- Kristall näeb välja nagu tumehall pulber. Aine, ehkki sellel on teemanditaoline kristallvõre, on aatomite vahelise liiga pika sideme tõttu habras. Selle pooljuhi omadused pakuvad huvi.
- Väga kõrge rõhu korral saate kuusnurkne modifikatsioon tihedusega 2,55 g / cm3. Kuid see etapp ei ole veel praktilist tähtsust leidnud.
- Amorfne- pruunikaspruun pulber. Vastupidiselt kristalsele vormile reageerib see palju aktiivsemalt. See tuleneb mitte niivõrd esimese vormi inertsusest, kuivõrd sellest, et õhus on aine kaetud dioksiidikihiga.
Lisaks on vaja arvesse võtta teist tüüpi klassifikatsiooni, mis on seotud ränikristalli suurusega, mis koos moodustavad aine. Kristallvõre, nagu teada, eeldab mitte ainult aatomite, vaid ka nende aatomite moodustatavate struktuuride järjestamist-nn pikamaa järjestust. Mida suurem see on, seda homogeensem on aine omaduste poolest.
- Monokristalliline- proov on üks kristall. Selle struktuur on maksimaalselt korrastatud, omadused on ühtlased ja hästi etteaimatavad. Just see materjal on elektrotehnikas kõige nõudlikum. Kuid see kuulub ka kõige kallimate liikide hulka, kuna selle saamise protsess on keeruline ja kasvumäär madal.
- Multikristalne- proov on teatud kogus suuri kristalseid terakesi. Nendevahelised piirid moodustavad täiendavaid defektitasemeid, mis vähendab proovi kui pooljuhi jõudlust ja viib kiirema kulumiseni. Multikristalli kasvatamise tehnoloogia on lihtsam ja seetõttu on materjal odavam.
- Polükristalliline- koosneb suurest hulgast teradest, mis paiknevad üksteise suhtes juhuslikult. See on puhtaim tööstusliku räni tüüp, mida kasutatakse mikroelektroonikas ja päikeseenergias. Üsna sageli kasutatakse seda toorainena mitme- ja üksikristallide kasvatamiseks.
- Selles klassifikatsioonis on eraldi koht ka amorfsel räni. Siin hoitakse aatomite paigutuse järjekorda ainult lühimatel vahemaadel. Kuid elektrotehnikas kasutatakse seda endiselt õhukeste kilede kujul.
Mittemetallist tootmine
Puhta räni saamine pole nii lihtne, arvestades selle ühendite inertsust ja enamiku nende kõrgeid sulamistemperatuure. Tööstuses kasutatakse kõige sagedamini süsinikdioksiidi vähendamist dioksiidist. Reaktsioon viiakse läbi kaarahjudes temperatuuril 1800 C. Seega saadakse mittemetall, mille puhtus on 99,9%, mis ei ole selle kasutamiseks piisav.
Saadud materjal klooritakse kloriidide ja vesinikkloriidide saamiseks. Seejärel puhastatakse ühendid lisanditest kõikvõimalike meetoditega ja redutseeritakse vesinikuga.
Ainet saab puhastada ka magneesiumsiliidiga. Silitsiid puutub kokku vesinikkloriid- või äädikhappega. Silaan saadakse ja viimane puhastatakse erinevate meetoditega - sorptsioon, rektifitseerimine jne. Seejärel lagundatakse silaan temperatuuril 1000 C. vesinikuks ja räniks. Sellisel juhul saadakse aine lisandite fraktsiooniga 10 -8 -10 -6%.
Aine kasutamine
 Tööstuse jaoks on kõige huvitavamad mittemetalli elektrofüüsikalised omadused. Selle ühekristalliline vorm on kaudse piluga pooljuht. Selle omadused määravad lisandid, mis võimaldab saada soovitud omadustega ränikristalle. Niisiis, boori, indiumi lisamine võimaldab kasvatada aukude juhtivusega kristalle ning fosfori või arseeni lisamine võimaldab kasvatada elektroonilise juhtivusega kristalle.
Tööstuse jaoks on kõige huvitavamad mittemetalli elektrofüüsikalised omadused. Selle ühekristalliline vorm on kaudse piluga pooljuht. Selle omadused määravad lisandid, mis võimaldab saada soovitud omadustega ränikristalle. Niisiis, boori, indiumi lisamine võimaldab kasvatada aukude juhtivusega kristalle ning fosfori või arseeni lisamine võimaldab kasvatada elektroonilise juhtivusega kristalle.
- Räni on sõna otseses mõttes kaasaegse elektrotehnika alus. Sellest valmistatakse transistore, fotoelemente, integraallülitusi, dioode ja nii edasi. Pealegi määrab seadme funktsionaalsuse peaaegu alati ainult kristalli pinnalähedane kiht, mis määrab pinnatöötlusele väga spetsiifilised nõuded.
- Metallurgias kasutatakse tehnilist räni nii sulamite modifitseerijana - see annab suurema tugevuse, kui ka komponendina - näiteks ja deoksüdeerijana - malmi tootmisel.
- Ultrapuhas ja rafineeritud metallurgia on päikeseenergia alus.
- Mittemetalldioksiidi esineb looduslikult väga erinevates vormides. Selle kristallilised sordid - opaal, ahhaat, karneool, ametüst, mäekristall - on leidnud oma koha ehetes. Väliselt mitte nii atraktiivseid modifikatsioone - tulekivi, kvartsi - kasutatakse metallurgias, ehituses ja raadioelektrotehnikas.
- Mittemetallist süsinik -karbiidiga ühendit kasutatakse metallurgias, instrumentide valmistamisel ja keemiatööstuses. See on laia vahega pooljuht, millel on kõrge kõvadus - 7 Mohsi skaalal ja tugevus, mis võimaldab seda kasutada abrasiivmaterjalina.
- Silikaadid - see tähendab ränihappe soolad. Ebastabiilne, temperatuuri mõjul kergesti lagunev. Need on tähelepanuväärsed selle poolest, et neist moodustuvad arvukad ja mitmekesised soolad. Kuid viimased on aluseks klaasi, keraamika, savinõude, kristalli jne tootmiseks. Võime julgelt öelda, et kaasaegne ehitus põhineb mitmesugustel silikaatidel.
- Klaas on siin kõige huvitavam juhtum. See põhineb aluminosilikaatidel, kuid teiste ainete - tavaliselt oksiidide - ebaolulised lisandid annavad materjalile palju erinevaid omadusi, sealhulgas värvi. -, fajansil, portselanil on tegelikult sama valem, ehkki komponentide erinev suhe, ja ka selle mitmekesisus on hämmastav.
- Mittemetallil on veel üks võime: see moodustab räni aatomite pika ahela kujul selliseid ühendeid nagu süsinik. Selliseid ühendeid nimetatakse räniorgaanilisteks ühenditeks. Nende rakendusala ei ole vähem tuntud - need on silikoonid, hermeetikud, määrdeained jne.
Räni on väga laialt levinud element ja sellel on erakordselt oluline roll paljudes rahvamajanduse valdkondades. Pealegi kasutatakse aktiivselt mitte ainult ainet ennast, vaid ka kõiki selle erinevaid ja arvukaid ühendeid.
See video räägib teile räni omadustest ja kasutamisest:
silikaadid. Nende hulgas on kõige levinumad alumiinisilikaadid (on selge, et need silikaadid sisaldavad alumiiniumi). Aluminosilikaatide hulka kuuluvad graniit, erinevat tüüpi savid, vilgukivi. Mittealumiiniumsilikaat on näiteks asbest.
SiO2 oksiid on taimede ja loomade eluks hädavajalik. See annab jõudu taimede vartele ja loomade kaitsekatetele. Kalasoomused, putukakarbid, liblikatiivad, linnusulged ja loomakarvad on vastupidavad, kuna sisaldavad ränidioksiidi.
3) Rhinestone
Mäekristall on värvitu, läbipaistev, tavaliselt keemiliselt puhas, peaaegu lisanditeta, omamoodi madalatemperatuuriline modifikatsioon kvartsist - SiO2, mis kristalliseerub trigonaalses süsteemis. Seda leidub üksikute kristallide või prismaatilise-kuusnurkse kujuga kristallide kujul, mis on kogutud pudelitesse, mille mass võib mõnikord ulatuda tonnini või rohkem.
Kvarts on maakoores üks rikkalikumaid mineraale, enamiku tard- ja moondekivimite kivimit moodustav mineraal. Keemiline valem: SiO2.
Kvartsisordid: värvitu, roosa kvarts, "karvane", karneool, ahhaat, "tiigrisilm", poleeritud veeris.
5) Karneooli valem - SiO2, omamoodi kaltsedoon. Keemiline koostis - SiO2 sisaldus - 90-99%; Märgitakse Fe2O3, Al2O3, MgO, CaO, H2O lisandeid. Karneool, nagu ka ahhaadid, on keerulise struktuuriga sisuliselt kaltsedoonkoostise agregaadid.
Jaspis on läbipaistmatu kvartsi sort - ränidioksiid SiO2 -, millel on kiuline struktuur, mis sisaldab laias valikus mineraale: granaate, hematiiti, püriiti jne. Seetõttu eristab jaspis oma värvivalikut, sealhulgas kõiki toone, välja arvatud puhas sinine.
7) Ametüst
Ametüstid on violetsed või punakad kvartskristallid, mis on ränidioksiid ja kuuluvad trigonaalsesse kristalsüsteemi.
Opaal on muutuva veesisaldusega (6–10%) amorfne kvarts SiO2. Opaali keemiline nimetus on ränidioksiidi polühüdraat. Opaali peamine eelis on võime kiirgada päikesevalguse mõjul järjest erinevaid kiiri, tekitades mitmekesist värvimängu. Opaale on kolme tüüpi: must opaal, millel on väga tumesinine värv ja "vilgub" värve; tuleopaal oranžikaspunane ja valge opaal.
7) Tsitriin Kivi nimi, mis on tuletatud sõnast tsitreus - "sidrun", tähistab seda tüüpi kvartsi kollast tooni, mis annab raudraua tsitriinilisandeid. Tsitriin on hea keskendumiseks ja keskendumiseks.
Jade on poolläbipaistev valge ja roheline mineraal. Mineraloogilisest seisukohast on jade ränidioksiidiühend.
9) Ahhaat on poolläbipaistva kvartsi tüüp. Keemiline valem: SiO2.
Räniühendite kasutamine:
Räni kasutatakse silikaaditööstuses:
Keraamika, klaasi ja tsemendi tootmiseks kasutatakse looduslikke räniühendeid - liiva (SiO2) ja silikaate.


Silikaatliim on laialt tuntud, seda kasutatakse ehituses kuivatina ning pürotehnikas ja igapäevaelus paberi liimimiseks.
Laialt on levinud silikoonõlid ja silikoonid - räniorgaanilistel ühenditel põhinevad materjalid.
54) Betooni ja mineraalmaterjalide korrosiooni füüsikalised ja keemilised alused.
Betooni korrosioon on kõigi mineraalsete ehitusmaterjalide ja -konstruktsioonide (betoon, raudbetoon, tellis, eterniit, silikaat, vahtbetoon ja gaseeritud betoonplokid) peamine vaenlane. Kõige tõsisem probleem on atmosfääri-keemilise teguri mõju-agressiivsete atmosfääri ainete (karbonaadid, sulfaadid, kloriidid) mõju, samuti sagedased külmumis-sulamistsüklid.
Mineraalidel põhinevad ehitusmaterjalid on kapillaarpoorsed. Agressiivse atmosfääri mõjul moodustuvad poorse struktuuri sisse kristallid, mille kasv toob kaasa pragude tekkimise. Kokkupuutel vee, soolade ja süsinikdioksiidiga - betooni korrosioon ja ehituskonstruktsioonide hävitamine.
Mineraalse pinna kaitse on ülemaailmne väljakutse mis tahes rajatise projekteerimisel, ehitamisel ja kasutamisel. See on asjakohane igat tüüpi hoonete, rajatiste ja rajatiste puhul, mida kasutatakse kaasaegses ehituses.
Elemendi tunnusjoon
14 Si 1s 2 2s 2 2p 6 3s 2 3p 2
Isotoobid: 28 Si (92,27%); 29 Si (4,68%); 30 Si (3,05%)
Räni on hapniku järel (27,6 massiprotsenti) maakoore kõige levinum element. Looduses seda vabas olekus ei esine, seda leidub peamiselt SiO 2 või silikaatide kujul.
Si ühendid on mürgised; SiO 2 ja teiste räniühendite (näiteks asbesti) väikseimate osakeste sissehingamine põhjustab ohtliku haiguse - silikoosi
Põhiseisundis on räni aatomil valents = II ja ergastatud olekus = IV.
Si kõige stabiilsem oksüdatsiooniaste on +4. Metallidega ühendites (silitsiidid) S.O. -4.
Räni saamise meetodid
Kõige tavalisem looduslik räniühend on ränidioksiid (ränidioksiid) SiO 2. See on räni tootmise peamine tooraine.
1) SiO 2 redutseerimine süsinikuga kaarahjudes temperatuuril 1800 "C: SiO 2 + 2C = Si + 2CO
2) Kõrge puhtusega Si tehnilisest tootest saadakse vastavalt skeemile:
a) Si → SiCl 2 → Si
b) Si → Mg 2 Si → SiH 4 → Si
Räni füüsikalised omadused. Räni allotroopsed modifikatsioonid
1) Kristalliline räni on hõbehall metallilise läikega aine, teemant-tüüpi kristallvõre; t. pl. 1415 "C, bp 3249" C, tihedus 2,33 g / cm3; on pooljuht.
2) Amorfne räni on pruun pulber.
Räni keemilised omadused
Enamikus reaktsioonides toimib Si redutseerijana:
Madalatel temperatuuridel on räni keemiliselt inertne, kuumutamisel suureneb selle reaktsioonivõime järsult.
1. See interakteerub hapnikuga temperatuuril üle 400 ° C:
Si + O 2 = SiO 2 ränioksiid
2. Reageerib fluoriga juba toatemperatuuril:
Si + 2F 2 = SiF 4 ränitetrafluoriid
3. Ülejäänud halogeenidega toimuvad reaktsioonid temperatuuril = 300–500 ° С
Si + 2Hal2 = SiHal4
4. Väävliauruga 600 ° C juures moodustub disulfiid:
5. Reaktsioon lämmastikuga toimub temperatuuril üle 1000 ° C:
3Si + 2N 2 = Si 3 N 4 räninitriid
6. Temperatuuril = 1150 ° C reageerib see süsinikuga:
SiO 2 + 3C = SiC + 2CO
Karborund on kõvadusega lähedane teemandile.
7. Räni ei reageeri otseselt vesinikuga.
8. Räni on hapete suhtes vastupidav. Koostoimib ainult lämmastikhappe ja vesinikfluoriidhappe seguga:
3Si + 12HF + 4HNO 3 = 3SiF 4 + 4NO + 8H 2O
9. reageerib leeliseliste lahustega, moodustades silikaate ja eraldades vesinikku:
Si + 2NaOH + H 2 = Na 2 SiO 3 + 2H 2
10. Räni redutseerivaid omadusi kasutatakse metallide eraldamiseks nende oksiididest:
2MgO = Si = 2Mg + Si02
Reaktsioonides metallidega on Si oksüdeeriv aine:
Räni moodustab s-metallide ja enamiku d-metallidega silitsiide.
Selle metalli silitsiidide koostis võib olla erinev. (Näiteks FeSi ja FeSi 2; Ni 2 Si ja NiSi 2.) Üks kuulsamaid ränidioksiide on magneesiumsiliid, mida on võimalik saada lihtsate ainete otsese interaktsiooni teel:
2Mg + Si = Mg2Si
Silaan (monosilaan) SiH 4
Silaanid (ränidioksiidid) Si n H 2n + 2, (vrd alkaanidega), kus n = 1-8. Silaanid on alkaanide analoogid, mis erinevad neist -Si-Si- ahelate ebastabiilsuse poolest.
Monosilane SiH 4 on värvitu gaas, millel on ebameeldiv lõhn; lahustub etanoolis, bensiinis.
Saamise meetodid:
1. Magneesiumsilikaadi lagunemine vesinikkloriidhappega: Mg 2 Si + 4HCI = 2 MgCI 2 + SiH 4
2. Si -halogeniidide redutseerimine liitiumalumiiniumhüdriidiga: SiCl 4 + LiAlH 4 = SiH 4 + LiCl + AlCl 3
Keemilised omadused.
Silaan on võimas redutseerija.
1. SiH 4 oksüdeeritakse hapnikuga isegi väga madalatel temperatuuridel:
SiH 4 + 2O 2 = Si02 + 2H 2O
2. SiH 4 hüdrolüüsub kergesti, eriti leeliselises keskkonnas:
SiH4 + 2H20 = Si02 + 4H2
SiH 4 + 2NaOH + H20 = Na2Si03 + 4H2
Räni (IV) oksiid (ränidioksiid) SiO 2
Ränidioksiid on erinevates vormides: kristalne, amorfne ja klaasjas. Kõige tavalisem kristalne vorm on kvarts. Kvartskivimite hävitamisel moodustuvad kvartsliivad. Kvartsist monokristallid on läbipaistvad, värvitu (mäekristall) või värvitud erinevate värvidega lisanditega (ametüst, ahhaat, jaspis jne).
Amorfne SiO 2 esineb opaalmineraali kujul: kunstlikult saadakse silikageel, mis koosneb kolloidsetest SiO 2 osakestest ja on väga hea adsorbent. Klaasist SiO 2 on tuntud kui kvartsklaas.
Füüsikalised omadused
SiO 2 lahustub vees väga vähe ja praktiliselt ei lahustu orgaanilistes lahustites. Ränidioksiid on dielektrik.
Keemilised omadused
1. SiO 2 on happeline oksiid, seetõttu lahustub amorfne ränidioksiid aeglaselt leeliste vesilahustes:
SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O
2. SiO 2 interakteerub ka aluseliste oksiididega kuumutamisel:
SiO 2 + K 2 = K 2 SiO 3;
SiO 2 + CaO = CaSiO 3
3. Olles lendumatu oksiid, asendab SiO 2 süsinikdioksiidi Na 2 CO 3 -st (sulatamise teel):
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2
4. Ränidioksiid reageerib vesinikfluoriidhappega, moodustades vesinikfluorosiidhappe H 2 SiF 6:
Si02 + 6HF = H2 SiF6 + 2H20
5. Temperatuuril 250 - 400 ° С SiO 2 interakteerub gaasilise HF ja F 2 -ga, moodustades tetrafluorosilaani (ränitetrafluoriid):
Si02 + 4HF (gaas) = SiF4 + 2H20
Si02 + 2F2 = SiF4 + O2
Ränihape
Teatud:
Ortosilicic H4 SiO 4;
Metasilicic (räni) hape H 2 SiO 3;
Di- ja polüsiidhapped.
Kõik ränihapped lahustuvad vees vähe ja moodustavad kergesti kolloidlahuseid.
Saamise meetodid
1. Leelismetallisilikaatide lahuste hapetega sadestumine:
Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl
2. Klorosilaanide hüdrolüüs: SiCl 4 + 4H 2 O = H 4 SiO 4 + 4HCl
Keemilised omadused
Ränihapped on väga nõrgad happed (nõrgemad kui süsihape).
Kuumutamisel dehüdreeritakse, moodustades lõpptootena ränidioksiidi.
H 4 SiO 4 → H 2 SiO 3 → SiO 2
Silikaadid - ränihappe soolad
Kuna ränihapped on äärmiselt nõrgad, hüdrolüüsuvad nende soolad vesilahustes:
Na2Si03 + H20 = NaHSiO3 + NaOH
SiO 3 2- + H 2 = HSiO 3 - + OH - (leeliseline keskkond)
Samal põhjusel, kui süsinikdioksiid juhitakse läbi silikaatlahuste, eemaldatakse neist ränihape:
K 2 SiO 3 + CO 2 + H 2 O = H 2 SiO 3 ↓ + K 2 CO 3
SiO 3 + CO 2 + H 2 O = H 2 SiO 3 ↓ + CO 3
Seda reaktsiooni võib pidada silikaatioonide kvalitatiivseks reaktsiooniks.
Silikaatide hulgas on hästi lahustuvad ainult Na 2 SiO 3 ja K 2 SiO 3, mida nimetatakse lahustuvaks klaasiks, ja nende vesilahuseid nimetatakse vedelaks klaasiks.
Klaas
Tavalisel aknaklaasil on koostis Na 2 O CaO 6SiO 2, see tähendab, et see on naatriumi ja kaltsiumsilikaatide segu. See saadakse Na2CO3 sooda, lubjakivi CaCO 3 ja liiva SiO 2 sulatamisel;
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O CaO 6 SiO 2 + 2CO 2
Tsement
Pulbriline sideaine, mis moodustab veega suheldes plastmassi, mis aja jooksul muutub tahkeks kivilaadseks korpuseks; põhiline ehitusmaterjal.
Kõige tavalisema portlandtsemendi keemiline koostis (massiprotsentides) on 20 - 23% SiO 2; 62 - 76% CaO; 4-7% Al203; 2-5% Fe203; 1-5% MgO.