Põlemise soojusteooria. Põlemisteooria alused. Põlemistüübid, nende omadused
Põlemine- põlevate ainete kiiresti kulgev keemiline interaktsioon oksüdeerijaga, millega kaasneb suure hulga soojuse eraldumine ja ere kuma (leek). Põlemine on võimalik ainult kolme teguri olemasolul: põlev aine, oksüdeeriv aine ja soojusallikas.
Soojuse allikas(tuli) võib olla lahtine leek, säde, hõõrdumisest kuumutatud kuumus (rihmaajamis rihmad), löök, surve. Soojuseallikaks võib olla ka elektriline (juhtide kuumenemine, kaar), keemiline ja päikese kiirgusenergia.
Oksüdeerivad ained on kloor, fluor, broom. Kõige tavalisem oksüdeerija on õhuhapnik, põlemisprotsess sõltub selle sisaldusest õhus. Kui õhus on rohkem kui 14-16% hapnikku, siis täheldatakse stabiilset põlemist. Alla 14% hapnikusisalduse juures täheldatakse hõõgumist ja alla 8-10% hapnikusisalduse juures lakkab ka hõõgumine.
Põlev aine... Need võivad olla gaasid (ammoniaak, atsetüleen, vesinik), vedelikud (bensiin, atsetoon, alkohol), tahked ained (kivisüsi, puit). Et tulekahju tekiks tahke aine või vedel, on vaja kasutada soojusallikat nende soojendamiseks sellisele temperatuurile, et nende pindadelt tekiks intensiivne tuleohtlike aurude eraldumine. Teatud kontsentratsiooni saavutamisel need aurud süttivad. Põlemisel tekkivad gaasid ei muuda nende agregatsiooni olekut.
Põlemisel on järgmised tüübid: 1) välk; 2) süüde; 3) isesüttimine; 4) isesüttimine; 5) hõõguv; 6) plahvatus.
1... Välklamp nimetatakse õhuhapniku segu koheseks põlemiseks aurude, gaaside, tolmuga, millega ei kaasne kokkusurutud gaaside moodustumist. Leekpunkt on kõige kõrgem madal temperatuur põlev aine, mille pinna kohal tekivad aurud või gaasid, mis võivad süttimisallikast lekkida, kuid järgnevaks stabiilseks põlemiseks on nende tekkekiirus ebapiisav.
Sõltuvalt selle temperatuuri väärtusest jaotatakse tuleohtlikud vedelikud:
a) tuleohtlik (süttivad vedelikud - bensiin, atsetoon, alkohol) - t välk ≤ + 45 ° С;
b) tuleohtlikud vedelikud (GZh - õlid, diislikütus, kütteõli) - tp> + 45 ° С.
2. Süütamise teel nimetatakse aine stabiilseks pidevaks põlemiseks soojusallikast. Põlevaine minimaalset temperatuuri, mille juures see süttib süüteallikast ja jätkab põlemist pärast selle eemaldamist, nimetatakse süttimistemperatuuriks. See on leekpunktist kõrgem.
Põlevate ainete kontsentratsioon õhus, mille juures on võimalik süttimine või plahvatus, on teatud piirides: madalam on CWP ja ülemine ERW jaoks. Põlevsegude süttimine on võimatu kontsentratsioonidel, mis on alla CWP (segus ei ole piisavalt põleva aine molekule) ja üle CWC (segus pole piisavalt hapniku molekule). Mida suurem on erinevus ERC ja UWP vahel, seda ohtlikum on aine. Nende parameetrite väärtused võivad väheneda näiteks tolmu-õhu segu (PLVS) niiskuse suurenemisega, näiteks õhu segu suhkru, jahu, söetolmuga.
Toome näiteid NWP ja ERW väärtuste kohta mitmete gaaside ja vedelike aurude kohta:
atsetüleen 3,5-82%;
Maagaas 3,8-19,2%;
Bensiin 1-6%;
Vingugaas 12,8-75%.
3.Isesüttimine- ainete süttimisprotsess välisest allikast (leegist, kuumutatud või hõõguvast kehast) ilma sellega otsese kokkupuuteta süttimistemperatuuril. See temperatuur langeb rõhu suurenemisega ja enamiku põlevate gaaside puhul on vahemikus 400–700 ° C, puidu puhul - 340–400 ° C; kivisüsi - 400-500 ° C. Isesüttimise näide: puidu, paberi kuumutamine ja sellele järgnev süütamine, mis asub lahtise leegi (sellega kokku puutumata) või hõõguvate esemete (süsi, avatud spiraal kütteseade).
4. Isesüttimine ained tekivad aines (materjalis) endas toimuvate füüsikaliste, keemiliste ja bioloogiliste reaktsioonide tulemusena, mis põhjustavad süttimisallika puudumisel põlemist.
Suures koguses märja teravilja, heina, põhu ladustamisel ja nende ebapiisava ventilatsiooni korral nende materjalide sees toimuvad biokeemilised protsessid (lagunemine) koos soojuse eraldumisega. Nende materjalide temperatuur tõuseb, nende suur mass (rikk, heinakuhjas) takistab tekkiva soojuse hajumist keskkond, mis põhjustab tulekahju. Sellised materjalid tuleks enne ladustamist hästi kuivatada. Samuti süttib iseeneslikult kokkupuude õliplekke sisaldavate ja õhutamata kokkukuhjatud kangastega (riided, puhastuslapp). Seetõttu tuleks tööriided riputada selliselt, et oleks vaba õhu juurdepääs, ning õlised kaltsud tööruumidest kiiresti eemaldada.
Sõltuvalt reaktsioonikiirusest omandab põlemisprotsess vormi lagunemine(kiirus mitu cm / s), tegelikult põlemine(mitu m / s) ja plahvatus(mitusada tuhat m/s).
5. Plahvatus- aine füüsikalise ja keemilise oleku järsk muutus kõrge temperatuuri, rõhu, keemiliste reaktiivide mõjul. Plahvatuse ajal suureneb moodustunud gaaside ja aurude maht järsult, eraldub tohutul hulgal energiat, mis lööklaine kujul on võimeline sooritama. mehaaniline töö(hävitada hooneid, rajatisi, vigastada inimesi).
Materjalide põlemine võib olla täielik või mittetäielik. Täielikul põlemisel (hapniku liig) tekivad mittesüttivad produktid (CO 2 ja H 2 O) Mittetäieliku põlemise korral (O 2 puudus) tekivad mittetäielikud oksüdatsiooniproduktid (CO, alkoholid, happed). Need on mürgised ja plahvatusohtlikud. Seetõttu tuleks kütuse põlemisprotsessi korraldamisel (kateldes, ahjudes) varustada ahjus piisavas koguses hapnikku.
Põlemise molekulaarenergia
Enamik põlemisprotsesse ühendab vesinikku ja süsinikku sisaldavaid kütuseid õhuhapnikuga.
Enne põlemisteooria füüsikaliste ja matemaatiliste aluste käsitlemist proovime molekulaarsel tasandil mõista, kust pärineb põlemisenergia, mille vabanemisest sõltub kõik muu: gaasi kuumutamine, aktiivsete ainete ilmumine. selles olevad keemilised keskused jne.
Vaatame, millised on süsiniku ja vesiniku ja atmosfäärihapniku kombinatsiooni peamiste reaktsioonide kuumused.
Kirjutame vastavalt tabelis olevatele andmetele. 3.1 tahke süsiniku, näiteks grafiidi, järjestikuse oksüdatsiooni reaktsioonide energiabilanss:
Seega vabaneb tahke süsiniku kogu oksüdatsioonireaktsioonis 386 kJ / mol:
Vesiniku hapnikuga ühinemisel vabanev energia on samuti suuruselt sarnane:
CO molekul on võib-olla kõige vastupidavam, selle sidumisenergia on 1016 kJ / mol. (Tugevuselt järgmine on N2 molekul sidumisenergiaga 892 kJ / mol. Mõlemal molekulil on kolm paari siduvaid elektrone, keemilises mõttes - kolm valentssidemeid. CO molekulis läheb kõigepealt üks elektron O-st C-sse, pärast mis O + ja C- muutuvad sarnaseks lämmastikuaatomitega Seda kinnitab dipoolmomendi olemasolu CO molekulis.) CO2 molekulis on teise hapnikuaatomi side nõrgem: tabeli järgi. 3.1
Hapniku sidumisenergia nendes ühendites on võrreldav hapniku lähtemolekuli sidumisenergiaga. Sest
siis moodustab üks hapnikuaatom ainult 240 kJ / mol. Hapniku molekuli madal seondumisenergia on selle keemilise aktiivsuse põhjuseks ja oksüdatsiooni energiaallikana kasutamise põhjuseks.
Grafiidi (nagu ka teemandi ja amorfse süsiniku) kristallvõres oleva süsinikuaatomi sidumisenergia on väga kõrge. Reaktsiooni suhteliselt madal energia С (s) + 0,5О2 = = СО + 98 kJ / mol on kahe väga suure koguse vahe: sidumisenergiast СО (256 kJ / mol) tuleb lahutada pool O2 aatomiteks purustamise energia (59 kJ / mol) ja lahutage süsinikuaatomi aurustumissoojus. Tegelikult määratakse nii aurustumissoojus, mis on võrdne 671 kJ / mol. See on ka väga suur väärtus.
Tahke süsiniku ja gaasilise vesiniku muundamine süsivesinikkütusteks toimub vähese energiamuutusega. Teisest küljest, kui hapnik viiakse alkoholide, aldehüüdide ja ketoonide, orgaaniliste hapete, süsivesikute orgaanilistesse molekulidesse, vabaneb peaaegu sama palju energiat, kui vabaneb täielikul põlemisel (CO2-ks ja H2O-ks), loomulikult, kui võrdne kogus hapnikku tarbitakse. Seetõttu võib ligikaudselt eeldada, et mis tahes fossiilkütuse täielikul põlemisel eraldub 419–500 kJ / mol tarbitud hapnikku. Ainsad erandid on mõned endotermilised, energiarikkad ühendid, nagu atsetüleen ja tsüanogeen, nende põlemissoojus on kõrgem.
Mittetäielik põlemine on energeetiliselt ebasoodne mitte ainult kütusemolekuli, vaid ka kasutatud hapniku molekuli kohta. Reaktsioonis 2Q (tv) + O2 = 2CO eraldub vesiniku põletamisel 466 ja CO põletamisel 526 asemel vaid 210 kJ / mol.
C-aatomi tugev side tahkes süsinikus takistab süsiniku aurustumist. Süsinik lahkub tahkest olekust ainult koos hapnikuga CO või CO2 kujul.
Mittetäieliku põlemise ja madala temperatuuri korral on reaktsioon 2CO = CO2 + C (s) + 41 kJ / mol energeetiliselt soodne ainult tahke süsiniku kohta arvutatuna. Vaba süsinikuaatomi jaoks arvutatuna on vastaval reaktsioonil 2СО = СO2 + С - 129 kJ / mol suur energiabarjäär. Seetõttu tekib põlemisel tahm ja tahm ainult süsiniku karkassiga orgaaniliste molekulide lagunemisel, kuid mitte CO-st.
Nüüd pöördume lämmastikuga seotud oksüdatsioonireaktsioonide poole.
Lämmastiku molekul N2 on väga tugev - selle dissotsiatsioonienergia on 226 kJ / mol. Seetõttu on N2 ja O2 muundamise reaktsioon 2NO-ks endotermiline ja saab termodünaamilistel põhjustel toimuda ainult kõrgetel temperatuuridel.
Kõrgemate oksiidide (NO2, N2O3, N2O4, N2O5) moodustumine lämmastikust ja hapnikust toimub praktiliselt ilma energiamuutusteta (võrreldes N2 ja O2 sidumisenergiaga). Seetõttu on energia seisukohalt lämmastikuga ühenditesse (CH3-ONO2 - nitroeeter, CH3 (CeH2) (NO2) 3 - trinitrotolueen) pakitud hapnik praktiliselt samaväärne gaasilise hapnikuga. Orgaanilisse molekuli sisse ehitatud, kuid lämmastikuga seotud hapnik võimaldab luua aineid, mis eraldavad molekuli ümberkorraldamisel N2 moodustumisel ja hapniku üleminekul CO2 ja H2O molekulideks rohkem energiat. Sel põhjusel kasutatakse raketikütuste ja lõhkeainetena ühendeid, milles hapnik on seotud lämmastikuga (ja ka klooriga, rühmades CIO3, ClO4).
Need on üldised ideed molekulaarne energia põletamine.
Jätkame juttu keemia klassikalistest alustest, mis on vajalikud iga harjutava pürotehnika jaoks. BA-BAH tuletab meelde, et mis tahes praktiline tund pürotehnika on ohtlik ettevõtmine, kui see ei põhine rangel teoorial. Soovitame neil lugejatel, kes usuvad, et millest võib saada nende elukutse, läbida täieõiguslik õppekursus, näiteks Sergiev Posadi rakenduskeemia uurimisinstituudis.
Viidates ühenditele, osutasime, et nende peamiseks põhjuseks on elementide omavaheline sugulusaste. Vastasel juhul jäävad elemendid mõne aine juuresolekul ükskõikseks ja alluvad enam-vähem tugevale soovile ühineda teistega. Nii näiteks neelab lubi kergesti rasket kloorigaasi, st. ühineb sellega, moodustades kloorlubja; elavhõbe ühineb sulaväävliga, moodustades tuntud helepunase aine nimega kinaver. Kaneel (Zinnober) võib laguneda uuesti väävliks ja elavhõbedaks, kui kombineerida seda ainega, mille üks koostisosadest (näiteks väävel) tunneks tugevamat külgetõmmet kui sõber (st elavhõbe), misjärel ja teine millegagi seotud element saab vabaneda samas järjekorras neljanda aine abil. Selline vabanemine või vabanemine ei ole alati täielik, kuid enamasti piisab ka osalisest vabanemisest, mida saab teoreetiliselt arvutada valemite abil.
Üks väga levinud afiinsuse tagajärgi, mida korratakse igal sammul, on omadus nimega "hügroskoopsus", st. võime niisutada, niisutada, muidu - niiskust sisse tõmmata ja happe-vesiniku ühendeid moodustada. Seda omadust eristavad paljud ained ja, muide, lauasool ja väävelhape, mis on paigutatud aknaraamid endasse niiskust tõmbama; kustutamata lubi, keeb kokkupuutel veega; želatiin, millega alkohol dehüdreeritakse jne. Pürotehnika puhul on hügroskoopsus vastik omadus, millega tuleb arvestada. Näiteks strontsiumkloriidi ja nitraati ei ole äärmise hügroskoopsuse tõttu alati võimalik kasutada, kuigi neil ainetel on väärtuslikud pürotehnilised omadused; ja üldiselt tuleb kõiki koostisi hoolikalt niiskuse eest kaitsta. Kuid kõige olulisemat rolli pürotehnilises keemias mängivad ühendid, mida nimetatakse "põlemiseks" (Verbrennung, põlemine).
Väljendi "põletamine" või "põletamine" all kõige laiemas tähenduses tähendab keemia üldiselt kahe keha iga keemilist kombinatsiooni kolmanda moodustamiseks; lähimas tähenduses tähendab see keha ühendust hapnikuga.
Selguse huvides pöördume, nagu tavaliselt, eksperimentide poole. Sega teatud kogus rauaviilud teatud koguse väävliga ja kuumutage segu veidi; siis see segu kohe kuumeneb ja sulab kiiresti. Sel viisil saadud sulam ei ole enam väävel ja mitte raud: raud põletatakse väävliga, s.o. sellega keemiliselt kombineeritud ja selle tulemusena tekkis uus keha - raud või väävel (olenevalt ühe või teise koostisosa ülekaalust) püriit.
Sulata väävel tiiglis, aja sulam keema ja viska sinna vasktraadi tükid: see traat põleb väävliga, andes välja imelise punase värvuse; tulemuseks on spetsiaalne ühend – vasksulfiid ehk vase läige. Samamoodi saab seda põletada vasega, st. kombineeri sellega palju kehasid: plii, tina, tsinki jne.
Väävelsüsinik on värvitu, tugevalt haisev vedelik, mis ei külmu isegi temperatuuril 48 ° R (süsinikdisulfiidi sulamistemperatuur (CS 2) = -112 ° C) - moodustub väävliaurude ja kuumade söe kombinatsioonist. Mõlemad põhikehad põlevad, st koosnedes muutuvad nad vedelikuks.
Sama sarnasus on täheldatav metallide (raud, vask, tsink, antimon, arseen jne) puhul, mis on kuumuses juba mainitud gaasiga, mida nimetatakse "klooriks": raud, vask, tsink jne. põletada klooriga raudkloriidiks, vaskkloriidiks, tsinkkloriidiks, pliikloriidiks jne, arendades samal ajal tugevat kuumust ja kiirgades erilist valgust. Sulaväävel põleb kokkupuutel kloorigaasiga sinise leegiga ja muutub väävelkloriidiks; purustatud antimon või peenarseen, asetatud klooriga täidetud anumasse, süttib ise ja ühineb arseenkloriidiks või antimonkloriidiks.
Mõlemal juhul kombineeriti sarnasuse tõttu erinevaid kehasid, kord väävliga, kord klooriga ning ilmnes soojuse ja valguse eraldumine.
Täpselt samadel tingimustel tekivad erinevate kehade ühendid erineva gaasiga - hapnikuga.
Ühendage retort ( klaasist anum destilleerimiseks), millesse asetatakse elavhõbe välisõhu eest hermeetiliselt suletud klaaskattega. Kuumutage elavhõbe peaaegu keemistemperatuurini: elavhõbe ei põle, kuid kaotab oma metallilise läike ja endise hõbedase värvuse ning tilk-vedeliku oleku - see muutub punakaks pulbriks, mis on seotud vana metalliga. samamoodi nagu kivisüsi puitu. Kui olete enne katse algust täpselt kaalunud nii kapoti all oleva elavhõbeda kui ka õhu ja nüüd mõlemad uuesti, siis selgub, et õhus ja pulbris on kaalupuudus. on ülekaaluline ja niisama... Kui näiteks kapotialune õhk kaalus täpselt 1000 grammi, siis praegu vaid 767 grammi; kuid pulber kaalub 233 grammi rohkem kui elavhõbe. Nüüd tehke vastupidine katse: asetage pulber väikesesse retorti, mis on ühendatud pooleldi veega täidetud klaaspudeliga. Kuumutage retorti kange alkoholi tulel: pulber muutub auruks, mis vett läbides jaguneb kaheks osaks: metalliliseks sademeks, mis koosneb puhtast tilk-vedelast elavhõbedast ja hapnikust, mis koguneb silindrisse.
Ka hapnikul on sama afiinsus nagu kuumal elavhõbedal kuuma raua või sulavase suhtes: kokkupuutel õhuga immuvad need metallid pinnale ahnelt õhus sisalduva hapnikuga ja moodustavad vase või raua katlakivi (räbu), st. ... raua või vase "oksiid" (ühend hapnikuga), eraldades samal ajal erksavärvilisi sädemeid.
Kõigil neil juhtudel ilmnes sama nähtus: seos hapnikuga ehk nende kehade oksüdatsioon (oksüdatsioon) – mitte ainult soojuse mõjul, vaid ka soojuse ja valguse eraldumisega, nii et soojus ja valgus, s.o. see, mida tavaliselt nimetatakse "põletamiseks", on kõrvalmõju, otsene tagajärg või õigemini jõuline ilming, mida vanad pidasid eriliseks elemendiks, mille põhimõtet nad nimetasid "flogistoniks".
Kuid oksüdatsioon võib toimuda mitte ainult ilma tulekeskkonnata, vaid isegi ilma märgatava soojuse eraldumiseta: kui raud puutub kokku õhuga, kaetakse see roostega. See rooste pole midagi muud kui oksüdatsiooniprodukt, nimelt raudoksiid või põletatud raud.
Põlemisprotsess jäi ilma märgatava soojuse eraldumiseta ainult seetõttu, et oksüdatsioon ise oli väga aeglane. Puidu oksüdeerumine on mõnevõrra märgatavam: mäda helendab pimedas; kui paned käe mädahunnikusse, siis tunned sooja; hunnik ise väheneb iga päevaga; teisisõnu, puu põleb (hõõgub) aeglaselt õhus.
Veelgi märgatavam on sissevool värske õhk hõõgumise ajal: kui õhujuga puhuda kuumadele sütele või aeglaselt hõõguvale puidule (näiteks puhutava karvaga), siis tekib kohe leek. Protsess on järgmine: puit sisaldab kahte põlevat keha – süsinikku ja vesinikku; esimene ühineb hapnikuga ja muutub põlemisel süsihappegaasiks ehk süsihappegaasiks ning teine hapnikuks ehk veeks.
Ükskõik milline põlev materjal, v igapäevane elu nimetatakse kütuseks või valgustusmaterjaliks, põleb samade reeglite alusel. Näiteks rasv ja õli koosnevad peamiselt süsinikust ja vesinikust; nii ühel kui teisel on oluline afiinsus hapnikuga ning kogu põlemisprotsess, s.o. Oksüdatsioon on see, et hapnik lagundab põleva aine selle koostisosadeks ja ühineb igaühega neist eraldi.
Täpselt samasugune oksüdatsioon toimub ka loomakehas: lämmastikku sisaldavad (rasvad) kehaosad oksüdeeruvad ehk põlevad läbi kokkupuutel hapnikuga, mille juhiks on veri ja tulemuseks on loomne soojus.
Kuid nii nagu oksüdatsioon võib olla väga aeglane, võib see olla ülikiire ja energiline. Punane fosfor näiteks lamades õues, mitte ainult ei hõõgu ja hõõgub, vaid ka valatakse sisse suur hulk, sulab aeglaselt ja lõpuks süttib (isesüttimine). Väikseim keemiliselt puhta raua pulber süttib kokkupuutel välisõhuga. Lõpuks laguneb metallnaatrium vette sattudes kohe selle koostisosadeks, et absorbeerida vees sisalduvat hapnikku ja pealegi nii jõuliselt, et eralduv soojus on võimeline süütama teise gaasi, vesiniku. , mis vabaneb naatriumi ja hapniku koosmõjul. Nii süttib vesinik värvitu leegiga ja taasühendades atmosfäärihapnikuga, muutub taas veeks. Seetõttu sisaldub naatrium all mineraalõli aastast see õli on süsivesinike ühend, mis ei sisalda hapnikku.
Kõigest ülaltoodust saab teha mitmeid kaalukaid järeldusi:
- See, mida me igapäevaelus nimetame põletamiseks, s.t. leegi, valguse ja soojuse ilmumiseks on vaja kahte keha: põlevat materjali ja hapnikku.
- Põlemisprotsess ise seisneb esiteks põlevmaterjali lagunemises koos hapnikuga ühinevate osade vabanemisega ja teiseks selle kombineerimise protsessis, s.o. oksüdatsioonis. Põlevate ainete oksüdatsiooniprodukt piisava kuumutamisega on peamiselt nende ainete muundumine süsihappeks ja veeks.
- Sest looduses ei esine hapnikku kunagi isoleeritult, siis kombineerimisel eraldab põlev materjal selle atmosfäärist, veest või mis tahes muust keerulisest kehast, mis sisaldab hapnikku; seda silmas pidades nimetatakse hapnikku eraldavaid kehasid oksüdeerijateks, oksüdeerunud kehasid alusteks ja aineid, mis põhjustavad või suurendavad hapniku vabanemist, lagundajateks. Pürotehniliste preparaatide ja ilutulestiku segude koostises on tavaliselt nende kolme rühma esindajad, kuid on ka erandeid: teatud juhtudel piisab alusest ja oksüdeerivast ainest (näiteks alumiiniumist kaaliumpermanganaadiga); muudel, aga väga harvadel juhtudel, ainult üks alus, kui see on piisavalt hapnikuga rikastatud (näiteks magneesium, lükopoodium jne).
- Ilma oksüdeeriva aine osaluseta alus ei põle, kuid kui kinnitate sellele ainet, mis võib alusega ühineda ja seda lagundada, muutub segu tuleohtlikuks. Sellised alused, mis iseenesest ei ole süttivad, on: tsingi, naatriumi, plii, baariumi, kaaliumi, strontsiumi, kloori ja lämmastikhappe soolad jne. Põlevad lisandid, mis aitavad kaasa aluse lagunemisele, on: väävel, kivisüsi, tahm, suhkur, tärklis, dekstriin, šellak, kummilakk, seapekk jne. Näiteks soolapeet (kaaliumnitraat): iseenesest sool ei põle, aga kui segada see väävliga, saate põleva segu, sest väävel lagundab nitraate ja võtab sealt hapnikku, millega ühinedes moodustab väävelhapet. Sama ilmneb ka siis, kui väävlit kombineeritakse bertolleti soolaga (Kali cliloricum) või kaaliumpermanganaadiga (Kali hypemanganiucum). Kui kompositsioon on moodustatud söest, tahmast või tselluloosist alusena väävli ja nitraadi seguga, siis soolpeeter toimib oksüdeeriva ainena ja väävel lagundajana. Protsess on järgmine: kivisüsi lagundab nitraate, ühinedes selle lämmastikhappe hapnikuga ning hapnik ja kivisüsi ühinevad, moodustades gaasilise süsihappe ning eraldub lämmastik. Väävel seevastu soodustab lagunemist ja mis peamine, takistab süsihappe ja kaaliumi kooslust: samamoodi moodustaks ühend tahke keha – kaaliumkloriidi. Ilma väävlita muutuks pool süsihappest tahkeks ühendiks.
- Põlemine on mõeldamatu ilma hapnikuta, seetõttu petrooleumi all hoitud naatrium ei põle; hermeetiliselt suletud kella all süüdatud fosfor kustub, kui saadaolev hapnikuvaru on ammendunud (umbes 1/5 kella all olevast kuupõhu kogusisaldusest); süsinikuga täidetud "Koera grotti" pandud loomad lämbuvad ja. jne.
Kuid kuigi igapäevaelus toimib atmosfääriõhk peamise hapnikureservuaarina, osutab keemia paljudele teistele oksüdeerijatele, mille kaudu on võimalik saavutada põlemist nii vee all kui ka kosmoses - kas täiesti õhuta või varustatud gaasidega, milles puudub üks hapnikuaatom... Sellised oksüdeerijad, mis on võimelised vabastama piisavas koguses hapnikku kompositsiooni täielikuks põlemiseks ilma atmosfääriõhu osaluseta, on salpeet, berthollet' sool ja mitmed teised juba mainitud kehad. Tänu näiteks salpetrile omandab püssirohi võime põleda relva või kahuri suuosas ilma atmosfääriõhu osaluseta; Põlemine vee all on mõeldav eeldusel, et segu sisaldab piisavalt tugevat oksüdeerijat mitte ainult kompositsiooni täielikuks põlemiseks, vaid ka temperatuuri hoidmiseks vajalikul kõrgusel põlemisprotsessi ajal vee all.
Eeltoodu põhjal märgime, et põlevate ainete (näiteks kütuse) muundumine gaasiks piisaval kõrged temperatuurid võib toimuda neljal tingimusel: a) kuumutamine ilma juurdepääsuta õhule ja järelikult hapnikule (kivisüsi, koks, luminestsentsgaas); b) kuumutamine keemiliselt seotud hapniku (H 2 O, CO 2) juuresolekul: vesigaas; c) piiratud vaba hapniku (õhu) sissevooluga: generaatorigaas; d) piisava õhu juurdepääsuga (tavaline kamin) või suurendatud hapnikuvarustusega (tõmbetuulega). - Mida jõulisemalt oksüdatsiooniprotsess toimub ning mida tihedam on aluse keemiline afiinsus oksüdeeriva aine ja lagundajaga, seda tugevam ja kiirem on valguse ja soojuse avaldumine. Eespool märgiti veel ühte asjaolu: muudel juhtudel toimub meelevaldne oksüdeerumine (lagunemine, rooste, isesüttimine), teistel juhtudel on ühendi tekitamiseks vaja temperatuuri tõsta (objekti kuumutada) teatud kiiruseni. kuumade metallide oksüdeerimine, nende kombineerimine kloori ja väävliga, küünla, puidu, lambi, petrooleumi põletamine, püssirohu süütamine jne).
Lisaks: protsessi edasist kulgu saab läbi viia kas kiiresti või aeglaselt.
Seetõttu on vaja eristada põlevmaterjali tuletundlikkuse (st oksüdatsiooni välise ilmingu) kaht erinevat omadust: süttivus ja põlevus. Esimene tähistab temperatuuri, mille juures toimub süttimine (oksüdatsiooni algus) ja teine tähistab oksüdatsiooniprotsessi enda toimumise kiirust. Pürotehnika puhul on vaja täpselt teada nii üht kui ka teist, sest nendest teadmistest sõltub täielikult koostiste keemiline hinnang nii nende süttimise kui ka valguse intensiivsuse ja põlemise kestuse osas.
Soojusest põhjustatud keemiliste nähtuste kohta märgib Rudolf Wagner järgmist: "Teadus keemiliste ühendite ja lagunemise termiliste nähtuste kohta," termokeemia ", ei suuda veel kaugeltki seletada erinevaid lagunemis- ja valmistamismeetodeid. keemiatööstused, kuid see annab juba vihjeid keemiliste reaktsioonide suurema või väiksema tõenäosuse ja teostatavuse kohta, kuna Üldiselt on kõige lihtsam saada ühendeid, mis tekivad soojuse eraldumisel, samas kui soojuse neeldumisel tekkiv reaktsioon on enamikul juhtudel palju raskem.
Soojusühik on kogus, mis on vajalik vee massiühiku soojendamiseks 0 kuni 1 kraadi Celsiuse järgi. Kümnendsüsteemi järgi on kaaluühikuks gramm (cm 3); keemilist soojusühikut, mida nimetatakse kaloriks, tähistatakse sümboliga "cal" ja 1000 kalorit sümboliga "Cal". Sümbol "K" (kg) tähistab soojushulka, mis vabaneb 1 g veest selle keemistemperatuurist külmumistemperatuurini jahutamisel. Soojuse mehaaniline ekvivalent on 425 kg / m3.
Põlemismõjud ja -produktid
Täielikku põlemist ei eksisteeri: need kütuse koostise osad, mis pole muutunud gaasideks, moodustavad suitsu ega setteid. Suits pole midagi muud kui põlemata materjal, mis on muudetud peeneks tolmuks ja mida õhuvool kannab. Selliseks kehaks on muuhulgas tahm (põlemata puu jääk), tahm (põlemata rasvkeha jääk), kivisöel köetav piibusuits (mis ripub tehaselinnade kohal tuhandete poodide kaupa ja mida nüüd kasutatakse ära tervete ühiskondade poolt) jne. Sade moodustab kõige sagedamini mitte ainult põlemata, vaid ka mittesüttiva (tulekindla) keemilise ühendi.
Seega lähim probleem pürotehnika seisneb selliste koostiste valmimises, mis põleksid võimalikult väikese suitsu ja setetega.

Põlemisel tekib tulekahju leekide või sädemete kujul; gaaside leek iseenesest ei paista üldse (nagu näiteks vesiniku põletamine, kui naatrium on vette kastetud); selle valgus ja värvus saadakse tänu tihedamate kehade olemasolule tules. Nii näiteks on lambigaasi kollane tuli tingitud sellest, et see gaas koosneb vesinikust ja süsinikust; vesinikul on suurem oksüdatsioonivõime kui süsinik ning see põleb kiiremini ja täiuslikumalt ning süsi, mis koguneb tulekahjus üleliigselt, annab leegile heleda ja kollase värvi. Seega, et teada saada, kas mõni leek suitseb, piisab, kui torgata keskele, kus õhk on kõige vähem ligipääsetav, mõni võõrkeha: see kaetakse kohe tahmakattega.
Et leeki valgustavad just tahked kehad, tõendab järgmine: kõigist olemasolevatest kehadest eraldab põlemisel kõige rohkem soojust vesinik, sest sulatab nii plaatinat kui mäekristalli; kuid selle leek on äärmiselt kahvatu, samas kui oksüdatsioonielementidena toimivad ainult gaasid - vesinik ja veeaur, kuid niipea, kui ilmub mis tahes tiheda aine (nt raud, kivisüsi, marmor) segu, tekib pimestav valgus (Drummondi valgus).
Valguse intensiivsus on otseses proportsioonis oksüdatsioonienergiaga: mida tugevam on viimane, seda kõrgem on põlemistemperatuur ja seega ka tahkete lisandite põlemine. Nii annavad näiteks alkoholituli, kuumutatud õhuga segatud helendav gaas ja lõpuks Unica bensiinipõleti väga kahvatu leegi, kuid nad on võimelised andma teadaolevate lisandite kaudu märkimisväärse valguse intensiivsuse: elektripirnid annavad kollase leegi. , nõrgem valgus ja elektrilambid - valge, pimestav sära, sest esimesel juhul elektripinge võrreldamatult vähem energiline kui teises.
Eriti huvitavad on Aueri põletid, mida nüüd kasutatakse mitte ainult gaasi, vaid ka bensiini, alkoholi, atsetüleeni ja muude valgusallikate süütamiseks: need tulekindlate kehade segust koosnevad põletid muudavad tugeva soojusallika nõrga valguse hele, rohekas või sinakas valge valgus.
Valguse heleduse ja leegi suurendamiseks pürotehnilistes kompositsioonides kasutatakse antimoni, kivisütt ja muid aineid.
Leegi värvus ei tulene lisanditest endist, vaid eranditult nende lisandite põlemisel tekkinud gaasidest; Gaasid sisenevad tulle ja annavad valget, kollast, punast, rohelist, sinist, violetset värvi leegile igasuguste varjunditega. Sellised lisandid on naatriumi, vase, plii, baariumi, strontsiumi, antimoni jne soolad. Näiteks annab nitraadiga segatud väävel põlemisel ebamäärase värvuse ja antimoni juuresolekul valge; kui lisate berthollet soola ja väävli segule baariumnitraati, saate roheline värv jne.
Värvilisandid koosnevad valdavalt metalliühenditest, kuid värv ise ei sõltu ainult metallist, vaid ka sellega seotud mittemetallilistest ainetest. Seda tõestab kõige selgemalt järgmine katse vasega. Vask, nagu juba mainitud, põleb väävligaasides punase leegiga ja muutub väävliliseks vaseks. Kui vase väikese väävli lisandiga hapnikus põletatakse, tekib violetne leek. Kui väävli asemel lisatakse vasele tahket süsivesikut (šellak, suhkur jne), omandab leek rohelise värvi.
Kuumuta näpuotsatäis Grunspani või väävelsoola piirituse puhumistoru leegiga: alkoholigaaside mõjul tekib erkroheline leek. Lisage samale ainele veidi kalomeli või ammoniaaki: saate helesinise leegi, sest vask ühineb eralduva klooriga ja moodustab põlemisel vaskkloriidi (Chlorkupfer). Vaskkloriid põleb alkoholipõlengu mõjul rohelise leegiga, kuna piiritusetule vesinik võtab vasest ära kloori ja muudab selle leegi värvuse suhtes kehtetuks (CuCl 2 + 2H-2HCl + Cu). Kui vaskoksiidi (Kupferoxyd, CuO) põletatakse alkoholitules, on leegi südamik ja põhi valget värvi ning keele servad ja ots on sinised. See on seletatav asjaoluga, et leegi vesinik taandab esmalt vaskoksiidi (CuO + 2H = Cu + H 2 O), misjärel ilmub vase toonimisvõime uuesti leegi välimisse ümbrisesse oksüdeerimisvõime mõjul. ümbrik ja selles sisalduv väga kõrge temperatuur.
Värvi "tiheduse" suurendamiseks kasutatakse kalomeli, ammoniaaki, mastiksit, šellakit jne.
Kompositsiooni põlemiskiirus sõltub peamiselt:
- aluse ja lagundajate elementide keemilisest suhtest, kuna lagunemisaste ja seega ka aluse süttivus sõltub selle seose astmest;
- liitproportsioonidest, t.-ni. iga segu jaoks on äärmuslik piir, mille saavutamisel saadakse aluse kiireim ja täielikum lagunemine, samas kui väljaspool seda piiri, s.o. enne või pärast teda saadakse halvim tulemus - sellist piiri nimetatakse "normiks";
- põlemisel tekkiva temperatuuri kõrguselt;
- koostise tiheduse ja ühtluse kohta;
- alates keemiline mõju lisandid, st. alluvad elemendid;
- atmosfääri niiskusest ja kompositsiooni hügroskoopsusest;
- välistemperatuurist;
- lõpuks mitmete väikeste ja suurte, peamiste või teisejärguliste põhjuste tõttu, millest igaühel on oma mõju üldine protsess ravimi põlemine.
Põlemiskiiruse määramine on pürotehnilise kunsti üks tähtsamaid ülesandeid, kuna sellega on seotud leegi meelevaldse intensiivistamise või aeglustumise küsimus, seetõttu pööratakse selle all olevates kohtades erilist tähelepanu normile.
Esimene kronoloogiliselt (19. sajandi lõpp) oli termoteooria, mille rajajad on Malyar, Le Chatelier ja Nusselt. See teooria põhineb Van't Houghi hüpoteesil keemilise reaktsiooni kiiruse temperatuurisõltuvuse kohta. Termoplahvatuse tingimus on reaktsioonienergiast tingitud soojuse sisend ülekaal soojuse eraldumisest keskkonda. Sel juhul koguneb süsteemi soojust, mis põhjustab isekuumenemist ja vastavalt reaktsiooni isekiirenemist.
Põlevas süsteemis oksüdatsioonireaktsiooni tekkimine on kõige sagedamini seotud süsteemi kuumutamisega ühe või teise süüteallika poolt. Põlevsüsteemi kuumutamisel suureneb kütuse- ja hapnikumolekulide energia ning teatud väärtuse saavutamisel toimub nende aktiveerumine, s.o. moodustuvad vabade valentsidega aktiivtsentrid (radikaalid ja aatomid), mille tulemusena moodustuvad põleva aine molekulid kergesti atmosfäärihapnikuga ühendi. A.N. Bach ja K. Engler pakkusid 1898. aastal iseseisvalt välja oksüdatsiooni peroksiiditeooria, mille kohaselt süttiva süsteemi kuumutamisel aktiveerub hapnik ühe aatomivahelise sideme katkemise teel ja aktiivne molekul siseneb põleva ainega ühendiks lagunemata. aatomiteks ja moodustades R1 -OOR2 või ROO-OH tüüpi peroksiidühendeid.
Siiski ei suuda peroksiiditeooria selgitada mõningaid oksüdatsiooniprotsessi iseloomulikke tunnuseid, näiteks teravat toimet, mõnikord tühiseid lisandite jälgi.
Keemilise reaktsiooni kiirust m / s saab Arrheniuse seaduse alusel väljendada järgmise võrrandiga:
![]() , (1.12)
, (1.12)
kus on reaktsiooni kiiruskonstant (keemilise reaktsiooni kiirus reaktiivide kontsentratsioonidel, taandatuna ühikuni);
Reaktiivide kontsentratsioon, mol / m 3;
Stöhhiomeetrilised koefitsiendid, mis on määratud lähtereaktiivide kontsentratsioonide suhtega stöhhiomeetrilises reaktsioonivõrrandis;
Naturaallogaritmide alus;
Universaalne gaasikonstant = 8,3 J / (mol ∙ K);
- temperatuur, K.
Isesüttimise termiline teooria (nimetatakse ka termilise plahvatuse teooriaks) põhineb eksotermilise oksüdatsiooni ja seda sisaldava anuma seinas reageerivast segust soojuse eraldumise kiiruste võrdlemisel. Isesüttimise tingimuse määrab nende kiiruste võrdsus. Anuma seinte temperatuuri, mille juures see võrdsus saavutatakse, nimetatakse isesüttimistemperatuuriks. Alates sellest temperatuurist (tüüpiline igal juhul antud konkreetsete tingimuste puhul - anuma suurus ja kuju, gaasi termofüüsikalised omadused) toimub isekuumenemine, mis võib põhjustada sähvatust (isesüttimine).
Võttes arvesse ülaltoodut, võime isekuumenemiseks reageerivas keskkonnas kirjutada:
kus on soojusmahtuvus konstantse mahu juures, J / K;
Gaasi tihedus, kg / m 3;
Gaasi temperatuur, K;
Aeg, s;
Reaktsiooni termiline efekt, W;
Reaktsioonikiirus, m / s;
Reaktsioonianuma pind, m 2;
Reaktsioonianuma maht, m 3;
Soojusülekandetegur, W / (m 2 × K);
Anuma seina temperatuur, K.
D.A. Frank-Kamenetsky pakkus välja termilise isesüttimise kriteeriumi, mis põhineb statsionaarse temperatuurijaotuse rikkumisel reaktiivanumas piisava soojuseralduskiirusega:
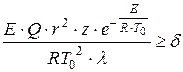 , (1.14)
, (1.14)
kus on laeva iseloomulik suurus, m;
Preeksponentsiaalne tegur;
Soojusjuhtivuse koefitsient gaasisegu, W/ (m × K);
Mõõtmeteta kriteerium võrdub 3,3; 0,88 ja 2 vastavalt sfääriliste, tasapinnaliste paralleelsete ja silindriliste anumate puhul.
D.A. Frank-Kamenetsky kriteeriumi tuleks mõista järgmiselt: kui pärast kõigi määravate parameetrite asendamist saame väärtuse, siis süttimise korral süttimist ei toimu. Kriteeriumivõrrandist tuleneb, et plahvatuse olulised määrajad on reaktsioonisoojus ja anuma raadius, milles reaktsioon toimub. Termiline plahvatus on seda tugevam, seda paremini ebavõrdsused täidetakse:
Kui need ebavõrdsused on halvasti täidetud, siis termiline plahvatus degenereerub - samaaegselt temperatuuri tõusuga põleb esialgne aine kiiresti läbi, mis määrib plahvatuspildi.
Põlemise tekkimine on kõige sagedamini seotud põleva süsteemi kuumutamisega ühe või teise süüteallika poolt. Vastavalt teooriale akadeemik N.N. Semjonovi sõnul kaasneb oksüdatsiooniprotsessiga soojuse eraldumine ja see võib teatud tingimustel ise kiireneda. Seda oksüdatsioonireaktsiooni isekiirendamise protsessi koos põlemisele üleminekuga nimetatakse isesüttimiseks.
Termilise isesüttimise korral tekib see soojuse eraldumise kiiruse ületamise tõttu soojuse eemaldamise kiirusest.
Vaatleme termilise isesüttimise protsessi, kasutades põlevgaasi või põleva vedeliku auru koos õhuga, mis asetatakse mahuga anumasse. Anuma ja põleva segu temperatuuri tõusuga suureneb reaktsioonikiirus ja soojuse vabanemine. Soojuse vabanemise kiiruse sõltuvus temperatuurist, J / s, määratakse:
![]() , (1.15)
, (1.15)
kus on gaasi põlemissoojus J;
Põlevsegu maht, m 3;
Reaktsioonikiiruse konstant;
Reagendi kontsentratsioon, kg / m 3;
Reaktsiooni järjekord;
Aktiveerimisenergia, J / mol;
Universaalne gaasikonstant J / (mol · K);
Segu temperatuur, K.
Vabanenud soojus kandub üle põlevale segule ja see soojeneb. Niipea kui segu temperatuur ületab anuma seinte temperatuuri, algab soojuse eemaldamine läbi anuma seinte ajaühiku kohta proportsionaalselt segu ja anuma seinte temperatuuride erinevusega ning määratakse sõltuvuse järgi:
![]() , (1.16)
, (1.16)
kus on soojuse eemaldamise kiirus läbi anuma seinte, J / s;
Soojusülekandetegur, J / (K · m 2 × s);
Anuma seinte pind, m 2;
Segu temperatuur, K;
Anuma seina temperatuur, K

Joonis 1.5 – Soojuse vabanemise sõltuvus temperatuurist erinevatel rõhkudel
Joonisel 1.5 on kõverad 2, 3 ja 4 näidatud soojuse eraldumise sõltuvust temperatuurist erinevatel rõhkudel ja sama segu koostise korral. Konstantse anuma ja keskkonna temperatuuri ning segu konstantse koostise korral iseloomustab põlemistsoonist eemaldatud soojushulk sirgjoonega 1. Segu koostise muutumisel suureneb soojuskao kiirus ja sellest tulenevalt muutub ka sirge kalle. Mida kõrgem on rõhk, seda rohkem tekib reaktsiooni käigus soojust (kõver 4). Kõveraga 2 määratud tingimustes ei saa isesüttimist toimuda, kuna soojuskadu (joon 1) on suurem kui soojuse eraldumine sellel rõhul. Kõvera 3 puutumispunkt sirgjoonega vastab eralduva ja eemaldatava soojuse vahelisele tasakaalule - antud põlevsüsteemi minimaalsel isesüttimistemperatuuril antud tingimustes. Väljastpoolt ebaolulise energiavarustuse korral on isesüttimine võimalik. Kõver 4 iseloomustab tingimusi, mille korral isesüttimine on vältimatu, kuna soojust eraldub rohkem kui eemaldatakse.
Ülaltoodud skeemi analüüsides leidis N.N. Semjonov tuvastas sõltuvuse:
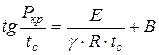 , (1.17)
, (1.17)
kus on minimaalne süüterõhk, Pa;
Minimaalne isesüttimistemperatuur, K;
Reaktsiooni järjekord;
Püsiv, olenevalt segu koostisest ja muudest omadustest.
Selle võrrandi (1.17) alusel on teoreetiliselt võimalik eelnevalt kindlaks teha, kas põleva segu isesüttimine on antud konkreetsetel tingimustel võimalik. Minimaalse rõhu ja isesüttimistemperatuuri seos on leidnud kinnitust arvukate katsetega ja osutunud väärtuslikuks põlemisprotsesside uurimisel.
Ahelpõlemise teooria
Aastal 1928 esitas NN Semenov idee, et keemilistes süsteemides võib eksisteerida kahte tüüpi plahvatusi - ahel- ja termiline.
Ahelreaktsioonideks nimetatakse reaktsioone, mis läbivad mitmeid etappe (läbi rea vahereaktsioone), mille käigus moodustuvad vabade valentsidega vaheühendid, nn aktiivsed keskused, mis on protsessi järgnevate kiirete etappide tuumad.
Esimest korda tekkis ahelreaktsiooni idee 1913. aastal, kui saksa füüsik ja keemik M. Bodenstein tegi kindlaks, et vesiniku ja kloori segu valgustamisel laguneb kloori molekul, mis neelab kvanti valgusenergiat. aatomiteks:
![]() .
.
Klooriaatomid reageerivad koheselt vesinikuga, mille tulemuseks on segu plahvatus. Ühe kloorimolekuli aktiveerimine põhjustaks kahe molekuli moodustumise:
![]() .
.
Kuid katsed näitavad, et see tekitab 100 000 vesinikkloriidi molekuli. Seda saab seletada, kui eeldada, et kloori interaktsioonis vesinikuga tekib produkt, mis sekundaarsetesse reaktsioonidesse sattudes sünnib uuesti ja võib reaktsiooni jätkata. See eeldus vastab järgmisele reaktsiooniskeemile:
I Esmane reaktsioon
IV Avatud vooluring
Selle skeemi kohaselt põhjustab ühe kloorimolekuli (I) aktiveerimine kahe klooriaatomi - ahelreaktsiooni kahe aktiivse tsentri - ilmumise. Iga klooriaatom kutsub esile oma ahelreaktsiooni, mille käigus aktiivne kese redutseerub pidevalt (II, III). Seega initsieeriva reaktsiooni (I) mõjul toimuvad järgnevad reaktsioonid, mis moodustavad ahela (II, III jne). Selliste reaktsioonide arvu alates ahela alguse hetkest kuni selle lõppemiseni nimetatakse ahela pikkuseks. Ahel võib katkeda, kui kloori (IV) aatomid või vesinikuaatomid (V) põrkuvad ja moodustavad neist molekule või kui aktiivsed tsentrid põrkuvad kokku tahke aine pinnaga. See on tüüpiline mittehargnev ahelreaktsioon. Selles põhjustab iga aktiivne keskus ainult ühe uue aktiivse keskuse ilmumise, nii et reaktsioon võib jätkuda, kuid mitte kiireneda.
Hargneva ahelreaktsiooni korral tekitab iga aktiivne keskus kaks või enam uut aktiivset keskust.
Ahelreaktsioonide teooria kohaselt algab oksüdatsiooniprotsess põleva aine aktiveerumisest.
Praktika on näidanud, et süttimine võib toimuda isotermilistes tingimustes, s.t. ilma reaktsioonikeskkonna temperatuuri tõstmata (segu "külm" süttimine). Sel juhul räägitakse ahela (isomeetrilisest) plahvatusest.
Kaks algkomponenti: kütus ja oksüdeerija, mis on suhteliselt stabiilses molekulaarses olekus, läbivad enne uuteks, stabiilsemateks põlemisproduktide molekulideks assotsieerumist terve ahela keerulisi vahepealseid muundumisi, mille tulemuseks on ebastabiilsete saaduste moodustumine: aatomid, radikaalid, suhteliselt suure ionisatsiooniastmega ergastatud molekulid (formaldehüüd, süsivesinik- ja hüdroksüülradikaalid, aatomi hapnik ja vesinik).
Kondratjev V.N. erinevate süsivesinike leegis oli võimalik tuvastada kõrgeid aatomhapniku (O), hüdroksüradikaali (OH), süsivesinikradikaalide (CH 3), süsinikmonooksiidi (CO), formaldehüüdi (CH 2 O) jne kontsentratsioone. Nende ainete sisaldus leegis oli tuhandeid ja miljoneid kordi suurem kui nende tasakaalukontsentratsioon termilise lagunemise ajal reaktsiooni lõppsaaduste leegitemperatuuril, näiteks H 2 O → H + OH.
Nende vaatluste tulemused võimaldasid järeldada, et vaadeldavad aatomid ja radikaalid ei esine reageerivas gaasis mitte toodete lõpliku lagunemise tulemusena, vaid on reaktsiooni vaheproduktid.
Seega põhineb süüteahela mehhanism teatud ainete keemiliste muundumiste tervel ahelal teisteks, mille tulemuseks on keemiliselt väga aktiivsete ebastabiilsete produktide, mida nimetatakse aktiivseteks tsentriteks, moodustumine eraldi vaheetappides, mis kergesti reageerivad üksteisega. ja lähteainete molekulidega, et moodustada uusi aktiivtsentreid ja lõppprodukte, näiteks H 2 O ja CO 2 metaani-õhu segu jaoks.
Kõrge reaktsioonivõime radikaalid ja aatomid on seletatavad nende reaktsioonide madala aktivatsioonienergiaga, mis on lähedane aatomireaktsioonide aktiveerimisenergiale:
OH + H2 = H2O + H - 25 kJ / mol
CH3 + C3H6 - 12,5 kJ/mol
CH3 + C6H6 - 23,5 kJ/mol
H2O → H + OH
Kõik saadud aktiivsed osakesed (H või OH), mis on äärmiselt ebastabiilsed ja seetõttu keemiliselt aktiivsed, põrkuvad algse aine molekuliga, lõhenevad, moodustades uusi aktiivseid osakesi:
H + O 2 = OH + O
OH + H 2 = H 2 O + H
Reaktsiooni tulemusena saadud aktiivsed osakesed H ja OH lähevad uuesti reaktsioonidesse ning O osakesed interakteeruvad vesinikuga:
O + H2 = OH + H.
See tähendab, et aktiivsete osakeste ja algainete molekulide vahelise reaktsiooni tulemusena ei moodustu mitte ainult lõppsaadused, vaid ka uued aktiivsed osakesed. Reaktsiooni tulemusena moodustunud aktiivsed osakesed kutsuvad esile uued keemilise muundamise etapid, mis toimuvad kuni algainete täieliku äratarbimiseni.
Selliseid korduvaid keemilisi reaktsioone nimetatakse ahelreaktsioonideks ja aktiivseid osakesi, mis tekitavad uusi transformatsiooniahelaid, nimetatakse aktiivseteks keskusteks.
Eelpool käsitletud vesiniku põlemise ahelprotsessi saab esitada diagrammina (joonis 1.6).
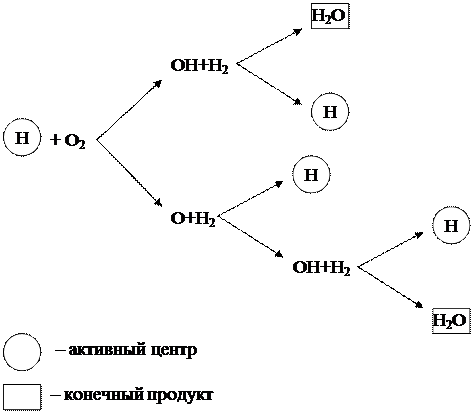
Joonis 1.6 – vesiniku ahelpõlemise skeem
Diagrammilt on näha, et ainult vesiniku (H) osakesed, mis on aktiivsed tsentrid, tekitavad uusi transformatsiooniahelaid. Sel juhul moodustub ahela igas lülis aktiivse tsentri H ja hapnikumolekuli O 2 vahelise reaktsiooni tulemusena lisaks lõpp-produktile H 2 O 3 uut aktiivset tsentrit H, tekitades uutele transformatsioonide ahelatele.
Sellist ahelreaktsiooni, mis toimub aktiivsete keskuste suurenemisega, nimetatakse hargnenud. Reaktsioon areneb nagu laviin ja kulgeb väga suure kiirusega, ületades oluliselt tavaliste molekulaarsete reaktsioonide kiirust.
Tüüpiline mittehargnev reaktsioon on kloori reaktsioon vesinikuga. Selle reaktsiooni aktiivseteks keskusteks on vahelduvad kloori- ja vesinikuaatomid. Klooriaatomi reageerimisel tekib üks vesinikuaatom, täpselt nagu vesinikuaatomi reageerimisel tekib üks klooriaatom. Seetõttu võib reaktsioon jätkuda, kuid mitte kiireneda.
Üldtuntud tõsiasi, et kloori fotokeemiline reaktsioon vesinikuga lõppeb siiski plahvatusega (isesüttimisega), on seletatav asjaoluga, et ahelreaktsiooni piisavalt suure kiiruse korral ületab soojuse eraldumine soojuse eemaldamist, mille tulemusena. millest segu kuumeneb tugevalt ja tekivad termiliseks isesüttimiseks vajalikud tingimused.
Süsivesinikele iseloomuliku hargnenud ahelreaktsiooni toimumisel võib aktiivsete tsentrite kontsentratsioon suureneda sõltumata algse initsiatsiooni tingimustest ja kui hargnemise ajal aktiivsete tsentrite moodustumise kiirus ületab ahela lõppemise kiirust, siis tekib iseseisev ahelreaktsioon. tekib laviinilaadse iseloomuga kiirenev protsess, mis viib süttimiseni.
Ahelreaktsioonide teooria võimaldas selgitada paljusid põlemisprotsesside iseärasusi (lisandite tugev mõju, isesüttimisrõhu piirid, katalüüs ja rõhu inhibeerimine jne), mida termilise teooriaga seletada ei saa. Tõeliste tulekahjude ja plahvatuste tekke ja arengu mehhanismi iseloomustab kombineeritud ahel-termiline protsess. Olles alanud ahelliselt, kiirendab oksüdatsioonireaktsioon oma eksotermilisuse tõttu jätkuvalt kuumuse toimel. Seetõttu määravad põlemise alguse ja arengu kriitilised (piiravad) tingimused lõpuks soojuse eraldumine ning reageeriva süsteemi ja keskkonna vahelise soojusvahetuse tingimused.
Keti peal keemilised reaktsioonid palju tehnoloogilised protsessid v keemiatööstus... Nende protsesside hulka kuuluvad näiteks polümerisatsiooniprotsessid, mis on aluseks sünteetiliste kummide, plastide, polümeerkiudude ja paljude muude toodete tootmisele. Nende hulka kuuluvad ka sellised olulised tööstuslikud protsessid, kui sünteetiliste rasvhapete tootmine, mis asendavad pesuvahendite valmistamisel varem kasutatud toidurasvu, krakkimine - õlist kvaliteetse kütuse saamise protsess jne.






