Nadharia ya joto ya mwako. Misingi ya nadharia ya mwako. Aina za mwako, sifa zao
Mwako- mwingiliano wa haraka wa kemikali wa vitu vinavyoweza kuwaka na oxidizer, ikifuatana na kutolewa kwa kiasi kikubwa cha joto na mwanga mkali (moto). Mwako unawezekana tu mbele ya mambo matatu: dutu inayowaka, wakala wa oxidizing, na chanzo cha joto.
Chanzo cha joto(moto) inaweza kuwa moto wazi, cheche, joto moto na msuguano (mikanda katika gari ukanda), athari, shinikizo. Chanzo cha joto kinaweza pia kuwa umeme (inapokanzwa kwa conductors, arc), kemikali na nishati ya jua.
Wakala wa vioksidishaji ni klorini, fluorine, bromini. Wakala wa kawaida wa vioksidishaji ni oksijeni ya hewa; mchakato wa mwako utategemea maudhui yake katika hewa. Ikiwa kuna oksijeni zaidi ya 14-16% katika hewa, basi mwako thabiti huzingatiwa. Katika maudhui ya oksijeni ya chini ya 14%, kuvuta huzingatiwa, na kwa maudhui ya oksijeni ya chini ya 8-10%, kuvuta pia hukoma.
Dutu inayoweza kuwaka... Wanaweza kuwa gesi (amonia, asetilini, hidrojeni), vinywaji (petroli, asetoni, pombe), yabisi (makaa ya mawe, kuni). Ili moto utokee jambo imara au kioevu, ni muhimu kutumia chanzo cha joto ili kuwapa joto kwa joto hilo kwamba kutolewa kwa nguvu kwa mvuke zinazowaka hutokea kutoka kwenye nyuso zao. Wakati mkusanyiko fulani unafikiwa, mvuke hizi huwaka. Gesi wakati wa mwako hazibadili hali yao ya mkusanyiko.
Kuna aina zifuatazo za mwako: 1) flash; 2) kuwasha; 3) kujiwaka moto; 4) mwako wa hiari; 5) kuvuta sigara; 6) mlipuko.
1... Mwako inaitwa mwako wa papo hapo wa mchanganyiko wa oksijeni ya hewa na mvuke, gesi, vumbi, sio kuambatana na uundaji wa gesi zilizoshinikizwa. Kiwango cha kumweka ndicho kikubwa zaidi joto la chini dutu inayowaka, ambayo mvuke au gesi huundwa juu ya uso wake ambao unaweza kuangaza kutoka kwa chanzo cha moto, lakini kwa mwako uliofuata, kiwango cha malezi yao haitoshi.
Kulingana na thamani ya joto hili, vinywaji vinavyoweza kuwaka vimegawanywa katika:
a) kuwaka (vioevu vinavyoweza kuwaka - petroli, acetone, pombe) - t flash ≤ + 45 ° С;
b) vinywaji vinavyoweza kuwaka (GZh - mafuta, mafuta ya dizeli, mafuta ya mafuta) - tp> + 45 ° С.
2. Kwa kuwasha inaitwa uchomaji thabiti unaoendelea wa dutu kutoka kwa chanzo cha joto. Kiwango cha chini cha joto cha dutu inayoweza kuwaka ambayo huwaka kutoka kwa chanzo cha moto na kuendelea kuwaka baada ya kuondolewa huitwa joto la kuwaka. Ni ya juu kuliko hatua ya flash.
Mkusanyiko wa vitu vinavyoweza kuwaka hewani, ambapo kuwaka au mlipuko unawezekana, uko ndani ya mipaka fulani: ya chini ni ya CWP na ya juu ni ya ERW. Kuwasha kwa mchanganyiko unaoweza kuwaka hauwezekani kwa viwango chini ya CWP (hakuna molekuli za kutosha za dutu inayowaka katika mchanganyiko) na juu ya CWC (hakuna molekuli za oksijeni za kutosha katika mchanganyiko). Kadiri tofauti kati ya ERC na UWP inavyokuwa, ndivyo dutu hii ilivyo hatari zaidi. Maadili ya vigezo hivi yanaweza kupungua, kwa mfano, na ongezeko la unyevu wa mchanganyiko wa vumbi-hewa (PLVS), kwa mfano, mchanganyiko wa hewa na sukari, unga, vumbi vya makaa ya mawe.
Wacha tutoe mifano ya maadili ya NWP na ERW kwa idadi ya gesi na mivuke ya kioevu:
Acetylene 3.5-82%;
Gesi asilia 3,8-19,2%;
Petroli 1-6%;
Monoxide ya kaboni 12.8-75%.
3.Kujiwasha- mchakato wa kuwasha vitu kutoka kwa chanzo cha nje (moto, moto au mwili wa incandescent) bila kugusa moja kwa moja nayo kwa joto la kuwasha. Joto hili litapungua kwa shinikizo la kuongezeka na kwa gesi nyingi zinazowaka ni katika aina mbalimbali za 400-700 ° C, kwa kuni - 340-400 ° C; makaa ya mawe - 400-500 ° C. Mfano wa kuwasha binafsi: inapokanzwa na moto unaofuata wa kuni, karatasi, iko karibu na moto wazi (bila kuwasiliana nayo) au vitu vya incandescent (makaa ya mawe, ond wazi heater).
4. Mwako wa hiari dutu hutokea kutokana na athari za kimwili, kemikali na kibaiolojia zinazotokea katika dutu (nyenzo) yenyewe, na kusababisha mwako kwa kukosekana kwa chanzo cha moto.
Wakati kuhifadhiwa kwa kiasi kikubwa cha nafaka ya mvua, nyasi, majani na uingizaji hewa wao wa kutosha ndani ya nyenzo hizi, michakato ya biochemical (kuoza) hutokea kwa kutolewa kwa joto. Joto la vifaa hivi huongezeka, misa yao kubwa (rick, haystack) huzuia utaftaji wa joto linalosababishwa. mazingira, ambayo ndiyo husababisha moto. Nyenzo kama hizo zinapaswa kukaushwa vizuri kabla ya kuhifadhi. Kugusa vitambaa (nguo, nguo za kusafisha) zilizo na madoa ya mafuta na zilizorundikwa bila uingizaji hewa pia huwaka kwa hiari. Kwa hiyo, nguo za kazi zinapaswa kunyongwa kwa njia ya kutoa upatikanaji wa hewa ya bure, na nguo za mafuta zinapaswa kuondolewa mara moja kutoka kwa majengo ya kazi.
Kulingana na kiwango cha majibu, mchakato wa mwako huchukua fomu kuoza(kasi ya cm / s kadhaa), kwa kweli mwako(m / s kadhaa) na mlipuko(mia kadhaa na elfu m / s).
5. Mlipuko- mabadiliko ya ghafla katika hali ya kimwili na kemikali ya dutu chini ya ushawishi wa joto la juu, shinikizo, reagents za kemikali. Wakati wa mlipuko, kiasi cha gesi zilizoundwa na mvuke huongezeka kwa kasi, kiasi kikubwa cha nishati hutolewa, ambayo kwa namna ya wimbi la mshtuko lina uwezo wa kufanya. kazi ya mitambo(kuharibu majengo, miundo, kuumiza watu).
Mwako wa nyenzo unaweza kuwa kamili au haujakamilika. Kwa mwako kamili (ziada ya oksijeni) bidhaa zisizoweza kuwaka (CO 2 na H 2 O) huundwa Kwa mwako usio kamili (ukosefu wa O 2), bidhaa zisizo kamili za oxidation (CO, alkoholi, asidi) huundwa. Ni sumu na hulipuka. Kwa hiyo, wakati wa kuandaa mchakato wa mwako wa mafuta (katika boilers, tanuu), kiasi cha kutosha cha oksijeni kinapaswa kutolewa katika tanuru.
Nishati ya Molekuli ya Mwako
Michakato mingi ya mwako ni kuchanganya mafuta yenye hidrojeni na kaboni na oksijeni ya anga.
Kabla ya kuendelea kuzingatia misingi ya kimwili na hisabati ya nadharia ya mwako, hebu jaribu kuelewa, katika ngazi ya Masi, ambapo nishati ya mwako inatoka, juu ya kutolewa ambayo kila kitu kingine kinategemea: inapokanzwa gesi, kuonekana kwa kazi. vituo vya kemikali ndani yake, nk.
Wacha tuone ni nini kinachojumuisha joto la athari kuu za mchanganyiko wa kaboni na hidrojeni na oksijeni ya anga.
Tutaandika kwa mujibu wa data katika meza. 3.1 mizani ya nishati ya athari za uoksidishaji mfuatano wa kaboni ngumu, kwa mfano grafiti:
Kwa hivyo, katika mmenyuko wa jumla wa oxidation ya kaboni ngumu, 386 kJ / mol hutolewa:
Nishati iliyotolewa wakati hidrojeni inapochanganyika na oksijeni pia ni sawa kwa ukubwa:
Molekuli ya CO labda ni ya kudumu zaidi, nishati yake ya kumfunga ni sawa na 1016 kJ / mol. (Inayofuata yenye nguvu zaidi ni molekuli ya N2 yenye nishati inayofunga ya 892 kJ / mol. Molekuli zote mbili zina jozi tatu za elektroni za kuunganisha, kwa maneno ya kemikali - vifungo vitatu vya valence. Katika molekuli ya CO, elektroni moja ya kwanza huenda kutoka O hadi C, baada ya hayo. ambayo O + na C- huwa sawa na atomi za nitrojeni; hii inathibitishwa na kuwepo kwa wakati wa dipole katika molekuli ya CO.) Katika molekuli ya CO2, dhamana ya atomi ya pili ya oksijeni ni dhaifu: kulingana na jedwali. 3.1
Nishati za kuunganisha za oksijeni katika misombo hii zinalinganishwa na nishati ya kuunganisha ya molekuli ya oksijeni mama. Kwa sababu
basi atomi moja ya oksijeni inachukua 240 kJ / mol tu. Nishati ya chini ya kumfunga ya molekuli ya oksijeni ni sababu ya shughuli zake za kemikali na sababu ya matumizi ya oxidation kama chanzo cha nishati.
Nishati ya kuunganisha ya atomi ya kaboni katika kimiani ya kioo ya grafiti (pamoja na almasi na kaboni ya amofasi) ni ya juu sana. Nishati ya chini ya mmenyuko С (s) + 0.5О2 = = СО + 98 kJ / mol ni tofauti kati ya kiasi kikubwa sana: kutoka kwa nishati ya kisheria ya СО (256 kJ / mol), mtu lazima aondoe nusu ya nishati ya kuvunja O2 ndani ya atomi (59 kJ / mol) na kutoa joto la mvuke wa atomi ya kaboni. Kweli, hii ndio jinsi joto la mvuke limedhamiriwa, sawa na 671 kJ / mol. Hii pia ni thamani kubwa sana.
Ubadilishaji wa kaboni ngumu na gesi ya hidrojeni kuwa mafuta ya hidrokaboni hutokea kwa mabadiliko kidogo ya nishati. Kwa upande mwingine, oksijeni inapoletwa ndani ya molekuli za kikaboni za alkoholi, aldehidi na ketoni, asidi za kikaboni, wanga, karibu nishati nyingi hutolewa kama inavyotolewa wakati wa mwako kamili (kwa CO2 na H2O), kwa kawaida, wakati kiasi sawa cha oksijeni hutumiwa. Kwa hiyo, inaweza kuwa takriban kudhani kuwa kwa mwako kamili wa mafuta yoyote ya mafuta, 419-500 kJ / mol ya oksijeni inayotumiwa hutolewa. Isipokuwa ni baadhi ya misombo ya endothermic, yenye utajiri wa nishati, kama vile asetilini na sianojeni, joto lao la mwako ni kubwa zaidi.
Mwako usio kamili ni mbaya kwa nguvu sio tu kwa molekuli ya mafuta, lakini pia kwa molekuli ya oksijeni iliyotumiwa. Katika mmenyuko 2Q (tv) + O2 = 2CO, 210 kJ / mol tu hutolewa badala ya 466 wakati wa kuchoma hidrojeni na 526 wakati wa kuchoma CO.
Kifungo chenye nguvu cha atomi C katika kaboni gumu huzuia kaboni kutoka kwa kuyeyuka. Carbon huacha hali ngumu tu pamoja na oksijeni katika mfumo wa CO au CO2.
Kwa mwako usio kamili na joto la chini, mmenyuko 2CO = CO2 + C (s)) + 41 kJ / mol ni nzuri kwa nguvu tu inapokokotolewa kwenye kaboni ngumu. Imehesabiwa kwa atomi ya kaboni ya bure, mmenyuko unaofanana 2СО = СO2 + С - 129 kJ / mol ina kizuizi kikubwa cha nishati. Kwa hiyo, soti na soti wakati wa mwako huundwa tu kutokana na mtengano wa molekuli za kikaboni na mifupa ya kaboni, lakini sio kutoka kwa CO.
Sasa hebu tugeukie athari za oksidi zinazohusisha nitrojeni.
Molekuli ya nitrojeni N2 ni nguvu sana - nishati yake ya kujitenga ni 226 kJ / mol. Kwa hiyo, majibu ya ubadilishaji wa N2 na O2 kuwa 2NO ni endothermic na, kwa sababu za thermodynamic, inaweza kuendelea tu kwa joto la juu.
Uundaji wa oksidi za juu (NO2, N2O3, N2O4, N2O5) kutoka kwa nitrojeni na oksijeni huendelea bila mabadiliko yoyote ya nishati (kwa kulinganisha na nishati ya kisheria ya N2 na O2). Kwa hiyo, kutokana na mtazamo wa nishati, oksijeni iliyojaa katika misombo na nitrojeni (CH3-ONO2 - nitroether, CH3 (CeH2) (NO2) 3 - trinitrotoluene) ni sawa na oksijeni ya gesi. Oksijeni, iliyojengwa ndani ya molekuli ya kikaboni, lakini imefungwa na nitrojeni, inafanya uwezekano wa kuunda vitu vinavyotoa nishati zaidi wakati wa kupanga upya molekuli na uundaji wa N2 na mpito wa oksijeni kwenye CO2 na H2O molekuli. Kwa sababu hii, misombo ambayo oksijeni huunganishwa na nitrojeni (na pia na klorini, katika vikundi vya CIO3, ClO4) hutumiwa kama propellants na vilipuzi.
Haya ni mawazo ya jumla kuhusu nishati ya molekuli kuungua.
Tunaendelea kuzungumza juu ya misingi ya classic ya kemia, ambayo ni muhimu kwa pyrotechnic yoyote ya kufanya mazoezi. BA-BAH inakumbusha kwamba yoyote somo la vitendo pyrotechnics ni ahadi hatari ikiwa haitokani na nadharia kali. Tunapendekeza wale wasomaji ambao wanaamini kwamba nini kinaweza kuwa wito wao wa maisha, kuchukua kozi kamili ya masomo, kwa mfano, katika Taasisi ya Utafiti ya Kemia Inayotumika huko Sergiev Posad.
Tukirejelea misombo, tulionyesha kuwa sababu kuu kwao ni kiwango cha ujamaa wa vitu kati yao wenyewe. Vinginevyo, vipengele vinabaki kutojali mbele ya vitu vingine na vinakabiliwa na hamu kubwa zaidi au chini ya kuungana na wengine. Kwa hiyo, kwa mfano, chokaa huchukua kwa urahisi gesi ya klorini nzito, i.e. inachanganya nayo ili kuunda chokaa cha klorini; zebaki huchanganyika na salfa iliyoyeyuka na kutengeneza dutu nyekundu inayong'aa inayojulikana sana iitwayo cinnabar. Cinnabar (Zinnober) inaweza kuoza tena kuwa kiberiti na zebaki, ikiwa utaichanganya na dutu ambayo moja ya vitu vilivyojumuishwa (kwa mfano, sulfuri) itakuwa na kivutio cha nguvu zaidi kuliko kwa rafiki (yaani, zebaki), baada ya hapo. na kipengele cha pili kilichofungwa kwa kitu kinaweza kutolewa kwa utaratibu ule ule kwa njia ya dutu ya nne. Utoaji au uchapishaji kama huo haukamiliki kila wakati, lakini mara nyingi zaidi, toleo la sehemu linatosha, ambalo linaweza kuhesabiwa kinadharia kwa kutumia fomula.
Moja ya matokeo ya kawaida ya mshikamano, mara kwa mara kwa kila hatua, ni mali inayoitwa "hygroscopicity," i.e. uwezo wa unyevu, unyevu, vinginevyo - kuteka unyevu na kuunda misombo ya asidi-hidrojeni. Mali hii inajulikana na vitu vingi, na, kwa njia, chumvi ya meza na asidi ya sulfuriki, ambayo huwekwa kati ya muafaka wa dirisha kuteka unyevu ndani yako; quicklime, kuchemsha kutoka kwa kuwasiliana na maji; gelatin, ambayo pombe hupungukiwa na maji, nk. Kwa pyrotechnics, hygroscopicity ni mali mbaya ambayo inapaswa kuzingatiwa. Kwa hivyo, kwa mfano, kloridi ya strontium na nitrati, kwa sababu ya hygroscopicity iliyokithiri, haiwezekani kutumia kila wakati, ingawa vitu hivi vina sifa za thamani za pyrotechnic; na kwa ujumla, nyimbo zote zinapaswa kulindwa kwa uangalifu kutokana na ushawishi wa unyevu. Lakini jukumu muhimu zaidi katika kemia ya pyrotechnic inachezwa na aina ya misombo inayoitwa "mwako" (Verbrennung, mwako).
Kwa usemi "mwako" au "uchomaji" kwa maana pana zaidi, kemia kwa ujumla ina maana ya kila mchanganyiko wa kemikali wa miili miwili kuunda ya tatu; kwa maana ya karibu, ina maana uhusiano wa mwili na oksijeni.
Kwa ufafanuzi, wacha tugeuke, kama kawaida, kwa majaribio. Changanya kiasi fulani cha filings za chuma na kiasi fulani cha sulfuri na joto kidogo mchanganyiko; basi mchanganyiko huu utawaka mara moja na kuyeyuka haraka. Aloi iliyopatikana kwa njia hii si tena sulfuri na si chuma: chuma kilichochomwa na sulfuri, i.e. kemikali pamoja nayo, na matokeo yake mwili mpya uliundwa - chuma au sulfuri (kulingana na predominance ya moja au kiungo kingine) pyrite.
Sulfuri kuyeyuka katika crucible, kuleta alloy kwa chemsha na kutupa vipande vya waya wa shaba ndani yake: waya huu utawaka na sulfuri, ukitoa rangi nyekundu ya ajabu; matokeo ni kiwanja maalum - sulfidi ya shaba, au luster ya shaba. Kwa njia hiyo hiyo inaweza kuchomwa moto kwa shaba, i.e. kuchanganya miili mingi nayo: risasi, bati, zinki, nk.
Mkaa wa sulfuri ni kioevu kisicho na rangi, chenye harufu kali ambacho hakigandi hata saa 48 ° R (kiwango cha kuyeyuka cha disulfidi ya kaboni (CS 2) = -112 ° C) - huundwa kutokana na mchanganyiko wa mivuke ya sulfuri na makaa ya moto. Miili yote miwili kuu itawaka, yaani, ikiunganishwa, itageuka kuwa kioevu.
Sawa sawa huzingatiwa kati ya metali (chuma, shaba, zinki, antimoni, arseniki, nk) ambazo ziko katika hali ya joto na gesi iliyotajwa tayari inayoitwa "klorini": chuma, shaba, zinki, nk. choma kwa klorini ndani ya kloridi ya feri, kloridi ya shaba, kloridi ya zinki, kloridi ya risasi, nk, huku ukitengeneza joto kali na kutoa mwanga maalum. Sulfuri iliyoyeyuka, inapogusana na gesi ya klorini, huwaka kwa moto wa bluu na kugeuka kuwa kloridi ya sulfuri; antimoni iliyovunjika au arseniki nzuri, iliyowekwa kwenye chombo kilichojaa klorini, huwaka wenyewe na kuchanganya katika kloridi ya arseniki au kloridi ya antimoni.
Katika matukio yote mawili, kutokana na kufanana, miili mbalimbali iliunganishwa, wakati mwingine na sulfuri, wakati mwingine na klorini, na kutolewa kwa joto na mwanga kulionekana.
Chini ya hali sawa, misombo ya miili mbalimbali huundwa na gesi tofauti - oksijeni.
Unganisha urejeshaji ( chombo cha kioo kwa kunereka), ambamo zebaki huwekwa, na ndani ya kifuniko cha glasi, imefungwa kwa hermetically kutoka hewa ya nje. Joto zebaki karibu na kiwango cha kuchemsha: zebaki haitawaka, lakini itapoteza luster yake ya chuma, na rangi yake ya zamani ya fedha, na hali ya kioevu-droplet - itageuka kuwa poda nyekundu, ambayo inahusiana na chuma cha zamani. kwa njia sawa na makaa ya mawe kwa kuni. Ikiwa kabla ya kuanza kwa jaribio ulipima kwa usahihi zebaki na hewa iliyo chini ya kofia, na sasa unapima zote mbili tena, basi zinageuka kuwa kuna ukosefu wa uzito hewani, na kwenye poda huko. ni mzito kupita kiasi, na ni sawa tu ... Ikiwa, kwa mfano, hewa chini ya kofia ilikuwa na uzito wa gramu 1000, sasa ina uzito wa gramu 767 tu; lakini unga huo una uzito wa gramu 233 zaidi ya zebaki. Sasa fanya jaribio la kinyume: weka poda kwenye urejesho mdogo uliounganishwa na chupa ya kioo nusu iliyojaa maji. Joto urejesho juu ya moto mkali wa pombe: poda hugeuka kuwa mvuke, ambayo, kupitia maji, imegawanywa katika sehemu mbili: ndani ya mvua ya metali inayojumuisha zebaki safi ya kioevu ya droplet na kutoka kwa oksijeni, ambayo hukusanya kwenye silinda.
Oksijeni huonyesha mshikamano sawa na zebaki moto kwa chuma moto au shaba iliyoyeyushwa: inapogusana na hewa, metali hizi huingizwa kwa uchoyo juu ya uso na oksijeni iliyo angani, na kuunda kiwango cha shaba au chuma (slag), i.e. .. . chuma au shaba "oksidi" (kiwanja na oksijeni), huku ikitoa cheche za rangi mkali.
Katika matukio haya yote, jambo sawa lilitokea: uhusiano na oksijeni, au oxidation (oxydation) ya miili hii - si tu chini ya ushawishi wa joto, lakini pia kwa kutolewa kwa joto na mwanga, ili joto na mwanga, i.e. kile kinachojulikana kama "kuchoma" ni athari ya upande, matokeo ya moja kwa moja, au tuseme, udhihirisho wa nguvu, ambao watu wa kale walizingatia kipengele maalum, kanuni ambayo waliita "phlogiston".
Lakini oxidation inaweza kufanyika sio tu bila kati ya moto, lakini hata bila kutolewa kwa joto: ikiwa chuma kinakabiliwa na hewa, basi itafunikwa na kutu. Kutu hii si kitu zaidi ya bidhaa ya oxidation, yaani oksidi ya chuma au chuma cha kuteketezwa.
Mchakato wa mwako uliachwa bila kutolewa kwa joto kwa sababu tu oxidation yenyewe ilikuwa polepole sana. Oxidation ya kuni inaonekana zaidi: glovu huangaza gizani; ukiweka mkono wako kwenye rundo lililooza, basi unahisi joto; rundo lenyewe linapungua siku baada ya siku; kwa maneno mengine, mti huwaka polepole (moshi) hewani.
Hata zaidi inayoonekana ni utitiri hewa safi wakati wa kuvuta: ikiwa mkondo wa hewa unapulizwa kwenye makaa ya moto au kuni inayovuta polepole (kwa mfano, na manyoya ya kupiga), basi moto utaonekana mara moja. Mchakato ni kama ifuatavyo: kuni ina miili miwili inayoweza kuwaka - kaboni na hidrojeni; ya kwanza inachanganya na oksijeni na, inapochomwa, inageuka kuwa kaboni dioksidi, au kaboni dioksidi, na ya pili ndani ya oksijeni, au maji.
Yoyote nyenzo zinazoweza kuwaka, v maisha ya kila siku inayoitwa mafuta au nyenzo za taa, huwaka kulingana na sheria sawa. Kwa mfano, tallow na mafuta huundwa hasa na kaboni na hidrojeni; zote mbili na nyingine zina mshikamano mkubwa na oksijeni, na mchakato mzima wa mwako, i.e. oxidation, ni kwamba oksijeni hutengana dutu inayoweza kuwaka katika sehemu zake kuu na kuunganishwa na kila moja yao tofauti.
Oxidation sawa hutokea katika mwili wa wanyama: sehemu za nitrojeni (mafuta) za mwili zimeoksidishwa, au zimechomwa nje, kutokana na kuwasiliana na oksijeni, conductor ambayo ni damu, na matokeo ni joto la wanyama.
Lakini kama vile oksidi inaweza kuwa polepole sana, inaweza kuwa haraka sana na yenye nguvu. Fosforasi nyekundu, kwa mfano, amelala nje, si tu smolders na glows, lakini, hutiwa ndani idadi kubwa, huyeyuka polepole na hatimaye kuwaka (kujiwasha). Poda ndogo kabisa ya chuma safi yenye kemikali huwashwa inapogusana na hewa ya nje. Hatimaye, sodiamu ya chuma, mara tu inapoingia ndani ya maji, mara moja hutengana ndani ya sehemu zake za kawaida ili kunyonya oksijeni iliyo ndani ya maji, na zaidi ya hayo kwa nguvu sana kwamba joto lililotolewa linaweza kuwasha gesi nyingine, hidrojeni, iliyotolewa. kwa mchanganyiko wa sodiamu na oksijeni. Kwa hiyo hidrojeni huwaka na moto usio na rangi na, kwa mara nyingine tena kuchanganya na oksijeni ya anga, tena hugeuka kuwa maji. Kwa hiyo, sodiamu iko chini mafuta ya madini tangu mafuta haya ni kiwanja cha hydrocarbon ambacho hakina oksijeni.
Kutoka kwa yote hapo juu, hitimisho kadhaa za kulazimisha zinaweza kutolewa:
- Tunachoita kuchoma katika maisha ya kila siku, i.e. kuonekana kwa moto, mwanga na joto, inahitaji miili miwili: nyenzo zinazowaka na oksijeni.
- Mchakato wa mwako yenyewe unajumuisha, kwanza, katika mtengano wa nyenzo zinazowaka na kutolewa kwa sehemu hizo zinazochanganya na oksijeni, na pili, katika mchakato wa mchanganyiko huu, i.e. katika oxidation. Bidhaa ya oxidation ya vitu vinavyoweza kuwaka na inapokanzwa kutosha ni hasa mabadiliko ya vitu hivi katika asidi kaboniki na maji.
- Kwa sababu kwa asili, oksijeni haipatikani kwa kutengwa, basi wakati wa kuchanganya, nyenzo zinazowaka huiondoa kutoka anga, kutoka kwa maji au kutoka kwa mwili mwingine wowote mgumu, unaojumuisha oksijeni; kwa kuzingatia hili, miili ambayo hutoa oksijeni huitwa vioksidishaji, miili ambayo ni oxidized inaitwa besi, na vitu vinavyosababisha au kuongeza kutolewa kwa oksijeni huitwa decomposers. Muundo wa maandalizi ya pyrotechnic na mchanganyiko wa fireworks kawaida hujumuisha wawakilishi wa kila moja ya vikundi hivi vitatu, lakini kuna tofauti: katika hali fulani, msingi na wakala wa oksidi ni wa kutosha (kwa mfano, alumini na permanganate ya potasiamu); katika hali nyingine, hata hivyo, kesi za nadra sana, msingi mmoja tu, ikiwa ni oksijeni ya kutosha (kwa mfano, magnesiamu, lycopodium, nk).
- Bila ushiriki wa wakala wa oksidi, msingi hauwaka, lakini ikiwa unashikamana nayo dutu ambayo inaweza kuchanganya na msingi na kuitenganisha, basi mchanganyiko huwaka. Misingi hiyo, ambayo yenyewe haiwezi kuwaka, ni: zinki, sodiamu, risasi, bariamu, potasiamu, strontium, chumvi za kloriki na nitriki, nk. Uchafu unaoweza kuwaka unaochangia kuoza kwa msingi ni: sulfuri, makaa ya mawe, soti, sukari, wanga, dextrin, shellac, gummilac, mafuta ya nguruwe, nk. Mfano ni saltpeter (nitrate ya potasiamu): yenyewe, saltpeter haina kuchoma, lakini ikiwa unachanganya na sulfuri, unapata mchanganyiko unaowaka, kwa sababu. sulfuri hutengana na nitrati na huchukua oksijeni kutoka kwayo, ambayo inachanganya na kuunda asidi ya sulfuri. Vile vile huzingatiwa wakati sulfuri imeunganishwa na chumvi ya berthollet (Kali cliloricum) au na permanganate ya potasiamu (Kali hypemanganiucum). Ikiwa muundo huo umeundwa kutoka kwa makaa ya mawe, soti au selulosi kama msingi na mchanganyiko wa sulfuri na nitrati, basi chumvi hutumika kama wakala wa oksidi, na sulfuri kama kitenganishi. Mchakato ni kama ifuatavyo: makaa ya mawe hutengana na nitrati, ikichanganya na oksijeni ya asidi yake ya nitriki, na oksijeni na makaa ya mawe huchanganyika kuunda asidi ya kaboni ya gesi, na nitrojeni hutolewa. Sulfuri, kwa upande mwingine, inakuza utengano, na muhimu zaidi, inazuia mchanganyiko wa asidi ya kaboni na potasiamu: kwa njia hiyo hiyo, kiwanja kingeunda mwili imara - potashi. Bila uwepo wa sulfuri, nusu ya asidi ya kaboni ingeingia kwenye kiwanja kigumu.
- Mwako haufikiriki bila kuwepo kwa oksijeni, kwa hiyo, sodiamu iliyohifadhiwa chini ya mafuta ya taa haina kuchoma; fosforasi, iliyowashwa chini ya kengele iliyofungwa kwa hermetically, hutoka wakati usambazaji wa oksijeni unaopatikana umepungua (karibu 1/5 ya jumla ya hewa ya ujazo chini ya kengele); wanyama kuwekwa katika "Grotto Mbwa" kujazwa na kaboni suffocate na. na kadhalika.
Lakini ingawa katika maisha ya kila siku hewa ya anga hutumika kama hifadhi kuu ya oksijeni, kemia inaashiria idadi ya vioksidishaji vingine, kwa njia ambayo mwako unaweza kupatikana chini ya maji na katika nafasi - ama isiyo na hewa kabisa au iliyopewa gesi ambayo hakuna atomi moja ya oksijeni ... Vioksidishaji vile, vinavyoweza kutoa kiasi cha kutosha cha oksijeni kwa mwako kamili wa utungaji bila ushiriki wa hewa ya anga, ni chumvi, chumvi ya berthollet na miili mingine kadhaa iliyotajwa tayari. Shukrani kwa, kwa mfano, saltpeter, bunduki hupata uwezo wa kuchoma kwenye muzzle wa bunduki au kanuni bila ushiriki wa hewa ya anga; mwako chini ya maji ni kufikirika mradi admixture ina kioksidishaji nguvu ya kutosha si tu kwa ajili ya mwako kamili ya utungaji, lakini pia kudumisha joto katika urefu unaohitajika wakati wa mchakato wa mwako chini ya maji.
Kulingana na hapo juu, tunaona kuwa mabadiliko ya vitu vinavyoweza kuwaka (kwa mfano, mafuta) kuwa gesi kwa kutosha. joto la juu inaweza kufanyika chini ya hali nne: a) inapokanzwa bila upatikanaji wa hewa, na, kwa hiyo, oksijeni (makaa ya mawe, coke, gesi ya luminescent); b) inapokanzwa mbele ya oksijeni iliyofungwa na kemikali (H 2 O, CO 2): gesi ya maji; c) na uingizaji mdogo wa oksijeni ya bure (hewa): gesi ya jenereta; d) na upatikanaji wa hewa ya kutosha (sanduku la moto la kawaida) au kwa ugavi wa oksijeni ulioimarishwa (rasimu). - Kwa nguvu zaidi mchakato wa oxidation unafanyika na karibu na mshikamano wa kemikali wa msingi na wakala wa oxidizing na decomposer, nguvu na kasi ya udhihirisho wa mwanga na joto. Hapo juu, hali moja zaidi ilibainishwa: katika hali zingine, oxidation ya kiholela hufanyika (kuoza, kutu, mwako wa moja kwa moja), kwa zingine, inahitajika kuongeza joto (joto la kitu) kwa kiwango fulani ili kusababisha kiwanja ( oxidation ya metali za moto, mchanganyiko wao na klorini na sulfuri, kuwaka kwa mshumaa, kuni, taa, mafuta ya taa, kuwaka kwa bunduki, nk).
Kwa kuongeza: kozi zaidi ya mchakato inaweza kufanywa haraka au polepole.
Kwa hiyo, ni muhimu kutofautisha kati ya mali mbili tofauti za uwezekano wa nyenzo zinazowaka kwa moto (yaani kwa udhihirisho wa nje wa oxidation): kuwaka na kuwaka. Ya kwanza inaashiria hali ya joto ambayo kuwaka hutokea (mwanzo wa oxidation), na ya pili inaashiria kasi ambayo mchakato wa oxidation yenyewe hufanyika. Kwa pyrotechnics, ni muhimu kujua hasa moja na nyingine, kwa sababu makadirio ya kemikali ya utunzi hutegemea ufahamu wa hii, kwa suala la kuwasha kwao, na kuhusiana na ukubwa wa mwanga na muda wa mwako.
Kuhusu matukio ya kemikali yanayosababishwa na joto, Rudolf Wagner anabainisha yafuatayo: "Sayansi ya matukio ya joto katika misombo ya kemikali na mtengano," thermokemia ", bado iko mbali na kuwa na uwezo wa kueleza njia mbalimbali za mtengano na maandalizi katika viwanda vya kemikali, lakini tayari inatoa dalili kuhusu uwezekano mkubwa au mdogo na uwezekano wa athari za kemikali, kwani kwa ujumla, rahisi kupata ni misombo ambayo huundwa na kutolewa kwa joto, wakati majibu ambayo hutokea kwa kunyonya joto ni katika hali nyingi ngumu zaidi.
Kitengo cha joto ni kiasi kinachohitajika ili joto la kitengo cha uzito wa maji kutoka digrii 0 hadi 1 Celsius. Kwa mujibu wa mfumo wa decimal, kitengo cha uzito ni gramu (cm 3); kitengo cha kemikali cha joto kinachoitwa kalori kinaonyeshwa na ishara "cal" na kalori 1000 inaonyeshwa na ishara "Cal". Alama "K" (kg) inawakilisha kiasi cha joto kinachotolewa na 1 g ya maji wakati kilichopozwa kutoka kwa kiwango chake cha kuchemsha hadi kiwango cha kuganda. Sawa ya mitambo ya joto ni 425 kg / m3.
Athari za mwako na bidhaa
Mwako kamili haupo: sehemu hizo za utungaji wa mafuta ambazo hazijageuka kuwa gesi huunda moshi au sediment. Moshi sio kitu zaidi ya nyenzo ambazo hazijachomwa, zimegeuzwa kuwa vumbi bora na kuchukuliwa na mtiririko wa hewa. Mwili kama huo, pamoja na mambo mengine, ni masizi (salio la mti ambao haujachomwa), masizi (sehemu iliyobaki ya mafuta ambayo hayajachomwa), moshi wa bomba la makaa ya mawe (ambalo huning'inia juu ya miji ya kiwanda na maelfu ya poda na sasa inanyonywa. na jamii nzima), nk. Mvua mara nyingi huunda sio tu isiyochomwa, lakini pia kiwanja cha kemikali kisichoweza kuwaka (kinzani).
Kwa hiyo, tatizo la karibu pyrotechnics inajumuisha kukamilisha utunzi kama huo ambao ungewaka na utoaji mdogo wa moshi na mchanga.

Mwako husababisha moto kuonekana kwa namna ya moto au cheche; moto wa gesi yenyewe hauangazi kabisa (kama, kwa mfano, kuchoma hidrojeni wakati sodiamu inapoingizwa ndani ya maji); mwanga na rangi yake hupatikana kwa sababu ya uwepo wa miili minene kwenye moto. Kwa hiyo, kwa mfano, mwanga wa njano wa gesi ya taa ni kutokana na ukweli kwamba gesi hii inajumuisha hidrojeni na kaboni; hidrojeni ina uwezo mkubwa wa vioksidishaji kuliko kaboni, na huwaka kwa kasi na kamilifu zaidi, na kaboni, ikikusanya kwa ziada katika moto, huwapa moto mwanga na rangi ya njano. Kwa hivyo, ili kujua ikiwa moto wowote unavuta sigara, inatosha kuweka mwili wa kigeni katikati, ambapo hewa haipatikani sana: itafunikwa mara moja na mipako ya soti.
Kwamba ni miili imara ambayo hutoa mwanga kwa moto inathibitishwa na yafuatayo: ya miili yote iliyopo, hidrojeni hutoa joto kubwa zaidi wakati wa mwako, kwa sababu. huyeyusha kioo cha platinamu na mwamba; lakini moto wake ni rangi sana, wakati gesi tu - mvuke wa hidrojeni na maji hutumika kama vitu vya oksidi, lakini mara tu mchanganyiko wa dutu yoyote mnene (kwa mfano, chuma, makaa ya mawe, marumaru) unapoonekana, taa inayong'aa hupatikana (mwanga wa Drummond. )
Nguvu ya mwanga ni sawa na nishati ya oxidation: nguvu ya mwisho, juu ya joto la mwako, na kwa hiyo, nguvu ya mwako wa uchafu imara. Kwa hivyo, kwa mfano, moto wa pombe, gesi inayoangaza iliyochanganywa na hewa moto, na, mwishowe, burner ya petroli ya Unica hutoa moto wa rangi sana, lakini wana uwezo wa kutoa mwangaza mkubwa kupitia uchafu unaojulikana: balbu za umeme hutoa manjano. , mwanga dhaifu, na taa za umeme - nyeupe, kuangaza kuangaza, kwa sababu katika kesi ya kwanza voltage ya umeme bila kulinganishwa na nguvu kidogo kuliko ya pili.
Ya riba hasa ni burners za Auer, ambazo sasa hazitumiwi tu kwa gesi ya taa, lakini pia kwa petroli, pombe, asetilini na vyanzo vingine vya taa: burners hizi, zinazojumuisha mchanganyiko wa miili ya kinzani, hubadilisha mwanga dhaifu wa chanzo cha joto kali ndani. mwanga mkali, kijani kibichi au samawati.
Antimoni, makaa ya mawe na vitu vingine hutumiwa kuongeza mwangaza wa mwanga na kuongeza moto katika nyimbo za pyrotechnic.
Rangi ya moto haitokani na uchafu wenyewe, lakini pekee kutoka kwa gesi zinazoundwa kutokana na mwako wa uchafu huu; Gesi huingia kwenye moto na hutoa nyeupe, njano, nyekundu, kijani, bluu, rangi ya violet kwa moto wa kila aina ya vivuli. Uchafu huo ni chumvi za sodiamu, shaba, risasi, bariamu, strontium, antimoni, nk. Kwa hiyo, kwa mfano, sulfuri iliyochanganywa na nitrati inatoa rangi isiyojulikana wakati wa mwako, na mbele ya antimoni, nyeupe; ikiwa unaongeza nitrati ya bariamu kwa mchanganyiko wa chumvi ya berthollet na sulfuri, unapata rangi ya kijani na kadhalika.
Uchafu wa kuchorea hujumuisha zaidi misombo ya metali, lakini rangi yenyewe inategemea si tu juu ya chuma, bali pia juu ya vitu visivyo vya metali vinavyounganishwa nayo. Hii inathibitishwa kwa uwazi zaidi na jaribio lifuatalo la shaba. Shaba, kama ilivyotajwa tayari, huwaka katika gesi za sulfuri na moto mwekundu na kugeuka kuwa shaba ya sulfuri. Ikiwa shaba iliyo na mchanganyiko mdogo wa sulfuri imechomwa katika oksijeni, basi moto wa violet huundwa. Ikiwa, badala ya sulfuri, kabohaidreti imara (shellac, sukari, nk) huongezwa kwa shaba, basi moto utapata rangi ya kijani.
Joto la chumvi ya Grunspan au sulfuriki na moto wa bomba la pombe: chini ya ushawishi wa gesi za pombe, moto mkali wa kijani huundwa. Ongeza calomel kidogo au amonia kwa dutu sawa: unapata moto mkali wa bluu, kwa sababu shaba inachanganya na klorini iliyotolewa na, kuchoma, hutengeneza kloridi ya shaba (Chlorkupfer). Kloridi ya shaba chini ya ushawishi wa moto wa pombe huwaka na moto wa kijani, kwa sababu hidrojeni ya moto wa pombe huchukua klorini kutoka kwa shaba na kuifanya kuwa batili kwa heshima na rangi ya moto (CuCl 2 + 2H-2HCl + Cu). Ikiwa oksidi ya shaba (Kupferoxyd, CuO) imechomwa katika moto wa pombe, basi msingi na chini ya moto utakuwa na rangi nyeupe, na kando na mwisho wa ulimi utakuwa bluu. Hii inafafanuliwa na ukweli kwamba hidrojeni ya moto hupunguza kwanza oksidi ya shaba (CuO + 2H = Cu + H 2 O), baada ya hapo uwezo wa kuchapa wa shaba huonekana tena kwenye bahasha ya moto wa nje chini ya ushawishi wa uwezo wa oxidizing. bahasha na joto la juu sana lililomo ndani yake.
Calomel, amonia, mastic, shellac, nk hutumiwa kuimarisha "wiani" wa rangi.
Kiwango cha kuchoma cha utungaji inategemea hasa:
- kutoka kwa uhusiano wa kemikali kati ya mambo ya msingi na decomposers, tangu kiwango cha uharibifu, na hivyo kuwaka kwa msingi, inategemea kiwango cha uhusiano huu;
- kutoka kwa uwiano wa mchanganyiko, t. kwa kila mchanganyiko kuna kikomo kikubwa, juu ya kufikia ambayo utengano wa haraka na kamili wa msingi unapatikana, wakati nje ya kikomo hiki, i.e. kabla au baada yake, matokeo mabaya zaidi yanapatikana - kikomo hicho kinaitwa "kawaida";
- kutoka kwa urefu wa joto linalotengenezwa na mwako;
- juu ya wiani na usawa wa muundo;
- kutoka ushawishi wa kemikali uchafu, i.e. vipengele vya chini;
- kutoka kwa unyevu wa anga na hygroscopicity ya muundo;
- kutoka kwa joto la nje;
- hatimaye, kutoka kwa idadi ya ndogo na kubwa, sababu kuu au sekondari, kila mmoja kuwa na sehemu yake ya ushawishi juu ya mchakato wa jumla mwako wa dawa.
Uamuzi wa kiwango cha mwako huunda moja ya kazi muhimu zaidi za sanaa ya pyrotechnic, kwa sababu. kushikamana nayo ni swali la kuimarisha kiholela au kupungua kwa moto, kwa hiyo, katika maeneo ya msingi, tahadhari maalum hulipwa kwa kawaida.
Ya kwanza kwa mpangilio (mwisho wa karne ya 19) ilikuwa nadharia ya joto, waanzilishi ambao ni Malyar, Le Chatelier na Nusselt. Nadharia hii inategemea nadharia ya Van't Hough ya utegemezi wa halijoto wa kiwango cha mmenyuko wa kemikali. Hali ya mlipuko wa joto ni kutawala kwa uingizaji wa joto kutokana na majibu ya nishati juu ya uondoaji wa joto kwenye mazingira. Katika kesi hiyo, joto hujilimbikiza kwenye mfumo, ambayo inaongoza kwa joto la kibinafsi na, ipasavyo, kwa kuongeza kasi ya majibu.
Tukio la mmenyuko wa oxidation katika mfumo unaowaka mara nyingi huhusishwa na kupokanzwa kwa mfumo na chanzo kimoja au kingine cha kuwasha. Wakati mfumo unaowaka unapokanzwa, nishati ya molekuli ya mafuta na oksijeni huongezeka, na inapofikia thamani fulani, uanzishaji wao hutokea, i.e. vituo vya kazi (radicals na atomi) na valensi za bure huundwa, kama matokeo ambayo molekuli za dutu inayowaka huunda kwa urahisi kiwanja na oksijeni ya anga. A.N. Bach na K. Engler mnamo 1898 walipendekeza kwa uhuru nadharia ya peroksidi ya oxidation, kulingana na ambayo, wakati mfumo unaowaka unawaka, oksijeni huwashwa kwa kuvunja dhamana moja kati ya atomi, na molekuli inayofanya kazi huingia kwenye kiwanja na dutu inayoweza kuwaka bila kuoza. ndani ya atomi na kutengeneza misombo ya peroksidi ya aina: R 1 -OOR 2 au ROO-OH.
Hata hivyo, nadharia ya peroxide haiwezi kueleza baadhi ya vipengele vya sifa za mchakato wa oxidation, kwa mfano, hatua kali, wakati mwingine athari zisizo na maana za uchafu.
Kiwango cha mmenyuko wa kemikali, m / s, kinaweza kuonyeshwa, kwa kuzingatia sheria ya Arrhenius, na equation ifuatayo:
![]() , (1.12)
, (1.12)
ambapo ni kiwango cha mara kwa mara cha mmenyuko (kiwango cha mmenyuko wa kemikali katika viwango vya reagents, kupunguzwa kwa umoja);
Mkusanyiko wa reagents, mol / m 3;
Coefficients ya Stoichiometric, imedhamiriwa na uwiano wa viwango vya vitendanishi vya kuanzia katika equation ya mmenyuko wa stoichiometric;
Msingi wa logarithms asili;
Mara kwa mara gesi ya Universal, = 8.3 J / (mol ∙ K);
- joto, K.
Nadharia ya joto ya kujiwasha (pia inaitwa nadharia ya mlipuko wa joto) inategemea kulinganisha viwango vya kutolewa kwa joto wakati wa oxidation ya exothermic na uondoaji wa joto kutoka kwa mchanganyiko unaoitikia kwenye ukuta wa chombo kilichomo. Hali ya kujiwasha imedhamiriwa na usawa wa kasi hizi. Joto la kuta za chombo ambacho usawa huu unapatikana huitwa joto la autoignition. Kuanzia joto hili (kawaida katika kila kesi kwa hali maalum - ukubwa na sura ya chombo, mali ya thermophysical ya gesi), inapokanzwa binafsi hutokea, ambayo inaweza kusababisha flash (self-ignition).
Kwa kuzingatia hapo juu, kwa kujipasha joto katika mazingira ya kujibu, tunaweza kuandika:
ni wapi uwezo wa joto kwa kiasi cha mara kwa mara, J / K;
Uzito wa gesi, kilo / m 3;
Joto la gesi, K;
Wakati, s;
Athari ya joto ya mmenyuko, W;
Kasi ya mmenyuko, m / s;
Uso wa chombo cha mmenyuko, m 2;
Kiasi cha chombo cha majibu, m 3;
Mgawo wa uhamisho wa joto, W / (m 2 × K);
Joto la ukuta wa chombo, K.
D.A. Frank-Kamenetsky alipendekeza kigezo cha kujiwasha kwa joto kulingana na ukiukaji wa usambazaji wa halijoto tulio katika chombo tendaji kwa kiwango cha kutosha cha kutolewa kwa joto:
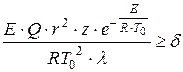 , (1.14)
, (1.14)
wapi ukubwa wa tabia ya chombo, m;
Sababu ya awali;
Mgawo wa conductivity ya mafuta mchanganyiko wa gesi, W / (m × K);
Kigezo kisicho na kipimo sawa na 3.3; 0.88 na 2, kwa mtiririko huo, kwa vyombo vya spherical, ndege-sambamba na cylindrical.
Kigezo cha D.A. Frank-Kamenetsky kinapaswa kueleweka kama ifuatavyo: ikiwa, baada ya kubadilisha vigezo vyote vinavyoamua, tunapata thamani, basi hakutakuwa na kuwasha, wakati kuwasha kunatokea. Inafuata kutoka kwa mlinganyo wa kigezo kwamba joto la mmenyuko na radius ya chombo ambamo mmenyuko hufanyika ni viashiria muhimu vya mlipuko. Mlipuko wa joto hutamkwa zaidi, bora kutokuwepo kwa usawa kunatimizwa:
Ikiwa usawa huu haujatimizwa vibaya, basi mlipuko wa joto hupungua - wakati huo huo na ongezeko la joto, dutu ya awali huwaka haraka, ambayo hupiga picha ya mlipuko.
Tukio la mwako mara nyingi huhusishwa na kupokanzwa kwa mfumo unaowaka na chanzo kimoja au kingine cha kuwasha. Kulingana na nadharia ya msomi N.N. Semyonov, mchakato wa oxidation unaambatana na kutolewa kwa joto na, chini ya hali fulani, inaweza kujitegemea kuharakisha. Mchakato huu wa kuongeza kasi ya mmenyuko wa oxidation na mpito wake hadi mwako unaitwa kujiwasha.
Katika kesi ya kujitegemea kwa joto, hutokea kutokana na ziada ya kiwango cha kutolewa kwa joto juu ya kiwango cha kuondolewa kwa joto.
Hebu tuchunguze mchakato wa kuwaka kwa joto kwa kutumia mfano wa gesi inayowaka au mvuke wa kioevu kinachoweza kuwaka na hewa, kilichowekwa kwenye chombo na kiasi. Kwa ongezeko la joto la chombo na mchanganyiko unaowaka, kiwango cha majibu na kutolewa kwa joto huongezeka. Utegemezi wa kiwango cha kutolewa kwa joto kwenye joto, J / s imedhamiriwa na:
![]() , (1.15)
, (1.15)
iko wapi joto la mwako wa gesi, J;
Kiasi cha mchanganyiko unaowaka, m 3;
Kiwango cha majibu mara kwa mara;
Mkusanyiko wa reactant, kg / m 3;
Agizo la majibu;
Nishati ya uanzishaji, J / mol;
Universal gesi mara kwa mara J / (mol · K);
Mchanganyiko wa joto, K.
Joto iliyotolewa huhamishiwa kwenye mchanganyiko unaowaka, na huwaka. Mara tu joto la mchanganyiko linapozidi joto la kuta za chombo, kuondolewa kwa joto kupitia kuta za chombo kutaanza kwa wakati wa kitengo, kulingana na tofauti ya joto kati ya mchanganyiko na kuta za chombo na imedhamiriwa. kwa utegemezi:
![]() , (1.16)
, (1.16)
wapi kiwango cha kuondolewa kwa joto kupitia kuta za chombo, J / s;
Mgawo wa uhamisho wa joto, J / (K · m 2 × s);
Uso wa kuta za chombo, m 2;
Mchanganyiko wa joto, K;
Joto la ukuta wa chombo, K

Mchoro 1.5 - Utegemezi wa kutolewa kwa joto kwenye joto kwa shinikizo tofauti
Katika Mchoro 1.5, curves 2, 3, na 4 zinaonyesha utegemezi wa kutolewa kwa joto kwenye joto kwa shinikizo tofauti na muundo sawa wa mchanganyiko. Kwa joto la mara kwa mara la chombo na kati na muundo wa mara kwa mara wa mchanganyiko, kiasi cha joto kinachoondolewa kwenye eneo la mwako kinajulikana na mstari wa moja kwa moja 1. Wakati muundo wa mchanganyiko unabadilika, kiwango cha kupoteza joto na, kwa hiyo, mteremko wa mstari wa moja kwa moja pia utabadilika. Shinikizo la juu, joto zaidi hutolewa wakati wa majibu (curve 4). Chini ya hali iliyoamuliwa na curve 2, kuwasha kwa kibinafsi hakuwezi kutokea, kwani upotezaji wa joto (mstari wa 1) ni wa juu kuliko kutolewa kwa joto kwa shinikizo hili. Hatua ya tangency ya curve 3 na mstari wa moja kwa moja inalingana na usawa kati ya joto iliyotolewa na kuondolewa - kiwango cha chini cha joto cha autoignition ya mfumo uliotolewa unaowaka chini ya masharti yaliyotolewa. Kwa usambazaji usio na maana wa nishati kutoka nje, kuwasha kwa hiari kunawezekana. Curve 4 ina sifa ya hali ambayo kujiwasha ni kuepukika, kwani joto zaidi hutolewa kuliko kuondolewa.
Kuchambua mpango hapo juu, N.N. Semyonov alianzisha utegemezi:
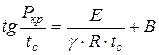 , (1.17)
, (1.17)
iko wapi shinikizo la chini la kuwasha, Pa;
Kiwango cha chini cha joto cha kujiwasha, K;
Agizo la majibu;
Mara kwa mara, kulingana na muundo na mali nyingine za mchanganyiko.
Kwa msingi wa mlingano huu (1.17), kinadharia inawezekana kuamua mapema ikiwa kuwasha kwa hiari kwa mchanganyiko unaoweza kuwaka kunawezekana chini ya hali maalum. Uhusiano kati ya shinikizo la chini na joto la autoignition imethibitishwa na majaribio mengi na ikawa muhimu katika utafiti wa michakato ya mwako.
Nadharia ya mwako wa mnyororo
Nyuma mnamo 1928, NN Semenov aliweka mbele wazo la uwezekano wa kuwepo katika mifumo ya kemikali ya aina mbili za milipuko - mnyororo na mafuta.
Athari za mnyororo huitwa athari ambazo hupitia hatua kadhaa (kupitia safu ya athari za kati), ambayo misombo ya kati na valensi za bure huundwa, kinachojulikana kama vituo vya kazi, ambavyo ni viini vya hatua za haraka za mchakato. .
Kwa mara ya kwanza, wazo la mmenyuko wa mnyororo lilionekana mnamo 1913, wakati mwanafizikia na mwanakemia wa Ujerumani M. Bodenstein aligundua kwamba wakati mchanganyiko wa hidrojeni na klorini unapoangaziwa, molekuli ya klorini, inachukua kiasi cha nishati ya mwanga, huharibika. katika atomi:
![]() .
.
Atomi za klorini hujibu papo hapo pamoja na hidrojeni, kusababisha mlipuko wa mchanganyiko. Kuamilishwa kwa molekuli moja ya klorini kunaweza kusababisha uundaji wa molekuli mbili:
![]() .
.
Walakini, majaribio yanaonyesha kuwa hii hutoa molekuli 100,000 za kloridi ya hidrojeni. Hii inaweza kuelezewa ikiwa tunadhani kwamba wakati klorini inaingiliana na hidrojeni, bidhaa huundwa, ambayo, kuingia katika athari za sekondari, huzaliwa upya na inaweza kuendelea na majibu. Dhana hii inalingana na mpango wa majibu ufuatao:
Majibu ya msingi
IV Fungua mzunguko
Kwa mujibu wa mpango huu, uanzishaji wa molekuli moja ya klorini (I) husababisha kuonekana kwa atomi mbili za klorini - vituo viwili vya kazi vya mmenyuko wa mnyororo. Kila moja ya atomi za klorini husababisha mmenyuko wake wa mnyororo, ambapo kituo cha kazi hupunguzwa kila wakati (II, III). Kwa hiyo, chini ya ushawishi wa mmenyuko wa kuanzisha (I), kuna athari zinazofuata zinazounda mnyororo (II, III, nk). Idadi ya athari kama hizo kutoka wakati wa kuanzishwa kwa mnyororo hadi kusitishwa kwake inaitwa urefu wa mnyororo. Mlolongo unaweza kuvunjika wakati atomi za klorini (IV) au atomi za hidrojeni (V) zinapogongana na kuunda molekuli kutoka kwao, au wakati vituo amilifu vinapogongana na uso wa kingo. Huu ni mmenyuko wa kawaida usio na matawi. Ndani yake, kila kituo cha kazi husababisha kuonekana kwa kituo kimoja tu kipya cha kazi, hivyo majibu yanaweza kuendelea, lakini si kuharakisha.
Katika mmenyuko wa mnyororo wa matawi, kila kituo kinachofanya kazi hutoa vituo viwili au zaidi vipya vilivyo hai.
Kwa mujibu wa nadharia ya athari za mnyororo, mchakato wa oxidation huanza na uanzishaji wa dutu inayowaka.
Mazoezi yameonyesha kuwa moto unaweza kutokea chini ya hali ya isothermal, i.e. bila kuongeza joto la kati ya mmenyuko (kuwasha "baridi" ya mchanganyiko). Katika kesi hii, mtu anazungumzia mlipuko wa mnyororo (isometric).
Vipengele viwili vya awali: mafuta na kioksidishaji, kuwa katika hali thabiti ya Masi, kabla ya kuunganishwa na molekuli mpya, thabiti zaidi za bidhaa za mwako, hupitia mlolongo mzima wa mabadiliko magumu ya kati, matokeo yake ni malezi ya bidhaa zisizo na utulivu: atomi, itikadi kali, molekuli za msisimko zilizo na kiwango kikubwa cha ionization (formaldehyde, hidrokaboni na radicals hidroksili, oksijeni ya atomiki na hidrojeni).
Kondratyev V.N. iliwezekana kugundua katika mwali wa hidrokaboni mbalimbali viwango vya juu vya oksijeni ya atomiki (O), hidroksi radical (OH), radicals hidrokaboni (CH 3), monoksidi ya kaboni (CO), formaldehyde (CH 2 O), nk. ya vitu hivi katika moto walikuwa katika maelfu na mamilioni ya mara kubwa zaidi kuliko viwango vya usawa wao wakati wa mtengano wa joto katika joto la moto la bidhaa za mwisho za mmenyuko, kwa mfano, H 2 O → H + OH.
Matokeo ya uchunguzi huu yalifanya iwezekane kuhitimisha kuwa atomi zinazozingatiwa na radicals huonekana kwenye gesi inayojibu sio kama matokeo ya mtengano wa mwisho wa bidhaa, lakini ni bidhaa za athari za kati.
Kwa hivyo, utaratibu wa mnyororo wa kuwasha ni msingi wa mlolongo mzima wa mabadiliko ya kemikali ya vitu vingine kuwa vingine, matokeo yake ni uundaji wa bidhaa zisizo na utulivu za kemikali, zinazoitwa vituo vya kazi, ambavyo huguswa kwa urahisi na kila mmoja na kwa molekuli. ya vitu vya kuanzia kuunda vituo vipya vya kazi na bidhaa za mwisho, kwa mfano, kwa mchanganyiko wa methane-hewa wa H 2 O na CO 2.
Juu reactivity radicals na atomi huelezewa na nishati ya chini ya uanzishaji ya athari zao, ambayo ni karibu na nishati ya uanzishaji wa athari za atomiki:
OH + H 2 = H 2 O + H - 25 kJ / mol
CH 3 + C 3 H 6 - 12.5 kJ / mol
CH 3 + C 6 H 6 - 23.5 kJ / mol
H 2 O → H + OH
Chembe yoyote iliyopatikana hai (H au OH), isiyo na msimamo sana na, kwa hivyo, inafanya kazi kwa kemikali, ikigongana na molekuli ya dutu ya awali, hugawanyika, na kutengeneza chembe mpya zinazofanya kazi:
H + O 2 = OH + O
OH + H 2 = H 2 O + H
Chembe hai H na OH zilizopatikana kama matokeo ya mmenyuko zitaingia kwenye athari tena, na chembe za O huingiliana na hidrojeni:
O + H 2 = OH + H.
Hiyo ni, kama matokeo ya mmenyuko kati ya chembe hai na molekuli za vitu vya awali, sio tu bidhaa za mwisho zinaundwa, lakini pia chembe mpya za kazi. Chembe hai zinazoundwa kama matokeo ya mmenyuko hutoa hatua mpya za mabadiliko ya kemikali, ambayo yatatokea hadi vitu vya awali vitakapotumiwa kabisa.
Athari kama hizo za kemikali zinazorudiwa huitwa athari za mnyororo, na chembe hai ambazo hutoa minyororo mpya ya mabadiliko huitwa vituo amilifu.
Mchakato wa mlolongo wa mwako wa hidrojeni uliojadiliwa hapo juu unaweza kuwakilishwa kama mchoro (Mchoro 1.6).
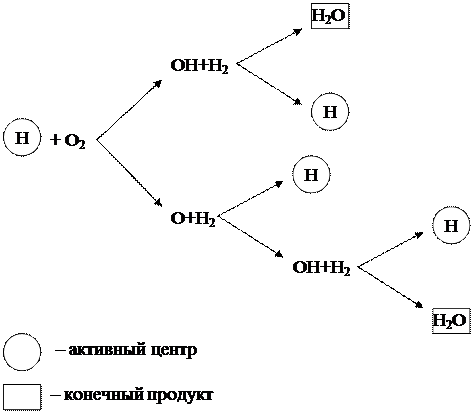
Mchoro 1.6 - Mpango wa mwako wa mnyororo wa hidrojeni
Inaweza kuonekana kutoka kwa mchoro kwamba chembe za hidrojeni (H) pekee, ambazo ni vituo hai, hutoa minyororo mpya ya mabadiliko. Katika kesi hii, katika kila kiunga cha mchakato wa mnyororo, kama matokeo ya mmenyuko kati ya kituo cha kazi H na molekuli ya oksijeni O 2, pamoja na bidhaa ya mwisho H 2 O, vituo 3 vipya vya kazi H huundwa, na kusababisha kuongezeka. kwa minyororo mipya ya mabadiliko.
Mmenyuko huo wa mnyororo, ambao hutokea kwa ongezeko la vituo vya kazi, huitwa matawi. Mwitikio hukua kama poromoko la theluji na kuendelea kwa viwango vya juu sana, kwa kiasi kikubwa kupita kiwango cha athari za kawaida za Masi.
Mmenyuko wa kawaida usio na matawi ni mmenyuko wa klorini na hidrojeni. Vituo amilifu vya mmenyuko huu ni atomi za klorini na hidrojeni zinazobadilishana. Atomu ya klorini inapoguswa, atomi moja ya hidrojeni huundwa, kama vile atomi ya hidrojeni inapoguswa, atomi moja ya klorini huundwa. Kwa hiyo, majibu yanaweza kuendelea, lakini si kuongeza kasi.
Ukweli unaojulikana kwamba mmenyuko wa picha ya klorini na hidrojeni bado huisha na mlipuko (kujiwasha) inaelezewa na ukweli kwamba kwa kiwango cha juu cha kutosha cha mmenyuko wa mnyororo, kutolewa kwa joto huzidi kuondolewa kwa joto, kwa sababu hiyo. ambayo mchanganyiko huwaka sana, na hali zinazohitajika kwa kujiwasha kwa joto hutokea.
Wakati mmenyuko wa mnyororo wa matawi unatokea, ambayo ni tabia ya hidrokaboni, mkusanyiko wa vituo vya kazi unaweza kuongezeka bila kujali hali ya uanzishwaji wa awali na, ikiwa kiwango cha malezi ya vituo vya kazi wakati wa matawi kinazidi kiwango cha kukomesha kwa mnyororo, basi kujitegemea. kuharakisha mchakato wa asili kama Banguko hutokea, na kusababisha kuwaka.
Nadharia ya athari za mnyororo ilifanya iwezekane kuelezea sifa nyingi za michakato ya mwako (ushawishi mkubwa wa uchafu, mipaka ya shinikizo la kuwasha, kichocheo na kizuizi cha shinikizo, nk), ambayo haiwezi kuelezewa na nadharia ya joto. Utaratibu wa tukio na maendeleo ya moto halisi na milipuko ni sifa ya mchakato wa mnyororo-joto. Baada ya kuanza kwa njia ya mlolongo, mmenyuko wa oxidation, kutokana na exothermicity yake, inaendelea kuharakishwa na joto. Kwa hiyo, hatimaye, hali muhimu (kikwazo) kwa mwanzo na maendeleo ya mwako itatambuliwa na kutolewa kwa joto na hali ya kubadilishana joto kati ya mfumo wa kukabiliana na mazingira.
Kwenye mnyororo athari za kemikali nyingi michakato ya kiteknolojia v sekta ya kemikali... Michakato hiyo ni pamoja na, kwa mfano, michakato ya upolimishaji ambayo huunda msingi wa uzalishaji wa mpira wa synthetic, plastiki, nyuzi za polymer na bidhaa nyingine nyingi. Pia ni pamoja na vile muhimu michakato ya viwanda kama utengenezaji wa asidi ya mafuta ya syntetisk ambayo inachukua nafasi ya mafuta ya chakula yaliyotumika hapo awali katika utengenezaji wa sabuni na mafuta, ngozi ni mchakato wa kupata mafuta ya hali ya juu kutoka kwa mafuta, nk.