Les alcanes interagissent avec de l'hydrogène. Nomenclature internationale d'Alcanov. Alkaans: structure, propriétés. Propriétés chimiques des hydrocarbures aromatiques
Les hydrocarbures limites sont de tels composés qui sont des molécules constituées d'atomes de carbone dans un état d'hybridation SP 3. Ils sont liés aux autres obligations de Sigma exclusivement covalentes. Le nom "Limite" ou "saturé" Les hydrocarbures procèdent du fait que ces composés ne sont pas capables de fixer des atomes. Ils sont extrêmement saturés. L'exception est des cycloalcanes.
Qu'est-ce que les alcanes?
Les alcanes sont des hydrocarbures de la limite et leur chaîne de carbone est claire et consiste en des atomes de carbone interconnectés en utilisant des liens simples. Il ne contient pas d'autres (c'est-à-dire double, comme des alcènes, ou triple, comme alkylov). Les Alkans sont également appelés paraffines. Ils ont obtenu ce nom, car des paraffines bien connues sont un mélange de ces hydrocarbures limites de 18-C 35 avec une inertie particulière.
Informations générales sur Alkans et leurs radicaux
Leur formule: C N P 2 N +2, ici est supérieure ou égale à 1. La masse molaire est calculée par la formule: m \u003d 14n + 2. une caractéristique: la fin de leur nom est "-an". Les restes de leurs molécules formées à la suite du remplacement des atomes d'hydrogène à d'autres atomes sont appelés radicaux aliphatiques ou alkys. Ils sont désignés par la lettre R. La formule générale pour les radicaux aliphatiques monovalents: avec NP 2 N +1, ici est supérieur ou égal à 1. La masse molaire de radicaux aliphatiques est calculée par la formule: m \u003d 14n + 1 . La caractéristique caractéristique des radicaux aliphatiques: fins dans les noms "- il. Les molécules d'Alkanov ont leurs propres caractéristiques de la structure:
- la connexion de C-C est caractérisée par une longueur de 0,154 nm;
- la connexion C-H est caractérisée par une longueur de 0,109 nm;
- l'angle de la valence (l'angle entre les liaisons de carbone-carbone) est égal à 109 degrés et 28 minutes.

La série homologue d'alcanes commence: méthane, éthane, propane, butane, etc.
Propriétés physiques de Alkanov
Les Alkais sont des substances qui n'ont pas de couleurs et insolubles dans l'eau. La température dans laquelle les alcanes commencent à fondre et la température à laquelle ils bouillir sont en hausse conformément à l'augmentation du poids moléculaire et de la longueur de la chaîne d'hydrocarbures. De moins ramifiés à des alcanes plus ramifiés, la température d'ébullition et de fusion est abaissée. Les alcanes gazeux sont capables de brûler une flamme bleu pâle ou incolore, tandis que beaucoup de chaleur se distingue. Le CH 4 -C 4 H 10 est des gaz qui sont également absents et l'odeur. C 5 H 12 -C 15 H 32 est des fluides qui ont une odeur spécifique. De 15 n 32 et ainsi de suite, ce sont des solides qui ne sentent pas non plus.
Propriétés chimiques de Alcanov
Ces composés sont peu actifs dans un plan chimique, qui peut être expliqué par la résistance des liens Sigma raffinés durement - C-C et C-N. Il convient également de garder à l'esprit que les relations avec C-C sont non polaires et SN est faible polaire. Ce sont des types de liens peu polarisables liés au Sigma de l'apparence et, en conséquence, de briser la plus grande probabilité qu'ils deviendront un mécanisme gomolitique, à la suite de laquelle les radicaux seront formés. Ainsi, les propriétés chimiques des alcanans sont principalement limitées aux réactions de la substitution radicale.

Réactions de noisette
Les Alkans interagissent uniquement avec de l'acide nitrique avec une concentration de 10% ou avec un oxyde d'azote tétraphique dans un milieu de gaz à une température de 140 ° C. La réaction de la nitration d'alcane s'appelle la réaction de Konovalov. En conséquence, des composés nitro de nitro sont formés: l'acide nitrique CH 4 + (dilué) \u003d CH 3 - N ° 2 (nitrométhane) + eau.
Réactions brûlant
Les hydrocarbures limites sont très souvent utilisés comme carburant, qui est justifié par leur capacité corporelle: avec n p 2n + 2 + ((3n + 1) / 2) O 2 \u003d (N + 1) H 2 O + N CO 2.
Réactions d'oxydation
Dans les propriétés chimiques des Alcanans, il comprend également leur capacité à oxydater. Selon les conditions qui sont accompagnées de la réaction et de la manière dont elles sont modifiées peuvent être obtenues à partir de la même substance pour obtenir divers produits finaux. L'oxydation douce de l'oxygène de méthane en présence d'un catalyseur qui accélère la réaction et les températures d'environ 200 ° C peuvent entraîner les substances suivantes:
1) 2CH 4 (oxydation d'oxygène) \u003d 2SH 3 IT (alcool - méthanol).
2) CH 4 (oxydation d'oxygène) \u003d CH 2 O (aldéhyde - méthanal ou formaldéhyde) + N 2 O.
3) 2CH 4 (oxydation d'oxygène) \u003d 2NSON (acide carboxylique - méthane ou formique) + 2N 2 O.

En outre, l'oxydation des alcanes peut être produite dans un air gazeux ou liquide. De telles réactions entraînent la formation d'alcools gras plus élevés et d'acides correspondants.
Attitude de chauffer
À des températures ne dépassant pas + 150-250 ° C, nécessairement en présence d'un catalyseur, un réarrangement structurel de substances organiques se produit, ce qui consiste à changer l'ordre du composé d'atomes. Ce processus s'appelle l'isomérisation et les substances obtenues à la suite de la réaction - isomères. Ainsi, de la normale butane, il allume son isomère - isobutane. À des températures de 300 à 600 ° C et de la présence du catalyseur, il existe une rupture de liaisons C-H pour former des molécules d'hydrogène (réaction de déshydrogénation), des molécules d'hydrogène avec une fermeture de chaîne de carbone dans un cycle (réaction de cyclisation ou réactions d'aromatisation de la cyclisation ou d'alkanov):
1) 2CH 4 \u003d C 2 H 4 (Eten) + 2N 2.
2) 2CH 4 \u003d C 2 H 2 (Ethin) + 3H 2.
3) C 7 H 16 (heptane normal) \u003d C 6 H 5 - CH 3 (toluène) + 4N 2.

Réactions d'halogénation
De telles réactions sont dans l'introduction d'halogènes (leurs atomes) dans la molécule de substance organique, à la suite de laquelle la connexion C-halogène est formée. Dans l'interaction des alcanes avec des halogènes, des dérivés halogènes sont formés. Cette réaction a des caractéristiques spécifiques. Il procède par le mécanisme du radical et correctement approprié, il est nécessaire d'affecter les halogènes et les alcananais pour affecter les rayons ultraviolets ou simplement le chauffer. Les propriétés des alcanans permettent à la réaction d'halogénation de s'écouler jusqu'à ce que la substitution complète des atomes d'halogène soit obtenue. C'est-à-dire que la chloration du méthane ne se termine pas par une étape et la production de chlorure de méthyle. La réaction ira plus loin, tous les produits de substitution possibles seront formés, en commençant par le chlorométhane et se terminant par du tétrachlorométhane. Les effets du chlore dans ces conditions sur d'autres alcanes entraîneront la formation de divers produits obtenus à la suite d'un remplacement d'hydrogène dans différents atomes de carbone. De la température à laquelle la réaction est en cours, le rapport des produits finis et la vitesse de leur formation dépendront. Plus la chaîne hydrocarbonée d'Alkane est longue, plus il sera plus facile d'aller cette réaction. Lorsque l'halogénation, l'atome de carbone sera d'abord remplacé par le moins hydrogéné (tertiaire). Primaire entrera dans la réaction après tous les autres. La réaction d'halogénation se produira par étapes. Sur la première étape, un seul atome d'hydrogène est substitué. Avec des solutions halogènes (chlore et eau de brome), les alcanes n'interagissent pas.

Sulfooling réactions
Les propriétés chimiques des alcanans sont également complétées par la réaction sulfooling (elle s'appelle la réaction de la réaction). Lorsqu'il est exposé au rayonnement ultraviolet, les alcanes sont capables de réagir avec un mélange de chlore et de dioxyde de soufre. En conséquence, le chlorure est formé, ainsi qu'un radical alkyle, qui joint du dioxyde de soufre. En conséquence, un composé complexe est obtenu, qui devient stable en raison de la capture de l'atome de chlore et de la destruction de sa molécule: R-H + SO 2 + CL 2 + rayonnement ultraviolet \u003d R-SO 2 CL + HCL. Les chlorures de sulfonyle formés à la suite de la réaction sont largement utilisés dans la production de tensioactifs.
Les composés organiques les plus simples sont hydrocarburescomposé de carbone et d'hydrogène. En fonction de la nature des liaisons chimiques chez les hydrocarbures et la relation entre le carbone et l'hydrogène, elles sont divisées en limitation et imprévues (alcènes, alcins, etc.)
Limiteles hydrocarbures (alcanes, hydrocarbures de la rangée de méthane) sont les composés de carbone avec de l'hydrogène, dont chaque atome de carbone dépense sur un composé avec tout autre atome voisin de pas plus d'une valence et toute la valence non autorisée à être connectée. à l'hydrogène carbone. Tous les atomes de carbone dans les alcanes sont dans SP 3 - condition. Limiter les hydrocarbures forment une série homologue caractérisée par la formule générale DE n. N. 2n + 2. . La priorité twin de cette série est le méthane.
Isomeria. Nomenclature.
Alkans avec N \u003d 1,2,3 peut exister uniquement sous la forme d'un isomère
À partir de N \u003d 4, le phénomène de l'isomérisme structurel apparaît.

Le nombre d'isomères structurels d'alcanes augmente rapidement avec une augmentation du nombre d'atomes de carbone, par exemple, pentane a 3 isomères, heptane - 9, etc.
Le nombre d'isomères d'alcane augmente et en raison de stéréoisomères éventuels. À partir de C 7 N 16, l'existence de molécules chirales qui forment deux énantiomères sont possibles.
Nomenclature des alcanes.
La nomenclature dominante est la nomenclature IUPAC. Dans le même temps, il présente des éléments de noms triviaux. Ainsi, les quatre premiers membres de la série homologue d'alcanes ont des noms triviaux.
CH 4 - méthane
De 2n 6 - éthane
C 3 H 8 - Propane
Avec 4 h 10 - Bhoutan.
Les noms des homologues restants sont formés de la latine grecque numérique. Ainsi, pour les membres suivants d'un certain nombre de bâtiments normaux (non ramés), les noms sont utilisés:
À partir de 5 h 12 - Pentan, de 6 h 14 - Hexane, de 7 h 18 - Heptane,
À partir de 14 h 30 - tétradecan, de 15 h 32 - Pentadecan, etc.
Règles de base de l'IUPAC pour Alcanov ramifié
a) Choisissez la plus longue chaîne non ramifiée, dont le nom est la base (racine). Cette base ajoutez suffixe "an"
b) numéro de cette chaîne sur le principe des moindres casiers,
c) Le substituant indique comme préfixes dans l'ordre alphabétique indiquant l'emplacement de l'emplacement. S'il y a plusieurs substituants identiques dans la structure du ressort, leur nombre indique le chiffrement grec.
En fonction du nombre d'autres atomes de carbone avec lesquels l'atome de carbone est directement connecté, distingué: atomes primaires, secondaires, tertiaires et quaternaires.


Les groupes alkyle ou les radicaux alkyle sont décrits comme des substituants dans des alcools ramifiés, qui sont considérés comme le résultat de la déduction de la molécule d'alcane d'un atome d'hydrogène.
Le nom des groupes alkyle formes du nom des alcanes correspondants en remplaçant le dernier suffixe "an" à la soffix "il".
Ch 3 - méthyle
CH 3 CH 2 - ETHYL
CH 3 CH 2 CH 2 - propyle

Pour le nom de groupes alkyle ramifiés, la numérotation de la chaîne est également utilisée:

À partir d'éthane, les alcanes sont capables de former des conformres, ce qui correspond à la conformation inhibée. La possibilité de transition d'une conformation inhibée à une autre à travers l'obscurci est déterminée par la barrière de la rotation. Déterminer la structure, la composition de conformes et barrières de rotation sont les tâches d'analyse de la conformation. Méthodes d'obtention d'alcanes.
1. Distillation fractionnée de la fraction d'huile de gaz naturel ou d'essence.De cette manière, les alcanes individuels peuvent être séparés à 11 atomes de carbone.
2. Hydrogénation du charbon.Le processus est effectué en présence de catalyseurs (oxydes et sulfures de molybdène, tungstène, nickel) à 450-470 ° C et pressions jusqu'à 30 MPa. Le charbon et le catalyseur sont triturés en poudre et hydrogénés hydrogénés et hydrogénés hydrogène à travers une suspension. Les mélanges résultants des alcanes et des cycloalcanes sont utilisés comme carburant à moteur.
3. Hydrogénation CO et avec 2 .
CO + H 2 Alcanes
CO 2 + H 2 Alcanes
CO, Fe et d'autres sont utilisés comme catalyseurs de ces réactions. D - Éléments.
4. Hydrogénation d'alcènes et d'alcins.

5. Synthèse métalorganique.
mais). Synthèse de Watza.
2Rhal + 2na R R + 2Nahal
Cette synthèse est inappropriée si deux halolennas différentes sont utilisées comme réactifs organiques.
b). Protolyse des réactifs grignaires.
R hal + mg rmghal
Rmghal + hoh rh + mg (oh) hal
dans). Interaction des dialkipriprats au lithium (LIR 2 CU) avec halogénures d'alkyle
LIR 2 CU + R X R R + RCU + LIX
Les dialkiprats au lithium eux-mêmes sont obtenus par une méthode en deux étapes.
2R LI + CUI LIR 2 CU + LII
6. Électrolyse des sels carboxyliques (Sintez Kolbe).
2RCOONA + 2H 2 O R R R + 2CO 2 + 2NAOH + H 2

7. Rouleau de sels d'acide carboxylique avec des alcalis.
La réaction est utilisée pour synthétiser les alcanes inférieurs.
8. Hydrogénolyse des composés carbonyliques et halolyanov.
mais). Composés carbonyliques. Synthèse de Clément.

b). Halogènes. Hydrogénolyse catalytique.
![]()
Ni, PT, PD sont utilisés comme catalyseurs.
c) halogènes. Récupération du réactif.
RHRAL + 2HI RH + HHAL + I 2
Propriétés chimiques des alcanes.
Toutes les connexions des alcanes sont peu polaires, à ce sujet, elles sont caractérisées par des réactions radicales. L'absence de liaisons PI rend impossible la réaction de la fixation. Pour les alcanans, la réaction de la substitution, du clivage, de la combustion est caractéristique.
|
Tapez et nom de la réaction | |
|
1. Réactions de substitution | |
|
A) avec des halogènes (de chloromCl. 2 -Et léger, Fr. 2 - lors du chauffage) Réaction obéit règle Markovnik (règles Markovnikova) - Principalement, l'halogène remplace l'hydrogène dans l'atome de carbone le moins hydrogéné. La réaction passe en phase - pour une étape à une étape, plus d'un atome d'hydrogène est remplacé. Le moyen le plus difficile de réagir de l'iode et, avec de plus, la réaction ne va pas à la fin, car, par exemple, avec l'interaction du méthane à l'iode, l'hydrogène d'iodure est formé, réagissant avec du méthyle d'iodure avec la formation de méthane et d'iode (réaction réversible): |
CH 4 + CL 2 → CH 3 CL + HCL (chlorométhane) CH 3 CL + CL 2 → CH 2 CL 2 + HCL (dichlorométhane) CH 2 CL 2 + CL 2 → CHCL 3 + HCL (trichlorométhane) CHCL 3 + CL 2 → CCL 4 + HCl (tétrachlorométhane). |
|
B) Nutting (Réaction de Konovalov) Les Alkans réagissent avec une solution d'acide nitrique de 10% ou une oxyde d'azote N 2 O 4 dans la phase gazeuse à une température de 140 ° et une légère pression avec la formation de nitro produisant. La réaction obéit également la règle de Markovnikov. L'un des atomes d'hydrogène est remplacé par le résidu n ° 2 (groupe nitro) et l'eau est distingué |
|
|
2. Réactions de clivage | |
|
A) déshydrogénation -Opt hydrogène. Conditions de réaction Catalyseur - Platine et température. |
CH 3 - CH 3 → CH 2 \u003d CH 2 + H 2 |
|
B) craquage Le processus de décomposition thermique des hydrocarbures, basé sur la réaction du scission de la chaîne de carbone de grandes molécules pour former des connexions avec une chaîne plus courte. À une température de 450 à 700 ° O, les alcanes se désintégrèrent en raison de la rupture des liaisons C-C (des liaisons C-Npri plus durables d'une telle température sont préservées) et des alcanes et des alcènes sont formés avec un nombre réduit d'atomes de carbone. |
C. 6 H. 14 C. 2 H. 6 + C. 4 H. 8 |
|
C) Décomposition thermique complète |
CH 4 C + 2H 2 |
|
3. Réactions d'oxydation | |
|
A) réaction de brûlure Lors de l'allumage (T \u003d 600 ° C), les alcanes réagissent avec de l'oxygène, tandis que leur oxydation se produit du dioxyde de carbone et de l'eau. |
C N 2N + 2 + O 2 -\u003e CO 2 + H 2 O + Q CH 4 + 2O 2 -\u003e CO 2 + 2H 2 O + Q |
|
B) oxydation catalytique- Avec une température relativement basse et l'utilisation de catalyseurs est accompagnée d'une ventilation d'une seule partie des liaisons de C-TROPLED au milieu de la molécule et du C-N et utilisée pour obtenir des produits précieux: acides carboxyliques, cétones, aldéhydes, alcools. |
Par exemple, avec une oxydation incomplète de butane (la liaison de communication C 2 -C 3) est obtenue par acide acétique |
|
4. Réactions d'isomérisation arakterna pas pour tout Alkanov. L'attention est attirée sur la possibilité de convertir un isomère à d'autres, la présence de catalyseurs. |
C 4 H 10 C 4 H 10 |
|
5.. Alkans avec la chaîne principale de 6 atomes de carbone ou plus aussi réagir déshydrocyclisation, mais il y aura toujours un cycle à 6 chaînons (cyclohexane et ses dérivés). Dans les conditions de réaction, ce cycle est soumis à une déshydrogénation ultérieure et se transforme en un cycle de benzol plus stable divertiquement plus stable d'hydrocarbure aromatique (arène). |
|
Mécanisme de réaction d'halogénation:
Haloge
L'halogénation des alcanes procède à travers un mécanisme radical. Pour initier la réaction, un mélange d'alcane et d'halogène est nécessaire pour irradier la lumière ou la chaleur des UV. La chloration de méthane ne s'arrête pas au stade de l'obtention de chlorure de méthyle (si des quantités équimolaires de chlore et de méthane sont prises) et conduit à la formation de tous les produits de substitution possibles, de chlorure de méthyle au tétrachloroupar. La chloration d'autres alcanes conduit à un mélange de produits de remplacement d'hydrogène dans différents atomes de carbone. Le rapport de produits de chloration dépend de la température. Le taux de chloration des atomes primaires, secondaires et tertiaires dépend de la température, à basse température, la vitesse diminue dans la rangée: tertiaire, secondaire, primaire. Avec une température croissante, la différence entre les vitesses diminue jusqu'à ce qu'elle devienne la même. Outre le facteur cinétique, la répartition des produits de chloration a un impact d'un facteur statistique: la probabilité de l'attaque de chlore est 3 fois inférieure à la primaire et deux fois comme secondaire. Ainsi, la chloration des alcanes est une réaction non stéréo-sélective, éliminant les cas où un seul produit de monochloration est possible.
L'halogénation est l'une des réactions de la substitution. L'halogénation d'Alkanov obéit la règle des règles de Markovnik (règles de Markovnikov) - principalement halogène l'atome de carbone le moins hydrogéné. L'halogénation alcanan passe progressivement - en une étape, pas plus d'un atome d'hydrogène est halogéné.
CH 4 + CL 2 → CH 3 CL + HCL (chlorométhane)
CH 3 CL + CL 2 → CH 2 CL 2 + HCL (dichlorométhane)
CH 2 CL 2 + CL 2 → CHCL 3 + HCL (trichlorométhane)
CHCL 3 + CL 2 → CCL 4 + HCl (tétrachlorométhane).
Sous l'action de la lumière, la molécule de chlore décompose aux atomes, puis attaquent des molécules de méthane, déchirant à l'atome d'hydrogène, en conséquence, des radicaux méthyle sont formés, qui sont confrontés à des molécules de chlore, les détruisant et formant de nouveaux radicaux.
Nitching (réaction de Konovalov)
Les Alkans réagissent avec une solution d'acide nitrique de 10% ou une oxyde d'azote N 2 O 4 dans la phase gazeuse à une température de 140 ° et une légère pression avec la formation de nitro produisant. La réaction obéit également la règle de Markovnikov.
RH + HNO 3 \u003d RNO 2 + H 2 O
c'est-à-dire que l'un des atomes d'hydrogène est remplacé par le résidu n ° 2 (ni-trogroupe) et l'eau est distingué.
Les caractéristiques de la structure des isomères sont fortement reflétées au cours de cette réaction, car il est plus facile de substituer l'atome d'hydrogène dans le groupe de nitro dans le résidu SI (existant uniquement dans certains isomères), l'hydrogène du groupe CH2 est Moins facilement, et encore plus difficile - dans le rebnant ch 3.
Les paraffines sont assez faciles à porter dans la phase gazeuse à 150-475 ° C de dioxyde d'azote ou d'acide nitrique; Dans ce cas, cela arrive en partie et. oxydation. Le filetage du méthane est presque exclusivement de nitrométhane:
Toutes les données disponibles indiquent un mécanisme de radical libre. À la suite de la réaction, des mélanges de produits sont formés. L'acide nitrique à la température ordinaire n'agit presque pas sur des hydrocarbures de paraffine. Lorsqu'il est chauffé, il agit principalement comme agent oxydant. Cependant, comme j'ai trouvé M. I. Konovalov (1889), l'acide nitrique chauffant agit en partie et la "contrainte"; La réaction de la nitration avec de l'acide nitrique faible est particulièrement bien sous chauffage et pression élevée. La réaction de la nitration est exprimée par l'équation.
Suivant le méthane, les homologues donnent un mélange de nitroparaphines différentes dues à la fractionnement du passage. Lorsque la nitrogénation d'éthane est obtenue, Nitroetan Ch 3 -CH 2 -NO 2 et Nitrométhane CH 3 -NO 2. Un mélange de nitroparaffines est formé à partir du propane:
Les paraffines de noisettes dans la phase gazeuse sont maintenant effectuées à l'échelle industrielle.
Sulfooling:
Une réaction importante est la sulfocyloration des alcanans. Lorsque l'alcane interagit avec l'arydrure de chlore et du soufre, l'hydrogène est remplacé par un groupe chlorosulfonyle:

Étapes de cette réaction:
CL + R: H → R + HCL
R + SO 2 → RSO 2
RSO 2 + cl: CL → RSO 2 CL + CL
Les alcanofochlorures sont facilement hydrolysés à l'alcanésulfoxylost (RSO 2 OH), dont les sels de sodium (RSO 3¯ Na + - alcanfonate de sodium) présentent des propriétés similaires aux summs et sont utilisés comme déterminants.
Propriétés physiques. Dans des conditions normales, les quatre premiers membres de la série homologue d'alcanans (à partir de 1 - avec 4) sont des gaz. Alcanes normales du pentane à l'heptadecan (C 5 - C 17 ) - Liquides, à partir de 18 et plus - solides. Comme le nombre d'atomes de carbone augmente dans la chaîne, c'est-à-dire Avec une augmentation du poids moléculaire relatif, la température d'ébullition et de fusion des alcanes augmente. Avec le même nombre d'atomes de carbone dans la molécule alcane alcavée avec une structure ramifiée, il y a des points d'ébullition plus bas que les alcanes normaux.
Alcana Pratiquement insoluble dans de l'eau, car leurs molécules sont peu polaires et n'interagissent pas avec les molécules d'eau, elles sont bien solubles dans des solvants organiques non polaires, tels que le benzène, le tétrachlorométhane, etc. Les alcanes liquides sont facilement mélangés les uns avec les autres.
Les principales sources naturelles d'alcanan - huile et gaz naturel. Diverses fractions pétrolières contiennent des alcanes deC 5 H 12 Jusqu'à 30 h 62. Le gaz naturel est constitué de méthane (95%) avec un mélange d'éthane et de propane.
De méthodes synthétiques d'obtentionalcanov Vous pouvez sélectionner les points suivants: /\u003e
une . Obtention d'hydrocarbures insaturés. L'interaction des alcènes ou des alcins avec de l'hydrogène ("hydrogénation") se produit en présence de catalyseurs métalliques (/\u003e NI, PD ) Comme
chauffage:
Ch w - C ≡sn + 2N 2 → CH 3 -CH 2 -CH 3.
2. Sortir halogènes. Lors du chauffage des alcanans substitués monogalogènes avec un sodium métallique, des alcanes sont obtenus avec des atomes de carbone à deux numéros (réaction de Würtz): /\u003e
C 2 H 5 BR + 2 NA + BR - C 2 H 5 → C 2 H 5 - C 2 H 5 + 2 Nabr..
Cette réaction n'est pas effectuée avec deux différents substitué par halogène Alkaniens, parce qu'il allume un mélange de trois alcanes différents
3. Obtention des sels d'acide carboxylique. Lors de la fusion de sels d'acide carboxylique anhydre avec des alcalis, des alcanes sont obtenus contenant un atome de carbone inférieur à la chaîne de carbone des acides carboxyliques d'origine: /\u003e
4. méthane. Dans l'arc électrique brûlant dans l'atmosphère d'hydrogène, une quantité importante de méthane est formée: /\u003e
C + 2N 2 → CH 4 .
La même réaction est livrée avec chauffage au carbone dans une atmosphère d'hydrogène à 400-500 ° C à une pression élevée en présence d'un catalyseur.
Dans des conditions de laboratoire, le méthane est souvent obtenu au carbure d'aluminium:
A l 4. C 3 + 12N 2 O \u003d ZSN 4 + 4Al (oh) 3.
Propriétés chimiques. Dans des conditions normales, les alcanes sont chimiquement inertes. Ils résistent à de nombreux réactifs: n'interagissez pas avec du soufre concentré et des acides nitriques, avec des alcalis concentrés et fondues, ne sont pas oxydés par des oxydants puissants - Permanganate de potassiumKMN.Environ 4, etc.
La stabilité chimique des alcanes est due à une résistance élevées -connexions C-S et C-N, ainsi que leur non-polarité. Les obligations non polaires C-C et C-H dans les alcanes ne sont pas sujettes à la rupture des ions, mais sont capables de diviser les homologies sous l'influence des radicaux libres actifs. Par conséquent, les réactions radicales sont caractéristiques des alcanans, à la suite de laquelle des composés sont obtenus, où des atomes d'hydrogène sont substitués par d'autres atomes ou groupes d'atomes. Par conséquent, les alcanes entrent dans la réaction qui traverse le mécanisme de substitution radical indiquée par le symboleS r ( de l'anglaissubstitution. radicalique). Selon ce mécanisme, les atomes d'hydrogène dans le secteur tertiaire, puis aux atomes de carbone secondaires et primaires sont ensuite remplacés.
1. Halogénation. Lorsque l'interaction des alcanans avec des halogènes (chlore et bromom) sous l'action du rayonnement UV ou de température élevée, un mélange de produits de mono- substitué en polyhalogène Alcanans. Le diagramme global de cette réaction est indiqué sur l'exemple de méthane: /\u003e
b) croissance de la chaîne. Le radical du chlore prend un atome d'hydrogène à la molécule d'alcane:
Cl.· + CH 4 → NA /\u003e L + CH 3 ·
Dans le même temps, un radical alkyle est formé, qui prend l'atome de chlore à la molécule de chlore:
CH 3 · + C L 2 → CH 3 avec L + C l.·
Ces réactions sont répétées jusqu'à ce que le circuit se décompose selon l'une des réactions:
Cl.· + Cl.· → avec L /\u003e 2, CH 3 · + CH 3 · → C 2 H 6, CH 3 · + Cl.· → CH 3 avec l ·
Équation de réaction totale:
| hv | ||
| CH 4 + SL 2 | → | CH 3 CL + HCL. |
Le chlorométhane formant peut être soumis à une nouvelle chloration, donnant un mélange de produitsCH 2 Cl. 2, CHCL 3, SS L 4 Selon le schéma (*).
Le développement de la théorie de la chaîne radical libre Les réactions sont étroitement liées au nom d'un scientifique russe exceptionnel, le prix Nobel Lauréate N.I. Semenova (1896-1986).
2. Nutting (réaction de Konovalov). Sous l'action de diluer l'acide nitrique aux alcanes à 140 ° C et une basse pression coule une réaction radicale: /\u003e
Avec des réactions radicales (halogénation, nitration), les atomes d'hydrogène dans le secteur tertiaire, puis aux atomes de carbone secondaires et primaires sont mélangés. Ceci s'explique par le fait que le plus léger de l'atome de carbone tertiaire avec de l'hydrogène (énergie de liaison 376 (390 kJ / mol), et seulement - primaire (415 kJ / mol), est alors plus facile.
3. Isomérisation. Les alcanes normaux sous certaines conditions peuvent se transformer en alcanes avec une chaîne ramifiée: /\u003e
4. L'évacuation est une rupture hémolytique de connexions C-C, qui coule lorsqu'elles sont chauffées et sous l'action des catalyseurs.
À la fissuration des plus hauts alcools, des alcènes et des alcanes inférieurs sont formés, l'acétylène est formé pendant la fissuration du méthane et de l'éthane: /\u003e
C /\u003e 8 h 18 → C 4 H 10 + C 4N 8, /\u003e
2SH 4 → C 2 H 2 + ZN 2,
C 2 H 6 → C 2 H 2 + 2N 2.
Ces réactions ont une grande valeur industrielle. De cette manière, des fractions d'huile à ébullition (huile de carburant) sont converties en essence, au kérosène et à d'autres produits précieux.
5. Oxydation. Avec l'oxydation légère d'oxygène de méthane en présence de divers catalyseurs, d'alcool méthylique, de formaldéhyde, de l'acide formique peut être obtenu:
 |
Oxydation catalytique douce de l'oxygène aérien butane - une des méthodes industrielles de production d'acide acétique:
t.°
2 C 4 /\u003e H /\u003e 10 + 5 O /\u003e 2 → 4 CH /\u003e 3 COOH /\u003e + 2N 2 O .
Chat.
Sur l'air alcana Brûler à CO 2 et H 2 O: /\u003e
Avec n 2 n +2 + (s n.+1) / 2O 2 \u003d N avec 2 + (N +1) H 2 O.
Alkais (limitant les hydrocarbures, les paraffines)
- Alcana - Hydrocarbures extrêmes aliphatiques (acycliques) dans lesquels des atomes de carbone sont interconnectés par des connexions simples (simples) dans des chaînes non ramifiées ou ramifiées.
Alcana - Le nom des hydrocarbures limites sur la nomenclature internationale.
Paraffines- Nom historiquement établi, reflétant les propriétés de ces composés (de la Lat. parrum affinis - avoir peu d'affinité, lowactive).
Limite, ou alors saturéCes hydrocarbures sont appelés en raison de la saturation complète des atomes de chaîne de carbone d'hydrogène.
Les représentants les plus simples d'Alkanov:
Modèles de molécules:


Lors de la comparaison de ces composés, il est clair qu'ils diffèrent les uns des autres pour le groupe. -Ch 2 - (méthylène). Ajouter un autre groupe au propane -Ch 2 -, Je reçois du bhoutan À partir de 4 h 10puis alcana À partir de 5 n 12, De 6 h 14 etc.
Maintenant, vous pouvez retirer la formule générale des Alkanans. Le nombre d'atomes de carbone dans une rangée d'alcanov nous allons prendre n.
, alors le nombre d'atomes d'hydrogène sera la magnitude 2n + 2.
. Par conséquent, la composition d'Alcanov correspond à la formule générale C n h 2n + 2.
Par conséquent, une telle définition est utilisée:
Alcana - hydrocarbures dont la composition est exprimée par la formule générale C n h 2n + 2où n. - le nombre d'atomes de carbone.
La structure de l'alcanan
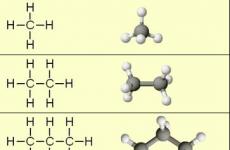
Structure chimique (L'ordre des composés d'atomes de molécules) des alcanes les plus simples - méthane, éthane et propane - montrent leurs formules structurelles, illustrées à la section 2. De ces formules, il est clair qu'il existe deux types de cravates chimiques dans des alcanes:
C-S. et C-n..
La communication C-C est une non-polaire covalente. La communication C - H est un covalent faibleolaire, car Le carbone et l'hydrogène sont proches de l'électronégabilisation (2,5 - pour le carbone et 2,1 - pour l'hydrogène). La formation de liaisons covalentes en alcanes en raison des paires électroniques générales d'atomes de carbone et d'hydrogène peut être montrée à l'aide de formules électroniques:

Les formules électroniques et structurelles reflètent structure chimiquemais ne donnez pas d'idées sur la structure spatiale des moléculesqui affecte considérablement les propriétés de la substance.
Structure spatiale. La disposition relative des atomes de molécules dans l'espace dépend de la direction d'orbitales atomiques (AO) de ces atomes. Dans les hydrocarbures, le rôle principal est joué par l'orientation spatiale des orbitales de carbone, car le 1S-AO sphérique de l'atome d'hydrogène est privé d'une certaine orientation.
L'agencement spatial du carbone AO \u200b\u200bdépend à son tour du type d'hybridation (partie I, section 4.3). Un atome de carbone riche en alcanes est associé à quatre autres atomes. Par conséquent, son état correspond à SP 3-hybridation (partie I, section 4.3.1). Dans ce cas, chacun des quatre SP 3-hybrides de carbone AO \u200b\u200best impliqué dans l'axial (σ-) se chevauchant de l'hydrogène S-AO ou avec SP 3 -AO d'un autre atome de carbone, formant une liaison σ avec S-H ou C-C.

Quatre σ-liaisons de carbone sont dirigées dans l'espace à un angle de 109 ° C 28 ", ce qui correspond à la plus petite répulsion des électrons. Par conséquent, la molécule du plus simple représentatif des alcanes - méthane CH 4 - a la forme d'un tétraèdre , au centre de laquelle il y a des atomes de carbone, et aux sommets - atomes d'hydrogène:

Le coin de la valence du N-C-N est 109 ® 28 ". La structure spatiale du méthane peut être montrée à l'aide de modèles en vrac (échelle) et de scaleline.
Pour l'enregistrement, il est pratique d'utiliser une formule spatiale (stéréochimique).

Dans la molécule du prochain homologue - éthane avec 2 h 6 - deux tétraédrique sp. 3 tapis de carbone forment une structure spatiale plus complexe:

Pour les molécules d'alcanov contenant plus de 2 atomes de carbone, des formes incurvées sont caractéristiques. Cela peut être indiqué sur l'exemple n.-Butan (modèle VRML) ou n.-Penta:

Isomériya alcanov
- Isomerius - L'apparence des composés ayant la même composition (la même formule moléculaire), mais une structure différente. Ces composés sont appelés isométreurs.
Différences dans l'ordre du composé d'atomes dans des molécules (c'est-à-dire dans la structure chimique) conduisent à isoméria structurelle. La structure des isomères structurels est reflétée par des formules structurelles. Dans un certain nombre d'alcanans, l'isomérisme structurel est manifesté lorsque le contenu de 4 atomes de carbone et plus dans le circuit est, c'est-à-dire En commençant par Bhoutan avec 4 h 10.
Si dans des molécules de même composition et la même structure chimique, divers agencements mutuels d'atomes dans l'espace sont possibles, puis observé isomérisme spatial (stéréoisomérie). Dans ce cas, l'utilisation de formules structurelles n'est pas suffisante et les modèles de molécules ou de formules spéciales doivent être utilisés - stéréochimique (spatiale) ou projection.
Les alcanes, à partir d'éthane H 3 C-CH 3, existent sous diverses formes spatiales ( conformité) en raison de la rotation intramoléculaire de σ-liaisons C-C et manifestent le soi-disant isomérisme rotatif (conformationnel).
De plus, s'il y a un atome de carbone dans la molécule associée à 4 substituants différents, un autre type d'isomérisme spatial est possible, lorsque deux stéréoisomères appartiennent à l'autre comme objet et son image miroir (juste comme la main gauche fait référence à droite ). De telles différences dans la structure des molécules sont appelées isomeria optique.
Isomérums structurels Alkanov
- Isomères structurels - composés de la même composition, caractérisés par la procédure pour les atomes de liaison, c'est-à-dire Structure chimique des molécules.
La cause de la manifestation de l'isomérisme structurel d'une rangée d'alcool est l'équipement d'atomes de carbone pour former des circuits de diverses structures. Ce type d'isomérisme structurel est appelé squelette de carbone isomeria.
Par exemple, la composition d'Alkan C 4 H 10 peut exister comme deux Isomères structurels:

et alkan c 5 h 12 - sous la forme trois isomères structurels, caractérisés par la structure de la chaîne de carbone:

Avec une augmentation du nombre d'atomes de carbone dans la composition des molécules, les possibilités de ramification de la chaîne, c'est-à-dire La quantité d'isomères augmente un seuil du nombre d'atomes de carbone.

Les isomères structurels sont distingués par des propriétés physiques. Alcanes avec une structure ramifiée en raison de l'emballage moins dense de molécules et, en conséquence, des interactions intermoléculaires plus petites, faites bouillir la température que leurs isomères non ramifiés.
Dans la sortie des formules structurelles des isomères, les techniques suivantes utilisent.
Les hydrocarbures sont les composés organiques les plus simples. Ils sont du carbone et de l'hydrogène. Les composés de ces deux éléments sont appelés hydrocarbures limites ou alcanes. Leur composition est exprimée en général pour les alcanes avec la formule CNH2N + 2, où n est le nombre d'atomes de carbone.
En contact avec
Odnoklassniki.
Alkana - Nom international des composés de données. De plus, ces composés sont appelés paraffines et hydrocarbures saturés. La communication dans les molécules d'alcananes est simple (ou célibataire). La valence restante est saturée d'atomes d'hydrogène. Tous les alcanes sont saturés d'hydrogène à la limite, ses atomes sont dans un état d'hybridation SP3.
Gamme homologique d'hydrocarbures limitatifs
 Le premier de la rangée homologue d'hydrocarbures saturés est le méthane. Sa formule CH4. La fin est -an au nom des hydrocarbures limitants, c'est une caractéristique distinctive. Ensuite, conformément à la formule ci-dessus, l'éthane - C2H6 est située dans une série homologue, le propane C3H8, Butane - C4H10.
Le premier de la rangée homologue d'hydrocarbures saturés est le méthane. Sa formule CH4. La fin est -an au nom des hydrocarbures limitants, c'est une caractéristique distinctive. Ensuite, conformément à la formule ci-dessus, l'éthane - C2H6 est située dans une série homologue, le propane C3H8, Butane - C4H10.
De la cinquième alcana La série homologue des titres des composés est formée comme suit: le nombre grec indiquant le nombre d'atomes d'hydrocarbures dans la molécule + end -an. Ainsi, dans les garcaires, le numéro 5 - Pande, respectivement, le Pentan - C5H12 va pour le Bhoutan. Suivant - Hexane C6H14. Heptane - C7H16, octan - C8H18, Nonane - C9H20, Dean - C10H22, etc.
Les propriétés physiques des alcanans changent de nettement dans la série homologue: le point de fusion, le point d'ébullition augmente, la densité augmente. Le méthane, l'éthane, le propane, le butane dans des conditions normales, c'est-à-dire à une température d'environ 22 degrés de chaleur Celsius, sont des gaz, avec du pentane sur hexadécan inclus - liquides, avec des solides heptadecans. À partir du Bhoutan, Alcanan a des isomères.
Il y a des tables réfléchissant changements dans la rangée homologue des alcanansqui reflètent clairement leurs propriétés physiques.
Nomenclature des hydrocarbures saturés, leurs dérivés
 Si l'atome d'hydrogène est séparé de la molécule d'hydrocarbures, des particules monovalentes sont formées, appelées radicaux (R). Le nom du radical donne l'hydrocarbure, à partir desquels ce radical est produit, tandis que l'extrémité -ning change à la fin. Par exemple, un radical méthyle radical est formé de méthane pendant la séparation de l'atome d'hydrogène, de l'éthane-éthyle, du propane-propyle, etc.
Si l'atome d'hydrogène est séparé de la molécule d'hydrocarbures, des particules monovalentes sont formées, appelées radicaux (R). Le nom du radical donne l'hydrocarbure, à partir desquels ce radical est produit, tandis que l'extrémité -ning change à la fin. Par exemple, un radical méthyle radical est formé de méthane pendant la séparation de l'atome d'hydrogène, de l'éthane-éthyle, du propane-propyle, etc.
Les radicaux sont également formés de composés inorganiques. Par exemple, à un acide nitrique, il est possible d'obtenir un radical monovalent -no2 radical, appelé nitroup.
Lors de la séparation de la molécule Alkan Deux atomes d'hydrogène sont formés par des radicaux bivalents, dont les noms sont également formés à partir du nom des hydrocarbures correspondants, mais la fin des changements à:
- orin, dans le cas où les atomes d'hydrogène sont déchirés d'un atome de carbone,
- ilen, dans le cas où les deux atomes d'hydrogène sont déchirés de deux atomes de carbone voisins.
Alcana: propriétés chimiques
Considérez les réactions caractéristiques des alcanans. Tous les alcanes sont inhérents aux propriétés chimiques générales. Ces substances sont peu actives.
Toutes les réactions connues impliquant des hydrocarbures sont divisées en deux types:
- communication S-H (un exemple est une réaction de substitution);
- Écart de communication C-C (craquage, formation de pièces individuelles).
Très actif au moment de la formation radicale. Par eux-mêmes, ils existent des actions de secondes. Les radicaux entrent facilement dans la réaction entre eux. Leurs électrons non appariés forment une nouvelle connexion covalente. Exemple: CH3 + CH3 → C2H6
Les radicaux entrent facilement dans la réaction avec des molécules organiques. Ils leur sont le joints, ou sont séparés d'eux un électron imparfaitable d'eux, à la suite de laquelle de nouveaux radicaux apparaissent, ce qui, à son tour, peut entrer dans des réactions avec d'autres molécules. Avec une telle réaction en chaîne, des macromolécules sont obtenues, ce qui cessez de ne se développer que lorsque la chaîne se casse (exemple: la connexion de deux radicaux)
Les réactions des radicaux libres expliquent de nombreux processus chimiques importants, tels que:
- Explosions;
- Oxydation;
- Huile de craquage;
- Polymérisation de composés insaturés.
 Détail envisager des propriétés chimiques Hydrocarbures saturés sur l'exemple de méthane. Nous avons déjà considéré la structure de la molécule d'Alkane. Les atomes de carbone sont situés dans la molécule de méthane dans l'état d'hybridation SP3 et une connexion assez durable est formée. Le méthane est une base de gaz d'odeur et de couleurs. C'est plus facile que l'air. Dans l'eau un peu de solvant.
Détail envisager des propriétés chimiques Hydrocarbures saturés sur l'exemple de méthane. Nous avons déjà considéré la structure de la molécule d'Alkane. Les atomes de carbone sont situés dans la molécule de méthane dans l'état d'hybridation SP3 et une connexion assez durable est formée. Le méthane est une base de gaz d'odeur et de couleurs. C'est plus facile que l'air. Dans l'eau un peu de solvant.
Alkana peut brûler. Le méthane brûle avec une flamme bleue. Dans ce cas, le résultat de la réaction sera du monoxyde de carbone et de l'eau. Lorsqu'il est mélangé avec de l'air, ainsi que dans un mélange avec de l'oxygène, en particulier si le rapport des volumes est de 1: 2, les données des mélanges explosifs des formes d'hydrocarbures, c'est pourquoi il est extrêmement dangereux pour une utilisation dans la vie quotidienne et les mines. Si le méthane brûle pas complètement, la suie est formée. Dans l'industrie, on obtient ainsi.
Le formaldéhyde et l'alcool méthylique sont obtenus de méthane par oxydation en présence de catalyseurs. Si le méthane est fortement chauffé, il se désintègre par la formule CH4 → C + 2H2
Décomposition de méthane Vous pouvez mettre en œuvre sur le produit intermédiaire dans des fours spécialement équipés. Un produit intermédiaire sera l'acétylène. Formule de réaction 2CH4 → C2H2 + 3H2. La libération d'acétylène du méthane réduit les coûts de production presque deux fois.
De plus, l'hydrogène est également obtenu à partir de méthane, produisant une conversion de méthane avec une vapeur d'eau. Caractéristique du méthane sont des réactions de substitution. Ainsi, à une température conventionnelle, l'hydrogène de la molécule de méthane est déplacé à la lumière de l'halogène (CL, BR). Ainsi, des substances sont formées, appelées dérivés halogènes. Atomes de chlore, remplacement des atomes d'hydrogène dans la molécule d'hydrocarbures, formant un mélange de connexions différentes.
Dans un tel mélange, le chlorométhane (ch3 cl ou le chlorure de méthyle), dichlorométhane (chlorure de méthylène ch2cl2ili), trichlorométhane (CHCL3 ou chloroforme), tétrachlorométhane (CCL4 ou tétrachlorure de carbone).
L'un de ces composés peut être isolé du mélange. En production, le chloroforme et le tétrachlorométhane sont importés, du fait qu'ils sont des solvants de composés organiques (graisse, résines, caoutchouc). Les dérivés halogènes sont formés par un mécanisme radical libre à chaîne.
La lumière affecte les molécules de chlore, à la suite de laquelle ils se désintègrent Les radicaux inorganiques qui déchirent l'atome d'hydrogène avec un électron de la molécule de méthane. Dans le même temps, HCL et méthyle sont formés. La méthyle réagit avec une molécule de chlore, entraînant un dérivé d'halogène et un radical de chlore. Ensuite, le radical de chlore continue la réaction de la chaîne.
À des températures normales, le méthane a suffisamment de résistance aux alcalis, aux acides, de nombreux oxydants. Exception - acide nitrique. La réaction avec elle est formée de nitrométhane et de l'eau.
Les réactions de connexion pour le méthane ne sont pas caractéristiques, car toutes les valences de sa molécule sont saturées.
Les réactions dans lesquelles des hydrocarbures peuvent avoir lieu non seulement avec la scission de la connexion C-H, mais également avec la ventilation de C-S. De telles transformations se produisent en présence de températures élevées. et catalyseurs. Ces réactions comprennent la déshydrogénation et la fissuration.
Parmi les hydrocarbures saturés par oxydation, les acides sont obtenus - acétique (de butane), acides gras (de la paraffine).
Obtention de méthane
 Dans la nature méthane Large répandu. C'est la principale composante de la majorité des gaz naturels et artificiels combustibles. Il est distingué des réservoirs de charbon dans les mines, du bas du marais. Les gaz naturels (qui sont très perceptibles dans les gaz associés des champs de pétrole) contiennent non seulement du méthane, mais également d'autres alcanes. L'utilisation de ces substances est variée. Ils sont utilisés comme carburant, dans divers secteurs, en médecine et à la technologie.
Dans la nature méthane Large répandu. C'est la principale composante de la majorité des gaz naturels et artificiels combustibles. Il est distingué des réservoirs de charbon dans les mines, du bas du marais. Les gaz naturels (qui sont très perceptibles dans les gaz associés des champs de pétrole) contiennent non seulement du méthane, mais également d'autres alcanes. L'utilisation de ces substances est variée. Ils sont utilisés comme carburant, dans divers secteurs, en médecine et à la technologie.
Dans les conditions de laboratoire, ce gaz est isolé lorsque le mélange est chauffé par acétate de sodium + hydroxyde de sodium, ainsi que la réaction d'aluminium et de carbure d'eau. Le méthane est également obtenu à partir de substances simples. Pour ces conditions obligatoires sont le chauffage et le catalyseur. L'importance industrielle obtient la synthèse de méthane basée sur la vapeur d'eau.
Le méthane et ses homologues peuvent être obtenus en calcinant les sels d'acides organiques appropriés avec des alcalis. Une autre façon d'obtenir des alcanans est la réaction de la Würz, à laquelle la production monogalogénique avec du sodium métallique est chauffée.