Palamisteorian perusteet. Palamistyypit, niiden ominaisuudet. Palamisen molekyylienergia
Ensimmäinen kronologisesti (1800 -luvun loppu) oli lämpöteoria, jonka perustajat ovat Malyar, Le Chatelier ja Nusselt. Tämä teoria perustuu Van't Houghin hypoteesiin nopeuden lämpötilariippuvuudesta kemiallinen reaktio... Lämpöräjähdyksen ehtona on lämmöntuonnin hallitsevuus, joka johtuu reaktioenergiasta lämmönpoiston sisällä ympäristöön... Tässä tapauksessa järjestelmään kerääntyy lämpöä, mikä johtaa itsestään kuumenemiseen ja vastaavasti reaktion kiihtymiseen.
Hapettumisreaktion esiintyminen palavassa järjestelmässä liittyy useimmiten järjestelmän lämmitykseen yhden tai toisen sytytyslähteen avulla. Palavaa järjestelmää lämmitettäessä polttoaine- ja happimolekyylien energia kasvaa, ja kun se saavuttaa tietyn arvon, niiden aktivointi tapahtuu, ts. muodostuu aktiivisia keskuksia (radikaaleja ja atomeja), joilla on vapaita valensseja, minkä seurauksena palavan aineen molekyylit muodostavat helposti yhdisteen ilmakehän hapen kanssa. A.N. Bach ja K. Engler vuonna 1898 ehdottivat itsenäisesti hapettumisen peroksiditeoriaa, jonka mukaan palavaa järjestelmää kuumennettaessa happi aktivoituu rikkomalla yksi sidos atomien välillä ja aktiivinen molekyyli tulee yhdisteeseen palavan aineen kanssa hajoamatta. atomeiksi ja muodostaa peroksidiyhdisteitä, jotka ovat tyyppiä: R1 -OOR 2 tai ROO -OH.
Peroksiditeoria ei kuitenkaan pysty selittämään joitain ominaisuudet hapetusprosessi, esimerkiksi terävä toiminta, joskus vähäisiä epäpuhtauksien jälkiä.
Kemiallisen reaktion nopeus, m / s, voidaan ilmaista Arrhenius -lain perusteella seuraavalla yhtälöllä:
![]() , (1.12)
, (1.12)
missä on reaktion nopeusvakio (kemiallisen reaktion nopeus reagenssien pitoisuuksina pelkistettynä yhtenäiseksi);
Reagenssien konsentraatio, mol / m 3;
Stoikiometriset kertoimet, jotka määritetään stökiometrisen reaktioyhtälön lähtöreagenssien konsentraatioiden suhteella;
Luonnollisten logaritmien perusta;
Yleinen kaasuvakio, = 8,3 J / (mol ∙ K);
- lämpötila, K.
Lämpöteoria itsesyttyminen (jota kutsutaan myös termisen räjähdyksen teoriaksi) perustuu lämmön vapautumisnopeuksien vertaamiseen eksotermisen hapetuksen ja lämmön poistamisen aikana reaktioseoksesta sitä sisältävän astian seinässä. Itsesyttymisolosuhteet määräytyvät näiden nopeuksien yhtäläisyyden mukaan. Astian seinämien lämpötilaa, jossa tämä tasa -arvo saavutetaan, kutsutaan itsesyttymislämpötilaksi. Tästä lämpötilasta (joka on tyypillistä tietyille erityisolosuhteille-astian koko ja muoto, kaasun termofysikaaliset ominaisuudet) alkaen alkaa itsestään kuumentua, mikä voi johtaa salamaan (itsesyttymiseen).
Ottaen huomioon edellä mainitut asiat, kun lämmitetään itse reagoivassa ympäristössä, voimme kirjoittaa:
missä on lämpökapasiteetti vakiotilavuudella, J / K;
Kaasun tiheys, kg / m 3;
Kaasun lämpötila, K;
Ajat;
Reaktion lämpövaikutus, W;
Reaktionopeus, m / s;
Reaktioastian pinta, m 2;
Reaktioastian tilavuus, m3;
Lämmönsiirtokerroin, W / (m 2 × K);
Aluksen seinämän lämpötila, K.
D.A. Frank-Kamenetsky ehdotti termistä itsesyttymiskriteeriä, joka perustuu suihkusäiliön paikallaan olevan lämpötilan jakautumisen rikkomiseen riittävällä lämmön vapautumisnopeudella:
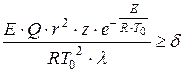 , (1.14)
, (1.14)
missä on aluksen ominaiskoko, m;
Ennakoiva tekijä;
Lämmönjohtavuuskerroin kaasuseos, W / (m × K);
Mitaton kriteeri on 3,3; 0,88 ja 2 pallomaisille, tasosuuntaisille ja lieriömäisille astioille.
D.A. Frank-Kamenetskin kriteeri on ymmärrettävä seuraavasti: jos saamme arvon sen jälkeen, kun olemme korvanneet kaikki määrittävät parametrit, sytytys ei tapahdu. Kriteeriyhtälöstä seuraa, että reaktion lämpö ja sen säteen säde, jossa reaktio tapahtuu, ovat tärkeitä räjähdyksen määrääviä tekijöitä. Lämpöräjähdys on sitä voimakkaampi, mitä paremmin eriarvoisuus täyttyy:
Jos nämä eriarvoisuudet täyttyvät huonosti, lämpöräjähdys rappeutuu - samanaikaisesti lämpötilan nousun kanssa alkuperäinen aine palaa nopeasti, mikä räjäyttää räjähdyskuvan.
Palamisen puhkeaminen liittyy useimmiten palavan järjestelmän kuumenemiseen yhden tai toisen sytytyslähteen avulla. Akateemikko N.N. Semyonov, hapetusprosessiin liittyy lämmön vapautuminen ja se voi tietyissä olosuhteissa kiihtyä itsestään. Tätä hapettumisreaktion kiihtymisprosessia sen siirtyessä palamiseen kutsutaan itsesyttymiseksi.
Termisen itsesyttymisen tapauksessa se johtuu siitä, että lämmön vapautumisnopeus ylittää lämmön poistonopeuden.
Harkitse termistä itsesyttymisprosessia palavan kaasun tai höyryn esimerkillä syttyvä neste ilmalla, asetetaan tilavuusastiaan. Kun astian ja palavan seoksen lämpötila nousee, reaktionopeus ja lämmön vapautuminen lisääntyvät. Lämmön vapautumisnopeuden riippuvuus lämpötilasta J / s määräytyy seuraavasti:
![]() , (1.15)
, (1.15)
missä on kaasun palamislämpö, J;
Palavan seoksen tilavuus, m 3;
Reaktionopeus vakio;
Reagoivan aineen pitoisuus, kg / m 3;
Reaktio järjestys;
Aktivointienergia, J / mol;
Yleinen kaasuvakio J / (mol · K);
Seoksen lämpötila, K.
Vapautunut lämpö siirtyy palavaan seokseen ja se lämpenee. Heti kun seoksen lämpötila ylittää astian seinien lämpötilan, lämpö poistuu astian seinien läpi ajan yksikköä kohti suhteessa seoksen ja astian seinien väliseen lämpötilaeroon. riippuvuuden perusteella:
![]() , (1.16)
, (1.16)
missä on lämmön poistonopeus astian seinien läpi, J / s;
Lämmönsiirtokerroin, J / (K · m 2 × s);
Astian seinien pinta, m 2;
Seoksen lämpötila, K;
Aluksen seinämän lämpötila, K

Kuva 1.5 - Lämmön vapautumisen riippuvuus lämpötilasta eri paineissa
Kuviossa 1.5 käyrät 2, 3 ja 4 osoittavat lämmön vapautumisen riippuvuuden lämpötilasta eri paineissa ja samalla seoskoostumuksella. Säiliön ja väliaineen vakioissa lämpötiloissa ja seoksen vakiokoostumuksessa palamisvyöhykkeeltä poistetulle lämmölle on ominaista suora viiva 1. Kun seoksen koostumus muuttuu, lämpöhäviön nopeus ja siten , myös suoran kaltevuus muuttuu. Mitä suurempi paine, sitä enemmän lämpöä syntyy reaktion aikana (käyrä 4). Käyrän 2 määrittämissä olosuhteissa itsesyttymistä ei voi tapahtua, koska lämpöhäviö (linja 1) on suurempi kuin lämmön vapautuminen tässä paineessa. Käyrän 3 tangenttipiste suoralla vastaa vapautuneen ja poistetun lämmön välistä tasapainoa - tietyn palavan järjestelmän itsesyttymisen minimilämpötilassa tietyissä olosuhteissa. Jos energiansaanti on vähäistä ulkopuolelta, syttyminen on mahdollista. Käyrä 4 kuvaa olosuhteita, joissa itsesyttyminen on väistämätöntä, koska lämpöä vapautuu enemmän kuin poistetaan.
Analysoimalla yllä olevaa kaavaa N.N. Semjonov vahvisti riippuvuuden:
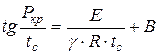 , (1.17)
, (1.17)
missä on pienin sytytyspaine, Pa;
Minimi itsesyttymislämpötila, K;
Reaktio järjestys;
Vakio, riippuen seoksen koostumuksesta ja muista ominaisuuksista.
Tämän yhtälön (1.17) perusteella on teoriassa mahdollista määrittää etukäteen, onko palavan seoksen syttyminen itsestään mahdollista tietyissä olosuhteissa. Minimipaineen ja itsesyttymislämpötilan välinen suhde on vahvistettu lukuisilla kokeilla ja osoittautunut arvokkaaksi palamisprosesseja tutkittaessa.
Ketjun palamisteoria
Vuonna 1928 NN Semenov esitti ajatuksen mahdollisesta olemassaolosta kemiallisissa järjestelmissä kahden tyyppisiä räjähdyksiä - ketju- ja termisiä.
Ketjureaktioita kutsutaan reaktioiksi, jotka käyvät läpi useita vaiheita (useiden välireaktioiden kautta), joissa muodostuu vapaita valensseja sisältäviä väliyhdisteitä, ns. Aktiivisia keskuksia, jotka ovat prosessin seuraavien nopeiden vaiheiden ytimiä.
Ajatus ketjureaktiosta ilmestyi ensimmäisen kerran vuonna 1913, kun saksalainen fyysikko ja kemisti M.Bodenstein havaitsi, että kun vedyn ja kloorin seos valaistaan, kloorimolekyyli, joka absorboi valon energian kvantin, hajoaa atomeihin:
![]() .
.
Klooriatomit reagoivat välittömästi vedyn kanssa, mikä johtaa seoksen räjähdykseen. Yhden kloorimolekyylin aktivoituminen aiheuttaisi kahden molekyylin muodostumisen:
![]() .
.
Kokeet osoittavat kuitenkin, että tämä tuottaa 100 000 kloorivetymolekyyliä. Tämä voidaan selittää, jos oletamme, että kloorin ollessa vuorovaikutuksessa vedyn kanssa muodostuu tuote, joka toissijaisiin reaktioihin siirtyessään syntyy uudelleen ja voi jatkaa reaktiota. Tämä olettamus vastaa seuraavaa reaktiokaaviota:
I Ensisijainen reaktio
IV Avoin piiri
Tämän kaavion mukaan yhden kloorimolekyylin (I) aktivointi aiheuttaa kahden klooriatomin - kahden ketjureaktion aktiivisen keskuksen - ilmestymisen. Jokainen klooriatomi saa aikaan oman ketjureaktionsa, jossa aktiivinen keskus pienenee jatkuvasti (II, III). Siten aloitusreaktion (I) vaikutuksesta on seuraavia reaktioita, jotka muodostavat ketjun (II, III jne.). Tällaisten reaktioiden määrää ketjun alkamishetkestä sen päättymiseen kutsutaan ketjun pituudeksi. Ketju voi katketa, kun kloori (IV) tai vetyatomi (V) törmää ja muodostaa niistä molekyylejä tai kun aktiiviset keskukset törmäävät kiinteän aineen pintaan. Tämä on tyypillinen haarautumaton ketjureaktio. Siinä jokainen aktiivinen keskus aiheuttaa vain yhden uuden aktiivisen keskuksen, joten reaktio voi jatkua, mutta ei kiihtyä.
Haarautuvassa ketjureaktiossa jokainen aktiivinen keskus synnyttää kaksi tai useampia uusia aktiivisia keskuksia.
Ketjureaktioiden teorian mukaan hapetusprosessi alkaa palavan aineen aktivoinnilla.
Käytäntö on osoittanut, että syttyminen voi tapahtua isotermisissä olosuhteissa, ts. lisäämättä reagoivan väliaineen lämpötilaa (seoksen "kylmä" sytytys). Tässä tapauksessa puhutaan ketju (isometrinen) räjähdyksestä.
Kaksi alkukomponenttia: polttoaine ja hapetin, jotka ovat suhteellisen vakaassa molekyylitilassa, ennen kuin ne yhdistyvät uusiin, vakaampiin palamistuotemolekyyleihin, käyvät läpi koko ketjun monimutkaisia välimuunnoksia, joiden seurauksena muodostuu epävakaita tuotteita: atomit, radikaalit, viritetyt molekyylit, joilla on suhteellisen suuri ionisaatioaste (formaldehydi, hiilivety- ja hydroksyyliradikaalit, atomihappo ja vety).
Kondratjev V.N. eri hiilivetyjen liekistä oli mahdollista havaita korkeat pitoisuudet atomihappoa (O), hydroksiradikaalia (OH), hiilivetyradikaaleja (CH 3), hiilimonoksidia (CO), formaldehydiä (CH 2 O) jne. Näitä liekissä olevia aineita oli tuhansia ja miljoonia kertoja suurempi kuin niiden tasapainokonsentraatiot termisen hajoamisen aikana lopullisten reaktiotuotteiden, esimerkiksi H 2O → H + OH, liekin lämpötilassa.
Näiden havaintojen tulokset mahdollistivat sen johtopäätöksen, että tarkasteltavat atomit ja radikaalit esiintyvät reagoivassa kaasussa ei tuotteiden lopullisen hajoamisen vuoksi, vaan ovat välituotteita.
Sytytysketjun mekanismi perustuu siis tiettyjen aineiden kemiallisten muutosten kokonaiseen ketjuun toisiksi, minkä seurauksena kemiallisesti erittäin aktiivisia epävakaita tuotteita, joita kutsutaan aktiivisiksi keskuksiksi, muodostuu erillisissä välivaiheissa, jotka reagoivat helposti keskenään ja lähtöaineiden molekyylien kanssa muodostaen uusia aktiivisia keskuksia ja lopputuotteita, esimerkiksi H20: n ja CO 2: n metaani-ilma-seokselle.
Radikaalien ja atomien korkea reaktiivisuus selittyy niiden reaktioiden alhaisella aktivointienergialla, joka on lähellä atomireaktioiden aktivointienergiaa:
OH + H2 = H20 + H - 25 kJ / mol
CH3 + C3H6 - 12,5 kJ / mol
CH3 + C6H6 - 23,5 kJ / mol
H20 → H + OH
Mikä tahansa saaduista aktiivisista hiukkasista (H tai OH), jotka ovat erittäin epävakaita ja siksi kemiallisesti aktiivisia ja törmäävät alkuperäisen aineen molekyyliin, jakautuu muodostaen uusia aktiivisia hiukkasia:
H + 02 = OH + O
OH + H2 = H20 + H
Reaktion tuloksena saadut aktiiviset hiukkaset H ja OH siirtyvät uudelleen reaktioihin ja O -hiukkaset ovat vuorovaikutuksessa vedyn kanssa:
O + H 2 = OH + H.
Toisin sanoen aktiivisten hiukkasten ja lähtöaineiden molekyylien välisen reaktion seurauksena muodostuu paitsi lopputuotteita myös uusia aktiivisia hiukkasia. Reaktion seurauksena muodostuneet aktiiviset hiukkaset synnyttävät uusia kemiallisen muutoksen vaiheita, joita tapahtuu, kunnes lähtöaineet ovat täysin kuluneet.
Tällaisia toistuvia kemiallisia reaktioita kutsutaan ketjureaktioiksi, ja aktiivisia hiukkasia, jotka synnyttävät uusia transformaatioketjuja, kutsutaan aktiivisiksi keskuksiksi.
Edellä käsitelty vedyn palamisen ketjuprosessi voidaan esittää kaaviona (kuva 1.6).
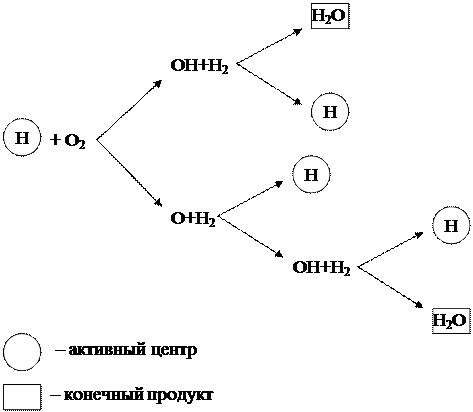
Kuva 1.6 - Vedyn ketjupolttokaavio
Kaaviosta voidaan nähdä, että vain vety (H) -hiukkaset, jotka ovat aktiivisia keskuksia, synnyttävät uusia transformaatioketjuja. Tässä tapauksessa ketjuprosessin jokaiseen lenkkiin aktiivisen keskuksen H ja happimolekyylin O 2 välisen reaktion tuloksena muodostuu lopputuotteen H20 lisäksi 3 uutta aktiivista keskustaa H, jolloin syntyy uusille muutosketjuille.
Tällaista ketjureaktiota, joka tapahtuu aktiivisten keskusten lisääntyessä, kutsutaan haarautuneiksi. Reaktio kehittyy kuin lumivyöry ja etenee erittäin nopeasti, ylittäen merkittävästi tavallisten molekyylireaktioiden nopeuden.
Tyypillinen haarautumaton ketjureaktio on kloorin vuorovaikutus vedyn kanssa. Tämän reaktion aktiiviset keskukset ovat vuorottelevia kloori- ja vetyatomeja. Kun klooriatomi reagoi, muodostuu yksi vetyatomi, aivan kuten vetyatomi reagoi, yksi klooriatomi. Siksi reaktio voi jatkua, mutta ei kiihtyä.
Tunnettu tosiasia, että kloorin fotokemiallinen reaktio vedyn kanssa päättyy edelleen räjähdykseen (itsesyttyminen), selitetään sillä, että riittävän suurella ketjureaktion nopeudella lämmön vapautuminen ylittää lämmönpoiston josta seos lämpenee voimakkaasti ja syntyy lämpö itsesyttymiseen tarvittavat olosuhteet.
Kun tapahtuu haarautuneen ketjun reaktio, joka on ominaista hiilivedyille, aktiivisten keskusten pitoisuus voi kasvaa riippumatta alkuvaiheen olosuhteista ja jos aktiivisten keskusten muodostumisnopeus haarautumisen aikana ylittää ketjun päättymisnopeuden, syntyy kiihtyvä, lumivyörymäinen prosessi, joka johtaa syttymiseen.
Ketjureaktioiden teoria on antanut mahdollisuuden selittää monia palamisprosessien piirteitä (epäpuhtauksien voimakas vaikutus, itsesyttymispainerajat, katalyysi ja paineen esto jne.), Joita ei voida selittää lämpöteorialla. Todellisten tulipalojen ja räjähdysten syntymis- ja kehittymismekanismille on ominaista yhdistetty ketju-lämpöprosessi. Käynnistettyään ketjussa hapettumisreaktio kiihtyy eksotermisen vaikutuksensa vuoksi edelleen lämmön vaikutuksesta. Siksi lopulta kriittiset (rajoittavat) olosuhteet palamisen alkamiselle ja kehittymiselle määräytyvät lämmön vapautumisen ja reagoivan järjestelmän ja ympäristön välisen lämmönvaihdon olosuhteiden mukaan.
Monet perustuvat kemiallisiin ketjureaktioihin. tekniset prosessit v kemianteollisuus... Tällaisia prosesseja ovat esimerkiksi polymerointiprosessit, jotka muodostavat perustan synteettisten kumien, muovien, polymeerikuitujen ja monien muiden tuotteiden valmistukselle. Niihin kuuluu myös sellaisia tärkeitä teolliset prosessit kuten synteettisten rasvahappojen tuotanto, jotka korvaavat pesuaineiden valmistuksessa aiemmin käytetyt syötävät rasvat, halkeilu - prosessi korkealaatuisen polttoaineen saamiseksi öljystä jne.
Räjähdysenergia
Räjähteiden tärkeimmät edut muihin energialähteisiin nähden ovat kompakti, siirrettävyys ja se, että energian vapautuminen voi jatkua lyhyitä aikoja jonka avulla voit kehittää valtavia valmiuksia. Joten pallomaisen varauksen räjähdyksessä, jonka massa on 1 kg ja tiheys 1,65 g / cm3, joka on valmistettu voimakkaasta räjähteestä - RDX, joka on viritetty (käynnistetty) keskellä, räjähtävän muutoksen etenemisnopeus aineen läpi (räjähdys) on 8300 m / s. Tapa r(varauksen säde), joka kulkee räjähdyksen läpi, määritetään tasa -arvosta
missä Gup - vastaavasti varauksen massa ja tiheys.
Prosessin toteutusaika - τ = r / D (D- räjähdysnopeus).
Virta N(kJ / e), joka kehittyy räjähdyksen aikana, voidaan arvioida tietämällä vapautuneen lämmön määrä q 1 kg RDX: n räjähdysmäisellä muutoksella:
RDX: lle q= 5420 kJ / kg. Laskettu teho on yliarvioitu, koska aikaa, jonka aikana laajenevat kaasut tekevät työtään, ei otettu huomioon. On huomattava, että se ylittää maailman suurimpien voimalaitosten kapasiteetin. Räjähteitä, jotka kykenevät niin nopeaan muutokseen, kutsutaan räjäytys.
Käynnistysräjähteet eristetään räjähdysaineista, joita käytännössä ei ole itsesovellus ja sitä käytetään vain räjähteiden valmistukseen. Räjähdysaineet (sytytinkorkit, räjähdyspatruunat, sulakkeet, räjähtävät johdot jne.) Yhdistetään erityiseen alaryhmään. Korkeat räjähteet, ponneaineet ja räjähteet muodostavat ryhmän räjähteitä. Sekä räjähdyksen aikana että palamisen aikana räjähdysaineiden muuttumiselle kaasuille asetetaan lisäedellytyksiä: ponneaineille - vakaa palaminen suunnitellulla nopeudella eri paineissa, räjähteiden räjäytykselle - erittäin suuri muutoksen etenemisnopeus aine.
Räjähteet kykenevät kuitenkin muutakin kuin vain nopeisiin muutoksiin. Jos sytytät pienen määrän räjähteitä tavanomaisin keinoin ja annat sen palaa ilmakehässä estämättä kaasujen evakuointia, palaminen etenee hitaasti ja rauhallisesti. Tämä on perusta menetelmälle, jolla hävitetään käyttökelvottomat räjähteet polttamalla, ja pätevä toteutus on melko turvallinen ja kätevä. Virheellisen palamisen sattuessa voi syntyä tilanteita, joissa palaminen muuttuu spontaanisti räjähdykseksi ja räjähteet muuttuvat nopeammin kaasuiksi.
Mikä on räjähdys? Räjähdys on aineen fysikaalinen tai kemiallinen muutos, jossa sen energia muuttuu nopeasti itse aineen tai sen muuntumistuotteiden ja ympäristön puristus- ja liikeenergiaksi Räjähdyksen energia voi olla erilainen. Kemiallisten, sähköisten, ydinvoima-, ydin-, lämpö-, kineettisten ja elastisten puristusenergioiden vapautumiseen voi liittyä räjähtäviä prosesseja. Esimerkiksi materiaalien tuhoamiseen tarkoitetussa sähköpurkausmenetelmässä käytetään mikroläjähdyksiä, joiden energialähde on sähköpurkaus ja energian kantajana ovat haihtumis- ja hajoamistuotteet tai yksinkertaisesti väliaineen lämmitys, jossa purkaus kuljetetaan. ulos. Painekaasupullojen, höyrykattiloiden ja astioiden tuhoutumisen aiheuttama räjähdys korkeapaine voi myös edetä suurella nopeudella ja aiheuttaa vakavia vahinkoja ympäröivälle alueelle.
Tärkeintä on kuitenkin potentiaalisen kemiallisen energian käyttö, joka monissa aineissa tietyissä olosuhteissa (kemiallisen reaktion seurauksena) voi nopeasti muuttua puristettujen kaasujen energiaksi. Tällaisiin muutoksiin kykeneviä aineita kutsutaan räjähdysaineiksi ja räjähdyksiä kemiallisiksi. Seuraavassa tarkoitamme vain räjähdyksellä ilman erityisiä varauksia kemiallinen räjähdys, ja kaikki tarkasteltavat prosessit liittyvät kemiallisen räjähdyksen aikana tapahtuviin prosesseihin.
Räjähdyksen voi kuvata vapautuneen energian määrällä. Koska tämä prosessi on joskus asetettu laitteiston parametreilla (esimerkiksi pneumaattisilla lähettimillä - kammion tilavuuden ja paineilman paineen mukaan), on voitava määrittää sen energia. Pneumaattisella emitterillä se on yhtä suuri kuin PV /(k- 1), missä R- paineistetun kaasun paine; V - kammion tilavuus; k - korjauskerroin (ilmalle k= 1.4), sähköiselle kipinänlähteelle - UC 2/2, missä KANSSA- kapasiteetti, U - Jännite. Kemiallisten räjähteiden energia saadaan useimmiten räjähdyslämmöstä kilojouleina kiloa kohti. Luonnollisesti lähteiden vertailuun kuuluu energian muuntaminen yksiköstä toiseen (kalorit jouleiksi jne.).
Räjähdyksen tarkastelun yhteydessä kosketaan prosessia, joka on jossain määrin sitä vastakkaista - impulssia, jota on alkanut käyttää tekniikassa. Kun räjähtävä varaus räjähtää, energiataso mahdollistaa kaasujen toiminnan laajentumisen ansiosta ulkoinen ympäristö... Impulssin aikana lähdettä ympäröivän aineen paine on korkeampi kuin itse lähteessä, ja kun erottava este poistetaan, se pystyy ryntämään lähteeseen. Tällainen prosessi voi aiheuttaa aaltohäiriöitä. Yksinkertaisin esimerkki impulssista on sähkölampun lamppu (se tyhjennetään), joka on rikki ilmassa. Mitä suurempi väliaineen paine, sitä enemmän energiaa voi vapautua, kun ontelo romahtaa. Syvissä kaivoissa siitä tulee merkittävä myös pienissä onteloissa. Samanlainen ilmiö havaitaan vedenalaisen räjähdyksen aikana, kun ylikuormitetut räjähdystuotteet romahtavat hydrostaattisen paineen vaikutuksesta. Seismismissä tämä kirjataan säiliön räjähdyksen toiseksi iskuksi, jossa on riittävästi varausta.
Kemiallinen räjähdys- aineen itsensä etenevä kemiallinen muuntaminen, joka etenee suurella nopeudella, jolloin lämpöä vapautuu ja muodostuu korkeapaineisiin puristettuja kaasuja. Räjähdys on erityistapaus räjähdykselle, joka suoritetaan vakio-, enimmäisnopeudella tietylle aineelle.
Ensinnäkin sinun on arvioitava räjähdyksen aikana vapautunut energia (lämmön määrä). Reaktioita on kahta tyyppiä - vapauttaen lämpöä (eksoterminen) ja absorboimalla (endoterminen). Molekyylien - atomien yhdisteiden (niiden muodostumislämpö on nolla) - muodostumislämpö voi olla joko negatiivinen (niiden muodostamiseksi elementeistä on käytettävä lisäenergiaa) tai positiivinen. Lämmön vapautuminen räjähteistä johtuu yleensä palavien komponenttien ja sen koostumukseen sisältyvän hapettimen (hapen) välisestä reaktiosta. Jos räjähteet ovat yksittäisiä kemiallisia yhdisteitä, ne ovat eri ryhmiä molekyylissä, jos ne sekoitetaan, niin seoksen muodostavat eri aineet. Niiden suhde määrää aineen happitasapainon. Kun happi ei riitä räjähdysaineen palavan komponentin täydelliseen hapettumiseen, vaaka on negatiivinen. Aineissa, joilla on positiivinen happitasapaino, osa hapesta jää käyttämättä räjähdyksen aikana ja hukkaantuu tuottamatta. Sekoitettujen räjähteiden ominaisuuksia voidaan muuttaa valitsemalla sopivat hapettimet ja polttoaineet.
Happitasapainoksi määritellään hapen puute tai ylimäärä (grammoina), joka tarvitaan hapetukseen tai joka jää jäljelle 100 g räjähdysaineen hapetuksen aikana. Tetranitrometap C (ΝO2) 4: lle se on +49, ammoniumnitraatti ΝH4ΝΟ3 - +20, trotyyli С7Н5N3O6 - -74, heksogeeni (СH2N2) 3 - -21,6. Suurin negatiivinen happitasapaino on määritelmän mukaan vedyn (-794), suurin positiivinen hapen (+100).
Esimerkki räjähteestä, jolla on negatiivinen happitasapaino, on TNT, laajalle levinnyt räjähdysaine. Sen kemiallinen nimi on trinitrotolueeni, on olemassa nimiä tol, TNT. Kuten rakennekaavasta voidaan nähdä, TNT -molekyylin palavat komponentit - vety- ja hiiliatomit ja hapettava aine - happi, joka on osa nitroryhmää (NO2), eivät ole vielä yhteydessä toisiinsa:
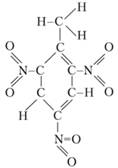
Aineen kaavan perusteella voit ilmoittaa, mihin suuntaan reaktio kulkee siinä, mitä tuotteita voi muodostua tässä tapauksessa. TNT: n räjähtävä hajoamisreaktio on seuraava:
Tuotteiden koostumus riippuu räjähdysolosuhteista ja niiden lopullisesta tilasta (laajentumisaste). Monissa räjähdysjärjestelmissä reaktiot, joille on ominaista suurin energian vapautuminen, toteutuvat ensimmäisenä. Joten aineessa, jonka kaava on muotoa CaH4McOd, suhteellisen pieni hapenpuute [ d< (2a + b / 2)], ensinnäkin vedyn ja hapen välinen reaktio tapahtuu edullisimmin, koska happiyksikköä kohti vapautuu 255 kJ muodostuessa N20 ja 187 kJ muodostaessa CO 2 (СО2: n muodostumislämpö on 379 kJ / mol).
Lähestymistapaa räjähdysaineen muutoslämmön laskemiseen, johon kirjataan mahdolliset reaktiotuotteet, joiden muodostuminen saa aikaan maksimaalisen lämpövaikutuksensa, kutsutaan maksimaalisen työn periaatteeksi. Laskelma idealisoi prosessin jossain määrin ja antaa suurimman tarkkuuden järjestelmille, joissa happitase on positiivinen tai hieman negatiivinen. Todellisuudessa räjähdystuotteiden (EP) koostumus ei yleensä vastaa tätä laskentaa. Jälkimmäinen johtuu siitä, että jonkin aikaa räjähdyksen jälkeen vuorovaikutus jatkuu PW: ssä ja tasapaino saavutetaan reaktiotuotteiden välillä, joilla on sekä positiivisia että negatiivisia lämpövaikutuksia. Esimerkkejä jälkimmäisistä ovat reaktiot
Negatiivisen happitasapainon omaavien järjestelmien likimääräisiä laskelmia varten voidaan käyttää Le Chatelierin menetelmää, joka perustuu enimmäistilavuuden periaatteeseen, ja jos tilavuudet ovat samat, reaktio suurella lämmön vapautumisella on etusijalla. Menetelmä soveltuu parhaiten räjähdystuotteiden lopullisen tilan määrittämiseen. Hallitseva reaktio on hiilen hapetus CO: ksi. Jos happea käytetään liian vähän, sitä kulutetaan yhtä paljon CO: n ja H2: n lisähapetukseen. RDX: n hajoamisreaktio on tässä tapauksessa kirjoitettu seuraavasti:
Räjähdystuotteiden koostumuksen tarkempi laskenta suoritetaan ottaen huomioon reaktioiden kinetiikka ja olosuhteet. Näiden laskelmien tarkkuus ei aina riitä, koska aineen tilasta ei ole luotettavaa tietoa korkeita lämpötiloja ja paineita. Tietoja lämmöstä ja räjähdystuotteiden koostumuksesta saadaan myös kokeellisesti, ja niille on kehitetty ja sovellettu menestyksekkäästi erityisiä räjähdystutkimusmenetelmiä.
Kuten jo todettiin, räjähdyksen energialle on ominaista räjähdysaineen räjähdysmuutoksen lämpö. Alkuperäisten aineiden ja räjähdystuotteiden muodostumislämpö ja Hessin lain (prosessin lämpövaikutus ei riipu muutosreitistä, vaan aineiden alku- ja lopputilasta) perusteella voidaan laskea lämpöä ja useita muita räjähdyksen parametreja. Tällaisia laskelmia voidaan kohdata myös geofysiikan insinöörin työssä, koska sekoitettuja räjähteitä ja ponneaineita käytetään ja tullaan käyttämään yhä enemmän.
Lasketaan halpa räjähtävä seos, kuten igdaniitti, rakeisesta ammoniumnitraatista nestemäisellä polttoaineella. Laskennan yksinkertaisuuden vuoksi otamme käytettyjen öljytuotteiden - dieselöljyn tai kerosiinin - sijaan aineiden seoksen - sijasta bentseeniä (C6H6). Harkitse tapausta, jossa räjähtävä seos määritetään määrittämällä komponentit ja happitasapaino. Olkoon otettava huomioon, että bentseenin ja ammoniumnitraatin seoksen happitase on oltava -10, muuten siinä ei ole tarpeeksi 10 g happea 100 g: n seoksen täydelliseen hapetukseen. Aluksi määritämme, minkä koostumuksen seoksen tulisi olla tehtävän tyydyttämiseksi.
Ratkaisun yksinkertaistamiseksi kuvitellaan, että räjähteemme koostuu kahdesta osasta - yhdestä komponentista (tässä tapauksessa polttoaineesta, koska vaaka on negatiivinen), halutun tasapainon saaneesta määrästä ja seoksesta tietyt aineet, joiden happitasapaino on nolla (jälkimmäistä kutsutaan joskus stoikiometriseksi). Jos lisäämme tällaisen seoksen laskettuun polttoainemäärään, jolloin kokonaispaino on 100 g, saadaan koostumus, jolla on tietty happitasapaino.
Tehdään laskelmat yksi kerrallaan.
Bentseenimolekyylin hapettamiseen (sen molekyylipaino on 78)
se vaatii 15 happiatomia. Näin ollen bentseenin määrä x 1, jonka hapetus vaatii 10 g happea, saamme osuudesta "bentseeni - tarvittava happi":
![]()
Lisätään tähän määrään (100 - NS 1) g seosta, jonka happitase on nolla, saamme tietyn koostumuksen seoksen.
Siirrytään laskemaan komponenttien pitoisuus 96,75 g: n stökiometrisessä seoksessa. Määritä hapen ylimäärä happea. Saltpeter, hajoaa, vapauttaa happea:
lisäksi 80 g hapettavaa ainetta (molekyylipaino 80 ammoniumnitraattia) vapauttaa 16 g happea. Bentseenin ja ammoniumnitraatin välinen reaktio happitaseen nollaseoksessa kirjoitetaan seuraavasti
Sitten saamme osuuden: ![]()
Siksi 96,75 g seosta sisältää 5,85 g bentseeniä ja 90,85 g ammoniumnitraattia. Näin ollen seoksen lopullinen koostumus, jolla on tietty happitasapaino ja räjähdystuotteiden koostumus, joka lasketaan maksimaalisen toiminnan periaatteen mukaisesti, on:
Laskelmiin turvautumatta oli mahdollista heti kirjoittaa ylös hiilen vapaan hiilen pitoisuus, koska sen läsnäolo määrittää seoksen negatiivisen happitasapainon. Koska 12 g hiiltä vaatii 32 g happea täydelliseen hapettumiseen, 10 g happea voi hapettaa g hiiltä tai murto -osan hiilimoolia. Näiden seikkojen avulla on hyvä tarkistaa tehtyjen laskelmien oikeellisuus.
Tällaisen seoksen valmistaminen on melko yksinkertaista: oikea määrä nitraatti on sekoitettava bentseenin kanssa. Järjestelmän räjähdyslämpö on helppo laskea alkukomponenttien ja räjähdystuotteiden koostumuksen tuntemuksen perusteella. Alkukomponenttien ja räjähdystuotteiden muodostumislämpö löytyy vastaavista viitekirjoista. Joten 1 moolilla bentseeniä se on (kJ / mol) -39,1, ammoniumnitraatti - +410,8, CO2 - +444,2, H2O - +271,7.
Räjähdyslämpövaikutus Q x varaus tehtävässä voidaan määrittää yhtälöstä
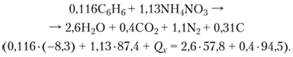 (4.29)
(4.29)
Se on 374 kJ / 100 g seosta tai 3740 kJ / kg.
Muodostuneiden kaasumaisten tuotteiden tilavuus (litroina) voidaan laskea käyttämällä reaktioyhtälöä kertomalla kaasumoolien lukumäärä 22,4: llä (grammamolekyylin tilavuus). Luonnollisesti tässä tapauksessa on otettava huomioon aineen tila. Joten hiili (sublimaatiolämpötila on yli 3700 ° C normaalissa ilmakehän paineessa) ei anna kaasufaasia, vesi on luonnollisesti höyryä. Räjähdystuotteiden tilavuutta, johon viitataan normaalissa ilmakehässä, kutsutaan pienempi äänenvoimakkuus. Edellä käsitellyssä ongelmassa se on noin 800 l / kg.
Jos räjähdystuotteiden lämpö ja koostumus tiedetään, niin niiden lämpötila T vz voidaan määrittää suhteesta T vz = = Q / C vcр, missä KANSSA v cp - räjähdystuotteiden keskimääräinen lämpökapasiteetti (tasaisella tilavuudella) aikavälillä Τ 0–Τ otettu On tärkeää huomata, että lämpökapasiteetti on lämpötilan funktio.
Jälkimmäinen tuo laskelmiin joitakin (puhtaasti teknisiä) komplikaatioita, koska riippuvuuden tyyppi on tiedossa. On kuitenkin helpompi käyttää valmiita tietoja kaasujen lämpöpitoisuudesta eri lämpötiloissa (taulukko 4.1).
Taulukko 4.1
Muutos joidenkin kaasujen lämpöpitoisuudessa (sisäinen energia) (kJ / mol)
|
Lämpötila, K. |
C (grafiitti) |
||||||
Kun lämpötila on asetettu ja räjähdystuotteiden koostumus tiedossa, niiden lämpöpitoisuus voidaan löytää ja verrata räjähdyslämpöön. Vertailu määrittää lämpötilan valinnassa tehdyn virheen luonteen. Toistamalla toimenpide, mutta eri (korjattu) lämpötila, on mahdollista löytää räjähdyslämpötila likimääräisellä menetelmällä.
On huomattava, että räjähdyksen aikana vapautunut energia on suhteellisen pieni: tehokkaimpien räjähteiden räjähdyslämpö on 6500-6700 kJ / kg. 1 kg: n TNT: n räjähdys ilmassa vapauttaa noin 4000 kJ lämpöä ja 1 kg: n dieselöljyn palaminen - noin 44 000 kJ. Mutta 1 kg dieselöljyn ja hapen seoksen palamislämpö on jo vain 10000 kJ ja 1 kg dieselöljyn ja ilman seosta - 2670 kJ. On toistuvasti korostettu, että energian vapautumisen lisäksi räjähdykselle on ominaista tuotteiden muodostuminen, jotka ovat kaasumaisessa tilassa räjähdyksen aikana saavutetuissa lämpötiloissa.
Vaikka termiitin reaktiolämpö
noin 2,3 kertaa suurempi kuin TNT: n räjähtävän hajoamisen kuumuus, sen palaminen etenee rauhallisesti; tuloksena olevat tuotteet pysyvät nesteinä jopa lämpötiloissa, joihin ne kuumennetaan. Mutta heti kun kastat termiitin, kuva muuttuu: lämpö muuttaa veden höyryksi ja palamiseen liittyy räjähtäviä prosesseja. Räjähdysaineessa varauksen varaamassa tilavuudessa räjähdyksen aikana muodostuu välittömästi valtavaan paineeseen puristettuja kaasuja - reaktiotuotteita, jotka tarjoavat vapautuneen energian toteuttamisen laajentavien kaasujen suorittaman työn muodossa.
Luodessamme räjähteitä olemme luonnollisesti kiinnostuneita siitä, että sadassa räjähdyksessä vapautuu enemmän energiaa ja puristetut kaasut kykenevät ymmärtämään energiaa oikealla tavalla. Joskus nämä vaatimukset ovat ristiriidassa. Siten räjähtävän hajoamisen energiaa voidaan lisätä valitsemalla sopivia polttoaineita, erityisesti lisäämällä metalleja, kuten alumiinia, räjähtävään koostumukseen (A12O3: n muodostumislämpö on 1599 kJ / mol). Alumiinin hapetustuotteet ovat kiinteitä aineita. Alumiinin lisääminen (tiettyyn rajaan asti) joidenkin räjähtävien seosten koostumukseen voi lisätä jälkimmäisen tehokkuutta. On räjähdysaineita, joilla on lisääntynyt räjähdyslämpö ja jotka sisältävät metalleja koostumuksessaan. Kuten jo todettiin, räjähdystuotteiden koostumus riippuu paitsi räjähteestä myös räjähdyksen olosuhteista: sytytysmenetelmästä, varauksen ja kuoren koosta ja rakenteesta sekä ympäristöolosuhteista, joissa räjähdys suoritetaan. Jos alkutuotteet pysyvät vakioina ja räjähdystuotteiden koostumus muuttuu, myös räjähdyksen lämpövaikutus muuttuu, joten joidenkin räjähteiden osalta eri merkityksiä räjähdyksen kuumuus riippuen olosuhteista, joissa se suoritetaan. Esimerkiksi taulukossa. 4.2 esittää (R. Schmidtin mukaan) TNT: n räjähdystuotteiden koostumuksen (tiheys 1,52), kun varauksen räjähdys herättää heikot ja vahvat käynnistimet.
Jotta räjähdysaineen muutos nopean kemiallisen reaktion puhkeamisen seurauksena kulkisi koko varauksen yli, prosessin on oltava itsestään etenevää. Tätä varten kemiallisella reaktiolla on oltava asianmukaiset kineettiset ominaisuudet, ja energian vapautumisen on kompensoitava väistämättömät häviöt. Reaktionopeus, kyky levitä itseään, eksotermisyys, kaasun muodostuminen liittyvät läheisesti toisiinsa ja vaikuttavat toisiinsa ja räjähdysprosessin rajoihin.
Taulukko 4.2
TNT -räjähdystuotteiden koostumus
Pöytä 4.3 esittää useiden teollisuuden käyttämien räjähteiden ja ponneaineiden ominaisuudet.
Taulukko 4.3
Joidenkin räjähteiden räjähdysominaisuudet
Räjähdysaine räjähdyksessä vapauttaa energiaa, koska pieni määrä kiinteää tai nestemäistä räjähdettä muuttuu valtavaksi kaasutilavuudeksi, joka on lämmitetty tuhansiin asteisiin. Varten eri tyyppejä Räjähteet, joiden päästettyjen kaasujen määrä 1 kg räjähteitä kohden, joiden alkutilavuus on enintään 0,8-1 litraa, vaihtelee välillä 300-1000 litraa tai enemmän. Räjähdyksen aikana syntyneet räjähteiden kuumat kaasumaiset hajoamistuotteet alkavat laajentua ja tuottaa mekaanista työtä... Siten räjähteillä on piilevän kemiallisen energian varanto, joka vapautuu räjähdyksen aikana. Piilevää energiaa hallitsevat kuitenkin paitsi räjähteet, myös esimerkiksi bensiini, hiili, puu ja muut palavat aineet. Tämä palavien aineiden energia voi vapautua palamisen aikana. Miksi räjähteitä ja ruutia käytetään tuhoamiseen ja heittämiseen, ei esimerkiksi bensiiniä? Tiedetään, että 1 kg bensiiniä sisältää 10 kertaa enemmän energiaa kuin 1 kg TNT: tä ja 12 kertaa enemmän kuin savuton pyroksiliinijauhe. Mutta räjähdyspanos ja ruutilataus muuttuvat kaasuiksi valtavalla nopeudella, eikä bensiini tai mikään polttoaine voi palaa ilman riittävää määrää ilmaa tai vapaata happea. 1 kg bensiinin polttaminen vaatii niin paljon happea kuin 15,5 kg ilmaa. Siksi polttoaineen palamislämpö (energia) on laskettava 1 kg: lle sen seosta ja sen täydelliseen palamiseen tarvittavaa happea. Tällaisella laskelmalla ero bensiinin ja hapen seoksen palamisenergian ja saman määrän räjähdyspanoksen räjähdysenergian välillä on pienempi kuin edellä annettu, mutta tässä tapauksessa energian määrä bensiinin palaminen on suurempi: savuton jauhe - 2860 kJ / kg, TNT - 4100 kJ / kg, bensiinin ja hapen seos - 11 000 kJ / kg. Näin ollen räjähteiden ja ponneaineiden sisältämän energian määrä ei ole pääasiallinen syy niiden käyttöön tuhoamiseen ja heittämiseen. Suurin syy ei ole energian määrässä, vaan sen erittäin nopeassa vapautumisessa. Jos 1 kg bensiiniä poltetaan auton moottori tapahtuu (riippuen moottorin tehosta ja sen kuormituksesta) 10-60 minuutissa, sitten 1 kg ruutia palaa tykistön latauskammiossa muutamassa tuhannesosassa ja 1 kg: n TNT: n räjähdys kestää vain 30-40 sata tuhannesosaa sekunnista. Räjähdysenergia vapautuu kymmeniä miljoonia kertoja nopeammin kuin polttoaineiden palaminen. Tämä selittää räjähdyksen valtavan voiman. On kuitenkin oikeampaa laskea räjähdysteho ei koko varauksen räjähdysajan perusteella, vaan siihen mennessä, kun räjähdystuotteet ylittävät normaalitason ilmakehän paine, tällaisen tason saavuttaminen räjähdysprosessin nopean kuvaamisen tulosten mukaan tapahtuu muutaman millisekunnin kuluessa. Tässä tapauksessa 1 kg TNT: n teho ilmaistaan yli 1 MW: na. Mutta edes tätä voimaa todellisissa olosuhteissa ei voida täysin toteuttaa sen lyhyen toiminnan keston, siirretyn tai tuhoutuvan materiaalin massojen hitauden vuoksi, johon se vaikuttaa, sekä häviöt ympäristön lämmittämisestä, liiallisesta hionnasta ja hajottamisesta räjähdystuotteiden jäännöslämmölle niiden lopullisen laajentumisen ja väistämättömien kemiallisten menetysten jälkeen. Tämän seurauksena hyödyllinen mekaaninen työ ei usein ylitä 1-2% ja räjähdyksen sattuessa kiinteässä väliaineessa-8-9% räjähdysaineen sisältämästä energiasta. Räjähteiden ja ponneaineiden valtava määrä potentiaalista energiaa tekee niistä kuitenkin korvaamattomia huolimatta siitä, että niitä käytetään epätäydellisesti räjähdyksessä. Suuri teho on ominaista räjähteille ja silloin, kun niitä käytetään ammusten heittämiseen. Suurikaliiberisen tykinkierroksen jauhevarauksen teho on 10 MW.
1. Palamisteorian peruskäsitteet.
1. Palamisprosessien ominaisuudet.
Palaminen - monimutkainen fysikaalis -kemiallinen prosessi, jossa kemiallinen muutos
kutistumiseen liittyy energian vapautumista (pääasiassa lämmön ja säteilyn muodossa)
sekä lämmön ja massan vaihto ympäristön kanssa.
Palamisprosessi perustuu kemialliseen reaktioon, joka voi tapahtua a
kiihtyvyys. Syyt itsekiihtyvyyteen voivat olla:
1. Lämmön kertyminen järjestelmään - terminen itsekiihtyvyys
2. Aktiivisten hiukkasten kertyminen - ketjun itsekiihtyvyys
3. Autokatalyysi on tuotteiden kiihdyttämä reaktio.
Monissa tapauksissa käytännössä tärkeät palamisprosessit ovat puhtaasti fyysisiä
fysikaalisia lakeja, koska korkeissa lämpötiloissa kemiallinen muutos voi edetä suurella nopeudella ja kemiallinen prosessi on puhtaasti fysikaalisten lakien, kuten lämmönsiirron ja diffuusion alainen, ja sitä säännellään. Tämä tarkoittaa, että kemiallinen reaktio, joka voi edetä suurella nopeudella
stu, sillä on rajoitettu nopeus ja se noudattaa yhden tai toisen fyysisen lait
fyysinen ilmiö.
Palamisprosessien pääpiirre on, että olosuhteet itsekiihtyvyydelle
kemialliset reaktiot syntyvät itsestään. Kybernetiikassa tätä ilmiötä kutsutaan positiiviseksi palautteeksi, eli ulkoisten olosuhteiden pienellä muutoksella siirtyminen kiinteä tila reaktion kulkua hitaasti hallintoon, noin
jossa reaktionopeus kasvaa geometrinen eteneminen. Samanlaisia ilmiöitä kutsutaan reaktiojärjestelmän jyrkkää muutosta ja pieniä muutoksia ulkoisissa olosuhteissa
ovat kriittisiä tapahtumia, ja olosuhteita, joissa niitä noudatetaan, kutsutaan
kriittisissä olosuhteissa.
Kriittisiä tapahtumia ovat:
1. Itsesyttyminen
2. Sytytys
3. Liekin leviämisen pitoisuusrajat.
Kriittisiä ilmiöitä ei synny siitä, että luonnon lait muuttuvat äkillisesti, vaan
ovat seurausta reagoivan järjestelmän ja ympäristön välisestä epätasapainosta
ympäristöön.
Itsesyttymisedellytys on lämpö- tai diffuusiotasapainon mahdottomuus
tasapaino ympäristön kanssa, sytytystila on epätasapaino annetuissa alkuolosuhteissa.
Toinen ominaisuus palamisprosesseissa on niiden kyky levitä
avaruudessa. Klo lämpöjärjestelmä palaminen etenee lämmönsiirrolla, ketjun tai autokatalyyttisen tapauksessa - aktiivisten hiukkasten diffuusiolla.
2. Palamistyypit ja -muodot.
1. Osallistujien kokonaistilan mukaan:
a. Palaminen kaasujärjestelmät- homogeeninen palaminen
b. Kiinteiden ja nestemäisten polttoaineiden (kiinteät nesteet ja kiinteät kaasut) polttaminen-heterogeeninen polttaminen
c. Kondensoituneiden järjestelmien polttaminen (kiinteät ja nestejärjestelmät,
neste - neste, kiinteä - neste).
2. Prosessin etenemisnopeuden mukaan:
a. Deflagraation polttaminen - prosessin hidas eteneminen (käyttämällä lämmönjohtavuutta tai diffuusiota)
b. Räjähdyspoltto on prosessin nopea eteneminen (kun
iskuaallon teho).
3. Aerodynaamisten olosuhteiden mukaan:
a. Laminaarinen palaminen on tasainen liekki.
b. Turbulentti palaminen on erittäin kaareva liekkirintama.
Esimerkkejä eri tyyppejä palaminen osallistujien yhteenlasketun tilan mukaan:
Homogeeninen palaminen:
Orgaanisen aineen palaminen hapessa
CH4 (g.) + 2O2 (g.) = CO2 (g.) + 2H20 (höyry)
Palaminen muiden kaasumaisten hapettimien läsnä ollessa
H2 (g) + Cl2 (g) = 2HCI (g)
Epävakaiden aineiden hajoaminen (otsoni)
2O3 (g) = 3O2 (g)
Heterogeeninen palaminen:
Nestemäisen hydratsiinin palaminen:
N2 H4 (l) + O2 (g) = N2 (g) + 2H20 (höyry)
Hiilen polttaminen:
C (tv.) + O2 (g.) = CO2 (g.)
Epävakaiden aineiden hajoaminen (asetyleeni)
C2 H2 (g) = 2C (tv) + H2 (g)
Tiivistettyjen järjestelmien polttaminen:
KClO3 (s) + Al (s) = KCl (s) + Al203 (s) 2NH4 NO3 (s) = 2N2 (g) + 4H20 (höyry) + O2 (g)
3. Palamisprosessien termodynamiikka. Lämmön tasapaino.
Palamislämpötila: Palamisprosessit on tavallista luonnehtia neljään
palamislämpötiloja
Teoreettinen | T Theor | Määrittää stökiometrinen lämpöarvo (esim. |
||
seoksen reaktioyhtälöä), ottaen huomioon sen kuumeneminen ja dissosiaatio |
||||
palamistuotteet ottamatta huomioon lämmönvaihtoa ympäristön kanssa. |
||||
Kalorimetrinen T -kalorimäärä - määritetään stoikiometrisen lämpöarvon perusteella |
||||
seos, jonka alkulämpötila on T 0 273K ottamatta huomioon lämmönvaihtoa
elinympäristö.
3. Adiabaattinen T g ad - määräytyy mielivaltaisen koostumuksen seoksen palamislämmöstä ottamatta huomioon lämmönvaihtoa ympäristön kanssa.
4. Todellinen Tg -toiminta on lämpötilan todellinen (mitattu) lämpötila
Palamislämpötilan eri määritelmien välinen suhde
Palamisprosessien lämpötasapaino perustuu absorboidun lämmön määrittämiseen
palamistuotteet. Yhtälö lämmön tasapaino näyttää:
Q pgQ pQ refQ potti, |
jossa Q pg on palamistuotteiden absorboima lämpö, Q p on kemiallisen reaktion lämpö,
Q out - ulkoisista lähteistä saatu lämpö, Q hiki - lämpöhäviöt.

palaa. Käytännössä palamistuotteiden hajoaminen vaikuttaa merkittävästi vain yli 20000 asteen lämpötiloihin.
Erota korkeampi ja matalampi palamislämpö. Ensimmäisessä tapauksessa vesi palamistuotteena otetaan nestemäisessä muodossa, toisessa - höyryssä. Koska teidän lukumääränne-
jaettu lämpö riippuu palanneen aineen määrästä, moolilämpö erotetaan
lautta ja erityinen palamislämpö. Nuo. palamisen aikana vapautunut lämpö 1
mooli tai kilo syttyvää ainetta.
Palamislämmön (kJ / kg) laskemiseksi käytetään D.I.
Mendelejev
Q p 339, 4C 1257H 108.9O N S 25 9H W, |
jossa X on polttoaineen koostumuksen elementin pitoisuus% (paino), W on kosteuspitoisuus.
Yleinen lähestymistapa reaktioiden lämpöjen laskemiseen perustuu kemialliseen termodynaamiseen
täydentää järjestelmä. Sitten termodynamiikan ensimmäisestä laista (energian säilymisen laki)
gii) seuraa | |||
missä Q on järjestelmän vastaanottama lämpö, U on sisäisen energian muutos, W on työ, |
|||
täydentää järjestelmä. Meillä on äärettömän pieniä muutoksia | |||
dU - sisäisen energian kokonaisero (ei riipu virtausreitistä |
|||
prosessi) Q, W - ääretön määrä lämpöä ja työtä, mikä | |||
riippuu järjestelmän siirtymisreitistä tilasta toiseen. | |||
Anna järjestelmän suorittaa vain laajentumisen mekaaninen työ. | |||
pdV. | |||
Korvaamalla (1.6) kohtaan (1.5) saadaan | |||
Isokoriseen prosessiin V = const dV = 0 ja integrointi (1.7) saadaan | |||
isobaarisessa prosessissa p = const, integraatio (1.7) ja yksinkertaiset muunnokset antavat
Kohdista (1.8) ja (1.10) seuraa, että isokorisissa ja isobaarisissa prosesseissa lämpö saavuttaa tilafunktion ominaisuudet, ts. ei ole riippuvainen prosessin polusta. Tätä säännöstä kutsutaan G.I: n laki Hess... Kemiallisen uudelleenkäytön alku- ja lopputila
varastot ovat lähtöaineita ja reaktiotuotteita. Yksinkertaisten aineiden entalpiat,
pysyvät vakio -olosuhteissa (298K ja 0,10113 MPa) nollana. Monimutkaisten aineiden entalpia muuttuu niiden muodostumisen aikana alkuaineista.
Ca (tv.) + С (tv.) + 1.5O2 = CaCO3 | |||||||||||||||
Tästä seuraa sääntö, jonka mukaan reaktiolämmöt lasketaan aineiden muodostumisen entalpioista |
|||||||||||||||
Hessin laki. | |||||||||||||||
reaktiotuotteiden ja lähtöaineiden stökiometriset kertoimet |
|||||||||||||||
vastaavasti. Lisäksi tavaramerkkisopimuksen mukaisesti, jos | 0 reagoi sitten |
||||||||||||||
eksoterminen (luovuttaa lämpöä).
4. Lämpökapasiteetti. Reaktion lämpövaikutuksen riippuvuus lämpötilasta
Lämpökapasiteetti - kutsutaan lämmön määräksi, joka tarvitaan yksikön lämmittämiseen
aineen massa per 1 K. Erota ominais- ja moolilämpökapasiteetti, ts. 1 kg lämmitykseen tarvittava lämmön määrä. Tai 1 mooli ainetta 1 K.
Todellinen molaarinen lämpökapasiteetti määritetään seuraavasti
C (1,12) dT
jossa C on moolilämpökapasiteetti, mol K.
Lämpökapasiteeteille tasaisella tilavuudella ja paineella (isokorinen ja isobaarinen) kanssa
ottaen huomioon (1.8) ja (1.10), saamme
; C s | ||||||

Tarkastellaanpa prosessin lämmön riippuvuutta lämpötilasta vakiotilavuudessa tai -paineessa. Ottaen huomioon yhtälöt (1.13), saamme
Yhtälöitä (1.14) kutsutaan Kirchhoffin yhtälöt.
Lämpökapasiteetin muutos reaktion aikana määräytyy ilmentymän perusteella
i Cp, i (jatkoa) | jC p, j (ulos), | ||
nuo. ero reaktiotuotteiden ja lähtöaineiden lämpökapasiteetin summan välillä.
Yhtälöstä (1.14) seuraa, että jos lämpökapasiteetin muutos reaktion aikana
negatiivisesti (eli tuotteiden lämpökapasiteetti on pienempi kuin alkuperäisten aineiden lämpökapasiteetti), reaktion lämpövaikutus muuttuu negatiivisemmaksi ja reaktio tehostuu.
lämpö.
Prosessin lämpövaikutuksen laskemiseksi kohdassa T 2 (p = const) Kirchhoffin yhtälö |
|||||
fa on integroitava. | |||||
Cp dT, | |||||
On pidettävä mielessä, että lämpötila -alueella T 1 - T 2 | vaiheiden siirtymiä ei pitäisi olla |
||||
dov -aineita. | |||||
Yleensä T 1 valitaan sitten 298K | r H 0 on reaktion lämpövaikutus |
||||
ilmaiset ehdot (1.11) mukaisesti laskettuna.
Todellisten aineiden lämpökapasiteetti monimutkaisella tavalla riippuu siis lämpötilasta
Kirchhoffin yhtälön integrointiin käytetään seuraavia arvioita: | ||||
Nolla - tuotteiden lämpökapasiteetti on yhtä suuri kuin alkuperäisten aineiden lämpökapasiteetti, |
||||
nuo. C p 0 ja reaktion lämpö on riippumaton lämpötilasta. | ||||
Ensimmäinen tilaus - C s | siis konst | |||
a T2 T1 | ||||
Palaminen- nopeasti etenevä palavien aineiden kemiallinen vuorovaikutus hapettimen kanssa, johon liittyy suuren määrän lämmön vapautuminen ja kirkas hehku (liekki). Palaminen on mahdollista vain kolmen tekijän läsnä ollessa: palava aine, hapettava aine, lämmönlähde.
Lämmön lähde(tuli) voi olla avotuli, kipinä, kitkan lämmittämä lämpö (hihnakäytön hihnat), isku, paine. Lämmönlähde voi olla myös sähköinen (johtimien lämmitys, valokaari), kemiallinen ja auringon säteilyenergia.
Hapettavat aineet ovat kloori, fluori, bromi. Yleisin hapettava aine on ilman happi; palamisprosessi riippuu sen pitoisuudesta ilmassa. Jos ilmassa on yli 14-16% happea, havaitaan vakaa palaminen. Kun happipitoisuus on alle 14%, havaitaan palamista, ja kun happipitoisuus on alle 8-10%, se myös lakkaa.
Palava aine... Ne voivat olla kaasuja (ammoniakki, asetyleeni, vety), nesteitä (bensiini, asetoni, alkoholi), kiinteitä aineita (hiili, puu). Jotta kiinteät aineet tai nesteet syttyvät, on lämmityslähteen avulla lämmitettävä ne sellaiseen lämpötilaan, että niiden pinnoilta vapautuu voimakkaasti syttyviä höyryjä. Kun tietty pitoisuus saavutetaan, nämä höyryt syttyvät. Palamisen aikana syntyvät kaasut eivät muuta niiden aggregaatiotilaa.
On olemassa seuraavia palamistyyppejä: 1) salama; 2) sytytys; 3) itsesyttyminen; 4) itsesyttyminen; 5) kuumeneminen; 6) räjähdys.
1... Salama kutsutaan ilmahapen seoksen hetkelliseksi palamiseksi höyryjen, kaasujen ja pölyn kanssa, johon ei liity puristettuja kaasuja. Leimahduspiste on suurin matala lämpötila palava aine, jossa sen pinnan yläpuolelle muodostuu höyryjä tai kaasuja, jotka voivat syttyä syttymislähteestä, mutta myöhemmän stabiilin palamisen osalta niiden muodostumisnopeus ei ole riittävä.
Tämän lämpötilan arvon mukaan syttyvät nesteet jaetaan:
a) syttyvä (syttyvät nesteet - bensiini, asetoni, alkoholi) - t vilkkuu ≤ + 45 ° С;
b) syttyvät nesteet (GZh - öljyt, dieselpolttoaine, polttoöljy) - tp> + 45 ° С.
2. Sytyttämällä kutsutaan aineen vakaaksi jatkuvaksi palamiseksi lämmönlähteestä. Palavan aineen minimilämpötilaa, jossa se syttyy sytytyslähteestä ja jatkaa palamista sen poistamisen jälkeen, kutsutaan syttymislämpötilaksi. Se on korkeampi kuin leimahduspiste.
Syttyvien aineiden pitoisuus ilmassa, jossa syttyminen tai räjähdys on mahdollista, on tietyissä rajoissa: alempi on CWP ja ylempi ERW. Palavien seosten syttyminen on mahdotonta pitoisuuksilla, jotka ovat alle CWP: n (seoksessa ei ole riittävästi palavan aineen molekyylejä) ja ERW: n yläpuolella (seoksessa ei ole tarpeeksi happimolekyylejä). Mitä suurempi ero ERC: n ja UWP: n välillä, sitä vaarallisempi aine. Näiden parametrien arvot voivat pienentyä esimerkiksi pölyn ja ilman seoksen (PLVS) kosteuden lisääntyessä, esimerkiksi ilman ja sokerin, jauhojen, kivihiilipölyn seoksen ollessa lisääntynyt.
Annetaan esimerkkejä NWP- ja ERW -arvoista useille kaasuille ja nesteiden höyryille:
Asetyleeni 3,5-82%;
Maakaasu 3,8-19,2%;
Bensiini 1-6%;
Hiilimonoksidi 12,8-75%.
3.Itsesyttyminen- aineiden syttymisprosessi ulkoisesta lähteestä (liekki, lämmitetty tai hehkulamppu) ilman suoraa kosketusta sen kanssa syttymislämpötilassa. Tämä lämpötila laskee paineen kasvaessa ja useimpien palavien kaasujen välillä on 400-700 ° C, puun-340-400 ° C; hiili-400-500 ° C.Esimerkki itsesyttymisestä: puun, paperin kuumentaminen ja sen jälkeinen sytytys, joka sijaitsee lähellä avotulta (ilman kosketusta sen kanssa) tai hehkulamppuja (hiiltä, avoin kierre lämmitin).
4. Itsesyttyminen aineita tapahtuu aineessa itsessään tapahtuvien fysikaalisten, kemiallisten ja biologisten reaktioiden seurauksena, mikä johtaa palamiseen ilman syttymislähdettä.
Säilytettäessä suuria määriä märkää viljaa, heinää, olkea ja ilmanvaihtoa näiden materiaalien sisällä riittää biokemiallisia prosesseja (hajoamista) lämmön vapautuessa. Näiden materiaalien lämpötila nousee, niiden suuri massa (rick, heinäsuovasta) estää syntyvän lämmön siirtymisen ympäristöön, mikä aiheuttaa tulipalon. Tällaiset materiaalit on kuivattava hyvin ennen varastointia. Kosketus öljytahroja sisältäviin kankaisiin (vaatteet, puhdistusliina), jotka kasaantuvat ilman tuuletusta, syttyvät myös itsestään. Siksi työvaatteet on ripustettava siten, että ne pääsevät vapaasti ilmaan, ja öljyiset rätit on poistettava viipymättä työtilasta.
Reaktionopeudesta riippuen palamisprosessi on muodoltaan rappeutuminen(nopeus useita cm / s), itse asiassa palaminen(useita m / s) ja räjähdys(useita satoja tuhansia m / s).
5. Räjähdys- äkillinen muutos aineen fysikaalisessa ja kemiallisessa tilassa korkean lämpötilan, paineen ja kemiallisten reagenssien vaikutuksesta. Räjähdyksen aikana muodostuneiden kaasujen ja höyryjen määrä kasvaa jyrkästi, vapautuu valtava määrä energiaa, joka iskuaallon muodossa pystyy suorittamaan mekaanista työtä (tuhoamaan rakennuksia, rakenteita, loukkaantumaan).
Materiaalien palaminen voi olla täydellistä tai epätäydellistä. Täydellisessä palamisessa (ylimääräinen happi) muodostuu palamattomia tuotteita (CO 2 ja H 2 O). Ne ovat myrkyllisiä ja räjähtäviä. Siksi polttoaineen palamisprosessia järjestettäessä (kattiloissa, uuneissa) uunissa on oltava riittävä määrä happea.
Jatkamme keskustelua aiheesta klassiset perustukset kemia, jota jokainen pyrotekniikan ammattilainen tarvitsee. BA-BAH muistuttaa, että mikä tahansa käytännön oppitunti pyrotekniikka on vaarallinen yritys, jos se ei perustu tiukkaan teoriaan. Suosittelemme lukijoille, jotka uskovat, että mikä voi muuttua heidän elämänkutsumuksekseen, suorittamaan täysimittaisen opintojakson esimerkiksi Sergiev Posadin soveltavan kemian tutkimuslaitoksessa.
Viitaten yhdisteisiin osoitimme, että tärkein syy niihin on elementtien sukulaisuusaste keskenään. Muutoin elementit ovat välinpitämättömiä joidenkin aineiden läsnä ollessa, ja ne altistuvat enemmän tai vähemmän voimakkaalle yhdistymiselle muiden kanssa. Esimerkiksi kalkki imee helposti raskasta kloorikaasua, ts. yhdistyy sen kanssa muodostaen kloorattua kalkkia; elohopea yhdistyy sulan rikin kanssa muodostaen tunnetun kirkkaan punaisen aineen, nimeltään cinnabar. Cinnabar (Zinnober) voidaan hajottaa uudelleen rikkiä ja elohopeaa, jos yhdistät sen aineeseen, johon jokin sen ainesosista (esimerkiksi rikki) vetäisi enemmän kuin ystävä (eli elohopea), minkä jälkeen ja toinen johonkin sidottu elementti voidaan vapauttaa samassa järjestyksessä neljännen aineen avulla. Tällainen vapautuminen tai vapautuminen ei ole aina täydellistä, mutta useimmiten riittää osittainen vapautuminen, joka voidaan teoriassa laskea kaavojen avulla.
Yksi affiniteetin hyvin yleisistä seurauksista, joka toistetaan jokaisessa vaiheessa, on ominaisuus, jota kutsutaan "hygroskooppisuudeksi", ts. kyky kosteuttaa, kostea, muuten - imeä kosteutta ja muodostaa happo -vetyyhdisteitä. Tämä ominaisuus erottuu monista aineista ja muuten ruokasuolasta ja rikkihaposta, jotka on sijoitettu niiden väliin ikkunanpuitteet vetää kosteutta itseesi; sammuttamaton kalkki, kiehuva kosketuksesta veden kanssa; gelatiini, jolla alkoholi kuivuu jne. Hygroskooppisuus on pyrotekniikan kannalta ikävä ominaisuus, joka on otettava huomioon. Esimerkiksi strontiumkloridia ja nitraattia ei voida aina käyttää äärimmäisen hygroskooppisuuden vuoksi, vaikka näillä aineilla on arvokkaita pyroteknisiä ominaisuuksia; ja yleensä kaikki koostumukset on suojattava huolellisesti kosteudelta. Mutta tärkein rooli pyroteknisessä kemiassa on yhdisteiden tyypillä, jota kutsutaan "palamiseksi" (Verbrennung, palaminen).
Ilmaisulla "polttaminen" tai "polttaminen" laajimmassa merkityksessä kemia tarkoittaa yleensä jokaista kahden kappaleen kemiallista yhdistelmää kolmannen muodostamiseksi; lähimmässä merkityksessä se tarkoittaa kehon yhteyttä hapen kanssa.
Selvyyden vuoksi siirrymme, kuten tavallista, kokeiluihin. Sekoita tietty määrä rautahiutaleita tiettyyn määrään rikkiä ja kuumenna seosta hieman; sitten tämä seos lämpenee välittömästi ja sulaa nopeasti. Tällä tavalla saatu seos ei ole enää rikki eikä rauta: rikkiä poltettu rauta, ts. kemiallisesti yhdistettynä siihen, ja sen seurauksena muodostui uusi kappale - rauta tai rikki (riippuen yhden tai toisen ainesosan vallitsevuudesta) pyriitti.
Sulata rikki upokkaassa, kuumenna seos kiehuvaksi ja heitä siihen kuparilankaa: tämä lanka palaa rikkiä, jolloin syntyy ihana punainen väri; Tuloksena on erityinen yhdiste - kuparisulfidi tai kuparin kiilto. Samalla tavalla se voidaan polttaa kuparilla, ts. yhdistää siihen monia kappaleita: lyijyä, tinaa, sinkkiä jne.
Rikkihiili on väritön, voimakkaasti haiseva neste, joka ei jääty edes 48 ° R: ssa (hiilidisulfidin sulamispiste (CS 2) = -112 ° C) - muodostuu rikkihöyryjen ja kuumien hiilen yhdistelmästä. Molemmat pääkappaleet palavat, toisin sanoen ne muuttuvat nesteiksi.
Sama samankaltaisuus havaitaan metallien (rauta, kupari, sinkki, antimoni, arseeni jne.) Välillä, jotka ovat lämmön tilassa jo mainitun "kloorin" kanssa nimetyn kaasun kanssa: rauta, kupari, sinkki jne. polttaa kloorilla ferrikloridiksi, kuparikloridiksi, sinkkikloridiksi, lyijykloridiksi jne. samalla kun se kehittää voimakasta lämpöä ja säteilee erityistä valoa. Sula rikki, joutuessaan kosketuksiin kloorikaasun kanssa, palaa sinisellä liekillä ja muuttuu rikkikloridiksi; murskattu antimoni tai pieni arseeni, joka on asetettu kloorilla täytettyyn astiaan, syttyy itsestään ja yhdistyy arseenikloridiksi tai antimonikloridiksi.
Molemmissa tapauksissa samankaltaisuuden vuoksi tapahtui eri kappaleiden yhdistäminen rikin, sitten kloorin kanssa, ja lämmön ja valon vapautuminen ilmestyi.
Täsmälleen samoissa olosuhteissa muodostuu eri kappaleiden yhdisteitä eri kaasulla - hapella.
Kytke retortti (lasitislausastia), joka sisältää elohopeaa, lasikupolin sisäpuolelle, joka on ilmatiiviisti suljettu. Lämmitä elohopea melkein kiehumispisteeseen: elohopea ei pala, mutta se menettää metallisen kiillon ja entisen hopeisen värinsä sekä pisara -nestemäisen tilan - se muuttuu punertavaksi jauheeksi, joka liittyy vanhaan metalliin samalla tavalla kuin hiili puuhun. Jos ennen kokeen alkua olet punninnut tarkasti sekä elohopean että konepellin alla olevan ilman ja punninnut nyt molemmat uudelleen, käy ilmi, että ilmassa ja jauheessa ei ole painoa on ylipainoinen ja sama ... Jos esimerkiksi konepellin alla oleva ilma painoi täsmälleen 1000 grammaa, nyt se painaa vain 767 grammaa; mutta jauhe painaa 233 grammaa enemmän kuin elohopea. Tee nyt päinvastainen koe: aseta jauhe pieneen retorttiin, joka on liitetty puoliksi vettä täynnä olevaan lasipulloon. Kuumenna retortti vahvan alkoholipalon päällä: jauhe muuttuu höyryksi, joka veden läpi jakautuu kahteen osaan: metallisaostumaan, joka koostuu puhtaasta pisarasta nestemäistä elohopeaa ja hapesta, joka kerääntyy sylinteriin .
Hapella on sama affiniteetti kuin kuumalla elohopealla kuumaa rautaa tai sulaa kuparia varten: joutuessaan ilman kanssa nämä metallit kyllästyvät pinnalle ahneesti ilmassa olevalla hapella ja muodostavat kuparia tai rautaa (kuonaa), ts. . rauta- tai kuparioksidia (yhdiste, jossa on happea) ja säteilee kirkkaita kipinöitä.
Kaikissa näissä tapauksissa tapahtui sama ilmiö: yhteys hapen kanssa tai näiden kappaleiden hapettuminen (hapettuminen) - ei vain lämmön vaikutuksesta, vaan myös lämmön ja valon vapautuessa, niin että lämpö ja valo, ts. mitä yleisesti kutsutaan "polttavaksi", on sivuvaikutus, suora seuraus tai pikemminkin voimakas ilmentymä, jota muinaiset pitivät erityisenä elementtinä, jonka periaatteeksi he kutsuivat "flogistonia".
Mutta hapettuminen voi tapahtua paitsi ilman tulipaloa, mutta jopa ilman huomattavaa lämmön vapautumista: jos rauta altistuu ilmalle, se peitetään ruosteella. Tämä ruoste on vain hapetustuote, nimittäin rautaoksidi tai poltettu rauta.
Palamisprosessi jäi ilman havaittavaa lämmön vapautumista vain siksi, että hapetus itsessään oli hyvin hidasta. Puun hapettuminen on hieman havaittavampaa: mätä hehkuu pimeässä; jos laitat kätesi mätäneeseen kasaan, sinusta tuntuu lämpimältä; itse kasa vähenee päivä päivältä; toisin sanoen puu palaa hitaasti (haisee) ilmassa.
Vieläkin havaittavampaa on tulva raikas ilma kuumenemisen aikana: jos ilmavirta puhalletaan kuumille hiileille tai hitaasti palavalle puulle (esimerkiksi puhaltavalla turkilla), liekki ilmestyy välittömästi. Prosessi on seuraava: puu sisältää kaksi palavaa kappaletta - hiiltä ja vetyä; ensimmäinen yhdistyy hapen kanssa ja palaessaan muuttuu hiilidioksidiksi tai hiilidioksidiksi ja toinen hapeksi tai vedeksi.
Minkä tahansa palava materiaali, v jokapäiväinen elämä polttoaineena tai valaistusmateriaalina, palovammat samojen sääntöjen perusteella. Esimerkiksi tali ja öljy koostuvat pääasiassa hiilestä ja vedystä; sekä toisella että toisella on merkittävä affiniteetti hapen kanssa ja koko palamisprosessi, ts. hapettumisella tarkoitetaan sitä, että happi hajoaa palavan aineen osiinsa ja yhdistyy jokaisen kanssa erikseen.
Täsmälleen sama hapettuminen tapahtuu eläimen kehossa: typen (rasvaiset) ruumiinosat hapetetaan tai poltetaan pois kosketuksesta hapen kanssa, jonka johtaja on veri, ja seurauksena on eläinten lämpö.
Mutta aivan kuten hapettuminen voi olla hyvin hidasta, se voi olla erittäin nopeaa ja energistä. Punainen fosfori, esimerkiksi makaa ulkona, ei vain haise ja hehkuu, vaan siihen kaadetaan suuri numero, sulaa hitaasti ja lopulta syttyy (itsesyttyminen). Pienin kemiallisesti puhtaan raudan jauhe syttyy tulehduksen yhteydessä ulkoilmaan. Lopuksi metallimetrium hajoaa heti veteen tullessaan välittömästi sen ainesosiksi imeäkseen veteen sisältyvän hapen ja lisäksi niin voimakkaasti, että vapautunut lämpö voi sytyttää toisen vapautuvan kaasun, vedyn natriumin ja hapen yhdistelmällä. Niinpä vety syttyy värittömällä liekillä ja yhdistyy jälleen ilmakehän hapen kanssa veteen. Siksi alla on natriumia mineraaliöljyä siitä asti kun tämä öljy on hiilivetyyhdiste, joka ei sisällä happea.
Kaiken edellä mainitun perusteella voidaan tehdä useita pakottavia johtopäätöksiä:
- Mitä me kutsumme polttamiseksi jokapäiväisessä elämässä, ts. liekin, valon ja lämmön esiintyminen edellyttää kahden kappaleen läsnäoloa: palavaa materiaalia ja happea.
- Itse palamisprosessi koostuu ensinnäkin palavan materiaalin hajoamisesta vapautettaessa osia, jotka yhdistyvät hapen kanssa, ja toiseksi, tämän yhdistelmän prosessissa, ts. hapettumisessa. Palavien aineiden hapetustuote riittävällä lämmöllä on pääasiassa näiden aineiden muuttuminen hiilihapoksi ja veteen.
- Koska luonnossa happea ei koskaan esiinny erillisessä muodossa, sitten palaessa palaminen materiaali erottaa sen yhdistettäessä ilmakehästä, vedestä tai mistä tahansa muusta monimutkaisesta kappaleesta, joka sisältää happea; tämän vuoksi happea lähettäviä kappaleita kutsutaan hapettimiksi, hapettuneita kappaleita emäksiksi ja aineita, jotka aiheuttavat tai lisäävät hapen vapautumista, hajottajiksi. Pyroteknisten valmisteiden ja ilotulitusseosten koostumukseen kuuluu yleensä kunkin kolmen ryhmän edustajia, mutta on poikkeuksia: tietyissä tapauksissa emäs ja hapettava aine riittävät (esimerkiksi alumiini ja kaliumpermanganaatti); muissa, mutta hyvin harvinaisissa tapauksissa vain yksi emäs, jos se on riittävästi hapetettu (esimerkiksi magnesium, lycopodium jne.).
- Ilman hapettavan aineen osallistumista emäs ei pala, mutta jos kiinnität siihen aineen, joka kykenee yhdistymään emäksen kanssa ja hajottamaan sen, seos muuttuu syttyväksi. Tällaisia emäksiä, jotka eivät itsessään ole syttyviä, ovat: sinkki, natrium, lyijy, barium, kalium, strontiumi, kloori- ja typpihapposuolat jne. Palavat epäpuhtaudet, jotka edistävät emäksen hajoamista, ovat: rikki, hiili, noki, sokeri, tärkkelys, dekstriini, sellakka, kumimilakki, rasva, jne. Esimerkki on suolapeteri (kaliumnitraatti): suolapeteri ei pala, mutta jos sekoitat sen rikin kanssa, saat palavan seoksen, koska rikki hajottaa nitraatin ja ottaa siitä happea, jonka kanssa se muodostaa rikkihapon. Sama havaitaan, kun rikki yhdistetään bertholletin suolan (Kali cliloricum) tai kaliumpermanganaatin (Kali hypemanganiucum) kanssa. Jos koostumus muodostuu hiilestä, nokista tai selluloosasta emäksenä rikin ja nitraatin seoksen kanssa, suolapeteri toimii hapetusaineena ja rikki hajotusaineena. Prosessi on seuraava: hiili hajottaa nitraatin yhdistettynä typpihapon hapen kanssa ja happi ja hiili yhdistyvät kaasumaiseksi hiilihapoksi ja vapautuu typpeä. Rikki puolestaan edistää hajoamista ja mikä tärkeintä, estää hiilihapon ja kaliumin yhdistymisen: samalla tavalla yhdiste muodostaisi kiinteän kappaleen - kaliumia. Ilman rikkiä puolet hiilihaposta menisi kiinteään yhdisteeseen.
- Palaminen on mahdotonta kuvitella ilman happea, joten petrolin alle varastoitu natrium ei pala; ilmatiiviisti suljetun kellon alla syttynyt fosfori sammuu, kun käytettävissä oleva hapensaanti on loppunut (noin 1/5 kellon alla olevasta kuutiomäärästä); eläimet, jotka on asetettu "koiran luolaan", täynnä hiiltä, tukehtuvat ja. jne.
Mutta vaikka jokapäiväisessä elämässä ilmakehä toimii hapen pääsäiliönä, kemia viittaa useisiin muihin hapettimiin, joiden kautta palaminen voidaan saavuttaa sekä veden alla että avaruudessa - joko täysin ilmaton tai kaasuilla, joissa ei ole yksi happiatomi ... Tällaisia hapettimia, jotka kykenevät vapauttamaan riittävän määrän happea koostumuksen täydelliseen palamiseen ilman ilman mukanaoloa, ovat suolapeteri, bertholletin suola ja useat muut jo mainitut kappaleet. Esimerkiksi suolapeterin ansiosta ruuti hankkii kyvyn palaa aseen tai tykin kuonossa ilman ilmakehän osallistumista; palaminen veden alla on ajateltavissa edellyttäen, että seos sisältää hapettimen, joka on riittävän voimakas paitsi koostumuksen täydelliseen palamiseen, myös lämpötilan ylläpitämiseksi vaaditulla korkeudella veden alla tapahtuvan palamisprosessin aikana.
Edellä esitetyn perusteella huomaamme, että palavien aineiden (esimerkiksi polttoaineen) muuttuminen kaasuksi riittävän korkeissa lämpötiloissa voi tapahtua neljässä olosuhteessa: a) lämmitys ilman pääsyä ilmaan ja siten happi (hiili, koksi, luminoiva kaasu); b) kuumentaminen kemiallisesti sitoutuneen hapen (H20, CO 2) läsnä ollessa: vesikaasu; c) rajoitetun vapaan hapen (ilman) tulo: generaattorikaasu; d) riittävä ilmansaanti (tavallinen tulipesä) tai parempi hapensyöttö (vedos). - Mitä voimakkaammin hapetusprosessi tapahtuu ja mitä lähempänä emäksen kemiallinen affiniteetti hapettavan aineen ja hajoajan kanssa on, sitä voimakkaampi ja nopeampi valon ja lämmön ilmentyminen. Edellä todettiin vielä yksi seikka: muissa tapauksissa tapahtuu mielivaltaista hapettumista (rappeutuminen, ruoste, itsesyttyminen), toisissa on nostettava lämpötila (lämmitettävä esine) tiettyyn nopeuteen yhdisteen ( kuumien metallien hapettuminen, niiden yhdistelmä kloorin ja rikin kanssa, kynttilän, puun, lampun, kerosiinin polttaminen, ruuti sytyttäminen jne.).
Lisäksi: prosessin jatkokurssi voidaan suorittaa nopeasti tai hitaasti.
Siksi on tarpeen erottaa toisistaan kaksi eri ominaisuutta palavan materiaalin paloherkkyydestä (eli hapettumisen ulkoisesta ilmentymästä): syttyvyys ja palavuus. Ensimmäinen osoittaa lämpötilan, jossa syttyminen tapahtuu (hapettumisen alkaminen), ja toinen osoittaa nopeuden, jolla itse hapetusprosessi tapahtuu. Pyrotekniikan osalta on välttämätöntä tietää tarkasti sekä toinen että toinen, koska koostumusten kemiallinen arvio riippuu täysin tämän tietämyksestä sekä niiden syttymisen että valon voimakkuuden ja keston suhteen. palaminen.
Mitä tulee lämmön aiheuttamiin kemiallisiin ilmiöihin, Rudolf Wagner toteaa seuraavaa: ”Tiede kemiallisten yhdisteiden ja hajoamisen lämpöilmiöistä,” termokemia ”, ei vieläkään pysty selittämään erilaisia hajoamis- ja valmistusmenetelmiä kemianteollisuudessa, mutta se antaa jo viitteitä suhteellisen suuresta tai pienemmästä kemiallisten reaktioiden todennäköisyydestä ja toteutettavuudesta, koska Yleensä helpoin saada yhdisteitä, jotka muodostuvat lämmön vapautuessa, kun taas reaktio, joka tapahtuu lämmön absorboitumisen yhteydessä, on useimmissa tapauksissa paljon vaikeampaa. "
Lämpöyksikkö on määrä, joka tarvitaan lämmittämään painoyksikkö vettä 0–1 celsiusasteeseen. Desimaalijärjestelmän mukaan painoyksikkö on gramma (cm 3); kemiallinen lämpöyksikkö, jota kutsutaan ”kaloriksi”, on merkitty symbolilla “cal” ja 1000 kaloria symboli “cal”. Symboli "K" (kg) ilmaisee lämmön määrän, jonka 1 g vettä vapauttaa kiehumispisteestä jäätymispisteeseen. Lämmön mekaaninen ekvivalentti on 425 kg / m3.
Palamisvaikutukset ja tuotteet
Täydellistä palamista ei ole: polttoaineen koostumuksen osat, jotka eivät ole muuttuneet kaasuiksi, muodostavat savua tai sakkaa. Savu on vain palamatonta materiaalia, joka muuttuu hienoimmaksi pölyksi ja jota ilmavirta kuljettaa pois. Tällainen runko on muun muassa noki (loppuosa palamattomasta puusta), noki (loput polttamattomasta rasvaisesta ruumiista), hiilivoimalla toimiva savupiippusavu (joka tuhansilla puikoilla roikkuu tehdaskaupunkien päällä ja jota käytetään nyt hyväksi) koko yhteiskunta) jne. Sakka muodostaa useimmiten palamattoman, mutta myös palamattoman (tulenkestävän) kemiallisen yhdisteen.
Siksi lähin ongelma pyrotekniikka koostuu sellaisten koostumusten valmistamisesta, jotka palaisivat mahdollisimman vähäisellä savun ja sedimentin päästöllä.

Palaminen aiheuttaa tulipalon liekkien tai kipinöiden muodossa; kaasujen liekki itsessään ei loista lainkaan (kuten esimerkiksi poltettaessa vetyä, kun natrium upotetaan veteen); sen valo ja väri saadaan, koska tulessa on tiheämpiä kappaleita. Esimerkiksi lampun kaasun keltainen valo johtuu siitä, että tämä kaasu koostuu vedystä ja hiilestä; vedyllä on suurempi hapettumiskyky kuin hiilellä ja se palaa nopeammin ja täydellisemmin, ja hiileen, joka kerääntyy liikaa tuleen, saadaan liekille vaalea ja keltainen maali. Siksi sen selvittämiseksi, tupakoiko liekki, riittää, että pistät jonkin vieraan ruumiin keskelle, missä ilma on vähiten saatavilla: se peitetään välittömästi nokipinnoitteella.
Mitä tarkalleen kiinteät kappaleet antaa valoa liekille, todistaa seuraavan: kaikista olemassa olevista kappaleista vety vapauttaa suurimman lämmön palamisen aikana, koska sulaa sekä platinaa että vuorikiteitä; mutta sen liekki on erittäin vaalea, kunhan vain kaasut - vety ja vesihöyry - toimivat hapetuselementteinä, mutta heti kun jonkin tiheän aineen (esimerkiksi raudan, hiilen, marmorin) seos ilmestyy, saadaan häikäisevä valo (Drummondin valo).
Valon voimakkuus on suoraan verrannollinen hapetusenergiaan: mitä voimakkaampi jälkimmäinen, sitä korkeampi palamislämpötila ja siten sitä voimakkaampi kiinteiden epäpuhtauksien palaminen. Esimerkiksi alkoholipalo, valoisa kaasu, joka on sekoitettu lämmitettyyn ilmaan, ja lopuksi Unica -bensiinipoltin antaa erittäin vaalean liekin, mutta ne pystyvät antamaan merkittävän valovoiman tunnettujen epäpuhtauksien kautta: sähkölamput antavat keltaisen , heikompi valo ja sähkölamput - valkoinen, häikäisevä kirkkaus, koska ensimmäisessä tapauksessa sähköjännite on vertaansa vailla vähemmän energinen kuin toisessa.
Erityisen kiinnostavia ovat Auer -polttimet, joita käytetään nyt paitsi kaasun sytyttämiseen myös bensiinin, alkoholin, asetyleenin ja muiden valonlähteiden tuottamiseen: nämä polttimet, jotka koostuvat tulenkestävien kappaleiden seoksesta, muuttavat voimakkaan lämmönlähteen heikon valon kirkas, vihertävä tai sinertävä valkoinen valo.
Antimonia, hiiltä ja muita aineita käytetään parantamaan valon kirkkautta ja lisäämään liekkiä pyroteknisissä koostumuksissa.
Liekin väri ei johdu itse epäpuhtauksista, vaan yksinomaan kaasuista, jotka muodostuvat näiden epäpuhtauksien palamisen seurauksena; kaasut tulevat tuleen ja antavat liekille valkoisia, keltaisia, punaisia, vihreitä, sinisiä, violetteja värejä kaikenlaisissa sävyissä. Tällaisia epäpuhtauksia ovat natriumin, kuparin, lyijyn, bariumin, strontiumin, antimonin jne. Suolat. Esimerkiksi rikki, joka on sekoitettu suolapetteriin, antaa epämääräisen värin palamisen aikana ja antimonin läsnä ollessa valkoinen; jos lisäät bariumnitraattia berthollet -suolan ja rikin seokseen, saat vihreä väri jne.
Värjäysaineet koostuvat pääosin metalliyhdisteistä, mutta itse maali ei riipu pelkästään metallista vaan myös siihen yhdistetyistä ei-metallisista aineista. Tämän todistaa selvimmin seuraava kuparikokeilu. Kupari, kuten jo mainittiin, palaa rikkikaasuissa punaisella liekillä ja muuttuu rikkipitoiseksi kupariksi. Jos kuparia, jossa on pieni rikki, poltetaan hapessa, muodostuu violetti liekki. Jos rikin sijaan kupariin lisätään kiinteää hiilihydraattia (sellakka, sokeri jne.), Liekki saa vihreän värin.
Kuumenna ripaus Grunspania tai rikasuolaa alkoholipuhallus liekillä: alkoholikaasujen vaikutuksesta muodostuu kirkkaan vihreä liekki. Lisää vähän kalomelia tai ammoniakkia samaan aineeseen: saat kirkkaan sinisen liekin, koska kupari yhdistyy vapautuneen kloorin kanssa ja palaessa muodostaa kuparikloridia (Chlorkupfer). Alkoholipalon vaikutuksen alainen kuparikloridi palaa vihreällä liekillä, koska alkoholipalon vety poistaa kloorin kuparista ja tekee sen pätemättömäksi liekin värin suhteen (CuCl 2 + 2H-2HCl + Cu). Jos kuparioksidi (Kupferoxyd, CuO) poltetaan alkoholipalossa, liekin ytimessä ja pohjassa on valkoinen väri ja kielen reunat ja pää ovat sinisiä. Tämä selittyy sillä, että liekin vety pelkistää ensin kuparioksidia (CuO + 2H = Cu + H 2O), minkä jälkeen kuparin sävytyskyky ilmenee jälleen ulkoisessa liekinkuorella hapetuskyvyn vaikutuksesta. kirjekuori ja sen sisältämä erittäin korkea lämpötila.
Kalomelia, ammoniakkia, mastiksia, sellakkia jne. Käytetään parantamaan värin "tiheyttä".
Koostumuksen palamisnopeus riippuu pääasiassa:
- emäksen elementtien ja hajottajien välisestä kemiallisesta suhteesta, tk. hajoavuusaste ja siten pohjan syttyvyys riippuu tämän suhteen asteesta;
- komposiittisuhteista, t. kullekin seokselle on äärimmäinen raja, jonka saavuttamisen jälkeen saadaan emäksen nopein ja täydellisin hajoaminen, kun taas tämän rajan ulkopuolella, ts. ennen tai jälkeen, huonoin tulos saadaan - tällaista rajaa kutsutaan "normiksi";
- palamisen aiheuttaman lämpötilan korkeudesta;
- koostumuksen tiheydestä ja yhtenäisyydestä;
- alkaen kemiallinen vaikutus epäpuhtaudet, ts. alisteiset elementit;
- ilmakehän kosteudesta ja koostumuksen hygroskooppisuudesta;
- ulkolämpötilasta;
- lopuksi useista pienistä ja suurista, tärkeimmistä tai toissijaisista syistä, joista jokaisella on oma osuutensa yleinen prosessi lääkkeen palaminen.
Palamisnopeuden määrittäminen on yksi pyrotekniikan tärkeimmistä tehtävistä, koska siihen liittyy kysymys liekin mielivaltaisesta tehostamisesta tai hidastamisesta, joten taustalla olevissa paikoissa kiinnitetään erityistä huomiota normiin.






