Palamisen lämpöteoria. Palamisteorian perusteet. Polttotyypit, niiden ominaisuudet
Palaminen- palavien aineiden nopeasti etenevä kemiallinen vuorovaikutus hapettimen kanssa, johon liittyy suuren lämpömäärän vapautuminen ja kirkas hehku (liekki). Palaminen on mahdollista vain kolmen tekijän läsnä ollessa: palava aine, hapettava aine ja lämmönlähde.
Lämmön lähde(tuli) voi olla avotuli, kipinä, kitkan kuumentama lämpö (hihnakäytössä hihnat), isku, paine. Lämmönlähde voi olla myös sähköä (johtimien lämmitys, kaari), kemiallista ja auringon säteilyenergiaa.
Hapettavat aineet ovat klooria, fluoria, bromia. Yleisin hapetin on ilman happi, palamisprosessi riippuu sen pitoisuudesta ilmassa. Jos ilmassa on yli 14-16 % happea, havaitaan vakaa palaminen. Alle 14 %:n happipitoisuudessa havaitaan kytemistä, ja alle 8-10 %:n happipitoisuudessa kyteminen myös lakkaa.
Palava aine... Ne voivat olla kaasuja (ammoniakki, asetyleeni, vety), nesteitä (bensiini, asetoni, alkoholi), kiinteitä aineita (hiili, puu). Jotta tulipalo syttyisi kiinteä aine tai nestemäistä, on tarpeen käyttää lämmönlähdettä niiden lämmittämiseen sellaiseen lämpötilaan, että niiden pinnoilta vapautuu voimakkaasti syttyviä höyryjä. Kun tietty pitoisuus saavutetaan, nämä höyryt syttyvät. Kaasut palamisen aikana eivät muuta aggregaatiotilaansa.
On olemassa seuraavat palamistyypit: 1) salama; 2) sytytys; 3) itsestään syttyminen; 4) itsestään syttyminen; 5) kyteminen; 6) räjähdys.
1... Flash sanotaan ilman hapen seoksen välittömäksi palamiseksi höyryjen, kaasujen, pölyn kanssa, johon ei liity puristettujen kaasujen muodostumista. Leimahduspiste on eniten matala lämpötila palava aine, jonka pinnan yläpuolelle muodostuu höyryjä tai kaasuja, jotka voivat leimahtaa sytytyslähteestä, mutta myöhempää vakaata palamista varten niiden muodostumisnopeus on riittämätön.
Tämän lämpötilan arvon mukaan syttyvät nesteet jaetaan:
a) syttyvät (palavat nesteet - bensiini, asetoni, alkoholi) - t flash ≤ + 45 ° С;
b) syttyvät nesteet (GZh - öljyt, dieselpolttoaine, polttoöljy) - tp> + 45 ° С.
2. Sytytyksellä kutsutaan aineen vakaaksi jatkuvaksi palamiseksi lämmönlähteestä. Palavan aineen vähimmäislämpötilaa, jossa se syttyy sytytyslähteestä ja jatkaa palamista sen poistamisen jälkeen, kutsutaan syttymislämpötilaksi. Se on korkeampi kuin leimahduspiste.
Ilman palavien aineiden pitoisuus, jossa syttyminen tai räjähdys on mahdollista, on tietyissä rajoissa: alempi on CWP:lle ja ylin ERW:lle. Palavien seosten syttyminen on mahdotonta CWP:n alapuolella (seoksessa ei ole tarpeeksi palavan aineen molekyylejä) ja CWC:n yläpuolella (seoksessa ei ole tarpeeksi happimolekyylejä). Mitä suurempi ero ERC:n ja UWP:n välillä on, sitä vaarallisempi aine on. Näiden parametrien arvot voivat laskea esimerkiksi pöly-ilmaseoksen (PLVS) kosteuden lisääntyessä, esimerkiksi ilman sekoitus sokerin, jauhojen, hiilipölyn kanssa.
Annetaan esimerkkejä NWP:n ja ERW:n arvoista useille kaasuille ja nesteiden höyryille:
asetyleeni 3,5-82 %;
Maakaasu 3,8-19,2%;
Bensiini 1-6 %;
Hiilimonoksidi 12,8-75 %.
3.Itsesyttyvyys- aineiden syttymisprosessi ulkoisesta lähteestä (liekistä, kuumennetusta tai hehkuvasta kappaleesta) ilman suoraa kosketusta sen kanssa syttymislämpötilassa. Tämä lämpötila laskee paineen noustessa ja useimmille palaville kaasuille on alueella 400-700 ° C, puulla - 340-400 ° C; kivihiili - 400-500 ° C. Esimerkki itsesyttymisestä: puun, paperin lämmitys ja myöhempi sytytys, joka sijaitsee lähellä avotulta (koskematta siihen) tai hehkuvia esineitä (hiilet, avoin spiraali lämmitin).
4. Spontaani palaminen aineet syntyvät itse aineessa (materiaalissa) tapahtuvien fysikaalisten, kemiallisten ja biologisten reaktioiden seurauksena, jotka johtavat palamiseen ilman sytytyslähdettä.
Varastoitaessa suuria määriä märkää viljaa, heinää, olkia ja niiden riittämätön ilmanvaihto näiden materiaalien sisällä tapahtuu biokemiallisia prosesseja (hajoamista) lämmön vapautuessa. Näiden materiaalien lämpötila nousee, niiden suuri massa (rikki, heinäsuovasta) estää syntyvän lämmön haihtumisen ympäristöön, mikä aiheuttaa tulipalon. Tällaiset materiaalit on kuivattava hyvin ennen varastointia. Myös kosketus ilman tuuletusta sisältäviin öljytahroja sisältäviin kankaisiin (vaatteet, puhdistusliina) syttyy itsestään. Siksi työvaatteet tulee ripustaa siten, että ilma pääsee vapaasti, ja öljyiset rievut on poistettava viipymättä työtiloista.
Reaktionopeudesta riippuen palamisprosessi saa muodon hajoaminen(nopeus useita cm/s), itse asiassa palaminen(useita m/s) ja räjähdys(useita satojatuhansia m/s).
5. Räjähdys- äkillinen muutos aineen fysikaalisessa ja kemiallisessa tilassa korkean lämpötilan, paineen ja kemiallisten reagenssien vaikutuksesta. Räjähdyksen aikana muodostuneiden kaasujen ja höyryjen tilavuus kasvaa jyrkästi, vapautuu valtava määrä energiaa, joka pystyy suorittamaan iskuaallon muodossa mekaaninen työ(tuhota rakennuksia, rakenteita, vahingoittaa ihmisiä).
Materiaalien palaminen voi olla täydellistä tai epätäydellistä. Täydellisen palamisen yhteydessä (ylimääräinen happi) muodostuu palamattomia tuotteita (CO 2 ja H 2 O) Epätäydellisessä palamisessa (O 2:n puute) syntyy epätäydellisiä hapettumistuotteita (CO, alkoholit, hapot). Ne ovat myrkyllisiä ja räjähtäviä. Siksi polttoaineen polttoprosessia organisoitaessa (kattiloissa, uuneissa) uunissa on oltava riittävä määrä happea.
Palamisen molekyylienergia
Useimmissa polttoprosesseissa yhdistetään vetyä ja hiiltä sisältäviä polttoaineita ilmakehän happeen.
Ennen kuin ryhdymme pohtimaan palamisteorian fysikaalisia ja matemaattisia perusteita, yritetään ymmärtää molekyylitasolla, mistä palamisenergia tulee, jonka vapautumisesta riippuu kaikki muu: kaasun lämmitys, aktiivisen aineen esiintyminen. siinä olevat kemialliset keskukset jne.
Katsotaanpa, mikä muodostaa hiilen ja vedyn yhdistelmän pääreaktioiden lämpöt ilmakehän hapen kanssa.
Kirjoitamme taulukon tietojen mukaisesti. 3.1 Kiinteän hiilen, esimerkiksi grafiitin, peräkkäisen hapettumisen reaktioiden energiatase:
Siten kiinteän hiilen kokonaishapetusreaktiossa vapautuu 386 kJ / mol:
Myös vedyn ja hapen yhdistyessä vapautuva energia on suuruudeltaan samanlainen:
CO-molekyyli on ehkä kestävin, sen sitoutumisenergia on 1016 kJ / mol. (Seuraavaksi vahvin on N2-molekyyli, jonka sitoutumisenergia on 892 kJ/mol. Molemmissa molekyyleissä on kolme paria sidoselektroneja, kemiallisesti kolme valenssisidosta. CO-molekyylissä ensin yksi elektroni siirtyy O:sta C:hen, sen jälkeen jotka O + ja C- tulevat samanlaisiksi kuin typpiatomit; tämän vahvistaa dipolimomentin läsnäolo CO-molekyylissä.) CO2-molekyylissä toisen happiatomin sidos on heikompi: taulukon mukaan. 3.1
Näiden yhdisteiden hapen sitoutumisenergiat ovat verrattavissa alkuperäisen happimolekyylin sitoutumisenergiaan. Koska
silloin yksi happiatomi vastaa vain 240 kJ/mol. Happimolekyylin alhainen sitoutumisenergia on syy sen kemialliseen aktiivisuuteen ja syynä hapettumisen käytölle energialähteenä.
Grafiitin (sekä timantin ja amorfisen hiilen) kidehilassa olevan hiiliatomin sitoutumisenergia on erittäin korkea. Reaktion suhteellisen pieni energia С (s) + 0,5О2 = = СО + 98 kJ / mol on kahden erittäin suuren määrän ero: СО:n sitoutumisenergiasta (256 kJ / mol) on vähennettävä puolet O2:n hajoamisenergia atomeiksi (59 kJ/mol ) ja vähennä hiiliatomin höyrystymislämpö. Itse asiassa näin määritetään höyrystymislämpö, joka on 671 kJ / mol. Tämä on myös erittäin suuri arvo.
Kiinteän hiilen ja vetykaasun muuntaminen hiilivetypolttoaineiksi tapahtuu pienellä energiamuutoksella. Toisaalta kun happea viedään orgaanisiin alkoholien, aldehydien ja ketonien, orgaanisten happojen, hiilihydraattien molekyyleihin, vapautuu lähes yhtä paljon energiaa kuin vapautuu täydellisen palamisen aikana (CO2:ksi ja H2O:ksi), luonnollisesti, kun yhtä suuri määrä happea kuluu. Siksi voidaan olettaa, että minkä tahansa fossiilisen polttoaineen täydellisen palamisen yhteydessä vapautuu 419-500 kJ / mol kulutettua happea. Ainoat poikkeukset ovat endotermiset, energiarikkaat yhdisteet, kuten asetyleeni ja syaani, joiden palamislämpö on korkeampi.
Epätäydellinen palaminen on energeettisesti epäedullista paitsi polttoainemolekyyliä, myös käytettyä happimolekyyliä kohti. Reaktiossa 2Q (tv) + O2 = 2CO vapautuu vain 210 kJ / mol vetyä poltettaessa 466 ja CO:ta poltettaessa 526 kJ / mol.
C-atomin vahva sidos kiinteässä hiilessä estää hiiltä haihtumasta. Hiili poistuu kiinteästä olomuodosta vain yhdessä hapen kanssa CO tai CO2 muodossa.
Epätäydellisessä palamisessa ja alhaisessa lämpötilassa reaktio 2CO = CO2 + C (s)) + 41 kJ / mol on energisesti edullinen vain kiinteälle hiilelle laskettuna. Vapaalle hiiliatomille laskettuna vastaavalla reaktiolla 2СО = СO2 + С - 129 kJ / mol on suuri energiaeste. Siksi noki ja noki muodostuvat palamisen aikana vain orgaanisten molekyylien hajoamisesta hiilirungolla, mutta ei CO:sta.
Siirrytään nyt hapetusreaktioihin, joissa on mukana typpeä.
Typpimolekyyli N2 on erittäin vahva - sen dissosiaatioenergia on 226 kJ / mol. Siksi N2:n ja O2:n muuntumisreaktio 2NO:ksi on endoterminen ja termodynaamisista syistä voi edetä vain korkeissa lämpötiloissa.
Korkeampien oksidien (NO2, N2O3, N2O4, N2O5) muodostuminen typestä ja hapesta etenee käytännössä ilman energiamuutosta (verrattuna N2:n ja O2:n sitoutumisenergiaan). Siksi happi, joka on pakattu typpiyhdisteisiin (CH3-ONO2 - nitroeetteri, CH3 (CeH2) (NO2) 3 - trinitrotolueeni) energian näkökulmasta, vastaa käytännössä kaasumaista happea. Orgaaniseen molekyyliin sisäänrakennettu, mutta typen kanssa sitoutunut happi mahdollistaa aineiden luomisen, jotka vapauttavat enemmän energiaa molekyylin uudelleenjärjestyessä N2:n muodostuessa ja hapen siirtyessä CO2- ja H2O-molekyyleiksi. Tästä syystä ponneaineina ja räjähteinä käytetään yhdisteitä, joissa happi on sitoutunut typen kanssa (ja myös klooriin, CIO3-, ClO4-ryhmissä).
Nämä ovat yleisiä ajatuksia aiheesta molekyylienergiaa palaa.
Puhumme edelleen klassisista kemian perusteista, jotka ovat välttämättömiä jokaiselle pyrotekniikkaa harjoittavalle. BA-BAH muistuttaa, että kaikki käytännön oppitunti pyrotekniikka on vaarallinen yritys, jos se ei perustu tiukkaan teoriaan. Suosittelemme niille lukijoille, jotka uskovat, että mikä voi tulla heidän elämänkutsumukseen, suorittamaan täysimittaisen opintojakson esimerkiksi soveltavan kemian tutkimuslaitoksessa Sergiev Posadissa.
Viitaten yhdisteisiin osoitimme, että niiden pääasiallinen syy on alkuaineiden keskinäinen sukulaisuusaste. Muuten elementit pysyvät välinpitämättöminä joidenkin aineiden läsnäollessa ja ovat enemmän tai vähemmän voimakkaan halun alla yhdistyä muiden kanssa. Joten esimerkiksi kalkki imee helposti raskasta kloorikaasua, ts. yhdistyy sen kanssa muodostaen kloorattua kalkkia; elohopea yhdistyy sulaan rikkiin muodostaen hyvin tunnetun kirkkaan punaisen aineen, jota kutsutaan kinaberiksi. Kaneli (Zinnober) voi hajota uudelleen rikiksi ja elohopeaksi, jos se yhdistetään aineeseen, jonka yksi ainesosista (esimerkiksi rikki) vetäisi voimakkaammin kuin ystävä (eli elohopea), jonka jälkeen ja toinen johonkin sidottu elementti voidaan vapauttaa samassa järjestyksessä neljännen substanssin avulla. Tällainen vapautuminen tai vapautuminen ei aina ole täydellistä, mutta useimmiten riittää osittainen vapautuminen, joka voidaan teoriassa laskea kaavoilla.
Yksi hyvin yleisimmistä affiniteetin seurauksista, joka toistuu joka vaiheessa, on ominaisuus nimeltä "hygroskooppisuus", ts. kyky kosteuttaa, kosteuttaa, muuten - imeä kosteutta ja muodostaa happo-vetyyhdisteitä. Tämä ominaisuus erottuu monista aineista ja muuten pöytäsuolasta ja rikkihaposta, jotka sijoitetaan väliin. ikkunoiden kehyksiä vetää kosteutta itseesi; poltettu kalkki, kiehuva joutuessaan kosketuksiin veden kanssa; gelatiini, jolla alkoholi kuivataan jne. Pyrotekniikan osalta hygroskooppisuus on ikävä ominaisuus, joka on otettava huomioon. Joten esimerkiksi strontiumkloridia ja nitraattia äärimmäisen hygroskooppisuuden vuoksi ei aina ole mahdollista käyttää, vaikka näillä aineilla on arvokkaita pyroteknisiä ominaisuuksia; ja yleensä kaikki koostumukset on suojattava huolellisesti kosteuden vaikutukselta. Mutta tärkein rooli pyroteknisessä kemiassa on yhdistetyypeillä, joita kutsutaan "poltoksi" (Verbrennung, poltto).
Ilmaisulla "poltto" tai "poltto" laajimmassa merkityksessä kemia tarkoittaa yleensä jokaista kahden kappaleen kemiallista yhdistelmää kolmannen muodostamiseksi; lähimmässä merkityksessä se tarkoittaa kehon yhteyttä happeen.
Selvyyden vuoksi käännytään tavalliseen tapaan kokeiluihin. Sekoita tietty määrä rautaviilat tietyllä määrällä rikkiä ja lämmitä seosta hieman; sitten tämä seos kuumenee välittömästi ja sulaa nopeasti. Tällä tavalla saatu seos ei ole enää rikkiä eikä rautaa: rautaa poltetaan rikillä, ts. kemiallisesti yhdistettynä siihen, ja seurauksena muodostui uusi kappale - rauta tai rikki (riippuen yhden tai toisen ainesosan vallitsevasta) pyriitti.
Sulata rikki upokkaassa, kiehauta seos ja heitä siihen kuparilangan paloja: tämä lanka palaa rikillä ja antaa upean punaisen värin; tuloksena on erityinen yhdiste - kuparisulfidi tai kuparikiilto. Samalla tavalla se voidaan polttaa kuparilla, ts. yhdistää siihen monia kappaleita: lyijyä, tinaa, sinkkiä jne.
Rikkipitoinen hiili on väritön, voimakkaasti haiseva neste, joka ei jäädy edes 48 ° R:ssa (hiilidisulfidin sulamispiste (CS 2) = -112 ° C) - muodostuu rikkihöyryjen ja kuumien hiilen yhdistelmästä. Molemmat pääkappaleet palavat, eli yhdessä ne muuttuvat nesteeksi.
Sama samankaltaisuus havaitaan metallien (rauta, kupari, sinkki, antimoni, arseeni jne.) välillä, jotka ovat lämpötilassa jo mainitun "kloorin" kaasun kanssa: rauta, kupari, sinkki jne. polttaa kloorilla rautakloridiksi, kuparikloridiksi, sinkkikloridiksi, lyijykloridiksi jne., samalla kun se kehittää voimakasta lämpöä ja säteilee erityistä valoa. Sula rikki, joutuessaan kosketuksiin kloorikaasun kanssa, palaa sinisellä liekillä ja muuttuu rikkikloridiksi; murskattu antimoni tai hieno arseeni, asetettuna kloorilla täytettyyn astiaan, syttyy itsestään ja yhdistyy arseenikloridiksi tai antimonikloridiksi.
Molemmissa tapauksissa samankaltaisuudesta johtuen eri kappaleiden yhdistäminen tapahtui, joskus rikillä, joskus kloorilla, ja lämpöä ja valoa vapautui.
Täsmälleen samoissa olosuhteissa muodostuu eri kappaleiden yhdisteitä eri kaasun - hapen kanssa.
Yhdistä retortti ( lasiastia tislausta varten), johon laitetaan elohopeaa lasikannen sisäpuolelta, joka on hermeettisesti suljettu ulkoilmalta. Kuumenna elohopea lähes kiehumispisteeseen: elohopea ei pala, mutta se menettää metallisen kiillonsa ja entisen hopeisen värinsä sekä nestepisaratilan - muuttuu punertavaksi jauheeksi, joka liittyy vanhaan metalliin samalla tavalla kuin hiilestä puuhun. Jos ennen kokeen alkua punnit tarkasti sekä konepellin alla olevan elohopean että ilman, ja nyt punnit molemmat uudelleen, niin käy ilmi, että ilmassa ja siellä olevassa jauheessa on painon puute. on ylipainoinen ja ihan sama... Jos esimerkiksi konepellin alla oleva ilma painoi täsmälleen 1000 grammaa, nyt se painaa vain 767 grammaa; mutta jauhe painaa 233 grammaa enemmän kuin elohopea. Tee nyt päinvastainen koe: aseta jauhe pieneen retorttiin, joka on yhdistetty lasipulloon, joka on puoliksi täynnä vettä. Kuumenna retortti vahvalla alkoholitulella: jauhe muuttuu höyryksi, joka veden läpi kulkeutuessaan jakautuu kahteen osaan: metallisakka, joka koostuu puhtaasta pisara-nestemäisestä elohopeasta ja hapesta, joka kerääntyy sylinteriin.
Happella on sama affiniteetti kuin kuumalla elohopealla kuumaan rautaan tai sulaan kupariin: joutuessaan kosketuksiin ilman kanssa nämä metallit kyllästyvät pintaan ahneesti ilman sisältämällä hapella ja muodostavat kupari- tai rautahilsettä (kuonaa), ts. . raudan tai kuparin "oksidi" (yhdiste, jossa on happea), samalla kun se säteilee kirkkaita kipinöitä.
Kaikissa näissä tapauksissa tapahtui sama ilmiö: yhteys happeen tai näiden kappaleiden hapettuminen (hapettuminen) - ei vain lämmön vaikutuksesta, vaan myös lämmön ja valon vapautuessa, niin että lämpö ja valo, ts. se, mitä yleisesti kutsutaan "poltavaksi", on sivuvaikutus, suora seuraus tai pikemminkin voimallinen ilmentymä, jota muinaiset pitivät erityisenä elementtinä, jonka periaatetta he kutsuivat "flogistoniksi".
Mutta hapettuminen voi tapahtua paitsi ilman tuliainetta, myös ilman huomattavaa lämmön vapautumista: jos rauta altistuu ilmalle, se peittyy ruosteella. Tämä ruoste ei ole muuta kuin hapettumistuotetta, nimittäin rautaoksidia tai poltettua rautaa.
Palamisprosessi jäi ilman huomattavaa lämmön vapautumista vain siksi, että itse hapetus oli hyvin hidasta. Puun hapettuminen on hieman selvempää: mätä hohtaa pimeässä; jos laitat kätesi mädäntyneeseen kasaan, tunnet olosi lämpimäksi; itse kasa pienenee päivä päivältä; toisin sanoen puu palaa hitaasti (kyteilee) ilmassa.
Vielä näkyvämpi on tulva raikas ilma kytemisen aikana: jos ilmavirta puhalletaan kuumalle hiilelle tai hitaasti kytevälle puulle (esimerkiksi puhaltavalla turkilla), liekki ilmestyy välittömästi. Prosessi on seuraava: puu sisältää kaksi palavaa kappaletta - hiiltä ja vetyä; ensimmäinen yhdistyy happeen ja palaessaan muuttuu hiilidioksidiksi tai hiilidioksidiksi ja toinen hapeksi tai vedeksi.
Minkä tahansa palavaa materiaalia, v jokapäiväinen elämä kutsutaan polttoaineeksi tai sytytysmateriaaliksi, palovammoja samojen sääntöjen mukaan. Esimerkiksi tali ja öljy koostuvat pääasiassa hiilestä ja vedystä; sekä toisella että toisella on merkittävä affiniteetti happeen ja koko palamisprosessi, ts. hapettuminen tarkoittaa sitä, että happi hajottaa palavan aineen sen aineosiksi ja yhdistyy kunkin kanssa erikseen.
Täsmälleen sama hapettuminen tapahtuu eläimen kehossa: kehon typpipitoiset (rasvaiset) osat hapettuvat, tai palavat, joutuessaan kosketuksiin hapen kanssa, jonka johde on veri, ja tuloksena on eläinlämpö.
Mutta aivan kuten hapettuminen voi olla hyvin hidasta, se voi olla erittäin nopeaa ja energistä. Punainen fosfori, esimerkiksi makuulla ulkona, ei vain kytetä ja hehkuu, vaan myös kaadetaan suuri numero, sulaa hitaasti ja lopulta syttyy (itsesyttyvä). Pienin kemiallisesti puhtaan raudan jauhe syttyy, kun se koskettaa ulkoilmaa. Lopuksi metallinatrium hajoaa sen heti, kun se joutuu veteen, välittömästi osiinsa absorboidakseen vedessä olevan hapen, ja lisäksi niin voimakkaasti, että vapautuva lämpö pystyy sytyttämään toisen vapautuvan kaasun, vedyn. natriumin ja hapen yhdistelmällä. Joten vety syttyy värittömällä liekillä ja jälleen yhdistettynä ilmakehän happeen muuttuu jälleen vedeksi. Siksi natrium sisältyy alle mineraaliöljy siitä asti kun tämä öljy on hiilivetyyhdiste, joka ei sisällä happea.
Kaiken edellä olevan perusteella voidaan tehdä useita vakuuttavia johtopäätöksiä:
- Se, mitä kutsumme arkielämässä polttamiseksi, ts. liekin, valon ja lämmön esiintyminen vaatii kaksi kappaletta: palavaa materiaalia ja happea.
- Itse palamisprosessi koostuu ensinnäkin palavan materiaalin hajoamisesta niiden osien vapautuessa, jotka yhdistyvät hapen kanssa, ja toiseksi tämän yhdistelmän prosessissa, ts. hapettumisessa. Palavien aineiden hapetustuote riittävällä kuumennuksella on pääasiassa näiden aineiden muuttuminen hiilihapoksi ja vedeksi.
- Koska luonnossa happea ei koskaan esiinny erillään, sitten yhdistettäessä palava materiaali erottaa sen ilmakehästä, vedestä tai mistä tahansa muusta monimutkaisesta kappaleesta, joka sisältää happea; tätä silmällä pitäen happea vapauttavia kappaleita kutsutaan hapettimiksi, hapettuneita kappaleita emäksiksi ja aineita, jotka aiheuttavat tai lisäävät hapen vapautumista, kutsutaan hajottajiksi. Pyroteknisten valmisteiden ja ilotulitusseosten koostumuksessa on yleensä edustajia kustakin näistä kolmesta ryhmästä, mutta poikkeuksiakin on: tietyissä tapauksissa emäs ja hapetin riittävät (esim. alumiini kaliumpermanganaatin kanssa); muissa kuitenkin hyvin harvoissa tapauksissa vain yksi emäs, jos se on riittävästi hapetettu (esim. magnesium, lykopodium jne.).
- Ilman hapettavan aineen osallistumista emäs ei pala, mutta jos kiinnität siihen aineen, joka voi yhdistyä pohjan kanssa ja hajottaa sen, seoksesta tulee syttyvä. Tällaisia emäksiä, jotka eivät itsessään ole syttyviä, ovat: sinkki-, natrium-, lyijy-, barium-, kalium-, strontium-, kloori- ja typpihapon suolat jne. Palavia epäpuhtauksia, jotka vaikuttavat pohjan hajoamiseen, ovat: rikki, kivihiili, noki, sokeri, tärkkelys, dekstriini, sellakka, kummilakka, laardi jne. Esimerkki on suola (kaliumnitraatti): suola ei pala itsessään, mutta jos sekoitat sen rikin kanssa, saat palavan seoksen, koska rikki hajottaa nitraattia ja ottaa siitä happea, jonka kanssa se yhdistyy muodostaen rikkihappoa. Sama havaitaan, kun rikki yhdistetään berthollet-suolan (Kali cliloricum) tai kaliumpermanganaatin (Kali hypemanganiucum) kanssa. Jos koostumus on muodostettu kivihiilestä, noesta tai selluloosasta emäksenä rikin ja nitraatin seoksella, niin salpietari toimii hapettavana aineena ja rikki hajottajana. Prosessi on seuraava: kivihiili hajottaa nitraattia yhdistyen typpihapponsa hapen kanssa, ja happi ja kivihiili yhdistyvät muodostaen kaasumaista hiilihappoa ja typpeä vapautuu. Rikki puolestaan edistää hajoamista, ja mikä tärkeintä, estää hiilihapon yhdistelmää kaliumin kanssa: samalla tavalla yhdiste muodostaisi kiinteän kappaleen - potaskan. Ilman rikkiä puolet hiilihaposta muuttuisi kiinteäksi yhdisteeksi.
- Palaminen on mahdotonta ajatella ilman hapen läsnäoloa, joten kerosiinin alle varastoitu natrium ei pala; hermeettisesti suljetun kellon alla sytytetty fosfori sammuu, kun käytettävissä oleva happivarasto loppuu (noin 1/5 kellon alla olevasta kuutioilman kokonaismäärästä); Hiilellä täytettyyn "Koiran luolaan" sijoitetut eläimet tukehtuvat ja. jne.
Mutta vaikka jokapäiväisessä elämässä ilmakehän ilma toimii päähappisäiliönä, kemia viittaa useisiin muihin hapettimiin, joiden kautta palaminen voidaan saavuttaa sekä veden alla että avaruudessa - joko täysin ilmattomana tai varustettuna kaasuilla, joissa ei ole yksi happiatomi... Tällaisia hapettimia, jotka pystyvät vapauttamaan riittävän määrän happea koostumuksen täydelliseen palamiseen ilman ilmakehän ilman osallistumista, ovat salpetteri, berthollet-suola ja useat muut jo mainitut kappaleet. Esimerkiksi salpeterin ansiosta ruuti saa kyvyn polttaa aseen tai tykin suussa ilman ilmakehän ilman osallistumista; palaminen veden alla on ajateltavissa edellyttäen, että seos sisältää riittävän vahvaa hapetinta, ei ainoastaan koostumuksen täydelliseen palamiseen, vaan myös lämpötilan ylläpitämiseen vaaditulla korkeudella veden alla tapahtuvan palamisprosessin aikana.
Edellä olevan perusteella toteamme, että palavien aineiden (esimerkiksi polttoaineen) muuttuminen kaasuksi riittävällä korkeita lämpötiloja voi tapahtua neljässä tilanteessa: a) lämmitys ilman pääsyä ilmaan ja siten happeen (hiili, koksi, luminoiva kaasu); b) kuumennus kemiallisesti sitoutuneen hapen (H20, CO 2) läsnä ollessa: vesikaasu; c) rajoitetulla vapaan hapen (ilman) sisäänvirtauksella: generaattorikaasu; d) riittävällä ilman pääsyllä (tavallinen tulipesä) tai tehostetulla hapensyötöllä (veto). - Mitä voimakkaammin hapetusprosessi tapahtuu ja mitä lähempänä emäksen kemiallista affiniteettia hapettimeen ja hajottajaan on, sitä voimakkaammin ja nopeammin valon ja lämmön ilmeneminen on. Yllä todettiin vielä yksi seikka: muissa tapauksissa tapahtuu mielivaltaista hapettumista (hajoaminen, ruoste, itsestään syttyminen), toisissa on tarpeen nostaa lämpötila (lämmittää esine) tiettyyn nopeuteen yhdisteen aiheuttamiseksi ( kuumien metallien hapetus, niiden yhdistelmä kloorin ja rikin kanssa, kynttilän, puun, lampun, kerosiinin polttaminen, ruudin sytytys jne.).
Lisäksi: prosessin jatkokulku voidaan suorittaa joko nopeasti tai hitaasti.
Siksi on tarpeen erottaa kaksi erilaista palavan materiaalin paloherkkyyden ominaisuutta (eli hapettumisen ulkoista ilmentymää): syttyvyys ja palavuus. Ensimmäinen tarkoittaa lämpötilaa, jossa syttyminen tapahtuu (hapetuksen alkamista), ja toinen tarkoittaa nopeutta, jolla itse hapetusprosessi tapahtuu. Pyrotekniikan osalta on tiedettävä tarkasti sekä toinen että toinen, koska koostumusten kemiallinen arvio riippuu täysin tämän tiedosta, sekä syttymisen että valon voimakkuuden ja keston suhteen. palaminen.
Lämmön aiheuttamista kemiallisista ilmiöistä Rudolf Wagner huomauttaa seuraavaa: "Tiede lämpöilmiöistä kemiallisissa yhdisteissä ja hajoamisessa," lämpökemia ", ei vieläkään pysty selittämään erilaisia hajoamis- ja valmistusmenetelmiä. kemianteollisuus, mutta se antaa jo viitteitä kemiallisten reaktioiden suuremmasta tai pienemmästä todennäköisyydestä ja toteutettavuudesta, koska yleensä helpoimmin saatavat ovat yhdisteet, jotka muodostuvat lämmön vapautuessa, kun taas lämmön imeytymisen yhteydessä tapahtuva reaktio on useimmissa tapauksissa paljon vaikeampi."
Lämmön yksikkö on määrä, joka tarvitaan veden painoyksikön lämmittämiseen 0 - 1 celsiusastetta. Desimaalijärjestelmän mukaan painoyksikkö on gramma (cm 3); kemiallinen lämpöyksikkö, jota kutsutaan kaloriksi, on merkitty symbolilla "cal" ja 1000 kaloria symbolilla "Cal". Symboli "K" (kg) edustaa lämpömäärää, jonka 1 g vettä vapauttaa, kun se jäähdytetään kiehumispisteestä jäätymispisteeseen. Lämmön mekaaninen ekvivalentti on 425 kg/m3.
Palamisvaikutukset ja tuotteet
Täydellistä palamista ei ole olemassa: ne polttoainekoostumuksen osat, jotka eivät ole muuttuneet kaasuiksi, muodostavat savua tai sedimenttiä. Savu ei ole muuta kuin palamatonta materiaalia, joka muuttuu hienoimmiksi pölyksi ja jonka ilmavirta kuljettaa pois. Sellainen ruumis on muun muassa noki (jäännös palamattomasta puusta), noki (jäännös palamattomasta rasvakappaleesta), kivihiilellä lämmitetty piippusavu (joka roikkuu tehdaskaupunkien päällä tuhansilla puuroilla ja jota nyt käytetään hyväksi kokonaisten yhteiskuntien toimesta) jne. Sakka muodostaa useimmiten ei vain palamattoman, vaan myös palamattoman (tulenkestävän) kemiallisen yhdisteen.
Siksi lähin ongelma pyrotekniikka koostuu sellaisten koostumusten täydentämisestä, jotka palaisivat mahdollisimman pienillä savu- ja sedimenttipäästöillä.

Palaminen saa aikaan tulen liekkien tai kipinöiden muodossa; kaasujen liekki itsessään ei paista ollenkaan (kuten esimerkiksi vedyn palaminen, kun natrium upotetaan veteen); sen valo ja väri saadaan tulessa olevien tiheämpien kappaleiden vuoksi. Joten esimerkiksi lamppukaasun keltainen valo johtuu siitä, että tämä kaasu koostuu vedystä ja hiilestä; vedyllä on suurempi hapetuskyky kuin hiilellä, ja se palaa nopeammin ja täydellisemmin, ja tulipalossa ylimääräinen hiili antaa liekille vaalean ja keltaisen maalin. Siksi, jotta saadaan selville, savuako jokin liekki, riittää, että työnnetään vieraskappale keskelle, jossa ilma on vähiten saatavilla: se peittyy välittömästi nokipinnoitteella.
Sen, että liekille valoa antavat kiinteät kappaleet, todistaa seuraava: kaikista olemassa olevista kappaleista vety vapauttaa palaessaan eniten lämpöä, koska sulattaa sekä platinaa että vuorikristallia; mutta sen liekki on äärimmäisen vaalea, kun taas vain kaasut - vety ja vesihöyry - toimivat hapetuselementteinä, mutta heti kun jonkin tiheän aineen (esimerkiksi rauta, kivihiili, marmori) seos ilmaantuu, saadaan häikäisevä valo (Drummond's). valo).
Valon intensiteetti on suoraan verrannollinen hapettumisenergiaan: mitä voimakkaampi jälkimmäinen, sitä korkeampi palamislämpötila ja siten sitä voimakkaampi kiinteiden epäpuhtauksien palaminen. Joten esimerkiksi alkoholipalo, lämmitettyyn ilmaan sekoitettu valokaasu ja lopuksi Unica-bensiinipoltin antavat hyvin vaalean liekin, mutta ne pystyvät antamaan huomattavan valon voimakkuuden tunnettujen epäpuhtauksien kautta: sähkölamput antavat keltaisen , heikompi valo ja sähkölamput - valkoinen, häikäisevä kiilto, koska ensimmäisessä tapauksessa sähköjännite verrattoman energisempi kuin toisessa.
Erityisen kiinnostavia ovat Auer-polttimet, joita käytetään nykyään paitsi kaasun, myös bensiinin, alkoholin, asetyleenin ja muiden valonlähteiden sytytykseen: nämä tulenkestäviä kappaleita koostuvat polttimet muuttavat vahvan lämmönlähteen heikon valon kirkas, vihertävä tai sinertävä valkoinen valo.
Antimonia, hiiltä ja muita aineita käytetään lisäämään valon kirkkautta ja lisäämään liekkiä pyroteknisissä koostumuksissa.
Liekin väri ei tule itse epäpuhtauksista, vaan yksinomaan kaasuista, jotka muodostuvat näiden epäpuhtauksien palamisen seurauksena; Kaasut menevät tuleen ja antavat valkoista, keltaista, punaista, vihreää, sinistä, violettia väriä liekille kaikenlaisissa sävyissä. Tällaisia epäpuhtauksia ovat natriumin, kuparin, lyijyn, bariumin, strontiumin, antimonin jne. suolat. Joten esimerkiksi rikki sekoitettuna nitraattiin antaa epämääräisen värin palamisen aikana ja antimonin läsnä ollessa valkoista; jos lisäät bariumnitraattia berthollet-suolan ja rikin seokseen, saat vihreä väri jne.
Värilliset epäpuhtaudet koostuvat pääosin metalliyhdisteistä, mutta itse maali ei riipu pelkästään metallista, vaan myös siihen liittyvistä ei-metallisista aineista. Tämän todistaa selkeimmin seuraava kuparikoe. Kupari, kuten jo mainittiin, palaa rikkikaasuissa punaisella liekillä ja muuttuu rikkipitoiseksi kupariksi. Jos kuparia pienellä rikkiseoksella poltetaan hapessa, muodostuu violetti liekki. Jos rikin sijasta kupariin lisätään kiinteää hiilihydraattia (sellakka, sokeri jne.), liekki saa vihreän värin.
Kuumenna ripaus Grunspania tai rikkisuolaa alkoholipuhallusputken liekillä: alkoholikaasujen vaikutuksesta muodostuu kirkkaan vihreä liekki. Lisää vähän kalomelia tai ammoniakkia samaan aineeseen: saat kirkkaan sinisen liekin, koska kupari yhdistyy vapautuneen kloorin kanssa ja muodostaa palaessaan kuparikloridia (Chlorkupfer). Kuparikloridi alkoholipalon vaikutuksen alaisena palaa vihreällä liekillä, koska alkoholipalon vety ottaa kuparista klooria ja tekee siitä liekin värin (CuCl 2 + 2H-2HCl + Cu) suhteen virheellisen. Jos kuparioksidia (Kupferoxyd, CuO) poltetaan alkoholipalossa, liekin ydin ja pohja ovat valkoisia ja kielen reunat ja pää ovat siniset. Tämä selittyy sillä, että liekin vety pelkistää ensin kuparioksidin (CuO + 2H = Cu + H 2 O), minkä jälkeen kuparin sävytyskyky ilmestyy uudelleen liekin ulkovaippaan hapetuskyvyn vaikutuksesta. kirjekuori ja sen sisältämä erittäin korkea lämpötila.
Kalomelia, ammoniakkia, mastiksia, sellakkaa jne. käytetään lisäämään värin "tiheyttä".
Koostumuksen palamisnopeus riippuu pääasiassa:
- emäksen alkuaineiden ja hajottajien välisestä kemiallisesta suhteesta, koska hajoavuusaste ja siten pohjan syttyvyys riippuu tämän suhteen asteesta;
- yhdistetyistä mittasuhteista, t. to. jokaiselle seokselle on ääriraja, jonka saavuttaessa saadaan nopein ja täydellisin emäksen hajoaminen, kun taas tämän rajan ulkopuolella, ts. ennen häntä tai sen jälkeen saadaan huonoin tulos - tällaista rajaa kutsutaan "normiksi";
- palamisen synnyttämän lämpötilan korkeudesta;
- koostumuksen tiheydestä ja tasaisuudesta;
- alkaen kemiallinen vaikutus epäpuhtaudet, ts. alisteiset elementit;
- ilmakehän kosteudesta ja koostumuksen hygroskooppisuudesta;
- ulkolämpötilasta;
- lopuksi useista pienistä ja suurista, tärkeimmistä tai toissijaisista syistä, joista jokaisella on oma vaikutusvaltansa yleinen prosessi lääkkeen palaminen.
Palamisnopeuden määrittäminen on yksi pyroteknisen taiteen tärkeimmistä tehtävistä, koska siihen liittyy kysymys liekin mielivaltaisesta voimistumisesta tai hidastumisesta, joten alla olevissa paikoissa kiinnitetään erityistä huomiota normiin.
Ensimmäinen kronologisesti (1800-luvun loppu) oli lämpöteoria, jonka perustajat ovat Malyar, Le Chatelier ja Nusselt. Tämä teoria perustuu Van't Houghin hypoteesiin kemiallisen reaktion nopeuden lämpötilariippuvuudesta. Lämpöräjähdyksen edellytyksenä on reaktioenergian aiheuttama lämmöntuonti ylivoimainen lämmönpoisto ympäristöön. Tässä tapauksessa järjestelmään kertyy lämpöä, mikä johtaa itsekuumenemiseen ja vastaavasti reaktion itsekiihtymiseen.
Hapetusreaktion esiintyminen palavassa järjestelmässä liittyy useimmiten järjestelmän kuumenemiseen yhdellä tai toisella sytytyslähteellä. Kun palavaa järjestelmää lämmitetään, polttoaine- ja happimolekyylien energia kasvaa ja kun se saavuttaa tietyn arvon, tapahtuu niiden aktivoituminen, ts. muodostuu aktiivisia keskuksia (radikaaleja ja atomeja), joissa on vapaita valensseja, minkä seurauksena palavan aineen molekyylit muodostavat helposti yhdisteen ilmakehän hapen kanssa. A.N. Bach ja K. Engler ehdottivat vuonna 1898 itsenäisesti hapettumisen peroksiditeoriaa, jonka mukaan palavaa järjestelmää kuumennettaessa happi aktivoituu katkaisemalla yksi atomien välinen sidos ja aktiivinen molekyyli muuttuu yhdisteeksi palavan aineen kanssa hajoamatta. atomeiksi ja muodostaen peroksidiyhdisteitä, joiden tyyppi on R1-OOR2 tai ROO-OH.
Peroksiditeoria ei kuitenkaan pysty selittämään joitain hapetusprosessin tunnusomaisia piirteitä, esimerkiksi terävää vaikutusta, joskus vähäisiä epäpuhtauksien jälkiä.
Kemiallisen reaktion nopeus, m/s, voidaan ilmaista Arrheniuksen lain perusteella seuraavalla yhtälöllä:
![]() , (1.12)
, (1.12)
missä on reaktion nopeusvakio (kemiallisen reaktion nopeus reagenssien pitoisuuksilla, vähennettynä yksikköön);
Reagenssien pitoisuus, mol / m 3;
Stökiömetriset kertoimet, jotka määritetään lähtöreagenssien pitoisuuksien suhteena stoikiometrisessä reaktioyhtälössä;
Luonnollisten logaritmien kanta;
Yleiskaasuvakio = 8,3 J / (mol ∙ K);
- lämpötila, K.
Itsesyttymisen lämpöteoria (kutsutaan myös termisen räjähdyksen teoriaksi) perustuu lämmön vapautumisnopeuksien vertailuun eksotermisen hapettumisen aikana ja lämmön poistumisen nopeuksia reagoivasta seoksesta sitä sisältävän astian seinämässä. Itsesyttymistilanne määräytyy näiden nopeuksien yhtäläisyyden perusteella. Astian seinämien lämpötilaa, jossa tämä tasa-arvo saavutetaan, kutsutaan itsesyttymislämpötilaksi. Tästä lämpötilasta alkaen (tyypillinen kussakin tapauksessa tietyissä olosuhteissa - astian koko ja muoto, kaasun lämpöfysikaaliset ominaisuudet) tapahtuu itsekuumenemista, mikä voi johtaa salamaan (itsesyttymiseen).
Yllä oleva huomioon ottaen voimme kirjoittaa itsekuumenemiseen reagoivassa ympäristössä:
missä on lämpökapasiteetti vakiotilavuudessa, J / K;
Kaasun tiheys, kg / m 3;
Kaasun lämpötila, K;
Ajat;
Reaktion lämpövaikutus, W;
Reaktionopeus, m/s;
Reaktioastian pinta, m 2;
Reaktioastian tilavuus, m3;
Lämmönsiirtokerroin, W / (m 2 × K);
Aluksen seinämän lämpötila, K.
D.A. Frank-Kamenetsky ehdotti termistä itsesyttymiskriteeriä, joka perustuu kiinteän lämpötilajakauman rikkomiseen reaktiivisessa astiassa riittävällä lämmön vapautumisnopeudella:
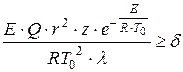 , (1.14)
, (1.14)
missä on aluksen ominaiskoko, m;
Preeksponentiaalinen tekijä;
Lämmönjohtavuuskerroin kaasuseos, W/(m x K);
Dimensionless-kriteeri on 3,3; 0,88 ja 2 pallomaisille, tasasuuntaisille ja sylinterimäisille astioille.
D.A. Frank-Kamenetskyn kriteeri on ymmärrettävä seuraavasti: jos kaikkien määrittävien parametrien korvaamisen jälkeen saamme arvon, syttymisen yhteydessä ei tapahdu sytytystä. Kriteeriyhtälöstä seuraa, että reaktiolämpö ja sen astian säde, jossa reaktio tapahtuu, ovat tärkeitä räjähdyksen määrääviä tekijöitä. Lämpöräjähdys on voimakkaampi, sitä paremmin epätasa-arvot täyttyvät:
Jos nämä epätasa-arvot täyttyvät huonosti, lämpöräjähdys rappeutuu - samanaikaisesti lämpötilan nousun kanssa alkuperäinen aine palaa nopeasti, mikä tahraa räjähdyskuvan.
Palamisen esiintyminen liittyy useimmiten palavan järjestelmän lämmittämiseen yhdellä tai toisella sytytyslähteellä. Teorian mukaan akateemikko N.N. Semjonovin mukaan hapetusprosessiin liittyy lämmön vapautuminen ja se voi tietyissä olosuhteissa kiihtyä itsestään. Tätä hapetusreaktion itsekiihtymisprosessia sen siirtymisellä palamiseen kutsutaan itsesyttymiseksi.
Termisen itsesyttymisen tapauksessa se johtuu siitä, että lämmön vapautumisnopeus ylittää lämmönpoistonopeuden.
Tarkastellaan termistä itsesyttymisprosessia käyttämällä esimerkkiä palavan kaasun tai palavan nesteen höyrystä ilman kanssa, joka on sijoitettu tilavuuteen asti. Astian ja palavan seoksen lämpötilan noustessa reaktionopeus ja lämmön vapautuminen lisääntyvät. Lämmön vapautumisnopeuden riippuvuus lämpötilasta, J / s, määräytyy:
![]() , (1.15)
, (1.15)
missä on kaasun palamislämpö, J;
Palavan seoksen tilavuus, m 3;
Reaktionopeusvakio;
Reagenssin pitoisuus, kg/m3;
Reaktiojärjestys;
Aktivointienergia, J / mol;
Yleiskaasuvakio J / (mol · K);
Seoksen lämpötila, K.
Vapautunut lämpö siirtyy palavaan seokseen ja se lämpenee. Heti kun seoksen lämpötila ylittää astian seinämien lämpötilan, alkaa lämmön poisto astian seinämien läpi aikayksikköä kohti suhteessa seoksen ja astian seinämien väliseen lämpötilaeroon ja määritetään. riippuvuuden perusteella:
![]() , (1.16)
, (1.16)
missä on lämmönpoistonopeus astian seinämien läpi, J/s;
Lämmönsiirtokerroin, J / (K · m 2 × s);
Astian seinien pinta, m 2;
Seoksen lämpötila, K;
Aluksen seinämän lämpötila, K

Kuva 1.5 - Lämmön vapautumisen riippuvuus lämpötilasta eri paineissa
Kuvan 1.5 käyrät 2, 3 ja 4 esittävät lämmön vapautumisen riippuvuuden lämpötilasta eri paineissa ja samalla seoskoostumuksella. Astian ja väliaineen vakiolämpötiloissa ja seoksen vakiokoostumuksessa palamisvyöhykkeeltä poistuvan lämmön määrälle on tunnusomaista suora viiva 1. Kun seoksen koostumus muuttuu, lämpöhäviön nopeus ja sen seurauksena myös suoran kaltevuus muuttuu. Mitä korkeampi paine, sitä enemmän lämpöä syntyy reaktion aikana (käyrä 4). Käyrän 2 määrittämissä olosuhteissa itsesyttymistä ei voi tapahtua, koska lämpöhäviö (viiva 1) on suurempi kuin lämmön vapautuminen tässä paineessa. Käyrän 3 kosketuspiste suoralla viivalla vastaa vapautuneen ja poistetun lämmön välistä tasapainoa - tietyn palavan järjestelmän itsesyttymislämpötilan minimilämpötilassa tietyissä olosuhteissa. Merkittömällä ulkopuolelta tulevalla energiansyötöllä spontaani syttyminen on mahdollista. Käyrä 4 kuvaa olosuhteita, joissa itsesyttyminen on väistämätöntä, koska lämpöä vapautuu enemmän kuin poistuu.
Analysoimalla yllä olevaa kaaviota N.N. Semjonov totesi riippuvuuden:
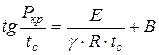 , (1.17)
, (1.17)
missä on pienin sytytyspaine, Pa;
Minimi itsesyttymislämpötila, K;
Reaktiojärjestys;
Vakio, riippuen seoksen koostumuksesta ja muista ominaisuuksista.
Tämän yhtälön (1.17) perusteella on teoriassa mahdollista määrittää etukäteen, onko palavan seoksen itsestään syttyminen mahdollista tietyissä olosuhteissa. Minimipaineen ja itsesyttymislämpötilan välinen suhde on vahvistettu lukuisilla kokeilla ja osoittautunut arvokkaaksi palamisprosessien tutkimuksessa.
Ketjun palamisen teoria
Vuonna 1928 NN Semenov esitti ajatuksen kahden tyyppisten räjähdysten - ketju- ja lämpöräjähdysten - olemassaolosta kemiallisissa järjestelmissä.
Ketjureaktiot ovat reaktioita, jotka käyvät läpi useita vaiheita (sarjan välireaktioita), joissa muodostuu välituoteyhdisteitä, joilla on vapaita valensseja, niin sanottuja aktiivisia keskuksia, jotka ovat prosessin myöhempien nopeiden vaiheiden ytimiä.
Ensimmäisen kerran ajatus ketjureaktiosta syntyi vuonna 1913, kun saksalainen fyysikko ja kemisti M. Bodenstein totesi, että kun vedyn ja kloorin seosta valaistaan, kloorimolekyyli, joka absorboi kvantin valoenergiaa, hajoaa. atomeiksi:
![]() .
.
Klooriatomit reagoivat välittömästi vedyn kanssa, mikä johtaa seoksen räjähtämiseen. Yhden kloorimolekyylin aktivoituminen aiheuttaisi kahden molekyylin muodostumisen:
![]() .
.
Kokeet osoittavat kuitenkin, että tämä tuottaa 100 000 molekyyliä vetykloridia. Tämä voidaan selittää, jos oletetaan, että kloorin vuorovaikutuksessa vedyn kanssa muodostuu tuote, joka sekundaarisiin reaktioihin joutuessaan syntyy uudelleen ja voi jatkaa reaktiota. Tämä oletus vastaa seuraavaa reaktiokaaviota:
I Ensisijainen reaktio
IV Avoin piiri
Tämän kaavion mukaan yhden kloorimolekyylin (I) aktivoituminen aiheuttaa kahden klooriatomin - kahden aktiivisen ketjureaktion keskuksen - ilmestymisen. Jokainen klooriatomi saa aikaan oman ketjureaktion, jossa aktiivinen keskus pelkistyy jatkuvasti (II, III). Siten aloitusreaktion (I) vaikutuksesta tapahtuu seuraavia reaktioita, jotka muodostavat ketjun (II, III jne.). Tällaisten reaktioiden lukumäärää ketjun alkamishetkestä sen päättymiseen kutsutaan ketjun pituudeksi. Ketju voi katketa, kun klooriatomit (IV) tai vetyatomit (V) törmäävät ja muodostavat niistä molekyylejä tai kun aktiiviset keskukset törmäävät kiinteän aineen pintaan. Tämä on tyypillinen haarautumaton ketjureaktio. Siinä jokainen aktiivinen keskus aiheuttaa vain yhden uuden aktiivisen keskuksen ilmestymisen, joten reaktio voi jatkua, mutta ei kiihtyä.
Haaroittumisketjureaktiossa jokainen aktiivinen keskus synnyttää kaksi tai useampia uusia aktiivisia keskuksia.
Ketjureaktioteorian mukaan hapettumisprosessi alkaa palavan aineen aktivoitumisesta.
Käytäntö on osoittanut, että syttyminen voi tapahtua isotermisissä olosuhteissa, ts. nostamatta reaktioväliaineen lämpötilaa (seoksen "kylmä" sytytys). Tässä tapauksessa puhutaan ketju (isometrisesta) räjähdyksestä.
Kaksi alkukomponenttia: polttoaine ja hapetin, jotka ovat suhteellisen vakaassa molekyylitilassa, käyvät läpi koko ketjun monimutkaisia välimuunnoksia, joiden seurauksena muodostuu epästabiileja tuotteita, ennen kuin ne yhdistyvät uusiksi, stabiilimmiksi palamistuotteiden molekyyleiksi: atomit, radikaalit, viritetyt molekyylit, joilla on suhteellisen suuri ionisaatioaste (formaldehydi-, hiilivety- ja hydroksyyliradikaalit, atomihappi ja vety).
Kondratjev V.N. eri hiilivetyjen liekissä oli mahdollista havaita korkeita pitoisuuksia atomihappia (O), hydroksiradikaaleja (OH), hiilivetyradikaaleja (CH 3), hiilimonoksidia (CO), formaldehydiä (CH 2 O) jne. Pitoisuudet näistä liekissä olevista aineista oli tuhansia ja miljoonia kertoja suurempia kuin niiden tasapainopitoisuudet termisen hajoamisen aikana loppureaktiotuotteiden, esimerkiksi H 2 O → H + OH, liekin lämpötilassa.
Näiden havaintojen tulosten perusteella oli mahdollista päätellä, että tarkasteltavat atomit ja radikaalit eivät esiinny reagoivaan kaasuun tuotteiden lopullisen hajoamisen seurauksena, vaan ovat reaktiovälituotteita.
Siten sytytysketjumekanismi perustuu joidenkin aineiden koko ketjuun kemiallisia muunnoksia toisiksi, joiden seurauksena erillisiin välivaiheisiin muodostuu kemiallisesti erittäin aktiivisia epästabiileja tuotteita, joita kutsutaan aktiivisiksi keskuksiksi ja jotka reagoivat helposti keskenään. ja lähtöaineiden molekyylien kanssa muodostamaan uusia aktiivisia keskuksia ja lopputuotteita esimerkiksi H 2 O:n ja CO 2:n metaani-ilmaseokselle.
Korkea reaktiivisuus radikaalit ja atomit selittyvät niiden reaktioiden alhaisella aktivaatioenergialla, joka on lähellä atomireaktioiden aktivaatioenergiaa:
OH + H2 = H20 + H - 25 kJ/mol
CH3 + C3H6 - 12,5 kJ/mol
CH3 + C6H6 - 23,5 kJ/mol
H20 → H + OH
Mikä tahansa saaduista aktiivisista hiukkasista (H tai OH), joka on erittäin epästabiili ja siksi kemiallisesti aktiivinen, törmää alkuperäisen aineen molekyyliin, halkeaa muodostaen uusia aktiivisia hiukkasia:
H + O 2 = OH + O
OH + H2 = H2O + H
Reaktion tuloksena saadut aktiiviset hiukkaset H ja OH tulevat jälleen reaktioihin ja O-hiukkaset ovat vuorovaikutuksessa vedyn kanssa:
O + H2 = OH + H.
Toisin sanoen aktiivisten hiukkasten ja lähtöaineiden molekyylien välisen reaktion seurauksena ei muodostu ainoastaan lopputuotteita, vaan myös uusia aktiivisia hiukkasia. Reaktion tuloksena muodostuneet aktiiviset hiukkaset aiheuttavat uusia kemiallisen transformaation vaiheita, joita tapahtuu, kunnes alkuperäiset aineet ovat täysin kuluneet.
Tällaisia toistuvia kemiallisia reaktioita kutsutaan ketjureaktioksi, ja aktiivisia hiukkasia, jotka synnyttävät uusia muutosketjuja, kutsutaan aktiivisiksi keskuksiksi.
Edellä kuvattu vedyn palamisen ketjuprosessi voidaan esittää kaaviona (kuva 1.6).
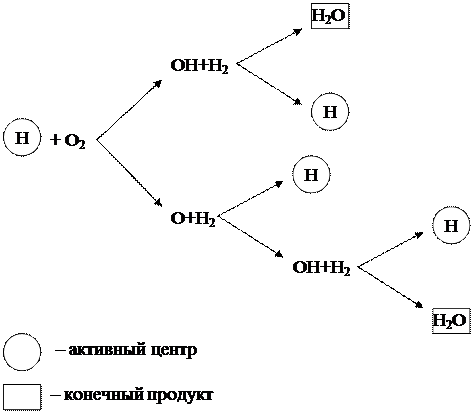
Kuva 1.6 - Kaavio vedyn ketjupoltosta
Kaaviosta voidaan nähdä, että vain vety (H) hiukkaset, jotka ovat aktiivisia keskuksia, synnyttävät uusia transformaatioketjuja. Tässä tapauksessa jokaisessa ketjuprosessin lenkkeessä muodostuu aktiivisen keskuksen H ja happimolekyylin O 2 välisen reaktion seurauksena lopputuotteen H 2 O lisäksi 3 uutta aktiivista keskusta H, jotka synnyttävät. uusiin muutosketjuihin.
Tällaista ketjureaktiota, joka tapahtuu aktiivisten keskusten lisääntyessä, kutsutaan haarautuneeksi. Reaktio kehittyy lumivyörynä ja etenee erittäin suurilla nopeuksilla, ylittäen huomattavasti tavallisten molekyylireaktioiden nopeuden.
Tyypillinen haarautumaton reaktio on kloorin reaktio vedyn kanssa. Tämän reaktion aktiiviset keskukset ovat vuorottelevia kloori- ja vetyatomeja. Kun klooriatomi reagoi, muodostuu yksi vetyatomi, aivan kuten vetyatomin reagoiessa muodostuu yksi klooriatomi. Siksi reaktio voi jatkua, mutta ei kiihtyä.
Tunnettu tosiasia, että kloorin fotokemiallinen reaktio vedyn kanssa päättyy edelleen räjähdykseen (itsesyttymiseen), selittyy sillä, että riittävän suurella ketjureaktion nopeudella lämmön vapautuminen ylittää lämmönpoiston, minkä seurauksena jonka seos kuumenee voimakkaasti ja termiselle itsesyttymiselle tarvittavat olosuhteet syntyvät.
Kun tapahtuu hiilivedyille tyypillinen haarautunut ketjureaktio, aktiivisten keskusten pitoisuus voi nousta riippumatta alkukäynnistyksen olosuhteista ja jos aktiivisten keskusten muodostumisnopeus haarautuessa ylittää ketjun päätymisnopeuden, voi muodostua itsekeskittymä. syntyy kiihtyvä lumivyörymäinen prosessi, joka johtaa syttymiseen.
Ketjureaktioiden teoria mahdollisti monia palamisprosessien piirteitä (epäpuhtauksien voimakas vaikutus, itsesyttymispaineen rajat, katalyysi ja paineenesto jne.), joita ei voida selittää lämpöteorialla. Todellisten tulipalojen ja räjähdysten esiintymis- ja kehittymismekanismille on ominaista yhdistetty ketju-terminen prosessi. Ketjuisesti alkanut hapetusreaktio kiihtyy edelleen sen eksotermisen vuoksi lämmön vaikutuksesta. Siksi viime kädessä kriittiset (rajoittavat) olosuhteet palamisen alkamiselle ja kehittymiselle määräytyvät lämmön vapautumisen ja reagoivan järjestelmän ja ympäristön välisen lämmönvaihdon olosuhteiden mukaan.
Ketjussa kemialliset reaktiot monet teknisiä prosesseja v kemianteollisuus... Näitä prosesseja ovat esimerkiksi polymerointiprosessit, jotka muodostavat perustan synteettisten kumien, muovien, polymeerikuitujen ja monien muiden tuotteiden valmistukseen. Niihin kuuluu myös sellaisia tärkeitä teolliset prosessit Synteettisten rasvahappojen tuotantona, jotka korvaavat aiemmin käytetyt ruokarasvat pesu- ja voiteluaineiden valmistuksessa, krakkaus on prosessi, jossa öljystä saadaan korkealaatuista polttoainetta jne.






