Työvoiman suojelu ilmailussa. Itse polttamisen teorian elementtejä. Itsensä lämmityslämpötila. Itsensä polttamisen ero itsestään sytytys- ja sytytys - palonsammutuskoostumukset
Lämpöteorian mukaan itse sytytyslämpötilassa he ymmärtävät aineen alimman lämpötilan (materiaali, seos), jolloin eksotermisen reaktioiden nopeus on voimakas kasvu, joka päättyy liekin polttamisen ulkonäköön. Kuviossa 1 2.3 Tällainen lämpötila on lämpötila T S.Vastaaja SISÄÄNjossa jäähdytyslevy q. 2 Lämmöntuotantolinjan osalta.
Lämpötilan mittaus T S. Se on melkein hyvin vaikeaa johtuen suuremmista muutoksista seoksen lämpötilassa, kun se on itsevaihetta. Siksi itse sytytyslämpötilaan, aluksen seinän pienin lämpötila otetaan tai ympäröiväjossa näissä olosuhteissa aine on itses sytytetty aine, ts. T 0.. Tämä ei aiheuta liian suuria virheitä.
Aika, kun muodostetaan lämpötila palamisessa T 0. kunnes lämpötila on saavutettu T S. olla nimeltään induktiokausi tai itse sytytysviive. Induktionaika samaan aineeseen Neodynaksin aineelle ja riippuu voimakkaasti palavan seoksen, lämpötilan ja paineen koostumuksesta. Alempi palavan aineen lämmityslämpötila itsestään sytytyksen aikana, sitä suurempi induktiokausi. Mennessä
tämä johtuu usein itsesyötön lämpötilasta, ympäristön lämpötilaan tai astian seinämiin otetaan, jossa induktioaika on suurin.
Seuraavassa esitetään muutos metaaniseosten induktionaikana ilman, riippuen niiden koostumuksesta ja lämpötilasta:
|
Induktiokausi |
|||
|
775 0 s .............................................. ....... |
|||
|
825 0 s .............................................. ..... |
|||
|
875 0 s .............................................. ..... |
|||
Itse sytytyslämpötilan määrittämisessä on mahdotonta mitata induktio-ajanjaksoa, joten induktiokauden aikana vie aikaa aineen lämmittämishetkestä, kunnes liekki tulee näkyviin. Induktiokausi on käytännöllistä toimia pienten tulehduslähteiden polttoaineessa (kipinät). Kun kipinöinti höyryjen tai kaasujen palavassa seoksessa ilmalla, jotkin seoksen tilavuus lämmitetään ja samalla kipinä jäähdytetään. Seoksen sytytys tässä tapauksessa riippuu seoksen indusointijakson ja kipinän jäähdytysajan suhteen. Jos induktioaika on suurempi kuin kipinän jäähdytysaika lämpötilaan, joka on pienempi kuin itsen sytytyslämpötila, seoksen sytytys ei tapahdu. Jos induktioaika on pienempi kuin jäähdytysaika kipinä, seos on syttyvää. Näin ollen pienen voiman kipinä voi sivuuttaa seoksen pienellä induktiolla ja se ei saa sytyttää seosta suurella induktiojaksolla.
Induktiokausi kiinteät aineet Se eroaa kaasun ja pölyiseosten jaksosta. Jos induktioaika kaasuseos Se on kymmeniä ja satoja sekuntia, kiinteän palavien aineiden induktio-aika voi olla kellot, päivät ja kuukaudet. Itse sytytysaineen lämpötilassa polttaminen ei vielä tapahdu. Se tapahtuu ja kehittyy palamislämpötilassa (liekki), mikä ylittää merkittävästi itsesääntymisen lämpötilan. Esimerkiksi bensiinin 260 0 C: n itsen sytytyslämpötila ja sen liekinlämpötila on 1200 - 1300 0 C. Hyppy lämpötilassa nousee 260 - 1200 ° C: sta, on tulosta bensiinin seoksen itsestään kuumentamisesta höyry ilmalla.
Palattavan aineen itsensä sytytyksen lämpötila ei ole vakioarvo. Itse sytytyksen lämpöteorian mukaan tämä lämpötila riippuu lämmöntuotannosta ja lämpöalustan nopeudesta, joka puolestaan \u200b\u200briippuu palavan aineen, sen pitoisuuden, paineen ja muiden tekijöiden tilavuudesta.
Kokeissa itse sytytyslämpötilan määrittämiseksi todettiin, että se muuttuu paitsi palavan aineen tilavuuden muutoksesta vaan myös aluksen (säiliön) muodossa, jossa aine sijaitsee. Tämä selittää, että aluksen muodon tai koon muutoksella, spesifinen jäähdytyslevy pinta vaihtelee S./ V.. Samassa astioissa se on pienempi kuin aluksen tilavuus. Siksi aluksen tilavuuden kasvu, jäähdytyselementin nopeus pienenee ja tämän mukaisesti itse sytytyslämpötila olisi vähennettävä. Seuraavat lämpötilat eri nesteiden höyryjen itsestyttämisestä eri volyymit vahvistavat tämän oletuksen:
|
Aluksen tilavuus, .................. .. |
||||||||
|
Itsesuojauslämpötila |
||||||||
|
asetoni ........................... |
||||||||
|
bentseeni ........................... |
||||||||
|
bensiini ............................. |
||||||||
|
dietyylieetteri ............ .. |
||||||||
|
kerosene ........................ |
||||||||
|
metyylialkoholi ............ .. |
||||||||
|
seroublerod .................. .. |
||||||||
|
toloole ........................... |
||||||||
itse sytytyslämpötila äänenvoimakkuudella pienenee, kunnes tilavuus saavuttaa tietyn arvon (aluksen muoto ei muutu); Volyymin lisääntymisen lisäksi itsesyötön lämpötila pysyy vakiona.
Niinpä kokeilu osoittaa, että yli 12 litran tilavuudella palavan seoksen itsesääntymisen lämpötila vaihtelee hieman. Tämä selitetään sillä, että suurissa määrissä palava seos on itseehdotus, joka ei ole samanaikaisesti äänenvoimakkuutta, mutta osittain siitä, missä sitä eniten optimaaliset olosuhteet. Siksi pieni polttoaine, jäähdytyselementin muutos ulompien pintojen läpi vaikuttaa itsesääntymisen lämpötilan muutokseen ja suuressa tilavuudessa - ei.
Palattavan aineen sytytyksen lämpötilan lisääminen tilavuuden vähenemisen vuoksi ei myöskään ole ääretön. Hyvin pienellä tilavuudella jäähdytyselementin spesifinen pinta-ala muuttuu niin suuri, että lämmön vapautumisnopeus johtui palavan seoksen hapettamisesta, jopa erittäin korkeilla lämpötiloissa, ei voi ylittää lämpöalustan nopeutta ja Itse sytytys ei tapahdu. Tässä periaatteessa monet laitteet, joiden tarkoituksena on estää kaasuseosten palamisen (tuliprocers), suunnitellaan ja toimivat.
Yksinkertaisin Fireprosessori on suojusruudu, joka on sijoitettu palavaan kaasuseokseen, joka rikkoo verkon pieniksi tilavuuksille. Tällöin itse sytytys ei voi tapahtua. Suojaverkkoa käytetään kaivoslamppuissa sekä pienissä halkaisijoiden putkistoissa, joiden mukaan ilmaa öljytuotteiden pareittain. Suojaverkkoa ei voida käyttää ilman seoksiin vety, asetyleeni, höyrytyshöyryt, alkoholit, eetterit ja muut aineet, joilla on joko itsesääntymisen alhainen lämpötila tai palamislämpö. Tällaisissa olosuhteissa polttava seos kulkua polttoverkon läpi ei jäähdytetä itsesääntymisen lämpötilan alapuolelle ja jatkaa ruudukon takana.
Jäähdytyslevyn suurempi spesifinen pinta-ala voidaan saada paitsi aluksen tilavuuden vähenemisen vuoksi myös antamalla sille vastaava muoto. Kuviossa 1 2.4 Kuvatut alukset eri muodoistajoka mahtuu sama määrä palavaa seosta.
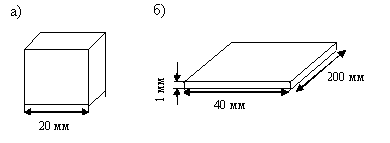
Kuva. 2.4. Saman säiliön alukset eri nopeuksilla jäähdytyslevyllä
Ensimmäisessä astiassa (kuutio) (kuva 2.4, mutta) Kun lämmitetään seoksen itsensä sytytys, toisessa, joka edustaa ohutta aukkoa (kuvio 2.4, b.), seos ei ole itseehdotus. Tämä selittää se, että toisella aluksella on useita kertoja lämpöalustan suuri pinta kuin ensimmäinen.
\u003e Itsensä polttamisen teorian elementit. Itsensä lämmityslämpötila. Ero itsestään sytytyksen ja sytytyksen välillä
Oikea organisaatio palontorjuntatapahtumat Ja sammutuspaloja ei ole ymmärtämättä polttamisen aikana tapahtuvan kemiallisten ja fysikaalisten prosessien olemusta. Näiden prosessien tunteminen mahdollistaa tulipalon onnistumisen onnistuneesti.
Polttaminen- Tämä on kemiallinen hapetusreaktio, johon liittyy suuri määrä lämpöä ja tavallisesti hehkulla. Polttoprosessin hapettimen voi olla happea sekä klooria, bromia ja muita aineita.
Useimmissa tapauksissa tulipalon sattuessa palavien aineiden hapettaminen ilmenee happea ilmalla. Palaminen on mahdollista, jos ainetta kykenee polttamaan, happea (ilma) ja sytytyslähde. On välttämätöntä, että fury-aine ja happi ovat tietyissä määrällisissä suhteissa, ja sytytyksen lähde oli välttämätöntä lämpöenergian tarjonta.
Tiedetään, että ilmassa sisältää noin 21% happea. Useimpien aineiden polttaminen on mahdotonta, kun ilman happipitoisuus laskee 14-18 prosenttiin ja vain joitain palavia aineita (vety, etyleeni, asetyleeni jne.) Voidaan palaa, kun happipitoisuus on ilmassa 10%: iin ja Vähemmän. Happipitoisuuden väheneminen, useimpien aineiden polttaminen pysähtyy.
Polttoaine ja happi reagoimaan aineita ja tekevät polttoainejärjestelmää ja sytytyslähde aiheuttaa polttoreaktion. Sytytyslähde voi olla valssatun rungon polttava PP sekä sähkövaraus, jolla on energiavaraus, joka on riittävä polttamiseen ja muuhun itsetuntoiseen sytytyspalon sammuttamiseen
Palavat järjestelmät jaetaan homogeeniseen ja epähomogeeniseen. Yhdenmukaiset ovat järjestelmät, joissa polttoaine ja ilma sekoitetaan tasaisesti toistensa kanssa (palavien kaasujen seokset, höyryt ilmalla). Tällaisten järjestelmien polttamista kutsutaan polttava kineettinen. Nopeus määräytyy nopeudella kemiallinen reaktio, merkittävä korkeat lämpötilat. Tietyissä olosuhteissa tällainen palaminen voi olla räjähdyksen tai räjähdyksen luonne. Inhomogeeniset järjestelmät, joissa polttoainetta ja ilmaa ei sekoiteta toisiinsa ja niillä on osan pinta (kiinteät palavat materiaalit ja lausumattomia nesteitä). Inhomogeenisten palavien järjestelmien polttoprosessissa ilman happi tunkeutuu polttotuotteiden kautta polttoaineeseen ja syöttää reaktion sen kanssa. Tällaista polttamista kutsutaan diffuusiopoltto,koska sen nopeus määritetään pääasiassa suhteellisen hitaasti virtaavan prosessin diffuusion.
Tulipaloon sytytyslähteen lämmön pitäisi olla riittävä palavien aineiden muuttamiseksi pareiksi ja kaasuiksi ja lämmittää ne itsesääntymisen lämpötilaan. Polttoaineen ja hapettimen suhde, köyhien ja rikkaiden palavien seosten polttoprosessit erotetaan. Huono Mixit sisältävät hapettavaa ainetta ylimäärin ja niillä on polttoainekomponentin puute. Rikkaat sekoitukset päinvastoin, on syttyvä komponentti ylimäärin ja hapettavan aineen haittana.
Palamisen esiintyminen liittyy pakolliseen itseluottamukseen järjestelmässä järjestelmässä. Itsesäätävän reaktion prosessi sen siirtymisen kanssa polttamiseen kutsutaan itsestään sytytykseksi. Kemiallisen reaktion itsepainottaminen palamisessa on jaettu kolmeen päätyyppiin: lämpö, \u200b\u200bketju ja yhdistetty ketjuinen lämpö. Lämpöteorialla itsesyötön prosessi selitetään hapetusprosessin aktivoimalla kemiallisen reaktion nopeuden lisäämiseksi. Ketjutteorian mukaan itsestytysprosessi johtuu kemiallisen reaktion ketjujen haarautumisesta. Käytännöllisesti katsoen polttoprosesseja toteutetaan pääasiassa yhdistetyllä ketjun lämpömekanismilla.
Poltto erottaa täydellisen ja epätäydellisen. Täysi palamista muodostuu tuotteita, jotka eivät pysty polttamaan enemmän: Hiilidioksidi, rikkikaasu, vesiparit. Epätäydellinen polttaminen ilmenee, kun hapen käyttö on vaikeaa polttovyöhykkeelle, mikä on muodostettu epätäydellinen palamistuotteet: hiilimonoksidi, alkoholit, aldehydit jne. Muodostetaan.
Noin ilman (M3) määrää, joka on välttämätöntä 1 kg: n aineen (tai 1 m3 kaasun) polttamiseksi,
Joidenkin aineiden lämmönpolto: bensiini-47 000 kJ / kg; Ilmakuivaus -14 600 kJ / kg; Asetyleeni - 54400 kJ / m3; Metaani - 39400 kJ / m3; Hiilioksidi - 12600 kJ / m3.
Palattavan aineen palamisen lämmöstä on mahdollista määrittää, kuinka paljon lämpöä vapautuu polttamisen aikana, palamislämpötila, paine räjähdyksessä suljetussa tilavuudessa ja muissa dataa.
Aineen palamislämpötila määritellään sekä teoreettisella että päteväksi. Teoreettinen on palamislämpötila, johon polttotuotteita kuumennetaan, olettaen, että kaikki polttamisen aikana erotetaan kaikki lämpö, \u200b\u200bjoka on lämmitetty.
Todellinen palamislämpötila on 30-50% alempi teoreettinen, koska merkittävä osa polttamisen aikana vapautettua lämpöä hajotetaan ympäristöön.
Korkea palamislämpötila edistää tulipalon leviämistä suuri määrä Lämpöä päästetään ympäristöön, ja palamattomien aineiden valmistaminen polttaa. Palonsammutus suurella palamislämpötilassa haittaavat.
Polttoprosesseja harkittaessa seuraavia tyyppejä on erotettava: salama, tulipalo, sytytys, itsestään sytytys, itsensä polttaminen, räjähdys.
Salama- Tämä on nopea palaminen palavan seoksen, ei liitetty puristuskaasujen muodostumiseen.
Sytytys- palamisen esiintyminen sytytyslähteen vaikutuksesta.
Sytytys- Sytytys, liekin ulkonäkö.
Tietämättömyys- kyky syttyä (sytyttää) sytytyslähteen vaikutuksesta.
Spontaani palaminen- Tämä on ilmiö, joka on voimakas kasvu eksotermisen reaktioiden nopeudesta, mikä johtaa aineiden palamisen (materiaalin, seos) esiintymiseen sytytyslähteen puuttuessa.
Itsesäsyttimistä- Tämä on itsenäinen, mukana liekin ulkonäkö.
Räjähdyssitä kutsutaan erittäin nopeaksi kemikaaliksi (räjähtävä) muuntaminen aineen, johon liittyy energian vapautuminen ja pakattujen kaasujen muodostuminen, joka kykenee tuottamaan mekaanista työtä.
On välttämätöntä ymmärtää erotus sytytysprosesseja (sytytys) ja itsensä polttamalla (itsestään sytytys). Jotta voittua itseään, on välttämätöntä tehdä lämpöpulssi palavaan järjestelmään, jonka lämpötila on suurempi kuin aineen itse sytytyslämpötila. Polttoman esiintyminen lämpötiloissa itsestytyslämpötilan alapuolella viittaa itsestään polttavan prosessiin (itse sytytys).
Palaminen tapahtuu ilman sytytyslähdettä - termisen tai mikrobiologisen itsensä polttamisen vuoksi.
Lämpöäaineita esiintyy itsenäisen lämmityksen seurauksena piilotetun tai ulkoisen lämmityslähteen vaikutuksesta. Itse sytytys on mahdollista vain, jos itsetutkimuksen aikana syntyvä lämpö ylittää lämpöä ympäristöön.
Mikrobiologinen itsensä polttaminen Se tapahtuu itsestään lämmityksen seurauksena mikro-organismien toimeen vaikutuksen aineen massassa (materiaali, seos). Sytytyssytytyslämpötila on palavan aineen tärkeä ominaisuus.
Itselähtölämpötila - Tämä on eniten matala lämpötila Aineet, joilla eksotermisien reaktioiden nopeus on voimakas kasvu, joka päättyy tulisen polttamisen syntymiseen.
Taulukossa on esitetty joitain nesteitä, kaasuja ja kiintoaineita, jotka ovat käyttäneet koneenrakennusteollisuudessa käytettäviä nesteitä, kaasuja ja kiintoaineita. yksi.
pöytä 1 Joidenkin nesteiden itsensä sytytyslämpötilat
Itse sytytyslämpötilan lisäksi palavilla aineilla on tunnusomaista itsesääntymisen induktio- tai hidastumisaika. Induktiojaikaa kutsutaan ajanjaksoksi, jonka aikana itsestään lämmitys sytytykseen. INDUCTUCTION samalle palavalla aineelle ja riippuu seoksen koostumuksesta, alkuperäiset lämpötilat ja paine.
Induktiokausi on käytännöllistä toimia pienten tulehduslähteiden polttoaineessa (kipinät). Kipinä, päästä höyryjen tai kaasujen polttoaineseokseen ilman, kuumenee jonkin verran seoksen tilavuutta ja samalla kipinä jäähdytetään. Seoksen sytytys riippuu seoksen induktiokauden ja kipinän jäähdytysajan suhteen. Samanaikaisesti, jos induktioaika on suurempi kuin kipinän jäähdytysaika, seoksen sytytys ei tapahdu.
Induktiokausi perustuu kaasuseosten luokitteluun sytytysasteensa mukaan. Pölyseosten induktio-aika riippuu pölyn koosta, haihtuvien aineiden, kosteuden ja muiden tekijöiden määrästä.
Jotkin aineet voivat olla itsekäytyksiä, jotka ovat normaalissa lämpötilassa. Tämä on pääasiassa kiinteitä huokoisia aineita enimmäkseen orgaaninen alkuperä (sahanpuru, turve, fossiilinen hiili jne.). Altis itsen polttamiseen ja öljyihin, jotka on jaettu ohuella kerroksella suurella pinnalla. Tämä aiheuttaa mahdollisuuden itse poltettavaksi pesty vetolle. Pestyjen kuitumateriaalien itsensä polttamisen syy on rasvaisten aineiden jakautuminen ohuella kerroksella niiden pinnalla ja hapen imeytyminen ilmasta. Öljy hapen hapetus liittyy lämmöntumiseen. Siinä tapauksessa, jossa muodostettu lämpö ylittää ympäristön lämpöhäviöt, tulipalon syntyminen voi ilmetä.
Self-polttamiseen alttiina aineiden tulipalo on erittäin korkea, koska ne voivat sytyttää ilman lämpöä lämpötilassa aineiden itsesäsytisilämpötilan alapuolella ja itsen puhuttujen aineiden indusointi voi olla useita tunteja, päivää ja jopa kuukausia. Hapettumisen nopeuttamisprosessi (aineen kuuleminen) voidaan pysäyttää vain, kun havaitaan vaarallinen lämpötilan nousu, mikä osoittaa hyvin tärkeä palo ja ehkäisevät toimenpiteet.
Monia aineita, jotka kykenevät itsensä polttamiseen, käytetään koneenrakennusyrityksissä. Itsekirjelmä, kun vuorovaikutuksessa ilmaa voi rautaa, noki, alumiini ja sinkkijauhe, jne. Itsensä vuorovaikutuksessa vuorovaikutuksessa veden kanssa alkalimetallit, metallien karbidit jne. Kalsiumkarbidi (CAC2), reagoi veden kanssa, muodostaa asetyleeniä (C2N2).
Polttoaikaa kutsutaan eksotermiseksi reaktioksi, joka esiintyy progressiivisessa itsekonfiguraatiossaan. Palamista voi tapahtua sekä yhdisteen kemiallisen reaktion ja aineiden hajoamisen lisäksi ilman ilman happea, vaan myös aineita, jotka sisältävät sen itse (esimerkiksi kalkki). Monien aineiden polttaminen voi esiintyä klooriaineessa, bromi-höyryssä, rikkiä.
Polttaminen on jaettu useisiin tyyppeihin: taudinpurkaukset, sytyttimet, tulehdus, itsensä polttaminen, itsensä polttaminen.
Salaman lämpötila on väkevöidyn aineen pienin lämpötila, jossa muodostuu höyryä, joka kykenee vilkkumaan ilmassa virtalähteestä; Kestävää polttamista ei tapahdu.
Tulehdus on palavan aineen nopea polttaminen, jota ei liity puristetun kaasun muodostamiseen.
Syttyvyyslämpötilan nesteen alapuolella ei edustaa palovaara Jos liekki, kipinöitä tai hienonnettu runko lyhyen aikavälin vaikutusta. Jos nestettä kuumennetaan sytytyslämpötilaan ja edellä, jopa lyhyen aikavälin toiminta liekkillä tai kipinöillä aiheuttaa väistämättä sytytyksensä ja tietyissä olosuhteissa voi olla tulipalo. Tämän huomioon ottaen puhkeamisen lämpötila otetaan perustana nesteiden luokitteluun paloturvallisuus. Nesteet, jotka kykenevät polttamaan, jaetaan syttyviin (LVZ) ja palavaan (GJ) *.
Syttyvät aineet, jotka ovat useimmiten ilmailussa, ovat tällaisia \u200b\u200bpuhkeamislämpötilat (asteina Celsius):
* Helposti syttyvät nesteet sisältävät palavien nesteiden kanssa puhkeamisen lämpötila ei ylitä 61 ° C, kun määritetään suljetussa upokkaassa, tai 66 ° C - määritettäessä avoimessa upokkaassa. Fluidi leimahduspisteellä on suurempi kuin syttyvän määritetty.
Riippuen Flare-lämpötilasta, sinun on valittava turvalliset menetelmät Liikenteen kuljetus, varastointi ja käyttö eri tarkoituksiin. Kiusauslämpötilassa ei tapahdu vakaa polttaminen ja palovammoja muodostuu vain nesteen yläpuolelle höyryjen seoksella ilmalla. Jos nesteen lämpötila on jonkin verran suurempi kuin salaman lämpötila, sen haihduttamisen nopeus avoin pinta Lisääntynyt ja seoksen puhkeamisen aikana neste kykenee erottamaan jatkuvasti pariksi riittävästi kestävään polttoon. Tällaista lämpötilaa kutsutaan sytytyslämpötilaan. Tämä on aineen pienin lämpötila, jolla erityistiikojen olosuhteissa aine kohottaa polttoaineparia ja kaasuja niin nopeudella, joka altistuu energialähteelle, ne ovat sytytys.
Tulehdus on tulipalo, johon liittyy liekin ulkonäkö.
Syttyvissä nesteissä salaman lämpötilan yläpuolella oleva syttymislämpötila on 1-5 ° C, lisäksi nesteen puhkeamisen lämpötila, sitä vähemmän tämä ero. Joten bentseenissä asetonissa, jolla on salaman lämpötila nollan alapuolella, tämä ero on 1 ° C, palavalla nesteillä - tämä ero on 30 ° C ja sitä korkeampi.
Spontaani palaminen - Tämä on voimakas lisäys eksotermisten volumetristen reaktioiden nopeudesta, mikä johtaa lämpötilan voimakkaaseen kasvuun ja aineiden palamisen esiintymiseen sytytyslähteen puuttuessa.
S.N. S.N. S.N. Semenov ja kehittää edelleen D. A. Frank-Kamenetsky ja A. N. Todes.
Tämän teorian tärkeimmät määräykset voidaan harkita palavien höyryjen tai kaasun seoksen itse sytytyksestä ilmalla. Alhaisessa lämpötilassa T0 (esimerkiksi plus 20 ° C), reaktio kerosiinin ja ilman hapen välillä seoksessa käytännössä ei tapahdu, koska ei ole aktiivisia happimolekyylejä. Jotta ne näkyvät ja hapetusreaktio alkoi, seos on lämmitettävä korkeammalle lämpötilaan T1. Tätä tarkoitusta varten asetetaan väliaineen seoksella olevat astiat, lämpötila T1 (kuvio 15.1, A). Jonkin ajan kuluttua astiat ja seos ovat lämpimät lämpötilaan T1 ja hapettumisprosessi tapahtuu seoksessa, jossa on lämmön vapautuminen. Valittu lämpö Q1 lähetetään palavaan seokseen, lämpö lämpötilaan T1. Kuitenkin heti kun seoksen lämpötila ylittää astioiden ja ulkoisen ympäristön seinien lämpötilan, lämpöviseriseos alkaa astioiden seinistä ja edelleen ulkoinen ympäristö. Seoslämmön määrä merkitsee Q2: lla.

Kuva. 15.1. Järjestelmä, joka selittää palavan seoksen itsensä polttamisen prosessia:
a-lämmitys seos sille toimitetun lämpöenergian ansiosta; B - Lämmön tasapaino; B - Seoksen itsensä lämmitys ja sen vetäminen lämpöön ympäristöön
Seoksen edelleen lämmitys riippuu lämmöntuotannon ja lämpöalustan nopeuden suhteesta. Jos Q1\u003e Q2 sitten seos, hapettava, kuumennetaan ja jos Q1 \u003d Q2, seos hapetetaan mihin tahansa jatkuva lämpötilajossa tämä suhde syntyi. Oletetaan, että seoksen hapettumisen aiheuttama lämmön vapautumisnopeus ylittää lämpöä uppoamisen. Tämä ei kuitenkaan vieläkään riitä siten, että seos jatkaa lämmittää ja pois, koska palavan seoksen lämpötilan nousu, lämpö- ja jäähdytyselementti ei ole yhtä suurempi. Ja jos seoksen lisäämällä lämpötilaa, jäähdytyslevyn nopeus kasvaa nopeammin kuin lämpöhäviö, sitten jonkin seoksen lämpötilassa ne ovat yhtä suuria (91 \u003d 92) ja tulevaisuudessa kuumennetaan. Tämä tapahtuu yleensä palavan aineen alhaisella hapetusnopeudella tai suurella jäähdytyslevyllä.
Esimerkiksi teräsleikkeitä ja sahanpurua hapetetaan myös, joten lämpö vapautetaan, mutta alhaisen hapetusnopeuden vuoksi tämä ei aina johda polttamiseen. Elokuvassa Öljyvärimaalaus. Maalatulla pinnalla hapetusprosessi tapahtuu, mutta johtuen lämmityslämpöalustan erittäin suuresta pinnasta, sitä ei havaita.
Joten seos, joka kuumennetaan lämpötilaan T2, johtuu reaktiosta, hapettumisesta, jäähdytetään vähitellen lämpötilaan T1 (heti kun reaktantti-aineiden pitoisuus seoksessa alkaa laskea). Tästä seuraa, että palavan seoksen hapettumisprosessi, joka kuumennetaan lämpötilaan T ei voi siirtyä palamaan alhaisen reaktionopeuden kautta.
Lisäämme seoksen hapetuksen nopeutta, lämmittämällä se lämpötilaan T3. Lämpöalustan nopeus pysyy muuttumattomana, koska aluksen pinta ei ole muuttunut. Tämä voi johtaa siihen, että palavan seoksen lämpötilassa lämmönopeus ylittää jatkuvasti jäähdytyslevyn nopeuden ja seos pystyy itse pakoputkeen korkeaan lämpötilaan. Kun seoksen lämpötila saavuttaa palamislämpötilan, liekki ilmenee ja polttaa. Näin ollen itsensä palamisen virtauksen edellytys on lämmön vapautumisnopeuden ylimääräinen seoksessa jäähdytysnestönopeuden yläpuolella.
Joten lämpöä itsensä polttamista kutsutaan polttamisen prosessiksi, joka esiintyy autojen lämmitettyjen aineiden itsensä lämmittämisen seurauksena prosessissa, jolle hapetusreaktion aiheuttama lämmön vapautumisnopeus ylittää lämpöalustuksen nopeuden. Itse sytytyslämpötilat ladataan tavallisesti astian seinien lämpötilasta, jossa näissä olosuhteissa on itsenäinen.
Lämmön itsesyötön prosessia voidaan harkita ajankohdasta riippuen (kuva 15.2).
Aseta polttoaine hapettumislämpötilan alapuolelle kuumennettuun ilmaan. Aineen lämpötila tässä tapauksessa kasvaa hitaasti (käyrä 1) ja jonkin ajan kuluttua yhtä suuri kuin ilman lämpötila T0. Koska T0 hapettumislämpötilan alapuolella polttoaine toimii ei-palamattomana. Jos ilmaa kuumennetaan T1: n lämpötilaan, joka on suurempi kuin tämän aineen hapetuslämpötila, palavaa ainetta (käyrä 2) kuumennetaan lämpötilaan, suurempi T1: ssä, mutta lämpötila alkaa laskea.

Kuva. 15.2. Aikataulun muutos palavien aineiden lämpötilassa kuumennettaessa
Olemme lämmetä lämpötilaan TS\u003e T1. Luonnollisesti hapettumisreaktion nopeus tässä tapauksessa on paljon suurempi kuin edellisessä, ja aineen lämpötila nousee TS-ilman lämpötilan yläpuolelle, saavuttaen TB-arvot, minkä jälkeen Aine polttolämpötilaan tapahtuu. Itsensä polttamisen prosessia kaasuseoksen esimerkissä ei ole vain palavia höyryjä ja kaasuja. Se koskee kiinteitä aineita.
Itse sytytyksen lämpötila ei ole vakioarvo saman palavan aineen osalta. Se riippuu lämmöntuotannosta ja lämpöalustan nopeuksista, jotka puolestaan \u200b\u200briippuvat palavan aineen tilavuudesta ja muodosta, sen koostumuksesta tilavuudessa, paineessa ja muissa tekijöissä. Joidenkin syttyvien ja palavien aineiden itsen sytytyslämpötilan (Celsius) rajat ovat seuraavat:

Lämmön (ulkoisen lämmityksen lisäksi) itse polttaminen on edelleen mikrobiologinen ja kemiallinen.
Mikrobiologinen itsensä polttaminen johtuu itsestään lämmityksen vuoksi mikro-organismien vaikutuksen alaisuudessa. Tätä ilmiötä havaitaan, kun varastoidaan vilja, heinää, turpeen, hiilen jne.
Kemiallinen itsensä polttaminen tapahtuu aineiden kemiallisen vuorovaikutuksen seurauksena ilmaalle ja vedelle (kasviöljy- ja eläinrasvot, öljyt) suuren hapetuspinnan ja alhaisen lämmönsiirron läsnä ollessa ympäristöön.
Itse sytytyksen lämpötila joissakin palavilla aineilla voi olla yli 500 ° C ja muissa alle 16 ° C. Kaikki palavat aineet, joilla on itsesyöttölämpötila, voidaan jakaa kahteen ryhmään: aineet, joissa on itsestään sytytyslämpötilat normaalisti (16-25 ° C) ja alla. Ensimmäisen ryhmän aineet kykenevät itseään vain silloin, kun niitä kuumennetaan yhteen tai useampaan lämpötilaan, toisen ryhmän aineet ovat itse koordinoineet ilman lisälämpöä, koska ympäristö on jo lämmittänyt ne sytytyslämpötilaan. Palavat aineet ovat lisääntynyt palovaara, koska syttymisen mahdollisuus ei ole suljettu tietyin edellytyksin. Esimerkiksi alumiini jauheen muodossa hapettumisen seurauksena kykenee itsensä kuumentamaan palamisen esiintymiseen. Itsensä lämmitys voi alkaa normaalilla ympäristön lämpötilassa ja jopa pienemmällä ja päättyy polttavalla. Jos ohut kangas, kyllästetty öljyllä, tee tiukka, sitten kuumuus, joka muodostuu hapettumisen aikana, ei ole aikaa haihtua ilmassa ja valot kankaalla. Kuitenkin, jos sama kudos hajotetaan eikä kääntämällä, silloin itsenäinen palaminen ei tapahdu, koska nopea hapetusprosessissa kohdennettu lämpö hajoaa ympäristössä nopeudella, joka ylittää muodostuksen nopeuden.
Siksi on erittäin tärkeää tietää toiselle ryhmälle kuuluvat aineet, sillä sen avulla voit asettaa edellytykset varastointiin ja kuljetukseen erityisvaatimuksetTämä on mahdotonta näyttää tulta.
Esimerkiksi kuten tiedätte, on kivennäis-, kasvi- ja eläinöljyjä. Kivennäisöljyt Hapettu ilmaa vain korkeissa lämpötiloissa, joten ne eivät ole itsekin. On olemassa tapauksia RAG: n itsensä polttamisesta, kostutettu kivennäislähetysöljyillä, jotka syntyivät kasviöljyjen epäpuhtauksien seurauksena. Rasvat ja öljyt, jotka sisältävät orgaanisia yhdisteitä, jotka kykenevät itsensä polttamiseen.
Jodi-numero voidaan arvioida itsestään polttavaa kykyä - jodin grammoiden lukumäärä, joka tulee 100 g: n öljyn yhteydessä. Mitä enemmän liitännät öljyssä, sitä enemmän jodi liittyy jodiin, ja siksi sillä on suurempi kyky itse polttaa.
Olife lisätään kuivaavien materiaalien levittämiseen kuitumateriaaleilla levitetyillä väleillä. Semi-luonnollinen I. keinotekoiset Purkaminen tai voi olla itsekin. Öljyt, rasvat tai olifa, jotka ovat missä tahansa suljetussa säiliössä, eivät voi olla itseliikennöitä, koska pinta koskettaa niitä ilmaan, on hyvin pieni. Öljyjen ja rasvojen kyky itse polttavaan kasvaa merkittävästi, kun hapetuspinta on merkittävästi lisää pinta lämmönsiirto. Tällaiset olosuhteet syntyvät, kun pestyjä materiaaleja kootaan kasaan, pinoihin, pakkauksiin ja vierekkäisiin. Itsekuljettavat öljyt ja rasvat riippuu pesutetyn materiaalin pakkauksen tiheydestä. Sen kyky itsestään polttaa lisääntyä tiettyyn rajalle, jonka jälkeen se alkaa laskea.
Tärkeä rooli itsestään sytytysprosessissa toistaa ympäristön lämpötilaa. Mitä suurempi ilman lämpötila, sitä pienempi määrä pestyn materiaalin tilavuus, joka kykenee itsensä polttamiseen ja öljyjä tarvitsevat vähemmän. Tulipalon todennäköisyys tässä tapauksessa kasvaa useita kertoja.
Pienin lämpötila, jossa: mitä havaitaan itsestään polttavia öljyjä ja rasvoja, on 10-15 ° C. puuvillajätteet kyllästetty kasviöljyt (Asiakaskudos päättyy), voi olla itseluottamus riippuen olosuhteista eri aikoina (useita tunteja useita päiviä).
Induktiokausi (viivästyminen itse sytytysvirta) aineet, jotka kykenevät itseään, kaasuissa ja nesteissä, hapetetaan kaasumaisessa väliaineessa, hyvin lyhyt. Lähes sama jakso kiintoaineissa, jotka ovat aerosolien tilassa.
Kiintoaineiden induktionaika kokkareiden muodossa eri kokoinen Se voi olla pitkä, koska hapetuspinta tässä tapauksessa oli. Pieni ja nopeus ilman diffuusiota hapettumisen pinnalla.
Itsensä polttamista kutsutaan itsestään polttavaksi, mukana liekin ulkonäkö. Palamista voi liittyä tulipalo ja räjähdys.
Aineiden ja materiaalien palaminen jakautuu kolmeen ryhmään: - On olemassa materiaaleja ja rakenteita, jotka eivät ole mukana tulessa, joita ei ole mukana toiminnassa tai korkeassa lämpötilassa, eikä niitä ole hiiltynyt (esimerkiksi hapettavia aineita tai aineita, jotka erittyvät palavien tuotteiden erittyvät Kun vuorovaikutuksessa veden, ilman hapen tai ystävän kanssa ystävä);
Syöminen materiaaleja ja rakenteita, jotka tulipalon tai korkeiden lämpötilojen toiminnassa kiinnittyvät, smoldering tai hiilee ja edelleen polttaa ja koagitit sytytyslähteen kanssa ja sen jälkeen, kun nämä prosessit lopetetaan.
Nämä sisältävät keinotekoiset materiaalit, paitsi ei-palamattomat mineraalit, on yli 80 painoprosenttia orgaanisia aggregaatteja; Kovapojakelpoista materiaaleista valmistetut mallit sekä poltetuista, suojelluista tulipaloista ja korkeista lämpötilasta ei-raskaiden materiaalien (asbesti- ja kattorauhasten peitossa)
Materiaalit ja rakenteet, jotka tulipalon tai korkeiden lämpötilojen alaisuudessa polttavat, alkoivat tai satamaa ja polttaa sytyttilähdön lähteen jälkeen. Näihin kuuluvat kaikki orgaaniset materiaalit, joita ei ole suojattu palo- tai korkeista lämpötilasta.
Suurin osa palavista aineista riippumatta niiden alkuperäisestä aggregaattitilasta (kiinteä, neste, kaasumaista), kun lämmitetään kaasumaisissa tuotteissa ja palavilla seoksilla ilmalla. Tulipalon valmistus määräytyy höyryn, pölyn tai kaasumaisten tuotteiden koostumuksella (pitoisuus). Palavien aineiden vähimmäis- ja maksimaaliset pitoisuudet ovat ilmassa alla ja sen yläpuolella, joiden yläpuolella on mahdotonta tulta.
Nämä pitoisuudet kutsutaan näin ollen alemmaksi ja ylhäältä keskittymisrajat Syttyvyys.
Framaatiset kaasut ja kiinteät hienonnetut aineet (pöly) voivat muodostaa palavat seokset millä tahansa lämpötilassa. Kiinteät aineet sekä nesteet muodostavat palavat seokset vain tietyissä lämpötiloissa. Jos seos valmistetaan edellä mainittujen olosuhteiden mukaisesti, voidaan katsoa, \u200b\u200bettä se on valmis tuleen, joka voi syntyä sytytyslähteen sattuessa.
Liekin leviämisen lämpötilarajat (sytytys) ovat tällaisia \u200b\u200baineen lämpötilat, joiden alla tyydyttynyt höyry Luo pitoisuus oksidatiiviseen väliaineeseen, joka on yhtä suuri kuin alempi (alempi lämpötila raja) ja ylempi (ylempi lämpötila) liekin etenemisen pitoisuusrajojen.
Liekinjakauman lämpötila-rajojen arvoa käytetään: kehitettäessä toimenpiteitä objektin tulipalon ja räjähdysturvallisuuden varmistamiseksi; Tulipalon ja räjähtävän laskemiseksi lämpötilatilat teknologisten laitteiden toiminta; Arviot hätätilanteetliittyy palamattomien nesteiden vuotamiseen; liekkijakauman pitoisuusrajojen laskeminen. Lämpötilan rajojen lämpötila on sisällytettävä standardiin tai tekniset edellytykset Palavilla aineilla. Palamisen mahdollisuus on pääasiassa flash-lämpötilat, sytytys, itsensä sytytys ja itsensä polttaminen.
Spontaani palaminenPalavien kiinteiden materiaalien itsensä lämmityksen seurauksena, joka aiheutuu eksotermich itsetunto. reaktiot. Itsensä polttaminen johtuu siitä, että lämpöhäviö reaktioiden aikana on enemmän lämpöä pesuallas ympäristöön.
Itsensä polttamisen alussa on ominaista itsensä lämmityslämpötila ( T. CH), joka on vähäinen kokemusolosuhteissa, lämpötila, jolla lämpöhäviö havaitaan.
Kun saavutat itsesäätikön prosessissa erityinen lämpötila, nimeltään itsensä polttava lämpötila ( T. Ääni), materiaali on palaminen, joka ilmenee joko tyhjennys- tai liekkipolttamalla. Jälkimmäisessä tapauksessa T. Ääni riittävä lämpötila ( T. SV), jonka alla palo toimii ymmärtää syntymän ja kuumennettaessa jonkin kriittiseen lämpötilaan. (Katso palokotelossa) .
Periaatteessa itsensä polttaminen ja itsestään sytytys fyysisessä yksikössä ovat samankaltaisia \u200b\u200bja vaihtelevat vain palamisen tyypissä, itse sytytys tapahtuu vain tulisen polttamisen muodossa.
Itsensä lämmityksen (puolueettoman lämmityksen) tapauksessa se kehittyy muutamassa asteessa ja siksi ei oteta huomioon palovaaran ja nesteiden arvioinnissa. Kun itsestään polttava, itsestään lämmitysalue voi saavuttaa useita satoja astetta (esimerkiksi turve 70-225 ° C). Tämän seurauksena itsenäisen lämmityksen ilmiö otetaan aina huomioon määritettäessä kiinteiden aineiden taipumuksen itsensä polttamiseen
Itsensä polttamista tutkitaan termostaatti tutkimuksen mukaisella materiaalilla tietyssä lämpötilassa ja luomalla riippuvuus lämpötilan välillä, jossa polttaminen, näytekoko ja termostaatin lämmitysaika ilmenee.
Kuviossa on esitetty prosesseja, jotka esiintyvät palavan materiaalin näytteiden itsensä polttamisen aikana. Lämpötiloissa T. CH (esim T. 1) Materiaali kuumennetaan muuttumattomana (ei lämpöä). Saavutettuna T. CH materiaalissa esiintyy eksotermiset reaktiot. Jälkimmäinen, riippuen lämmön kerääntymisolosuhteista (materiaalimassa, niiden atomien ja molekyylien pakkauksen tiheys, prosessin kesto jne.) Toukokuun jälkeen pienen itsestään lämmityksen jälkeen kykenevän Materiaalikomponenttien itsehoito, joka jäähdytetään näyteestä termostaatin alkuperäiseen lämpötilaan (käyrä 1) tai jatka säätääksesi T. Ääni (käyrä 2). Alue T. Ch I. T. Sozos on mahdollisesti palovaarallinen, alla T. Sn -
turvallinen.
Lämpötilan muutos T.aika t termostaatisoituneissa näytteissä polttoainemateriaalia.
Mahdollisesti itsenäinen polttava materiaali potentiaalisesti palon vaarallisessa alueessa asetetaan yhtälöillä:
missä T. OKR-Embetterympäristö, ° C; l.- materiaalin koon (tavallisesti paksuuden) määrittäminen; T-aika, jonka aikana itsenäinen polttaminen voi tapahtua; A. 1 , n. 1 I. MUTTA 2 , N. 2-) Määritetty kullekin materiaalille kokeellisten tietojen mukaan (ks. Taulukko).
Yhtälöllä (1) tietylle l. löytö T. Ok, jolloin itsensä polttaminen voi ilmetä tämä materiaali, yhtälöllä (2) -henkilöllä T. OFC VALUE T. Alla olevassa lämpötilassa laskettuna T. OCD tai t, pienempi kuin yhtälön (2) laskettu aika, itse palaminen ei tapahdu.
Riippuen alkuperäisen prosessin luonteesta, joka aiheutti materiaalin itsensä lämmityksen ja arvot T. CH erottaa kemialliset, mikrobiologiset ja lämpöä polttamalla

Kemiallinen itsensä polttaminen sisältää aineiden eksotermisen vuorovaikutuksen (esimerkiksi, kun se osui väkevöidään HNO 3 paperilla, puun sahanpuru jne.). Tyypillisin ja yleinen esimerkki tällaisesta prosessista on vesipohjaisen ajoneuvon tai muiden kuitumateriaalien itsensä polttaminen kehittyneellä pinnalla. Erityisen vaarallisia öljyjä, jotka sisältävät yhdisteitä, joissa on tyydyttymättömät kemialliset sidokset ja joilla on korkea jodinumero (puuvilla, auringonkukka, juutti jne.).
Kemiallisen itsensä polttamisen ilmiöihin kuuluu myös useiden aineiden valaistus (esimerkiksi pienikokoinen AL ja Fe, Si hydridit, in ja jotkut metallit, organometalliset yhdisteet - alumiineurganic jne.) Kun ne ovat kosketuksissa ilmaa lämmityksen puuttuessa. Aineiden kykyä itsestään polttamiseen tällaisissa olosuhteissa kutsutaan pyruodiksi. Pyroporisten aineiden ominaisuus on se, että ne ovat T. Ääni (tai. T. SV) huoneenlämpötilan alapuolella: - 200 ° C SIH 4: lle, - 80 ° C A1 (C2H5) 3. Kemiallisen itsensä polttamisen estämiseksi palavien aineiden ja materiaalien yhteensovittamisen menettely on ehdottomasti säännelty.
Mikrobiologisen itsensä polttamisen taipumus on palava materiaali, erityisesti kostutettu, mikä toimii ravintoaineina mikro-organismeille, jonka toimeentulo liittyy lämmön (turpeen, puudagdustin jne.). Tästä syystä suuri määrä tulipaloja ja räjähdyksiä tapahtuu, kun varastoidaan maataloustuotteita (esimerkiksi siilo, kostutettu heinää) hisseissä. Mikrobiologisista ja kemiallisista itsestään polttamisesta se on ominaista T. CH ei ylitä tavanomaisia \u200b\u200barvoja T. OCC, ja se voi olla negatiivinen. Materiaalit, joilla on T. CH huoneen lämpötilan yläpuolella, joka kykenee lämpöpolttoon
Yleensä monet kiinteät materiaalit, joilla on kehittynyt pinta (esimerkiksi kuitumaton) sekä joitain nesteitä ja sulavia aineita, jotka sisälsivät tyydyttymättömiä yhdisteitä, joita sovelletaan kehittyneeseen (mukaan lukien ei-palava) pinnalle, on taipumus kaikentyyppisille itsetyypeille -palaa. Kemikaalien, mikrobiologisten ja termisen itsensä polttamisen kriittisten olosuhteiden laskeminen suorittaa yhtälöt (1) ja (2). Kokeellinen määritelmä T.
Oikea palontorjunta-tapahtumien ja sammutusaineiden organisointi on mahdotonta ilman polttamisen aikana tapahtunutta kemiallisten ja fysikaalisten prosessien olemusta. Näiden prosessien tunteminen mahdollistaa tulipalon onnistumisen onnistuneesti.
Polttaminen on kemiallinen hapetusreaktio, johon liittyy suuri määrä lämpöä ja tavallisesti hehkulla. Polttoprosessin hapettimen voi olla happea sekä klooria, bromia ja muita aineita.
Useimmissa tapauksissa tulipalon sattuessa palavien aineiden hapettaminen ilmenee happea ilmalla. Tällainen hapettava aine ja hyväksyttiin tulevassa esityksessä. Palaminen on mahdollista, jos ainetta kykenee polttamaan, happea (ilma) ja sytytyslähde. On välttämätöntä, että fury-aine ja happi ovat tietyissä määrällisissä suhteissa, ja sytytyksen lähde oli välttämätöntä lämpöenergian tarjonta.
Tiedetään, että ilmassa sisältää noin 21% happea. Useimpien aineiden polttaminen on mahdotonta, kun ilman happipitoisuus laskee 14-18 prosenttiin ja vain joitain palavia aineita (vety, etyleeni, asetyleeni jne.) Voidaan palaa, kun happipitoisuus on ilmassa 10%: iin ja Vähemmän. Happipitoisuuden väheneminen, useimpien aineiden polttaminen pysähtyy.
Polttoaine ja happi reagoimaan aineita ja tekevät polttoainejärjestelmää ja sytytyslähde aiheuttaa polttoreaktion. Sytytyslähde voi olla valssatun rungon polttava PP sekä sähköinen purkaus, jolla on energiavaraus, joka riippuu palamisessa jne.
Palavat järjestelmät jaetaan homogeeniseen ja epähomogeeniseen. Yhdenmukaiset ovat järjestelmät, joissa polttoaine ja ilma sekoitetaan tasaisesti toistensa kanssa (palavien kaasujen seokset, höyryt ilmalla). Tällaisten järjestelmien polttamista kutsutaan kineettiseksi polttavaksi. Nopeus määräytyy kemiallisen reaktion nopeudella, joka on merkittävä korkeassa lämpötilassa. Tietyissä olosuhteissa tällainen palaminen voi olla räjähdyksen tai räjähdyksen luonne. Inhomogeeniset järjestelmät, joissa polttoainetta ja ilmaa ei sekoiteta toisiinsa ja niillä on osan pinta (kiinteät palavat materiaalit ja lausumattomia nesteitä). Inhomogeenisten palavien järjestelmien polttoprosessissa ilman happi tunkeutuu polttotuotteiden kautta polttoaineeseen ja syöttää reaktion sen kanssa. Tällaista polttamista kutsutaan diffuusiopoltoksi, koska sen nopeus määritetään pääasiassa suhteellisen hidasta prosessin diffuusiota.
Tulipaloon sytytyslähteen lämmön pitäisi olla riittävä palavien aineiden muuttamiseksi pareiksi ja kaasuiksi ja lämmittää ne itsesääntymisen lämpötilaan. Polttoaineen ja hapettimen suhde, köyhien ja rikkaiden palavien seosten polttoprosessit erotetaan. Huono Mixit sisältävät hapettavaa ainetta ylimäärin ja niillä on polttoainekomponentin puute. Rikkaat sekoitukset päinvastoin, on syttyvä komponentti ylimäärin ja hapettavan aineen haittana.
Palamisen esiintyminen liittyy pakolliseen itseluottamukseen järjestelmässä järjestelmässä. Itsesäätävän reaktion prosessi sen siirtymisen kanssa polttamiseen kutsutaan itsestään sytytykseksi. Kemiallisen reaktion itsepainottaminen palamisessa on jaettu kolmeen päätyyppiin: lämpö, \u200b\u200bketju ja yhdistetty ketjuinen lämpö. Lämpöteorialla itsesyötön prosessi selitetään hapetusprosessin aktivoimalla kemiallisen reaktion nopeuden lisäämiseksi. Ketjutteorian mukaan itsestytysprosessi johtuu kemiallisen reaktion ketjujen haarautumisesta. Käytännöllisesti katsoen polttoprosesseja toteutetaan pääasiassa yhdistetyllä ketjun lämpömekanismilla.
Poltto erottaa täydellisen ja epätäydellisen. Täysi palamista muodostuu tuotteita, jotka eivät pysty polttamaan enemmän: Hiilidioksidi, rikkikaasu, vesiparit. Epätäydellinen polttaminen ilmenee, kun hapen käyttö on vaikeaa polttovyöhykkeelle, mikä on muodostettu epätäydellinen palamistuotteet: hiilimonoksidi, alkoholit, aldehydit jne. Muodostetaan.
Noin ilman (M3) määrää, joka on välttämätöntä 1 kg: n aineen (tai 1 M3 kaasun) polttamiseksi,
jossa q on palamisen, kj / kg tai kj / m 3.
Joidenkin aineiden lämmönpolto: bensiini-47 000 kJ / kg; Ilmakuivaus -14 600 kJ / kg; Asetyleeni - 54400 kJ / m 3; metaani - 39400 kJ / m 3; Hiilidioksidit - 12 600 kJ / m 3.
Palattavan aineen palamisen lämmöstä on mahdollista määrittää, kuinka paljon lämpöä vapautuu polttamisen aikana, palamislämpötila, paine räjähdyksessä suljetussa tilavuudessa ja muissa dataa.
Aineen palamislämpötila määritellään sekä teoreettisella että päteväksi. Teoreettinen on palamislämpötila, johon polttotuotteita kuumennetaan, olettaen, että kaikki polttamisen aikana erotetaan kaikki lämpö, \u200b\u200bjoka on lämmitetty.
Teoreettinen palamislämpötila
jossa m on 1 kg: n polttona muodostettujen polttotuotteiden määrä; C on polttotuotteiden lämpökapasiteetti, kJ / (kg * k); θ - ilman lämpötila, K; Q - Palamisen lämpö, \u200b\u200bKJ / kg.
Todellinen palamislämpötila on 30-50% alempi teoreettinen, koska merkittävä osa polttamisen aikana vapautettua lämpöä hajotetaan ympäristöön.
Suuri palamislämpötila edistää tulen leviämistä, sillä se on suuri määrä lämpöä, ja palavien aineiden polttaminen on intensiivinen valmistelu. Palonsammutus suurella palamislämpötilassa haittaavat.
Polttoprosesseja harkittaessa seuraavia tyyppejä on erotettava: salama, tulipalo, sytytys, itsestään sytytys, itsensä polttaminen, räjähdys.
Salama on palavan seoksen nopea polttaminen, joka ei liity puristuskaasujen muodostumiseen.
Tulipalo on palamisen esiintyminen sytytyslähteen vaikutuksesta.
Tulehdus on tulipalo, johon liittyy liekin ulkonäkö.
Epäonnistuminen - kyky sytyttää (sytyttää) sytytyslähteen vaikutuksesta.
Itsensä polttaminen on ilmiö, joka on voimakas kasvu eksotermisen reaktioiden nopeudesta, mikä johtaa aineiden palamisen (materiaalin, seos) esiintymiseen sytytyslähteen puuttuessa.
Itse sytytys on itsenäinen, mukana liekin ulkonäkö.
Räjähdys kutsutaan erittäin nopeaksi kemikaaliksi (räjähtävä) aineen muuntaminen, johon liittyy energian vapautuminen ja pakattujen kaasujen muodostuminen, joka kykenee tuottamaan mekaanista työtä.
On välttämätöntä ymmärtää erotus sytytysprosesseja (sytytys) ja itsensä polttamalla (itsestään sytytys). Jotta voittua itseään, on välttämätöntä tehdä lämpöpulssi palavaan järjestelmään, jonka lämpötila on suurempi kuin aineen itse sytytyslämpötila. Polttoman esiintyminen lämpötiloissa itsestytyslämpötilan alapuolella viittaa itsestään polttavan prosessiin (itse sytytys).
Palaminen tapahtuu ilman sytytyslähdettä - termisen tai mikrobiologisen itsensä polttamisen vuoksi.
Lämpöäaineita esiintyy itsenäisen lämmityksen seurauksena piilotetun tai ulkoisen lämmityslähteen vaikutuksesta. Itse sytytys on mahdollista vain, jos itsetutkimuksen aikana syntyvä lämpö ylittää lämpöä ympäristöön.
Mikrobiologinen itsensä polttaminen Se esiintyy itsenäisen lämmityksen seurauksena mikro-organismien toimeen vaikutuksen aineen massassa (materiaali, seos). Sytytyssytytyslämpötila on palavan aineen tärkeä ominaisuus.
Itse syttymislämpötila on alhaisin lämpötila aineen, joka on voimakas kasvu nopeuden eksotermisten reaktioiden, päättyy syntymistä liekin palamisen.
Taulukossa on esitetty joitain nesteitä, kaasuja ja kiintoaineita, jotka ovat käyttäneet koneenrakennusteollisuudessa käytettäviä nesteitä, kaasuja ja kiintoaineita. 28.
Taulukko 28. Joidenkin nesteiden itsensä sytytyslämpötilat
| Aine | Itse sytytyslämpötila, ° С |
Fosforivalkoinen |
20 |
Seroublerod. |
112 |
Selluloidi |
140-180 |
Rikkivety |
246 |
Öljyöljyt |
250-400 |
| 250 | |
Bensiini A-76 |
255 |
| 380-420 | |
Kivihiili |
400 |
Asetyleeni |
406 |
Etanoli |
421 |
Puuhiili |
450 |
Nitrobentseeni |
482 |
| 530 | |
| 612 | |
| 625 | |
Hiilimonoksidi |
644 |
| 700 |
Itse sytytyslämpötilan lisäksi palavilla aineilla on tunnusomaista itsesääntymisen induktio- tai hidastumisaika. Induktiokausi kutsutaan ajanjaksoksi,
vaikka itsestään lämmitys sytytykseen. INDUCTUCTION samalle palavalla aineelle ja riippuu seoksen koostumuksesta, alkuperäiset lämpötilat ja paine.
Induktiokausi on käytännöllistä toimia pienten tulehduslähteiden polttoaineessa (kipinät). Kipinä, päästä höyryjen tai kaasujen polttoaineseokseen ilman, kuumenee jonkin verran seoksen tilavuutta ja samalla kipinä jäähdytetään. Seoksen sytytys riippuu seoksen induktiokauden ja kipinän jäähdytysajan suhteen. Samanaikaisesti, jos induktioaika on suurempi kuin kipinän jäähdytysaika, seoksen sytytys ei tapahdu.
Induktiokausi perustuu kaasuseosten luokitteluun sytytysasteensa mukaan. Pölyseosten induktio-aika riippuu pölyn koosta, haihtuvien aineiden, kosteuden ja muiden tekijöiden määrästä.
Jotkin aineet voivat olla itsekäytyksiä, jotka ovat normaalissa lämpötilassa. Tämä on pääasiassa kiinteitä huokoisia aineita enimmäkseen orgaaninen alkuperä (sahanpuru, turve, fossiilinen hiili jne.). Altis itsen polttamiseen ja öljyihin, jotka on jaettu ohuella kerroksella suurella pinnalla. Tämä aiheuttaa mahdollisuuden itse poltettavaksi pesty vetolle. Pestyjen kuitumateriaalien itsensä polttamisen syy on rasvaisten aineiden jakautuminen ohuella kerroksella niiden pinnalla ja hapen imeytyminen ilmasta. Öljy hapen hapetus liittyy lämmöntumiseen. Siinä tapauksessa, jossa muodostettu lämpö ylittää ympäristön lämpöhäviöt, tulipalon syntyminen voi ilmetä.
Self-polttamiseen alttiina aineiden tulipalo on erittäin korkea, koska ne voivat sytyttää ilman lämpöä lämpötilassa aineiden itsesäsytisilämpötilan alapuolella ja itsen puhuttujen aineiden indusointi voi olla useita tunteja, päivää ja jopa kuukausia. Tuloksena oleva hapettumisen kiihdytysprosessi (aineen kuuleminen) voidaan pysäyttää vain, kun havaitaan vaarallinen lämpötilan nousu, mikä osoittaa tulipalon ehkäisevien toimenpiteiden suurta merkitystä.
Monia aineita, jotka kykenevät itsensä polttamiseen, käytetään koneenrakennusyrityksissä. Silitysraudan, noki-, alumiinin ja sinkkijauheiden sulfidit voivat olla itse kääntyviä vuorovaikutuksessa ilmassa ja tohtori. Itsekääntö vuorovaikutuksessa veden kanssa voi emäksisiä metalleja, metallien karbidit jne. Kalsiumkarbidi (CAC 2), reagoida veden kanssa , muodostaa asetyleeniä (C 2N 2).