Alkanes kuingiliana na hidrojeni. Nomenclature ya kimataifa ya alkanov. Alkaans: muundo, mali. Mali ya kemikali ya hidrokaboni yenye kunukia
Kupunguza hidrokaboni ni misombo kama hiyo ambayo ni molekuli yenye atomi za kaboni ambazo ziko katika hali ya hybridization sp 3. Wao huunganishwa na kila mmoja tu vifungo vya sigma. Jina la "kikomo" au "limejaa" hidrokaboni linatokana na ukweli kwamba misombo hii haiwezi kuunganisha atomi yoyote. Wao ni nyingi sana. Mbali ni cycloalkanes.
Alkanes ni nini?
Alkania ni hydrocarbons ya kikomo, na mlolongo wao wa kaboni hauwezi kufungwa na una atomi za kaboni zinazounganishwa kwa kutumia mahusiano moja. Haina na wengine (yaani, mara mbili, kama alkenes, au mara tatu, kama vile alkylov). Alkans pia huitwa parafini. Walipata jina hili, tangu parafini inayojulikana ni mchanganyiko wa hydrocarbons hizi za kikomo na 18 -C 35 na idertness maalum.
Maelezo ya jumla kuhusu Alkans na radicals yao.
Mfumo wao: c n p 2 n +2, hapa n ni kubwa kuliko au sawa na 1. molekuli ya molar inahesabiwa na formula: m \u003d 14n + 2. Kipengele cha tabia: mwisho katika majina yao ni "-Ani." Mabaki ya molekuli yao ambayo huundwa kama matokeo ya kuchukua atomi hidrojeni kwa atomi nyingine huitwa aliphatic radicals, au alkyls. Wao wanaashiria na barua R. formula ya jumla ya radicals monovalent: na np 2 n +1, hapa n ni kubwa kuliko au sawa na 1. molekuli molar ya radicals aliphatic ni mahesabu na formula: m \u003d 14n + 1 . Kipengele cha tabia ya radicals aliphatic: mwisho katika majina "- IL. Molekuli za alkanov zina sifa zao za muundo:
- uunganisho wa C-C una sifa ya urefu wa 0.154 nm;
- uunganisho wa C-H una sifa ya urefu wa 0.109 nm;
- angle ya valence (angle kati ya vifungo vya kaboni-kaboni) ni sawa na digrii 109 na dakika 28.

Mfululizo wa alkanes wa homologous kuanza: methane, ethane, propane, butane, na kadhalika.
Mali ya kimwili ya Alkanov.
Alkaans ni vitu ambavyo havi na rangi na visivyo na maji. Joto ambalo alkanes huanza kuyeyuka, na joto ambalo huchemsha wanaongezeka kwa mujibu wa ongezeko la uzito wa Masi na urefu wa mlolongo wa hydrocarbon. Kutoka chini ya matawi ya alkanes zaidi ya matawi, joto la kuchemsha na kuyeyuka hupungua. Alkanes ya gesi yana uwezo wa kuchoma rangi ya bluu au rangi isiyo na rangi, wakati joto nyingi linasimama nje. Ch 4 -C 4 h 10 ni gesi ambazo hazipo na harufu. C 5 h 12 -C 15 h 32 ni maji ambayo yana harufu maalum. Kutoka 15 n 32 na kadhalika, haya ni solids ambayo pia haifai.
Mali ya kemikali ya alkanov.
Misombo hii ni ya chini katika mpango wa kemikali, ambayo inaweza kuelezewa na nguvu ya viungo vya sigma-c-c na c-n. Inapaswa pia kuzingatiwa kuwa mahusiano na C - C ni yasiyo ya polar, na SN ni chini ya polar. Hizi ni aina ya chini ya viungo vinavyohusiana na sigma ya kuonekana na, kwa hiyo, kuvunja uwezekano mkubwa zaidi watakuwa utaratibu wa kigaidi, kama matokeo ya radicals yataundwa. Kwa hiyo, mali ya kemikali ya alkanans ni hasa kwa athari ya kubadilika kwa kiasi kikubwa.

Majibu ya nuting.
Alkans huingiliana tu na asidi ya nitriki na mkusanyiko wa 10% au kwa oksidi ya nitrojeni ya tetraphic katika kati ya gesi kwa joto la 140 ° C. Mmenyuko wa nitration ya Alkane inaitwa mmenyuko wa Konovalov. Matokeo yake, misombo ya nitro na maji hutengenezwa: Ch 4 + asidi ya nitriki (diluted) \u003d Ch 3 - NO 2 (nitromethane) + maji.
Athari ya moto
Punguza hidrokaboni mara nyingi hutumiwa kama mafuta, ambayo ni haki na uwezo wa mwili wao: na n p 2n + 2 + ((3N + 1) / 2) o 2 \u003d (n + 1) h 2 o + n co 2.
Athari za oksidi
Katika mali ya kemikali ya alkanans pia inajumuisha uwezo wao wa oxidation. Kulingana na hali ambayo inaongozana na majibu na jinsi ya kubadilishwa, yanaweza kupatikana kutoka kwa dutu moja ili kupata bidhaa mbalimbali za mwisho. Oxidation laini ya oksijeni ya methane mbele ya kichocheo kinachoharakisha majibu, na joto la karibu 200 ° C inaweza kusababisha vitu vifuatavyo:
1) 2ch 4 (oxidation oksijeni) \u003d 2sh 3 ni (pombe - methanol).
2) ch 4 (oksijeni oksijeni) \u003d ch 2 o (aldehyde - methanal au formaldehyde) + n 2 O.
3) 2ch 4 (oxidation oksijeni) \u003d 2nson (carboxylic asidi - methane au formic) + 2n 2 O.

Pia, oxidation ya alkanes inaweza kuzalishwa katika gesi ya gesi au kioevu. Athari hizo husababisha kuundwa kwa pombe za juu na asidi sambamba.
Mtazamo wa joto.
Katika joto halizidi + 150-250 ° C, lazima uwepo wa kichocheo, upyaji wa miundo ya vitu vya kikaboni hutokea, ambayo inabadilisha utaratibu wa kiwanja cha atomi. Utaratibu huu unaitwa isomerization, na vitu vilivyopatikana kama matokeo ya majibu - isomers. Hivyo, kutoka kwa kawaida ya butane inageuka isomer yake - isobutane. Katika joto la 300-600 ° C na uwepo wa kichocheo, kuna kupasuka kwa vifungo vya C-H ili kuunda molekuli ya hidrojeni (majibu ya dehydrogenation), molekuli ya hidrojeni na kufungwa kwa kaboni katika mzunguko (mmenyuko wa cyclization au athari ya aromatov ya alkanov):
1) 2ch 4 \u003d c 2 h 4 (ethen) + 2n 2.
2) 2ch 4 \u003d c 2 h 2 (Ethin) + 3h 2.
3) c 7 h 16 (heptane ya kawaida) \u003d c 6 h 5 - ch 3 (toluene) + 4N 2.

Majibu ya Halogenation.
Athari hizo ni katika kuanzishwa kwa halojeni (atomi zao) katika molekuli ya dawa ya kikaboni, kama matokeo ambayo uhusiano wa C-Halogen huundwa. Katika mwingiliano wa alkanes na halojeni, derivatives halogen huundwa. Mmenyuko huu una sifa maalum. Inaendelea na utaratibu wa radical, na vizuri, ni muhimu kuathiri halogen na alkanani kuathiri mionzi ya ultraviolet au tu joto. Mali ya alkanans kuruhusu majibu ya halogenation ya mtiririko mpaka kubadilisha kamili kwa atomi za halojeni zitapatikana. Hiyo ni, klorini ya methane haitakuwa na hatua moja na uzalishaji wa kloridi ya methyl. Mmenyuko utaendelea zaidi, bidhaa zote zinazoweza kubadilishwa zitaundwa, kuanzia na chloromethane na kuishia na tetrachloromethane. Madhara ya klorini chini ya hali hizi kwenye alkanes nyingine itasababisha malezi ya bidhaa mbalimbali zilizopatikana kama matokeo ya uingizwaji wa hidrojeni katika atomi tofauti za kaboni. Kutoka kwa joto ambalo mmenyuko unaendelea, uwiano wa bidhaa za mwisho na kasi ya malezi yao itategemea. Kwa muda mrefu mlolongo wa hydrocarbon wa Alkane, ni rahisi zaidi kwenda majibu haya. Wakati halogenation, atomi ya kaboni itabadilishwa kwanza na angalau hidrojeni (ya juu). Msingi utaingia kwenye majibu baada ya wengine wote. Dawa ya halojeni itatokea katika hatua. Katika hatua ya kwanza, atomi moja ya hidrojeni ni kubadilishwa. Pamoja na ufumbuzi wa halogen (maji ya klorini na bromine), alkanes haziingiliana.

Majibu ya sulfooling.
Mali ya kemikali ya alkanans pia yanajumuishwa na majibu ya sulfooling (inaitwa majibu ya majibu). Wakati wazi kwa mionzi ya ultraviolet, alkanes ina uwezo wa kukabiliana na mchanganyiko wa klorini na dioksidi ya sulfuri. Matokeo yake, kloridi hutengenezwa, pamoja na radical ya alkyl, ambayo hujiunga na dioksidi ya sulfuri. Matokeo yake, kiwanja kikubwa kinapatikana, ambacho kinakuwa imara kutokana na kukamata kwa atomi ya klorini na uharibifu wa molekuli moja: R-H + hivyo radiation ya 2 + ya 2 + ultraviolet \u003d r-hivyo 2 cl + HCl. Chlorides ya sulfonyl iliyoundwa kama matokeo ya mmenyuko hutumiwa sana katika uzalishaji wa wasambazaji.
Misombo ya kikaboni isiyo rahisi hydrocarbons.yenye kaboni na hidrojeni. Kulingana na hali ya vifungo vya kemikali katika hidrokaboni na uhusiano kati ya kaboni na hidrojeni, wamegawanywa katika kuzuia na zisizotarajiwa (Alkenes, Alkins, nk)
Kikomohydrocarbons (alkanes, hidrokaboni ya mstari wa methane) ni misombo ya kaboni na hidrojeni, katika molekuli ambayo kila atomi ya kaboni hutumia kiwanja na atomi nyingine yoyote ya jirani ya valence moja, na valence yote hairuhusiwi kushikamana kwa kaboni ya hidrojeni. Atomi zote za kaboni katika alkanes ziko katika SP 3 - hali. Kupunguza hidrokaboni huunda mfululizo wa homologous unaojulikana na formula ya jumla Kutoka n. N. 2N + 2. . Kipaumbele cha mapafu ya mfululizo huu ni methane.
Isomeria. Nomenclature.
Alkans na n \u003d 1,2,3 inaweza kuwepo tu kwa namna ya isomeri moja
Kuanzia na n \u003d 4, uzushi wa isomerism ya miundo inaonekana.

Idadi ya isomers ya miundo ya alkanes inakua kwa kasi na ongezeko la idadi ya atomi za kaboni, kwa mfano, Pentane ina isomers 3, heptane - 9, nk.
Idadi ya isomers ya alkane huongezeka na kutokana na stereoisomers iwezekanavyo. Kuanzia na C 7 n 16, kuwepo kwa molekuli ya chiral ambayo huunda enantiomers mbili inawezekana.
Nomenclature ya alkanes.
Nomenclature kubwa ni nomenclature ya IUPAC. Wakati huo huo, hutoa vipengele vya majina yasiyo ya kawaida. Kwa hiyo, wanachama wanne wa kwanza wa mfululizo wa alkanes wana majina yasiyo ya kawaida.
Ch 4 - Methane.
Kutoka 2n 6 - ethane.
C 3 h 8 - propane.
Na 4 h 10 - Bhutan.
Majina ya homologues iliyobaki yanaundwa kutoka kwa nambari ya Kilatini ya Kigiriki. Kwa hiyo, kwa wanachama wafuatayo wa kawaida (unbranched) kujenga, majina hutumiwa:
Kutoka 5 h 12 - Pentan, kutoka 6 h 14 - Hexane, kutoka 7 h 18 - heptane,
Kuanzia 14 h 30 - Tetradecan, kutoka 15 h 32 - Pentadecan, nk.
Kanuni za msingi za IUPAC kwa Alkanov ya matawi
a) Chagua mlolongo mrefu usiovunjika, jina ambalo ni msingi (mizizi). Msingi huu huongeza suffix "a"
b) Nambari ya mlolongo huu juu ya kanuni ya lockers angalau,
c) substituent inaonyesha kama prefixes katika utaratibu wa alfabeti kuonyesha eneo la eneo. Ikiwa kuna mbadala kadhaa zinazofanana katika muundo wa spring, basi idadi yao inaonyesha namba ya Kigiriki.
Kulingana na idadi ya atomi nyingine za kaboni ambayo atomi ya kaboni inaunganishwa moja kwa moja, inayojulikana: Atomi za msingi, za sekondari, za juu na za quaternary.


Vikundi vya Alkyl au radicals ya alkyl vinaelezewa kuwa mbadala katika alkans za matawi, ambazo zinachukuliwa kama matokeo ya punguzo kutoka kwa molekuli ya alkane ya atomi moja ya hidrojeni.
Jina la makundi ya alkyl hutoa kutoka kwa jina la alkanes sambamba kwa kuchukua nafasi ya mwisho ya "A" kwa Soffix "Il".
Ch 3 - methyl.
Ch 3 ch 2 - ethyl.
Ch 3 ch 2 ch 2 - propil.

Kwa jina la makundi ya alkyl ya matawi, idadi ya mlolongo pia hutumiwa:

Kuanzia na ethane, alkanes ni uwezo wa kutengeneza conforms, ambayo yanahusiana na conformation iliyozuiliwa. Uwezekano wa mpito wa conformation moja iliyozuiliwa kwa mwingine kwa njia ya kufichwa imedhamiriwa na kizuizi cha mzunguko. Kuamua muundo, muundo wa conforms na vikwazo vya mzunguko ni kazi za uchambuzi wa conformational. Njia za kupata Alkanes.
1. Kutoroka kwa sehemu ya gesi ya asili au sehemu ya mafuta ya petroli.Kwa njia hii, alkanes binafsi inaweza kutengwa na atomi 11 za kaboni.
2. Hydrogenation ya makaa ya mawe.Mchakato huo unafanywa mbele ya kichocheo (oksidi na sulfides ya molybdenum, tungsten, nickel) saa 450-470 ° C na shinikizo hadi 30 MPa. Makaa ya mawe na kichocheo hutumiwa katika poda na hidrojeni hidrojeni, hidrojeni ya hidrojeni kupitia kusimamishwa. Mchanganyiko unaosababisha wa alkanes na cycloalkanes hutumiwa kama mafuta ya mafuta.
3. Ushirikiano wa hydrogenation na na 2 .
CO + H 2 Alkanes.
CO 2 + H 2 Alkanes.
Co, Fe, na wengine hutumiwa kama kichocheo cha athari hizi. D - vipengele.
4. Hydrogenation ya Alkenes na Alkins.

5. Ya awali ya metali.
lakini). Awali ya Watza.
2Ral + 2na r + 2nahal
Hii ya awali haifai ikiwa halolenna mbili tofauti hutumiwa kama reagents za kikaboni.
b). Protolysis ya Reagents Grignar.
R Hal + mg rmhal.
Rmghal + hoh rh + mg (oh) hal
in). Ushirikiano wa Lithiamu Dialkiprats (Lir 2 CU) na ALKYL Halides
Lir 2 cu + r x r + rcu + lix
Lithiamu dialkiprats wenyewe hupatikana kwa njia mbili.
2R li + cui lir 2 cu + lii
6. Electrolysis ya chumvi za carboxylic (Sintez kolbe).
2rcoona + 2h 2 o r + 2Co 2 + 2naoh + h 2

7. Roll ya chumvi ya asidi ya carboxylic na alkali.
Majibu hutumiwa kuunganisha alkanes ya chini.
8. Hydrogenolysis ya misombo ya carbonyl na Halolyanov.
lakini). Carbonyl misombo. Awali ya Clement.

b). Halojeni. Hydrogenolysis ya kichocheo.
![]()
NI, PT, PD hutumiwa kama kichocheo.
c) halojeni. Upyaji wa Reagent.
RHAL + 2HI RH + HHAL + I 2
Kemikali mali ya alkanes.
Uunganisho wote katika alkanes ni chini ya polar, juu ya hii ni sifa ya athari kubwa. Kutokuwepo kwa vifungo vya PI hufanya kuwa haiwezekani kwa mmenyuko wa kushikamana. Kwa alkanans, mmenyuko wa kubadili, cleavage, mwako ni tabia.
|
Aina na jina la mmenyuko | |
|
1. Athari ya kubadili. | |
|
A) na halogens. (Kutoka chlorom.Cl. 2 Na mwanga, Br. 2 - Wakati inapokanzwa) Mmenyuko unatii sheria ya Markovnik (Kanuni Markovnikov.) - hasa halogen huchagua hidrojeni katika atomi ya chini ya hidrojeni ya kaboni. Majibu hupita katika hatua - kwa hatua moja hakuna zaidi ya atomi moja ya hidrojeni inabadilishwa. Njia ngumu sana ya kujibu iodini, na kwa zaidi ya hayo, majibu hayatakwenda mwisho, kwani, kwa mfano, na kuingiliana kwa methane na iodini, hidrojeni ya iodide hutengenezwa, kuitikia na methyl iodide na malezi ya methane na iodini (majibu ya reversible): |
Ch 4 + cl 2 → ch 3 cl + hcl (chloromethane) Ch 3 cl + cl 2 → ch 2 cl 2 + hcl (dichloromethane) Ch 2 cl 2 + cl 2 → chcl 3 + hcl (trichloromethane) CHCL 3 + Cl 2 → CCL 4 + HCl (tetrachloromethane). |
|
B) nut (mmenyuko wa konovalov) Alkans wanashughulika na suluhisho la asidi 10% au oksidi ya nitrojeni n 2 o 4 katika awamu ya gesi kwa joto la 140 ° na shinikizo kidogo na malezi ya kuzalisha nitro. Reaction pia huitii utawala wa Markovnikov. Moja ya atomi za hidrojeni hubadilishwa na mabaki ya 2 (nitro Group) na maji yanajulikana |
|
|
2. Athari za Cleavage. | |
|
A) dehydrogenation. -Opt hidrojeni. Hali ya majibu ya kichocheo -platin na joto. |
Ch 3 - ch 3 → ch 2 \u003d ch 2 + h 2 |
|
B) Kupoteza Mchakato wa uharibifu wa mafuta ya hidrokaboni, kulingana na mmenyuko wa kugawanyika kwa mlolongo wa kaboni wa molekuli kubwa ili kuunda uhusiano na mnyororo mfupi. Katika joto la 450-700 o, alkanes hugawanyika kutokana na kupasuka kwa vifungo vya C-C (vifungo vya muda mrefu zaidi vya C-NPRI vya joto hilo vinalindwa) na alkanes na alkenes hutengenezwa kwa idadi ndogo ya atomi za kaboni. |
C. 6 H. 14 C. 2 H. 6 + C. 4 H. 8 |
|
C) Uharibifu kamili wa mafuta |
Ch 4 c + 2h 2. |
|
3. athari za oksidi | |
|
A) majibu ya moto Wakati wa kupuuza (T \u003d 600 o C), alkanes huguswa na oksijeni, wakati oxidation yao inatokea kwa dioksidi kaboni na maji. |
C n 2n + 2 + o 2 -\u003e CO 2 + H 2 O + Q Ch 4 + 2o 2 -\u003e co 2 + 2h 2 o + q |
|
B) oxidation ya kichocheo- Kwa joto la chini na kutumia kichocheo kinaambatana na kuvunjika kwa sehemu tu ya vifungo vya C-tatu katikati ya molekuli na c - n na kutumika kupata bidhaa muhimu: carboxylic acids, ketoni, aldehydes, pombe. |
Kwa mfano, na oxidation isiyokwisha ya butane (dhamana ya mawasiliano C 2 -C 3) inapatikana kwa asidi ya asidi |
|
4. Athari ya isomerization. arakterna si kwa alkanov yote. Tahadhari inakabiliwa na uwezekano wa kubadili isomers moja kwa wengine, kuwepo kwa kichocheo. |
C 4 h 10 c 4 h 10. |
|
5.. Alkans na mlolongo kuu katika atomi 6 au zaidi ya kaboni Pia jibu dehydrocyclization, lakini daima kuna aina ya mzunguko wa 6 (cyclohexane na derivatives yake). Chini ya hali ya majibu, mzunguko huu unakabiliwa na dehydrogenation zaidi na hugeuka kuwa mzunguko wa benzol wenye nguvu zaidi wa harufu ya aromatic (uwanja). |
|
Mfumo wa majibu ya halojeni:
Haloiding.
Halogenation ya alkanes inaendelea kupitia utaratibu mkubwa. Kuanzisha majibu, mchanganyiko wa Alkane na Halogen ni muhimu kwa kuimarisha mwanga wa UV au joto. Chlorination ya methane haina kuacha katika hatua ya kupata kloridi ya methyl (ikiwa kiasi cha equimolar cha klorini na methane kinachukuliwa), na husababisha kuundwa kwa bidhaa zote zinazoweza kubadilika, kutoka kwenye kloridi ya methyl hadi tetrachloroupar. Chlorination ya alkanes nyingine inaongoza kwa mchanganyiko wa bidhaa za uingizaji wa hidrojeni katika atomi tofauti za kaboni. Uwiano wa bidhaa za klorini inategemea joto. Kiwango cha kloriation ya atomi ya msingi, ya sekondari na ya juu inategemea joto, kwa joto la chini, kasi hupungua kwa mstari: juu, sekondari, msingi. Kwa ongezeko la joto, tofauti kati ya kasi hupungua hadi inakuwa sawa. Mbali na sababu ya kinetic, usambazaji wa bidhaa za klorination una athari ya sababu ya takwimu: uwezekano wa mashambulizi ya klorini ni mara 3 chini ya msingi na mara mbili kama sekondari. Kwa hiyo, klorini ya alkanes ni mmenyuko usio na stero-kuchagua, kuondoa kesi wakati bidhaa moja tu ya monochlorination inawezekana.
Halogenation ni moja ya athari za kubadili. Harusi ya Alkanov huitii utawala wa Markovnik (Markovnikov sheria) - hasa halogenated atomi angalau hidrojeni carbon. Harusi ya Alkanan hupita kwa hatua kwa hatua - katika hatua moja, hakuna atomi moja ya hidrojeni ni halogenated.
Ch 4 + cl 2 → ch 3 cl + hcl (chloromethane)
Ch 3 cl + cl 2 → ch 2 cl 2 + hcl (dichloromethane)
Ch 2 cl 2 + cl 2 → chcl 3 + hcl (trichloromethane)
CHCL 3 + Cl 2 → CCL 4 + HCl (tetrachloromethane).
Chini ya hatua ya mwanga, molekuli ya klorini huharibika kwa atomi, basi wanashambulia molekuli ya methane, kunyoosha kwenye atomi ya hidrojeni, kwa sababu hiyo, radicals ya methyl huundwa, ambayo inakabiliwa na molekuli ya klorini, kuharibu na kutengeneza radicals mpya.
Kuweka (konovalov mmenyuko)
Alkans wanashughulika na suluhisho la asidi 10% au oksidi ya nitrojeni n 2 o 4 katika awamu ya gesi kwa joto la 140 ° na shinikizo kidogo na malezi ya kuzalisha nitro. Reaction pia huitii utawala wa Markovnikov.
RH + HNO 3 \u003d RNO 2 + H 2 O
i.E. Moja ya atomi za hidrojeni hubadilishwa na mabaki ya 2 (ni-trogroup) na maji yanajulikana.
Makala ya muundo wa isomers yanajitokeza sana wakati wa mmenyuko huu, kwa kuwa ni rahisi kwa atomi ya hidrojeni katika kundi la Nitro katika mabaki ya SI (iliyopo tu katika isomers), hidrojeni katika kikundi cha CH 2 ni Chini kwa urahisi, na hata vigumu zaidi - katika ch 3 ya mabaki.
Parafini ni rahisi sana kuvaa nje ya awamu ya gesi saa 150-475 ° C ya dioksidi ya nitrojeni au jozi ya asidi ya nitriki; Katika kesi hii, hutokea kwa sehemu na. oxidation. Kushikamana kwa methane ni karibu tu nitromethane:
Takwimu zote zilizopo zinaonyesha utaratibu wa bure wa radical. Kama matokeo ya mmenyuko, mchanganyiko wa bidhaa huundwa. Asidi ya nitriki kwa joto la kawaida karibu haina kutenda juu ya hidrokaboni ya mafuta. Wakati wa joto, hufanya hasa kama wakala wa oksidi. Hata hivyo, kama nilivyomwona M. I. Konovalov (1889), na inapokanzwa asidi ya nitriki vitendo kwa sehemu na "njia ya shida"; Majibu ya nitration na asidi ya nitriki dhaifu ni hasa chini ya joto na shinikizo la juu. Mmenyuko wa nitration huelezwa na equation.
Kufuatia methane, homologues hutoa mchanganyiko wa nitroparapfins tofauti kutokana na kugawanyika. Wakati nitrojeni ya ethane inapatikana nitroetan ch 3 -ch 2 -no 2 na nitromethane ch 3 -no 2. Mchanganyiko wa nitroparaffini huundwa kutoka kwa propane:
Nyuma ya parafini katika awamu ya gesi sasa imefanywa kwa kiwango cha viwanda.
Sulfooling:
Mmenyuko muhimu ni sulfocyloration ya alkanans. Wakati alkane inavyoingiliana na chlorini na sulfuri ya sulfuri, hidrojeni inabadilishwa na kikundi cha chlorosulfonyl:

Hatua za mmenyuko huu:
Cl + R: H → R + HCl.
R + SO 2 → RSO 2.
RSO 2 + CL: Cl → RSO 2 Cl + Cl
Alcanofochlorides ni rahisi hydrolyzed kwa alkanesulfoxylost (RSO 2 Oh), chumvi ya sodiamu ambayo (RSO 3¯ na + - sodiamu AlkanFonate) Malipo ya mali sawa na SOAM na hutumiwa kama maamuzi.
Mali ya kimwili. Chini ya hali ya kawaida, wajumbe wa kwanza wa mfululizo wa alkanans (kutoka 1 - na 4) ni gesi. Alkanes ya kawaida kutoka Pentane hadi Heptadecan (C 5 - C 17. ) - Liquids, kuanzia na 18 na juu - solids. Kama idadi ya atomi za kaboni huongezeka katika mlolongo, i.e. Pamoja na uzito wa uzito wa molekuli, joto la kuchemsha na kiwango cha alkanes huongezeka. Kwa idadi sawa ya atomi za kaboni katika molekuli ya alkane iliyo na muundo wa matawi, kuna pointi za chini za kuchemsha kuliko alkanes ya kawaida.
Alkana Kwa kawaida husababishwa na maji, kwa kuwa molekuli yao ni chini ya polar na hawaingiliani na molekuli ya maji, ni vyema vyema katika vimumunyisho vya kikaboni vya polar, kama vile benzini, tetrachloromethane, nk Alkanes ya kioevu huchanganywa kwa urahisi.
Vyanzo vya asili vya alkanan - mafuta na gesi ya asili. Vipande mbalimbali vya mafuta vina vyenye alkanes kutokaC 5 h 12. hadi 30 h 62. Gesi ya asili ina methane (95%) na mchanganyiko wa egane na propane.
Ya njia za kupendeza za kupataalkanov. Unaweza kuchagua yafuatayo: / \u003e.
moja. Kupata kutoka hydrocarbons zisizohifadhiwa. Mwingiliano wa alkenes au alkins na hidrojeni ("hidrojeni") hutokea mbele ya kichocheo cha chuma (/\u003e ni, pd ) AS.
inapokanzwa:
Ch w - C ≡sn. + 2n 2 → Ch 3 -ch 2-3.
2. Kuondoka halogenproducts.. Wakati inapokanzwa alkanans iliyobadilishwa na monogaed na sodiamu ya chuma, alkanes hupatikana kwa atomi za kaboni ya twin (Würtz mmenyuko): /\u003e
C 2 h 5 br + 2 na + br - c 2 h 5 → c 2 h 5 - c 2 h 5 + 2 Nabr..
Mmenyuko huu haufanyike na tofauti mbili. halogen-substituted. Alkanians, kwa sababu inageuka mchanganyiko wa alkanans tatu tofauti
3. Kupata saluni za asidi za carboxylic. Wakati wa kufungia chumvi za asidi ya carboxylic na alkali, alkanes hupatikana vyenye atomi moja ya kaboni chini ya mlolongo wa kaboni wa asidi ya awali ya carboxylic: /\u003e
4. Methane. Katika arc ya umeme inayowaka katika hali ya hidrojeni, kiasi kikubwa cha methane kinaundwa: /\u003e
C + 2n 2 → Ch. 4 .
Mmenyuko huo unakuja na joto la kaboni katika hali ya hidrojeni hadi 400-500 ° C kwa shinikizo la juu mbele ya kichocheo.
Katika hali ya maabara, methane mara nyingi hupatikana kutoka kwa carbide ya alumini:
L 4. C 3 + 12N 2 O \u003d ZSN 4 + 4Al (oh) 3.
Kemikali mali.. Chini ya hali ya kawaida, alkanes ni inert ya kemikali. Wao ni sugu kwa reagents nyingi: usiingiliane na sulfuri ya kujilimbikizia na asidi ya nitriki, na alkali ya kujilimbikizia na ya kuyeyuka, sio oxidized na oxidizers kali - permanganate ya potasiamuKMN.Kuhusu 4, nk.
Utulivu wa kemikali ya alkanes ni kutokana na nguvu ya juus -c-S na C-N Connections, pamoja na yasiyo ya polarity. Vifungo visivyo vya polar C-C na C-H katika alkanes haziwezi kukabiliwa na ion kupasuka, lakini wanaweza kugawanya homologies chini ya ushawishi wa radicals bure. Kwa hiyo, athari kubwa ni tabia ya alkanans, kwa sababu ya misombo hupatikana, ambapo atomi za hidrojeni zinabadilishwa na atomi nyingine au vikundi vya atomi. Kwa hiyo, alkanes huingia mmenyuko unaozunguka kupitia utaratibu wa kubadilika kwa kiasi kikubwa unaoashiria na isharaS ( kutoka Kiingerezabadala. radicalic.). Chini ya utaratibu huu, atomi za hidrojeni katika elimu ya juu, kisha kwa atomi za sekondari na za msingi za kaboni zinabadilishwa.
1. Halogenation.. Wakati mwingiliano wa alkanans na halogens (klorini na bromom) chini ya hatua ya mionzi ya UV au joto la juu, mchanganyiko wa bidhaa kutoka kwa mono- polyhalogen-substituted. Alkanans. Mchoro wa jumla wa mmenyuko huu umeonyeshwa juu ya mfano wa methane: /\u003e
b) ukuaji wa mlolongo. Radical ya klorini inachukua atomi ya hidrojeni kwenye Molekuli ya Alkane:
Cl.· Ch 4 → Na /\u003e l + ch 3 ·
Wakati huo huo, radical ya alkyl huundwa, ambayo inachukua atomi ya klorini kwenye molekuli ya klorini:
Ch 3 · + c l 2 → ch 3 na l + c l.·
Majibu haya yanarudiwa mpaka mzunguko unapopungua kulingana na moja ya athari:
Cl.· + Cl.· → na l /\u003e 2, ch 3 · ch 3 · → c 2 h 6, ch 3 · + Cl.· → ch 3 na l ·
Jumla ya mmenyuko wa mmenyuko:
| hV. | ||
| Ch 4 + SL 2. | → | Ch 3 Cl + HCl. |
Chloromethane ya kutengeneza inaweza kuwa chini ya klorini zaidi, kutoa mchanganyiko wa bidhaaCh 2. Cl. 2, CHCL 3, SS L 4 Kulingana na mpango (*).
Maendeleo ya nadharia ya mlolongo bure radical. Majibu yanahusiana sana na jina la mwanasayansi maarufu wa Kirusi, Laureate ya Tuzo ya Nobel N.I. Semenova (1896-1986).
2. NUTING (mmenyuko wa Konovalov). Chini ya hatua ya asidi ya nitriki kwa alkanes saa 140 ° C na shinikizo la chini linapita majibu makubwa: /\u003e
Na athari kubwa (halogenation, nitration), atomi hidrojeni katika elimu ya juu, kisha kwa atomi ya sekondari na ya msingi ya kaboni ni mchanganyiko. Hii inaelezwa na ukweli kwamba nyepesi ya atomi ya kaboni ya juu na hidrojeni (nishati ya kuunganisha 376 (390 kJ / mol), na tu basi - msingi (415 kJ / mol), ni rahisi.
3. Isomerization. Alkanes ya kawaida chini ya hali fulani inaweza kugeuka katika alkanes na mnyororo wa matawi: /\u003e
4. Kukabiliana ni kupasuka kwa hemolytic ya uhusiano wa C-C, ambayo inapita wakati joto na chini ya hatua ya kichocheo.
Wakati wa kupoteza kwa alkans, alkenes na alkanes ya chini hutengenezwa, Acetylene huundwa wakati wa kupoteza methane na ethane: /\u003e
C /\u003e 8 h 18 → C 4 h 10 + c 4N 8, /\u003e
2sh 4 → c 2 h 2 + zn 2,
C 2 h 6 → C 2 H 2 + 2N 2.
Majibu haya yana thamani kubwa ya viwanda. Kwa njia hii, sehemu ndogo za mafuta ya moto (mafuta ya mafuta) zinabadilishwa kuwa petroli, mafuta ya mafuta na bidhaa nyingine za thamani.
5. Oxidation. Kwa oxidation kali ya oksijeni ya methane mbele ya kichocheo mbalimbali, pombe ya methyl, formaldehyde, asidi ya aina inaweza kupatikana:
 |
Oxidation ya kichocheo cha butane ya oksijeni ya hewa - moja ya mbinu za viwanda za kuzalisha asidi ya asidi:
t.°
2 C 4 /\u003e H /\u003e 10 + 5 O /\u003e 2 → 4 CH /\u003e 3 COOH /\u003e + 2N 2 O .
Paka.
Juu ya alkana ya hewa Burn kwa CO 2 na H 2 O: /\u003e
Na n 2 N +2 + (S. n.+1) / 2o 2 \u003d n na 2 + (n +1) h 2 O.
Alkaans (kupunguza hidrokaboni, parafini)
- Alkana - Aliphatic (acyclic) hidrokaboni kali ambayo atomi za kaboni zinaunganishwa na uhusiano rahisi (moja) katika minyororo isiyo na matawi.
Alkana - Jina la hidrokaboni ya kikomo juu ya nomenclature ya kimataifa.
Parafini- Jina la kihistoria limeanzishwa, kuonyesha mali ya misombo hii (kutoka Lat. parrum Affinis. - Kuwa na ushirika mdogo, chini).
Kikomo, au imejaaHidrocarbons hizi zinaitwa kwa sababu ya kueneza kamili ya atomi za kaboni za hidrojeni.
Wawakilishi rahisi wa Alkanov:
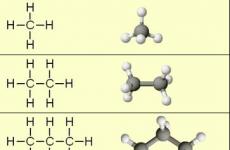
Molekuli mifano:


Wakati wa kulinganisha misombo hii ni wazi kwamba hutofautiana kwa kila mmoja kwa kikundi. -Ch 2 - (methylene.). Kuongeza kikundi kingine kwa propane. -Ch 2 -, Ninapata Bhutan. Kutoka 4 h 10., basi Alkana Kutoka 5 n 12., Kutoka 6 h 14. na kadhalika.
Sasa unaweza kuondoa formula ya jumla ya alkanans. Idadi ya atomi za kaboni mfululizo wa alkanov tutachukua n.
, basi idadi ya atomi ya hidrojeni itakuwa ukubwa 2N + 2.
. Kwa hiyo, muundo wa alkanov unafanana na formula ya jumla C n H 2n + 2..
Kwa hiyo, ufafanuzi huo unatumiwa:
Alkana - hidrokaboni ambao muundo unaonyeshwa na formula ya jumla C n H 2n + 2.wapi n. - Idadi ya atomi za kaboni.
Mfumo wa Alkanan.
Mfumo wa kemikali (Utaratibu wa misombo ya atomi katika molekuli) ya alkanes rahisi - methane, ethane na propane - kuonyesha formula yao ya kimuundo, iliyoonyeshwa katika kifungu cha 2. Kutoka kwa fomu hizi ni wazi kuwa kuna aina mbili za mahusiano ya kemikali katika Alkanes:
C-s. Na C-n..
Mawasiliano C-C ni covalent yasiyo ya polar. Mawasiliano C - H ni dhaifu dhaifu, kwa sababu Carbon na hidrojeni ni karibu na electronegability (2.5 - kwa kaboni na 2.1 - kwa hidrojeni). Uundaji wa vifungo vyema katika alkanes kutokana na jozi ya umeme ya kaboni na atomi za hidrojeni inaweza kuonyeshwa kwa kutumia formula za elektroniki:

Formula za elektroniki na miundo kutafakari. mfumo wa kemikaliLakini usipe mawazo kuhusu muundo wa anga wa molekuli.ambayo huathiri kwa kiasi kikubwa mali ya dutu hii.
Muundo wa anga.. Mpangilio wa jamaa wa atomi za molekuli katika nafasi hutegemea mwelekeo wa orbitals ya atomiki (AO) ya atomi hizi. Katika hydrocarbons, jukumu kuu linachezwa na mwelekeo wa anga wa orbitals ya kaboni, kwa kuwa 1S-Ao ya Spherical ya atomi ya hidrojeni inanyimwa mwelekeo fulani.
Mpangilio wa eneo la Carbon AO kwa upande hutegemea aina ya hybridization (Sehemu ya I, Sehemu ya 4.3). Atom tajiri ya kaboni katika alkanes inahusishwa na atomi nyingine nne. Kwa hiyo, hali yake inafanana na sp 3-hybridization (Sehemu ya I, Sehemu ya 4.3.1). Katika kesi hiyo, kila mmoja wa SP 3-mseto Carbon AO anahusishwa katika axial (σ-) kuingiliana kutoka s-ao hidrojeni au na SP 3 -AO ya atomi nyingine ya kaboni, na kuunda σ-dhamana na S-H au C-c.

Vifungo vinne vya kaboni vinaelekezwa katika nafasi kwa angle ya 109 ° C 28 ", ambayo inafanana na upungufu mdogo wa elektroni. Kwa hiyo, molekuli ya mwakilishi rahisi wa alkanes - methane ch 4 - ina fomu ya tetrahedron , katikati ambayo kuna atomi za kaboni, na kwa vertices - atomi za hidrojeni:

Corner ya valence ya N-C-N ni 109 о 28 ". Mfumo wa anga wa methane unaweza kuonyeshwa kwa kutumia wingi (wadogo) na mifano ya scalaline.
Kwa kurekodi ni rahisi kutumia formula ya spatial (stereoochémical).

Katika molekuli ya homologist ijayo - ethane na 2 h 6 - tetrahedral mbili sp. 3 mikeka ya kaboni huunda muundo wa anga zaidi:

Kwa molekuli za alkanov zilizo na atomi za kaboni zaidi ya 2, fomu za mviringo ni tabia. Hii inaweza kuonyeshwa juu ya mfano n.-Butan (Mfano wa VRML) au n.-Penta:

Isomeriya Alkanov.
- Isomerius - kuonekana kwa misombo ambayo ina muundo sawa (formula sawa ya molekuli), lakini muundo tofauti. Misombo hiyo inaitwa. isomaers..
Tofauti katika utaratibu wa kiwanja cha atomi katika molekuli (i.e. katika muundo wa kemikali) Kuongoza isomeria ya miundo.. Mfumo wa isomers ya kimuundo inaonekana na formula za kimuundo. Katika idadi ya alkanans, isomerism ya miundo inadhihirishwa wakati maudhui ya atomi 4 na zaidi ya kaboni katika mzunguko ni, i.e. Kuanzia na Bhutan na 4 h 10.
Ikiwa katika molekuli ya muundo huo huo na muundo huo wa kemikali, utaratibu wa aina mbalimbali za atomi katika nafasi inawezekana, kisha umezingatiwa isomerism ya anga (stereoisomeria). Katika kesi hiyo, matumizi ya formula ya kimuundo haitoshi na mifano ya molekuli au formula maalum inapaswa kutumika - stereochemical (anga) au makadirio.
Alkanes, kuanzia na ethane h 3 c-ch 3, iko katika aina mbalimbali za anga ( maelekezo) Kutokana na mzunguko wa intramolecular wa σ-viungo C-C, na kuonyesha kinachojulikana rotary (conformational) isomerism..
Aidha, ikiwa kuna atomi ya kaboni katika molekuli inayohusishwa na substituents 4 tofauti, aina nyingine ya isomerism ya anga inawezekana, wakati stereoisomers mbili ni ya kila mmoja kama kitu na picha yake ya kioo (kama vile mkono wa kushoto inahusu haki ). Tofauti kama hiyo katika muundo wa molekuli huitwa. isomeria ya macho..
Isomeria ya miundo Alkanov.
- Isomers ya miundo - misombo ya muundo huo, unaojulikana na utaratibu wa atomi za kumfunga, i.e. Mfumo wa kemikali ya molekuli.
Sababu ya udhihirisho wa isomerism ya miundo mfululizo wa alkans ni vifaa vya atomi za kaboni ili kuunda nyaya za miundo mbalimbali. Aina hii ya isomerism ya miundo inaitwa isomeria kaboni mifupa..
Kwa mfano, muundo wa alkan c 4 h 10 inaweza kuwepo kama mbili Isomers ya miundo:

na alkan c 5 h 12 - kwa fomu tatu. Isomers ya miundo, inayojulikana na muundo wa mnyororo wa kaboni:

Pamoja na ongezeko la idadi ya atomi za kaboni katika muundo wa molekuli, uwezekano wa kuunganisha mlolongo, i.e. Kiasi cha isomers kinaongezeka kizingiti cha idadi ya atomi za kaboni.

Isomers ya miundo inajulikana na mali ya kimwili. Alkanes na muundo wa matawi kutokana na ufungaji mdogo wa molekuli na, kwa hiyo, ushirikiano mdogo wa intermolecular, chemsha joto kuliko isomers yao isiyo ya kawaida.
Katika pato la kanuni za kimuundo za isomers, mbinu zifuatazo zinatumia.
Hydrocarbons ni misombo ya kikaboni rahisi. Wao ni kaboni na hidrojeni. Misombo ya vipengele hivi viwili vinaitwa kikomo hidrokaboni au alkanes. Utungaji wao unaonyeshwa kwa ujumla kwa Alkanes na formula ya CNH2N + 2, ambapo n ni idadi ya atomi za kaboni.
Katika kuwasiliana na
Odnoklassniki.
Alkana - Jina la Kimataifa la Misombo ya Data.. Pia, misombo hii inaitwa parafini na hidrokaboni zilizojaa. Mawasiliano katika molekuli ya alkanan ni rahisi (au moja). Valence iliyobaki imejaa atomi za hidrojeni. Alkanes zote zimejaa hidrojeni hadi kikomo, atomi zake ziko katika hali ya hybridization ya SP3.
Aina ya homological ya hidrokaboni
 Ya kwanza katika mstari wa homologous ya hidrokaboni iliyojaa ni methane. Formula yake ch4. Mwisho ni - kwa jina la kuzuia hidrokaboni, ni kipengele tofauti. Kisha, kwa mujibu wa formula ya hapo juu, ethane - C2H6 iko katika mfululizo wa homologous, C3H8 Propane, Butane - C4H10.
Ya kwanza katika mstari wa homologous ya hidrokaboni iliyojaa ni methane. Formula yake ch4. Mwisho ni - kwa jina la kuzuia hidrokaboni, ni kipengele tofauti. Kisha, kwa mujibu wa formula ya hapo juu, ethane - C2H6 iko katika mfululizo wa homologous, C3H8 Propane, Butane - C4H10.
Kutoka alkana ya tano Mfululizo wa homologous ya majina ya misombo huundwa kama ifuatavyo: namba ya Kigiriki inayoonyesha idadi ya atomi za hidrokaboni katika molekuli + mwisho -n. Kwa hiyo, katika garcari, nambari ya 5 - pande, kwa mtiririko huo, Pentan - C5H12 inakwenda kwa Bhutan. Next - Hexane C6H14. Heptane - C7H16, OCadan - C8H18, Nonane - C9H20, Dean - C10H22, nk.
Mali ya kimwili ya alkanans yanabadilika kwa kiasi kikubwa katika mfululizo wa homologous: hatua ya kiwango, kiwango cha kuchemsha huongezeka, wiani huongezeka. Methane, ethane, propane, butane chini ya hali ya kawaida, i.e. kwa joto la takriban 22 digrii ya joto Celsius, ni gesi, na Pentane juu ya hexadecan jumuishi - liquids, na heptecan - solids. Kuanzia na Bhutan, Alkanan ina isomers.
Kuna meza zinazoonyesha mabadiliko katika mstari wa homologous wa alkanans.ambayo inaonyesha wazi mali zao za kimwili.
Nomenclature ya hidrokaboni iliyojaa, derivatives yao.
 Ikiwa atomi ya hidrojeni imetenganishwa na molekuli ya hidrocarbon, chembe za moongozi zinaundwa, ambazo huitwa radicals (R). Jina la radical hutoa hydrocarbon, ambayo hii radical inazalishwa, wakati mwisho -nn mabadiliko hadi mwisho. Kwa mfano, radical kali ya methyl hutengenezwa kutoka methane wakati wa kutenganishwa kwa atomi ya hidrojeni, kutoka kwa ethane - ethyl, kutoka propane - propyl, nk.
Ikiwa atomi ya hidrojeni imetenganishwa na molekuli ya hidrocarbon, chembe za moongozi zinaundwa, ambazo huitwa radicals (R). Jina la radical hutoa hydrocarbon, ambayo hii radical inazalishwa, wakati mwisho -nn mabadiliko hadi mwisho. Kwa mfano, radical kali ya methyl hutengenezwa kutoka methane wakati wa kutenganishwa kwa atomi ya hidrojeni, kutoka kwa ethane - ethyl, kutoka propane - propyl, nk.
Radicals pia hutengenezwa misombo isiyo ya kawaida. Kwa mfano, katika asidi ya nitriki, inawezekana kupata radical monovalent -No2 radical, ambayo inaitwa nitroup.
Wakati wa kutenganisha na molekuli. Alkan atomi mbili hidrojeni zinaundwa na radicals bivali, majina ambayo pia yanaundwa kutoka kwa jina la hidrokaboni sambamba, lakini mabadiliko ya mwisho kwa:
- orin, katika tukio ambalo atomi za hidrojeni zimevunjwa kutoka kwa atomi moja ya kaboni,
- ilen, katika tukio ambalo atomi mbili za hidrojeni zimevunjwa kutoka kwa atomi mbili za jirani za kaboni.
Alkana: mali ya kemikali
Fikiria athari ya sifa za alkanans. Alkanes zote ni asili katika mali ya kemikali ya jumla. Dutu hizi ni chini-kazi.
Athari zote zinazojulikana zinazohusisha hidrokaboni zimegawanywa katika aina mbili:
- mawasiliano S-H (mfano ni mmenyuko mbadala);
- gAP ya Mawasiliano C-C (kufuta, malezi ya sehemu binafsi).
Kazi sana wakati wa malezi makubwa. Kwao wenyewe, wana sehemu za sekunde. Radicals huingia kwa urahisi majibu kati yao wenyewe. Elektroni zao zisizohifadhiwa huunda uhusiano mpya. Mfano: CH3 + CH3 → C2H6.
Radicals huingia kwa urahisi na molekuli ya kikaboni. Wao ni ama kujiunga nao, au kutengwa na wao elektroni isiyoweza kutokea kutoka kwao, kama matokeo ya radicals mpya kuonekana, ambayo kwa upande wake, inaweza kuingia katika athari na molekuli nyingine. Kwa mmenyuko huo wa mnyororo, macromolecules hupatikana, ambayo huacha kukua tu wakati unapovunja mlolongo (mfano: uhusiano wa radicals mbili)
Athari za radicals bure kuelezea michakato mingi muhimu ya kemikali, kama vile:
- Milipuko;
- Oxidation;
- Mafuta ya kupoteza;
- Upolimishaji wa misombo isiyosawazishwa.
 Maelezo. fikiria mali ya kemikali Hidrokaboni zilizojaa juu ya mfano wa methane. Tumezingatia tayari muundo wa molekuli ya alkane. Atomi za kaboni ziko katika molekuli ya methane katika hali ya hybridization ya SP3, na uhusiano wa muda mrefu zaidi hutengenezwa. Methane ni msingi wa gesi ya harufu na rangi. Ni rahisi kuliko hewa. Katika maji kutengenezea kidogo.
Maelezo. fikiria mali ya kemikali Hidrokaboni zilizojaa juu ya mfano wa methane. Tumezingatia tayari muundo wa molekuli ya alkane. Atomi za kaboni ziko katika molekuli ya methane katika hali ya hybridization ya SP3, na uhusiano wa muda mrefu zaidi hutengenezwa. Methane ni msingi wa gesi ya harufu na rangi. Ni rahisi kuliko hewa. Katika maji kutengenezea kidogo.
Alkana inaweza kuchoma. Methane inawaka na moto wa bluu. Katika kesi hiyo, matokeo ya mmenyuko itakuwa monoxide ya kaboni na maji. Wakati umechanganywa na hewa, pamoja na mchanganyiko na oksijeni, hasa ikiwa uwiano wa kiasi ni 1: 2, data ya aina ya hydrocarbon inajumuisha mchanganyiko wa kulipuka, ndiyo sababu ni hatari sana kwa matumizi katika maisha ya kila siku na migodi. Ikiwa methane huwaka kabisa, soti hutengenezwa. Katika sekta, hivyo hupatikana.
Formaldehyde na pombe ya methyl hupatikana kutoka methane na oxidation mbele ya kichocheo. Ikiwa methane ni joto kali, linaangamiza na formula ya CH4 → C + 2H2
Kuoza methane. Unaweza kutekeleza kwa bidhaa za kati katika vifuniko maalum vya vifaa. Bidhaa ya kati itakuwa acetylene. Mfumo wa majibu 2ch4 → C2H2 + 3h2. Kuondolewa kwa acetylene kutoka methane hupunguza gharama za uzalishaji karibu mara mbili.
Pia, hidrojeni pia hupatikana kutoka methane, kuzalisha uongofu wa methane na mvuke wa maji. Tabia ya methane ni athari za kubadilisha. Kwa hiyo, kwa joto la kawaida, hidrojeni kutoka molekuli ya methane ni makazi yao kwa mwanga wa halogen (CL, BR). Hivyo, vitu vinaundwa, vinavyoitwa derivatives halogen. Chlorini atomi, kuchukua nafasi ya atomi hidrojeni katika molekuli ya hydrocarbon, fanya mchanganyiko wa uhusiano tofauti.
Katika mchanganyiko huo kuna chloromethane (CH3 cl au methyl kloridi), dichloromethane (ch2cl2ili methylene kloridi), trichloromethane (Chcl3 au chloroform), tetrachloromethane (CCL4 au kaboni tetrachloride).
Yoyote ya misombo hii inaweza kutengwa na mchanganyiko. Katika uzalishaji, chloroform na tetrachloromethane ni umuhimu wa nje, kutokana na ukweli kwamba wao ni solvents ya misombo ya kikaboni (mafuta, resini, mpira). Halogen derivatives hutengenezwa na utaratibu wa mnyororo wa bure.
Mwanga huathiri molekuli ya klorini, kama matokeo ambayo wao hugawanyika Radicals isiyo ya kawaida ambayo huvunja atomi ya hidrojeni na elektroni moja kutoka molekuli ya methane. Wakati huo huo, HCl na methyl huundwa. Methyl humenyuka na molekuli ya klorini, na kusababisha uharibifu wa halogen na klorini radical. Kisha, radical ya klorini inaendelea mmenyuko wa mnyororo.
Kwa joto la kawaida, methane ina upinzani wa kutosha kwa alkali, asidi, oxidizers nyingi. Uzoefu - asidi ya nitriki. Jibu hilo linaundwa nitromethane na maji.
Majibu ya uunganisho ya methane sio tabia, kwa kuwa kila thamani katika molekuli yake imejaa.
Athari ambazo hidrokaboni zinaweza kutokea sio tu kwa kugawanyika kwa uhusiano wa C-H, lakini pia kwa kuvunjika kwa C-s. Mabadiliko hayo hutokea mbele ya joto la juu. na kichocheo. Athari hizo ni pamoja na dehydrogenation na kupoteza.
Ya hidrokaboni iliyojaa na oxidation, asidi hupatikana - acetic (kutoka butane), asidi ya mafuta (kutoka parafini).
Kupata methane.
 Katika hali ya methane. Upana mkubwa. Ni sehemu kuu ya idadi kubwa ya gesi za asili na za bandia. Inajulikana kutoka kwa mabwawa ya makaa ya mawe katika migodi, kutoka chini ya bwawa. Gesi za asili (ambazo zinaonekana sana katika gesi zinazohusiana na mashamba ya petroli) hazina methane tu, bali pia alkanes nyingine. Matumizi ya vitu hivi ni tofauti. Wao hutumiwa kama mafuta, katika viwanda mbalimbali, katika dawa na teknolojia.
Katika hali ya methane. Upana mkubwa. Ni sehemu kuu ya idadi kubwa ya gesi za asili na za bandia. Inajulikana kutoka kwa mabwawa ya makaa ya mawe katika migodi, kutoka chini ya bwawa. Gesi za asili (ambazo zinaonekana sana katika gesi zinazohusiana na mashamba ya petroli) hazina methane tu, bali pia alkanes nyingine. Matumizi ya vitu hivi ni tofauti. Wao hutumiwa kama mafuta, katika viwanda mbalimbali, katika dawa na teknolojia.
Chini ya hali ya maabara, gesi hii imetengwa wakati mchanganyiko unapowashwa na hidroksidi ya sodiamu + hidroksidi ya sodiamu, pamoja na majibu ya alumini na carbide ya maji. Pia methane hupatikana kutoka kwa vitu rahisi. Kwa hali hii ya lazima Inapokanzwa na kichocheo. Umuhimu wa viwanda ni kupata awali ya methane kulingana na mvuke wa maji.
Methane na homologs zake zinaweza kupatikana kwa kuhesabu chumvi za asidi zinazofaa za kikaboni na alkali. Njia nyingine ya kupata alkanans ni mmenyuko wa Würz, ambapo uzalishaji wa monogaenic na sodiamu ya chuma ni moto.