Алкани взаємодіють з воднем. Міжнародна номенклатура алканів. Алкани: будова, властивості. Хімічні властивості ароматичних вуглеводнів
Граничні вуглеводні - це такі сполуки, які представляють собою молекули, що складаються з атомів вуглецю, що знаходяться в стані гібридизації sp 3. Вони пов'язані між собою виключно ковалентними сигма-зв'язками. Назва «граничні» або «насичені» вуглеводні виходить з того факту, що ці сполуки не мають можливості приєднувати будь-які атоми. Вони граничні, повністю насичені. Виняток становлять Циклоалкани.
Що таке алкани?
Алкани - це вуглеводні граничні, а їх вуглецевий ланцюг незамкнута і складається з атомів вуглецю, пов'язаних між собою за допомогою одинарних зв'язків. Вона не містить інших (тобто подвійних, як у алкенов, або ж потрійних, як у алкілів) зв'язків. Алкани також називають парафинами. Це назву вони отримали, так як загальновідомі парафіни є сумішшю переважно даних граничних вуглеводнів С 18 -С 35 з особливою інертністю.
Загальні відомості про алканах і їх радикалах
Їх формула: С n Р 2 n +2, тут n більше або дорівнює 1. Молярна маса обчислюється за формулою: М \u003d 14n + 2. Характерна особливість: закінчення в їхніх назвах - «ан». Залишки їх молекул, які утворюються в результаті заміщення водневих атомів на інші атоми, мають назву аліфатичних радикалів, або алкілів. Їх позначають буквою R. Загальна формула одновалентних аліфатичних радикалів: З n Р 2 n +1, тут n більше або дорівнює 1. Молярна маса аліфатичних радикалів обчислюється за формулою: М \u003d 14n + 1. Характерна особливість аліфатичних радикалів: закінчення в назвах «- мул ». Молекули алканів мають свої особливості будови:
- зв'язок С-С характеризується довжиною 0,154 нм;
- зв'язок С-Н характеризується довжиною 0,109 нм;
- валентний кут (кут між зв'язками вуглець-вуглець) дорівнює 109 градусів і 28 хвилин.

Починають гомологічний ряд алкани: метан, етан, пропан, бутан і так далі.
Фізичні властивості алканів
Алкани - це речовини, які не мають кольору і нерозчинні у воді. Температура, при якій алкани починають плавитися, і температура, при якій вони закипають, підвищуються відповідно до збільшення молекулярної маси і довжини вуглеводневого ланцюга. Від менш розгалужених до більш розгалуженим алканами температури кипіння і плавлення знижуються. Газоподібні алкани здатні горіти блідо-блакитним або безбарвним полум'ям, при цьому виділяється досить багато тепла. СН 4-С 4 Н 10 представляють собою гази, у яких відсутня також і запах. З 5 Н 12-С 15 Н 32 - це рідини, які володіють специфічним запахом. З 15 Н 32 і так далі - це тверді речовини, які також не мають запаху.
Хімічні властивості алканів
Дані сполуки є малоактивними в хімічному плані, що можна пояснити міцністю трудноразриваемих сигма-зв'язків - С-С і С-Н. Також варто враховувати, що зв'язку С-С неполярних, а С-Н малополярни. Це малополярізуемие види зв'язків, що відносяться до сигма-виду і, відповідно, розриватися по найбільшої ймовірності вони стануть за механізмом гомолитически, в результаті чого будуть утворюватися радикали. Таким чином, хімічні властивості алканів в основному обмежуються реакціями радикального заміщення.

реакції нітрування
Алкани взаємодіють тільки з азотною кислотою з концентрацією 10% або з оксидом чотирьохвалентного азоту в газовому середовищі при температурі 140 ° С. Реакція нітрування алканів носить назву реакції Коновалова. В результаті утворюються нитросоединения і вода: CH 4 + азотна кислота (розбавлена) \u003d CH 3 - NO 2 (нитрометан) + вода.
реакції горіння
Граничні вуглеводні дуже часто застосовуються як паливо, що обгрунтовано їх здатністю до горіння: З n Р 2n + 2 + ((3n + 1) / 2) O 2 \u003d (n + 1) H 2 O + n СО 2.
реакції окислення
В хімічні властивості алканів також входить їх здатність до окислення. Залежно від того, які умови супроводжують реакцію і як їх змінюють, можна з одного і того ж речовини отримати різні кінцеві продукти. М'яке окислення метану киснем при наявності каталізатора, що прискорює реакцію, і температури близько 200 ° С може дати в результаті такі речовини:
1) 2СН 4 (окислення киснем) \u003d 2СН 3 ОН (спирт - метанол).
2) СН 4 (окислення киснем) \u003d СН 2 О (альдегід - формальдегід або формальдегід) + Н 2 О.
3) 2СН 4 (окислення киснем) \u003d 2НСООН (карбонова кислота - метанова або мурашина) + 2Н 2 О.

Також окислення алканів може проводитися в газоподібному або рідкому середовищі повітрям. Такі реакції призводять до утворення вищих жирних спиртів і відповідних кислот.
Ставлення до нагрівання
При температурах, що не перевищують + 150-250 ° С, обов'язково в присутності каталізатора, відбувається структурна перебудова органічних речовин, яка полягає в зміні порядку з'єднання атомів. Даний процес називається изомеризацией, а речовини, отримані в результаті реакції - ізомерами. Таким чином, з нормального бутану виходить його ізомер - ізобутан. При температурах 300-600 ° С і наявності каталізатора відбувається розрив зв'язків С-Н з утворенням молекул водню (реакції дегідрування), молекул водню з замиканням вуглецевого ланцюга в цикл (реакції циклізації або ароматизації алканів):
1) 2СН 4 \u003d \u200b\u200bС 2 Н 4 (етен) + 2Н 2.
2) 2СН 4 \u003d \u200b\u200bС 2 Н 2 (Етін) + 3Н 2.
3) З 7 Н 16 (нормальний гептан) \u003d С 6 Н 5 - СН 3 (толуол) + 4Н 2.

реакції галогенування
Такі реакції полягають у введенні в молекулу органічної речовини галогенів (їх атомів), в результаті чого утворюється зв'язок С-галоген. При взаємодії алканів з галогенами утворюються галогенопохідні. Дана реакція має специфічні особливості. Вона протікає по механізму радикальному, і щоб її проініціювати, необхідно на суміш галогенів і алканів впливати ультрафіолетовим випромінюванням або ж просто нагріти її. Властивості алканів дозволяють реакції галогенування протікати, поки не буде досягнуто повне заміщення на атоми галогену. Тобто хлорування метану не закінчиться однією стадією і отриманням метилхлорида. Реакція піде далі, будуть утворюватися всі можливі продукти заміщення, починаючи з хлорметана і закінчуючи тетрахлорметаном. Вплив хлору при даних умовах на інші алкани призведе до утворення різних продуктів, отриманих в результаті заміщення водню у різних атомів вуглецю. Від температури, при якій йде реакція, буде залежати співвідношення кінцевих продуктів і швидкість їх утворення. Чим довше вуглеводнева ланцюг алкана, тим легше буде йти дана реакція. При Галогенування спочатку буде заміщатися атом вуглецю найменш гідрування (третинний). Первинний вступить в реакцію після всіх інших. Реакція галогенування відбуватиметься поетапно. На першому етапі замістити тільки один атом водню. C розчинами галогенів (хлорного і бромної водою) алкани не взаємодіють.

реакції сульфохлорування
Хімічні властивості алканів також доповнюються реакцією сульфохлорування (вона носить назву реакції Ріда). При впливі ультрафіолетового випромінювання алкани здатні реагувати з сумішшю хлору і діоксиду сірки. В результаті утворюється хлороводень, а також алкільний радикал, який приєднує до себе діоксид сірки. В результаті виходить складне з'єднання, яке стає стабільним завдяки захопленню атома хлору і руйнування черговий його молекули: R-H + SO 2 + Cl 2 + ультрафіолетове випромінювання \u003d R-SO 2 Cl + HCl. Утворилися в результаті реакції сульфонілхлоріди знаходять широке застосування у виробництві поверхнево-активних речовин.
Найпростішими органічними сполуками є вуглеводні, Що складаються з вуглецю і водню. Залежно від характеру хімічних зв'язків в вуглеводнях і співвідношення між вуглецем і воднем вони поділяються на граничні і ненасичені (алкени, алкіни і ін.)
граничнимивуглеводнями (алканами, вуглеводнями метанового ряду) називаються сполуки вуглецю з воднем, в молекулах яких кожен атом вуглецю витрачає на з'єднання з будь-яким іншим сусіднім атомом не більше однієї валентності, причому, все не витрачені на з'єднання з вуглецем валентності насичені воднем. Всі атоми вуглецю в алканах знаходяться в sp 3 - стані. Граничні вуглеводні утворюють гомологічний ряд, який характеризується загальною формулою З n Н 2n + 2 . Родоначальником цього ряду є метан.
Ізомерія. Номенклатура.
Алкани з n \u003d 1,2,3 можуть існувати тільки у вигляді одного ізомеру
Починаючи з n \u003d 4, з'являється явище структурної ізомерії.

Число структурних ізомерів алканів швидко зростає зі збільшенням числа вуглецевих атомів, наприклад, пентан має 3 ізомери, гептан - 9 і т.д.
Число ізомерів алканів збільшується і за рахунок можливих стереоізомерів. Починаючи з C 7 Н 16 можливе існування хіральних молекул, які утворюють два енантіомера.
Номенклатура алканів.
Домінуючою номенклатурою є номенклатура IUPAC. У той же час в ній присутні елементи тривіальних назв. Так, перші чотири члени гомологічного ряду алканів мають тривіальні назви.
СН 4 - метан
З 2 Н 6 - етан
З 3 Н 8 - пропан
З 4 Н 10 - бутан.
Назви інших гомологів утворені від грецьких латинських числівників. Так, для наступних членів ряду нормального (неразветвленного) будови використовуються назви:
З 5 Н 12 - пентан, С 6 Н 14 - гексан, С 7 Н 18 - гептан,
З 14 Н 30 - тетрадекан, С 15 Н 32 - пентадекан і т.д.
Основні правила IUPAC для розгалужених алканів
а) вибирають найбільш довгу неразветвленную ланцюг, назва якої становить основу (корінь). До цієї основи додають суфікс "ан"
б) нумерують цей ланцюг за принципом найменших локантов,
в) заступник вказують у вигляді префіксів в алфавітному порядку із зазначенням місця знаходження. Якщо при родоначальної структурі знаходяться кілька однакових заступників, то їх кількість вказують грецькими числівниками.
Залежно від числа інших вуглецевих атомів, з якими безпосередньо пов'язаний розглянутий вуглецевий атом, розрізняють: первинні, вторинні, третинні і четвертинні вуглецеві атоми.


Як заступників в розгалужених алканів фігурують алкіли або алкільні радикали, які розглядаються як результат відщеплення від молекули алкана одного водневого атома.
Назва алкільних груп утворюють від назви відповідних алканів шляхом заміни останніх суфікса "ан" на суфікс "мул".
СН 3 - метил
СН 3 СН 2 - етил
СН 3 СН 2 СН 2 - пропив

Для назви розгалужених алкільних груп використовують також нумерацію ланцюга:

Починаючи з етану, алкани здатні утворювати конформери, яким відповідає загальмована конформація. Можливість переходу однієї загальмованою конформації в іншу через заслоненного визначається бар'єром обертання. Визначення структури, складу конформеров і бар'єрів обертання є завданнями конформационного аналізу. Методи отримання алканів.
1. Фракційна перегонка природного газу або бензинової фракції нафти.Таким способом можна виділяти індивідуальні алкани до 11 вуглецевих атомів.
2. Гідрування вугілля.Процес проводять в присутності каталізаторів (оксиди і сульфіди молібдену, вольфраму, нікелю) при 450-470 о С і тисках до 30 МПа. Вугілля і каталізатор розтирають в порошок і в суспендованих вигляді гидрируются, борботіруя водень через суспензію. Що виходять суміші алканів і циклоалканов використовують в якості моторного палива.
3. Гідрування СО і СО 2 .
СО + Н 2 алкани
СО 2 + Н 2 алкани
В якості каталізаторів цих реакцій використовують Со, Fe, та ін. D - елементи.
4. Гідрування алкенів і алкінів.

5. Металоорганічного синтез.
а). Синтез Вюрца.
2RHal + 2Na R R + 2NaHal
Цей синтез малопридатний, якщо в якості органічних реагентів використовують два різних галогеналкани.
б). Протолізу реактивів Гриньяра.
R Hal + Mg RMgHal
RMgHal + HOH RH + Mg (OH) Hal
в). Взаємодія діалкілкупратов літію (LiR 2 Cu) з алкилгалогенидами
LiR 2 Cu + R X R R + RCu + LiX
Самі діалкілкупрати літію отримують двохстадійною способом
2R Li + CuI LiR 2 Cu + LiI
6. Електроліз солей карбонових кислот (синтез Кольбе).
2RCOONa + 2H 2 O R R + 2CO 2 + 2NaOH + H 2

7. Сплавлення солей карбонових кислот з лугами.
Реакція використовується для синтезу нижчих алканів.
8. Гідрогеноліз карбонільних з'єднань і галогеналканов.
а). Карбонільні сполуки. Синтез Клемменсена.

б). Галогеналкани. Каталітичний гидрогенолиз.
![]()
Використовують як каталізатори Ni, Pt, Pd.
в) галогеналкани. Реагентне відновлення.
RHal + 2HI RH + HHal + I 2
Хімічні властивості алканів.
Все зв'язку в алканах малополярние, з цього для них характерні радикальні реакції. Відсутність пі-зв'язків унеможливлює реакції приєднання. Для алканів характерні реакції заміщення, відщеплення, горіння.
|
Тип і назва реакції | |
|
1. реакції заміщення | |
|
А) з галогенами (з хлоромCl 2 -на світла, Br 2 - при нагріванні) Реакція підпорядковується правилом Марковника (Правила Марковникова) - в першу чергу галоген заміщає водень у найменш гідрованого атома вуглецю. Реакція проходить поетапно - за один етап заміщається не більше одного атома водню. Найважче реагує йод, і до того ж реакція не йде до кінця, так як, наприклад, при взаємодії метану з йодом утворюється йодистий водень, що реагує з йодистим метилом з утворенням метану і йоду (оборотна реакція): |
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан) CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан) CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (тріхлорметан) CHCl 3 + Cl 2 → CCl 4 + HCl (Тетрахлорметан). |
|
Б) Нітрування (Реакція Коновалова) Алкани реагують з 10% розчином азотної кислоти або оксидом азоту N 2 O 4 в газовій фазі при температурі 140 ° і невеликому тиску з утворенням нітропохідних. Реакція так само підпорядковується правилу Марковникова. Один з атомів водню замінюється на залишок NO 2 (нітрогрупа) і виділяється вода |
|
|
2. Реакції відщеплення | |
|
А) дегидрирование -отщепленіе водню. Умови реакції каталізатор -платіна і температура. |
CH 3 - CH 3 → CH 2 \u003d CH 2 + Н 2 |
|
Б) крекінг процес термічного розкладання вуглеводнів, в основі якого лежать реакції розщеплення вуглецевого ланцюга великих молекул з утворенням сполук з більш коротким ланцюгом. При температурі 450-700 o С алкани розпадаються за рахунок розриву зв'язків С-С (більш міцні зв'язки С-Нпрі такій температурі зберігаються) і утворюються алкани і алкени з меншим числом вуглецевих атомів |
C 6 H 14 C 2 H 6 + C 4 H 8 |
|
В) повне термічне розкладання |
СН 4 C + 2H 2 |
|
3. Реакції окислення | |
|
А) реакція горіння При підпалюванні (t \u003d 600 o С) алкани вступають в реакцію з киснем, при цьому відбувається їх окислення до вуглекислого газу і води. |
З n Н 2n + 2 + O 2 -\u003e CO 2 + H 2 O + Q СН 4 + 2O 2 -\u003e CO 2 + 2H 2 O + Q |
|
Б) Каталітичне окислення- при відносно невисокій температурі і з застосуванням каталізаторів супроводжується розривом тільки частини зв'язків С-Спрімерно в середині молекули і С-Н і використовується для отримання цінних продуктів: карбонових кислот, кетонів, альдегідів, спиртів. |
Наприклад, при неповному окисленні бутану (розрив зв'язку С 2-С 3) отримують оцтову кислоту |
|
4. реакції ізомеризації арактерной не для всіх алканів. Звертається увага на можливість перетворення одних ізомерів в інші, наявність каталізаторів. |
З 4 Н 10 C 4 H 10 |
|
5.. Алкани з основним ланцюгом в 6 і більше атомів вуглецю також вступають в реакцію дегидроциклизации, але завжди утворюють 6-членний цикл (циклогексан і його похідні). В умовах реакції цей цикл піддається подальшому дегидрированию і перетворюється в енергетично більш стійкий бензоловий цикл ароматичного вуглеводню (арена). |
|
Механиз реакції галогенування:
Галогенування
Галогенування алканів протікає за радикальним механізмом. Для ініціювання реакції необхідно суміш алкана і галогену опромінити УФ-світлом або нагріти. Хлорування метану не зупиняється на стадії отримання метилхлорида (якщо взяті еквімолярних кількості хлору і метану), а призводить до утворення всіх можливих продуктів заміщення, від метилхлорида до тетрахлорвуглець. Хлорування інших алканів приводить до суміші продуктів заміщення водню у різних атомів вуглецю. Співвідношення продуктів хлорування залежить від температури. Швидкість хлорування первинних, вторинних і третинних атомів залежить від температури, при низькій температурі швидкість зменшується в ряді: третинний, вторинний, первинний. При підвищенні температури різниця між швидкостями зменшується до тих пір, поки не стає однаковою. Крім кінетичного фактора на розподіл продуктів хлорування впливає статистичний фактор: ймовірність атаки хлором третинного атома вуглецю в 3 рази менше, ніж первинного і в два рази менше ніж вторинного. Таким чином хлорування алканів є нестереоселектівной реакцією, крім випадків, коли можливий тільки один продукт монохлорірованія.
Галогенування - це одна з реакцій заміщення. Галогенування алканів підпорядковується правилу Марковника (Правила Марковникова) - в першу чергу галогеніруются найменш гідрування атом вуглецю. Галогенування алканів проходить поетапно - за один етап галогеніруются не більше одного атома водню.
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (тріхлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl (Тетрахлорметан).
Під дією світла молекула хлору розпадається на атоми, потім вони атакують молекули метану, відриваючи у них атом водню, в результаті цього утворюються метильние радикали СН 3, які стикаються з молекулами хлору, руйнуючи їх і утворюючи нові радикали.
Нітрування (Реакція Коновалова)
Алкани реагують з 10% розчином азотної кислоти або оксидом азоту N 2 O 4 в газовій фазі при температурі 140 ° і невеликому тиску з утворенням нітропохідних. Реакція так само підпорядковується правилу Марковникова.
RH + HNO 3 \u003d RNO 2 + H 2 O
т. е. один з атомів водню замінюється на залишок NO 2 (ні-трогруппа) і виділяється вода.
Особливості будови ізомерів сильно відбиваються на перебігу цієї реакції, так як найлегше вона веде до заміщення на нітрогрупу атома водню в залишку СІ (наявному лише в деяких ізомери), менш легко заміщується водень в групі СН 2 і ще важче - в залишку СН 3.
Парафін досить легко нітрит в газовій фазі при 150-475 ° С двоокисом азоту або парами азотної кислоти; при цьому відбувається частково і. окислення. Нитрованием метану виходить майже виключно нитрометан:
Всі наявні дані вказують на вільнорадикальних механізм. В результаті реакції утворюються суміші продуктів. Азотна кислота при звичайній температурі майже не діє на парафінові вуглеводні. При нагріванні ж діє головним чином як окислювач. Однак, як знайшов М. І. Коновалов (1889), при нагріванні азотна кислота діє частково і «Нітра» чином; особливо добре йде реакція нітрування зі слабкою азотною кислотою при нагріванні і підвищеному тиску. Реакція нітрування виражається рівнянням.
Наступні за метаном гомологи дають суміш різних нітропарафінов внаслідок попутно йде розщеплення. При нитровании етану виходять нітроетан СН 3-СН 2 -NO 2 і нитрометан СН 3 -NO 2. З пропану утворюється суміш нітропарафінов:
Нітрування парафінів в газовій фазі тепер здійснюється в промисловому масштабі.
Сульфахлорірованіе:
Важливою в практичному відношенні реакцією є сульфохлорування алканів. При взаємодії алкана з хлором і сірчистим ангідридом при опроміненні відбувається заміщення водню на хлорсульфонільную групу:

Стадії цієї реакції:
Cl + R: H → R + HCl
R + SO 2 → RSO 2
RSO 2 + Cl: Cl → RSO 2 Cl + Cl
Алкансульфохлоріди легко гідролізуються до алкансульфоксілост (RSO 2 OH), натрієві солі яких (RSO 3¯ Na + - алкансульфонат натрію) проявляють властивості, подібні до мила, і застосовуються в якості детерагентов.
Фізичні властивості. У звичайних умовах перші чотири члени гомологічного ряду алканів (С1 - З 4) - гази. Нормальні алкани від пентану до гептадекан (C 5 - C 17 ) - рідини, починаючи з З 18 і вище - тверді речовини. У міру збільшення числа атомів вуглецю в ланцюзі, тобто з ростом відносної молекулярної маси, зростають температури кипіння і плавлення алканів. При однаковому числі атомів вуглецю в молекулі алкани з розгалуженим будовою мають більш низькі температури кипіння, ніж нормальні алкани.
алкани практично нерозчинні в воді, так як їх молекули малополярни і не взаємодіють з молекулами води, вони добре розчиняються в неполярних органічних розчинниках, таких як бензол, Тетрахлорметан і ін. Рідкі алкани легко змішуються один з одним.
Основні природні джерела алканів - нафта і природний газ. Різні фракції нафти містять алкани відC 5 H 12 до З 30 Н 62. Природний газ складається з метану (95%) з домішкою етану і пропану.
з синтетичних методів отриманняалканів можна виділити наступні: /\u003e
1. Отримання з ненасичених вуглеводнів. Взаємодія алкенов або алкинов з воднем ( "гідрування") відбувається в присутності металевих каталізаторів (/\u003e Ni, Pd ) при
нагріванні:
СН з - C ≡СН +2 Н 2 → СН 3-СН 2-СН 3.
2. отримання з галогенпротводних. При нагріванні моногалогензамещенних алканів з металевим натрієм отримують алкани з подвоєним числом атомів вуглецю (реакція Вюрца): /\u003e
З 2 Н 5 Br + 2 Na + Br - C 2 H 5 → C 2 H 5 - C 2 H 5 + 2 NaBr.
Подібну реакцію не проводять з двома різними галогензамещеннимі алканами, оскільки при цьому виходить суміш трьох різних алканів
3. Отримання з солей карбонових кислот. При сплаві безводних солей карбонових кислот з лугами виходять алкани, що містять на один атом вуглецю менше в порівнянні з вуглецевим ланцюгом вихідних карбонових кислот: /\u003e
4 Отримані метану. В електричній дузі, що горить в атмосфері водню, утворюється значна кількість метану: /\u003e
З + 2Н 2 → СН 4 .
Така ж реакція йде при нагріванні вуглецю в атмосфері водню до 400-500 ° С при підвищеному тиску в присутності каталізатора.
У лабораторних умовах метан часто отримують з карбіду алюмінію:
А l 4 З 3 + 12Н 2 О \u003d ЗСН 4 + 4Аl (ОН) 3.
Хімічні властивості. У звичайних умовах алкани хімічно інертні. Вони стійкі до дії багатьох реагентів: не взаємодіють з концентрованими сірчаної та азотної кислотами, з концентрованими і розплавленими лугами, що не окислюються сильними окислювачами - перманганатом каліюKMnО 4 і т.п.
Хімічна стійкість алканів пояснюється високою міцністюs -зв'язків С-С і С-Н, а також їх неполярні. Полярні зв'язку С-С і С-Н в алканах не схильні до іонного розриву, але здатні розщеплюватися гомолитически під дією активних вільних радикалів. Тому для алканів характерні радикальні реакції, в результаті яких утворюються сполуки, де атоми водню заміщені на інші атоми або групи атомів. Отже, алкани вступають в реакції, що протікають за механізмом радикального заміщення, що позначається символомS R ( від англ,substitution radicalic). За цим механізмом найлегше заміщаються атоми водню у теоретичних, потім у вторинних і первинних атомів вуглецю.
1. Галогенування. При взаємодії алканів з галогенами (хлором і бромом) під дією УФ-випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогензамещенних алканів. Загальна схема цієї реакції показана на прикладі метану: /\u003e
б) Зростання ланцюга. Радикал хлору забирає у молекули алкана атом водню:
Cl· + СН 4 → НС /\u003e l + СН 3 ·
При цьому утворюється алкільних радикал, який забирає атом хлору у молекули хлору:
СН 3 · + З l 2 → СН 3 С l + С l·
Ці реакції повторюються до тих пір, поки не відбудеться обрив ланцюга по одній з реакцій:
Cl· + Cl· → З l /\u003e 2, СН 3 · + СН 3 · → З 2 Н 6, СН 3 · + Cl· → СН 3 С l ·
Сумарне рівняння реакції:
| hv | ||
| СН 4 + Сl 2 | → | СН 3 Сl + НСl. |
Утворений хлорметан може піддаватися подальшому хлоруванню, даючи суміш продуктівCH 2 Cl 2, CHCl 3, СС l 4 по схемі (*).
Розвиток теорії ланцюгових вільнорадикальних реакцій тісно пов'язане з ім'ям видатного російського вченого, лауреата Нобелівської премії Н.І. Семенова (1896-1986).
2. Нітрування (реакція Коновалова). При дії розбавленої азотної кислоти на алкани при 140 ° С і невеликому тиску протікає радикальна реакція: /\u003e
При радикальних реакціях (галогенирование, нітрування) в першу чергу замішаний атоми водню у теоретичних, потім у вторинних і первинних атомів вуглецю. Це пояснюється тим, що найлегше розривається гомолитически зв'язок теоретичного атома вуглецю з воднем (енергія зв'язку 376 кДж / моль), потім - вторинного (390 кДж / моль) і тільки потім - первинного (415 кДж / моль).
3. Ізомеризація. Нормальні алкани при певних умовах можуть перетворюватися в алкани з розгалуженим ланцюгом: /\u003e
4. Крекінг - це гемолітичний розрив зв'язків С-С, який протікає при нагріванні і під дією каталізаторів.
При крекінгу вищих алканів утворюються алкени і нижчі алкани, при крекінгу метану і етану утворюються ацетилен: /\u003e
C /\u003e 8 H 18 → C 4 H 10 + З 4 Н 8, /\u003e
2СН 4 → З 2 Н 2 + ЗН 2,
З 2 Н 6 → З 2 Н 2 + 2Н 2.
Ці реакції мають велике промислове значення. Таким шляхом висококиплячі фракції нафти (мазут) перетворюють в бензин, гас і інші цінні продукти.
5. Окислення. При м'якому окисленні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
 |
М'яке каталітичне окислення бутану киснем повітря - один з промислових способів отримання оцтової кислоти:
t°
2 C 4 /\u003e H /\u003e 10 + 5 O /\u003e 2 → 4 CH /\u003e 3 COOH /\u003e + 2Н 2 О .
кат
На повітрі алкани згоряють до СО 2 і Н 2 О: /\u003e
З n Н 2 n +2 + (З n+1) / 2О 2 \u003d n СО 2 + (n +1) Н 2 О.
Алка (граничні вуглеводні, парафіни)
- Алкани - аліфатичні (ациклічні) граничні вуглеводні, в яких атоми вуглецю зв'язані між собою простими (одинарними) зв'язками в нерозгалужені або розгалужені ланцюги.
алкани - назва граничних вуглеводнів з міжнародної номенклатурі.
Парафін- історично сформована назва, що відбиває властивості цих сполук (від лат. parrum affinis - має мало спорідненості, малоактивний).
граничними, або насиченими, Ці вуглеводні називають в зв'язку з повним насиченням вуглецевого ланцюга атомами водню.
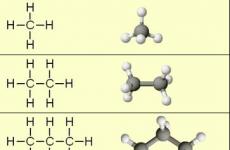
Найпростіші представники алканів:
Моделі молекул:


При порівнянні цих сполук видно, що вони відрізняються один від одного на групу СН 2 - (метилен). Додаючи до пропану ще одну групу СН 2 -, Отримаємо бутан З 4 Н 10, Потім алкани З 5 Н 12, З 6 Н 14 і т.д.
Тепер можна вивести загальну формулу алканів. Число атомів вуглецю в ряду алканів приймемо за n
, Тоді число атомів водню складе величину 2n + 2
. Отже, склад алканів відповідає загальній формулі C n H 2n + 2.
Тому часто використовується таке визначення:
алкани - вуглеводні, склад яких виражається загальною формулою C n H 2n + 2, де n - число атомів вуглецю.
будова алканів
хімічна будова (Порядок з'єднання атомів в молекулах) найпростіших алканів - метану, етану і пропану - показують їх структурні формули, наведені в розділі 2. З цих формул видно, що в алканах є два типи хімічних зв'язків:
З-С і З-Н.
Зв'язок С-С є ковалентним неполярной. Зв'язок С-Н - ковалентний слабополярная, тому що вуглець і водень близькі по електронегативності (2.5 - для вуглецю і 2.1 - для водню). Освіта ковалентних зв'язків в алканах за рахунок загальних електронних пар атомів вуглецю і водню можна показати за допомогою електронних формул:

Електронні та структурні формули відображають хімічну будову, Але не дають уявлення про просторовому будову молекул, Яке істотно впливає на властивості речовини.
просторова будова, Тобто взаємне розташування атомів молекули в просторі, залежить від спрямованості атомних орбіталей (АО) цих атомів. У вуглеводнях головну роль грає просторова орієнтація атомних орбіталей вуглецю, оскільки сферична 1s-АТ атома водню позбавлена \u200b\u200bпевної спрямованості.
Просторове розташування АТ вуглецю в свою чергу залежить від типу його гібридизації (частина I, розділ 4.3). Насичений атом вуглецю в алканах пов'язаний з чотирма іншими атомами. Отже, його стан відповідає sp 3-гібридизації (частина I, розділ 4.3.1). У цьому випадку кожна з чотирьох sp 3 -гібрідних АТ вуглецю бере участь в осьовому (σ-) перекривання з s-АТ водню або з sp 3-АТ іншого атома вуглецю, утворюючи σ-зв'язку С-Н або С-С.

Чотири σ-зв'язку вуглецю спрямовані в просторі під кутом 109 про 28 ", що відповідає найменшому відштовхування електронів. Тому молекула найпростішого представника алканів - метану СН 4 - має форму тетраедра, в центрі якого знаходиться атом вуглецю, а в вершинах - атоми водню:

Валентний кут Н-С-Н дорівнює 109 про 28 ". Просторова будова метану можна показати за допомогою об'ємних (масштабних) і шаростержневих моделей.
Для запису зручно використовувати просторову (стереохимическую) формулу.

У молекулі наступного гомолога - етану С 2 Н 6 - два тетраедричних sp 3 -атома вуглецю утворюють більш складну просторову конструкцію:

Для молекул алканів, що містять понад 2-х атомів вуглецю, характерні вигнуті форми. Це можна показати на прикладі н-бутан (VRML-модель) або н-пентана:

ізомерія алканів
- Ізомерія - явище існування сполук, які мають однаковий склад (однакову молекулярну формулу), але різну будову. Такі сполуки називаються изомерами.
Відмінності в порядку з'єднання атомів в молекулах (тобто в хімічному будову) призводять до структурної ізомерії. Будова структурних ізомерів відбивається структурними формулами. В ряду алканів структурна ізомерія виявляється при вмісті в ланцюзі 4-х і більше атомів вуглецю, тобто починаючи з бутану З 4 Н 10.
Якщо в молекулах однакового складу і однакового хімічної будови можливе різне взаємне розташування атомів в просторі, то спостерігається просторова ізомерія (стереоізомерія). У цьому випадку використання структурних формул недостатньо і слід застосовувати моделі молекул або спеціальні формули - стереохимические (просторові) або проекційні.
Алкани, починаючи з етану H 3 C-СН 3, існують в різних просторових формах ( конформаціях), Обумовлених внутрімолекулярних обертанням по σ-зв'язків С-С, і виявляють так звану поворотну (конформаційну) изомерию.
Крім того, при наявності в молекулі атома вуглецю, пов'язаного з 4-ма різними заступниками, можливий ще один вид просторової ізомерії, коли два стереоізомери ставляться один до одного як предмет і його дзеркальне зображення (подібно до того, як ліва рука відноситься до правої). Такі відмінності в будові молекул називають оптичної ізомерії.
Структурна ізомерія алканів
- Структурні ізомери - сполуки однакового складу, що відрізняються порядком зв'язування атомів, тобто хімічною будовою молекул.
Причиною прояви структурної ізомерії в ряду алканів являетсяспособность атомів вуглецю утворювати ланцюги різного строенія.Етот вид структурної ізомерії називається ізомерією вуглецевого скелета.
Наприклад, алкан складу C 4 H 10 може існувати у вигляді двох структурних ізомерів:

а алкан З 5 Н 12 - у вигляді трьох структурних ізомерів, що відрізняються будовою вуглецевого ланцюга:

Зі збільшенням числа атомів вуглецю в складі молекул увелічіваютсявозможності для розгалуження ланцюга, тобто кількість ізомерів зростає з ростом числа вуглецевих атомів.

Структурні ізомери відрізняються фізичними властивостями. Алкани з розгалуженим будовою через менш щільною упаковки молекул і, відповідно, менших міжмолекулярних взаємодій, киплять при болеенізкой температурі, ніж їх нерозгалужені ізомери.
При виведенні структурних формул ізомерів використовують такі прийоми.
Вуглеводні являють собою найпростіші органічні сполуки. Їх складають вуглець і водень. З'єднання цих двох елементів називаються граничними вуглеводнями або алканами. Їх склад виражається загальною для алканів формулою CnH2n + 2, де n - кількість атомів вуглецю.
Вконтакте
Однокласники
Алкани - міжнародне найменування даних сполук. Також ці сполуки називають парафинами і насиченими вуглеводнями. Зв'язок в молекулах алканів проста (або одинарна). Решта валентності насичені атомами водню. Все алкани насичені воднем до межі, його атоми знаходяться в стані sp3-гібридизації.
Відповідний ряд граничних вуглеводнів
 Першим в гомологічної ряду насичених вуглеводнів коштує метан. Його формула CH4. Закінчення -а в найменуванні граничних вуглеводнів являє відмітною ознакою. Далі відповідно до наведеної формулою в гомологічної ряду розташовуються етан - C2H6, пропан C3H8, бутан - C4H10.
Першим в гомологічної ряду насичених вуглеводнів коштує метан. Його формула CH4. Закінчення -а в найменуванні граничних вуглеводнів являє відмітною ознакою. Далі відповідно до наведеної формулою в гомологічної ряду розташовуються етан - C2H6, пропан C3H8, бутан - C4H10.
З п'ятого алкана в гомологічної ряду назви сполук утворюються в такий спосіб: грецьке число, яке вказує число атомів вуглеводню в молекулі + закінчення -а. Так, по-грецьки число 5 - пенде, відповідно за бутаном йде пентан - C5H12. Далі - гексан C6H14. гептан - C7H16, октан - C8H18, нонан - C9H20, декан - C10H22 і т. д.
Фізичні властивості алканів помітно змінюються в гомологічної ряду: збільшується температура плавлення, кипіння, збільшується щільність. Метан, етан, пропан, бутан при звичайних умовах, т. Е. При температурі рівній приблизно 22 градуси тепла за Цельсієм, є газами, з пентану по гексадекан включно - рідинами, з гептадекан - твердими речовинами. Починаючи з бутану, у алканів є ізомери.
Існують таблиці, що відображають зміни в гомологічної ряду алканів, Які наочно відображають їх фізичні властивості.
Номенклатура насичених вуглеводнів, їх похідні
 Якщо відбувається відрив атома водню від молекули вуглеводню, то утворюються одновалентні частинки, які називають радикалами (R). Назва радикалу дає то вуглеводень, з якого цей радикал проведений, при цьому закінчення -а змінюється на закінчення іл. Наприклад, з метану при відриві атома водню утворюється радикал метил, з етану - етил, з пропану - пропив і т. Д.
Якщо відбувається відрив атома водню від молекули вуглеводню, то утворюються одновалентні частинки, які називають радикалами (R). Назва радикалу дає то вуглеводень, з якого цей радикал проведений, при цьому закінчення -а змінюється на закінчення іл. Наприклад, з метану при відриві атома водню утворюється радикал метил, з етану - етил, з пропану - пропив і т. Д.
Радикали також утворюються і неорганічними з'єднанням. Наприклад, відібравши у азотної кислоти гідроксильну групу ОН, можна отримати одновалентних радикал -NO2, який називається нітрогрупою.
При відриві від молекули алкана двох атомів водню утворюється двовалентні радикали, назви яких також утворюються з назви відповідних вуглеводнів, але закінчення змінюється на:
- іліен, в тому випадку, якщо атоми водню відірвані від одного атома вуглецю,
- Ілен, в тому випадку, якщо від двох атоми водню відірвані від двох сусідніх атомів вуглецю.
Алкани: хімічні властивості
Розглянемо реакції, характерні для алканів. Всім алканами притаманні загальні хімічні властивості. Дані речовини є малоактивними.
Всі відомі реакції за участю вуглеводнів поділяються на два види:
- розрив зв'язку С-Н (прикладом може служити реакція заміщення);
- розрив зв'язку С-С (крекінг, утворення окремих частин).
Дуже активні в момент утворення радикали. Самі по собі вони існують частки секунди. Радикали легко вступають в реакції між собою. Їх неспарені електрони утворюють нову ковалентний зв'язок. Приклад: CH3 + CH3 → C2H6
Радикали легко вступають в реакції з молекулами органічних речовин. Вони або приєднуються до них, або відривають від них атом з неспареним електроном, в результаті чого з'являються нові радикали, які, в свою чергу, можуть вступати в реакції з іншими молекулами. При такій ланцюгової реакції виходять макромолекули, які перестають рости тільки тоді, коли обірветься ланцюг (приклад: з'єднання двох радикалів)
Реакції вільних радикалів пояснюють багато важливих хімічні процеси, такі як:
- вибухи;
- окислення;
- Крекінг нафти;
- Полімеризацію ненасичених сполук.
 детально можна розглянути хімічні властивості насичених вуглеводнів на прикладі метану. Вище ми вже розглядали будову молекули алкана. Атоми вуглецю знаходяться в молекулі метану в стані sp3-гібридизації, і утворюється досить міцний зв'язок. Метан є газ баз запаху і кольору. Він легший за повітря. У воді малорастворим.
детально можна розглянути хімічні властивості насичених вуглеводнів на прикладі метану. Вище ми вже розглядали будову молекули алкана. Атоми вуглецю знаходяться в молекулі метану в стані sp3-гібридизації, і утворюється досить міцний зв'язок. Метан є газ баз запаху і кольору. Він легший за повітря. У воді малорастворим.
Алкани можуть горіти. Горить метан синюватим блідим полум'ям. При цьому результатом реакції будуть оксид вуглецю і вода. При змішуванні з повітрям, а також в суміші з киснем, особливо якщо співвідношення обсягів буде 1: 2, дані вуглеводень утворює вибухові суміші, через що він вкрай небезпечний для застосування в побуті і шахтах. Якщо метан згоряє не повністю, то утворюється сажа. У промисловості її таким чином і отримують.
З метану отримують формальдегід і метиловий спирт шляхом його окислення в присутності каталізаторів. Якщо ж метан сильно нагріти, то він розпадається за формулою CH4 → C + 2H2
розпад метану можна здійснити до проміжного продукту в спеціально обладнаних печах. Проміжним продуктом буде ацетилен. Формула реакції 2CH4 → C2H2 + 3H2. Виділення ацетилену з метану скорочує витрати виробництва майже в два рази.
Також з метану отримують водень, виробляючи конверсію метану з водяною парою. Характерними для метану є реакції заміщення. Так, при звичайній температурі, на світлі галогени (Cl, Br) за стадіями витісняють водень з молекули метану. Таким чином утворюються речовини, звані галогенопроїзводниє. атоми хлору, Заміщаючи в молекулі вуглеводню атоми водню, утворюють суміш різних з'єднань.
У такій суміші присутні хлорметан (CH3 Cl або хлористий метил), дихлорметан (CH2Cl2ілі хлористий метилен), тріхлорметан (CHCl3 або хлороформ), тетрахлорметан (CCl4 або чотирихлористий вуглець).
Будь-яке з цих з'єднань може бути виділено з суміші. У виробництві важливе значення відводиться хлороформу і ТЕТРАХЛОРМЕТАНОМ, в силу того, що вони є розчинниками органічних сполук (жирів, смол, каучуку). Галогенопроїзводниє метану утворюються по ланцюговому свободнорадикальному механізму.
Світло впливає на молекули хлору, внаслідок чого вони розпадаються на неорганічні радикали, які відривають атом водню з одним електроном від молекули метану. При цьому утворюється HCl і метил. Метил реагує з молекулою хлору, в результаті чого виходить галогенопроїзводниє і радикал хлору. Далі радикал хлору продовжує ланцюгову реакцію.
При звичайній температурі метан володіє достатньою стійкістю до лугів, кислот, багатьом окислювача. Виняток - азотна кислота. В реакції з нею утворюється нитрометан і вода.
Реакції приєднання для метану не характерні, т. К. Все валентності в його молекулі насичені.
Реакції, в яких беруть участь вуглеводні можуть проходити не тільки з розщепленням зв'язку С-Н, але і з розривом зв'язку С-С. Такі перетворення відбуваються при наявності високих температур і каталізаторів. До таких реакцій відносяться дегідрогенізація і крекінг.
З насичених вуглеводнів шляхом окислення отримують кислоти - оцтову (з бутану), жирні кислоти (з парафіну).
отримання метану
 У природі метан розповсюджений досить широко. Він - головна складова частина більшості горючих природних і штучних газів. Він виділяється з кам'яновугільних пластів в рудниках, з дна боліт. Природні гази (що дуже помітно в попутних газах нафтових родовищ) містять не тільки метан, а й інші алкани. Застосування цих речовин різноманітно. Вони використовуються як паливо, на різних виробництвах, в медицині і техніці.
У природі метан розповсюджений досить широко. Він - головна складова частина більшості горючих природних і штучних газів. Він виділяється з кам'яновугільних пластів в рудниках, з дна боліт. Природні гази (що дуже помітно в попутних газах нафтових родовищ) містять не тільки метан, а й інші алкани. Застосування цих речовин різноманітно. Вони використовуються як паливо, на різних виробництвах, в медицині і техніці.
В умовах лабораторії даний газ виділяють при нагріванні суміші ацетат натрію + гідроксид натрію, а також реакцією карбіду алюмінію і води. Також метан отримують з простих речовин. Для цього обов'язковими умовами є нагрів і каталізатор. Промислове значення має отримання метану синтезом на основі водяної пари.
Метан і його гомологи можуть бути отримані при прожаренні солей відповідних органічних кислот з лугами. Ще одним способом отримання алканів є реакція Вюрца, при якій нагрівається моногалогенопохідних з металевим натрієм.