Alkaanid suhtlevad vesinikuga. Alkanovi rahvusvaheline nomenklatuur. Alkaans: struktuur, omadused. Aromaatsete süsivesinike keemilised omadused
Piirake Süsivesinikud on sellised ühendid, mis on molekulid, mis koosnevad süsinikuaatomitest, mis on hübridisatsiooni seisundis SP3. Nad on üksteisega seotud ainult kovalentse Sigma võlakirjadega. Nimi "limiit" või "küllastunud" süsivesinikud lähtub asjaolust, et need ühendid ei suuda aatomeid kinnitada. Need on äärmiselt küllastunud. Erandiks on tsükloalkaanid.
Mis on alkaanid?
Alkaanlased on limiidi süsivesinikud ja nende süsinikuahela on lahti ühendatud ja koosneb süsinikuaatomitest ühendatud ühendatud ühe sidemete abil. See ei sisalda teisi (see tähendab, topelt, nagu alkeenid või kolmekordsed, nagu alkylov) ühendused. Alkaanide nimetatakse ka parafiinideks. Nad said selle nime, kuna tuntud parafiinid on valdavalt nende limiidi süsivesinike segu 18-C35-ga spetsiaalse inertsutusega.
Üldine teave alkaanide ja nende radikaalide kohta
Nende valem: C N P 2 N +2, siin N on suurem või võrdne 1. Molari mass arvutatakse valemiga: M \u003d 14N + 2. iseloomulik omadus: nende nimede lõpp on "-an". Vesiniku aatomite asendamise tulemusena moodustatud jäägid, mis on moodustatud vesiniku aatomite asendamise tulemusena teistele aatomitele, on alifaatsed radikaalid või alküülrühmad. Neid tähistatakse tähega R. Üldvalemiga monovalentsete alifaatsete radikaalide puhul: NP2N +1-ga on siin n n-ga suurem või võrdne 1. Alifaatsete radikaalide molaarmass arvutatakse valemiga: m \u003d 14n + 1 . Alifaatsete radikaalide iseloomulik tunnus: nimede lõpud "- Il. Alkanov molekulidel on oma struktuuri omadused:
- c-C-ühenduse ühendamist iseloomustab pikkusega 0,154 nm;
- c-H-ühendust iseloomustab pikkusega 0,109 nM;
- valentsnurk (süsinik-süsiniku sidemete vaheline nurk) on 109 kraadi ja 28 minutit.

Alkaanide homoloogse seeria algab: metaan, etaan, propaan, butaan ja nii edasi.
Alkanovi füüsikalised omadused
Alkaans on ained, millel ei ole vees lahustumata värve ja lahustumata. Temperatuur, milles alkaanid hakkavad sulama ja temperatuur, milles nad keeta, tõusevad vastavalt molekulmassi suurenemisele ja süsivesinike ahela pikkusele. Vähemalt hargnenud hargnenud alkaanide külge ja sulamistemperatuuri langetatakse. Gaasilised alkaanid on võimelised põletama kahvatu sinine või värvitu leek, samas kui üsna palju soojust paistab silma. CH4-C4H10 on gaase, mis puuduvad ka ja lõhna. C5H 12-C 15 H 32 on vedelikud, millel on spetsiifiline lõhn. 15 N 32-st ja nii edasi, need on tahked ained, mis ka ei lõhna.
Alkanovi keemilised omadused
Need ühendid on keemilises plaanis madalad aktiivsed, mida saab seletada rafineeritud Sigma-linkide - C-C ja C-N tugevusega. Samuti tuleb meeles pidada, et suhted C-C-ga on mittepolaarsed ja SN on madalpolar. Need on väikese polarable tüüpi lingid, mis on seotud Sigma välimuse ja vastavalt murda suurima tõenäosuse nad muutuvad gomoliitiline mehhanism, mille tulemusena radikaalid moodustuvad. Seega on alkaanide keemilised omadused piirduvad peamiselt radikaalse asendamise reaktsioonidega.

Pähklireaktsioonid
Alkaanid suhtlevad ainult lämmastikhappega, mille kontsentratsioon on 10% või tetraphilise lämmastikoksiidi kontsentratsiooniga gaasikeskkonnas temperatuuril 140 ° C. Alkaani nitroaratsiooni reaktsiooni nimetatakse Konovalovi reaktsiooniks. Selle tulemusena moodustatakse nitroühendid ja vesi: CH 4 + lämmastikhape (lahjendatud) \u003d CH3 - NO2 (nitrometaan) + vesi.
Reaktsioonid põletavad
Piirata süsivesinikke on väga sageli kasutatud kütusena, mis on õigustatud nende keha võimega: N P 2N + 2 + ((3N + 1) / 2) O2 \u003d (N + 1) H20 + N CO 2-ga.
Oksüdeerimisreaktsioonid
Alkaanlaste keemilistes omadustes hõlmab ka nende oksüdatsiooni võimet. Sõltuvalt sellest, millistel tingimustel on kaasas reaktsioon ja kuidas neid muudetakse, võib saada samast ainest erinevate lõpptoodete saamiseks. Metaani hapniku pehme oksüdeerimine katalüsaatori juuresolekul, mis kiirendab reaktsiooni kiirendavat ja umbes 200 ° C temperatuure võib põhjustada järgmisi aineid: \\ t
1) 2CH4 (hapniku oksüdatsioon) \u003d 2sH3 (alkoholi - metanool).
2) CH4 (hapniku oksüdeerimine) \u003d CH20 (aldehüüdi - metanal või formaldehüüdi) + N2O.
3) 2CH4 (hapniku oksüdeerimine) \u003d 2Non (karboksüülhape - metaan või formika) + 2N2O.

Samuti võib alkaanide oksüdeerimist valmistada gaasilises või vedelas õhus. Sellised reaktsioonid põhjustavad kõrgema rasvase alkoholide ja vastavate hapete moodustumist.
Suhtumine küte
Temperatuuridel ei ületa + 150-250 ° C, tingimata katalüsaatori juuresolekul, orgaaniliste ainete struktuurne ümberkorraldamine, mis seisneb aatomite ühendi järjekorra muutmisel. Seda protsessi nimetatakse isomerisatsiooniks ja reaktsiooni isomeeride tulemusena saadud ained. Seega selgub tavalisest butaanist välja oma isomeeri - isobutaani. Temperatuuridel 300-600 ° C ja katalüsaatori juuresolekul on rebend C-H sidemed, et moodustada vesinikumolekulide (dehüdrogeenimisreaktsioon), vesinikumolekulide süsinikuahelaga sulgemisega tsükli (tsüklistamisreaktsiooni või alkanovi aromatiseerimisreaktsioonidega);
1) 2CH4 \u003d C2H4 (EEEN) + 2N2.
2) 2CH 4 \u003d C2H2 (Etin) + 3H2.
3) C7H16 (normaalne heptaan) \u003d C6H 5 - CH3 (tolueen) + 4N2.

Halogeenimisreaktsioonid
Sellised reaktsioonid on halogeenide (nende aatomite) kasutuselevõtuga orgaanilise aine molekulis, mille tulemusena moodustub C-halogeenühendus. Alkaanide koostoimes halogeenide, halogeenide derivaadid moodustuvad. Sellel reaktsioonil on konkreetsed tunnused. See lähtub radikaalse mehhanismi ja korralikult nõuetekohaselt, on vaja halogeeni ja alkaanide mõjutamiseks mõjutada ultraviolettkiirgust või lihtsalt seda soojendada. Alkaanide omadused võimaldavad halogeenimisreaktsiooni voolamiseks, kuni saavutatakse halogeeniaatomite täielik asendamine. See tähendab, et metaani kloorimine ei lõpe ühe etapi ja metüülkloriidi tootmisega. Reaktsioon läheb kaugemale, kõik võimalikud asendustooted moodustatakse, alustades klorometaanist ja lõpeb tetraklorometaaniga. Kloori mõju nendel tingimustel teistele alkaanidele toob kaasa erinevate süsinikuaatomite vesiniku asendamise tulemusena saadud erinevate toodete valmistamise. Alates temperatuurist, kus reaktsioon on käimas, sõltub piiratud toodete ja nende moodustumise kiiruse suhe. Mida kauem alkaani süsivesinike ahel, seda lihtsam on selle reaktsiooni liikumine. Kui halogeenimine on süsinikuaatom kõigepealt kõige vähem hüdrogeenitud (tertsiaarne). Esmane siseneb reaktsiooni pärast teisi teisi. Halogeenimisreaktsioon toimub etappides. Esimeses etapis on asendatud ainult üks vesinikuaatom. Halogeenlahuste (kloori ja broomi veega), alkaanid ei toimi.

Sulfoolimise reaktsioonid
Alkaanlaste keemilisi omadusi täiendab ka sulfoolimisreaktsiooni abil (seda nimetatakse reaktsiooni reaktsiooniks). Ultraviolettkiirguse kokkupuutel on alkaanid reageerida kloori ja vääveldioksiidi seguga. Selle tulemusena moodustub kloriid, samuti alküülradikaal, mis ühendab vääveldioksiidiga. Selle tulemusena saavutatakse keeruline ühend, mis muutub stabiilseks, kuna kloori aatomi püüdmine ja ühe molekuli hävimine: R-H + SO 2 + Cl 2 + ultraviolettkiirgus \u003d R-SO 2 CL + HCl. Reaktsiooni tulemusena moodustunud sulfonüülkloriidid kasutatakse laialdaselt pindaktiivsete ainete tootmisel.
Lihtsamad orgaanilised ühendid on süsivesinikudkoosneb süsinikust ja vesinikust. Sõltuvalt süsivesinike keemiliste sidemete olemusest ja süsiniku ja vesiniku suhetest jagunevad need piiravaks ja ettenägematuteks (alkeenideks, alkinaks jne)
Piirsüsivesinikud (alkaanid, metaani rida) on ühendid süsiniku vesinikuga, molekulides, mille iga süsinikuaatom kulutab ühendile ühele teisele naabruses mitte rohkem kui ühe valentsusega ja kõik valents ei tohi ühendada vesiniku süsinikule. Kõik süsinikuaatomid alkaanides on SP-s 3-seisundis. Piirake süsivesinikud moodustavad homoloogse seeria, mida iseloomustab üldvalemiga Alates n. N. 2N + 2. . Selle seeria kahe prioriteet on metaan.
Isomeria. Nomenklatuur.
N \u003d 1,2,3-ga alkaanid võivad esineda ainult ühe isomeeri kujul
Alates n \u003d 4-ga ilmub struktuurse isomeri nähtus.

Alkaanide struktuursete isomeeride arv kasvab kiiresti süsinikuaatomite arvu suurenemisega, näiteks pentaanil on 3 isomeeri, heptaani - 9 jne.
Alkaani isomeeride arv suureneb ja võimalike stereoisomeeride tõttu. Alates C 7 N 16-ga on võimalik kahe enantiomeeri moodustuvate kiraalse molekulide olemasolu.
Alkaanide nomenklatuur.
Domineeriv nomenklatuur on IUPAC-nomenklatuur. Samal ajal esitavad ta triviaalsete nimede elemente. Seega esimesed neli liikme homoloogse seeria alkaanid on triviaalne nimed.
CH 4 - metaan
2N-st 6-st etaanist
C3H 8 - propaan
4 h 10-bhutaniga.
Ülejäänud homoloogide nimed moodustavad kreeka latina numbritest. Niisiis, järgmiste tavapärase (hargnemata) ehitamise liikmetele kasutatakse nimesid:
5H 12-pentaanist 6H14-heksaanist, 7H 18-heptaanist, \\ t
14H 30-tetradekaanist 15-st 32-pentadekaanist jne.
IUPACi põhireeglid hargnenud alkanovi jaoks
a) Vali pikim hargnemata ahela, mille nimi on alus (juur). See alus lisab sufiksit "AN"
b) number see ahel põhimõtet vähemalt kapid,
c) asendaja näitab eesliiteid tähestikulises järjekorras, mis näitab asukoha asukohta. Kui kevadel struktuuris on mitmeid identseid asendajaid, näitavad nende arv kreeka numbrilist numbrilist.
Sõltuvalt teiste süsinikuaatomite arvust, millega süsinikuaatom on otseselt ühendatud, eristatav: primaar-, sekundaarsed, tertsiaarsed ja kvaternaarsed süsinikuaatomid.


Alküülrühmi või alküülradikaale kirjeldatakse hargnenud alkaanide asendajatena, mida peetakse ühe vesinikuaatomi alkaanmolekuli mahaarvamise tulemusena.
Alküülrühmade nimetus moodustavad vastavate alkaanide nimest, asendades viimase sufiks "A" Soffixi "IL".
CH3-metüül
CH3 CH2 - etüül
CH3 CH 2 CH 2 - Propil

Harjatatud alküülrühmade nimetuse nimetamiseks kasutatakse ka ahela numeratsioon:

Alustades etaanist, on alkaanid võimelised moodustama konformereid, mis vastavad inhibeeritud konformatsioonile. Võimalus üleminek ühe inhibeeritud konformatsiooni teise kaudu varjatud määratakse pöörlemise barjääri. Konstruktsioonide ja pöörlemisbakerite struktuuri määramine on konformatsioonilise analüüsi ülesanded. Alkaanide saamise meetodid.
1. Maagaasi või bensiiniõli fraktsiooni osaline destilleerimine.Sel viisil võivad üksikuid alkaanid eraldada 11 süsinikuaatomiga.
2. Söe hüdrogeenimine.Protsess viiakse läbi katalüsaatorite (molübdeeni, volframi, nikli)) juuresolekul 450-470 ° C juures ja survet kuni 30 MPa. Söe ja katalüsaatorit tritureeritakse pulbris ja hüdrogeenitud hüdrogeenitud, vesiniku poolt suspensiooni kaudu. Saadud alkaanide ja tsükloalkaanide segusid kasutatakse mootori kütusena.
3. Hüdrogeenimine CO ja koos 2 .
CO + H2 alkaanid
CO 2 + H2 alkaanid
CO, FE ja teised kasutatakse nende reaktsioonide katalüsaatoritena. D - elemendid.
4. Alkeenide ja alkajate hüdrogeenimine.

5. Metallorgaanilise sünteesi.
aga). Watza süntees.
2rh + 2NA r r + 2Nahal
See süntees ei sobi, kui orgaaniliste reagentidena kasutatakse kahte erinevat halolennati.
b). Grigrandi reaktiivide protolüüs.
R Hal + mg RMHAL
RMHAL + Hoh RH + mg (OH) Hal
sisse). Liitium-dialkipratsite koostoime (LIR 2 CU) alküülhalogeniididega
Lir 2 Cu + r x r r + rcu + lix
Liitium-dialkiprats ise saadakse kaheastmelise meetodiga.
2R li + cui lir 2 cu + lii
6. Karboksüülsoolade elektrolüüs (Sintez Kolbe).
2rcoona + 2H2O R + 2CO 2 + 2NAOH + H2

7. Karboksüülhappe soolade rulli leelisega.
Reaktsiooni kasutatakse madalamate alkaanide sünteesimiseks.
8. Karbonüülühendite ja halolyanovi hüdrogenolüüs.
aga). Karbonüülühendid. Clementi süntees.

b). Halogeenid. Katalüütiline hüdrogenolüüs.
![]()
NI, PT, PD kasutatakse katalüsaatoritena.
c) halogeenid. Reaktiivide taastamine.
Rhal + 2Hi RH + Hhal + I 2
Alkaanide keemilised omadused.
Kõik alkaanide ühendused on madalad polaarsed, selle järgi iseloomustavad radikaalsed reaktsioonid. PI-võlakirjade puudumine muudab kinnituse reaktsioonile võimatuks. Alkaanide puhul on asendamise reaktsioon, lõhustamine, põletamine iseloomulik.
|
Reaktsiooni tüüp ja nimi | |
|
1. Asendamise reaktsioonid | |
|
A) halogeenidega (alates kloromCl. 2 -Ja valgus, Br. 2 - kuumutamisel) Reaktsioon Ubeys markovnik reegel (reeglid Markovnikov) - peamiselt halogeen asendab vähemalt hüdrogeenitud süsinikuaatomi vesinikku. Reaktsiooni läbib etappides - ühe etapi jaoks ei ole enam kui üks vesinikuaatom. Kõige raskem viis joodi reageerimiseks ja lisaks sellele ei lähe reaktsioon lõpuni, kuna näiteks metaani interaktsiooniga joodiga jodiidi vesinik reageeritakse, reageerides metaani ja joodi moodustumisega jodiidmetüüliga (pöörduv reaktsioon): |
CH 4 + CL2 → CH3CI + HCl (klorometaan) CH3CL + Cl 2 → CH2CI2 + HCl (diklorometaan) CH2CI2 + Cl 2 → CHCI3 + HCl (triklorometaan) CHCI3 + Cl 2 → CCl4 + HCI (tetraklorometaan). |
|
B) pähkli (Konovalovi reaktsioon) Alkaanide reageerivad 10% lämmastikuhappe lahuse või lämmastikoksiidi N2O4-ga gaasifaasis temperatuuril 140 ° ja väikese rõhuga nitro-tootmise moodustumisega. Reaktsioon järgib ka Markovnikovi reeglit. Üks vesinikuaatomite asendatakse jäägiga nr 2 (nitrorühm) ja vee eristatakse |
|
|
2. Lõhustamise reaktsioonid | |
|
A) dehüdrogeenimine -Opt vesinik. Reaktsioonitingimused katalüsaator -platiin ja temperatuur. |
CH 3 - CH3 → CH2 \u003d CH2 + H2 |
|
B) pragunemine Süsivesinike soojuse lagunemise protsess, mis põhineb suure molekulide süsinikuahela jagamise reaktsioonil lühema ahelaga ühenduste moodustamiseks. Temperatuuril 450-700 O, alkaanid lagunevad C-C-võlakirjade purunemise tõttu (sellise temperatuuri vastupidavamad C-NPRI-sidemed) ja alkaanid ja alkeenid moodustatakse väiksema arvu süsinikuaatomite arvuga. |
C. 6 H. 14 C. 2 H. 6 + C. 4 H. 8 |
|
C) täielik termiline lagunemine |
CH 4 C + 2H 2 |
|
3. Oksüdeerimisreaktsioonid | |
|
A) põletusreaktsioon Süütes (t \u003d 600 o c), reageerivad alkaanid hapnikuga, samas kui nende oksüdeerimine toimub süsinikdioksiidi ja veega. |
C N2N + 2 + O2 -\u003e CO 2 + H2O + Q CH 4 + 2O 2 -\u003e CO 2 + 2H2 O + Q |
|
B) Katalüütiline oksüdatsioon- suhteliselt madala temperatuuriga ja katalüsaatorite kasutamisega kaasneb ainult C-kolmekordse võlakirjade jaotus molekuli keskel ja C-N keskel ja kasutatud väärtuste saamiseks: karboksüülhapped, ketoonid, aldehüüdid, alkoholid. |
Näiteks koos ebatäieliku oksüdeerimisega butaani (side sideühend C2-C3) saadakse äädikhappega |
|
4. Isomerisatsiooni reaktsioonid arakterna mitte kõigi alkanovi jaoks. Tähelepanu pööratakse võimalusele ühe isomeeri teistele teisendamiseks katalüsaatorite olemasolu. |
C4H10 C4H10 |
|
5.. Alkaanid pearattaga 6 või enama süsinikuaatomiga ka reageerida dehüdrotsüklistamise, kuid moodustab alati 6-liikmelise tsükli (tsükloheksaani ja selle derivaadid). Reaktsioonitingimuste kohaselt allutatakse see tsükkel edasise dehüdrogeenimise ja muutub energiliselt stabiilsemaks bensoolitsükli aromaatse süsivesiniku (areenil). |
|
Halogeenimisreaktsiooni mehhanism:
Haloideerimine
Alkaanide halogeenimine toimub radikaalse mehhanismi kaudu. Reaktsiooni alustamiseks on UV-valguse või soojuse kiiritamiseks vajalik alkaani ja halogeeni segu. Metaani kloorimine ei lõpe metüülkloriidi saamise etapis (kui võetakse ekvimolaarseid koguseid kloori ja metaani koguseid) ja toob kaasa kõigi võimalike asendustoodete moodustumise metüülkloriidist tetrakloropaarini. Muude alkaanide kloorimine toob kaasa vesiniku asendustoodete segu erinevates süsinikuaatomites. Kloorimistoodete suhe sõltub temperatuurist. Primaarsete, sekundaarsete ja tertsiaarsete aatomite kloorimise kiirus sõltub temperatuurist madalatel temperatuuridel, kiirus väheneb järjest: tertsiaarne, sekundaarne esmane. Suurema temperatuuriga väheneb kiiruse vahe aga kuni see muutub samaks. Lisaks kineetilisele tegurile on kloorimistoodete jaotus statistilise teguri mõju: kloori rünnaku tõenäosus on 3 korda vähem kui alg- ja kaks korda sekundaarsemalt. Seega on alkaanide kloorimine mitte-stero-selektiivse reaktsiooni, kõrvaldades juhtudel, kui on võimalik ainult üks monokloorimisprodukt.
Halogeenimine on üks asendamise reaktsioone. Alkanovi halogeenimine Ubeys reegel Markovnik (Markovnikovi eeskirjad) - peamiselt halogeenitud vähemalt hüdrogeenitud süsinikuaatomi. Alkaanide halogeenimine läbib järk-järgult - ühes etapis, mitte rohkem kui ühe vesinikuaatomi halogeenitud.
CH 4 + Cl 2 → CH3CI + HCl (klorometaan)
CH3CL + Cl 2 → CH2CI2 + HCl (diklorometaan)
CH2CI2 + Cl 2 → CHCI3 + HCl (triklorometaan)
CHCI3 + Cl 2 → CCl4 + HCI (tetraklorometaan).
Valguse toime all, kloori molekul laguneb aatomitele, siis nad ründavad metaani molekule, mille tulemusena moodustuvad vesinikuaatomi rebimine, mis on moodustatud metüülradikaalid, mis seisavad silmitsi kloori molekulidega, hävitades need ja moodustavad uued radikaalid.
Nitching (Konovalovi reaktsioon)
Alkaanide reageerivad 10% lämmastikuhappe lahuse või lämmastikoksiidi N2O4-ga gaasifaasis temperatuuril 140 ° ja väikese rõhuga nitro-tootmise moodustumisega. Reaktsioon järgib ka Markovnikovi reeglit.
RH + HNO 3 \u003d RNO 2 + H2O
s.o üks vesinikuaatomite asendatakse jäägi nr 2 (Ni-tross) ja vee eristatakse.
Isomeeride struktuuri tunnused peegeldavad tugevalt selle reaktsiooni käigus, kuna see on lihtsaim asendada vesinikuaatomit Nitrorühmas SI jäägis (olemas ainult mõnes isomeerides), on CH2 rühma vesinik vesinik Vähem kergem ja veelgi raskem - jäänahtud ch 3.
Parafiinid on üsna lihtne kanda gaasifaasis lämmastiku dioksiidi või lämmastikhappe paari 150-475 ° C juures; Sel juhul juhtub see osaliselt ja. oksüdatsioon. Metaani keermestamine on peaaegu eranditult nitrometaan:
Kõik kättesaadavad andmed näitavad vabade radikaalide mehhanismi. Reaktsiooni tulemusena moodustuvad toodete segud. Lämmastikhape tavalisel temperatuuril peaaegu ei tegutse parafiini süsivesinikele. Kuumutamisel toimib see peamiselt oksüdeeriva ainena. Kuid nagu ma leidsin M. I. Konovalov (1889), soojendus lämmastikhappe toimib osaliselt ja "tüve" viisil; Netrratsiooni reaktsioon nõrga lämmastikhappega on eriti hästi kuumutamisel ja kõrgendatud rõhul. Nitratsiooni reaktsiooni ekspresseeritakse võrrandiga.
Järgides metaani, homoloogid annavad segu erineva nitroparaphaphaphins tõttu möödunud lõhenemine. Kui etaani nitrogeenimine saadakse nitroetan CH3-CH2 -NO2 ja nitrometaan CH3 -NO2. Nitroparafiinide segu moodustub propaanist:
Suutte parafiinid gaasifaasis viiakse nüüd läbi tööstusliku mastaabis.
Sulfooling:
Oluline reaktsioon on alkaanide sulfotsüülimine. Kui alkaan suhtleb kloori ja väävliga arhüdriid, vesinik asendatakse klorosulfonüülrühmaga:

Selle reaktsiooni etapid:
CL + R: H → R + HCI
R + SO 2 → RSO2
RSO2 + CL: Cl → RSO 2 CL + Cl
Alcanofokloorid on kergesti hüdrolüüsivad alkaansulfoksüüliga (RSO2OH), mille naatriumsoolad (RSO 3¯ Na + - naatriumi alkanfonaat) näituse omadused Soamidele sarnased omadused ja neid kasutatakse deterjalidena.
Füüsikalised omadused. Normaalsetes tingimustes on alkaanide homoloogse seeria esimesed neli liiget (1-st 4-st) gaasid. Normaalsed alkaanid pentaanist heptadekaanile (C 5 - C 17 ) - Vedelikud, alustades 18-aastastest ja kõrgematest tahketest ainetest. Nagu süsinikuaatomite arv suureneb ahelas, st Suhtelise molekulmassi suurendamisega suureneb alkaanide keemine ja sulamistemperatuur. Sama arvu süsinikuaatomitega allutatud alkaan-molekulis hargnenud struktuuriga on madalamad keemispunktid kui tavalised alkaanid.
Alkaela Praktiliselt lahustumatu vees, kuna nende molekulid on madala polaarse ja ei vasta vee molekulidega, nad on hästi lahustuvad mitte-polaarses orgaanilistes lahustites, nagu benseen, tetraklorometaan jne. Vedeliku alkaanid on kergesti segatud üksteisega.
Alkaanide peamised looduslikud allikad - nafta ja maagaasi. Erinevad naftafraktsioonid sisaldavad alkaanidC 5 h 12 Kuni 30 h 62. Maagaas koosneb metaanist (95%) etaani ja propaani seguga.
of sünteetilised meetodidalkanov Saate valida järgmised andmed: /\u003e
üks. Küllastumata süsivesinike saamine. Alkeenide või vesinikuga alrode (hüdrogeenimine ") koostoime (" hüdrogeenimine ") esineb metallkatalüsaatorite (/\u003e Ni, PD) juuresolekul )
küte:
Ch w - C ≡sn + 2N2 → CH3-CH2-CH3.
2. Välja minema halogeenproducts. Kuumutamisel monogalogeen-asendatud alkaanlased metalli naatriumi, alkaanid saadakse kahe numbri süsinikuaatomitega (Würtzi reaktsioon): /\u003e
C2H 5 BR + 2 Na + Br - C2H 5 → C2H5 - C2H5 + 2 Nabr..
Seda reaktsiooni ei teostata kahe erineva halogeen-asendatud Alkaanlased, sest selgub kolme erineva alkaani segu
3. Karboksüülhappe soolade saamine. Kui manustamisel veevabad karboksüülhappe soolad leelisega, alkaanid saadakse ühe süsinikuaatomi väiksem kui süsinikuahela originaalkarboksüülhapped: /\u003e
4. Metaan. Vesiniku atmosfääris põletamisel tekkiv elektriline kaar, moodustub märkimisväärne kogus metaani: /\u003e
C + 2N 2 → CH 4 .
Sama reaktsioonis on süsinikuküte vesiniku atmosfääris 400-500 ° C-ni suurenenud rõhul katalüsaatori juuresolekul.
Laboratoorsetes tingimustes saadakse metaan sageli alumiiniumkarbiidi alates:
L 4. C3 + 12N 2O \u003d ZSN 4 + 4Al (oh) 3.
Keemilised omadused. Normaalsetes tingimustes on alkaanid keemiliselt inertsed. Need on vastupidavad paljude reagentide suhtes: ei suhtle kontsentreeritud väävli ja lämmastikhappega, kontsentreeritud ja sulanud leelisega ei oksüdeerita tugevad oksüdeerijad - kaaliumpermanganaatKmn.Umbes 4 jne.
Alkaanide keemiline stabiilsus on suure tugevuse tõttus -c-S ja C-N ühendused, samuti nende mitte-polaarsuse. Mitte-polaarsed võlakirjad C-C ja C-H alkaanides ei ole kiskunud ioonide purunemisse, vaid on võimelised jagama homreid aktiivsete vabade radikaalide mõju all. Seetõttu on alkaanidele iseloomulikud radikaalsed reaktsioonid, mille tulemusena saadakse ühendid, kus vesinikuaatomid on asendatud teiste aatomite või aatomite rühmadega. Järelikult sisenevad alkaanid reaktsiooni, mis voolab sümboliga tähistatud radikaalse asenduse mehhanismi kauduS r ( alates inglise keeltasendamine. radikaalne). Selle mehhanismi all asendatakse vesinikuaatomid tertsiaarselt, seejärel sekundaarsetel ja põhiliste süsinikuaatomite korral.
1. Halogeenimine. Kui alkaanide koostoime halogeenide (kloori ja bromomiga) interaktsiooni UV-kiirguse või kõrge temperatuuri toimel, mono- polühalogeen-asendatud Alkaanid. Selle reaktsiooni üldine diagramm on näidatud metaani näitel: /\u003e
b) ahela kasv. Kloori radikaal kestab alkaanimolekulis vesinikuaatomi:
Cl.· + CH 4 → NA /\u003e L + CH 3 ·
Samal ajal moodustub alküülradikaal, mis võtab kloori aatomi kloori molekulis:
CH 3 · + C L 2 → CH3 koos L + C-ga l.·
Neid reaktsioone korratakse seni, kuni ahel puruneb vastavalt ühele reaktsiooni järgi:
Cl.· + Cl.· → L /\u003e 2, CH3 · + CH3 · → C2H6, CH3 · + Cl.· → CH3 koos l ·
Kogu reaktsioonivõrrand:
| hv | ||
| CH 4 + SL 2 | → | CH3CI + HCl. |
Klorometaani moodustumine võib allutada täiendava kloorimisega, andes toodete seguCh 2 Cl. 2, CHCl3, SS L 4 vastavalt skeemile (*).
Ahela teooria arendamine vaba radikaal Reaktsioonid on tihedalt seotud silmapaistva vene teadlase nimega, Nobeli preemia laureaadi N.I. Semenova (1896-1986).
2. Suutmine (Konovalovi reaktsioon). Lahjendatud lämmastikhappe happe algus alkaanidele temperatuuril 140 ° C ja madal rõhk voolab radikaalne reaktsioon: /\u003e
Radikaalsete reaktsioonidega (halogeenimine, nitratsioon), vesiniku aatomid tertsiaalis, siis sekundaarse ja primaarsete süsinikuaatomite segatakse. Seda seletab asjaoluga, et tertsiaarse süsinikuaatomi kergem vesinikuga (sidumise energia 376 (390 kJ / mol) ja alles siis - primaarne (415 kJ / mol), on siis kõige lihtsam.
3. Isomeriseerimine. Normaalsed alkaanid teatud tingimustel võib muutuda alkaanideks hargnenud ahelaga: /\u003e
4. C-C-ühenduste hemolüütiline purunemine, mis voolab kuumutamisel ja katalüsaatorite toimel.
Kõrgeimate alkaanide lõhenemisel moodustuvad alkeenid ja madalamad alkaanid, moodustuvad atsetüleen metaani ja etaani pragunemise ajal: /\u003e
C /\u003e 8H 18 → C4H10 + C4N 8, /\u003e
2SH 4 → C2H2 + ZN 2,
C2H 6 → C2H2 + 2N2.
Nendel reaktsioonidel on suur tööstuslik väärtus. Sel viisil konverteeritakse kõrge keeva naftafraktsioonid (kütteõli) bensiini, petrooleumi ja muude väärtuslike toodetena.
5. Oksüdatsioon. Mis kerge oksüdatsiooni metaani hapniku juuresolekul erinevate katalüsaatorite, metüülalkoholi, formaldehüüdi, sipelghapet võib saada:
 |
Butaani õhu hapniku pehme katalüütiline oksüdeerimine - üks äädikhappe tootmise tööstusmeetodeid:
t.°
2 C 4 /\u003e H /\u003e 10 + 5 O /\u003e 2 → 4 CH /\u003e 3 COOH /\u003e + 2N2O .
Kass.
Air Alkanalil Põletage CO 2 ja H20: /\u003e
N 2 N +2 + (S n.+1) / 2O 2 \u003d N 2 + (N +1) H2 O.
Alkaans (Piiravad süsivesinikud, parafiinid)
- Alkana - alifaatsed (atsüklilised) äärmuslikud süsivesinikud, kus süsinikuaatomid on ühendatud lihtsate (ühekordsete) ühenduste abil hargnemata või hargnenud ahelates.
Alkaela - Rahvusvahelise nomenklatuuri piiri piirtempiiride nimi.
Parafiinid- ajalooliselt kehtestatud nimi, mis peegeldab nende ühendite omadusi (lat. parrumi affinis - Väike afiinsus, alaraktiivne).
Piirvõi küllastunudNeid süsivesinikke kutsutakse vesiniku süsinikuahela aatomite täielikku küllastumist.
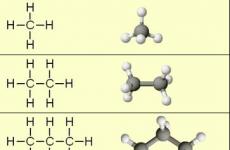
Alkanovi kõige lihtsamad esindajad:
Molekulide mudelid:


Nende ühendite võrdlemisel on selge, et nad erinevad grupi jaoks üksteisest. -Ch 2 - (metüleen). Teise grupi lisamine propaani -Ch 2 -, Ma saan bhutani 4-st, siis alkaana 5 n 12-st, 6 n 14-st jne.
Nüüd saate alkaanide üldvalemi tagasi võtta. Süsiniku aatomite arv alkantovis me võtame n.
, siis vesinikuaatomite arv on suurusjärgus 2N + 2.
. Järelikult vastab alkanovi koostise üldvalemiga C N H 2N + 2.
Seetõttu kasutatakse sellist määratlust:
Alkaela - süsivesinikud, mille koostis väljendatakse üldvalemiga C N H 2N + 2kus n. - süsinikuaatomite arv.
Alkaanide struktuur
Keemiline struktuur (Ühendite järjekord aatomite molekulide ühendite) lihtsamate alkaanide, etaani ja propaani puhul - näidata nende struktuurseid valemeid, mis on esitatud punktis 2. Nendest valemitest on selge, et alkaanides on kahte tüüpi keemilisi sidemeid:
C-s. ja C-n..
Side C-C on kovalentne mittepolaarne. Side C - H on kovalentne nõrgalt, sest Süsinik ja vesinik on lähedal elektronegavusega (2,5 - süsiniku ja 2,1 - vesiniku jaoks). Süsiniku ja vesiniku aatomite üldiste elektrooniliste paaride üldiste elektrooniliste paari üldiste elektrooniliste paari siduvate lekkide moodustumist võib näidata elektrooniliste valemite abil:

Elektroonilised ja struktuurilised valemid peegeldavad keemiline struktuurkuid ei anna ideid molekulide ruumiline struktuurmis mõjutab oluliselt aine omadusi.
Ruumiline struktuur. Molekuli aatomite suhteline paigutus ruumis sõltub nende aatomite aatomi orbitaalsete (AO) suunas. Süsivesinikele mängib peamine rolli süsinik-orbitaalide ruumilise orientatsiooni abil, kuna vesinikuaatomi sfäärilised 1s-ao on teatud orientatsiooni ära võetud.
Süsiniku AO ruumiline paigutus omakorda sõltub hübridisatsiooni liigist (I osa punkt 4.3). Rikkalik süsinikuaatom alkaanides on seotud nelja teise aatomiga. Järelikult vastab selle riik SP 3-hübridisatsioonile (I osa punkt 4.3.1). Sellisel juhul osaleb iga nelja SP-de hübriid süsiniku AO AXiaalsesse (σ-) kattumise S-AO vesinikust või teise süsinikuaatomi SP3 -AO-ga, moodustades σ sideme S-H või C-C-ga.

Süsiniku neli σ-sidet suunatakse kosmosesse 109 ° C 28 nurga all ", mis vastab väikseimatele elektronide vastutõmbele. Seetõttu on alkaanide lihtsama esindaja molekul - metaani CH4 vorm kesklinnas, mille keskel on süsinikuaatomid ja tipud - vesiniku aatomid:

N-C-N valentsi nurk on 109 О 28 ". Metaani ruumilist struktuuri saab näidata lahtiselt (skaala) ja skaalainete mudelite abil.
Salvestamiseks on mugav kasutada ruumilist (stereoochemical) valemit.

Järgmise homloogi molekuli molekuli-etaaniga 2H 6 - kaks tetrapedralit sp. 3 süsinik-matid moodustavad keerulisema ruumilise struktuuri:

Alkanovi molekulide puhul, mis sisaldavad üle 2 süsinikuaatomit, on kõverad vormid iseloomulikud. Seda saab näites näidata n.-Butan (VRML mudel) või n.-Penta:

Isomeriya alkanov
- Isomerius - ühendite välimus, millel on sama koostis (sama molekulaarne valem), kuid erinev struktuur. Selliseid ühendeid kutsutakse isomained.
Erinevused ühendi aatomite järjekorras molekulidesse (s.o keemilises struktuuris) struktuurne isomeeria. Struktuuride isomeeride struktuur kajastub struktuurivalemitest. Paljudes alkaanlastele avaldub struktuurne isomermus, kui Circuitis 4 ja rohkem süsinikuaatomite sisaldus on, st. Alates bhutanist 4-ga 10-ga.
Kui sama koostise molekulide ja sama keemilise struktuuri molekulides on võimalik erinevate aatomite vastastikuse paigutuse ruumis võimalik, seejärel täheldatakse ruumiline isomerism (stereoisomeria). Sellisel juhul ei ole struktuursete valemite kasutamine piisavalt ja molekulide või spetsiaalsete valemite mudeleid - stereokeemiline (ruumiline) või projektsioon.
Alkaanid, alustades etaani H3C-CH3-st, eksisteerivad erinevates ruumilistes vormides ( konformatsioon) σ-linkide σ-linkide intramolekulaarse pöörlemise tõttu ja ilmneb nn rotary (konformatsiooniline) isomermus.
Lisaks sellele, kui 4 erineva asendajaga seotud molekulis on süsinikuaatom, on võimalik teine \u200b\u200bruumilise isomeri tüüp, kui kaks stereoisomeeri kuuluvad üksteisele objekti ja selle peegelpildi (just nagu vasak käsi viitab paremale ). Selliseid molekule struktuuri erinevusi kutsutakse optiline isomeeria.
Struktuurne isomeria alkanov
- Struktuursed isomeerid - ühe ühendid sama koostisega, mida iseloomustab seondumise protseduur aatomite, s.o. Molekulide keemiline struktuur.
Põhjus ilming struktuurse isomerrismi rida alkaanide on seadmed süsinikuaatomid moodustavad ahelad erinevate struktuuride. Seda tüüpi struktuurne isomermus nimetatakse isomeria süsinik skelett.
Näiteks alkan kompositsioon C4H10 võib esineda kaks korda Struktuurilised isomeerid:

ja Alkan C5H 12 - vormis kolm Struktuursed isomeerid, mida iseloomustab süsinikuahela struktuur:

Süsinikuaatomite arvu suurenemisega molekulide koostises on ahela hargnemise võimalused, st Isomeeride kogus kasvab süsinikuaatomite arvu künnise.

Struktuurilised isomeerid eristuvad füüsikaliste omadustega. Alkaanid hargnenud struktuuri tõttu vähem tiheda pakendi molekulide ja seega ka väiksemate vahetu interaktsioonide, keedetakse temperatuuri kui nende hargnemata isomeerid.
Isomeeride struktuursete valemite väljundis kasutavad järgmised meetodid.
Süsivesinikud on kõige lihtsamad orgaanilised ühendid. Nad on süsiniku ja vesiniku. Nende kahe elemendi ühendeid nimetatakse piir süsivesinike või alkaanidena. Nende koostist väljendatakse üldiselt alkaanidele CNH2N + 2 valemiga, kus n on süsinikuaatomite arv.
Kontaktis
Odnoklassniki.
Alkana - andmeühendite rahvusvaheline nimi. Samuti nimetatakse neid ühendeid parafiinideks ja küllastunud süsivesinikeks. Kommunikatsioon alkaanimolekulides on lihtne (või üksik). Ülejäänud valents on küllastunud vesinikuaatomitega. Kõik alkaanid on küllastunud vesinikuga piirini, selle aatomid on SP3 hübridiseerimise seisundis.
Hüdrobaaride piiramise homoloogiline valik
 Esimene küllastunud süsivesinike homoloogses reas on metaan. Tema valemiga CH4. Lõpp on -an Süsivesinike piiramise nimel, see on eristusvõime. Järgmisena vastavalt ülaltoodud valemile aitavad etaan-C2H6 homoloogses seerias, C3H8 propaanis, butaan-C4H10.
Esimene küllastunud süsivesinike homoloogses reas on metaan. Tema valemiga CH4. Lõpp on -an Süsivesinike piiramise nimel, see on eristusvõime. Järgmisena vastavalt ülaltoodud valemile aitavad etaan-C2H6 homoloogses seerias, C3H8 propaanis, butaan-C4H10.
Viiendas Alkana Ühendite ühendite jaotise homoloogse seeria moodustatakse järgmiselt: Kreeka number, mis näitab molekuli süsivesinike aatomite arvu + otsa -an. Niisiis, Garcaries, number 5 - Pande, Pentan - C5H12 läheb Bhutan. Järgmine - heksaan C6H14. Heptaan - C7H16, oktan - C8H18, Nonane - C9H20, Dean - C10H22 jne
Alkaanide füüsikalised omadused muutuvad märgatavalt homoloogses seerias: sulamistemperatuur, keemistemperatuur suureneb, tihedus suureneb. Metaan, etaan, propaan, butaan normaalsetes tingimustes, st temperatuuril ligikaudu 22 kraadi Celsiuse järgi, on gaase, millel on heptadekaaniga kaasava vedelikud pentaaniga, heptadekaaniga - tahkete ainetega. Alustades Bhutanist, alkanalil on isomeerid.
Seal on tabelid peegeldavad muutused alkaanide homoloogses reasmis selgelt kajastavad nende füüsikalisi omadusi.
Amenclation küllastunud süsivesinikud, nende derivaadid
 Kui vesinikuaatom eraldatakse süsivesiniku molekulist, moodustuvad monovalentsed osakesed, mida nimetatakse radikaalideks (R). Radikaali nimi annab süsivesinikule, kust see radikaal valmistatakse, samal ajal kui lõpp -N-i muudatused lõpevad. Näiteks on vesinikuaatomi eraldamise ajal moodustatud radikaalne metüülradikaal metaanist etaani-etüül, propaani - propüül- jne.
Kui vesinikuaatom eraldatakse süsivesiniku molekulist, moodustuvad monovalentsed osakesed, mida nimetatakse radikaalideks (R). Radikaali nimi annab süsivesinikule, kust see radikaal valmistatakse, samal ajal kui lõpp -N-i muudatused lõpevad. Näiteks on vesinikuaatomi eraldamise ajal moodustatud radikaalne metüülradikaal metaanist etaani-etüül, propaani - propüül- jne.
Samuti moodustatakse radikaalid anorgaanilised ühendid. Näiteks lämmastikhappes on võimalik saada monovalentse radikaali -no2-radikaali, mida nimetatakse nitroupiks.
Molekulist eraldamisel Alkan kaks vesinikuaatomit moodustavad kahevalentse radikaalidega, mille nimed moodustavad ka vastavate süsivesinike nimed, kuid lõpevad muudatused:
- orin, juhul, kui vesinikuaatomid rebib ühest süsinikuaatomist välja,
- ilen, juhul kui kaks vesinikuaatomit on välja rebitud kahe naabruses süsinikuaatomiga.
Alkana: keemilised omadused
Kaaluge alkaanidele iseloomulikke reaktsioone. Kõik alkaanid on üldistele keemilistele omadustele omane. Need ained on madala aktiivsed.
Kõik süsivesinikega seotud reaktsioonid on jagatud kahte tüüpi:
- side S-H (näide on asendusreaktsioon);
- side vahe C-C (pragunemine, üksikute osade moodustumine).
Väga aktiivne radikaalse moodustumise hetkel. Iseendaga eksisteerivad nad sekundite osakaalu. Radikaalid sisenevad kergesti reaktsiooni omavahel. Nende paarimata elektronid moodustavad uue kovalentse ühenduse. Näide: CH3 + CH3 → C2H6
Radikaalid sisenevad kergesti reaktsiooni orgaaniliste molekulidega. Nad on kas nendega liitunud või nendega eraldatud nendest ebamugav elektronidest, mille tulemusena ilmuvad uued radikaalid, mis omakorda võivad siseneda teiste molekulidega reaktsioonidesse. Sellise ahelreaktsiooni abil saadakse makromolekulid, mis lakkavad kasvama ainult siis, kui ahela katkestused (näiteks: kahe radikaalide ühendamine)
Vabade radikaalide reaktsioonid selgitavad paljusid olulisi keemilisi protsesse, näiteks:
- Plahvatused;
- Oksüdatsioon;
- Lõhenemisõli;
- Küllastumata ühendite polümerisatsioon.
 Detail kaaluge keemilisi omadusi Metaani näites küllastunud süsivesinikud. Oleme juba leidnud alkaani molekuli struktuuri. Süsinikuaatomid asuvad metaani molekulis SP3 hübridisatsiooni olekus ja moodustub üsna vastupidav ühendus. Metaan on lõhna ja värvide gaasibaas. See on lihtsam kui õhk. Vees veidi lahusti.
Detail kaaluge keemilisi omadusi Metaani näites küllastunud süsivesinikud. Oleme juba leidnud alkaani molekuli struktuuri. Süsinikuaatomid asuvad metaani molekulis SP3 hübridisatsiooni olekus ja moodustub üsna vastupidav ühendus. Metaan on lõhna ja värvide gaasibaas. See on lihtsam kui õhk. Vees veidi lahusti.
Alkana võib põletada. Metaan põletab sinise leegiga. Sellisel juhul on reaktsiooni tulemus süsinikmonooksiid ja vesi. Kui segatakse õhuga, samuti hapnikuga segus, eriti kui mahtude suhe on 1: 2, moodustab süsivesinike andmed plahvatusohtlikke segusid, mistõttu on see äärmiselt ohtlik igapäevaelus ja kaevandustes. Kui metaani põleb täielikult, moodustub tahm. Tööstuses saadakse see seega.
Formaldehüüdi ja metüülalkohol saadakse metaanist oksüdeerumisega katalüsaatorite juuresolekul. Kui metaan on tugevalt soojus, laguneb see CH4 → C + 2H2 valemiga
Metaani lagunemine Saate rakendada vahesaadusele spetsiaalselt varustatud ahjudes. Vahesaadus on atsetüleen. Reaktsiooni valemiga 2CH4 → C2H2 + 3H2. Atsetüleeni vabanemine metaanist vähendab tootmiskulusid peaaegu kaks korda.
Samuti saadakse vesinik, mis on saadud metaanist, valmistades metaani muundamise veeauruga. Iseloomulik metaani on asendamise reaktsioonid. Niisiis, tavalisel temperatuuril, vesinik metaanmolekuli ümberasustatakse valguses halogeen (Cl, Br). Seega moodustatakse ained, mida nimetatakse halogeenide derivaatideks. Kloori aatomid, vesinikuaatomite asendamine süsivesiniku molekulis moodustavad erinevate ühenduste segu.
Sellisel segul on klorometaan (CH3Cl või metüülkloriid), diklorometaan (CH2Cl2ili metüleenkloriid), triklorometaan (CHCl3 või kloroform), tetraklorometaan (CCI4 või süsiniktetrakloriid).
Ükskõik millise neist ühenditest võib segust eraldada. Tootmises, kloroformi ja tetraklorometaani imporditakse tähtsust, kuna need on orgaaniliste ühendite lahustid (rasv, vaigud, kumm). Halogeenide derivaadid moodustavad ahelavaba radikaalmehhanismiga.
Valgus mõjutab kloori molekule, selle tulemusena nad lagunevad Anorgaanilised radikaalid, mis rebivad vesinikuaatomi ühe elektroniga metaanmolekulist. Samal ajal moodustuvad HCl ja metüül. Metüül reageerib kloori molekuliga, mille tulemuseks on halogeenide derivaat ja klooriradikaal. Seejärel jätkab klooriradikaal ahelreaktsiooni.
Normaalsel temperatuuril on metaanil piisav resistentsus leelistele, hapetele, paljudele oksüdeeritele. Erand - lämmastikhape. Reaktsiooniga on moodustatud nitrometaan ja vesi.
Metaani ühendusreaktsioonid ei ole iseloomulikud, kuna kõik oma molekuli valents on küllastunud.
Reaktsioonid, milles süsivesinikud võivad toimuda mitte ainult C-H-ühenduse jagamisega, vaid ka C-S jaotusega. Sellised muutused esinevad kõrge temperatuuri juuresolekul. ja katalüsaatorid. Selliste reaktsioonide hulka kuuluvad dehüdrogeenimine ja pragunemine.
Küllastunud süsivesinike oksüdatsioonist saadakse happed - äädikhapped (butaanist), rasvhapped (parafiinist).
Metaani saamine
 Looduses metaan Lai laialt levinud. See on enamiku põlevate looduslike ja kunstiliste gaaside peamine komponent. See eristatakse kivisöe reservuaaridest kaevanduste hulgast soomuse alt. Maagaasid (mis on väga märgatavad naftaväljade gaasides), sisaldavad mitte ainult metaani, vaid ka teisi alkaanid. Nende ainete kasutamine on mitmekesine. Neid kasutatakse kütusena erinevates tööstusharudes meditsiinis ja tehnoloogias.
Looduses metaan Lai laialt levinud. See on enamiku põlevate looduslike ja kunstiliste gaaside peamine komponent. See eristatakse kivisöe reservuaaridest kaevanduste hulgast soomuse alt. Maagaasid (mis on väga märgatavad naftaväljade gaasides), sisaldavad mitte ainult metaani, vaid ka teisi alkaanid. Nende ainete kasutamine on mitmekesine. Neid kasutatakse kütusena erinevates tööstusharudes meditsiinis ja tehnoloogias.
Laboratoorsetes tingimustes eraldatakse see gaas, kui segu kuumutatakse naatriumatsetaadi + naatriumhüdroksiidi abil, samuti alumiiniumi ja veekarbiidi reaktsiooni. Samuti saadakse metaani lihtsatest ainetest. Selle kohustusliku seisundi jaoks on küte ja katalüsaator. Tööstuslik tähtsus on veeauru põhjal metaani sünteesi hankimine.
Metaani ja selle homoloogide võib saada sobivate orgaaniliste hapete soolade kaltsineerides leelisega. Teine võimalus alkaanlaste saamiseks on Würzi reaktsioon, mille juures kuumutatakse monogalogeenset tootmist metalli naatriumiga.