Alkani djeluju s vodikom. Međunarodna nomenklatura Alkanova. Alkans: struktura, svojstva. Kemijska svojstva aromatskih ugljikovodika
Granični ugljikovodici su takvi spojevi koji su molekule koje se sastoje od ugljikovih atoma koji su u stanju hibridizacije SP3. Oni su povezani jedni s drugima isključivo kovalentne sigma obveznice. Naziv "Limit" ili "zasićeni" ugljikovodici odvijaju od činjenice da ovi spojevi ne mogu pričvrstiti atome. Oni su izuzetno zasićeni. Iznimka je cikloalkana.
Što je Alkana?
Alkani su ugljikovodici granice, a njihov ugljični lanac se uklanja i sastoji se od ugljikovih atoma međusobno povezanim korištenjem pojedinačnih veza. Ona ne sadrži druge (to jest, dvostruki, kao alkeni ili trostruki, poput alkilov). Alkaans se također nazivaju parafinima. Dobili su ovo ime, budući da su poznati parafini mješavina su pretežno ovih graničnih ugljikovodika s 18-C5 s posebnom inertnom.
Opće informacije o Alkancima i njihovim radikalima
Njihova formula: C N p2 N + 2, ovdje n je veća ili jednaka 1. molarna masa se izračunava pomoću formule: m \u003d 14N + 2. karakteristika: kraj njihovih imena je "-an". Ostaci njihovih molekula koji se formiraju kao rezultat zamjene atoma vodika na druge atome nazivaju se alifatski radikali ili alkili. Oni su označeni slovom R. Opće formule za monovalentne alifatske radikale: s NP2N + 1, ovdje n je veća ili jednaka 1. molarna masa alifatskih radikala izračunava se formulom: m \u003d 14N + 1 , Karakteristična značajka alifatskih radikala: završava u imenima "- il. Alkanovljeve molekule imaju vlastite karakteristike strukture:
- priključak C-C karakterizira duljina od 0,154 nm;
- c-H je karakterizirana duljinom od 0,109 nm;
- kut valencije (kut između veza ugljik) jednak je 109 stupnjeva i 28 minuta.

Homologni seriji alkana počinju: metana, etan, propan, butan, i tako dalje.
Fizička svojstva alkanovog
Alkaans su tvari koje nemaju boje i netopljive u vodi. Temperatura u kojoj se alkani početi rastopiti, a temperatura na kojoj kuhati rastu se u skladu s povećanjem molekulske mase i duljine ugljikovodičnog lanca. Od manje razgranata do razgranata alkana, temperatura vrenja i taljenja se spuštaju. Galijski alkani mogu spaliti blijedo plavi ili bezbojni plamen, dok se jako ističe. CH4-C4H10 je plinovi koji su također odsutni i miris. C5H12-C12H32 je tekućine koje imaju određeni miris. Od 15 n 32 i tako dalje, to su krute tvari koje također ne mirise.
Kemijska svojstva alkanovog
Ovi spojevi su nisko aktivni u kemijskom planu, koji se može objasniti snagom hard-rafiniranih sigma-linkova - C-C i C-N. Također treba imati na umu da su odnosi s c-c ne-polarni, a SN je nisko-polarni. To su nisko-polarizabilni tipovi veza vezanih uz sigmu izgleda i, prema tome, razbiti najveću vjerojatnost da će postati gomolitički mehanizam, kao posljedica toga što će se formirati radikali. Tako su kemijska svojstva alkanana uglavnom ograničena na reakcije radikalne supstitucije.

Reakcije s njom
Alkanci komuniciraju samo s dušičnom kiselinom s koncentracijom od 10% ili s tetrafnim dušikovim oksidom u plinskom mediju na temperaturi od 140 ° C. Reakcija nitracije alkana naziva se konovalovska reakcija. Kao rezultat toga, formirani su nitro spojevi i voda: CH4 + dušična kiselina (razrijeđena) \u003d CH3 - NO2 (nitrometan) + voda.
Spaljivanje reakcija
Granični ugljikovodici se vrlo često koriste kao gorivo, koji je opravdan njihovom tjelesnom sposobnošću: s n p2N + 2 + ((3N + 1) / 2) o2 \u003d (N + 1) H20 + n CO 2.
Reakcije oksidacije
U kemijskim svojstvima alkanana također uključuje njihovu sposobnost oksidacije. Ovisno o tome koji su uvjeti popraćeni reakcijom i kako se mijenjaju, mogu se dobiti iz iste tvari za dobivanje različitih krajnjih proizvoda. Meka oksidacija metana kisika u prisutnosti katalizatora koji ubrzava reakciju, a temperature od oko 200 ° C mogu rezultirati sljedećim tvarima:
1) 2CH4 (oksidacija kisika) \u003d 2SH3 (alkohol - metanol).
2) CH4 (oksidacija kisika) \u003d CH2O (aldehid - metanal ili formaldehid) + n2O.
3) 2CH4 (oksidacija kisika) \u003d 2nson (karboksilna kiselina - metan ili formic) + 2N2O.

Također, oksidacija alkana može se proizvesti u plinovitom ili tekućem zraku. Takve reakcije dovode do stvaranja viših masnih alkohola i odgovarajućih kiselina.
Stav prema grijanju
Na temperaturama koje ne prelaze + 150-250 ° C, nužno u prisutnosti katalizatora, nastaje strukturno pregrađivanje organskih tvari, koje se sastoji u mijenjanju reda spoja atoma. Ovaj se postupak naziva izomerizacijom i tvari dobivene kao rezultat reakcijskih izomera. Tako se iz normalnog butan ispada svoj izobutan. Pri temperaturama od 300-600 ° C i prisutnosti katalizatora, postoji ruptura C-H vez da se formiraju molekule vodika (reakcija dehidrogenacije), molekule vodika s zatvaranjem ugljikovog lanca u ciklus (reakcija ciklizacije ili alkanov aromatizacijske reakcije):
1) 2CH4 \u003d C2H4 (Ethen) + 2N 2.
2) 2CH4 \u003d C2H2 (Etin) + 3H2.
3) C7H 16 (normalni heptan) \u003d C6H5-CH3 (toluen) + 4N 2.

Reakcije halogeniranja
Takve reakcije su u uvođenju halogena (njihovi atomi) u molekuli organske tvari, kao rezultat kojim se formira c-halogen priključak. U interakciji alkana s halogenima formiraju se halogeni derivati. Ova reakcija ima specifične značajke. Ona se nastavlja mehanizmom radikala i pravilno pravilno, potrebno je izbaciti halogen i alkanan da utječu na ultraljubičasto zračenje ili jednostavno toplinu. Svojstva alkanana omogućuju tijek halogenirajuće reakcije dok se postigne potpuna supstitucija za atome halogena. To jest, kloriranje metana neće završiti s jednom fazom i proizvodnjom metil klorida. Reakcija će ići dalje, formiraju se svi mogući supstitucijski proizvodi, počevši od klorometana i završavaju s tetraklorometanom. Učinci klora u ovim uvjetima na drugim alkanima rezultirat će stvaranjem raznih proizvoda dobivenih kao posljedica zamjene vodika u različitim atomima ugljika. Od temperature na kojoj je reakcija u tijeku, ovisit će se omjer konačnih proizvoda i brzina njihove formiranja. Što duži ugljikovodični lanac alkana lakše će biti da se ova reakcija. Kada se halogeniranje, ugljikov atom će se najprije zamijeniti s najmanje hidrogeniranim (tercijarno). Primarna će unijeti reakciju nakon svih ostalih. Reakcija halogeniranja će se pojaviti u fazama. Na prvoj fazi, samo jedan atom vodika je supstituiran. S halogenim otopinama (klor i brom voda), alkani ne djeluju.

Reakcije sulfooliranja
Kemijska svojstva alkanana također se nadopunjuju reakcijom sulfooliranja (to se naziva reakcija reakcije). Kada su izloženi ultraljubičastom zračenju, alkani mogu reagirati s smjesom klora i sumpornog dioksida. Kao rezultat toga, nastaje klorid, kao i alkil radikal, koji se pridružuje sumpornom dioksidu. Kao rezultat toga, dobiva se složeni spoj, koji postaje stabilan zbog hvatanja atoma klora i uništavanja njegove molekule: R-H + S02 + Cl2 + ultraljubičasto zračenje \u003d R-S02C1 + HCl. Sulfonil kloridi formirani kao rezultat reakcije naširoko se koriste u proizvodnji surfaktanata.
Najjednostavniji organski spojevi su ugljikovodicikoji se sastoji od ugljika i vodika. Ovisno o prirodi kemijskih veza u ugljikovodicima i odnosu između ugljika i vodika, podijeljeni su na ograničavanje i nepredviđene (alkenete, alkine, itd.)
Ograničitiugljikovodici (alkani, ugljikovodici retka metan) su spojevi ugljika s vodikom, u kojima svaki ugljikov atom troši na spoj s bilo kojim drugim susjednim atomom ne više od jedne valencije, a sva valencija nije dopuštena da se spoje do ugljika vodika. Svi ugljikovi atomi u alkanima su u SP 3 - stanje. Granični ugljikovodici tvore homolognu seriju koju karakterizira opća formula IZ n. N. 2N + 2. , Twin Prioritet ove serije je metana.
Izomerija. Nomenklatura.
Alkanci s n \u003d 1,2,3 mogu postojati samo u obliku jednog izomera
Počevši s n \u003d 4, pojavit će se fenomen strukturnog izomerizma.

Broj strukturnih izomera alkana raste brzo s povećanjem broja ugljikovih atoma, na primjer, pentane ima 3 izomera, heptana - 9, itd.
Broj izomera alkana povećava se i zbog mogućih stereoizomera. Počevši od C 7 N 16, moguće je postojanje kiralnih molekula koje tvore dva enantiomera.
Nomenklatura alkana.
Dominantna nomenklatura je nomenklatura IUPAC-a. U isto vrijeme, predstavlja elemente trivijalnih imena. Dakle, prva četiri člana homologne serije alkana imaju trivijalna imena.
CH 4 - metan
Od 2n 6 - etan
C3H 8 - propan
S 4 h 10 - butan.
Imena preostalih homologa formiraju se od grčkog latinskog numeričkog. Dakle, da se koriste sljedeći članovi niza normalne (nerazvijene) izgradnje, imena se koriste:
Od 5 h 12 - pentan, od 6 h 14 - heksana, od 7 h 18 - heptana,
Od 14 h 30 - Tetradekan, od 15 h 32 - pentadekan, itd.
Osnovna pravila IUPAC za razgranate Alkanov
a) Odaberite najduži nerazgrađeni lanac, čiji je naziv temelj (korijen). Ova osnova dodati sufiks "an"
b) broj ovaj lanac na načelu najmanjih ormarića,
c) supstituent označava kao prefiks abecednim redom koji ukazuje na mjesto lokacije. Ako postoji nekoliko identičnih supstituenata u proljetnoj strukturi, njihov broj ukazuje na grčki numerički.
Ovisno o broju drugih atoma ugljika s kojima je ugljikov atom izravno povezan, razlikovan: primarni, sekundarni, tercijarni i kvartarni atomi ugljika.


Alkilne skupine ili alkilni radikali opisani su kao supstituenti u razgranatim alkancima, koji se smatraju posljedica odbitka od alkane molekule jednog vodikovog atoma.
Naziv alkilnih skupina čine iz imena odgovarajućih alkana zamjenom posljednjeg sufiksa "an" na Soffix "IL".
CH3 - metil
CH3CH2 - etil
CH3CH2CH2 - propil

Za ime razgranatih alkilnih skupina također se koristi numeriranje lanca:

Počevši od etana, alkani su sposobni formirati konformera, koji odgovaraju inhibiranoj konformaciji. Mogućnost prijelaza jedne inhibirane konformacije na drugu kroz zaklonjenu određena je barijerom rotacije. Određivanje strukture, sastav konformera i barijera rotacije su zadaci konformacijske analize. Metode za dobivanje alkana.
1. Frakcijska destilacija prirodnog plina ili frakcije benzinskih ulja.Na taj se način pojedinačni alkani mogu razdvojiti do 11 atoma ugljika.
2. Hidrogeniranje ugljena.Proces se provodi u prisutnosti katalizatora (oksidi i sulfidi molibdena, volframa, nikla) \u200b\u200bna 450-470 ° C i tlakovi do 30 mPa. Ugljen i katalizator se trituriraju u prahu i hidrogenirani hidrogenirani, riblji vodik kroz suspenziju. Dobivene smjese alkana i cikloalkana koriste se kao motorno gorivo.
3. Hidrogenacija CO i sa 2 .
CO + h 2 alkane
CO2 + h 2 alkane
Co, Fe, a drugi se koriste kao katalizatori tih reakcija. D - Elementi.
4. Hidrogeniranje alkina i alkina.

5. Metalorganska sinteza.
ali). Sinteza Watze.
2RHal + 2NA R4 R + 2NAHAL
Ova sinteza je neprikladna ako se dvije različite halolene koriste kao organski reagensi.
b). Protoliza grignarskih reagensa.
R Hal + mg rmghal
Rmghal + hoh RH + mg (oh) Hal
u). Interakcija litij dialkiPrata (LIR 2 CU) s alkil halidima
LIR 2 CU + R X RCU + LIX
Sami litij dialkiPrats dobivaju se dvostupanjskim metodom.
2R Li + cui Lir 2 Cu + lii
6. Elektroliza karboksilnih soli (Sintez Kolbe).
2RCoona + 2H2ON R4 R + 2CO 2 + 2NAOH + H2

7. Roll soli karboksilnih kiselina s alkalijom.
Reakcija se koristi za sintetiziranje nižih alkana.
8. Hidrogenoliza karbonilnih spojeva i halolijanov.
ali). Karbonilni spojevi. Sinteza klimata.

b). Halogeni. Katalitička hidrogenoliza.
![]()
Ni, pt, Pd se koriste kao katalizatori.
c) halogene. Reagens Recovery.
Rhal + 2Hi RH + HHAL + I 2
Kemijska svojstva alkana.
Svi priključci u alkanima su niske polarne, na to se karakteriziraju radikalne reakcije. Odsutnost PI obveznica onemogućuje reakciju vezanja. Za alkanane, reakcija supstitucije, cijepanja, izgaranja je karakteristična.
|
Vrsta i naziv reakcije | |
|
1. Reakcije supstitucije | |
|
A) s halogenima (iz klorCl. 2 I svjetlo, Br. 2 - Kada grijanje) Reakcijske operacije markovnik vladavina (Pravila Markovnikova) - prvenstveno halogen zamjenjuje vodik u najmanje hidrogeniranog ugljikovog atoma. Reakcija prolazi u fazama - za jednu fazu ne više od jednog atoma vodika zamjenjuje se. Najteži način odgovora na jod, i s više, reakcija ne ide na kraj, jer, na primjer, s interakcijom metana s jodinom, nastaje jodid vodik, reagira s jodidnim metilom s formiranjem metana i joda (Reverzibilna reakcija): |
CH 4 + Cl2 → CH3C1 + HCl (klorometan) CH3C1 + Cl2 → CH2C12 + HCl (diklormetan) CH2Cl2 + Cl2 → CHCl3 + HCl (triklormetan) CHCl3 + Cl2 → CCl 4 + HCl (tetraklormetan). |
|
B) nutring (reakcija konolova) Alkanci reagiraju s 10% otopinom dušične kiseline ili dušikovog oksida N204 u plinskoj fazi na temperaturi od 140 ° i blagim tlakom s formiranjem nitro. Reakcija također poštuje pravilo Markovnikovih. Jedan od atoma vodika zamijenjen je ostatkom br2 (nitro skupina) i voda se razlikuje |
|
|
2. Reakcije cijepanja | |
|
A) dehidrogenacija -Pt vodik. Reakcijske uvjete katalizatora -platina i temperatura. |
CH3-CH3 → CH2 \u003d CH2 + H2 |
|
B) pucanje Proces toplinske razgradnje ugljikovodika, na temelju reakcije cijepanja ugljikovog lanca velikih molekula kako bi se stvorilo priključke s kraćim lancem. Na temperaturi od 450-700 o, alkane se raspadaju zbog rupture C-C veza (više izdržljivih C-Npri vezanja takve temperature), a alkane i alkeni se formiraju s manjim brojem ugljikovih atoma. |
C. 6 H. 14 C. 2 H. 6 + C. 4 H. 8 |
|
C) puna toplinska raspadanja |
CH4C + 2H 2 |
|
3. Reakcije oksidacije | |
|
A) Reakcija spaljivanja Kada pale (T \u003d 600 o C), alkani reagiraju s kisikom, dok se njihova oksidacija javlja na ugljični dioksid i vodu. |
C N 2N + 2 + O 2 -\u003e CO 2 + H20 + Q CH 4 + 2O 2-\u003e CO2 + 2H2O + q |
|
B) katalitička oksidacija- s relativno niskim temperaturama i korištenjem katalizatora popraćena je slomom samo dijela veza C-tri puta u sredini molekule i C-N i korištena za dobivanje vrijednih proizvoda: karboksilne kiseline, ketone, aldehide, alkohole. |
Na primjer, s nepotpunom oksidacijom butana (veza komunikacije C2-C3) dobiva se octenom kiselinom |
|
4. Reakcije izomerizacije arakterna ne za sve Alkanov. Pažnja je privučena mogućnost pretvaranja jednog izomera na druge, prisutnost katalizatora. |
C4H10C4H10 |
|
5.. Alkanci s glavnim lancem u 6 ili više ugljikovih atoma također reagirati dehidrociklizacija, ali uvijek će formirati 6-člani ciklus (cikloheksan i njezini derivati). Pod reakcijskim uvjetima, ovaj ciklus je podvrgnut daljnjem dehidrogeniranju i pretvara se u energetski stabilniji benzolni ciklus aromatskog ugljikovodika (arena). |
|
Mehanizam reakcije halogeniranja:
Haloiding
Halogeniranje alkana se odvija kroz radikalni mehanizam. Da bi se pokrenula reakcija, potrebna je smjesa alkana i halogena za zraranje UV svjetla ili topline. Metan kloriranje se ne zaustavlja u fazi dobivanja metil klorida (ako se uzimaju ekvimolarne količine klora i metana) i dovodi do stvaranja svih mogućih supstitucijskih proizvoda, od metil klorida do tetrakloloropora. Kloriranje drugih alkana dovodi do smjese produkata zamjene vodika u različitim atomima ugljika. Omjer proizvoda za kloriranje ovisi o temperaturi. Stopa kloriranja primarnih, sekundarnih i tercijarnih atoma ovisi o temperaturi, pri niskim temperaturama, brzina se smanjuje u retku: tercijarnom, sekundarnom, primarnom. Uz sve veću temperaturu, razlika između brzina se smanjuje dok ne postane ista. Osim kinetičkog čimbenika, distribucija proizvoda za kloriranje ima utjecaj statističkog faktora: vjerojatnost napada klora je 3 puta manji od primarnih i dvostruko više od sekundarne. Prema tome, kloriranje alkana je ne-stero-selektivna reakcija, eliminirajući slučajeve kada je moguć samo jedan monoklorining proizvod.
Halogeniranje je jedna od reakcija supstitucije. Alkanovljeva halogenacija pokorava vladavinu Markovnik (Markovnikov pravila) - prvenstveno halogenira najmanje hidrogenirani ugljikov atom. Alkanan halogeniranje prolazi postupno - u jednoj fazi, ne više od jednog vodikovog atoma je halogenirano.
CH 4 + Cl2 → CH3C1 + HCl (klorometan)
CH3C1 + Cl2 → CH2C12 + HCl (diklormetan)
CH2Cl2 + Cl2 → CHCl3 + HCl (triklormetan)
CHCl3 + Cl2 → CCl 4 + HCl (tetraklormetan).
Pod djelovanjem svjetla, molekula klora propadaju atomima, zatim napadaju molekule metana, suzeći na atom vodika, kao rezultat toga, formiraju se metil radikali, koji se suočavaju s molekulama klora, uništavajući ih i formiranje novih radikala.
Nitching (reakcija konovala)
Alkanci reagiraju s 10% otopinom dušične kiseline ili dušikovog oksida N204 u plinskoj fazi na temperaturi od 140 ° i blagim tlakom s formiranjem nitro. Reakcija također poštuje pravilo Markovnikovih.
RH + HNO 3 \u003d RNO 2 + H20
i.E. Jedan od atoma vodika zamijenjen je ostatkom NO2 (ni-trogrup) i voda se razlikuje.
Značajke strukture izomera snažno se odražavaju tijekom te reakcije, budući da je najlakše zamijeniti atom vodika u nitro skupini u ostatku SI (postojeći samo u nekim izomerima), vodik u CH2 skupini je Manje lako, a još teže - u ostatku CH3.
Parafini su prilično lako istrošiti se u plinskoj fazi na 150-475 ° C dušikovog dioksida ili parova dušičnih kiselina; U ovom slučaju, to se događa djelomično i. oksidacija. Navođenje metana je gotovo isključivo nitrometan:
Svi dostupni podaci ukazuju na slobodni radikalni mehanizam. Kao rezultat reakcije formiraju se smjese proizvoda. Dušična kiselina na uobičajenoj temperaturi gotovo ne djeluje na parafinske ugljikovodike. Kada se grije, djeluje uglavnom kao oksidirajuće sredstvo. Međutim, kao što sam našao M. I. Konovalov (1889), s grijanjem dušične kiseline djeluje djelomično i "soj" način; Reakcija nitracije s slabom dušičnom kiselinom posebno je dobro pod grijanjem i povišenom tlakom. Reakcija nitracije se izražava jednadžbom.
Nakon metana, homolozi daju smjesu različitih nitroparafa zbog cijepanja prolaza. Kada se dobije duširanje etana nitroetanska CH3-CH2 -N02 i nitrometan CH3 -N02. Smjesa nitroparafina se formira iz propana:
Parafini u plinskoj fazi sada se provodi u industrijskoj skali.
Sulflooling:
Važna reakcija je sulfociloracija alkanana. Kada alkan interagira s arhidridom klora i sumpora, vodik se zamjenjuje klorosulfonilnom skupinom:

Faze ove reakcije:
Cl + R: h → R + HCl
R + SO 2 → RSO 2
RSO 2 + CL: Cl → RSO 2 Cl + Cl
Alkanofokloride se lako hidroliziraju na alkansulfoksilost (RSO 2 OH), čiji su natrijeve soli (RSO 3 Na + - natrijev alkanfonat) pokazuju svojstva slične soamovima i koriste se kao determinante.
Fizička svojstva, U normalnim uvjetima, prva četiri člana homologne serije alkanana (od 1 - s 4) su plinovi. Normalni alkani iz pentana do heptadekan (C 5 - C 17 ) - tekućine, počevši od 18 i iznad - krute tvari. Kako se broj ugljikovih atoma povećava u lancu, tj. Uz povećanje relativne molekularne težine, temperatura vrelišta i taljenja povećanja alkana. S istim brojem ugljikovih atoma na alkaviranoj molekuli alkana s razgranatom strukturom, postoje donje točke vrenja od normalnih alkana.
Alkana Praktički netopljivi u vodi, budući da su njihove molekule niske polarne i ne u interakciji s molekulama vode, oni su dobro topljivi u ne-polarnim organskim otapalima, kao što su benzen, tetraklorometan, itd. Tekući alkani se lako miješaju jedni s drugima.
Glavni prirodni izvori alkanan - nafte i prirodnog plina. Razne frakcije ulja sadrže alkane odC 5 h 12 do 30 h 62. Prirodni plin se sastoji od metana (95%) s smjesom etana i propana.
Od sintetičke metode dobivanjaalkanov Možete odabrati sljedeće: /\u003e
jedan . Dobivanje od nezasićenih ugljikovodika. Interakcija alkina ili alkina s vodikom ("hidrogenacija") javlja se u prisutnosti metalnih katalizatora (/\u003e ni, PD ) Kao
grijanje:
Ch w - C ≡sn + 2N 2 → CH3-CH2-CH3.
2. Izlaziti halogenproducts, Pri zagrijavanju alkanana monogalogena s metalnim natrijem, alkani se dobivaju s ugljikovim atomima s dvostrukim brojem (reakcija Würtz): /\u003e
C2H 5 Br + 2 Na + Br - C2H5 → C2H5 - C2H5 + 2 NABR..
Ova reakcija se ne provodi s dva različita halogen-supstituiran Alkani, jer se ispada mješavina tri različita alkanana
3. Dobivanje soli karboksilnih kiselina. Kada spajaju soli bezvodne karboksilne kiseline s alkalijom, alkani se dobivaju sadrže jedan ugljikov atom manji od ugljikovog lanca izvornih karboksilnih kiselina: /\u003e
4. Metan. U električnom luku koji gori u atmosferi vodika, formira se značajna količina metana: /\u003e
C + 2n 2 → ch 4 .
Ista reakcija dolazi s zagrijavanjem ugljika u atmosferi vodika do 400-500 ° C na povišenom tlaku u prisutnosti katalizatora.
U laboratorijskim uvjetima, metani se često dobiva od aluminijskog karbida:
A l 4. C3 + 12N 2 O \u003d ZSN 4 + 4Al (oh) 3.
Kemijska svojstva, U normalnim uvjetima alkane su kemijski inertni. Oni su otporni na mnoge reagense: ne u interakciji s koncentriranim sumporom i dušičnim kiselinama, s koncentriranim i rastaljenim alkalijama, nisu oksidirani jakim oksidizatorima - kalijem permanganatomKmn.Oko 4, itd.
Kemijska stabilnost alkana je zbog visoke čvrstoćes -c-S i C-N veze, kao i njihov ne-polaritet. Ne-polarne veze C-C i C-H u alkanima nisu skloni rupturi ionske, ali su u stanju podijeliti homologiju pod utjecajem aktivnih slobodnih radikala. Stoga su radikalne reakcije karakteristične za alkanane, kao rezultat kojih se dobiju spojevi, gdje su atomi vodika supstituirani s drugim atomima ili skupinama atoma. Prema tome, alkani ulaze u reakciju koja teče kroz mehanizam radikalne supstitucije označenog simbolomS r ( s engleskogzamjena. radikalan). Pod ovim mehanizmom, zamijenjeni su atomi vodika u tercijarnom, zatim na sekundarnim i primarnim atomima.
1. Halogeniranje, Kada interakcija alkanana s halogenima (klorom i bromom) pod djelovanjem UV zračenja ili visoke temperature, mješavina proizvoda od mono- polihalogen-supstituiran Alkananci. Ukupni dijagram ove reakcije prikazan je na primjeru metana: /\u003e
b) rast lanca. Radikal klora uzima atom vodika na molekuli alkane:
Cl.· + CH 4 → Na /\u003e L + CH 3 ·
Istodobno se formira alkilni radikal, koji uzima atom klora na molekuli klora:
CH3 · + C12 → CH3 s L + C l.·
Te se reakcije ponavljaju dok se krug ne razbije u skladu s jednom od reakcija:
Cl.· + Cl.· → s l /\u003e 2, CH3 · + CH3 · → C2H6, CH3 · + Cl.· → CH3 s l ·
Ukupna jednadžba reakcije:
| hv | ||
| CH 4 + SL 2 | → | CH3C1 + HCl. |
Formiranje klorometana može biti podvrgnut daljnjem kloriranju, dajući smjesu proizvodaCH2. Cl. 2, CHC13, ss l4 prema shemi (*).
Razvoj teorije lanaca slobodni radikali Reakcije su usko povezane s imenom izvanrednog ruskog znanstvenika, Nobelove nagrade Laureate N.I. Semenova (1896-1986).
2. Nuliranje (reakcija konolova), Pod djelovanjem razrijeđene dušične kiseline na alkane na 140 ° C i nizak tlak teče radikalna reakcija: /\u003e
S radikalnim reakcijama (halogeniranjem, nitracijom), atomi vodika u tercijarnom, zatim na sekundarnim i primarnim atomima ugljika su miješani. To se objašnjava činjenicom da je upaljač tercijarnog atoma ugljika s vodikom (vezivanje energije 376 (390 KJ / mol), a tek tada - primarna (415 KJ / mol), tada je najlakše.
3. izomerizacija. Normalni alkani pod određenim uvjetima mogu se pretvoriti u alkane s razgranatim lancem: /\u003e
4. Kleška je hemolitička ruptura C-C veza, koja teče kada se zagrijavaju i pod djelovanjem katalizatora.
Na pucanju najviših alkana formiraju se alkeni i niži alkani, formira se acetilen tijekom pucanja metana i etana: /\u003e
C /\u003e 8H 18 → C4H10 + C4N 8, /\u003e
2SH4 → C2H2 + Zn2,
C2H6 → C2H2 + 2N 2.
Te reakcije imaju veliku industrijsku vrijednost. Na taj način frakcije visokog vrenja (loživo ulje) pretvaraju se u benzin, kerozin i druge vrijedne proizvode.
5. Oksidacija. Uz blagu oksidaciju metana kisika u prisutnosti različitih katalizatora, može se dobiti metil alkohol, formaldehid, mravlja kiselina:
 |
Mekana katalitička oksidacija butanskog zraka kisika - jedan od industrijskih metoda za proizvodnju octene kiseline:
t.°
2 C4 /\u003e H /\u003e 10 + 5 O /\u003e 2 → 4 CH /\u003e 3 COOH /\u003e + 2N 2 O .
Mačka.
Na air alkani Snimite u CO 2 i H20: /\u003e
S n 2 n +2 + (s n.+1) / 2O 2 \u003d N s 2 + (n + l) H20.
ALKAANS (ograničavanje ugljikovodika, parafina)
- Alkana - alifatski (aciklički) ekstremni ugljikovodici u kojima su ugljikovi atomi međusobno povezani jednostavnim (pojedinačnim) priključcima u nerazgranatim ili razgranatim lancima.
Alkana - naziv graničnih ugljikovodika na međunarodnoj nomenklaturi.
Parafini- Povijesno osnovano ime, odražavajući svojstva ovih spojeva (od lat. afinis Parrum - Imati malo afiniteta, lapoaktivnog).
Ograničiti, ili zasićenOvi ugljikovodici nazivaju se punom zasićenjem atoma ugljičnog lanca vodika.
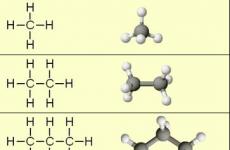
Najjednostavniji predstavnici Alkanova:
Molekula Modeli:


Kada uspoređujete ove spojeve, jasno se razlikuju od drugih za skupinu. -CH 2 - (metilen). Dodavanje druge skupine u propan -CH 2 -, Dobivam bhutan Od 4 h 10, onda alkana Od 5 n 12, Od 6 n 14 itd
Sada možete povući opću formulu alkanana. Broj ugljikovih atoma u nizu Alkanov ćemo uzeti n.
, onda će broj atoma vodika biti veličina 2N + 2.
, Prema tome, sastav Alkanov odgovara općoj formuli C n h 2n + 2.
Stoga se koristi takva definicija:
Alkana - ugljikovodici čiji se sastav izražava općom formulom C n h 2n + 2gdje n. - broj ugljikovih atoma.
Struktura alkanana
Kemijska struktura (Redoslijed spojeva atoma u molekulama) najjednostavnijih alkana, etana i propana - pokazuju njihove strukturne formule, prikazane u poglavlju 2. Iz tih formula jasno je da postoje dvije vrste kemijskih veza u alkanima:
C-s. i C-n..
Komunikacija C-C je kovalentna ne-polarna. Komunikacija C - H je kovalentni slabić, jer Ugljik i vodik su u blizini elektronegabilnosti (2.5 - za ugljik i 2.1 - za vodik). Formiranje kovalentnih veza u alkanima zbog općih elektroničkih parova ugljičnih i vodikovih atoma može se prikazati pomoću elektroničkih formula:

Elektronske i strukturne formule odražavaju kemijska strukturaali ne dajte ideje o tome prostorna struktura molekulašto značajno utječe na svojstva tvari.
Prostorna struktura, Relativni raspored atoma molekula u prostoru ovisi o smjeru atomskih orbitala (AO) ovih atoma. U ugljikovodicima, glavna uloga igra prostornu orijentaciju ugljikovih orbitala, budući da je sferični 1S-A-atom vodika lišen određene orijentacije.
Prostorni raspored ugljika AO zauzvrat ovisi o vrsti hibridizacije (dio I, dio 4.3). Bogat atoma ugljika u alkanima povezan je s još četiri atoma. Prema tome, njegova država odgovara SP 3-hibridizaciji (dio I, odjeljak 4.3.1). U tom slučaju, svaki od četiri sp 3-hibrid ugljika AO je uključen u aksijalni (σ-) koji se preklapa od S-AO vodika ili s SP3 -O-om drugog ugljikovog atoma, formirajući σ-vezu s S-H ili C-C.

Četiri σ-veze ugljika usmjerena su u prostoru pod kutom od 109 ° C 28 ", što odgovara najmanjim odbojnosti elektrona. Stoga molekula najjednostavnijeg predstavnika alkana - metana CH4 - ima oblik tetraedrona , u kojem se nalazi atomi ugljika, a na vrhovima - vodikovim atomima:

Kut valente N-C-N je 109 o 28 ". Prostorna struktura metana može se prikazati pomoću rasutih (ljestvica) i modela skaleline.
Za snimanje je prikladno koristiti prostornu (stereookemijsku) formulu.

U molekuli sljedećeg homologa - etan s 2 h 6 - dva tetraedarska sp. 3 Carbon tepisi čine složenija prostornu strukturu:

Za alkanovljeve molekule koje sadrže preko 2 atoma ugljika, zakrivljeni oblici su karakteristični. To se može prikazati na primjeru n.-Butan (VRML model) ili n.-Penta:

Izomeriya alkanov
- Isomerius - izgled spojeva koji imaju isti sastav (istu molekulsku formulu), ali različitu strukturu. Takvi spojevi se nazivaju isomas.
Razlike u redu spoja atoma u molekulama (tj. U kemijskoj strukturi) dovodi do strukturna izomerija, Struktura strukturnih izomera se odražava strukturnim formulama. U brojnim alkananima, strukturni izomerizam se manifestira kada je sadržaj 4 i više ugljikovih atoma u krugu, tj. Počevši od butana s 4 h 10.
Ako je moguće u molekulama istog sastava i iste kemijske strukture, razne međusobne rasporede atoma u prostoru, zatim se promatraju prostorni izomerizam (stereoizomeria), U tom slučaju, upotreba strukturnih formula nije dovoljna i koristi se modeli molekula ili posebnih formula - stereokemijski (prostorni) ili projekcija.
Alkani, počevši s etan H3C-CH3, postoje u različitim prostornim oblicima ( konformacije) zbog intramolekularne rotacije σ-linkova C-C i manifestiraju tzv rotacijski (konformacijski) izomerizam.
Osim toga, ako postoji ugljikov atom u molekuli povezanoj s 4 različita supstituenta, moguća je druga vrsta prostornog izomerizma, kada dva stereoizomeri međusobno pripadaju kao objekt i njezina zrcalna slika (kao što lijeva ruka odnosi na desno ). Takve razlike u strukturi molekula nazivaju se optička izomerija.
Strukturna izomerija alkanov
- Strukturni izomeri - spojevi istog pripravka, naznačeni postupkom za vezne atome, tj. Kemijska struktura molekula.
Uzrok manifestacije strukturnog izomerizma u nizu Alkana je oprema ugljika atoma da se formira krugovi različitih struktura. Ovaj tip strukturnog izomerizma naziva se izomeria ugljikov kostur.
Na primjer, alkanski pripravak C4H10 može postojati kao dva Strukturni izomeri:

i alkan C5H 12 - u obliku tri strukturni izomeri, naznačeni strukturom ugljikovog lanca:

Uz povećanje broja atoma ugljika u sastavu molekula, mogućnosti za grananje lanca, tj. Količina izomera raste prag broja ugljikovih atoma.

Strukturni izomeri se odlikuju fizičkim svojstvima. Alkani s razgranatom strukturom zbog manje guste ambalaže molekula i, prema tome, manje intermolekularne interakcije, kuruju temperaturu od njihovih nerazgranata izomera.
U izlazu strukturnih formula izomera, koriste sljedeće tehnike.
Ugljikovodici su najjednostavniji organski spojevi. Oni su ugljik i vodik. Spojevi ovih dvaju elemenata nazivaju se granični ugljikovodici ili alkani. Njihov sastav se eksprimira općenito za alkane s CNH2N + 2 formulom, gdje je n broj ugljikovih atoma.
U kontaktu s
Odnoklassnik.
Alkana - međunarodno ime spojeva podataka, Također, ovi spojevi se nazivaju parafini i zasićeni ugljikovodici. Komunikacija u molekulama alkana je jednostavna (ili pojedinačna). Preostala valencija je zasićena atomima vodika. Svi alkani su zasićeni vodikom do granice, a atomi su u stanju SP3 hibridizacije.
Homološki raspon ograničavajućih ugljikovodika
 Prvi u homolognom redu zasićenih ugljikovodika je metana. Njegova formula CH4. Kraj je -ana u ime ograničavanja ugljikovodika, to je prepoznatljiva značajka. Zatim, u skladu s gore navedenom formulom, etan - C2H6 nalaze se u homolognoj seriji, C3H8 propan, butan - C4H10.
Prvi u homolognom redu zasićenih ugljikovodika je metana. Njegova formula CH4. Kraj je -ana u ime ograničavanja ugljikovodika, to je prepoznatljiva značajka. Zatim, u skladu s gore navedenom formulom, etan - C2H6 nalaze se u homolognoj seriji, C3H8 propan, butan - C4H10.
Od petog alkana Homologni seriji naslova spojeva formiraju se kako slijedi: grčki broj koji ukazuje na broj atoma ugljikovodika u molekuli + kraju-inča. Dakle, u glačalima, broj 5 - pande, odnosno, Pentan - C5H1K ide za Butan. Sljedeći - heksan C6H14. Heptan - C7H16, oktan - C8H18, nonanski - C9H20, dean - C10H22, itd.
Fizička svojstva alkanaca značajno se mijenjaju u homolognoj seriji: točka taljenja, povećava se točka vrenja, gustoća se povećava. Metan, etan, propan, butan pod normalnim uvjetima, tj. Na temperaturi od približno 22 stupnjeva topline Celzijusa su plinovi, s pentanom na heksadekanu inkluzivne - tekućine, s heptadekan - krutih tvari. Počevši od Butana, Alkanan ima izomere.
Postoje tablice koje odražavaju promjene u homolognom redu alkananakoji jasno odražavaju njihova fizička svojstva.
Nomenklatura zasićenih ugljikovodika, njihovih derivata
 Ako se atom vodika razdvoji od molekule ugljikovodika, nastaju monovalentne čestice, koje se nazivaju radikali (R). Naziv radikala daje ugljikovodik, iz kojeg se proizvodi ovaj radikal, dok se kraj -nnnnn može promijeniti na kraju. Na primjer, radikalni metil radikal nastaje iz metana tijekom odvajanja atoma vodika, iz etana - etil, iz propan - propil, itd.
Ako se atom vodika razdvoji od molekule ugljikovodika, nastaju monovalentne čestice, koje se nazivaju radikali (R). Naziv radikala daje ugljikovodik, iz kojeg se proizvodi ovaj radikal, dok se kraj -nnnnn može promijeniti na kraju. Na primjer, radikalni metil radikal nastaje iz metana tijekom odvajanja atoma vodika, iz etana - etil, iz propan - propil, itd.
Radikali su također formirani anorganski spojevi. Na primjer, na dušičnoj kiselini, moguće je dobiti monovalentni radikal -N02 radikal, koji se zove nitrav.
Kada se odvajaš od molekule Alkan dva atoma vodika formiraju se od strane bivalentnih radikala, čiji su nazivi nastali i iz naziva odgovarajućih ugljikovodika, ali završetak promjene na:
- u slučaju da su atomi vodika rastrgani iz jednog ugljikovog atoma,
- ilen, u slučaju da su dva atoma vodika rastrgana od dva susjedna atoma ugljika.
Alkana: Kemijska svojstva
Razmotrite reakcije karakteristične za alkanane. Svi alkani su svojstveni općim kemijskim svojstvima. Te su tvari nisko aktivne.
Sve poznate reakcije koje uključuju ugljikovodike su podijeljene u dvije vrste:
- komunikacija S-H (primjer je reakcija supstitucije);
- komunikacijski razmak C-C (pucanje, stvaranje pojedinih dijelova).
Vrlo aktivan u trenutku radikalnog stvaranja. Sami, postoje dionice sekundi. Radikali lako ulaze u reakciju među sobom. Njihovi nespareni elektroni čine novu kovalentnu vezu. Primjer: CH3 + CH3 → C2H6
Radikali lako ulaze u reakciju s organskim molekulama. Oni su im ili spojeni s njima, ili ih se odvojiti od njih bez irmperskog elektrona, zbog čega se pojavljuju novi radikali, koji, zauzvrat, mogu ući u reakcije s drugim molekulama. S takvom lančanom reakcijom dobivaju se makromolekule, koje prestaju rasti samo kada se lanac prekine (primjer: priključak dva radikala)
Reakcije slobodnih radikala objašnjavaju mnoge važne kemijske procese, kao što su:
- Eksplozije;
- Oksidacija;
- Ulje za pucanje;
- Polimerizacija nezasićenih spojeva.
 Detalj razmotrite kemijska svojstva Zasićeni ugljikovodici na primjeru metana. Već smo razmišljali o strukturi molekule alkane. Atomi ugljika nalaze se u molekuli metana u stanju hibridizacije SP3, a formira se prilično trajna veza. Metan je plinska baza mirisa i boja. Lakše je od zraka. U vodi malo otapala.
Detalj razmotrite kemijska svojstva Zasićeni ugljikovodici na primjeru metana. Već smo razmišljali o strukturi molekule alkane. Atomi ugljika nalaze se u molekuli metana u stanju hibridizacije SP3, a formira se prilično trajna veza. Metan je plinska baza mirisa i boja. Lakše je od zraka. U vodi malo otapala.
Alkana može izgorjeti. Metan gori s plavim plamenom. U tom slučaju, rezultat reakcije će biti ugljični monoksid i voda. Kada se pomiješa s zrakom, kao i u smjesi s kisikom, osobito ako je omjer volumena 1: 2, podaci ugljikovodika tvori eksplozivne smjese, zbog čega je izuzetno opasno za uporabu u svakodnevnom životu i rudnicima. Ako metan ne gori potpuno, formira se čađa. U industriji se tako dobiva.
Formaldehid i metil alkohol dobiveni su iz metana oksidacijom u prisutnosti katalizatora. Ako se metan jako zagrijava, dezintegrira se s formulom CH4 → C + 2H2
Propadanje metana Možete provesti na srednji proizvod u posebno opremljenim pećima. Međuprodukt će biti acetilen. Reakcijska formula 2CH4 → C2H2 + 3H2. Oslobađanje acetilena iz metana smanjuje troškove proizvodnje gotovo dva puta.
Također, vodik se također dobiva iz metana, proizvodeći konverziju metana s vodenom parom. Karakteristična za metan su reakcije supstitucije. Dakle, na konvencionalnoj temperaturi, vodik iz molekule metana je premješten na svjetlo halogena (Cl, BR). Tako se formiraju tvari, nazvane halogene derivate. Atomi klora, zamjenjujući atome vodika u molekuli ugljikovodika, tvore mješavinu različitih spojeva.
U takvoj smjesi postoje klorometan (CH3C1 ili metil klorid), diklorometan (CH2Cl2ili metilen klorid), triklormetan (CHCl3 ili kloroform), tetraklormetan (CCl4 ili ugljik tetraklorid).
Bilo koji od ovih spojeva može se izolirati iz smjese. U proizvodnji, kloroform i tetraklorometan se uvoze važnosti, zbog činjenice da su otapala organskih spojeva (masti, smole, gume). Derivati \u200b\u200bhalogena nastaju lancem slobodni radikalni mehanizam.
Svjetlo utječe na molekule klora, kao rezultat kojim se raspadaju Anorganske radikale koji suzvukuju atom vodika s jednim elektronima iz molekule metana. U isto vrijeme, formiraju se HCl i metil. Metil reagira s molekulom klora, što rezultira halogenom derivatom i radikalom klora. Zatim, klor radikal nastavlja lančanu reakciju.
Kod normalnih temperatura, metana ima dovoljnu otpornost na alkaliju, kiseline, mnoge oksidizere. Iznimka - dušična kiselina. Reakcija se formira nitrometanom i vodom.
Reakcije veza za metan nisu karakteristične, jer su sve valencije u njegovoj molekuli zasićene.
Reakcije u kojima se ugljikovodici mogu odvijati ne samo s cijepanjem C-H, već i s razgradnjom C-S. Takve transformacije javljaju se u prisutnosti visokih temperatura. i katalizatori. Takve reakcije uključuju dehidrogenaciju i pucanje.
Od zasićenih ugljikovodika oksidacijom se dobiju - octene (iz butana), masne kiseline (od parafina).
Dobivanje metana
 U prirodi metana Široko rasprostranjena. To je glavna komponenta većine zapaljivih prirodnih i umjetnih plinova. Odlikuje se od spremnika ugljena u rudnicima, s dna močvare. Prirodni plinovi (koji su vrlo vidljivi u pridruženim plinovima naftnih polja) sadrže ne samo metan, već i druge alkane. Korištenje tih tvari je raznolika. Oni se koriste kao gorivo, u različitim industrijama, u medicini i tehnologiji.
U prirodi metana Široko rasprostranjena. To je glavna komponenta većine zapaljivih prirodnih i umjetnih plinova. Odlikuje se od spremnika ugljena u rudnicima, s dna močvare. Prirodni plinovi (koji su vrlo vidljivi u pridruženim plinovima naftnih polja) sadrže ne samo metan, već i druge alkane. Korištenje tih tvari je raznolika. Oni se koriste kao gorivo, u različitim industrijama, u medicini i tehnologiji.
Prema laboratorijskim uvjetima, ovaj plin se izolira kada se smjesa zagrijava natrijevim acetatom + natrijevim hidroksidom, kao i reakcijom aluminija i vodenog karbida. Također se dobiva metan iz jednostavnih tvari. Za ove obvezne uvjete su grijanje i katalizator. Industrijska važnost dobiva sintezu metana na temelju vodene pare.
Metan i njegove homologe mogu se dobiti kalcing soli odgovarajućih organskih kiselina s alkalizom. Drugi način dobivanja alkanana je reakcija Würza, na kojoj se zagrijava monogalogena proizvodnja s metalnim natrija.