Alkanes tương tác với hydro. Danh pháp quốc tế của Alkanov. Alkaans: Cấu trúc, tính chất. Tính chất hóa học của hydrocarbon thơm
Hạn chế hydrocarbon là các hợp chất như vậy là các phân tử bao gồm các nguyên tử carbon trong trạng thái lai sp 3. Chúng được kết nối với nhau trái phiếu sigma cộng đồng độc quyền. Tên "giới hạn" hoặc "bão hydrocarbon" bão hòa tiến hành từ thực tế là các hợp chất này không thể gắn bất kỳ nguyên tử nào. Chúng cực kỳ bão hòa. Ngoại lệ là Cycloalkanes.
Alkanes là gì?
Người dân Alkan là hydrocarbon của giới hạn, và chuỗi carbon của chúng được không được giải nén và bao gồm các nguyên tử carbon được kết nối với nhau bằng cách sử dụng các mối quan hệ duy nhất. Nó không chứa những người khác (nghĩa là, gấp đôi, như các kiềm hoặc ba, như alkylov) kết nối. Alkaans còn được gọi là parafin. Họ đã lấy được tên này, vì những parafin nổi tiếng là một hỗn hợp chủ yếu là những hydrocarbon giới hạn với 18 -c 35 với sự trung bình đặc biệt.
Thông tin chung về Alkans và các gốc của họ
Công thức của chúng: C N P 2 N +2, TẠI ĐÂY N lớn hơn hoặc bằng 1. Khối lượng mol được tính theo công thức: M \u003d 14N + 2. Một tính năng đặc trưng: kết thúc trong tên của chúng là "-an." Phần còn lại của các phân tử của chúng được hình thành do thay thế các nguyên tử hydro vào các nguyên tử khác được gọi là các gốc aliphatic hoặc alkyl. Chúng được ký hiệu bởi chữ R. Công thức chung cho các gốc Aliphatic monovalent: với NP 2 N +1, ở đây N lớn hơn hoặc bằng 1. Khối lượng mol của các gốc Aliphatic được tính theo công thức: M \u003d 14N + 1 . Đặc điểm đặc trưng của các gốc Aliphatic: kết thúc trong tên "- il. Các phân tử Alkanov có đặc điểm riêng của cấu trúc:
- kết nối của C-C được đặc trưng bởi chiều dài 0,154nm;
- kết nối C-H được đặc trưng bởi độ dài 0,109nm;
- góc hóa trị (góc giữa các liên kết carbon carbon) bằng 109 độ và 28 phút.

Sê-ri Alkanes tương đồng bắt đầu: Methane, Ethane, Propane, Butane, v.v.
Tính chất vật lý của Alkanov
Alkaans là những chất không có màu sắc và không hòa tan trong nước. Nhiệt độ trong đó các alkanes bắt đầu tan chảy và nhiệt độ mà chúng sôi đang tăng theo sự gia tăng trọng lượng phân tử và chiều dài của chuỗi hydrocarbon. Từ ít phân nhánh đến các kiềm phân nhánh nhiều hơn, nhiệt độ sôi và nóng chảy được hạ xuống. Alkanes khí có khả năng đốt cháy một ngọn lửa màu xanh nhạt hoặc không màu, trong khi khá nhiều nhiệt nổi bật. CH 4 -C 4 H 10 là khí cũng vắng mặt và mùi. C 5 H 12 -C 15 H 32 là chất lỏng có mùi cụ thể. Từ 15 N 32, v.v., đây là những chất rắn cũng không có mùi.
Tính chất hóa học của Alkanov
Các hợp chất này hoạt động thấp trong một kế hoạch hóa học, có thể được giải thích bằng sức mạnh của các liên kết Sigma tinh tế cứng - C-C và C-N. Nó cũng nên được ghi nhớ rằng quan hệ với C - C là phi cực và SN là cực thấp. Đây là những loại liên kết cực thấp liên quan đến Sigma về ngoại hình và, theo đó, để phá vỡ xác suất lớn nhất mà chúng sẽ trở thành một cơ chế gomolicative, do kết quả của những điểm gốc sẽ được hình thành. Do đó, các tính chất hóa học của kiềm kiêm chủ yếu giới hạn trong các phản ứng của sự thay thế triệt để.

Phản ứng nẹp
Alkans tương tác chỉ với axit nitric với nồng độ 10% hoặc với oxit nitơ tetraphic trong môi trường khí ở nhiệt độ 140 ° C. Phản ứng của Alkane Nitrat hóa được gọi là phản ứng của Konovalov. Do đó, các hợp chất nitro và nước được hình thành: CH 4 + axit nitric (pha loãng) \u003d CH 3 - NO 2 (Nitrometan) + Nước.
Phản ứng cháy bỏng
Hạn chế hydrocarbon rất thường được sử dụng làm nhiên liệu, được chứng minh bằng khả năng cơ thể của chúng: với N P 2N + 2 + ((3N + 1) / 2) O 2 \u003d (N + 1) H 2 O + N CO 2.
Phản ứng oxy hóa
Trong các tính chất hóa học của Alkans cũng bao gồm khả năng oxy hóa của chúng. Tùy thuộc vào những điều kiện nào được kèm theo phản ứng và cách chúng được thay đổi, có thể lấy được từ cùng một chất để có được các sản phẩm cuối cùng khác nhau. Sự oxy hóa mềm của oxy metan với sự hiện diện của một chất xúc tác làm tăng tốc độ phản ứng và nhiệt độ khoảng 200 ° C có thể dẫn đến các chất sau:
1) 2CH 4 (oxy hóa oxy) \u003d 2sh 3 nó (rượu - metanol).
2) CH 4 (oxy hóa oxy) \u003d CH 2 O (Aldehyd - Methanal hoặc formaldehyd) + N 2 O.
3) 2CH 4 (oxy hóa oxy) \u003d 2nson (axit carboxylic - metan hoặc figic) + 2n 2 o.

Ngoài ra, quá trình oxy hóa của Alkanes có thể được sản xuất trong một không khí khí hoặc lỏng. Các phản ứng như vậy dẫn đến sự hình thành của rượu béo cao hơn và axit tương ứng.
Thái độ để sưởi ấm
Ở nhiệt độ không quá + 150-250 ° C, nhất thiết phải có sự hiện diện của chất xúc tác, một sự sắp xếp lại cấu trúc của các chất hữu cơ xảy ra, bao gồm thay đổi thứ tự của hợp chất của các nguyên tử. Quá trình này được gọi là đồng phân hóa và các chất thu được do kết quả của phản ứng - đồng phân. Do đó, từ butan thông thường, nó hóa ra đồng phân của nó - isobutane. Ở nhiệt độ 300-600 ° C và sự hiện diện của chất xúc tác, có sự vỡ của các liên kết C-H để tạo thành các phân tử hydro (phản ứng khử nước), các phân tử hydro có đóng xích carbon thành một chu trình (phản ứng chu kỳ hoặc phản ứng aromatization alkanov):
1) 2ch 4 \u003d C 2 H 4 (ETHEN) + 2N 2.
2) 2ch 4 \u003d C 2 H 2 (ethin) + 3H 2.
3) C 7 H 16 (Heptane bình thường) \u003d C 6 H 5 - CH 3 (Toluene) + 4N 2.

Phản ứng halogenation
Các phản ứng như vậy đang trong việc giới thiệu halogen (nguyên tử của chúng) trong phân tử chất hữu cơ, do kết quả của kết nối C-halogen được hình thành. Trong sự tương tác của các alkanes với halogen, các dẫn xuất halogen được hình thành. Phản ứng này có các tính năng cụ thể. Nó tiến hành theo cơ chế triệt để, và đúng cách đúng cách, cần phải thực hiện halogen và alkan để ảnh hưởng đến bức xạ tia cực tím hoặc chỉ cần làm nóng nó. Các tính chất của Alkan cho phép phản ứng halogen chảy cho đến khi hoàn toàn thay thế cho các nguyên tử halogen sẽ đạt được. Đó là, sự clo của khí mêtan sẽ không kết thúc bằng một giai đoạn và việc sản xuất methyl clorua. Phản ứng sẽ đi xa hơn, tất cả các sản phẩm thay thế có thể sẽ được hình thành, bắt đầu với chloromethane và kết thúc bằng tetrachloromethane. Tác dụng của clo trong các điều kiện này đối với các kiềm khác sẽ dẫn đến sự hình thành các sản phẩm khác nhau thu được do thay thế hydro trong các nguyên tử carbon khác nhau. Từ nhiệt độ mà tại đó phản ứng đang được tiến hành, tỷ lệ của các sản phẩm hữu hạn và tốc độ hình thành của chúng sẽ phụ thuộc. Chuỗi hydrocarbon dài hơn của Alkane, sẽ dễ dàng hơn để đi phản ứng này. Khi halogenation, nguyên tử carbon sẽ được thay thế bằng ít hydro hóa ít nhất (thứ ba). Chính sẽ nhập phản ứng sau tất cả những người khác. Phản ứng halogenation sẽ xảy ra trong các giai đoạn. Ở giai đoạn đầu tiên, chỉ có một nguyên tử hydro được thay thế. Với các dung dịch halogen (nước clo và brom), Alkanes không tương tác.

Phản ứng sulfooling.
Các tính chất hóa học của Alkaners cũng được bổ sung bởi phản ứng sulfooling (nó được gọi là phản ứng của phản ứng). Khi tiếp xúc với bức xạ cực tím, các alkanes có khả năng phản ứng với hỗn hợp clo và sulfur dioxide. Do đó, clorua được hình thành, cũng như một gốc alkyl, tham gia lưu huỳnh dioxide. Do đó, một hợp chất phức tạp thu được, trở nên ổn định do sự bắt giữ nguyên tử clo và sự phá hủy của một phân tử của nó: R-H + nên 2 + CL 2 + tia cực tím \u003d R - SO 2 CL + HCL. Các sulfonyl clorua được hình thành do kết quả của phản ứng được sử dụng rộng rãi trong sản xuất chất hoạt động bề mặt.
Các hợp chất hữu cơ đơn giản nhất là hydrocarbons.bao gồm carbon và hydro. Tùy thuộc vào bản chất của liên kết hóa học trong hydrocarbon và mối quan hệ giữa carbon và hydro, chúng được chia thành hạn chế và không lường trước (kiềm, kiềm, v.v.)
Giới hạnhydrocarbon (Alkanes, hydrocarbon của metan hàng) là các hợp chất của carbon với hydro, trong các phân tử mà mỗi nguyên tử carbon dành trên một hợp chất với bất kỳ nguyên tử lân cận nào khác không quá một hóa trị, và tất cả các hóa trị không được phép kết nối đến hydro carbon. Tất cả các nguyên tử carbon ở Alkanes đều trong SP 3 - Điều kiện. Hạn chế hydrocarbons tạo thành một loạt tương đồng đặc trưng bởi công thức chung TỪ n. N. 2n + 2. . Ưu tiên sinh đôi của loạt phim này là metan.
Isomeria. Danh pháp.
Alkans với n \u003d 1,2,3 có thể chỉ tồn tại ở dạng một đồng phân
Bắt đầu với n \u003d 4, hiện tượng của chủ nghĩa đồng phân cấu trúc xuất hiện.

Số lượng đồng phân cấu trúc của Alkanes đang phát triển nhanh chóng với sự gia tăng số lượng nguyên tử carbon, ví dụ, Pentane có 3 đồng phân, heptane - 9, v.v.
Số lượng đồng phân Alkane tăng và do các trình phân lập có thể. Bắt đầu với C 7 N 16, sự tồn tại của các phân tử chirus tạo thành hai người enantiomers là có thể.
Danh pháp của Alkanes.
Danh pháp chiếm ưu thế là danh pháp IUPAC. Đồng thời, nó trình bày các yếu tố của tên tầm thường. Do đó, bốn thành viên đầu tiên của loạt Alkanes tương đồng có tên tầm thường.
Ch 4 - metan
Từ 2n 6 - ethane
C 3 H 8 - Propane
Với 4 H 10 - Bhutan.
Tên của những tương đồng còn lại được hình thành từ số Latin Hy Lạp. Vì vậy, đối với các thành viên sau của một số bản dựng, tên, tên được sử dụng),:
Từ 5 h 12 - Pentan, từ 6 giờ 14 - Hexane, từ 7 giờ 18 - Heptane,
Từ 14 H 30 - Tetradecan, từ 15 h 32 - Pentadecan, v.v.
Quy tắc cơ bản của IUPAC cho Alkanov phân nhánh
a) Chọn chuỗi không phân biệt dài nhất, tên của đó là cơ sở (root). Cơ sở này thêm hậu tố "một"
b) Số chuỗi này về nguyên tắc của ít tủ khóa,
c) THIẾT LẬP THIẾT LẬP là tiền tố theo thứ tự bảng chữ cái biểu thị vị trí của vị trí. Nếu có một số nhóm nguyên chất giống hệt nhau trong cấu trúc lò xo, thì số lượng của chúng cho biết số lượng Hy Lạp.
Tùy thuộc vào số lượng các nguyên tử carbon khác mà nguyên tử carbon được kết nối trực tiếp, phân biệt: nguyên tử cacin, thứ cấp, thứ ba và bậc bốn.


Các nhóm alkyl hoặc các gốc alkyl được mô tả như các nhóm nguyên chất trong các kiềm phân nhánh, được coi là kết quả của việc khấu trừ từ phân tử alkane của một nguyên tử hydro.
Tên của các nhóm alkyl hình thành từ tên của các alkanes tương ứng bằng cách thay thế hậu tố cuối cùng "một" cho soffix "il".
CH 3 - Methyl
Ch 3 ch 2 - ethyl
CH 3 CH 2 CH 2 - Propil

Đối với tên của các nhóm alkyl được phân nhánh, việc đánh số chuỗi cũng được sử dụng:

Bắt đầu bằng Ethane, Alkanes có khả năng tạo thành phù hợp, tương ứng với cấu trúc bị ức chế. Khả năng chuyển đổi một cấu trúc bị ức chế đối với một biện pháp khác thông qua sự che khuất được xác định bởi hàng rào quay. Xác định cấu trúc, thành phần của sự phù hợp và hàng rào xoay là các nhiệm vụ phân tích hình dạng. Phương pháp để có được alkanes.
1. Chưng cất phân đoạn khí tự nhiên hoặc phần dầu xăng.Bằng cách này, các alkanes riêng lẻ có thể được tách thành 11 nguyên tử carbon.
2. Hydro hóa than.Quá trình này được thực hiện với sự hiện diện của các chất xúc tác (oxit và sulfide molypden, vonfram, niken) ở 450-470 ° C và áp suất lên tới 30 MPa. Than và chất xúc tác được chiturated trong bột và hydro hóa hydro hóa, strubbing hydro qua một hệ thống treo. Các hỗn hợp kết quả của Alkanes và Cycloalkanes được sử dụng như nhiên liệu động cơ.
3. Hy hydro hóa và với 2 .
CO + H 2 Alkanes
CO 2 + H 2 Alkanes
CO, FE, và các loại khác được sử dụng làm chất xúc tác của những phản ứng này. D - các yếu tố.
4. Hydro hóa các kiềm và kiềm.

5. Tổng hợp kim loại.
nhưng). Tổng hợp Watza.
2RHAL + 2NA R R + 2NAHAL
Tổng hợp này không phù hợp nếu hai halolennas khác nhau được sử dụng làm thuốc thử hữu cơ.
b). Phù hợp thuốc thử grignar.
R hal + mg rmghal
Rmghal + hoh rh + mg (oh) hal
trong). Tương tác của lithium dialkiprats (lir 2 cu) với alkyl halogen
Lir 2 cu + r x r r r + rcu + lix
Bản thân dialkiprats lithium được lấy bằng phương pháp hai giai đoạn.
2R LI + CUI lir 2 cu + lii
6. Điện phân muối carboxylic (sintez kolbe).
2Rcoona + 2H 2 O R R + 2CO 2 + 2NAOH + H 2

7. Cuộn muối axit cacboxylic với kiềm.
Phản ứng được sử dụng để tổng hợp các kiềm thấp hơn.
8. Hydro hóa các hợp chất carbonyl và halolyanov.
nhưng). Hợp chất carbonyl. Tổng hợp clement.

b). Halogen. Catalytic hydroolysis.
![]()
Ni, PT, PD được sử dụng làm chất xúc tác.
c) halogen. Phục hồi thuốc thử.
Rhal + 2HI rh + hhal + I 2
Tính chất hóa học của Alkanes.
Tất cả các kết nối ở Alkanes là cực thấp, trên đây chúng được đặc trưng bởi các phản ứng triệt để. Sự vắng mặt của liên kết PI làm cho không thể phản ứng của sự gắn bó. Đối với Alkan, phản ứng của sự thay thế, phân tách, đốt cháy là đặc trưng.
|
Loại và tên của phản ứng | |
|
1. Phản ứng của sự thay thế | |
|
A) với halogen (từ chlorom.CL. 2 -Và ánh sáng, Br. 2 - Khi sưởi ấm.) Phản ứng tuân theo quy tắc Markovnik (quy tắc Markovnikova) - Chủ yếu halogen thay thế hydro trong nguyên tử carbon hydro hóa ít nhất. Phản ứng vượt qua trong các giai đoạn - đối với một giai đoạn không quá một nguyên tử hydro được thay thế. Cách khó khăn nhất để đáp ứng với iốt, và với hơn nữa, phản ứng không đi đến cuối cùng, ví dụ, với sự tương tác của khí mê-tan với iốt, iodide hydro được hình thành, phản ứng với methyl iốt với sự hình thành metan và iốt (hồi phục lại): |
CH 4 + CL 2 → CH 3 CL + HCL (chloromethane) CH 3 CL + CL 2 → CH 2 CL 2 + HCL (Dichloromethane) Ch 2 cl 2 + cl 2 → chcl 3 + hcl (trichloromethane) CHCL 3 + CL 2 → CCL 4 + HCL (Tetrachloromethane). |
|
B) Nuting (phản ứng Konovalov) Alkans đang phản ứng với dung dịch axit nitric 10% hoặc nitơ oxit n 2 o 4 trong pha khí ở nhiệt độ 140 ° và áp suất nhẹ với sự hình thành của sản xuất nitro. Phản ứng cũng tuân theo quy tắc của Markovnikov. Một trong những nguyên tử hydro được thay thế bằng dư lượng số 2 (nhóm Nitro) và nước được phân biệt |
|
|
2. Phản ứng của sự phân tách | |
|
A) mất nước -Pt hydro. Điều kiện phản ứng Catalyst -platin và nhiệt độ. |
CH 3 - CH 3 → CH 2 \u003d CH 2 + H 2 |
|
B) nứt Quá trình phân hủy nhiệt của hydrocarbon, dựa trên phản ứng của sự phân tách chuỗi carbon của các phân tử lớn để tạo thành các kết nối với một chuỗi ngắn hơn. Ở nhiệt độ 450-700 O, các kiềm làm tan rã do vỡ liên kết C-C (liên kết C-NPRI bền hơn của nhiệt độ như vậy được bảo tồn) và kiềm và kiềm được hình thành với số nguyên tử carbon nhỏ hơn. |
C. 6 Hòx 14 C. 2 Hòx 6 + C. 4 Hòx 8 |
|
C) Phân hủy nhiệt đầy đủ |
CH 4 C + 2H 2 |
|
3. Phản ứng oxy hóa | |
|
A) phản ứng cháy bỏng Khi đốt cháy (t \u003d 600 o c), các kiềm phản ứng với oxy, trong khi quá trình oxy hóa của chúng xảy ra với carbon dioxide và nước. |
C N 2N + 2 + O 2 -\u003e CO 2 + H 2 O + Q CH 4 + 2O 2 -\u003e CO 2 + 2H 2 O + Q |
|
B) oxy hóa xúc tác- Với nhiệt độ tương đối thấp và sử dụng các chất xúc tác được đi kèm với sự cố chỉ là một phần của các mối liên kết của C-ba lần ở giữa phân tử và C - N và được sử dụng để có được các sản phẩm có giá trị: axit carboxylic, ketone, aldehyd, rượu. |
Ví dụ, với quá trình oxy hóa không hoàn toàn của butan (liên kết của giao tiếp C 2 -c 3) thu được bằng axit axetic |
|
4. Phản ứng của đồng phân hóa arakidea không dành cho tất cả Alkanov. Sự chú ý được rút ra khả năng chuyển đổi một đồng phân sang người khác, sự hiện diện của các chất xúc tác. |
C 4 H 10 C 4 H 10 |
|
5.. Alkans với chuỗi chính trong 6 nguyên tử carbon trở lên cũng phản ứng dehydocyclization, nhưng sẽ luôn luôn tạo thành một chu kỳ 6 thành viên (Cyclohexane và các dẫn xuất của nó). Trong các điều kiện phản ứng, chu trình này phải chịu thêm khử nước và biến thành một chu trình benzol ổn định hơn của hydrocarbon thơm (đấu trường). |
|
Cơ chế phản ứng halogenation:
Haloiding.
Halogenation của Alkanes tiến hành thông qua một cơ chế triệt để. Để bắt đầu phản ứng, một hỗn hợp của Alkane và halogen là cần thiết để chiếu xạ tia UV hoặc nhiệt. Chất khử trùng metan không dừng ở giai đoạn lấy methyl clorua (nếu uống clo và metan được lấy) và dẫn đến sự hình thành tất cả các sản phẩm thay thế có thể, từ methyl clorua đến tetrachloroupar. Việc clo của các alkanes khác dẫn đến hỗn hợp các sản phẩm thay thế hydro trong các nguyên tử carbon khác nhau. Tỷ lệ các sản phẩm clo hóa phụ thuộc vào nhiệt độ. Tỷ lệ clo hóa các nguyên tử nguyên sinh, trung học và đại học phụ thuộc vào nhiệt độ, ở nhiệt độ thấp, tốc độ giảm trong hàng: Thứ ba, Trung học, Chính. Với nhiệt độ tăng, sự khác biệt giữa tốc độ giảm cho đến khi nó trở nên giống nhau. Ngoài yếu tố động học, việc phân phối các sản phẩm clo hóa có tác động của yếu tố thống kê: xác suất của đòn tấn công clo ít hơn 3 lần so với tiểu học và thứ hai gấp đôi. Do đó, sự clo của alkanes là một phản ứng không chọn lọc, loại bỏ các trường hợp khi chỉ có một sản phẩm đơn bào.
Halogenation là một trong những phản ứng của sự thay thế. Halogenation của Alkanov tuân theo quy tắc của Markovnik (quy tắc Markovnikov) - chủ yếu halogen hóa ít nguyên tử carbon hydro hóa ít nhất. Alkanan Halogenation đi qua dần dần - trong một giai đoạn, không quá một nguyên tử hydro được halogen.
CH 4 + CL 2 → CH 3 CL + HCL (chloromethane)
CH 3 CL + CL 2 → CH 2 CL 2 + HCL (Dichloromethane)
Ch 2 cl 2 + cl 2 → chcl 3 + hcl (trichloromethane)
CHCL 3 + CL 2 → CCL 4 + HCL (Tetrachloromethane).
Dưới tác động của ánh sáng, phân tử clo phân rã với các nguyên tử, sau đó chúng tấn công các phân tử metan, xé ở nguyên tử hydro, do đó, các gốc methyl được hình thành, phải đối mặt với các phân tử clo, phá hủy chúng và tạo thành các gốc mới.
Nitching (phản ứng Konovalov)
Alkans đang phản ứng với dung dịch axit nitric 10% hoặc nitơ oxit n 2 o 4 trong pha khí ở nhiệt độ 140 ° và áp suất nhẹ với sự hình thành của sản xuất nitro. Phản ứng cũng tuân theo quy tắc của Markovnikov.
Rh + hno 3 \u003d rno 2 + h 2 o
i.E. Một trong những nguyên tử hydro được thay thế bằng dư lượng số 2 (Ni-Trogroup) và nước được phân biệt.
Các tính năng của cấu trúc của các đồng phân được phản ánh mạnh trong quá trình phản ứng này, vì nó dễ nhất để thay thế nguyên tử hydro trong nhóm Nitro trong dư lượng SI (chỉ tồn tại trong một số đồng phân), hydro trong nhóm ch 2 là Dễ dàng dễ dàng, và thậm chí còn khó khăn hơn - trong Radnant Ch 3.
Parafin khá dễ dàng để mặc trong pha khí ở 150-475 ° C của các cặp axit nitơ dioxide hoặc axit nitric; Trong trường hợp này, nó xảy ra một phần và. Quá trình oxy hóa. Việc luồng khí mêtan gần như độc quyền nitromethane:
Tất cả dữ liệu có sẵn chỉ ra một cơ chế triệt để miễn phí. Là kết quả của phản ứng, hỗn hợp các sản phẩm được hình thành. Axit nitric ở nhiệt độ thông thường gần như không hoạt động trên hydrocarbon parafin. Khi đun nóng, nó hoạt động chủ yếu như một tác nhân oxy hóa. Tuy nhiên, như tôi đã tìm thấy M. I. Konovalov (1889), với việc làm nóng axit nitric hoạt động một phần và cách "chủng"; Phản ứng của nitrat hóa với axit nitric yếu đặc biệt tốt trong hệ thống sưởi và áp suất tăng cao. Phản ứng của nitrat hóa được thể hiện bởi phương trình.
Sau metan, các tương đồng cho một hỗn hợp các nitroparaphin khác nhau do sự phân tách. Khi nitơ hóa ethane thu được nitroetan ch 3 -ch 2 -no 2 và nitromethane ch 3 -no 2. Một hỗn hợp của nitroparaffin được hình thành từ propane:
Các parafin hạt trong giai đoạn khí hiện đang được thực hiện trên quy mô công nghiệp.
Sulfooling:
Một phản ứng quan trọng là sulfocyliver của các kiềm. Khi Alkane tương tác với clo và lưu huỳnh arhydrid, hydro được thay thế bằng một nhóm chlorosulfonyl:

Giai đoạn của phản ứng này:
Cl + r: h → r + hcl
R + vì vậy 2 → rso 2
Rso 2 + cl: cl → rso 2 cl + cl
Alcanofochloride dễ dàng bị thủy phân đến Alkanesulfoxylost (RSO 2 OH), các muối natri trong đó (RSO 3¯ Na + - Natri Alkanfonate) triển lãm các thuộc tính tương tự như SOAM và được sử dụng làm quyết định.
Tính chất vật lý. Trong điều kiện bình thường, bốn thành viên đầu tiên của loạt Alkanas tương đồng (từ 1 - với 4) là khí. Alkanes bình thường từ Pentane đến Heptadecan (C 5 - C 17 ) - Chất lỏng, bắt đầu từ 18 trở lên - chất rắn. Khi số lượng nguyên tử carbon tăng trong chuỗi, tức là. Với trọng lượng phân tử tương đối tăng, nhiệt độ sôi và nóng chảy của Alkanes tăng lên. Với cùng số nguyên tử carbon trong phân tử Alkane kiềm có cấu trúc phân nhánh, có các điểm sôi thấp hơn so với kkanes bình thường.
Alkana. Thực tế không hòa tan trong nước, vì các phân tử của chúng là cực thấp và không tương tác với các phân tử nước, chúng hòa tan tốt trong các dung môi hữu cơ không phải là cực, như benzen, tetrachlomethane, v.v. Alkanes chất lỏng dễ dàng trộn lẫn với nhau.
Các nguồn tự nhiên chính của Alkanan - dầu và khí tự nhiên. Phân số dầu khác nhau chứa Alkanes từC 5 H 12 Lên đến 30 H 62. Khí tự nhiên bao gồm metan (95%) với một phụ gia của ethane và propan.
Của phương pháp tổng hợp để có đượcalkanov. Bạn có thể chọn các mục sau: /\u003e
một . Có được từ hydrocarbon không bão hòa. Sự tương tác của các kiềm hoặc kiềm với hydro ("hydro hóa") xảy ra với sự hiện diện của các chất xúc tác kim loại (/\u003e Ni, PD ) Như
sưởi:
CH W - C ≡Sn. + 2N 2 → CH 3 -ch 2 -ch 3.
2. Ra ngoài sản phẩm halogen. Khi làm nóng các kiềm khô monogalogen bằng natri kim loại, alkanes thu được bằng một nguyên tử carbon số đôi (phản ứng Wurtz): /\u003e
C 2 H 5 BR + 2 Na + BR - C 2 H 5 → C 2 H 5 - C 2 H 5 + 2 NABR..
Phản ứng này không được thực hiện với hai khác nhau thay thế halogen. Người Alkani, vì hóa ra một hỗn hợp của ba người đàn ông Alkan khác nhau
3. Lấy muối axit carboxylic. Khi sử dụng muối axit carboxylic khan với kiềm, alkanes thu được chứa một nguyên tử carbon ít hơn chuỗi carbon của axit carboxylic ban đầu: /\u003e
4. Metan. Trong hồ quang điện đốt cháy trong khí quyển của hydro, một lượng khí mêtan đáng kể được hình thành: /\u003e
C + 2N 2 → ch 4 .
Phản ứng tương tự đi kèm với việc sưởi ấm carbon trong một bầu không khí hydro đến 400-500 ° C ở áp suất cao trong sự hiện diện của chất xúc tác.
Trong điều kiện phòng thí nghiệm, metan thường được lấy từ cacbua nhôm:
A l 4. C 3 + 12n 2 o \u003d zsn 4 + 4al (oh) 3.
Tính chất hóa học. Trong điều kiện bình thường, Alkanes trơ về mặt hóa học. Chúng có khả năng chống nhiều thuốc thử: không tương tác với lưu huỳnh lưu huỳnh và axit nitric đậm đặc, với kiềm tập trung và nóng chảy, không bị oxy hóa bởi các chất oxy hóa mạnh - kali permanganateKmn.Khoảng 4, v.v.
Tính ổn định hóa học của Alkanes là do cường độ caos -các kết nối C-S và C-N, cũng như không phân cực của chúng. Trái phiếu phi cực C-C và C-H ở Alkanes không dễ bị vỡ ion, nhưng có thể tách ra những tương đồng dưới ảnh hưởng của các gốc tự do hoạt động. Do đó, các phản ứng triệt để đặc trưng của các kiềm, do kết quả của các hợp chất thu được, trong đó các nguyên tử hydro được thay thế bằng các nguyên tử hoặc nhóm nguyên tử khác. Do đó, các alkanes xâm nhập vào phản ứng chảy qua cơ chế thay thế triệt để được biểu thị bởi biểu tượngS r ( từ tiếng Anhthay thế. tua điểm). Theo cơ chế này, các nguyên tử hydro trong đại học, sau đó ở nguyên tử carbon thứ cấp và chính sau đó được thay thế.
1. Halogenation.. Khi sự tương tác của các alkan với các halogen (clo và bromom) dưới tác động của bức xạ UV hoặc nhiệt độ cao, một hỗn hợp các sản phẩm từ Mono- polyhalogen thay thế Alkanans. Sơ đồ tổng thể của phản ứng này được hiển thị trên ví dụ về khí mê-tan: /\u003e
b) tăng trưởng chuỗi. Triệt để clo mất một nguyên tử hydro tại phân tử alkane:
CL.· + CH 4 → Na /\u003e L + CH 3 ·
Đồng thời, một gốc alkyl được hình thành, lấy nguyên tử clo tại phân tử clo:
Ch 3 · + C L 2 → CH 3 với L + C như l·
Những phản ứng này được lặp lại cho đến khi mạch bị phá vỡ theo một trong các phản ứng:
CL.· + CL.· → Với L /\u003e 2, CH 3 · + CH 3 · → C 2 H 6, CH 3 · + CL.· → CH 3 với L ·
Tổng phương trình phản ứng:
| hv. | ||
| CH 4 + SL 2 | → | CH 3 CL + HCL. |
Việc tạo thành chloromethane có thể bị clo hóa thêm, pha trộn các sản phẩmCh 2. CL. 2, CHCL 3, SS L 4 theo Đề án (*).
Sự phát triển của lý thuyết chuỗi gốc tự do. Phản ứng liên quan chặt chẽ với tên của một nhà khoa học Nga nổi bật, giải thưởng Nobel Laureate N.I. Semenova (1896-1986).
2. Nuting (phản ứng Konovalov). Dưới tác động của axit nitric pha loãng đến Alkanes ở 140 ° C và áp suất thấp chảy ra phản ứng cấp tiến: /\u003e
Với các phản ứng triệt để (halogenation, nitrat), nguyên tử hydro trong đại học, sau đó ở các nguyên tử carbon thứ cấp và chính được trộn lẫn. Điều này được giải thích bởi thực tế là cái bật lửa của nguyên tử carbon đại học với hydro (năng lượng liên kết 376 (390 kJ / mol) và chỉ sau đó - sơ cấp (415 kj / mol), sau đó là dễ nhất.
3. Phân phối. Alkanes bình thường trong một số điều kiện nhất định có thể biến thành Alkanes với một chuỗi phân nhánh: /\u003e
4. Carting là một vết vỡ tan máu của các kết nối C-C, chảy khi đun nóng và dưới tác động của các chất xúc tác.
Khi nứt của Alkans, các kiềm cao nhất và Alkanes dưới được hình thành, Acetylene được hình thành trong quá trình nứt metan và ethane: /\u003e
C /\u003e 8 h 18 → c 4 h 10 + c 4n 8, /\u003e
2sh 4 → C 2 H 2 + Zn 2,
C 2 H 6 → C 2 H 2 + 2N 2.
Những phản ứng này có một giá trị công nghiệp lớn. Bằng cách này, các phân số dầu sôi cao (dầu nhiên liệu) được chuyển đổi thành xăng, dầu hỏa và các sản phẩm có giá trị khác.
5. oxy hóa. Với quá trình oxy hóa khí metan nhẹ ở sự hiện diện của các chất xúc tác khác nhau, rượu methyl, formaldehyd, axit formic có thể thu được:
 |
Oxy hóa xúc tác mềm của oxy không khí butane - một trong những phương pháp công nghiệp để sản xuất axit axetic:
t.°
2 C 4 /\u003e H /\u003e 10 + 5 o /\u003e 2 → 4 ch /\u003e 3 cooh /\u003e + 2n 2 o .
Con mèo.
Trên không khí Alkana Burn to CO 2 và H 2 O: /\u003e
Với n 2 n +2 + (s n.+1) / 2o 2 \u003d n với 2 + (n +1) H 2 O.
Alkaans (giới hạn hydrocarbons, parafins)
- Alkana - Aliphatic (Acyclic) hydrocarbon cực đoan trong đó các nguyên tử carbon được kết nối với các kết nối đơn giản (đơn) trong chuỗi phân nhánh hoặc phân nhánh.
Alkana. - Tên của hydrocarbon giới hạn trên danh pháp quốc tế.
Parafrins.- Tên được thiết lập trong lịch sử, phản ánh các thuộc tính của các hợp chất này (từ LAT. parrum affinis. - Có ít mối quan hệ, thấp).
Giới hạn, hoặc là bão hòaNhững hydrocarbon này được gọi là do độ bão hòa đầy đủ của các nguyên tử chuỗi carbon của hydro.
Các đại diện đơn giản nhất của Alkanov:
Mô hình phân tử:


Khi so sánh các hợp chất này rõ ràng là chúng khác nhau đối với nhóm. -Ch 2 - (methylene.). Thêm một nhóm khác vào propan -Ch 2 -, Tôi nhận được bhutan Từ 4 h 10, rồi Alkana Từ 5 n 12, Từ 6 N 14 Vân vân.
Bây giờ bạn có thể rút lại công thức chung của Alkanans. Số nguyên tử carbon liên tiếp Alkanov, chúng ta sẽ lấy n.
, sau đó số lượng nguyên tử hydro sẽ là độ lớn 2n + 2.
. Do đó, thành phần của Alkanov tương ứng với công thức chung C n h 2n + 2.
Do đó, một định nghĩa như vậy được sử dụng:
Alkana. - hydrocarbon có thành phần được thể hiện bằng công thức chung C n h 2n + 2Ở đâu n. - Số lượng nguyên tử carbon.
Cấu trúc của Alkanan
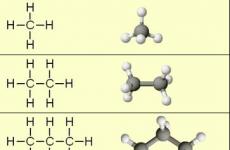
Cấu tạo hóa học (Thứ tự các hợp chất của các nguyên tử trong các phân tử) của các kiềm đơn giản nhất - metan, ethane và propane - cho thấy các công thức cấu trúc của chúng, được hiển thị trong phần 2. Từ các công thức này rõ ràng là có hai loại mối quan hệ hóa học ở Alkanes:
C-s. và C-n..
Truyền thông C-C là một không phân cực cộng hóa trị. Truyền thông C - h là một yếu tố yếu, bởi vì Carbon và hydro gần bằng khả năng điện electrone (2.5 - đối với carbon và 2.1 - cho hydro). Sự hình thành các liên kết cộng hóa trị ở Alkanes do các cặp điện tử chung của các nguyên tử carbon và hydro có thể được hiển thị bằng các công thức điện tử:

Công thức điện tử và kết cấu phản ánh cấu tạo hóa họcNhưng đừng đưa ra ý tưởng về cấu trúc không gian của các phân tửmà ảnh hưởng đáng kể đến các tính chất của chất.
Cấu trúc không gian. Sự sắp xếp tương đối của các nguyên tử phân tử trong không gian phụ thuộc vào hướng của các quỹ đạo nguyên tử (AO) của các nguyên tử này. Trong hydrocarbon, vai trò chính được chơi bởi định hướng không gian của các quỹ đạo carbon, vì 1s-AO hình cầu của nguyên tử hydro bị tước một định hướng nhất định.
Việc sắp xếp không gian của Carbon Ao lần lượt phụ thuộc vào loại hybridization (Phần I, Mục 4.3). Một nguyên tử carbon phong phú ở Alkanes có liên quan đến bốn nguyên tử khác. Do đó, trạng thái của nó tương ứng với SP 3-Hybridization (Phần I, Mục 4.3.1). Trong trường hợp này, mỗi trong số bốn SP 3-hybrid Carbon Ao có liên quan đến sự chồng chéo dọc trục (σ-) từ S-AO hydro hoặc với SP 3 -AO của một nguyên tử carbon khác, tạo thành liên kết với S-H hoặc C-C.

Bốn liên kết carbon được định hướng trong không gian ở góc 109 ° C 28 ", tương ứng với lực đẩy nhỏ nhất của các electron. Do đó, phân tử của đại diện đơn giản nhất của Alkanes - Methane ch 4 - có dạng tứ diện , ở trung tâm có một nguyên tử carbon, và tại các đỉnh - nguyên tử hydro:

Góc hóa trị của N-C-N là 109 о 28 ". Cấu trúc không gian của khí mêtan có thể được hiển thị bằng cách sử dụng các mô hình số lượng lớn (tỷ lệ) và Scaleeline.
Để ghi, nó thuận tiện để sử dụng một công thức không gian (stereowchemical).

Trong phân tử của nhà sản học tiếp theo - Ethane với 2 h 6 - hai tứ diện sP. 3 Thảm Carbon tạo thành một cấu trúc không gian phức tạp hơn:

Đối với các phân tử Alkanov chứa hơn 2 nguyên tử carbon, các hình thức cong là đặc trưng. Điều này có thể được hiển thị trong ví dụ n.-Butan (mô hình VRML) hoặc n.-Penta:

Isomeriya Alkanov.
- Isomerius - sự xuất hiện của các hợp chất có cùng thành phần (cùng một công thức phân tử), nhưng một cấu trúc khác nhau. Các hợp chất như vậy được gọi là thống nhất.
Sự khác biệt theo thứ tự của hợp chất của các nguyên tử trong các phân tử (I.E. Trong cấu trúc hóa học) dẫn đến cấu trúc đồng phân.. Cấu trúc của các đồng phân cấu trúc được phản ánh bởi các công thức cấu trúc. Trong một số lượng kiềm, chủ nghĩa đồng phân cấu trúc được biểu hiện khi hàm lượng 4 và nhiều nguyên tử carbon trong mạch là, tức là. Bắt đầu với Bhutan với 4 H 10.
Nếu trong các phân tử của cùng một thành phần và cùng một cấu trúc hóa học, có thể sắp xếp các nguyên tử lẫn nhau trong không gian, sau đó được quan sát Đồng phân không gian (Stereoisomeria). Trong trường hợp này, việc sử dụng các công thức cấu trúc là không đủ và các mô hình của các phân tử hoặc các công thức đặc biệt nên được sử dụng - lập thể (không gian) hoặc chiếu.
Alkanes, bắt đầu bằng Ethane H 3 C-CH 3, tồn tại trong các hình thức không gian khác nhau ( sự phù hợp) do xoay nội phân của σ-links c-c và biểu hiện cái gọi là chủ nghĩa đồng phân quay (hình dạng).
Ngoài ra, nếu có một nguyên tử carbon trong phân tử liên quan đến 4 nhóm ruột khác nhau, một loại đồng phân không gian khác là có thể, khi hai người lập dị thuộc nhau như một vật thể và hình ảnh phản chiếu của nó (giống như tay trái đề cập đến bên phải ). Sự khác biệt như vậy trong cấu trúc của các phân tử được gọi là isomeria quang.
Cấu trúc isomeria alkanov.
- Các đồng phân cấu trúc - các hợp chất của cùng một sáng tác, đặc trưng bởi thủ tục cho các nguyên tử ràng buộc, tức là Cấu trúc hóa học của các phân tử.
Nguyên nhân của biểu hiện của chủ nghĩa đồng phân cấu trúc liên tiếp với một hàng alkans là thiết bị của các nguyên tử carbon để tạo thành các mạch của các cấu trúc khác nhau. Loại đồng phân cấu trúc này được gọi là skeleton carbon isomeria..
Ví dụ, thành phần Alkan C 4 H 10 có thể tồn tại như hai Cấu trúc đồng phân:

và Alkan C 5 H 12 - ở dạng số ba Các đồng phân cấu trúc, đặc trưng bởi cấu trúc của chuỗi carbon:

Với sự gia tăng số lượng nguyên tử carbon trong thành phần của các phân tử, khả năng phân nhánh chuỗi, tức là. Lượng đồng phân đang phát triển một ngưỡng của số nguyên tử carbon.

Các đồng phân cấu trúc được phân biệt bởi các tính chất vật lý. Alkanes với một cấu trúc phân nhánh do bao bì ít đậm đặc hơn của các phân tử và, theo đó, tương tác giữa các phân phối nhỏ hơn, đun sôi nhiệt độ so với các đồng phân không phân biệt của chúng.
Trong đầu ra của các công thức cấu trúc của các đồng phân, các kỹ thuật sau đây sử dụng.
Hydrocarbon là các hợp chất hữu cơ đơn giản nhất. Chúng là carbon và hydro. Các hợp chất của hai nguyên tố này được gọi là hydrocarbon giới hạn hoặc kkanes. Thành phần của họ được thể hiện bằng chung về Alkanes với công thức CNH2N + 2, trong đó N là số nguyên tử carbon.
Tiếp xúc với
Odnoklassniki.
Alkana - Tên quốc tế của các hợp chất dữ liệu. Ngoài ra, các hợp chất này được gọi là parafin và hydrocarbon bão hòa. Giao tiếp trong các phân tử Alkanan là đơn giản (hoặc độc thân). Valence còn lại được bão hòa với các nguyên tử hydro. Tất cả các alkanes được bão hòa với hydro đến giới hạn, các nguyên tử của nó nằm trong một hybridization SP3.
Phạm vi tương đồng của hydrocarbon giới hạn
 Người đầu tiên trong hàng hydrocarbon tương đồng là metan. Công thức CH4 của anh. Sự kết thúc là -ANAN trong tên của giới hạn hydrocarbon, nó là một tính năng đặc biệt. Tiếp theo, phù hợp với công thức trên, ethane - C2H6 được đặt trong một loạt tương đồng, propane C3H8, Butan - C4H10.
Người đầu tiên trong hàng hydrocarbon tương đồng là metan. Công thức CH4 của anh. Sự kết thúc là -ANAN trong tên của giới hạn hydrocarbon, nó là một tính năng đặc biệt. Tiếp theo, phù hợp với công thức trên, ethane - C2H6 được đặt trong một loạt tương đồng, propane C3H8, Butan - C4H10.
Từ Alkana thứ năm Sê-ri tương đồng của các tiêu đề của các hợp chất được hình thành như sau: Số Hy Lạp cho biết số lượng nguyên tử hydrocarbon trong phân tử + end -an. Vì vậy, trong garcaries, số 5 - pande, tương ứng, Pentan - C5H12 cho Bhutan. Tiếp theo - Hexane C6H14. Heptane - C7H16, OCTAN - C8H18, Nonane - C9H20, Dean - C10H22, v.v.
Các tính chất vật lý của Alkanans thay đổi rõ rệt trong loạt tương đồng: điểm nóng chảy, điểm sôi tăng, mật độ tăng. Metan, ethane, propane, butan trong điều kiện bình thường, tức là ở nhiệt độ khoảng 22 độ celsius, là khí đốt, với Pentane trên bao gồm hexadecan - chất lỏng, với heptadecan - chất rắn. Bắt đầu với Bhutan, Alkanan có các đồng phân.
Có những cái bàn phản ánh những thay đổi trong hàng tương đồng của Alkanansmà phản ánh rõ ràng các tính chất vật lý của họ.
Danh pháp hydrocarbon bão hòa, các dẫn xuất của chúng
 Nếu nguyên tử hydro được tách ra khỏi phân tử hydrocarbon, các hạt monovalent được hình thành, được gọi là gốc (r). Tên của triệt để mang lại hydrocarbon, từ đó gốc này được tạo ra, trong khi kết thúc -ann thay đổi thành kết thúc. Ví dụ, một gốc metyl triệt để được hình thành từ metan trong quá trình phân tách nguyên tử hydro, từ ethyl - ethyl, từ propane - propyl, v.v.
Nếu nguyên tử hydro được tách ra khỏi phân tử hydrocarbon, các hạt monovalent được hình thành, được gọi là gốc (r). Tên của triệt để mang lại hydrocarbon, từ đó gốc này được tạo ra, trong khi kết thúc -ann thay đổi thành kết thúc. Ví dụ, một gốc metyl triệt để được hình thành từ metan trong quá trình phân tách nguyên tử hydro, từ ethyl - ethyl, từ propane - propyl, v.v.
Các gốc cũng được hình thành các hợp chất vô cơ. Ví dụ, tại một axit nitric, có thể có được một triệt lục -no2 đơn giản, được gọi là nitroup.
Khi tách khỏi phân tử ALKAN Hai nguyên tử hydro được hình thành bởi các gốc so sánh, tên cũng được hình thành từ tên của hydrocarbon tương ứng, nhưng kết thúc thay đổi thành:
- orin, trong trường hợp các nguyên tử hydro bị xé từ một nguyên tử carbon,
- ilen, trong trường hợp hai nguyên tử hydro bị xé nát từ hai nguyên tử carbon lân cận.
Alkana: Tính chất hóa học
Hãy xem xét các phản ứng đặc trưng của Alkanans. Tất cả các alkanes vốn có trong các tính chất hóa học nói chung. Những chất này có khả năng hoạt động thấp.
Tất cả các phản ứng đã biết liên quan đến hydrocarbon được chia thành hai loại:
- truyền thông S-H (một ví dụ là một phản ứng thay thế);
- gap truyền thông C-C (nứt, hình thành các bộ phận riêng lẻ).
Rất tích cực tại thời điểm hình thành triệt để. Tự mình, họ tồn tại cổ phiếu của giây. Triệt để dễ dàng nhập phản ứng của chính họ. Các electron không ghép đôi của họ tạo thành một kết nối cộng hóa trị mới. Ví dụ: CH3 + CH3 → C2H6
Gốc dễ dàng nhập phản ứng với các phân tử hữu cơ. Chúng được nối với họ, hoặc được tách ra khỏi chúng một chiếc electron không thấm nước từ chúng, do đó, các gốc mới xuất hiện, lần lượt, có thể nhập vào phản ứng với các phân tử khác. Với phản ứng chuỗi như vậy, các macromolecules thu được, chỉ khiến việc phát triển chỉ khi chuỗi ngắt (ví dụ: kết nối của hai gốc)
Các phản ứng của các gốc tự do giải thích nhiều quá trình hóa học quan trọng, chẳng hạn như:
- Vụ nổ;
- Quá trình oxy hóa;
- Nứt dầu;
- Trùng hợp các hợp chất không bão hòa.
 Chi tiết xem xét tính chất hóa học Hydrocarbon bão hòa về ví dụ của khí mê-tan. Chúng tôi đã xem xét cấu trúc của phân tử alkane. Các nguyên tử carbon được đặt trong phân tử metan trong trạng thái lai tạo SP3 và kết nối khá bền được hình thành. Methane là một màu khí của mùi và màu sắc. Nó dễ dàng hơn không khí. Trong nước một ít dung môi.
Chi tiết xem xét tính chất hóa học Hydrocarbon bão hòa về ví dụ của khí mê-tan. Chúng tôi đã xem xét cấu trúc của phân tử alkane. Các nguyên tử carbon được đặt trong phân tử metan trong trạng thái lai tạo SP3 và kết nối khá bền được hình thành. Methane là một màu khí của mùi và màu sắc. Nó dễ dàng hơn không khí. Trong nước một ít dung môi.
Alkana có thể đốt cháy. Methane đang cháy với một ngọn lửa màu xanh. Trong trường hợp này, kết quả của phản ứng sẽ là carbon monoxide và nước. Khi trộn với không khí, cũng như trong hỗn hợp với oxy, đặc biệt nếu tỷ lệ khối lượng là 1: 2, dữ liệu của hydrocarbon tạo thành hỗn hợp nổ, đó là lý do tại sao nó cực kỳ nguy hiểm để sử dụng trong cuộc sống và mìn hàng ngày. Nếu khí mêtan cháy không hoàn toàn, bồ hóng được hình thành. Trong ngành, do đó nó được thu được.
Formaldehyd và rượu metyl thu được từ metan bằng quá trình oxy hóa trong sự hiện diện của các chất xúc tác. Nếu khí mêtan nhiệt rất nhiều, nó sẽ tan rã với công thức CH4 → C + 2H2
Metan phân rã. Bạn có thể thực hiện vào sản phẩm trung gian trong các lò được trang bị đặc biệt. Một sản phẩm trung gian sẽ là acetylene. Công thức phản ứng 2CH4 → C2H2 + 3H2. Việc phát hành acetylene từ metan làm giảm chi phí sản xuất gần như hai lần.
Ngoài ra, hydro cũng được lấy từ metan, sản xuất chuyển đổi khí mêtan với hơi nước. Đặc trưng cho khí mêtan là phản ứng của sự thay thế. Vì vậy, ở nhiệt độ thông thường, hydro từ phân tử metan được di dời ở ánh sáng halogen (CL, BR). Do đó, các chất được hình thành, gọi là dẫn xuất halogen. Nguyên tử clo., Thay thế các nguyên tử hydro trong phân tử hydrocarbon, tạo thành một hỗn hợp các kết nối khác nhau.
Trong một hỗn hợp như vậy có chloromethane (CH3 CL hoặc methyl clorua), dichlomethane (CH2Cl2ili Methylene clorua), trichloromethane (chlô3 hoặc chloroform), tetrachloromethane (CCL4 hoặc carbon tetrachloride).
Bất kỳ hợp chất nào trong số này có thể được cách ly với hỗn hợp. Trong sản xuất, chloroform và tetrachloromethane có tầm quan trọng nhập khẩu, do thực tế là chúng là dung môi của các hợp chất hữu cơ (chất béo, nhựa, cao su). Các dẫn xuất halogen được hình thành bởi một cơ chế triệt để không có chuỗi.
Ánh sáng ảnh hưởng đến các phân tử clo, kết quả là họ tan rã Các gốc vô cơ xé nguyên tử hydro bằng một electron từ phân tử metan. Đồng thời, HCL và Methyl được hình thành. Methyl phản ứng với phân tử clo, dẫn đến đạo hàm halogen và triệt để clo. Tiếp theo, troorine triệt để tiếp tục phản ứng dây chuyền.
Ở nhiệt độ bình thường, khí mêtan có đủ sức đề kháng với kiềm, axit, nhiều oxy hóa. Ngoại lệ - axit nitric. Phản ứng với nó được hình thành nitromethane và nước.
Phản ứng kết nối đối với khí mêtan không phải là đặc trưng, \u200b\u200bvì tất cả các giá trị trong phân tử của nó được bão hòa.
Các phản ứng trong đó hydrocarbon có thể diễn ra không chỉ với sự phân tách kết nối C-H mà còn với sự cố của C-S. Những biến đổi như vậy xảy ra với sự hiện diện của nhiệt độ cao. và chất xúc tác. Những phản ứng như vậy bao gồm khử nước và nứt.
Trong số các hydrocarbon bão hòa bằng quá trình oxy hóa, axit thu được - acetic (từ butan), axit béo (từ parafin).
Lấy metan.
 Trong tự nhiên Methane. Rộng rãi. Đó là thành phần chính của phần lớn các khí tự nhiên và nhân tạo dễ cháy. Nó được phân biệt với các hồ chứa than trong các mỏ, từ dưới cùng của đầm lầy. Khí tự nhiên (rất đáng chú ý trong các loại khí liên quan của các trường dầu khí) không chỉ chứa metan, mà còn cả các kiềm khác. Việc sử dụng các chất này là đa dạng. Chúng được sử dụng làm nhiên liệu, trong các ngành công nghiệp khác nhau, trong y học và công nghệ.
Trong tự nhiên Methane. Rộng rãi. Đó là thành phần chính của phần lớn các khí tự nhiên và nhân tạo dễ cháy. Nó được phân biệt với các hồ chứa than trong các mỏ, từ dưới cùng của đầm lầy. Khí tự nhiên (rất đáng chú ý trong các loại khí liên quan của các trường dầu khí) không chỉ chứa metan, mà còn cả các kiềm khác. Việc sử dụng các chất này là đa dạng. Chúng được sử dụng làm nhiên liệu, trong các ngành công nghiệp khác nhau, trong y học và công nghệ.
Trong điều kiện phòng thí nghiệm, khí này được cách ly khi hỗn hợp được làm nóng bằng natri acetate + natri hydroxit, cũng như phản ứng của nhôm và cacbua nước. Ngoài ra metan thu được từ các chất đơn giản. Đối với các điều kiện bắt buộc này đang sưởi ấm và chất xúc tác. Tầm quan trọng công nghiệp đang thu được sự tổng hợp metan dựa trên hơi nước.
Metan và những người tương đồng của nó có thể thu được bằng cách nung muối của axit hữu cơ thích hợp với kiềm. Một cách khác để có được cả alkan là phản ứng của würz, tại đó sản xuất modogalogen với natri kim loại được làm nóng.