Mikä menetelmä määrittää sidekudoksen tilan. Oireet, diagnoosi ja hoito sidekudoksen dysplasiassa
LIITOSKUDOSDYSPLASIAN SYNDROMI.
NIIN. Klyuchnikov, M.A. Klyuchnikova
Lastensairauksien laitos nro 3, Venäjän valtion lääketieteellinen yliopisto; CDC-lasten poliklinikka № 69 Lounaishallintoalue,
Moskovan kaupunki.
LIITTYVÄ KUDOS - RAKENNE JA TOIMINNOT.
Sidekudoksella (CT) on tärkeä asema kehossa, ja sillä on erityinen paikka, eikä ole sattumaa, että sitä tutkivat monet kotimaiset ja ulkomaiset kirjailijat, joiden osuus on noin 50% koko kehon painosta. CT muodostaa tukikehyksen (luuranko) ja ulkoiset osat (iho) ja muodostaa kehon sisäisen ympäristön verellä ja imusolmukkeella; osallistuu aineenvaihdunta- ja troofisten prosessien säätelyyn; vuorovaikutuksessa fagosyyttisen ja immuunijärjestelmän, biologisesti aktiivisten aineiden järjestelmien kanssa, osallistuu immuunijärjestelmään ja rakenteelliseen homeostaasiin.
ST -kehityksen lähde on mesenkyymi, josta muodostuu ulospäin niin erilaisia kudoksia: iho ja luut, rasvakudos, veri ja imusolmukkeet, immuunijärjestelmä, sileät lihakset ja rusto.
CT: n soluelementtejä edustavat fibroblastit ja niiden lajikkeet (osteoblastit, kondrosyytit, odontoblastit, keratoblastit), makrofagit (histiosyytit) ja syöttösolut (syöttösolut). Fibroblastin tehtäviin kuuluu pääaineen hiilihydraatti-proteiinikompleksien (proteoglykaanit ja glykoproteiinit) tuottaminen, kollageeni-, retikuliini- ja elastiinikuitujen muodostuminen, näiden aineiden aineenvaihdunnan ja rakenteellisen vakauden säätely, mukaan lukien niiden katabolia, sen "mikroympäristö" ja epiteeli-mesenkymaalinen vuorovaikutus. Yhdessä kuitukomponenttien kanssa fibroblastit määrittävät CT -arkkitehtuurin.
Solunulkoista matriisia edustaa 3 erilaista kuitua: se koostuu 14 kollageenityypistä, retikulaarisista ja elastiinikuiduista, jotka ovat kuitu- ja CT -päärakenteellisia elementtejä, joilla on erityisiä ominaisuuksia. Kuituinen CT solujen välisen aineen kuitujen kehitysasteen mukaan voi olla löysä tai tiheä. Löysä muotoilematon CT muodostaa kaikkien elinten ja kudosten strooman. Tiheästi muodostetulla kuitu -CT: llä on merkittävä lujuus ja se koostuu nivelsiteistä, jänteistä, elinten faskista ja kuitukalvoista. Tiheä muotoilematon CT on myös kestävä ja osallistuu ihon (dermis), periosteumin ja perikondriumin muodostumiseen. ST: tä, jolla on erityisiä ominaisuuksia, edustavat limakalvot, rasva- ja verkkokudokset ja ne muodostavat pohjan nivel- ja limakalvoille, dentiinille, emalille, hammasmassalle, skleralle, silmän lasiaiselle, verisuonten ja epiteelin kalvolle, neurogliajärjestelmälle, verkkokudokselle .
Kollageenityypit eroavat toisistaan koostumukseltaan, hallitsevalta sijainniltaan elimissä ja kudoksissa ja muodostumislähteeltä. Kollageenimolekyyli koostuu polypeptidiketjuista, joita kutsutaan a-ketjuiksi. Jokainen a-ketju sisältää keskimäärin noin 1000 aminohappotähdettä. Kollageenin monimutkaiselle rakenteelle on ominaista proliinin, glysiinin, lysiinin molekyylien vuorottelu sekä kollageenille - lysiinille ja proliinille (oksylysiini ja oksiproliini) ominaisten hydroksyylimuotojen olemassaolo. Kollageenisisällön suhde eri tyyppejä elimistössä ja sen yksittäisissä elimissä ja järjestelmissä muuttuu koko elämän ajan ja luonnehtii monia fysiologisia prosesseja.
Tyypillisten kollageenikuitujen lisäksi useiden elinten stroomassa (imusolmukkeet, perna, keuhkot, verisuonet, dermiksen papillaarikerros, limakalvo, maksa, munuaiset, haima jne.) S. Kupfer ( 1879 g .) retikulaarisena. Ne perustuvat erityiseen proteiiniin - retikuliiniin. Retikulaariset kuidut eroavat kollageenikuiduista pienemmällä paksuudella, haarautumisella ja anastomoosilla muodostaen kuituverkoston, erityisesti imusolmukkeissa ja pernassa.
Joustavat kuidut ovat herättäneet tutkijoiden huomion jo yli 100 vuoden ajan, mikä johtuu niiden merkityksestä monien elinten, ominaisuuksien biomekaanisten toimintojen toteuttamisessa. kemiallinen koostumus ja tinctoriaaliset ominaisuudet, patologisten prosessien muutosten spesifisyys. Julkaistujen tietojen analyysin avulla voimme erottaa kaksi joustavan kudoksen järjestäytymistasoa: molekyyli- ja elin-kudoksen, ja kullakin näistä tasoista rakenneorganisaation spesifisyys määrää tämän kudoksen toiminnalliset ominaisuudet, kyvyn korjata muodonmuutos mekaanisen toiminnan vaikutus.
Kuitujen välinen tila on täynnä polysakkaridikomplekseja - glykosaminoglykaaneja ja niiden yhdisteitä proteiineilla - proteoglykaaneilla ja glykoproteiineilla. Proteoglykaanit tarjoavat ST: n troofisen tehtävän: veden, suolojen, aminohappojen ja lipidien kuljetuksen erityisesti avaskulaarisissa kudoksissa, verisuonten seinämissä, sydämen venttiileissä, rustoissa, sarveiskalvoissa jne.
ST suorittaa vähintään viisi tärkeintä toimintoa: biomekaaninen, troofinen, este, muovi ja morfogeneettinen (kuva 1).
Riisi. 1. Sidekudoksen toiminnot.
Biomekaaninen (tukikehys) On yksi tärkeimmistä toiminnoista. Tämä on kehon luu (luu), sisäelimet (stroma), lihakset (fascia), verisuonet (kollageeni tai kollageeni-elastinen selkäranka), yksittäiset solut (reticular-kuidut). CT: n ominaisuudet, jotka mahdollistavat tämän tehtävän suorittamisen, saadaan monista tekijöistä: kollageenin runko -ominaisuudet - glykoproteiinit, elastiini, fibronektiini; vahvuus - kollageenilla ja glykoproteiineilla; plastisuus - elastiini; viskositeetti - proteoglykaanit; elastoplastiset ominaisuudet - proteoglykaanit ja glykoproteiinit; supistuvuus - fibroblasteilla. CT: n ominaisuudet, jotka mahdollistavat tuki- ja liikuntaelimistön toiminnan, ovat sekä soluelementtejä että CT: n solujen välistä ainetta. Tässä tapauksessa kunkin ominaisuuden ilmenemismahdollisuus monistetaan useilla elementeillä.
Trofinen (metabolinen) toiminta määräytyy sen mukaan, että ST yhdessä veren ja imusolmukkeiden kanssa antaa kudoksille ravinteita ja eliminoi aineenvaihduntatuotteet. Tässä tapauksessa verisuonten läpäisevyys, sen ioninvaihto -ominaisuudet, suodatus määräytyvät pääasiassa proteoglykaanien ja glykoproteiinien tilan mukaan, kun taas läpäisevyys ja aineenvaihdunta säätelevät CT -solujen erittämiä tekijöitä - syöttösolut, makrofagit, lymfosyytit, fibroklastit. Maston solut säätelevät kollageenin läpäisevyyttä ja fibroblastit syntetisoivat kollageenin lisäksi myös lipidejä, useita entsyymejä, prostaglandiineja ja syklisiä nukleotideja. Fagosytoosin lisäksi makrofagit tuottavat tekijöitä, jotka vaikuttavat immuniteettiin ja säätelevät muiden solujen toimintaa. Aineenvaihduntatoiminto sisältää saostumistoiminnon (esimerkiksi lipidien kertyminen rasvakudoksen soluihin, rasvaliukoiset vitamiinit ja hormonit jne.). Jotkut vaikuttavat aineet kerääntyvät syöttösoluihin.
Suojatoiminto toteutettu: 1) mekaanisten esteiden luomisessa: keho (iho), elimet (kapselit, seroosikalvot), parenkymaaliset elimet (stroma); 2) epäspesifisessä suojauksessa (fagosytoosi ST -solujen avulla, ST: n bakterisidiset ominaisuudet, pääasiassa glykosaminoglykaanit). Glykosaminoglykaanit (erityisesti hyaluronihappo), jotka täyttävät kudosten aukot, estävät infektioiden ja toksiinien leviämisen, inaktivoivat bakteeri -entsyymejä); 3) immuunivasteessa, jonka suorittavat makrofagit, lymfosyytit ja plasmasolut. CT: n suojatoiminto, johon kaikki sen soluelementit ja solujen väliset komponentit ovat mukana, on selkeästi esillä patologiassa tulehduksen, organisoinnin, kapseloinnin jne.
Muovinen (korjaava, mukautuva) toiminto ilmenee paitsi fysiologisen myös korjaavan uudistumisen, haavan paranemisessa, nekroosipesien järjestämisessä, verihyytymien revaskularisaatiossa jne. Tämän toiminnon toteuttaminen on mahdollista solujenvälistä ainetta rakentavien CT -solujen suuren proliferatiivisen aktiivisuuden vuoksi. Kaikki CT: n komponentit ovat mukana sen toteuttamisessa; makrofagien ja fibroblastien, fibroblastien ja kollageenikuitujen välinen vuorovaikutus, joka liittyy CT: n korjaavan kasvun automaattiseen säätelyyn, on erityisen tärkeä.
Morfogeneettinen (rakenteellinen ja kasvatuksellinen) toiminto ilmenee sekä alkion aikana että synnytyksen jälkeisessä kehityksessä, koska kollageeni ja glykosaminoglykaanit säätelevät palautteen periaatteen mukaisesti sidekudoksen lihasten ja epiteelisolujen lisääntymistä. Ontogeneesin aikana kollageenin koostumus muuttuu, kollageeni- ja proteiini-hiilihydraattirakenteet muuttuvat, solukoostumus ja ST-aineenvaihdunnan voimakkuus muuttuvat, mikä ilmenee kudosten rakenteen ja muodon muutoksena. elimet.
Siten ST -toimintojen toteuttaminen liittyy kaikkiin sen soluihin ja solunulkoisiin komponentteihin, vaikka osallistumisen osuus ja näiden komponenttien rooli kunkin toiminnon toteuttamisessa sekä normissa että patologiassa ovat epätasaisia. Synnynnäiset ja / tai perinnölliset sidekudoksen viat voivat johtaa elintärkeiden toimintojen rikkomuksiin, joiden toteuttamiseen sidekudos osallistuu.
MÄÄRITELMÄ JA LUOKITUS STD.
Laajassa merkityksessä dysplasialla tarkoitetaan kaikkia tapauksia, joissa elinten ja kudosten epätyypillinen kasvu ja kehitys johtuu kehon erityisistä perinnöllisistä ominaisuuksista. Mitä tulee ST: hen, useimmat kirjoittajat termillä "ST -dysplasia" tarkoittavat kudosrakenteen poikkeavuutta, joka ilmenee tietyntyyppisten kollageenipitoisuuksien vähenemisenä tai niiden suhteen rikkomisena, mikä johtaa "voiman" laskuun sidekudoksesta.
V.M. Yakovlev ja G.I. Nechaevin tarjous määritelmän mukaisesti: « Sidekudoksen dysplasia(STD) on sidekudoksen kehittymisen rikkomus alkion ja synnytyksen jälkeisinä aikoina johtuen solunulkoisen matriisin geneettisesti muuttuneesta fibrillogeneesistä, mikä johtaa homeostaasin häiriöön kudoksen, elimen ja organismin tasolla erilaisten morfo-funktionaalisten muotojen muodossa sisäelinten ja liikuntaelinten häiriöt, joilla on etenevä kulku. "
Ensimmäinen sukupuolitauti kuvattiin vuonna 1682 Amsterdamin kirurgin toimesta J Van Meekeren , sitten Williams ( 1876 g .) sekä tutkijat A.N. Tšernogubov ( 1891) ja B. Marfan (1896) .). Seuraavassa kuvataan SDT Ehlers (1901) ja Danlos (1908).
Dysplastisten merkkien yhdistelmästä riippuen tunnistettiin Chernogubov-Ehlers-Danlos- ja Marfan-oireyhtymät. Jatkotutkimus vahvisti oireyhtymien perinnöllisen luonteen, jotka perustuvat kollageenisynteesin geenivirheeseen ja tiettyyn (hallitsevaan tai resessiiviseen) perintötyyppiin.
Perinnölliset sidekudossairaudet jaetaan erilaistuneisiin ja erilaistumattomiin (kaavio).
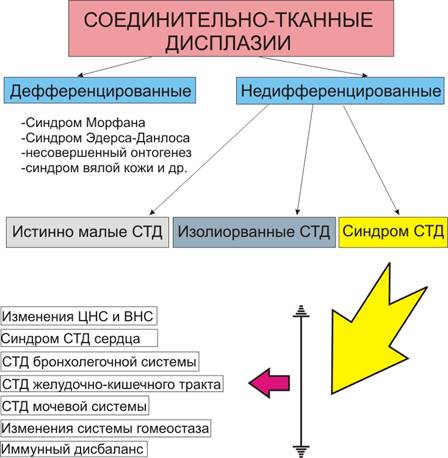
Kaavio. Sidekudoksen dysplasia.
Eriytetty niille on ominaista tietyntyyppinen perintö, selkeä kliininen kuva ja joissakin tapauksissa vakiintuneet ja hyvin tutkitut geneettiset tai biokemialliset viat. Tämän ryhmän tyypillisimpiä edustajia ovat Marfanin oireyhtymä, Ehlers-Danlosin oireyhtymä (10 tyyppiä), osteogenesis imperfecta, hilseilevä ihon oireyhtymä ( Cutis laxa ) jne. Nämä sairaudet kuuluvat perinnöllisten kollageenisairauksien ryhmään - kollageenipatiat. Eri kirjoittajien mukaan Marfanin oireyhtymän väestötiheys on 1,72-4 / 100000, 4-6 / 100000-1 / 15000 syntynyttä. Ehlers-Danlosin oireyhtymän esiintymistiheyttä ei ole vielä lopullisesti vahvistettu. Eri kirjoittajien mukaan se vaihtelee yhdestä sadasta tuhannesta vastasyntyneeseen.
Eriytymätön sidekudoksen dysplasia (NSTD) diagnosoidaan, kun potilaan fenotyyppiset piirteet eivät sovi mihinkään erilaistuneisiin sairauksiin.
Epäsuora todiste tällaisten NTD -tautien yleisyydestä voi olla se, että yli puolella ihmisistä, joilla on geneettisiin keskuksiin lähetettyjä STD -oireita, ei ole selvästi määriteltyä perinnöllistä patologiaa. NSTD ei epäilemättä ole mikään nosologinen yksikkö, vaan geneettisesti heterogeeninen ryhmä. Yhteisen terminologian puuttuminen ja tapausten esiintyvyys, joilla on epämääräisiä fenotyyppisiä STD -merkkejä, mahdollisti sen, että kirjoittajat voivat ehdottaa omaa nimeään STD: n nimeämiseksi. Niin Glesby M. J. ja Pyeritz R. E. (Vuosi 1989 ) ehdottaa termiä "sukupuolitauti, jolla on sekava fenotyyppi". R.G. Oganov et ai. ( 1984 vuosi ) otetaan käyttöön termi "sidekudoksen toimintahäiriö", Tari W., Narahova I. et ai. (Vuosi 1984 ) - "sidekudoksen heikkous". Hausser I. , Frantzmann Y. et ai. (Vuosi 1993 ) - "sukupuolitautien pienet muodot", Samsygin S.А. et ai. ( 1990 vuosi ) - "luokittelemattomat sukupuolitautilomakkeet", Bennis A., Mehaddji B. A. et ai. (1993 ) - "sidekudoksen dysplasia". Lyhenne " MASS - fenotyyppi ", Yleisimpien fenotyyppisten piirteiden ensimmäisten kirjainten mukaan ( Mitraaliventtiili, aortta, luuranko, iho ) ja lyhenne "KSC-fenotyyppi" (iho, sydän, kallo). Useimmat kirjoittajat noudattavat kuitenkin termiä NSTD.
NSTD: n etiologia ja patogeneesi.
NSTD: n syyn katsotaan olevan sikiöön vaikuttavia monivaiheisia vaikutuksia kohdunsisäisen kehityksen aikana, mikä voi aiheuttaa geneettisen laitteen vikoja (polygeeniset monifaktoriset vaikutukset).
Kollageeni on solunulkoinen proteiinimatriisi, jolla on johtava rooli eri kudosten rakenteellisessa integroinnissa. 14 kollageenityyppiä muodostaa yli 30 kollageeniketjua, 12 kromosomia ovat vastuussa niiden synteesistä. Entsyymiviat kollageenisynteesissä määritetään milloin eri tyyppejä Ehlers-Danlosin oireyhtymä, NSTD, ostegeneesi imperfecta, osteokondrodysplasia, Alportin oireyhtymä, osteoporoosi, nivelrikko, aortan aneurysmat. Kaikille näille sairauksille määritetään kollageenisynteesin viat. I, II, III tyypit, mikä johtaa liialliseen fibroosiin ja vastaaviin elinten ja kudosten toimintahäiriöihin.
Tällä hetkellä on olemassa tietoja ST: n erilaisten rakenteiden muutoksista sukupuolitautien erilaistumattomissa muodoissa. Kollageenifibrillien ultrastruktuurivikoja on kuvattu potilailla, joilla on NCTD: fibrillien halkaisija ja kehä eivät muutu, mutta ne keskeytetään ajoittain. Viallisen kollageenin tuotanto NCDS: ssä, joka on fenotyyppisesti samanlainen kuin Ehlers-Danlosin oireyhtymä, on havaittu useiden kirjoittajien teoksissa. Joidenkin tutkijoiden mukaan mutaatiot ovat NSTD: n syy Minä kollageenityyppi, prokollageenin rakenteen rikkominen III tyyppi. Muut kirjoittajat viittaavat ihon fibroblastien proliferatiivisen aktiivisuuden vähenemiseen lapsilla, joilla on ihon hyper-venyvyys ja nivelten hypermobiliteetti, jolla ilmeisesti on patogeeninen merkitys NSTD: n kliinisten oireiden kehittymisessä, fenotyyppisesti samanlainen kuin Ehlers-Danlosin oireyhtymä. Fibronektiinireseptorien määrän väheneminen polymorfonukleaarisissa leukosyyteissä havaittiin lapsilla, joilla oli erilaisia NSTD -muotoja ( Miura S., Et all 1990). Muiden kirjoittajien töissä geneettisesti määritetty vika prokollageenin biosynteesissä ja kollageeniin sitoutuneen proteoglykaanin puute paljastettiin lapsilla, joilla oli fenotyyppisiä NSTD- ja progeria-merkkejä, mikä ilmeisesti johtaa ihon varhaisiin vaurioihin ja ikääntymiseen. Kirjallisuuden mukaan yksi NSTD: n kriteereistä on kollageenisynteesiin liittyvät kromosomipoikkeavuudet.
Nykyaikaisen alkion ja teratologian kliiniset ja kokeelliset tiedot mahdollistavat riittävän tarkasti sen määrittämisen, missä ST -rakenteiden dysplastisten muutosten ontogeneesikausista tapahtui. Ottaen huomioon, että sellaisten CT -rakenteiden, kuten selkärangan, ihon, sydänläppien ja suurten suonien, erilaistuminen tapahtuu samanaikaisesti sikiön kehityksen kanssa, näiden järjestelmien dysplastisten muutosten yhdistelmä on todennäköisin. Tämän vahvistavat lukuisat kliiniset tiedot, vakuuttavasti todisteet näiden rakenteiden osallistumisesta useimpiin CT -oireyhtymiin. Suhde nikamien kehityshäiriöiden tason ja alkion ihon ja pehmytkudosten sijainnin - hemangioomat, lymfangioomat, ikäpisteet jne. Tiedetään, että nämä ihon muutokset, jotka sijaitsevat selkärankaa pitkin, ovat usein sen synnynnäisen patologian ulkoisia ilmentymiä.
On todisteita sydämen poikkeavuuksien, kraniovertebraalisen patologian, rintakehän poikkeavuuksien konjugaatiosta ( Th 1-6) nikamat, nopeasti etenevä likinäköisyys tai astigmatismi, kouristukset, motorisen ja henkisen kehityksen viivästyminen sekä lasten allergiset sairaudet.
Geneettisesti määritettyjen ontogeneesihäiriöiden vakavuus riippuu vastaavien geenien tunkeutumisasteesta ja ekspressiivisyydestä, ja synnynnäisten häiriöiden vakavuus määräytyy mutageenisten vaikutusten voimakkuuden ja ajoituksen mukaan. Siksi sukupuolitautien muutosten lokalisointi voidaan rajoittaa joko yhteen järjestelmään tai huomattavan määrän ilmentymien yhdistelmään. Yhdessä elimessä lokalisoitua UCTD: tä kutsutaan eristetyksi, ja UCTD: tä, joka ilmenee STD: n ulkoisista fenotyyppisistä oireista yhdessä vähintään yhden sisäelimen dysplasian merkkien kanssa, on pidettävä STD -oireyhtymänä.
Sekä endogeeniset että eksogeeniset mekanismit osallistuvat STD -oireyhtymän kehittymiseen. Kirjallisuuden mukaan tällä hetkellä havaittu sukupuolitautitapausten määrän kasvu liittyy patogeenisiin vaikutuksiin, jotka tapahtuivat ontogeneesissä ekologisen tilanteen heikkenemisen, huonon ravitsemuksen ja stressin vuoksi.
Kaikki tämä antaa meille mahdollisuuden määrittää STD -oireyhtymä nosologisesti itsenäisenä oireyhtymänä, joka on luonteeltaan polygeeninen-monifaktorinen, ja joka ilmenee sukupuolitautien ulkoisista fenotyyppisistä oireista yhdistettynä sidekudoksen dysplastisiin muutoksiin ja yhden tai useamman sisäelimen kliinisesti merkittävään toimintahäiriöön.
LIITOSKUDOSDYSPLASIAN SYNDROMI.
FENOTYYPILLISET MERKIT. LUOKITUS.
Fenotyyppi Onko joukko organismin kaikkia ominaisuuksia tietyssä kehitysvaiheessa.
Nykyaikaisessa ulkomaisessa ja kotimaisessa kirjallisuudessa on tietoja STD -oireyhtymän ulkoisten fenotyyppisten merkkien esiintyvyydestä, niiden tietosisällöstä ja yhteydestä muutoksiin sisäelinten sidekudoskehyksessä. Vuonna 1989 M. J. Glesby ja R. E. Pyeritz tarjosi erityisen kartan ns. "sekoitetun" fenotyypin tunnistamiseksi, joka kuvasi 16 tunnettua fenotyyppistä ominaisuutta. Kortti oli kuitenkin tarkoitettu vain prolapsin diagnosointiin. mitraaliventtiili(MVP) ja suurten alusten laajentuminen. Muita dysplasian ilmenemismuotoja siinä ei otettu huomioon.
Myöhemmin R.G. Oganov ehdotti muutettuja karttoja. et ai. v 1994 vuosi .; Martynov A.I. ja Stepura O.B. v 1996 vuosi ... Tällä hetkellä täydellinen luettelo STD -oireyhtymän ja kehityksen mikroanomalioiden fenotyyppisistä oireista sisältää yli 100 kohdetta.
Ehdollisesti STD -oireyhtymän ulkoiset fenotyyppiset merkit voidaan jakaa:
1. Perustuslailliset piirteet - asteninen rakenne, jossa kehon pituussuuntaiset mitat ovat poikittaisia ja alipainoisia.
2. Merkkejä oikeasta sukupuolitaudista - poikkeavuuksia kallon kasvojen, aksiaalisen luuston ja raajojen luuston kehityksessä, mukaan lukien kyfoskolioosi, kiiltävä epämuodostuma rintakehä(KDGK), suppilon rinnan epämuodostuma (VDGK), litteät jalat, erilaiset jalkojen epämuodostumat jne.
3. Pienet kehityshäiriöt (MAP) - tähän merkkiryhmään kuuluvat kehityksen mikroanomaliat, joilla ei pääsääntöisesti ole kliinistä merkitystä itsessään, mutta ne toimivat dysembryogeneesin leimautumisena erityisesti yhdistettynä STD -oireisiin.
Tällä hetkellä on tunnistettu paljon STD- ja MAP -oireyhtymän fenotyyppisiä merkkejä, jotka voidaan jakaa ehdollisesti ulkoisiin, fyysisen tarkastuksen aikana havaittuihin ja sisäisiin - sisäelinten, keskus- ja autonomisen puolen oireisiin hermosto... Merkittävimmät niistä on esitetty taulukossa 1.
Pöytä 1.
STD: n ulkoiset fenotyyppiset merkit (E.V. Zemtsovsky, 2000).
|
Anatominen alueella |
Merkit |
|
Perustuslailliset piirteet |
asteninen rakenne, kehon pituussuuntaisten mittojen ylivoima poikittaissuunnassa, heikentynyt asento, alipaino. |
|
Kraniocephalic |
kallon epäsäännöllinen muoto, dolichocephaly, huulten ja ylemmän kitalakilangan yhdistäminen, lyhyt kaula, nenän väliseinämän kaarevuus, usein nenäverenvuotoa. |
|
Silmälääkäri |
leveät tai lähekkäin sijaitsevat silmät, lyhyet tai kapeat kämmenhalkeamat, ptoosi, epikantus, koloboomat, likinäköisyys, astigmatismi, etenevä näköpatologia, kaihi. |
|
Suuontelon |
korkea ja "goottilainen" kitalaki, virheellinen tukkeuma, heikentynyt hampaiden kasvu, halkeama uvula, raidallinen kieli, viisto leuka, paksut huulet urilla, pieni tai suuri suu |
|
Korvat |
matala korvan asento ja epäsymmetria, kiharoiden epänormaali kehitys, pienet tai kiinnittyvät korvakorvat, traguksen puuttuminen, erittäin suuret tai pienet korvat, ulkonevat korvat, synnynnäinen kuulon heikkeneminen |
|
Nahka |
lisääntynyt venyvyys, depigmentaatiokohdat, striat, useat ikäpisteet, hypertrikoosi, hemangioomat, angioctasias, kuiva ryppyinen iho, vatsan poikittaiset taitokset, tavanomaiset dislokaatiot, subluxations, tyrät |
|
Kädet |
lyhyet tai vinoat pienet sormet, kynsien falangien paksuuntuminen, syndactyly, polyarachnodactyly, 4. varvas alle 2., nivelten hypermobiliteetti |
|
Jalat |
suonikohjut, litteät jalat, X- tai O-muotoinen jalkojen kaarevuus, "sandaalin kaltainen" ensimmäinen interdigitaalinen halkeama, nivelten hypermobiliteetti |
|
Luut, selkäranka |
rinnan epämuodostumat, skolioosi, kyfoosi, nuorten osteokondroosi, ihon hyperpigmentaatio spinous -prosessien aikana, lisääntynyt kynsien hauraus. |
|
Sukupuolitautien fenotyyppiset piirteet keskushermoston, ANS: n ja sisäelinten puolelta |
|
|
Sisäelimet ja järjestelmät |
Oireet ja merkit |
|
Keskus- ja autonominen hermosto |
enureesi, puheviat, vegetatiivinen-verisuoninen dystonia, psykologiset persoonallisuuspiirteet. |
|
Sydän ja verisuonisto järjestelmä |
venttiilin prolapsit, vääriä sointuja, papillaarisen lihasten dystopia, aortan juuren laajentuminen, eteisväliseinän aneurysma, angiodysplasia, alaraajojen laskimoiden venttiililaitteen vajaatoiminta jne. |
|
Ulkoinen hengitysjärjestelmä |
Polykystinen keuhkosairaus, spontaani pneumotooraksi, jonka etiologia on tuntematon, trakeobronkiaalinen dyskinesia, synnynnäinen trakeobronchomegalia, keuhkojen hypoplasia, keuhkoputkentulehdus, hyperventilaatio -oireyhtymä. |
|
Virtsatie järjestelmä |
Munuaisten hypoplasia, hevosenkengän munuaiset, munuaisten ja / tai virtsateiden kaksoiskappaleet, pyelokaliceaalisen järjestelmän atoopia, vesikoureteraalinen refluksi, nefroptoosi, ortostaattinen proteinuria, lisääntynyt määrä kollageeniprekursoria - oksiproliinia. |
|
Ruoansulatuskanava |
visceroptoosi, sappirakon poikkeavuudet, taipumus mahalaukun ja suoliston limakalvojen tulehduksellisiin sairauksiin, megakolon, dolichosigma, suoliston mikrodivertikuloosi. |
|
Verijärjestelmä |
lisääntynyt verenvuoto, hemoglobinopatia, trombosytopatia. |
|
Lisääntymiselle järjestelmä |
sukupuolielinten kehityksen ja sijainnin poikkeavuudet, spontaanit abortit naisilla, eunuchoidismi miehillä. |
|
Immuunijärjestelmä |
usein ARVI, herpes, kroonisen infektion keskipisteiden esiintyminen jne. |
Monien tutkijoiden töissä viime vuosina on saatu tietoja erilaisten ulkoisten fenotyyppisten sukupuolitautien merkkien esiintyvyydestä, niiden tietosisällöstä ja yhteydestä muutoksiin sisäelinten sidekudoskehyksessä. Tiedetään, että ulkoisten sukupuolitautien leimautumisten lukumäärän, ihon ja tuki- ja liikuntaelimistön dysplastisten ilmentymien vakavuuden ja sisäelinten sidekudoksen rungon muutosten välillä on läheinen suhde. Todettiin, että kolmen tai useamman sukupuolitaudin ulkoisen fenotyyppisen merkin tunnistaminen antaa aihetta olettaa poikkeavuuksia keskus- ja autonomisen hermoston sekä sisäelinten ja -järjestelmien rakenteessa ja toiminnassa. Huolimatta erilaisista lähestymistavoista sukupuolitaudin ulkoisten merkkien arvioimiseksi, useimmat kirjoittajat pitävät todennäköisimpänä riskiä sydämen ja suurten verisuonten sidekudosrakenteiden osallistumisesta dysplastiseen prosessiin.
Tutkimus dysplasian ulkoisten merkkien ja sydämen sidekudoksen rungon dysplasian välisestä suhteesta viime vuosina, etenkin sydämen ultraäänitutkimuksen kehittyessä, houkutteli monia kotimaisia ja ulkomaisia tutkijoita, ja siksi niitä on eniten tutkittu. Todettiin, että havaittujen leimautumisten määrän kasvaessa sydämen STD -taajuus kasvaa. Kolmen ulkoisen fenotyyppisen merkin läsnä ollessa sydämen sidekudoksen poikkeavuuksia havaittiin 71%: ssa tapauksista ja neljän tai useamman merkin läsnä ollessa - 89%: ssa tapauksista. MVP: n välinen yhteys ihon, silmien, tuki- ja liikuntaelimistön, henkitorven ja keuhkoputkien CT -heikkouden merkkien kanssa havaittiin.
Seuraavien ehdotettiin tarkempaa arviointia sukupuolitautien erilaisten ulkoisten ja / tai sisäisten ilmentymien muutosten asteesta ja kliinisestä ja toiminnallisesta merkityksestä sekä keskus- ja autonomisen hermoston osallisuuden luonteesta ja syvyydestä. NSTD -luokitus(E.V. Zemtsovsky, 2000):
1. Todella pieni sukupuolitauti on kolme tai useampia ulkoisia fenotyyppisiä merkkejä ja / tai MAP, joihin ei liity näkyviä ja kliinisesti merkittäviä muutoksia sisäelinten sidekudoksen rakenteessa.
2. STD -oireyhtymä on kolme tai useampia STD: n ulkoisia leimauksia yhdessä kliinisesti merkittävien muutosten kanssa ainakin yhdessä sisäelimissä.
3. Yleinen STD -oireyhtymän muoto on kolmen tai useamman STD -stigman esiintyminen yhdistettynä tuki- ja liikuntaelimistön merkittävään biomekaaniseen vikaan ja kliinisesti merkittäviin muutoksiin kahdessa tai useammassa sisäelimessä ja -järjestelmässä.
4. Yhden sisäelimen eristetty sukupuolitauti.
Luokitusehdotti V.M. Yakovlev ja G.I. Nechaeva ehdottaa korostamista:
1. Dysplastiset riippuvaiset muutokset STD-elimissä ja -järjestelmissä (liikunta, iho, sisäelimet).
2. STD: hen liittyvät olosuhteet.
Esimerkkejä diagnoosin muotoilusta:
Esimerkki 1. STD. Dysplastisista riippuvaiset muutokset: Luusto, lihakset - dolichostenomelia, suppilon rintakehä II aste, vatsalihaksen lihasten diastaasi, navan tyrä; Viskeraalinen - rintakehän ja kalvon sydämen supistava muunnos, mitraaliläpän prolapsi II aste, johon liittyy regurgitaatiota, hermoston verenkiertohäiriö, sapen dyskinesia.
Esimerkki 2. STD: hen liittyvä krooninen märkivä-obstruktiivinen keuhkoputkentulehdus, paheneminen. STD. Dysplastisista riippuvaiset muutokset: Tuki- ja liikuntaelimistön-rintakehän epämuodostuma, oikeanpuoleinen kylkiluun kyhmy, rintakehän kyphoscoliosis; Viskeraalinen - trakeobronchomalacia, rakkulainen emfyseema, mitraalinen ja trikuspidaaliventtiilin prolapsia ja regurgitaatio Minä tutkinto.
Hieman yksinkertaistetussa muodossa tätä luokitusta käytetään laajalti käytännössä, vaikka sukupuolitautien diagnoosi ei sisälly virallisiin otsikkoluetteloihin.
SYNDROOMI SIDOSKUDOSSydämen DISPLASIA.
Sydämen sidekudoksen dysplasian oireyhtymä (CTDS) yhdistää suuren joukon sydämen sidekudoksen rungon poikkeavuuksia ja ansaitsee erityistä huomiota sen suuren esiintyvyyden, kliinisten ja toiminnallisten ilmentymien tärkeyden ja komplikaatioiden vakavuuden vuoksi. STDS -ideoiden syntyminen ja nopea kehitys tuli mahdolliseksi, koska sydämen ultraäänitutkimus otettiin laajasti käyttöön lääketieteellisessä käytännössä. Kuitenkin vain sisään 1987 vuosi ... New Yorkin kardiologiliiton luokituksen tarkistamisen seurauksena siihen sisällytettiin kahden etiologisen luokan sydämen sidekudoksen dysplasiat. Ensimmäinen luokka sisältää sydämen eriytetyn sukupuolitaudin, toinen - sydämen sidekudoksen rungon "eristetyt" poikkeavuudet. Yksittäisiä poikkeavuuksia ovat: eristetty läppäventtiili, yhdistetty läppäventtiili, eristetty aortan regurgitaatio, aortan renkaan pullistuma, keuhkojen aneurysma.
Vuonna 1990 Omskissa, synnynnäisen sidekudoksen dysplasian ongelmalle omistetussa symposiumissa, STDS eristettiin itsenäisenä oireyhtymänä, mukaan lukien sydämen prolapsit, sydämen väliseinän aneurysmat (MPP) ja Valsalva -poskiontelot. Siitä lähtien kotimainen kirjallisuus on ilmestynyt suuri määrä teoksia, jotka osoittivat STDS: n kliinisen merkityksen ja osoittivat, että edellä mainittujen poikkeavuuksien lisäksi tähän ryhmään tulisi kuulua epänormaalisti sijaitsevat soinnut (LH) ja monet muut pienet sydämen kehityshäiriöt (MARS). MARS -tutkimus antoi S.F. Gnusaev ja Yu.M. Belozerov ehdottaa toimivaa morfologista luokitusta, joka osoittaa 29 anatomista poikkeavuutta sydämen eri osissa. Echokardiografian mukaan 1-12-vuotiaiden lasten alaryhmässä havaitaan erilaisia MARS-oireita 98-99%: ssa tapauksista.
Kehon kasvun ja kehityksen aikana sydämen dysmorfismin merkkien määrä vähenee. Tämä johtuu ennen kaikkea sydänrakenteiden muodostumisen parantumisesta kehittyvässä organismissa. Siten aortta- ja mitraaliventtiilien kehitys jatkuu synnytyksen jälkeisessä ontogeneesissä ja sen tarkoituksena on parantaa obturaattoritoimintaa. Lisäksi MARS -taajuuden väheneminen voi johtua sidekudosrakenteiden käänteisen kehityksen prosesseista (esimerkiksi Eustachian venttiili muuttuu alkeelliseksi iän myötä) ja verenkierron mukautuvasta uudelleenjärjestelystä: oikean kammion kuormitus (RV ) vähenee iän myötä, LV: llä - kasvaa. Tästä johtuen oikean AV -renkaan laajentuminen vähenee iän myötä. Samaan aikaan sellaiset kardiogeneesin häpeät, kuten Valsalva -poskionteloiden laajentuminen, MVP, trikuspidaaliventtiilin (TC) väliseinän siirtymä, voivat perustua dysplastisten prosessien lisääntymiseen, pääasiassa sydämen sidekudoksen stroomaan.
Useiden lapsia koskevien väestötutkimusten mukaan sydämen ultraäänitutkimus paljastaa keskimäärin 1–9 MARS, 3 poikkeavuutta. Kolmen MARS -läsnäolon katsotaan olevan sydämen poikkeavuuksien "kynnystaso". Niiden lasten määrä, joiden MARS -lukumäärä ylittää "kynnyksen" väestössä, on 31,8%. Tällaisilla lapsilla on useammin monimutkainen synnytystä edeltävä kehitys (gestoosi, raskauden keskeytymisen uhka, anemia, urogenitaalijärjestelmän tartuntataudit ja tulehdukselliset sairaudet, äidin hengitystiet jne. Ekologisesti saastuneilla alueilla lasten määrä, joilla on " kynnyksen yläpuolella oleva MARS-taso nousee merkittävästi.
Useissa teoksissa on tietoja STDS: n perinnöllisestä alttiudesta.
STDS -oireyhtymän sydämen ilmenemismuodot ovat erilaisia. Näistä poikkeavuuksista ominaisen kliinisen kuvan muodostumisesta vastuussa olevista mekanismeista ei ole yksimielisyyttä. Kaikkein tutkituin, usein esiintyvä ja kliinisesti merkittävä MARS on primaarinen mitraaliläpän prolapsi.
Prolapsilla tarkoitetaan sydämen mitraalisen ja / tai muun venttiilin yhden tai molempien kaarien taipumista sydämen proksimaalisen kammion suuntaan. MVP: n osalta puhumme venttiilien painumisesta vasemman eteisen onteloon.
Ensisijainen MVP tai "idiopaattinen" on valtaosassa tapauksista yksi STD -oireyhtymän erityisistä ilmenemismuodoista. Ensisijainen MVP esiintyy populaatiossa 1,8-38% tapauksista, ja lapsilla ja nuorilla MVP: n havaitsemistiheys on merkittävästi suurempi kuin aikuisväestöllä. Todettiin, että EchoCG-menetelmällä 1-12-vuotiaiden lasten alaryhmässä prolapsia havaitaan 23%: ssa tapauksista. MVP: tä esiintyy kaikenikäisillä lapsilla ja nuorilla, ja joidenkin kirjoittajien mukaan sitä on pidettävä ilmentymänä ikään liittyvistä eroista venttiililaitteen voimakkaan kasvun ja sydämen koon välillä. Viime vuosina on ilmestynyt tutkimuksia, joiden avulla MVP voidaan tunnistaa perinnöllisten tai synnynnäisten ST -sairauksien ilmentymänä, mikä johtaa MV -venttiilien sidekudoksen dysplasiaan ja niiden etenemiseen vasemman eteisen onteloon.
MVP: n syistä STDS -oireyhtymän yhteydessä voidaan erottaa seuraavat:
1. Mitraaliventtiilin rakenteen häiriöt myksomaattisen rappeutumisen (MD) muodossa, jotka johtuvat heikentyneestä kollageenin aineenvaihdunnasta III ja V tyypit. Termillä MD ymmärretään muutos kollageenikuitujen arkkitehtuurissa ja niiden korvaamisessa happamilla glykosaminoglykaaneilla. 38%: ssa tapauksista MD ulottuu sointulaitteistoon, kun taas sointujen histologiset muutokset ovat samankaltaisia kuin prolapsoivissa haaroissa. MD voi kaapata sydämen johtamisjärjestelmän ja intraventrikulaariset hermokuidut.
2. Poikkeamat venttiililaitteen ja subvalvulaaristen rakenteiden kehityksessä: venttiilien "redundanssi", venttiilien väärä kiinnitys, chordal -filamenttien pidentyminen, papillaaristen lihasten epänormaali vetovoima).
3. Alueelliset supistuvuuden rikkomukset ja LV -sydänlihaksen rentoutuminen (kuvataan 5 erilaista epänormaalia systolista LV: n supistumista ja sen eri osien ulkonemia). Nämä sydänlihaksen supistuvuuden segmentaaliset rikkomukset voivat rentouttaa sointuja ja aiheuttaa (tai pahentaa) mitraalikuskien "redundanssia".
4. Venttiilin ja kammion epätasapainon esiintyminen.
5. Afektiivisten tilojen somaattinen toteutuminen: venttiilien ja subvalvulaaristen rakenteiden vegetatiivisen innervation rikkominen vegetatiivisen tai psykoemotionaalisen toimintahäiriön (neuroosit, hysteria jne.) Taustalla.
6. Krooninen magnesiumionipuutos, joka havaittiin 85%: lla MVP -potilaista ja päinvastoin 26%: lla potilaista, joilla oli piilevä tetania, ultraäänitutkimuksen aikana havaitaan MVP. Havaittiin, että hypomagnesemian olosuhteissa fibroblastit tuottavat viallista kollageenia, mikä häiritsee CT -rakennetta.
STP -oireyhtymään liittyvä MVP: n kliininen kuva on polymorfinen. Tyypillisimmät valitukset rintakehän vasemmalla puolella olevasta kivusta - 32,3-65%. Cardialgiat ovat erilaisia - ompeleita, kipeitä jne. Mahdollisia sydänlihaksen kehittymismekanismeja ovat paikallinen sydänlihasiskemia papillaarilihasten jännityksen seurauksena.
Toinen valitus on hengenahdistus - 15,6-31,5% MVP -tapauksista. Kotimaiset kirjoittajat kuvailevat ilmanpuutteen tunteen, esteen sisäänhengitetyn ilman tiellä, syvien hengitysten tarpeen, tyytymättömyyden hengittämiseen ANS: n toimintahäiriön aiheuttaman hyperventilaatio -oireyhtymän ilmentyminä. Hyperventilaatio-oireyhtymän taajuus MVP: ssä on 21,5-50%.
Sydämentykytyksiä ja keskeytyksiä sydämen työssä esiintyy 25,8-45% tapauksista. Tutkimukset osoittavat, että Holter -seurannalla havaittujen sydämen rytmihäiriöiden ja sydämenlyönnin ja MVP: n keskeytysten välillä ei ole yhteyttä. Tämä tosiasia osoittaa sykkeen autonomisen säätelyn rikkomisen.
Presyncopal- ja pyörtymistilat esiintyvät 4–33,4%: lla MVP -potilaista. Yksi syy on ortostaattinen hypotensio, joka havaitaan 13,9%: lla potilaista, joilla on tämä patologia.
Kasvulliset kriisit ovat MVP: lle ominaisia. Ulkomaisessa kirjallisuudessa termi "paniikkikohtaus" on yleinen. MVP: n havaitsemisen korkea taajuus paniikkikohtauksissa (8,0–49,5%) vakuuttaa heidän läheisestä suhteestaan.
MVP: n diagnosointi auskultatiivisten merkkien avulla on erittäin käytännöllistä. Tyypillistä sydäntä kuunneltaessa on keski- tai myöhäinen systolinen napsahdus ja / tai myöhäinen systolinen kohina. Suru on määritelty sydämen kärjen yläpuolelle ja osoittaa mitraalisen vajaatoiminnan. Useimmissa tapauksissa MVP: n kulku voi kuitenkin olla oireeton, 20%: ssa tapauksista esiintyy "hiljaisia" prolapseja, joihin ei liity kuultavia ilmiöitä.
Koska sidekudoshäiriöt ovat usein yleistyneitä, MVP -potilailla määritetään merkkejä CT -heikkoudesta iholta, silmistä, tuki- ja liikuntaelimistöstä, henkitorvesta ja keuhkoputkista, VNS: stä ja ruoansulatuskanavasta.
Informatiivisin instrumentaalinen menetelmä MVP: n diagnosoimiseksi on EchoCG. Menetelmän herkkyys ja spesifisyys ovat 87-96% ja 87-100%. MVP: hen liittyy usein Doppler -ekokardiografinen mitraalinen regurgitaatio (MR). Mitä korkeampi lehtisten roikkuminen on, sitä todennäköisemmin kehittyy mitraalinen regurgitaatio (MR), joka määrittää MVP: n vakavuuden. Lisäksi riski kehittää muita MVP -komplikaatioita, kuten äkillinen kuolema, tarttuva endokardiitti, kammiorytmihäiriöt, kasvaa MR -asteen myötä. Yksi MR -kehityksen tekijöistä on MV -venttiilien MD -läsnäolo. MVP: n MR voi liittyä venttiilien MD: n lisäksi myös rengasmaisen fibrosuksen laajentumiseen tai venttiilien hypermobiliteettiin. Venttiilirenkaan laajenemisen tai sydänkudoksen liiallisen joustavuuden vuoksi MR ei välttämättä liity MVP: hen, vaan esiintyy itsenäisenä sairautena. Todettiin, että minimaalinen regurgitaatio MC: llä nuorilla esiintyy 76,4%: ssa tapauksista, MC: ssä - 72,7%.
MVP -potilailla havaitaan usein erilaisia rytmi- ja johtumishäiriöitä. Eri kirjoittajien mukaan kammioiden ennenaikaisia lyöntejä (VES) esiintyy 18,2-90,6%tapauksista, supraventrikulaarisia ennenaikaisia lyöntejä (SVES)-16-80%, SA-salpaa-3,2-5%, AV-lohkoja-0,9-9% .
Tällä hetkellä ei ole yksimielisyyttä rytmihäiriöiden kehittymismekanismeista MVP: ssä. Havaittiin, että potilaat, joilla oli idiopaattinen MVP ja sydämen ultraäänitutkimuskriteerit venttiilien MD: lle ja / tai papillaarilihasten epänormaali vetovoima 8 mm ja useimmilla on lisääntynyt kammioiden rytmihäiriöiden riski. Potilailla, joilla on MVP papillaarilihasten voimakkaan epänormaalin vetovoiman taustalla, Lownin mukaan laadukkaat VEB -arvot kirjataan 50%: ssa tapauksista. Todennäköisesti papillaarilihasten voimakas epänormaali vetovoima aiheuttaa LV -sydänlihaksen paikallisen osan elektrofysiologisen epävakauden, joka altistaa kammioiden rytmihäiriöille. MC: n prolapsiventtiilien MD: llä IVES: n ja VES: n esiintymisen riski kasvaa merkittävästi. IVES: n syntyminen liittyy vasemman eteisen solujen sähköisen aktiivisuuden lisääntymiseen ja muutokseen, jota systolin aikana ärsyttää MC: n prokssoitunut myksomaattinen venttiili ja / tai mitraalinen regurgitaatiovirta, ja IVES liittyy LV -seinän mekaaniseen stimulaatioon myksomaattisesti muutetuilla sointuilla.
MVP: n läsnä ollessa paroksismaalinen supraventrikulaarinen takykardia esiintyy useammin kuin populaatiossa, mikä lisää äkillisen kuoleman riskiä. Paroksismaalisten rytmihäiriöiden tunnistaminen MVP: ssä liittyy lisäpolkuja tilalla. Patogeeninen suhde MVP: n läsnäolon ja johtavan järjestelmän poikkeaman välillä havaittiin kehityshäiriöinä sydämen eri rakenteissa alkion organogeneesin aikana.
Toiminnallinen sairas sinus -oireyhtymä MVP: n läsnä ollessa esiintyy 2,4-17,5%: ssa tapauksista. Sen läsnäolo voi johtua autonomisesta toimintahäiriöstä, jossa vallitsevat vagaaliset vaikutukset.
Henkilöillä, joilla on MVP, SRPC (varhainen kammion repolarisaatio-oireyhtymä) esiintyy 12,5-35%: ssa tapauksista. Lisäksi kun SRPC havaitaan MVP -potilailla, sydämen rytmihäiriöitä havaitaan 92,3%: ssa tapauksista. MVP: llä oireyhtymä esiintyy 8 kertaa useammin kuin terveillä ihmisillä WPW.
Lisäksi, kun MVP on EKG: ssä, epäspesifisiä repolarisaatiohäiriöitä havaitaan 4-44%: ssa tapauksista ohimenevän T-aallon inversion ja segmentin masennuksen muodossa ST II, III, aVF, V 5, V 6. Nämä muutokset voivat liittyä iskemiaan ja ANS: n sympaattisen jaon toimintahäiriöön.
Viime vuosina on kiinnitetty paljon huomiota äkillisen kuoleman ennustajien tutkimukseen MVP -potilailla. Lisääntynyt aikaväli Q - T. EKG -tutkimus havaitaan 24%: lla MVP -potilaista. Lisäksi havaittiin positiivinen korrelaatio lisääntyneellä aikavälin vaihtelulla Q - T. prolapsin syvyydellä ja läpäisevien venttiilien MD: llä.
Julkaistut tiedot MVP: n hemodynaamisten häiriöiden arvioinnista STD -potilailla ovat ristiriitaisia. Jotkut kirjoittajat viittaavat siihen, että LV -ontelon koko pienenee ja sydänlihaksen supistumistoiminnan indikaattorit lisääntyvät; toiset huomaavat vain taipumuksen laskea sydänlihaksen massaa normaalilla pumppaamis- ja supistumisfunktiolla. Joissakin tutkimuksissa osoitettiin keskushermoston hyperkineettisen tyypin hallitsevuus (61,7%) ja MR: n suuri esiintyvyys (90,4%), toisissa - hypokineettinen. Hemodynaamisia häiriöitä koskevien julkaistujen tietojen ilmeinen epäjohdonmukaisuus voi johtua tutkittujen potilaiden ikään liittyvistä eroista, heidän perustuslaillisista ominaisuuksistaan sekä sopivan eriytetyn lähestymistavan puutteesta sukupuolitautien diagnosoinnissa.
Hemodynaamisten muutosten syiden tutkimus paljasti korrelaation iän ja sukupuolitaudeista kärsivien potilaiden perustuslaillisten piirteiden kanssa, erityisesti rintakehän, selkärangan epämuodostumien vakavuuden ja elinten asennon kanssa rinnassa.
Dysplastisesta riippuvaisia sydämiä on kolme tyyppiä:
1. STD -rintakehän sydämen asteninen muunnelma on tyypillinen potilaille, joilla on astenista rintatyyppiä, joilla on "suora selkä" -oireyhtymä ja rinnan epämuodostuma Minä tutkinto. Sille on ominaista sydänontelojen koon pieneneminen ilman sydänlihaksen massan vähenemistä ja biomekaniikan muutokset, mikä ilmenee systolisen supistumisen lisääntymisenä ja diastolisen rentoutumisen vähenemisenä, johon liittyy iskun tilavuus.
2. Dysplastisesta riippuvaisen sydämen supistuva variantti havaitaan potilailla, joilla on vakava rintakehän ja selkärangan epämuodostuma. Tässä tapauksessa sydän joko pienenee ja puristuu tai sitä pyöritetään verisuonten päärungon vääntöä. Sydänlihaksen supistumistoiminta heikkenee erityisesti haimassa.
3. Rintakehän sydämen pseudodiastolinen variantti esiintyy potilailla, joilla on selkeä rintakehän epämuodostuma ja aortan juuren laajeneminen. Rakenteellisiin muutoksiin liittyy diastolen pienikokoisen LV: n koon lisääminen. Tässä tapauksessa LV saa pallomaisen muodon.
On olemassa tietoja LV -diastolisen toimintahäiriön muodostumisesta lapsilla ja nuorilla, joilla on MR, MVP: n taustalla, mikä ilmenee varhaisen täytön huippuvirtausten pienenemisenä, aikaisen täyttövirtauksen hidastumisen ajan vähenemisenä ja kompensoiva lisäys eteiskomponentin osuudessa diastolisessa täytössä. Mukaan Nishimur, RA, Tajikaj (1994) syy varhaisen diastolisen täyttymisnopeuden laskuun on kammion seinämän lisääntynyt jäykkyys, heikentynyt aktiivinen rentoutuminen ja vähentynyt sydänlihaksen elastisuus. Lisäksi havaittiin, että kun läsnä on MD: tä MVP: n taustalla, LV -systolista toimintaa kuvaavat indikaattorit ovat käänteisiä, mikä ilmenee CVR: n (lopullinen systolinen tilavuus) nousuna, taipumuksena EDV: n lisääntymiseen (loppu diastolinen tilavuus), EF: n (ejektiofraktion) väheneminen taustaa vasten hidastaa sydänlihaksen pyöreän supistumisen nopeutta ja symmetrisen LV -hypertrofian ensimmäisten merkkien muodostumista, mikä ilmenee IVS: n ja LVWS ja sydänlihaksen massaindeksin (MI) nousu. Nämä muutokset (supistumisnopeuden hidastuminen ja MI: n nousu) voivat johtua sydänlihaksen rakenteiden laadullisesta tilasta MD: n läsnä ollessa. Lapsilla, joilla on MVP ilman MR- ja MD -oireita, ei ole diastolisia ja systolisia toimintahäiriöitä.
Toinen yleinen epänormaali sydämen sidekudoksen runko on vääriä sointuja, jotka valtaosassa tapauksista (95%) sijaitsevat LV -ontelossa, harvemmin RV: n, RV: n, LA: n onteloissa. Toisin kuin todelliset soinnut, ne eivät liity eteis -kammioventtiilien koukkuihin, vaan ne on kiinnitetty kammioiden vapaisiin seiniin. Epänormaaleja fibromuskulaarisia nippuja kuvattiin ensimmäisen kerran vuonna 1893 W. Turner ruumiinavauksessa ja niitä pidettiin muunnelmana normista. Vääriä sointuja on suhteellisen äskettäin pidetty seurauksena geneettisestä viasta tai sukupuolitaudeista, jotka johtavat sukupuolitaudin kehittymiseen. HL: n geneettisen determinismin vahvistaa se tosiasia, että niiden topografia lasten ja vanhempien LV -ontelossa on useimmissa tapauksissa identtinen.
LH ovat johdannainen primitiivisen sydämen sisäisestä lihaskerroksesta, joka esiintyy alkion aikana, kun papillaariset lihakset nyöritetään. Histologisesti HL: llä on kuitu-, fibromuskulaarinen tai lihasrakenne. Merkittävä sironta HL-määrityksen taajuuksien tuloksissa sydämen ultraäänitutkimuksella (0,5-68%) tapauksista osoittaa, että näiden poikkeavuuksien diagnosoinnissa ei ole yhtenäistä metodologista lähestymistapaa. Jotkut kirjoittajat ehdottavat erottamaan väärät soinnut ja epänormaalit trabekulat (AT). Suurin ero LH: n ja AT: n välillä on sen korkea ultraäänitiheys ja filamenttinen muoto. AT on yleensä karan muotoinen, ja sen pohja on leveä ja tiheys lähellä sydänlihaksen tiheyttä. Kuitenkin useissa tapauksissa rakenteen huomattavan vaihtelevuuden vuoksi ei ole aina mahdollista tunnistaa intraventrikulaarisia supistuksia sointuiksi tai trabekulaatioiksi, mikä useiden kirjoittajien mukaan vahvistaa yleisnimityksen - HL .
Sydämen ilmenemismuodot riippuvat suurelta osin näiden sointujen paikasta LV -ontelossa. Kliinisesti merkittävimpiä ovat poikittaiset basaaliset ja useat soinnut, jotka aiheuttavat "musikaalin" systolisen kohinaa ja johtavat sydämen sisäisen hemodynamiikan ja sydämen diastolisen toiminnan rikkomiseen, edistävät sydämen rytmihäiriöitä. Mielipiteet sydämensisäisen hemodynamiikan ominaisuuksista HL: ssä ovat kiistanalaisia. LH, riippuen topografiasta ja kammion osasta, jossa ne sijaitsevat (apikaalinen, mediaani ja basaali), vaikuttavat kammion geometriaan. Storozhakov G. I. tutkii LH: n roolia sydämen sisäisen hemodynamiikan rikkomisessa v 1993 vuosi havaitsi huippunopeiden verenvirtausten esiintymisen LH-ontelon LH-alueilla, mutta tämän ilmiön roolia ei ole tutkittu. Kirjallisuudessa on satunnaisia tietoja lähetysverivirtauksen nopeusparametrien muutoksista, mikä voi johtaa sydänlihaksen rentoutumiskyvyn heikkenemiseen ja LV -diastolisen toimintahäiriön kehittymiseen. Useat tutkimukset ovat osoittaneet, että LH: n sijoittaminen keski- tai basaalisegmenteihin voi estää LV -rentoutumista kutistamalla diastolen LV -onteloa. Petrov V.S. osoittaa LV -koon kasvua, lievää LV -ejektiofraktion pienenemistä aikuisilla HL -potilailla. Nämä muutokset liittyvät hänen mielestään sydämen CT-kehyksen heikkouteen ja MR: n esiintymiseen, jota esiintyy yksilöillä, joilla on HL suurella taajuudella.
HL: n rytmihäiriöistä roolia on tutkittu intensiivisesti viimeisten 10 vuoden aikana. Ensimmäistä kertaa sisään 1984 H. Suwadal ehdotti HL: n roolia sydämen rytmihäiriöissä. Useimpien tutkijoiden mukaan LH on sydämen johtamisjärjestelmän lisäelementti, jolla on kyky johtaa sähköisiä impulsseja ja siten osallistua sydämen rytmihäiriöiden esiintymiseen. Kuitenkin ei ole yksimielisyyttä rytmihäiriöiden mekanismeista LV LC: ssä. Toinen mahdollinen mekanismi rytmihäiriöt sisältävät muutoksia sileiden lihassolujen elektrofysiologisissa ominaisuuksissa johtuen LV -ontelon muodonmuutoksesta ja turbulentista verenkierrosta, joka johtuu LH: n muodossa olevasta esteestä. Arytmogeenisen vaikutuksen vakavuuden riippuvuus HL: n topografisista muunnelmista todettiin. Useimmat rytmihäiriöiset ovat poikittaisia perus-, moninkertaisia. Lisäksi sointupaksuuden ja sen rytmigeenisyyden välillä on suora korrelaatio.
On todettu, että SRPC -ilmiöt, CLC, WPW 68-84,9%: ssa ne yhdistetään LH: hen, pääasiassa pitkittäiseen. Lisäksi SRAD lapsilla, joilla on HL, havaitaan 72%: lla, aikuisilla - 19%: lla tapauksista. LH: n ja autonomisen toimintahäiriön oireyhtymän välinen suhde on havaittu, jota pidetään STD -oireyhtymän ilmentymänä.
1. Kammioiden ennenaikaisen virityksen oireyhtymä.
2. Kammioiden varhaisen repolarisaation oireyhtymä.
3. Ennenaikaiset kammiokompleksit.
4. Kammiokompleksin terminaaliosan epävakaus posterior-inferior-johtimissa.
Viime vuosina saavutetut menestykset STDS -tutkimuksessa, erityisesti sen yksittäiset ilmenemismuodot - MVP ja LVLVH, vahvistavat niiden kliinisen merkityksen, joka koostuu ennen kaikkea STDS: n kulkua vaikeuttavasta rytmihäiriöoireyhtymästä. Samaan aikaan muiden STDS -oireyhtymän merkkien kliiniset ja toiminnalliset ilmenemismuodot - aortta- ja trikuspidaaliventtiilien prolapsit, Valsalva -poskionteloiden aneurysmat, papillaaristen lihasten poikkeavuudet ja muut ovat edelleen huonosti ymmärrettyjä. Vain muutamissa tutkimuksissa on tietoja sydämen rytmihäiriöiden suhteesta HL: ään LA-ontelossa, MPP: n aneurysmaan ja oikean eteisen mikro-poikkeavuuksiin. Intrakardiaalisen hemodynamiikan indikaattoreiden tutkimukset ovat hajanaisia ja liittyvät yksittäisiin STDS -oireyhtymän oireisiin, ennen kaikkea MVP: hen ja LVH: hon. Ottaen huomioon tehtyjen tutkimusten tiedot, jotka osoittavat joidenkin sukupuolitautien sukupuolitautien etenemistä ja taantumista iän myötä ja samanaikaisesti muiden STD -oireiden ja STD -oireyhtymään liittyvien sairauksien esiintymistiheyden lisääntymistä, mikä johtuu laajalle levinneestä ST: n kehossa on ilmeistä, että on tarpeen etsiä lähestymistapoja varhaiseen diagnosointiin, arvioida eri elinten ja järjestelmien sidekudosrakenteiden osallisuuden aste ja muutosten vakavuus ajoissa tapahtuvaa ehkäisyä varten, ja tarvittaessa riittävä monimutkainen hoito ja kuntoutus potilailla, joilla on STDS -oireyhtymä.
LASTEN VEGETATIVE STAT STD.
V tutkimus toimii Viime vuosina on osoitettu SDST: n suhde voimakkaisiin autonomisiin oireisiin, sen mosaiikki- ja monisuuntaisiin reaktioihin. Autonomisen toimintahäiriön oireita havaitaan lähes ¾: lla STDS -nuorista, kun he käyttävät A.M. Wayne. Joidenkin tutkijoiden mukaan VSD havaitaan lähes kaikilla STD -potilailla. VSD: n havaitsemisen korkea taajuus johtuu limbikorekulaarisen kompleksin, joka sisältää aivojen hypotalamuksen, rungon ja ajallisten lohkojen, rakenteen ja toiminnan perinnöllisistä piirteistä. Tämä seikka määrää ennalta neurovegetatiivisten reaktioiden epänormaalin luonteen. STD: hen liittyvän autonomisen toimintahäiriön syy on kollageenin rakenteen muutos, joka vaikuttaa negatiivisesti sen troofiseen toimintaan keskus- ja autonomisessa hermostossa, mikä puolestaan edistää VSD: n kehittymistä. Kasvukriisien perheen alttiutta koskevat tutkimukset mahdollistivat paitsi niiden pystysuoran siirtymisen myös ympäristötekijöiden osallistumisen. Oletetaan, että neurovegetatiivisen vasteen luonne on perinnöllinen, ja sitä muutetaan tietyllä tavalla ympäristöolosuhteiden mukaan.
G.I. Nechaeva. STD -oireyhtymällä (aikuisväestössä) muodostuu autonomisen toimintahäiriön oireyhtymä, jossa vallitsee sympaattinen säätely (97%), jonka tärkeimmät ilmentymät ovat cardialgia (57,5%), verenpaineen epävakaus (78%) ja hengityselimet toimintahäiriö (67%). Sympaattisen sääntelyn vahvistumisen myötä luodaan olosuhteet kaikkien talouden elinten ja järjestelmien, erityisesti sydämen, verisuonten, keuhkojen, epätaloudelliselle energiankulutukselle, mikä on syy adaptiivisten mekanismien ehtymiseen. CIG -analyysi 15–30 -vuotiaiden alaryhmässä osoitti, että STD -oireyhtymää sairastavien potilaiden ryhmässä on taipumus hallita autonomisen sävyn reaktion sympaattisia mekanismeja (56% potilaista). COP: n autonomisen reaktiivisuuden arviointi osoittaa autonomisen säätelyn mukautumiskyvyn heikkenemisen 80%: lla STDS -potilaista: 1/3 - havaittiin hyperreaktiivisuus, 1/4 - reagoimattomuus, 47% - indikaattoreiden epäsynkronismi.
Kun tutkittiin STD: n ja MARS: n fenotyyppisiä ilmenemismuotoja yksilöillä, joilla oli kasvullisia kriisejä, paljastui näiden merkkien vallitseva kertyminen tässä potilasryhmässä verrattuna terveisiin. STDS -oireyhtymän merkkien lukumäärän ja autonomisen dysregulaation ilmenemismuotojen vakavuuden välillä havaittiin suora korrelaatio. Monet kirjoittajat korostavat VSD: n ja MVP: n etiologista yhteisyyttä, vegetatiivisen dystonian oireyhtymää pidetään yhtenä MVP: n ja / tai LVH: n kliinisistä oireista.
Lasten autonomisen reaktiivisuuden piirteitä on tutkittu vain vähän. Lapsilla (2-15-vuotiaat), joilla on rytmi- ja johtumishäiriöitä sukupuolitaudin taustalla, paljastuu VSD-oireyhtymä, lähinnä vagotonista tyyppiä. Kliinisesti tämä ilmenee presynkooppisten, pyörtymis- ja astenisten tilojen, kardiaalisen oireyhtymän, jännityspäänsärkyjen muodossa, joihin usein liittyy psykopatologisia häiriöitä. Samaan aikaan lähes kaikilla STDS -oireyhtymää sairastavilla lapsilla on CIG -tietojen mukaan autonomisen dysregulaation ilmenemismuotoja. Polkupyöräergometrian tietojen mukaan STDS -oireyhtymän oireita sairastavien lasten fyysinen suorituskyky heikkenee.
Tarve lisätutkimuksiin STS: n tilasta lapsilla, joilla on sukupuolitaudin oireita, on ilmeinen kliinisten ilmenemismuotojen runsauden, autonomisen dysregulaation ja fyysisen ja emotionaalisen stressin sietokyvyn vuoksi. Näillä potilailla on riski häiritä kehon sopeutumismekanismeja.
BRONKOLOGISEN JÄRJESTELMÄN STD JA PATOLOGIA.
On osoitettu, että geneettisesti määritetty ST -puutos voi liittyä keuhkoputkien toimintahäiriöön, jonka yksi ilmentymä on trakeobronkiaalinen dyskinesia (TBD). TBD - henkitorven ja suurten keuhkoputkien ontelon kaventuminen uloshengityksen aikana CT: n epänormaalin rakenteen vuoksi. TBD: n kehittymismekanismi liittyy siihen, että suurikokoisten ja keskikokoisten keuhkoputkien keuhkoissa on voimakas sidekudoskehys, ja siksi STD -potilailla ylempien hengitysteiden elastisuus vähenee CT: n ensisijainen "heikkous". Siksi pakotetun inhalaation aikana suurten ja keskisuurten keuhkoputkien kaventuminen tapahtuu niiden seinien prolapsin seurauksena.
TBD: n havaitsemiseksi berotek -inhalaatiotesti on informatiivinen. Berotekin kanssa hengitettynä vain sidekudoksen runko vastustaa ilmavirtaa uloshengityksen aikana, joten ylempien hengitysteiden ”heikkouden” tapauksissa trakeobronkiaalinen dyskinesia pahenee (paradoksaalinen tulos berotek -testistä). TBD: n esiintyminen todettiin 73,3%: lla idiopaattista MVP: tä sairastavista aikuispotilaista ja 83,3%: lla - LH, mikä on yhdenmukaista muiden kirjoittajien tutkimustulosten kanssa: MVP -potilailla primaarinen TBD määritetään 75,3%: ssa tapauksista.
Morfologiset muutokset keuhkoputkien keuhkosysteemissä STD: ssä johtavat muutoksiin trakeobronkiaalisen puun ja alveolaarisen kudoksen tuki- ja rustokehyksen toiminnassa, mikä tekee niistä erittäin joustavia ja muodostaa trakeobronchomegalian, tracheobronchomalasian, keuhkoputkentulehduksen ja joissakin tapauksissa idiopaattisen spontaanin pneumotooraksin esiintyminen. STDS-merkkiaineiden ilmaantuvuus oli suurempi potilailla, joilla oli trakeobronkiaalinen patologia (33,3%), mikä ylittää väestön yleiset indikaattorit 4-5 kertaa. Nämä tiedot vahvistavat sidekudoksen dysplasian roolin keuhkoputkentulehduksen kehittymisessä. Kun jälkimmäinen ilmenee henkilöillä, joilla on alkuperäinen CT -vika, muita epäsuotuisia tekijöitä havaitaan obstruktiivisen keuhkopatologian aikana. Näitä tekijöitä ovat sukupuolitaudeille ominainen immuunipuutos ja trakeobronkiaalinen dyskinesia. Huolimatta näiden muutosten vakavuudesta ja ongelman kiireellisyydestä, sukupuolitautien merkitys keuhkoputkien tukkeutumisen synnyssä vaatii lisätutkimuksia.
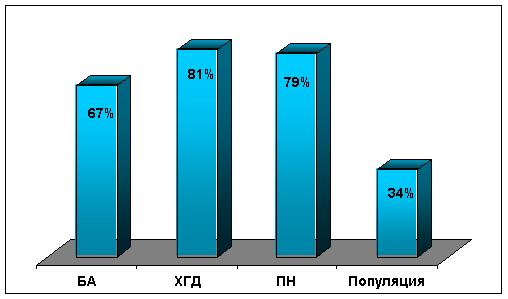
STD -lasten hengityselinten patologia on laaja, mutta huonosti ymmärretty. Tutkimuksessa V.V. Zelenskaya (1998) osoitti, että keuhkoputkipatologiaa sairastaville lapsille on ominaista suuri sukupuolitautien esiintyvyys (BA: lla - 32,1%, kroonisella keuhkoputkipatologialla - 30,8%). STD -oireita sairastavien lasten astman kulun kliiniset piirteet paljastettiin: hyökkäyksen vegetatiivinen väri, lievä astma - bronkospasmin "mykkä" variantti, kohtalainen ja vaikea astma - suuri osa keuhkoputkien poikkeavuuksista, komplikaatiot spontaani pneumotooraksi ja ihonalainen emfyseema, alhaisempi vaste bronkospasmolyyttisille lääkkeille, pääasiassa keuhkoputkia estävien häiriöiden proksimaalinen luonne.
Tietojemme mukaan lapsilla, joilla on astma, sukupuolitautien esiintyvyys on 67%. Useimmissa tapauksissa lapsilla, joilla on astma STD: n taustalla, havaittiin merkittäviä autonomisen säätelyn rikkomuksia, mikä vahvistetaan EKG: n tunnusmerkeillä sekä muutoksilla alkuperäisessä autonomisessa sävyssä ja autonomisessa vasteessa. Tälle lapsiluokalle on ominaista usein havaitut ja voimakkaimmat hemodynaamiset muutokset. Ensinnäkin ne liittyvät oikeaan sydämeen ja ilmenevät oikean kammion diastolisen toimintahäiriön, sen ontelon lisääntymisen, virtausprofiilin siirtymisen keuhkovaltimossa systolin alussa, sydämen murto -osa systolista paksuuntumista ja interventrikulaarisen väliseinän kinetiikan rikkominen. Nämä tiedot osoittavat, että jokaisella 3-4: llä BA-lapsella on keuhkoverenpainetauti. Sukupuolitautien vaikutus keuhkoverenpainetaudin kehittymiseen astmaa sairastavilla lapsilla on vahvistettu sillä, että näitä muutoksia havaittiin lapsilla, joilla ei ole vain vaikeaa, vaan myös kohtalaista ja jopa lievää astmaa.
Siitä huolimatta monet tämän patologian näkökohdat lapsuudessa ovat edelleen huonosti ymmärrettyjä. Epäselvän kliinisen kuvan, tämän patologian suuren esiintyvyyden ja prosessin kroonisuuden mahdollisuuden aiheuttamat vaikeudet diagnosoida oikea -aikaisesti edellyttävät lisätutkimuksia STD: n roolista bronkopulmonaalisen patologian kehityksessä.
STD- JA GASTROINTESTINAALISEN SUUREN PATOLOGIA.
STD: n yhteydessä maha -suolikanava (GIT), joka on yksi kollageenisimmista elimistä, on väistämättä mukana patologisessa prosessissa. ST -dysplasiassa tämä ilmenee suolen mikrodivertikuloosina, heikentyneenä ruoansulatusmehujen erittymisenä, onttojen elinten peristaltiikana. Sappirakon hypomotorinen dyskinesia havaitaan potilailla, joilla on MVP 59,8%: lla ja LVH 33,3%: ssa tapauksista. Potilailla, joilla on MVP ja ruoansulatuselinten patologia useammin kuin ilman sitä, sydämen vajaatoiminta (40,0-64,3%), hiatal-tyrä (14,0-45,2%), sappirakon kehityshäiriöt (20, 0-52,7%), dolichosigma (40,0-84,6%). MVP: tä pidetään yhtenä riskitekijänä ruoansulatuskanavan sairauksien kehittymiselle. Tiedetään, että STD -potilailla on erilaisia, yleensä kroonisia visceropatologioita. Krooninen gastroduodenitis (CGD) ruoansulatuskanavan sairauksien rakenteessa on 60-80%. CHD on sairaus, joka perustuu mahalaukun limakalvon solujen uudistumisen rikkomiseen vastauksena krooniseen bakteerivaurioon ( Helicobacter pylori ) tai muuta luonnetta.
STD-taustalla olevilla potilailla, joilla on CHD, prosessin kroonisuuden kehittymisessä olennainen yhteys on epiteeli-stromaalisten suhteiden rikkominen tulehduksen aikana, joita säätelee erityisesti paikallinen immuunijärjestelmä. T.N. Lebedenko tutki yksityiskohtaisesti kroonisen gastroduodeniitin kliinisiä ja morfologisia ominaisuuksia STD -potilailla. Kirjoittajan mukaan hallitseva muoto Helicobacter pylori - siihen liittyvä gastriitti STD -potilailla on pangastriitti, johon liittyy lievä tai kohtalainen mahalaukun limakalvon atrofia.
Ruoansulatuskanavan patologian ja sukupuolitautien välistä suhdetta lasten populaatiossa on tuskin tutkittu. Tästä ongelmasta on vain muutamia tutkimuksia. Erityisesti STD: n suuri esiintyvyys (28-30%) kuvattiin lapsilla, joilla oli maha-suolikanavan patologia ja kehityshäiriöitä, pääasiassa sappirakko (62%), lapsilla, joilla oli STD-taustalla oleva CHD. Joitakin piirteitä CGD: n kulusta STD -taustaa vasten paljastettiin, mukaan lukien kliinisen kuvan hämärtyminen, ANS: n kiinnostus. Tietojemme mukaan STD -oireyhtymän esiintyvyys CHD -lapsilla saavuttaa 81% (kuva). Tässä lapsiluokassa on vatsan elinten dysplasia - sappirakon poikkeavuudet, gastroesofageaalinen refluksi jne. (M.A. Klyuchnikova, 2003).
|
|
Riisi. STD -oireyhtymän esiintymistiheys keuhkoastmassa, kroonisessa mahalaukun tulehduksessa ja kroonisessa pyelonefriitissa (oman tutkimuksen tulokset)
STD JA Virtsatiejärjestelmän patologia.
Viime vuosikymmeninä, kun ulkoisen ympäristön haittavaikutukset ihmiskehoon ovat lisääntyneet, kirjallisuudessa on esiintynyt tietoja virtsatiejärjestelmän sairauksien esiintyvyyden lisääntymisestä väestössä. Samaan aikaan dysembryogeneesiin liittyvien munuaisvaurioiden määrä lisääntyi, ts. munuaisten muodostumisen rikkominen elin-, solu-, subcellular -tasoilla ja niiden yhdistelmien muodossa. Sairauksille on ominaista laaja ikäalue, merkittävä osa piilevistä kliinisistä muunnelmista, jotka lopulta muodostavat kroonisia muotoja.
Tällä hetkellä vallitsee mielipide, että primaarista pyelonefriittiä ei ole, mutta pyelonefriitti, jonka syy on tuntematon. STDS: n suuri esiintyvyys lapsilla, joilla on akuutti pyelonefriitti, viittaa siihen, että munuaisten sukupuolitauti voi olla riskitekijä ja sairauden kehittyminen näillä potilailla kudosrakenteen epänormaalisuuden seurauksena, joka ilmenee sisällön vähenemisenä tietyntyyppiset kollageeni tai niiden suhteen rikkominen. On näyttöä yleistyneestä ei-immuunisesta membranopatiasta, joka johtuu progressiivisesta kollageenin rappeutumisesta ja pääasiassa glomerulaaristen peruskalvojen osallistumisesta STD-potilailla. On esimerkiksi osoitettu, että nefroptoosia sairastavilla potilailla on häiriöitä elastisten ja kollageenikuitujen muodostumisessa ja jälkimmäisessä dystrofisia muutoksia. Tällä hetkellä hyväksytyn STD -luokituksen mukaan voidaan olettaa, että STDS -oireyhtymä voidaan yhdistää munuaisten STD: hen. Nämä potilaat kuuluvat perinnöllisten CT -sairauksien ryhmään, joilla on viskeraalisia ilmenemismuotoja. Tämä voidaan vahvistaa tiedoilla, jotka koskevat munuaissairauksien kuormittunutta perhehistoriaa useimmilla näistä potilaista, ts. voimme puhua tämän taudin geneettisestä determinismistä. Useiden kirjoittajien mukaan STDS -oireyhtymä havaitaan usein (72%) lapsilla, joilla on munuaissairaus, mukaan lukien ne, joilla on akuutteja ja kroonisia pyelonefriitin, glomerulonefriitin ja interstitiaalisen nefriitin muotoja. Lisäksi on osoitettu, että pyelonefriitilla lapsilla, joilla on sukupuolitauti, synnynnäisten epämuodostumien taustalla OMS: n kehityksessä on kurssin piirteitä: se etenee usein piilevästi, vähäisin oirein ja ilmenee pääsääntöisesti vain virtsaoireyhtymästä, kahdenvälisiä vaurioita, kalvoa tuhoavan prosessin läsnäolo ja pyridoksiinin puute.
MUUTOKSET VERIJÄRJESTELMÄSSÄ STD: ssä.
Hemorraginen oireyhtymä on yksi mesenkymaalisten dysplasioiden ilmentymistä, ja siksi sitä voidaan pitää osana STD -oireyhtymää. Henkilöillä, joilla on MVP, havaittiin hemostaasijärjestelmän linkkien rikkomuksia: muutos verihiutaleiden aggregaatiotoiminnassa, von Willebrand -tekijän aktiivisuuden väheneminen veriplasmassa, veren hyytymisen viimeisen vaiheen rikkominen. Todettiin, että potilailla, joilla on MVP, esiintyy verenvuoto-oireyhtymän ilmenemismuotoja: usein nenäverenvuotoa, petechial-täplikkäitä verenvuotoja iholla, lisääntynyttä ikenien verenvuotoa, pitkittynyttä verenvuotoa ja pareesia.
Immuunijärjestelmän tila STD: ssä.
Nykyaikaiset kirjallisuustiedot eivät jätä epäilystä immuunijärjestelmän tilan ja STD -oireyhtymän läheisestä suhteesta.
Nechajevan tietojen mukaan STD: ssä muodostuneen tymolymfikudoksen dystrofiset muutokset heikentävät kehon immunologista pätevyyttä. STD -potilailla 59,6%: lla on immunologisen vajaatoiminnan anamneettisia ja kliinisiä oireita (usein akuutteja hengitystieinfektioita, herpes, nokkosihottuma jne.), Jotka vahvistetaan solu- ja humoraalisen immuniteetin muutoksilla. G.F. Ibragimova toteaa myös immuunijärjestelmän epätasapainon lapsilla, joilla on rytmi- ja johtumishäiriöitä CT -dysplasian taustalla. Lapsilla, joilla on sukupuolitaudin oireita, diagnosoidaan usein kroonisen infektion keskipisteitä, usein esiintyviä samanaikaisia sairauksia, jatkuvia klamydia- ja herpeettisiä infektioita, tuberkuloosia, sisäelinten epämuodostumia ja hormonitoimintaa. Voidaan olettaa, että tämän luokan lasten kroonisten sairauksien piilevä tai epätyypillinen kulku voi liittyä immuunivasteen vääristymiseen sukupuolitautien taustalla eri patogeenisten tekijöiden vaikutuksesta.
HOITO.
STD -oireyhtymän hoidon tulee olla monimutkaista ja yksilöllistä ottaen huomioon ikä, sisäelinten ja tuki- ja liikuntaelimistön häiriöiden vakavuus, psyykkiset poikkeavuudet ja autonomiset toimintahäiriöt (E.V., Zemtsovsky, 2000). Järkevän päivittäisen ruokavalion ja ravitsemuksen ohella on tarpeen määrittää fyysisen aktiivisuuden tyyppi ja aste, joita ei pitäisi sulkea pois (vaan pitäisi olla pakollisia) lapsen yksilöllisessä ohjelmassa. STD -oireyhtymän kohtalaisissa ilmenemismuodoissa riittävää liikuntaa on pidettävä yhtenä tärkeimmistä terapeuttisen toiminnan keinoista. Virkistysliikunta nopeuttaa sidekudoksen kypsymistä ja kompensoi olemassa olevia vikoja, luo edellytykset kudoselinten lisääntyneelle hapettumiselle ja kehon reaktiivisuudelle (mukaan lukien immunologinen). Erilaisten harjoitus- ja hierontamenetelmien käyttö edistää usein paitsi patologisen prosessin kehittymisen keskeyttämistä myös lapsen kehon kompensoivien ja sopeutumiskykyjen lisääntymistä.
Lääketieteellinen (metabolinen) korjaus voidaan esittää kaavamaisesti seuraavasti:
1. Korjaus solutasolla ottaen huomioon kronobiologiset rytmit: karnitiini (L -muoto) - klo 22 asti, ubikinoni (koentsyymi Q 10) - klo 17–20; Poikkeuksena ovat vastasyntyneet ja 1 kuukauden ikäiset lapset, joille 2-3 kertaa karnitiinin saanti on perusteltua. On huomattava mahdollisuus käyttää nestemäisiä lääkemuotoja, erityisesti lapsille. nuorempi ikä(Elkar, Kudesan).
2. Elektrolyyttimuutosten korjaus: kalsium- ja magnesiumvalmisteet. Pitkäaikainen (useita kuukausia) Ca-valmisteiden käyttö yhdessä Mg: n kanssa on suositeltavaa paitsi sidekudoksen kypsymiseen (fibroblastit, solunulkoiset matriisirakenteet), mutta myös erilaisten komplikaatioiden, esimerkiksi sydämen rytmihäiriöiden, ehkäisyyn. Magnerotin kaltaisten lääkkeiden käytön yhteydessä havaitaan merkittävä sydämen häiriöiden käänteinen dynamiikka (erityisesti MVP: n kanssa). positiivinen vaikutus autonomisen säätelyn luonteesta ja verisuonisairauksien esiintymistiheydestä. Erityinen merkitys sisältää yhdistelmän Mg: tä ja orohappoa, joka "omien" toimintojensa lisäksi (pyrimidiiniemästen synteesi, ylläpito korkeatasoinen ATP jne.) Varmistaa magnesiumin toimittamisen suoraan soluihin vähäisin menetyksin ruoansulatuskanavassa tai erittymistä virtsaan. Magnesiumin puutteen kompensoimiseksi voidaan käyttää lääkettä "Magne B6").
3. Vapaiden radikaalien hapettumisprosessien vakauttaminen antioksidanttien avulla, joiden joukossa voidaan käyttää ubikinonin (koentsyymi Q 10, Kudesan) ohella E-, C- ja vetoron-annoksia. Fytokompleksia "Biorex" voidaan käyttää lapsilla, joiden antioksidanttiset ja immunomoduloivat ominaisuudet on vakuuttavasti osoitettu L.G. Korkina (Venäjän valtion lääketieteellinen yliopisto).
4. Vitamiinihoito syksyn ja kevään aikana sekä vilustumisen jälkeisen toipumisen aikana.
5. Immuunihäiriöiden korjaaminen (influenssaepidemian aikana, kroonisten tulehdussairauksien aikana, leikkausta valmisteltaessa) - lycopid, viferon, echinacea jne.
Havaintojemme mukaan lapsilla, joilla on keuhkoastma ja krooninen gastroduodeniitti STD-oireyhtymän taustalla, hyvä vaikutus havaitaan, kun suoritetaan perinteisiä näihin nosologisiin hoitomuotoihin yhdistettynä epäspesifiseen metaboliseen korjaukseen: kalsiumvalmisteet (kalsium-D3-Nycomed, merikalsium lapsille), magnesium (magnerot, magne B6), L - karnitiini (Elkar) ja koentsyymi Q 10 (Kudesan). Näiden lasten perussairauden merkkien ja autonomisen epätasapainon oireiden taantumisen lisäksi havaittiin lymfosyyttien SDH, LDH ja GPDH mitokondrioentsyymien aktiivisuuden normalisoituminen.
STD -oireyhtymää sairastavat lapset tarvitsevat dynaamisen lääkärinhoidon asianmukaisten asiantuntijoiden (kardiologi, pulmonologi, gastroenterologi ja / tai nefrologi) kuulemisen sekä pakollisen EKG: n ja EchoCG: n avulla vähintään kerran vuodessa.
Viime aikoina lääkärit ovat usein diagnosoineet lapsilla dysplastista oireyhtymää tai sidekudoksen dysplasiaa. Mikä se on?
Ihmiskehon sidekudos on kaikkein "monipuolisin". Se sisältää sellaisia erilaisia aineita kuin luu, rusto, ihonalainen rasva, iho, nivelsiteet jne. Toisin kuin muut kudokset, sidekudoksella on rakenteellisia piirteitä: soluelementtejä, jotka sijaitsevat väliaineessa, jota edustavat kuituelementit ja amorfinen aine.
Sidekudoksen sakeus riippuu amorfisen komponentin sisällöstä. Kollageenikuidut antavat koko kudokselle lujuutta ja joustavuutta.
Sidekudosdysplasian (CTD) kliiniset ilmentymät johtuvat kollageenirakenteiden poikkeavuuksista, jotka suorittavat tukitoiminnon, osallistuvat aktiivisesti kudosten muodostumiseen, sidekudossolujen uudistumiseen ja ikääntymiseen.
Sidekudoksen dysplasialla on perinnöllinen alttius.
Ja jos katsot kunnolla, sukutaulussasi on varmasti sukulaisia, jotka kärsivät alaraajojen suonikohjuista, likinäköisyydestä, litteistä jaloista, skolioosista, taipumuksesta verenvuotoon. Jollakin oli nivelkipuja lapsuudessa, joku kuunteli jatkuvasti sydämen nurinaa, joku oli hyvin "joustava" ... Nämä ilmentymät perustuvat mutaatioihin geeneissä, jotka ovat vastuussa kollageenin - sidekudoksen tärkeimmän proteiinin - synteesistä. Kollageenikuidut eivät ole muodostuneet oikein eivätkä kestä asianmukaista mekaanista rasitusta.
Lähes kaikilla alle 5 -vuotiailla lapsilla on merkkejä dysplasiasta - heillä on herkkä, helposti venyvä iho, "heikot nivelsiteet" jne. Siksi DST voidaan diagnosoida tässä iässä vain epäsuorasti, samoin kuin ulkoisten dysplasian merkkien läsnä ollessa lapsilla.
Se pitäisi heti selventää sidekudoksen dysplasia ei ole sairaus, vaan perustuslaillinen ominaisuus! Tällaisia lapsia on monia, mutta kaikki eivät kuulu lastenlääkärin, ortopedin ja muiden lääkäreiden näkökenttään.
Nykyään on tunnistettu monia DST -merkkejä, jotka voidaan ehdollisesti jakaa ulkoisen tutkimuksen aikana havaittuihin ja sisäisiin eli merkkeihin sisäelinten ja keskushermoston puolelta.
Alkaen ulkoiset merkit
yleisimpiä ovat seuraavat: vakava hypermobiliteetti tai nivelten löystyminen, ihon elastisuuden lisääntyminen, selkärangan epämuodostuma skolioosin tai kyfoosin muodossa, litteät jalat, jalkojen planovalgus -epämuodostuma, voimakas laskimoverkko iholla (ohut , herkkä iho), näköpatologia, rinnan muodonmuutos (kiiltävä, suppilomainen tai lievä rintalastan masennus), lapaluiden epäsymmetria, "veltto" asento, taipumus mustelmiin tai nenäverenvuotoihin, vatsalihasten heikkous, lihasten hypotonia, nenän väliseinän kaarevuus tai epäsymmetria, arkuus tai samettinen iho, "ontto" jalka, tyrä, epäsäännölliset kasvavat hampaat tai ylimääräiset hampaat.
Yleensä jo 5-7-vuotiaina lapsilla on paljon valituksia heikkoudesta, huonovointisuudesta, huonosta liikuntasietokyvystä, ruokahaluttomuudesta, sydämen, jalkojen, pään, vatsan kipuista.
Sisäelinten muutokset
muodostuu iän myötä. Sille on ominaista sisäelinten (munuaiset, vatsa), sydämen - prolapsit, sydämestä - mitraaliläpän prolapsi, sydämen sivuääni, ruoansulatuskanavasta - sapen dyskinesia, refluksitauti, taipumus ummetukseen, alaraajojen suonikohjut jne. Hemorraginen oireyhtymä ilmenee nenäverenvuotona, taipumuksena mustelmiin pienimmässäkin vammassa.
Hermosto on vegetatiivisen dystonian oireyhtymä, taipumus pyörtymiseen, vertebrobasillaarinen vajaatoiminta kohdunkaulan epävakauden taustalla, yliherkkyysoireyhtymä ja tarkkaavaisuus. Tuki- ja liikuntaelimistön puolelta: selkärangan nuorten osteokondroosi tai Schmorlin tyrä, nuorten osteoporoosi, nivelkipu tai mikrotraumaattinen "ohimenevä" niveltulehdus, lonkkanivelten dysplasia.
Kuinka voin auttaa lastani?
Päivittäinen järjestelmä. Yöunen tulisi olla vähintään 8-9 tuntia, joillekin lapsille näytetään päiväunet. On tarpeen tehdä aamuharjoituksia päivittäin. Jos urheilulle ei ole rajoituksia, heidän on osallistuttava koko elämänsä, mutta ei missään nimessä ammattiurheilua!
Lapset, joilla on nivelten hypermobiliteetti ja jotka harrastavat ammattiurheilua, kehittävät rappeuttavia ja dystrofisia muutoksia rustoon ja nivelsiteisiin hyvin varhain. Tämä johtuu jatkuvista traumoista, mikroefuusioista, jotka johtavat krooniseen aseptiseen tulehdukseen ja dystrofisiin prosesseihin.
Terapeuttinen uinti, hiihto, pyöräily, mäkiä ja portaita käveleminen, sulkapallo, wushu -voimistelu vaikuttavat hyvin.
Massoterapia
on tärkeä osa CTD -lasten kuntoutusta. Hierotaan selkä- ja niska-kaulusvyöhykettä sekä raajoja (15-20 istuntoa).
Jalkojen planovalgus -asennuksen läsnä ollessa se näkyy jalkatuet. Jos lapsi valittaa nivelkipuja, kiinnitä huomiota valintaan järkevät kengät... Pienillä lapsilla oikeiden kenkien tulisi kiinnittää jalka ja nilkka tiukasti tarranauhalla, ja niiden tulee olla vähimmäismäärä sisäsaumat, tehty luonnollisista materiaaleista... Selän tulee olla korkea, kova, kantapäät - 1-1,5 cm.
On suositeltavaa suorittaa päivittäinen jalkojen voimistelu, tehdä jalkakylpyjä merisuola 10-15 minuuttia, hiero jalat ja jalat.
Sidekudosdysplasian hoidon pääperiaate on ruokavaliohoito. Ruoan tulee sisältää proteiineja, rasvoja, hiilihydraatteja. Proteiinipitoisia ruokia (liha, kala, pavut, pähkinät) suositellaan. Ruokavalio vaatii myös raejuustoa ja juustoa. Tuotteiden tulee myös sisältää paljon hivenaineita ja vitamiineja.
CTD -potilaiden hoito on vaikea mutta palkitseva tehtävä, jos vanhempien ja lääkärin välillä saavutetaan keskinäinen ymmärrys. Rationaalinen päivittäinen rutiini, asianmukainen ravitsemus, kohtuullinen liikunta ja jatkuva hallitseminen voivat nopeasti päästä eroon DST: hen liittyvistä ongelmista. Dysplasia on perinnöllinen, ja terveet elämäntavat ovat hyödyllisiä kaikille perheenjäsenille!
Sidekudoksen dysplasia on patologia, jossa kudosten tai elinten muodostuminen on heikentynyt. Tauti on perinnöllinen patologia. On kuitenkin olemassa teoria, jonka mukaan dysplasia kehittyy magnesiumin puutteen vuoksi ihmiskehossa.
Taudin oireet
![]()
Sidekudoksen dysplasian kliiniset ilmenemismuodot lapsilla ja aikuisilla ovat käytännössä samat. Oireiden vakavuus riippuu potilaan yksilöllisistä ominaisuuksista. Dysplasian tyypilliset oireet ovat seuraavat:
- Neurologiset häiriöt. Niitä esiintyy noin 75-80%: lla potilaista. Neurologiset häiriöt ilmenevät paniikkikohtausten, huimauksen ja lisääntyneen hikoilun muodossa. Lisäksi joillakin ihmisillä on nopea syke.
- Asteninen oireyhtymä. Se ilmenee potilaan nopean väsymyksen muodossa. Lisäksi sidekudoksen dysplasiaan liittyy heikko suorituskyky ja usein stressiä. Potilaat eivät myöskään voi sietää voimakasta liikuntaa.
- Sydän- ja verisuonijärjestelmän toimintahäiriöt. Henkilö voi esimerkiksi kehittää mitraaliläpän prolapsin.
- Rintakehän normaalin rakenteen rikkominen. Tästä patologiasta tulee usein tuki- ja liikuntaelimistön sairauksien syy. Skolioosin tai selkärangan rakenteen epämuodostumien riski on suuri.
- Häiriöt verenkiertoelimistön työssä. Sidekudosdysplasian yhteydessä riski saada suonikohjuja kasvaa merkittävästi.
- Kehon painon puute.
- Neuroottiset häiriöt. Ne ilmaistaan jatkuvan masennuksen ja anoreksian muodossa.
- Pitkittäiset tai poikittaiset litteät jalat.
- Heikkous lihaksissa.
- Ruoansulatuskanavan toimintahäiriö. Dysplasia aiheuttaa kroonista ummetusta, huonoa ruokahalua ja turvotusta.
- ENT -elinten krooniset sairaudet. Keuhkokuume ja keuhkoputkentulehdus tulevat sidekudoksen dysplasiaoireyhtymän kumppaneiksi.
- Ihon kuivuus ja läpinäkyvyys.
- Allergisten reaktioiden taipumus.
- Leuan epätasapaino.
- Silmien sairaudet. Usein henkilö kehittää strabismuksen, likinäköisyyden tai astigmatismin.
Kun taudille on tunnusomaisia oireita, suoritetaan erityinen kliininen ja sukututkimus. Ensinnäkin asiantuntija tutkii potilaan historiatiedot ja valitukset. Kardiologin on suositeltavaa tutkia potilas, koska dysplasiasta tulee usein sydänsairauksien kehittymisen syy. Hoitavan lääkärin tulee sitten mitata kehon osien pituus ja suorittaa rannetesti. Diagnoosin aikana lääkärin tulee myös arvioida nivelten liikkuvuus ja ottaa virtsanäyte.
Sidekudoksen dysplasian yhteydessä on välttämätöntä noudattaa ruokavaliota. Yleensä tauti aiheuttaa välittömän kollageenin hajoamisen, joten sinun täytyy syödä paljon kalaa ja lihaa. Soija ja palkokasvit sisältävät myös välttämättömiä aminohappoja. Ruokavalion kaloripitoisuutta on lisättävä. Jos sinulla on dysplasiaa, muista syödä runsaasti omega-3- ja omega-6-rasvoja sisältäviä ruokia. Näiden hivenaineiden parhaat lähteet ovat saksanpähkinät, lohi, makrilli, sampi, katkaravut, hasselpähkinät, maapähkinät, juusto ja oliiviöljy. Lisäksi ruokavalioon tulisi sisällyttää runsaasti proteiinia sisältäviä elintarvikkeita. Täysmaito ja vähärasvainen raejuusto ovat hyviä. Terveiden aminohappojen imeytymiseksi sinun on syötävä runsaasti C -vitamiinia sisältäviä elintarvikkeita, kuten sitrushedelmiä ja marjoja. Lisäksi sinun on syötävä runsaasti kuitua sisältäviä elintarvikkeita - viljoja ja vihanneksia.
Taudin hoito
Sidekudoksen dysplasian hoito on yleensä konservatiivista. Erityisten lääkkeiden ottaminen suoritetaan kursseilla, joiden kesto on 6 viikkoa. Kollageenisynteesin stimuloimiseksi potilaan on juotava lääkkeitä, jotka sisältävät B -vitamiinia ja askorbiinihappoa. On myös suositeltavaa ottaa lääkkeitä, joissa on paljon magnesiumia ja kuparisulfaattia. Glykosaminoglykaanien hajoamiseen on suositeltavaa käyttää lääkkeitä, kuten Hodroxide tai Rumalon.
Erottamaton osa konservatiivista hoitoa ovat lääkkeet, jotka vakauttavat mineraalien aineenvaihduntaa. Yleensä käytetään Osteogenonia tai Upsavitia. Lisäksi hoitoa täydennetään glysiinillä tai glutamiinihapolla. Nämä lääkkeet auttavat normalisoimaan hyödyllisten aminohappojen pitoisuuden veressä.
Hoitoa täydentää fysioterapia. Potilasta suositellaan säännöllisesti harjoittamaan fysioterapiaharjoituksia, ottamaan suolakylpyjä ja käydä hieronnassa. Jos potilaan psyko-emotionaalinen tila on vakava, suoritetaan erityinen psykoterapia. On huomattava, että dysplasian yhteydessä seuraavat ovat vasta -aiheisia:
- Painonnosto.
- Psyko-emotionaalinen ylikuormitus.
- Työskentely laitteilla, jotka altistuvat jatkuvasti tärinälle.
- Harjoittele taistelulajeja tai muita kontaktilajeja.
- Työskentele säteily- tai korkeissa lämpötiloissa.
Jos kyseessä on vakava verisuonipatologia ja selvä selkärangan tai rinnan vika, suoritetaan leikkaus.
Sidekudoksen dysplasia (DST)- heikentynyt sidekudoksen kehitys alkion ja synnytyksen aikana solunulkoisen matriisin geneettisesti muuttuneesta fibrillogeneesistä johtuen, mikä johtaa homeostaasin häiriöön kudosten, elinten ja organismin tasolla erilaisten sisäelinten ja liikuntaelinten morfo-toiminnallisten häiriöiden muodossa progressiivinen kurssi. Valitettavasti kukaan ei ole vielä onnistunut määrittelemään.
Sidekudoksen erilaistuneille dysplasioille on ominaista tietyntyyppinen perintö, hyvin määritelty kliininen kuva ja joissakin tapauksissa-vakiintuneet ja hyvin tutkitut geneettiset tai biokemialliset viat. Tämän ryhmän yleisimpiä edustajia ovat Marfanin oireyhtymä, 10 Ehlers-Danlosin oireyhtymän tyyppiä, osteogenesis imperfecta ja hilseilevä ihon oireyhtymä (Cutis laxa). Nämä sairaudet kuuluvat perinnöllisten kollageenisairauksien ryhmään - kollageenipatiat. Ne ovat harvinaisia ja geneettiset tutkijat diagnosoivat ne melko nopeasti.
Eriytymättömät sidekudoksen dysplasiat diagnosoidaan, kun potilaan fenotyyppiset piirteet eivät sovi mihinkään erilaistuneisiin sairauksiin. Kokemus osoittaa, että tämä patologia on erittäin laaja.
Eriytymättömät sidekudoksen dysplasiat eivät epäilemättä ole mikään nosologinen yksikkö, vaan geneettisesti heterogeeninen ryhmä.
Yhdenmukaisen terminologian puute on johtanut siihen, että monet kirjoittajat käyttävät "omaa" terminologiaan viittaamaan erilaistumattomaan sidekudoksen dysplasiaan. Joskus tällaisten potilaiden fenotyyppisten merkkien joukko muistuttaa yhtä tai toista tunnettua erilaistunutta oireyhtymää. Tällaisissa tapauksissa monet kirjoittajat puhuvat "Marfanin kaltaisesta" tai "Elerin kaltaisesta" dysplasiasta. Lyhenne "MASS-fenotyyppi" on laajalti käytetty kirjallisuudessa, yleisimpien fenotyyppisten merkkien (mitraaliventtiili, aortta, luuranko, iho) ensimmäisten kirjainten mukaan ne puhuvat myös sidekudoksen toimintahäiriöstä tai heikkoudesta, mesenkymaalisesta vajaatoiminnasta tai "pienen" sidekudoksen dysplasian oireyhtymä ... Kiistanalaiset, epäjohdonmukaiset ja epäloogiset muotoilut heijastavat, kuten tiedätte, ongelman monimutkaista tilaa.
Vuosina 1990-1995 Omsk isännöi viisi vuotuista koko unionin kongressia, jotka olivat omistettu DST-ongelmille. Yhdessä näistä kongresseista osastomme professoreiden ehdottama luokitus V.M. Yakovlev ja hänen oppilaansa G.I. Nechaeva. Luokitus on käytännöllinen käytännön harjoittajalle ja sisältää 1) dysplastisista riippuvuudesta johtuvat muutokset elimissä ja järjestelmissä sidekudoksen dysplasiassa (liikunta, iho, sisäelimet) ja 2) sidekudoksen dysplasiaan liittyvät tilat. Jos joukko dysplastisista riippuvaisia muutoksia sopii kuvattuun systeemiseen perinnölliseen oireyhtymään, tehdään nosologinen diagnoosi: Marfanin oireyhtymä, Ehlers-Danlosin oireyhtymä jne.
Esimerkkejä diagnoosin muotoilusta:
1. Sidekudoksen dysplasia. Dysplastisesta riippuvaiset muutokset:
Luusto, lihakset: dolichostenomelia, suppilon rinnan epämuodostuma 2. asteen, suoran vatsalihasten diastaasi, navan tyrä;
Viskeraalinen: rintakehän ja kalvon sydämen supistava muunnelma, 2. asteen mitraaliläpän prolapsi, johon liittyy regurgitaatiota, sydämen NCD, sapen dyskinesia.
2. Krooninen märkivä-obstruktiivinen keuhkoputkentulehdus, johon liittyy sidekudoksen dysplasiaa, paheneminen.
DST. Dysplastisesta riippuvaiset muutokset:
Tracheobronchomalacia, rakkuloinen keuhkolaajentuma, mitraalisen ja trikuspidaalisen venttiilin prolapsia, 1 asteen regurgitaatio;
Luusto, lihakset: rintakehän epämuodostuma, oikeanpuoleinen kylkiluun kyhmy, rintakehän kyphoscoliosis.
Hieman yksinkertaistetussa muodossa tätä luokitusta käytetään laajalti käytännössä, vaikka sidekudoksen dysplasian diagnoosi ei sisälly virallisiin otsikkoluetteloihin.
Sidekudoksen dysplasian diagnoosi. Epäilemättä sidekudoksen dysplasian diagnosointiin tarvitaan integroitu lähestymistapa, joka käyttää kliinistä ja sukututkimusmenetelmää, potilaan sairauden ja elämän anamneesia, potilaan ja hänen perheenjäsentensä kliinistä tutkimusta sekä biokemiallisia ja molekyyligeneettisiä diagnostisia menetelmiä. Uskallan sanoa, että sidekudoksen dysplasian diagnoosi, kuten mikään muu, on näkyvissä silmälle. Nämä potilaat voidaan nähdä heti, ennen kuin hän alkaa puhua, ja ennen kuin tutkit häntä yksityiskohtaisesti. Sinun tarvitsee vain oppia näkemään ne. Olemme jo esittäneet potilaan likimääräisen ulkonäön. Valitukset ja anamneesi vahvistavat ensivaikutelmasi, ja yksinkertainen tutkimus ei jätä epäilystäkään. Biokemialliset ja molekyylien geneettiset testit ovat kalliita jokapäiväisessä käytännössä, mutta tieteellisessä työssä käytämme sitä koko ajan, usko minua, se ei myöskään pettänyt meitä.
Valitukset. Yleisin syy mennä lääkäriin ovat sydänoireet. Nämä potilaat ovat kaikkien kardiologien vitsaus, koska pohjimmiltaan mitään muuta kuin NDC: tä ei voida antaa eikä myöskään ole tarvetta luvata toipumista. Huomiota kiinnitetään autonomisten oireiden runsauteen, valtimoverenpaineeseen, yleiseen heikkouteen, päänsärkyyn, ortostaattisiin oireisiin jne. Teen heti varauksen, että ennen kuin luoput niistä, sinun on tehtävä EHOCG ja kaikki mitä parhaaksi näet. Olemme jo sopineet, että dysplastikoilta voidaan odottaa kaikkea, parhaimmillaan prolapsia, pahimmassa tapauksessa aortan aneurysmaa tai äkillistä kuolemaa.
Usein potilaan vie lääkäriin valitukset dyspeptisistä oireista, epämääräinen vatsakipu, ummetus ja turvotus. Taktiikka on sama - tutkia, tehdä FGDS, ultraääni, saada heidät analysoimaan dysbioosi, mutta muista: sinulla on dysplastinen edessäsi ja hän kärsii ennen kaikkea dysplasiasta.
On erittäin epämiellyttävää, jos hengityselimet ovat kiinnostuneita. Usein esiintyvä keuhkokuume tai krooninen keuhkoputkentulehdus piilottaa usein keuhkoputkien seinämän ja alveolien synnynnäisen heikkouden aiheuttamat viat. Hoidolla on vaikutus, keuhkokuume on ratkaistu, mutta diagnoosia ei ole. Jokainen uusi infektio (ja kenellä ei ole niitä?) Pahentaa tilannetta, keuhkoputkentulehdus ja tukos muodostuvat ... Samaan aikaan diagnoosi on kirjoitettu tällaisen potilaan kasvoille, sinun tarvitsee vain katsoa tarkasti.
Ja lopuksi, nivelistä voi tulla kosmeettisia valituksia ja valituksia. Mutta tämä on harvinaisempaa, yleensä lapset, joilla on hypermobility, eversio, lisääntynyt nivelsiteiden venyvyys ... se on oikein, balettiin. Tai voimistelu. Ensinnäkin olisi mukava varmistaa, että heillä ei ole anatomisia vikoja, että nuorten urheilijoiden keskuudessa olisi vähemmän kuolemia.
Sidekudoksen dysplasiaoireyhtymän historia. Lihaksen hypotensio, tyrät, ortopedin havainto kyfoskolioosista, kardiologi sydämen kipua, heikkoutta, heikkoa liikuntasietoa, ruokahalun heikkenemistä - kaikki tämä on potilaidemme yhteinen historia. Kun kaikki alkoi, he eivät kerro sinulle, koska he ovat syntyneet sen kanssa. Erikseen on tarpeen selventää näkötilaa, likinäköisyyttä, ENT -elinten patologiaa jne. Anamneesia otettaessa on aina mielenkiintoista yrittää laatia sukupuu tai vain kysyä ulkomuoto lähiomainen. Pyydämme yleensä näitä sukulaisia tuomaan heidät - näet, uusia potilaita on ilmestynyt. Määritä kaikki laboratorio- ja instrumentaalitutkimusten tiedot. Pyydä avohoitokorttia. Tiedot äidin raskauden patologisesta kulusta ovat yleensä vähemmän informatiivisia, missä olet nähnyt terveitä raskaana olevia naisia nyt?
Tarkastus:"Asteninen tyyppi, joka leviää yhä enemmän joukkoon moderni mies…. Koko hahmo on ohut, kapea, pitkä: pitkä ohut kaula, kapea, litteä ja pitkä rintakehä, kapea lantio, heikot lihakset, pterygoid -lapaluu ... Rasvakudoksen heikko kehitys, ohut vaalea iho, löysä kivespussit, veltto vatsalihakset, taipumus nivustyrään, pieni sydän, taipumus splanchnoptoosiin, liikkuvat munuaiset ... "AA Bogomolets.
Tämä on siis astenista.
Mitä tahansa paino- ja korkeusindikaattoria voidaan käyttää painon alijäämän arvioimiseen, esimerkiksi BMI tai Varga -indeksi.
Rintakehän epämuodostumat ovat suppilomaisia (normaali ja litteä suppilo) ja keeled (manubriocostal, corpuscostal ja rintakehä). Sivuttaisia röntgenkuvia voidaan käyttää niiden asteen mittaamiseen, mutta yleensä teemme tämän silmällä.
Selkärangan patologia (skolioosi, "suora selkä", hyperkyfoosi, hyperlordoosi) diagnosoidaan kliinisesti ja röntgentutkimuksella vahvistetun luumutestin avulla. Katso heti lapaluiden ja hartioiden symmetria.
Dolichostenomelia diagnosoitu mitattaessa rungon segmenttien pituutta, esimerkiksi: suhde "käsi / korkeus" on yli 11%, "jalka / korkeus" on yli 15%, ero on "käsivarsi - korkeus" on enemmän yli 7,6 cm jne. Voit kysyä, onko hihojen pituudessa ongelmia, kun ostat vaatteita - tämä on dolichostenomelia.
Arachnodactyly: Peukalon seulontatesti. Peukalo sopii helposti kämmenen yli ja tässä asennossa ulkonee ulnar -reunansa yli. Tai: keskisormi on yli 10 cm tai "rannetesti". Potilas tarttuu helposti ranteeseen pienellä sormella ja peukalolla. Metakarpalinen indeksi voidaan laskea röntgenkuvasta.
Nivelten hypermobiliteetti helpoin arvioida Beytonin kriteerien mukaan... Molemmille puolille suoritetaan peräkkäin 5 testiä:
- Pienen sormen passiivinen taivutus 90 astetta kummallekin puolelle.
- Ensimmäisen sormen passiivinen taipuminen kohti kyynärvartta, kun se taipuu ranteessa.
- Molempien kyynärliitosten yli -venytys yli 10 astetta.
- Molempien polvinivelten ylipainos yli 10 astetta.
- Kun kallistetaan eteenpäin kiinteästi polvinivelet potilaiden kämmenten tasot koskettavat täysin lattiaa.
Näiden testien indikaattoreiden enimmäisarvo on 9 pistettä. 1 pisteen indikaattori tarkoittaa nivelen patologista hyperekstensiota toisella puolella, 1-2 pisteen indikaattori tarkoittaa normin fysiologista muunnosta, 3-5 pistettä pidetään kohtalaisena hypermobiliteettina, 6-9 pistettä-voimakas nivelten liikkuvuus .
Voit myös kysyä, istuuko potilas langan päällä ja voiko hän heittää jalkansa niskan taakse - tämä on epätieteellistä, mutta suuntaa antavaa.
Raajojen epämuodostumat ovat valgus (X-muotoinen) ja varus (O-muotoinen). Voit nähdä hänet.
Jalkaa on 10 erilaista epämuodostumaa, mutta tärkeintä on nähdä, että se on siellä.
Pitkittäiset litteät jalat on mitattava pohjajäljellä (podometrinen indeksi) ja poikittainen hallus valgus ja varpaat, joten pyydämme sinua poistamaan sukat.
Ihon kunnon arvioidaan olevan "ohut iho" näkyvän verisuoniverkoston läsnä ollessa, "veltto", jos se on veltto ja "venyvä", jos sitä vedetään kivuttomasti 2-3 cm selän alueella kädestä, otsasta, solisluiden ulkoreunojen alta tai muodostuu rypyksi nenän tai korvakärkien kärjessä. Täällä voit myös tarkistaa verenvuotoilmiöitä, "pehmopaperin" oireita ja arvioida suonikohjujen vakavuutta.
Monenlaisia patologioita voidaan havaita kynsien, hiusten ja hampaiden puolelta, ja korvakkeet ovat pääsääntöisesti pehmeitä ja rullaavat helposti putkeen. Pienien kehityshäiriöiden (MAP) on oltava mitä tahansa: silmien hypertelorismi, nännit, goottilainen kitalaki, epicanthus, Sokratesin otsa, matala karvankasvu niskassa, sandaalin kaltainen halkeama ... Stigmal man, one word. IDA: ta ei sinänsä pidetä sidekudoksen dysplasiana, käsitteiden välillä ei ole yhtäläisyysmerkkiä, mutta ne ovat hyvin lähellä. Suhteellisesti ottaen MAP: t osoittavat geneettisiä vikoja, mutta kaltevaa leukaa ei aina pidä pitää CTD: n merkkinä.
Biokemialliset menetelmät sidekudoksen dysplasian oireyhtymän diagnosoimiseksi. Suosituin on hydroksiproliinin ja glykosaminoglykaanien määrittäminen päivittäisestä virtsanäytteestä. Kaikki nämä ovat kollageenin hajoamisen merkkejä, melko objektiivisia ja tarkkoja kriteerejä DST: lle. Niitä käytetään harvoin diagnoosin vahvistamiseen, ei ole tarvetta, mutta ne ovat käteviä seurata kuntoutushoidon aikana. Biokemiallisia ja molekyyligeenisiä tekniikoita on monia, mutta ne ovat kaikki kalliita eikä niitä käytetä rutiinikäytössä. Sidekudosdysplasian diagnosointi ei ole vaikeaa, tarvitset vain lääkärin tietoisuutta ja halua katsoa potilasta tarkemmin. Katso ympärillesi ja uskalla.
Sisätautien ja perhelääketieteen laitos.
Omskin osavaltion lääketieteellinen akatemia,
Luultavasti monet ovat lukeneet D. Grigorovichin pienen tarinan "Guttapercha-poika" tai katsoneet samannimistä elokuvaa. Teoksessa kuvattu pienen sirkusartistin traaginen tarina heijasti paitsi noiden aikojen suuntauksia. Kirjailija, ehkä huomaamatta, antoi kirjallisen kuvauksen tuskallisesta kompleksista, jota kotimaiset tutkijat, mukaan lukien T.I. Kadurina.
Kaikki lukijat eivät ajatelleet näiden epätavallisten ominaisuuksien alkuperää nuorella sankarilla ja hänen kaltaisillaan ihmisillä.
Siitä huolimatta oireiden kokonaisuus, jonka johtavuus on superjoustavuus, heijastaa sidekudoksen alemmuutta.
Mistä hämmästyttävä lahjakkuus tulee ja samalla lapsen kehittymiseen ja muodostumiseen liittyvä ongelma. Valitettavasti kaikki ei ole niin yksinkertaista ja suoraviivaista.
Mikä on dysplasia?
Itse käsite on käännetty latinaksi "kehityshäiriöksi". Tässä puhutaan sidekudoksen rakenteellisten osien kehityksen rikkomisesta, mikä johtaa useisiin muutoksiin. Ensinnäkin nivel-lihaskudoksen oireisiin, joissa sidekudoksen elementit ovat yleisimmin edustettuina.
Tärkeä rooli sidekudoksen dysplasian tutkimuksessa vuonna Neuvostoliiton jälkeinen tila näyttelijä Tamara Kadurina, monumentaalisen ja käytännössä ainoan oppaan alemmuusongelmansa kirjoittaja.
Taudin sidekudosdysplasian (DST) etiologia perustuu kollageeniproteiinisynteesin rikkomiseen, jolla on eräänlainen selkäranka tai matriisi paremmin organisoitujen elementtien muodostamiseksi. Kollageenisynteesi tapahtuu taustalla olevissa sidekudosrakenteissa, ja jokainen alatyyppi tuottaa oman tyyppisen kollageenin.
Mitä sidekudosrakenteet ovat?
On mainittava, että sidekudos on kehomme eniten edustava histologinen rakenne. Sen monipuoliset elementit muodostavat ruston perustan, luukudos, solut ja kuidut toimivat kehysinä lihaksissa, verisuonissa ja hermostossa.
Jopa veri, imusolmuke, ihonalainen rasva, iiris ja sklera ovat kaikki sidekudosta, joka on peräisin alkion pohjasta, jota kutsutaan mesenkyymiksi.
Ei ole vaikeaa olettaa, että solujen - kaikkien näiden näennäisesti erilaisten rakenteiden esi -isien kohdunsisäisen kehityksen aikana - muodostumisen rikkomisella on myöhemmin kliinisiä ilmenemismuotoja kaikista järjestelmistä ja elimistä.
Tiettyjen muutosten esiintyminen voi tapahtua ihmiskehon eri vaiheissa.
Luokitus
Diagnoosin vaikeudet johtuvat monista kliinisistä ilmenemismuodoista, jotka kapeat asiantuntijat kirjoittavat usein erillisten diagnoosien muodossa. DST: n käsite ei myöskään ole sairaus sellaisenaan ICD: ssä. Pikemminkin se on ryhmä ehtoja, jotka johtuvat kudoselementtien kohdunsisäisen muodostumisen rikkomisesta.
Tähän asti on toistuvasti yritetty yleistää nivelten patologiaa, johon liittyy useita kliinisiä oireita muista järjestelmistä.
Yritys esittää sidekudoksen dysplasia sarjana synnynnäisiä sairauksia, joilla on samanlaisia piirteitä ja lukuisia yleiset piirteet, teki T.I. Kadurin vuonna 2000
Kadurinan luokitus jakaa sidekudoksen dysplasiaoireyhtymän fenotyyppeihin (eli ulkoisten merkkien mukaan). Tämä sisältää:
- MASS -fenotyyppi (englannista - mitraaliläppä, aortta, luuranko, iho);
- marfanoidi;
- elerin kaltainen.
Kadurina loi tämän divisioonan useista olosuhteista, jotka eivät sovi ICD 10: tä vastaaviin diagnooseihin.
Syndroomainen sidekudoksen dysplasia
Täällä voidaan pitää täysin oikeutettuna Marfanin ja Ehlersin - Danlosin klassisia oireyhtymiä, joilla on paikkansa ICD: ssä.
Marfanin oireyhtymä
Yleisin ja laajalti tunnettu ryhmä on Marfanin oireyhtymä. Tämä ei ole ongelma vain ortopedille. Klinikan erityispiirteet pakottavat lapsen vanhemmat usein hakeutumaan kardiologiaan. Kuvattu gutta-läpäisevyys vastaa sitä. Sille on ominaista muun muassa:
- Korkeat, pitkät raajat, arachnodactyly, skolioosi.
- Näköelimen puolelta havaitaan verkkokalvon irtoaminen, linssin subluksaatio, sininen sklera, ja kaikkien muutosten vakavuus voi vaihdella laajalla alueella.
Tytöt ja pojat sairastuvat yhtä usein. Lähes 100%: lla potilaista on toiminnallisia ja anatomisia muutoksia sydämessä ja heistä tulee potilaita kardiologiassa.
Yleisimpiä ilmenemismuotoja ovat mitraaliläpän prolapsi, mitraalinen regurgitaatio, laajentuminen ja aortan aneurysma sekä mahdollinen sydämen vajaatoiminta.
Eulers-Danlosin oireyhtymä
Tämä on koko ryhmä perinnöllisiä sairauksia, joiden tärkeimmät kliiniset merkit ovat myös nivelten löysyys. Muita, hyvin yleisiä ilmenemismuotoja ovat ihon haavoittuvuus ja laajojen atrofisten arpien muodostuminen, jotka johtuvat ihon laajentumisesta. Diagnostiikan merkit voivat olla:
- ihonalaisen sidekudoksen muodostumisen esiintyminen ihmisissä;
- kipu liikkuvissa nivelissä;
- usein dislokaatiot ja subluksaatiot.
Koska tämä on koko joukko perinnöllisiä sairauksia, lääkärin on objektiivisten tietojen lisäksi selvennettävä sukututkimusta selvittääkseen, onko sukutaulussa samanlaisia tapauksia. Vallitsevista ja niihin liittyvistä ominaisuuksista riippuen klassinen tyyppi erotetaan:
- hypermobiilinen tyyppi;
- verisuonten tyyppi;
- kyphoscoliotic -tyyppi ja monet muut.
Niinpä nivelmoottorivaurion lisäksi vaurioita esiintyy verisuonien heikkouden muodossa repeytyneiden aneurysmien, mustelmien, progressiivisen skolioosin ja napanäyrien muodostumisen muodossa.
Sydämen sidekudoksen dysplasia
Tärkein objektiivinen kliininen ilmentymä sydämen sidekudoksen dysplasian diagnosoinnissa on mitraaliventtiilin prolapsia (ulkonema) kammion onteloon, johon liittyy erityinen systolinen kohina auskultaation aikana. Lisäksi kolmanneksessa tapauksista prolapsiin liittyy:
- nivelten hypermobiliteetin merkit;
- ihon ilmenemismuotoja haavoittuvuuden ja laajennettavuuden muodossa selässä ja pakarassa;
- silmien puolelta esiintyy yleensä astigmatismin ja likinäköisyyden muodossa.
Diagnoosi vahvistetaan tavanomaisella echokardioskopialla ja analyysillä kaikista ei -sydänoireista. Tällaisia lapsia hoidetaan kardiologiassa.
Muut sidekudoksen dysplasiat
On syytä puhua erikseen sellaisesta laajasta käsitteestä kuin erilaistumattoman sidekudoksen dysplasian oireyhtymä (UCTD)
Tässä kallistuu väestö kliiniset oireet, jotka eivät sovi mihinkään kuvatuista oireyhtymistä. Ulkoiset ilmenemismuodot, joiden avulla voidaan epäillä tällaisten ongelmien esiintymistä, tulevat esiin. Se näyttää joukolta sidekudosvaurion merkkejä, joista noin 100 on kuvattu kirjallisuudessa.
Tarkka diagnoosi edellyttää perusteellista tutkimusta ja analyysien keräämistä, erityisesti perinnöllisiä sairauksia koskevia tietoja.
Kaikista näiden merkkien moninaisuudesta huolimatta niitä yhdistää se tosiasia, että tärkein kehitysmekanismi on kollageenisynteesin rikkominen ja sen jälkeen tuki- ja liikuntaelimistön, näköelinten, sydänlihaksen patologian muodostuminen. Yhteensä on kuvattu yli 10 ominaisuutta, joista osa on tärkeimpiä:
- nivelten hypermobiliteetti;
- korkea ihon elastisuus;
- luuston epämuodostumat;
- purentapoikkeamat;
- lättäjalka;
- verisuoniverkosto.
Pieniä merkkejä ovat esimerkiksi korvien, hampaiden, tyrien jne.
Yleensä selvää perinnöllisyyttä ei ole, mutta osteokondroosi, litteät jalat, skolioosi, niveltulehdus, näköelimen patologia jne. Voidaan havaita suvussa.
Niveltulehduksen ominaisuudet lapsilla, joilla on DST

Lasten tutkiminen, joilla on niveltulehduksen merkkejä eri alkuperää osoitti, että useimmilla heistä on merkkejä DST: stä. Luustolaitteen heikkouden aiheuttaman niveloireyhtymän piirteitä ovat:
- eritteen liiallinen kertyminen nivelkapseliin;
- jalkojen nivelten vauriot;
- lieviä toimintahäiriöitä ja bursiitin muodostumista.
Toisin sanoen nivellaitteen sairauksilla on taipumus pitkäaikaiseen lopputulokseen nivelrikossa.
CTD -lasten hoidon ominaisuudet
DST -hoidon periaatteita ovat päivittäisen hoidon järjestäminen, erikoisruokavalion valinta, liikuntahoito ja saatavilla oleva urheilu ja järkevä psykoterapia.
Päivittäinen järjestelmä
Hoidon tehokkuus riippuu suurelta osin työ- ja lepo -ohjelman noudattamisesta. Tämä on riittävä yöunet, aamukontrasti. Terapeuttisten harjoitusten tulee olla vuorotellen lepoaikojen kanssa.
On suositeltavaa levätä korotetuilla jaloilla, jotta veri pääsee ulos alaraajoista.
Urheilu- ja fysioterapiaharjoituksia

Ortopedinen korjaus
Jos jalassa on ortopedisiä vikoja, on suositeltavaa käyttää ortopedisiä kenkiä tai käyttää erityisiä pohjallisia. Nivelten löysyyden hoitoon - polvisuojat ja muiden nivelten kiinnityslaitteet.
Hierontakurssit parantavat lihasten trofismia ja vähentävät nivelkipuja.
Rationaalinen psykovaikutus
Tällaisten lasten ja heidän sukulaistensa neuropsykologinen labiliteetti, taipumus ahdistuneisuuteen määrää hoidon tarpeen psykoterapian avulla.
Terveysruoka

Hoito ruokavaliohoidolla. Potilaita kehotetaan syömään runsaasti proteiineja, välttämättömiä aminohappoja, vitamiineja ja mikroelementtejä sisältävää ruokavaliota. Lasten, joilla ei ole ruoansulatuskanavan patologiaa, tulisi yrittää rikastuttaa ruokavaliotaan luonnollisella kondroitiinisulfaatilla. Nämä ovat vahvoja liha- ja kalaliemiä, hyytelö lihaa, lihahyytelöä, hyytelöä.
Tarvitset ruokavaliota, joka sisältää runsaasti luonnollisia antioksidantteja, kuten C- ja E -vitamiineja.
Tähän tulisi sisältyä sitrushedelmiä, Paprika, mustaherukka, pinaatti, tyrni, aronia.
Lisäksi määrätä elintarvikkeita, joissa on runsaasti makro- ja mikroelementtejä. Äärimmäisissä tapauksissa ne voidaan korvata hivenaineilla, jos lapsi on oikukas ruoassa.
Huumeterapia
Huumehoito on luonteeltaan korvaavaa. Huumeiden käytön tarkoitus tässä tilanteessa on edistää oman kollageenin synteesiä. Tätä varten käytetään glukosamiinia ja kondroitiinisulfaattia. Luiden ja nivelten kannalta välttämättömän fosforin ja kalsiumin imeytymisen parantamiseksi määrätään aktiivisia D -vitamiinin muotoja.
Kuinka unohtaa nivelkipu?
- Nivelkivut rajoittavat liikkeitäsi ja tyydyttävää elämää ...
- Olet huolissasi epämukavuudesta, rypistymisestä ja järjestelmällisestä kipusta ...
- Olet ehkä kokeillut joukon lääkkeitä, voiteita ja voiteita ...
- Mutta sen perusteella, että luet näitä rivejä, ne eivät auttaneet sinua paljon ...
Mutta ortopedi Sergei Bubnovsky väittää, että todellakin tehokas lääke nivelkipu on olemassa!